文献解读|Nat Commun(16.6):牙周炎中牙齿相关角质形成细胞的单细胞和空间分辨相互作用组学
✦ +
+
论文ID
原名:Single-cell and spatially resolved interactomics of tooth-associated keratinocytes in periodontitis
译名:牙周炎中牙齿相关角质形成细胞的单细胞和空间分辨相互作用组学
期刊:Nature Communications
影响因子:16.6
发表时间:2024.06.14
DOI号:10.1038/s41467-024-49037-y
背 景
牙周疾病(即牙周炎)每年影响全球数十亿人。对细胞亚群及其细胞状态(无论是支持生态位维持还是导致其崩溃)的了解有限,阻碍了牙周炎的精准治疗,并且需要阐明牙周发病机制中细胞特异性和协同细胞可塑性。尽管数十年的数据支持牙齿相关角质形成细胞异质性,但功能细胞注释仍然不完整。
实验设计
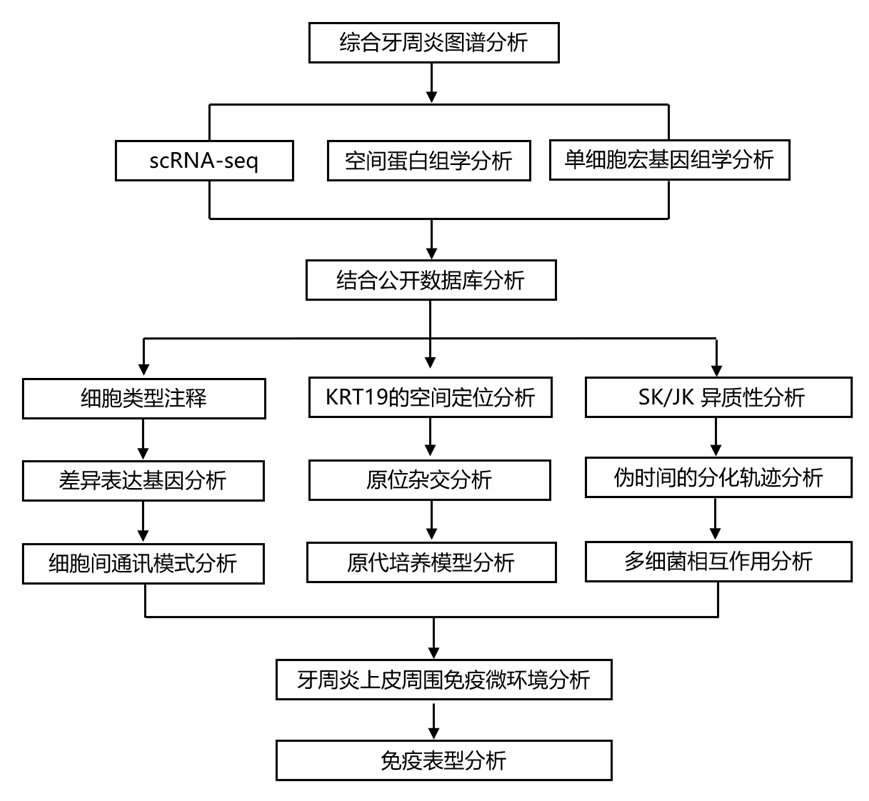
结 果
01
第一个综合牙周炎图谱草案的生成和分析
牙齿由多种多样的细胞类型支撑(图 1a)。数百种疾病影响牙齿;然而,对这些疾病的细胞特异性贡献仍然未知。尽管这里没有详尽的探索,但最近的小鼠和人类研究集中于牙齿支持牙周组织(矿化组织:牙槽骨、牙骨质;软组织:牙龈、牙周韧带)的单细胞转录组分析 (scRNA-seq) ,但某些细胞类型(如角质形成细胞)尽管已知其异质性,但注释却很少,研究团队使用 Cellenics® 分析了 4 个人类 scRNA-seq 数据集(健康20例,牙龈炎4例,牙周炎10例)(图1b)。
所有 scRNAseq 样本都经过重新处理、过滤和整合(图 1b)。以 Tier 1 分辨率(上皮、基质、内皮、神经和免疫)对细胞进行广泛注释。他们重点研究了牙龈上皮异质性(图 1c),该异质性位于非角化牙槽粘膜(AM)、附着龈(AG)、龈缘(GM)以及龈沟和连接角质形成细胞(SK/JK)之间的明显过渡区内。过滤掉红细胞(HBA + / HBB +)和循环细胞,并对每个研究进行进一步注释(Tier 2)(图1d)。整合数据使得能够对数据集中的 32 种细胞类型进行协调一致的细胞注释(Tier 3)(图 1e-f);为每种细胞确定了标记基因(图 1g)。所有角质形成细胞均由KRT5/KRT14广泛标记。SK/JK 还表达更高的FDCSP、ODAM和角蛋白KRT7和KRT19。在这种分辨率水平下,上皮细胞可分为 7 种不同类型,包括 SK/JK 和其他上皮驻留细胞,即默克尔细胞、黑素细胞和朗格汉斯细胞。
为了探究结构细胞类型如何在牙周炎进展中发挥作用,他们在bulk RNA-seq 分析中分析了牙周炎与健康细胞,生成了所有细胞(特别是角质形成细胞、成纤维细胞和脉管内皮细胞)的差异表达基因 (DEG) 列表(图1h)。
在患病的角质形成细胞中, DEG 分析显示CXCL1、CXCL3、CXCL8、CXCL13、CCL20、CSF3、IL1A、IL1B和IL36G以及受体IL1R1和IL7R在牙周炎中上调。此外,与所有细胞相比,CXCL1、CXCL8、IL1A和IL1B在角质形成细胞中的差异倍数变化更大(图1h),并且CXCL17、CCL20和CSF3在角质形成细胞中上调。
利用 DEG 数据,患病角质形成细胞的“反应组”进一步表明这些细胞具有积极的免疫作用。他们使用 CellPhoneDB通过受体-配体对研究 Tier 3 级细胞身份的相对细胞间通讯模式(图 1i),发现了预期的成纤维细胞-血管和成纤维细胞-免疫相互作用。正如所预测的那样,还发现 SK/JK 与许多其他细胞类型之间的许多相互作用,表明牙周炎中存在区域上皮-基质-免疫通讯轴。虽然预测一些其他角质形成细胞会在疾病状态下向其他细胞类型发出信号,但与其他角质形成细胞、黑素细胞和默克尔细胞相比,SK/JK 的表现更为突出。总的来说,本项研究重点是了解健康和疾病状态下的这些牙齿相关角质形成细胞。
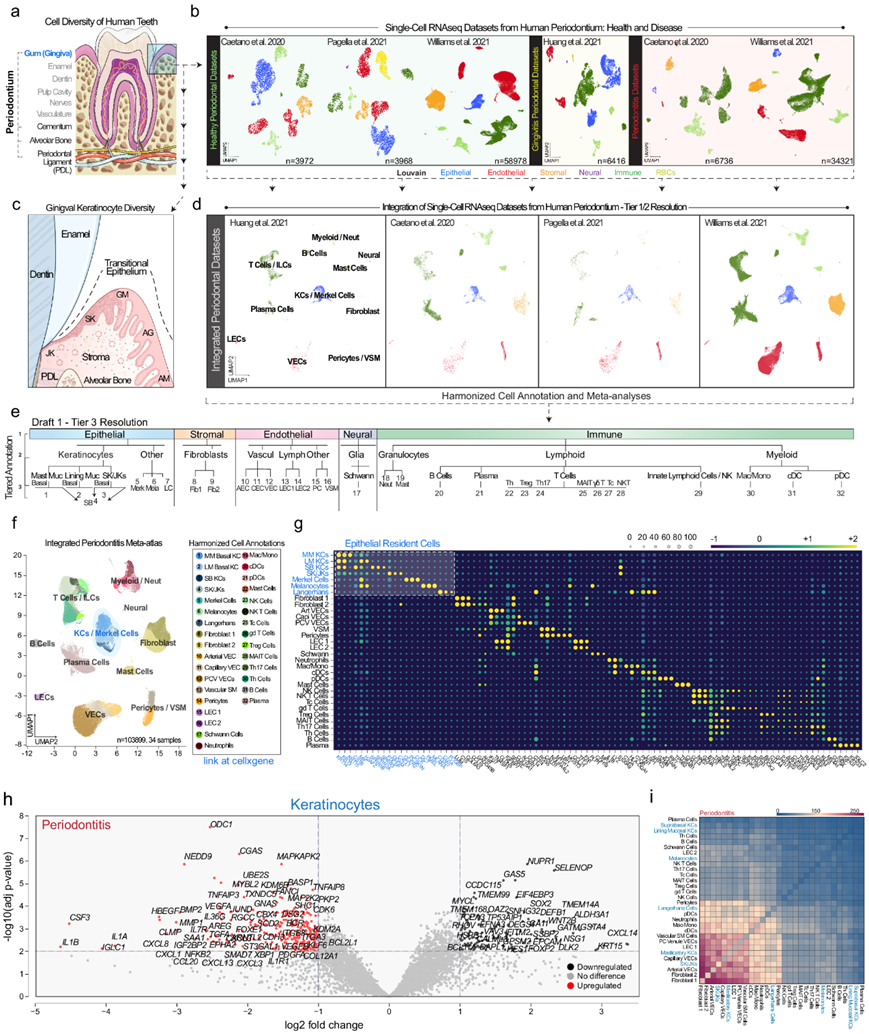
图1. 综合牙周炎图谱揭示了口腔角质形成细胞群在免疫信号传导中的重要作用。
(a) 特殊组织支撑人类牙齿,包括牙周组织、牙龈、牙周膜和矿化组织(牙骨质、牙槽骨)组成。(b) 重新处理四个scRNA-seq数据集,以在研究之间进行广泛的细胞类别比较。(c) 牙龈上皮附着是一种特殊的过渡上皮示例。(d) 首先使用 Harmony 整合每项研究并分配 Tier 1 细胞类型注释。(e) 在上皮、基质、内皮、神经和免疫细胞群之间进行了协调的层级注释。(f-g)UMAP可视化和细胞注释。(h) 火山区所有角质形成细胞对牙周炎中一些差异表达基因(DEG)的分析。(i) 使用CellPhoneDB分析所有Tier 3细胞类型以推断受体-配体相互作用。
02
重新定义人类牙龈角质形成细胞亚群以进行牙周炎的特异性分析
为了验证 KRT19的空间定位,他们切取成人牙龈,保持朝向口腔和牙齿的角质形成细胞的方向(图 2a-c)。免疫荧光验证 KRT19 为确切的 SK/JK 标记物(图 2b-c)。整个牙龈内的每个区域都显示出相似比例的 Ki67 +循环细胞,凸显了了解人类 SK/JK 上皮干细胞/祖细胞的必要性(图 2c)。他们从综合图谱中对角质形成细胞进行了亚聚类,并发现高表达KRT19的细胞聚集在一起(图 2d),为每个群体生成了标记物列表(图 2e)。使用根据单细胞特征设计的定制 12-plex原位杂交 (ISH) 检测 (RNAscope),内置阴性/低对照,他们发现CXCL14在角化基底细胞 (AG) 中表达,而 SK/JK KRT19 +细胞中无表达(图 2f)。在面向口腔的角质形成细胞中富集的其他标志物包括NPPC、PAPPA和NEAT1,但在面向牙齿的 SK/JK 中富集SAA1/2、IL18和RHCG。使用原代人牙龈角质形成细胞 (HGK),他们发现可以进入细胞周期的 KRT14 +和 KRT14 + /KRT19 +细胞的持久性(Ki67 +)(图 2h)。该混合原代培养模型维持在第 5 代 (P),包括来自两种干细胞/祖细胞类型的分化子代 (图 2i )。使用 ISH,他们还发现了细胞亚群特异性标记,例如 SK/JK ( SOX6 + / FDCSP + ) 和面向口腔的 AG 角质形成细胞 (SOX6+/LGR6+)(图 2j)。
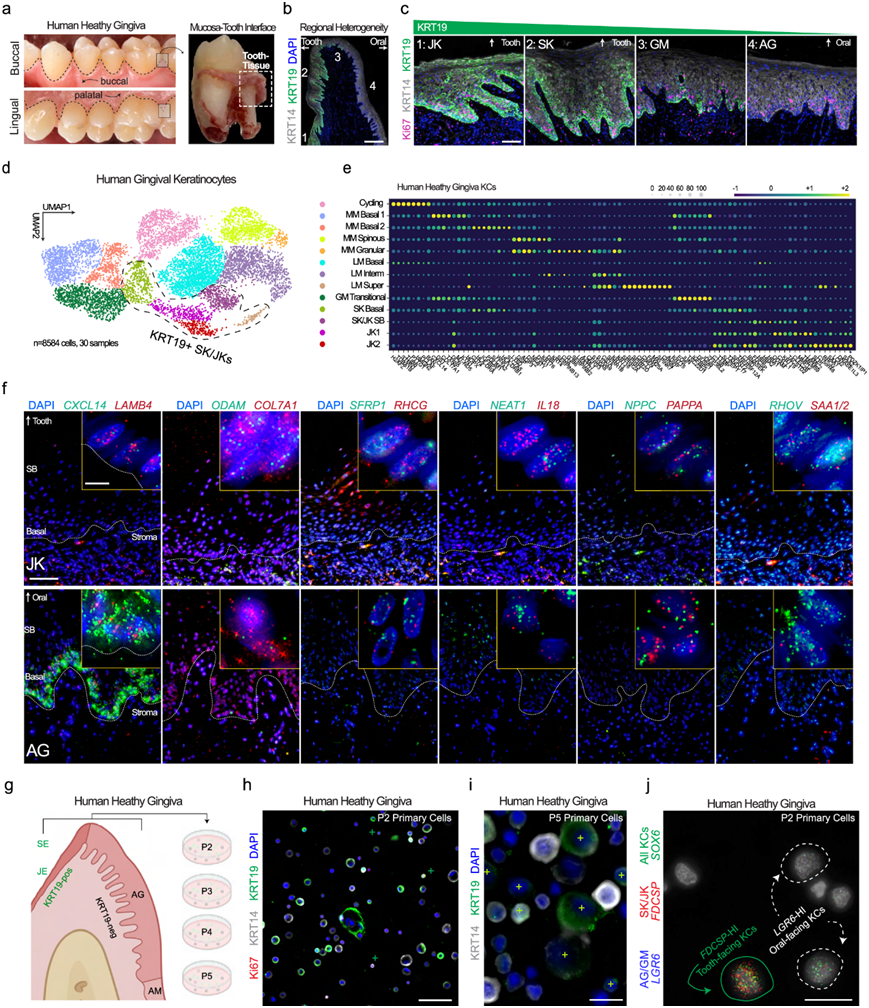
图2. 牙龈角质形成细胞多样性在分子上定义、空间上不同且在体外保存。
(a) 为了验证角质形成细胞的异质性,拔牙后将健康的人类牙龈组织保存在牙齿表面并固定。 (b) 使用 KRT19,IHC 揭示了从面向牙齿的 JK 和 SK 到 GM、AG 和 AM 角质形成细胞的逐渐转变。(c) KRT19-high和KRT19-low上皮干细胞在健康人的基底层增殖。(d-e) 所有角质形成细胞(KRT14+)从综合牙周炎meta-图谱中亚聚类,并基于Louvain聚类分配注释。(f) 使用这些特征,使用定制的12-plex ISH面板来揭示角质细胞群体的异质性。(g) 原代人牙龈角质形成细胞经过多次传代培养。(h-i) 在第一次传代和多次传代时,发现 KRT19-high基底和较大的上基底角质形成细胞在混合群中。(j) 使用 RNA ISH 和其他标记物,可以在体外识别在体内定义的细胞亚群。
03
牙周炎影响 SK/JK 干细胞/祖细胞分化,从而上调炎症特征
确认 SK/JK 细胞身份后,他们使用新标记物改进细胞注释(图 3a),并考虑 SK/JK 在牙周炎中受到的独特影响。为了更好地理解 SK/JK 异质性,他们从整合图谱中将KRT19-high细胞亚聚类出来,注释亚群包括基底(干细胞/祖细胞)及其分化后代(基底上 [SB] 角质形成细胞)(图3b-c)。他们发现牙周炎中 28.5% 的共同 SK/JK 基因上调(图 3d)。SB JK普遍上调了基础激酶和SB SK的效应细胞因子CXCL1、CXCL3、CXCL6、CXCL8、IL1A、IL1B和IL36G(CXCL1和IL1B)(图3e)。这一结果揭示了牙周炎生态位恢复健康的潜在治疗通路,因为与所有角质形成细胞相比,最靠近牙齿表面的角质形成细胞驱动了最多的效应细胞因子表达。
接下来,他们对基底和 SB SK 和 JK 进行了亚聚类,并发现这些不同的细胞身份使用基于分区的图形抽象(PAGA) 形成了独特的聚类。沿着伪时间的分化轨迹,他们预测了改变的分化轨迹,即JK 和 SK 中的JUND增加而SPRR3减少,而 JK 中的TGM减少,SK 中的SPINK7减少(图 3f-g)。JK 和 SK 之间的细胞信号变化差异最大(图 3h-i)。牙周炎的 JK 中的CXCL1、CXCL3、CXCL8、CSF3、IL1A、IL1B和IL1RN的活性均增加。总体而言,SK/JK 干细胞及其后代似乎以不同的方式上调促炎、免疫调节和先天免疫趋化特征,而牺牲了健康细胞分化和上皮屏障维持。
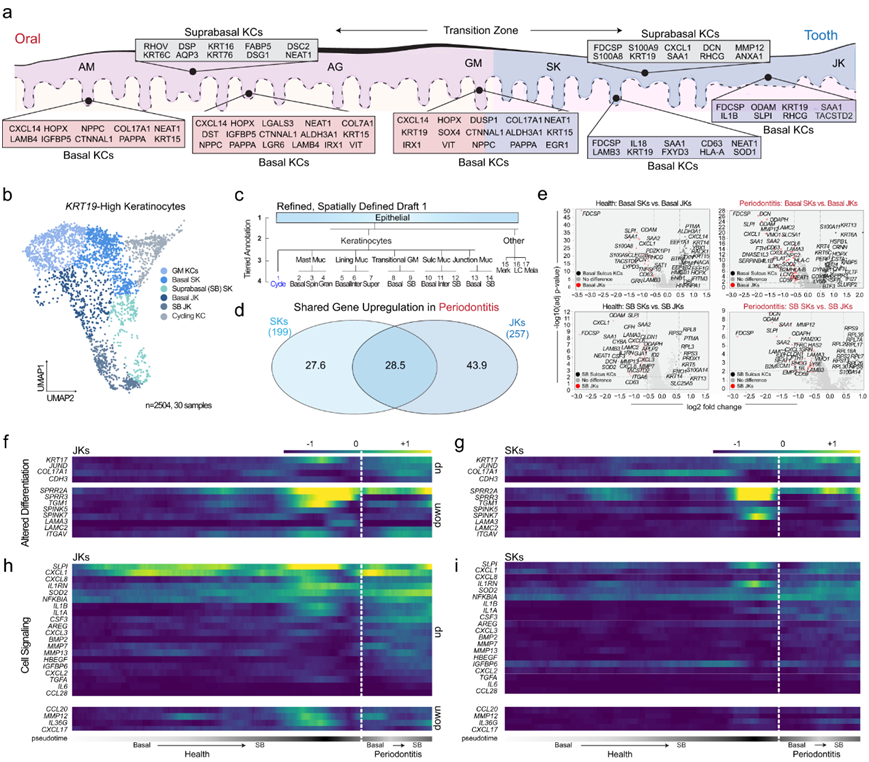
图3. 促炎特征的增加与牙齿相关角质形成细胞分化模式的改变相一致。
(a) 人类口腔到牙齿过渡区的模型。(b) krt19-high角化细胞(KC)亚聚类,包括龈缘角化细胞(GM)、沟状角化细胞(SK)和结界角化细胞(JK)。(c) 牙龈附着上皮细胞的更详细草图(Tier 4)注释。(d) 检测牙周炎中的差异表达基因。(e) 对基底和基底上(分化)SK 和 JK 角质形成细胞的进一步分析揭示了基底和基底上细胞类型之间独特的细胞特征。(f) 与健康细胞类型相比,JK 显示出改变的基因表达。(g) JK显示出强劲的细胞信号传导和炎症表型,这在疾病状态下似乎会加剧。 (h) 在 SK 中,与健康状态下的 JK 相比,分化相关基因的表达独一无二,但在疾病状态下,沿着基底到基底上的轨迹也似乎发生了改变。(i) 与疾病状态下的 JK 相比, SK的反应性通常较低,效应分子(如CXCL1、CXCL8、IL1A、IL1B和 IL1RN)的总体表达较低。
04
牙周炎中人类角质形成细胞的多细菌相互作用多样且频繁
考虑到多种微生物失调会导致易感宿主患上牙周炎, 他们假设这些 SK/JK 表型导致的分化和免疫细胞通讯改变部分源于牙周病原体(“牙周病原体”)相互作用。他们使用一种在健康和牙周炎组织中所有细菌共有的16S rRNA ISH 探针(图 4a)。在健康组织中,16S经常在基底层角质形成细胞中检测到;然而,在牙周炎中,注意到16S +基底角质形成细胞和基质细胞的数量较高,并且 JK 中的负担通常较高。他们希望揭示细胞特异性、物种特异性的细菌负担,并采用“宿主-微生物组相互作用的单细胞分析”管道(SAHMI)从单细胞数据集中识别稀疏的细菌读数(图4b)。他们首先观察了健康样本,确定了少量细胞-微生物关联(图4c)。然而,在患病样本中,他们观察到每个细胞有更多的细菌读数。众所周知的牙龈卟啉单胞菌在角质形成细胞中的增幅最大,接近200倍,在其他免疫细胞群中的增幅更大(图4d-e),这表明在疾病状态下,人体细胞内/上含有细菌核酸的口腔微生物和/或其外膜囊泡 (OMV) 的细胞特异性富集可能会增加。
他们假设 SK/JK 可能在细胞内藏有这些微生物(或微生物碎片)。使用健康和患病的角质形成细胞,他们分析了每个条形码中至少有一个细菌读数的细胞平均数量,发现 0.5-2% 的所有条形码中都富集了关键的牙周病原体(图 4f)。然后,他们针对 2 种检测到的牙周病原体(P. gingivalis:fimA;Fusobacterium:fadA)创建了一个 ISH 面板,以16S rRNA 探针作为对照。他们使用的组织首先通过多重 IF 在牙周炎中进行分析,然后重新探测微生物 mRNA 靶标(图 4g-h),结果以 3D 形式揭示了两种牙周病原体靶标的细胞内信号——有时在相同的JK 上皮干细胞中(图 4h)。
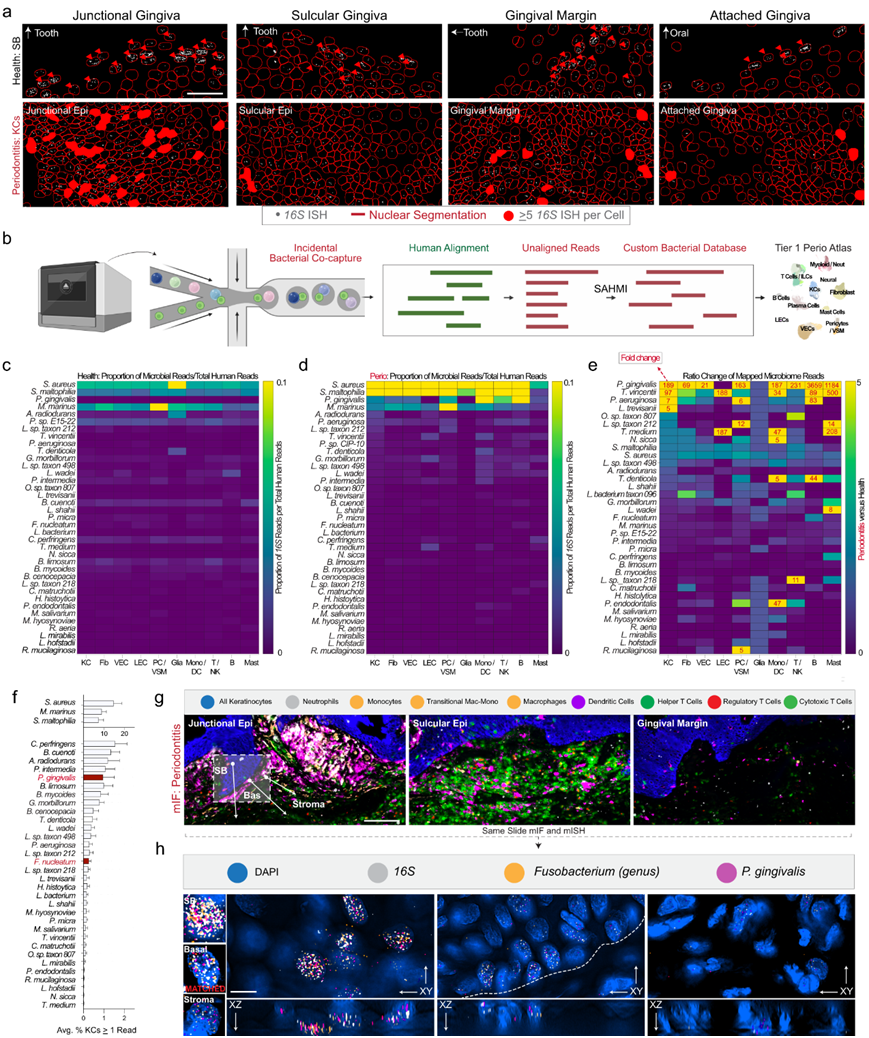
图4. 角质形成细胞的单细胞宏基因组学再分析。
(a) 使用16S rRNA FISH,在健康和疾病组织中分割细胞。(b) 实验流程图。(c) 广泛的 Tier 1 细胞类型注释。(d) 在牙周炎中,发现了较大的相关读取偏移,通常发生在众所周知的牙周病原体物种。(e) 对 (d) 与 (c)进行比率分析,发现许多细菌急剧增加,尤其是已知的牙周病原体。(f) 在所有角质形成细胞中,发现细菌数量各不相同。(g) 先天性与适应性免疫疾病病灶在16S高区域之间有所不同。(h) 对16S和两种常见牙周病原体 mRNA进行了原位杂交。
05
多细菌相互作用与连接角质形成细胞中的角质因子表达相互关联
他们预测多细菌相互作用可能比以前认识到的更常见,并对牙周炎图谱进行了宏基因组重新注释(图 1)。在此细胞不可知图谱中,每个主要聚类中都发现了单一(单细菌)和多个物种(多细菌)读数(图 5a)。他们发现了趋化因子特征,例如CXCL1/3/8/17和CCL20,这些特征在之前的分析中在牙周炎和健康中都曾发现过(图 5b-c)。此外,CXCL1/3/8和CCL20可以吸引先天(中性粒细胞)和适应性免疫细胞群(树突状细胞和 T 细胞),表明在慢性疾病状态中可能发挥免疫调节作用。
他们假设观察到的 SK/JK 免疫调节作用的增强可能与单细胞水平的宿主-微生物相互作用有关,他们将这种上皮细胞信号反应称为“表皮因子/角质因子”,即角质形成细胞在受到攻击后上调细胞因子。为了原位研究单细胞、多细菌相互作用,他们用一个 16S 探针创建了一个定制的 11 种角质因子面板,并进行了三轮连续成像,将相同组织切片的各个图像对齐,以同时评估所有 12 个探针的单细胞和空间分辨率(图 5c-e)。
使用16S揭示了上皮干细胞及其在AG、GM、SK和JK区分化的后代中多细菌相互作用的谱系追踪样模式(图5f)。在定性评估细胞因子表达时,似乎与宿主表达和16S +信号呈正相关(图 5g)。为了量化这一点,他们在四个感兴趣区域(ROI) 处分割了基质和基底/上基底角质形成细胞(图 5f),将每个组织细分为上皮过渡区周围的 12 个片段,生成了自定义脚本以从这些 ROI 运行 12 重 ISH 分析。同时进行的角质因子比较显示高度感染的基质细胞和角质形成细胞表现出细胞特异性表型(图 5c)。其他标志物在上基底细胞或基质中特别富集。IL1A、IL1B、CXCL1和CXCL3与高度感染的细胞(主要是基底上层细胞)显示出一定的相关性(图 5c),这可能解释了这些细胞在牙周炎中预测的分化效应(图 3)。
总体而言,当比较健康和牙周炎时,他们发现角质因子通过每个细胞的较高 RNA 转录本数量上调(图 5d)。IL1 超家族成员IL1A、IL1B和IL36G在牙周炎中在 JK 的基底层和基底层上均上调;此外,尽管之前已有报道,但他们观察到这些基因在牙周间基质中同时表达。这些观察结果在CXCL1和CXCL3表达中成立,两者都是先天免疫细胞趋化因子。根据JK 和远处 GM 区域中的 16S负担对角质因子表达热图进行了下采样和重新排序(图5h-i)。
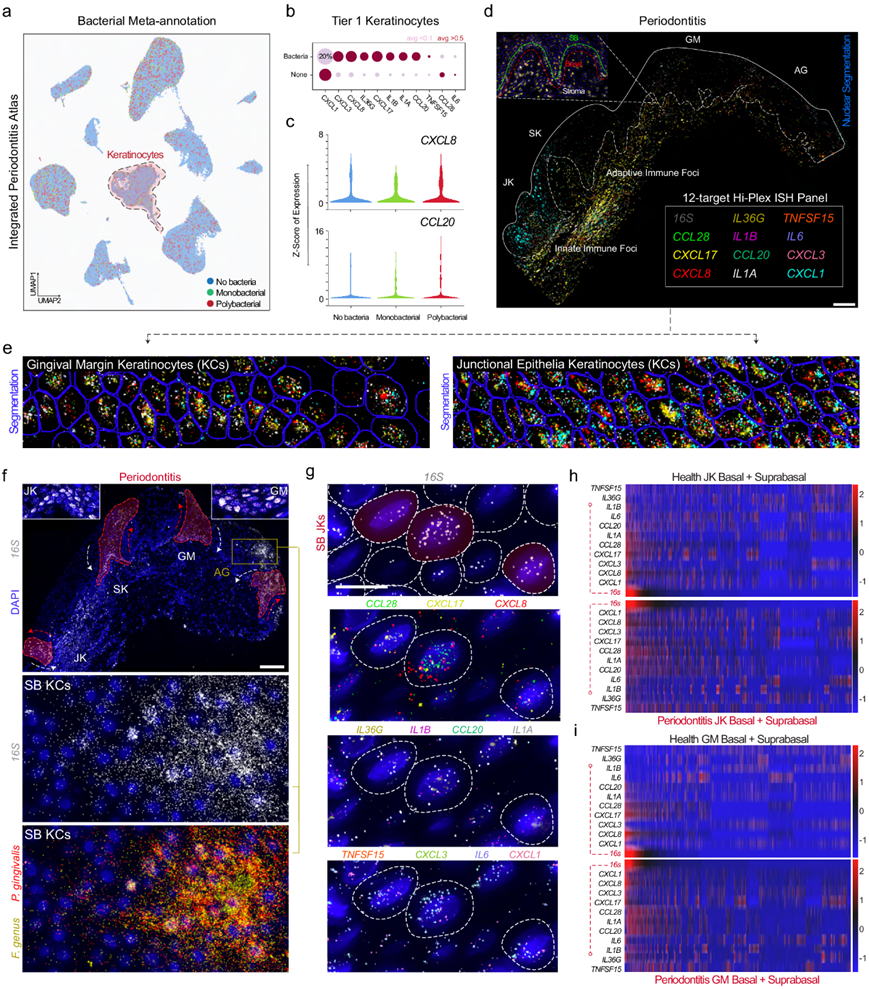
图5. 多细菌与牙龈角质形成细胞的相互作用具有高度特异性,并且可能与生态位和疾病状态无关。
(a) 综合牙周炎图谱的宏基因组“重新注释”表明大多数细胞没有细菌读数。(b-c) 对角质形成细胞免疫特征的疾病分析揭示了趋化因子和白细胞介素特征可能与细菌信号有关,即使在健康情况下。(d) 使用Warpy覆盖11个人效应细胞因子mRNA靶点和16S的12层定制ISH面板。(e) 这11种细胞因子在GM和JK中同时出现。(f) 在疾病中出现多细菌模式,扩散到所有上皮区域,包括终末分化的附着龈角化细胞,即角化粘膜。(g) 即使在16S信号稀疏的区域,表型似乎高度特异于每细胞16S计数最高的细胞。(h-i) 评估JK和GM,所有角化细胞都绘制在相对于16S表达的标准化热图上。
06
预计牙齿周围的角质形成细胞将支持先天和适应性免疫细胞类型的免疫反应协调
他们利用 CellChat 通过受体-配体相互作用来了解细胞间相互作用(参见方法),分别考虑先天和适应性群体。在健康状态下,相同和异质亚群之间的角质形成细胞受体-配体相互作用较高,较大的“节点”就是明证。这种现象在牙周炎中有所减少。免疫细胞通讯模式急剧增加,多个 T 细胞和树突状细胞亚群的节点较大(图 6a)。接下来,他们研究了从角质形成细胞到先天和适应性细胞的信息流(图 6b)。健康和患病的角质形成细胞表现出对细胞粘附(NECTIN、胶原蛋白、连接粘附分子 [JAM]、层粘连蛋白)和其他通路(如 APP、CXCL 和 MIF 通路)的偏好。在疾病中,他们观察到对细胞信号传导(TGFB、TIGIT、CCL、CD45 和 EGF)的偏好,这表明疾病中的细胞间通讯发生了变化,支持协调反应,可能与粘膜屏障缺陷有关。
确定了潜在的角质形成细胞适应性和角质形成细胞先天性轴后,他们接下来绘制了基础和 SB JK 和 SK 之间预测的相互作用,以了解先天和适应性群体在单个基因水平上的细胞间通讯变化。在先天性图中,巨噬细胞、中性粒细胞和1型经典树突状细胞(cDC1)的JK信号显著增加;GM KC通信减少。JK基底细胞信号传导减弱;分化SB细胞信号普遍增加(图6c)。在适应性图中,基础 JK 和 GM KC 受体-配体信号传导也减少,大多数分化/SB 信号传导到自然杀伤 T (NK T)、组织驻留记忆 T (TRM)、γ delta T (gd T) 和细胞毒性 T 细胞,观察到基础/SB SK 信号传导几乎没有变化(图 6d)。
他们量化了牙齿相关角质形成细胞和免疫细胞之间受体-配体相互作用的置信度。MIF 与牙周疾病进展有关,在先天和适应性分析中均是一种配体(通过 CXCR4 和 CD44/CD74);预测的 MIF 相互作用在中性粒细胞、巨噬细胞以及 NK 和 gd T 细胞的 JK 中最强(图 6e)。他们还发现结构标志物之间的几种先天和适应性细胞相互作用减少(图 6f)。总体而言,基础 JK 相互作用减少,表明这些细胞在牙周炎中尤其受到影响。
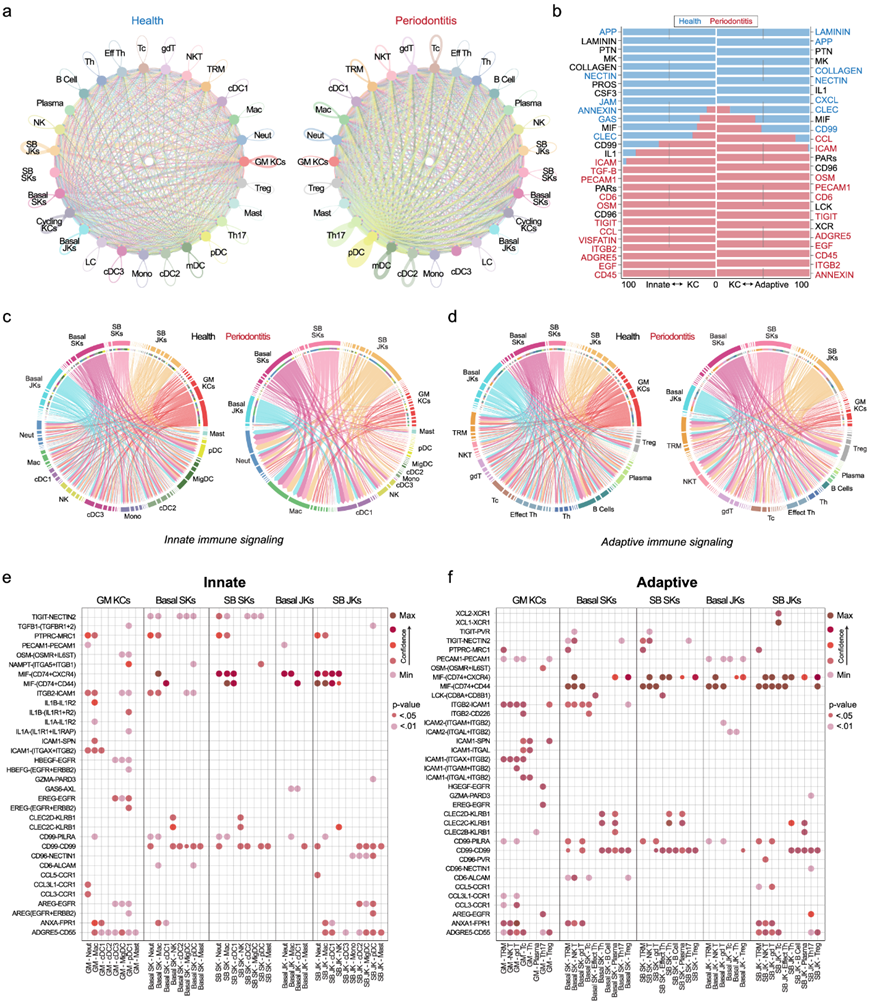
图6. 预计角质形成细胞和免疫细胞之间的细胞间通讯将通过先天和适应性细胞特异性程序进行。
(a) CellChat 用于了解健康和疾病状态下的细胞信号通路。(b) 健康和疾病状态下的相对信息流显示出对细胞粘附(NECTIN、COLLAGEN、JAM、LAMININ)和其他通路(如 APP、CXCL 和 MIF 通路)的偏好。(c-d) 使用弦图分析先天和适应性免疫细胞通讯,以可视化细胞间通讯。(e-f) 点图显示,基于牙齿相关角质形成细胞,在预测的受体-配体相互作用水平上,牙周炎中上调的信号通路。
07
牙周炎的空间蛋白质组学分析揭示了不同的上皮周围免疫微环境
根据在免疫和微生物挑战界面处的 SK/JK 图谱和下游分析的结果,他们设计了一种针对健康和牙周炎样本的高度多路复用免疫荧光 (mIF) 检测(33 种抗体)方法,以了解疾病状态如何影响这些角质形成细胞周围的免疫细胞模式(图 7a)。对于全载玻片分析,他们使用 StarDist 对图像进行分割(图 7b)。在牙周炎中,他们始终发现 SK 细胞附近集中的 CD45 +适应性免疫细胞;他们还发现krt19高表达细胞在角化粘膜(AG)中独特地吸引CD45+免疫细胞(图 7b)。当对细胞身份进行分类时,牙周炎中牙周袋周围微环境持续显示出较高的先天免疫细胞浓度(MPO + -中性粒细胞、CD14 / CD68 + -巨噬细胞、CD56 + -自然杀伤细胞、CD11c + -树突状细胞),而牙龈沟区域显示出不同的适应性免疫灶(CD8 + -细胞毒性T细胞、CD4 + -辅助T细胞、FOXP3 + -调节性T细胞和CD20 + -B细胞)(图 7c-d)。
使用相同四个 ROI 的多个蛋白质标记(图 7e),为细胞分配分层身份(图 7f)。按比例,组织范围内的免疫细胞比例转变为有利于树突状细胞、巨噬细胞、细胞毒性 T 细胞和 B 细胞。在局部细胞环境中,沟槽(sulcus)支持更多的免疫-免疫预测“互动”,有利于先天和适应性免疫细胞类型的相互作用;然而,在连接处(junction),支持的是CD14/CD68+过渡性单核细胞/巨噬细胞、CD68+巨噬细胞和MPO+中性粒细胞之间的互动(图 7g)。
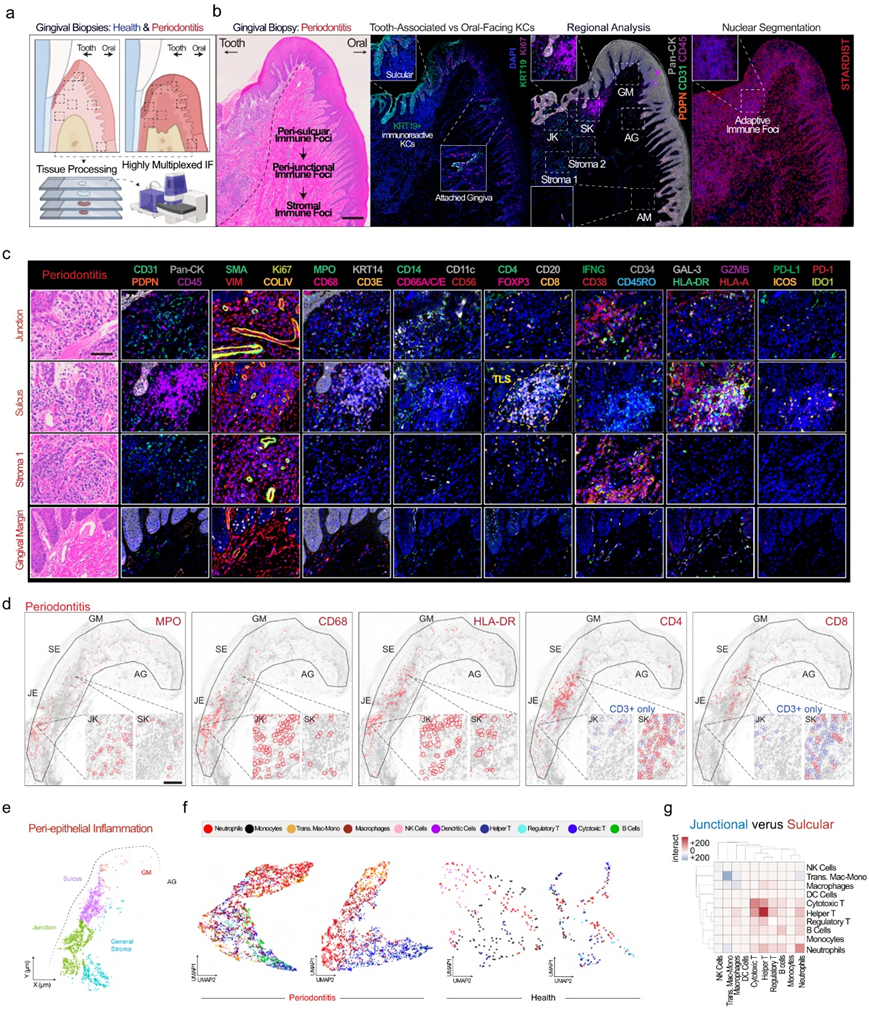
图7. 空间蛋白质组学分析。
(a) 实验流程。(b-c)免疫荧光分析。(d) 上皮周围区域的空间分析与之前一样分为四个特定区域,突出显示先天性 (MPO、CD68、HLA-DR) 到适应性 (CD4、CD8) 细胞的转变。(e) 在四个区域中,分段的免疫细胞分配了健康和疾病的身份。(f) 牙周炎表现出更加多样化的异质性。 (g) 免疫细胞之间的细胞间相互作用揭示了牙周炎中龈沟周围和龈沟周围免疫病灶中免疫细胞类型的多样化富集。
使用免疫细胞节点和细胞身份的图形网络(图 8a),他们想要了解这些免疫细胞的表型是如何在微生态位中形成的,包括细胞状态和免疫检查点表达。他们观察到很少的免疫细胞和很少的活化(ICOS)或免疫耗竭标志物表达(PD-1和PD-L1)(图 8b)。表型分析显示,在牙周炎中存在免疫抑制的jk微细胞(PD-L1+上皮细胞和基质细胞)和sk定位的三级淋巴结构,其中包含混合活性(ICOS+)和耗尽(PD-1+)群体(图8c)。
他们通过相同的 ROI 对此进行了量化,使用单个蛋白质标记物和手动阈值来通过将 0-255 个辅助荧光单位转换为阴性(“0”)或阳性(“1”)的二元分类来确定阳性。这揭示了在疾病中面向口周的基质中免疫浸润比例更高(图 8d)并且先天性交界处周围和适应性龈沟周围免疫灶频率更高(图 8e-f)。值得注意的是,在分析 JK 时,与 SK 相比,疾病中 PD-L1 +细胞的比例在统计学上显著更高(图 8e-f)。因此,在某些疾病状态下,牙周生态位可能通过最靠近牙齿-JK 界面的 PD-L1/PD-1 相互作用支持免疫抑制微环境。
对指定细胞节点的所有 10 种细胞状态进行了评估,包括细胞周期(Ki67)、免疫激活(GZMB、IFNG、Galectin-3、HLA-A、ICOS)、免疫耐受(IDO1)、免疫记忆(CD45RO)和免疫衰竭(PD-1、PD-L1),这扩展到 CD3 + T 细胞的细胞状态,其在龈沟周围病灶中显示出 ICOS +和 PD-1 +的混合表型(图8c)。评估细胞状态时,与龈沟周围病灶相比,疾病中的连接周围免疫细胞表达更多的 GZMB、IFNG/IFN-γ、Galectin-3 和 HLA-A(图 8g-i)。
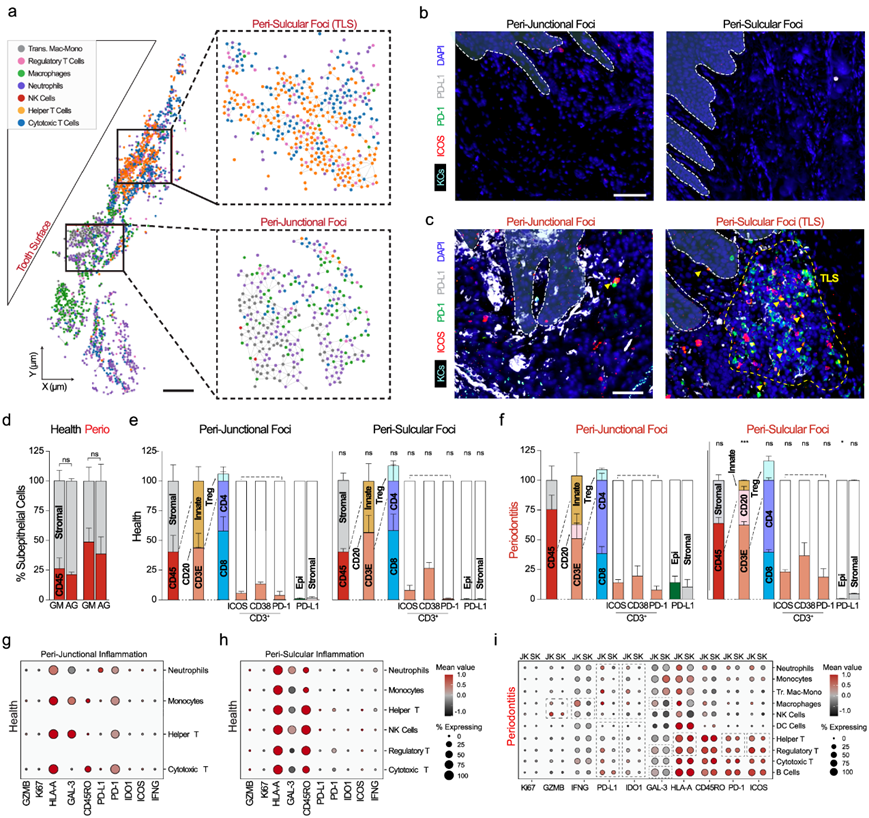
图8. 仅对免疫细胞间预测相互作用进行网络图分析,突出了牙周炎中免疫细胞聚集的区域差异。
(a) 仅对免疫细胞间预测相互作用进行网络图分析,突出了牙周炎中免疫细胞聚集的区域差异。 (b) 与健康细胞相比,牙周接合部免疫细胞表现出更多的免疫衰竭表型。(c) 在牙周炎中,上皮细胞和基质驻留细胞都参与其中。 (d) 显示沿上皮周围微环境的个体标记异质性。(e) CD45 +细胞的单一标记分析显示GM和 AG 基质普遍增加。(f) 比较细胞身份和细胞状态,结果显示健康状态下连接周围和龈沟周围微环境之间的差异很小。 (g-h) 健康免疫细胞状态的总体空间分析的点图。 (i) 在牙周炎中,量化了两个区域之间的差异。
+ + + + + + + + + + +
结 论
本项研究生成了人类牙周组织(34 个样本,105918 个细胞)的综合scRNA-seq图谱,包括SK/JK。SK/JK 表现出改变的分化状态,并在牙周炎中富含效应细胞因子。单细胞宏基因组学揭示了 37 种具有细胞特异性趋向性的细菌。荧光原位杂交检测了多种物种的细胞内16S和 mRNA 信号,并与 SK/JK 促炎表型原位相关。细胞间通讯分析预测了角质形成细胞特异性的先天和适应性免疫相互作用。高度多重免疫荧光揭示了上皮周围免疫灶,先天细胞通常在空间上受限于 JK 周围。空间表型分析显示牙周炎中 JK 微环境受到免疫抑制,SK 位于三级淋巴结构中。本项研究展示了健康和牙周炎中 SK 和 JK 细胞的影响和预测的相互作用组学,这需要进一步研究以支持慢性炎症状态下的精准牙周干预。
+ + + + +



 English
English


