文献解读|Cell Metab(27.7):肠道微生物群通过昼夜节律系统调节应激反应
✦ +
+
论文ID
原名:Gut microbiota regulates stress responsivity via the circadian system
译名:肠道微生物群通过昼夜节律系统调节应激反应
期刊:Cell Metabolism
影响因子:27.7
发表时间:2024.11.05
DOI号:10.1016/j.cmet.2024.10.003
背 景
应激系统和昼夜节律系统相互交织,是一种进化保守的适应性,使生物体能够对环境的变化做出反应。虽然应激反应的特点是对实际或感知到的危险的快速适应过程,但昼夜节律是一种预测可预测环境线索的内源性过程。虽然这两个系统的功能不同,但它们的重叠性质很明显,因为分配昼夜节律和应激相关信息的主要通路是相同的:下丘脑-垂体-肾上腺 (HPA) 轴和自主神经系统。此外,中枢昼夜节律起搏器视交叉上核 (SCN) 和下丘脑的室旁核 (PVN)(大脑中应激反应的主要驱动因素)距离很近且相互关联。应激和昼夜节律系统通过HPA 轴相互连接,以维持对外部刺激的反应。然而,这些信号如何协调的机制仍然未知。
实验设计
结 果
01
肠道菌群在一天中不断波动,调节皮质酮的昼夜节律
肠道菌群表现出昼夜波动,这是维持宿主代谢健康的关键,但这种波动对大脑功能的影响仍未得到探索。研究团队使用宏基因组测序在菌株水平上确定对照动物菌群的波动模式(图1 A),肠道微生物全天都在波动(图 1 B-C)。这种昼夜变化对于乳酸杆菌属尤其显著,小鼠肠道中振幅最高的 10 种菌株中有 7 种属于乳酸杆菌属(图 1 D)。有趣的是,这些细菌中存在一些益生菌的物种,例如Limosilactobacillus reuteri(以前称为罗伊氏乳杆菌)和詹氏乳杆菌。
已知 HPA 轴应激反应和基线皮质酮水平受肠道微生物群的调节。他们全天采集了抗生素处理 (ABX) 和无菌 (GF) 状态导致微生物群耗尽的动物的样本(图 1 A),血浆皮质酮的昼夜节律因为微生物状态而发生扰乱。更具体地说,这种激素特有的睡眠/觉醒峰值在 GF 小鼠中转移到黑暗期,而 ABX 小鼠在授时因子(zeitgeber)时间 (ZT) 11 显示出增加,从而导致更高的节律幅度(图 1 E-F)。除了糖皮质激素外,儿茶酚胺也是应激反应的核心。虽然未观察到昼夜血浆去甲肾上腺素水平的变化,但与传统 (CV) 小鼠相比,ABX 小鼠的肾上腺素表现出不同的节律性,其波动程度更高,类似于皮质酮。
由于糖皮质激素是主要的昼夜节律和应激信号,他们试图了解这些由微生物群驱动的节律紊乱是否也表现在大脑中参与整合应激和昼夜节律信号的区域中。于是,他们对 SCN、海马和杏仁核进行了转录组分析(RNA-seq),因为这些区域对于昼夜节律和应激调节都很重要。他们首先评估了转录本的节律性,并通过将 GF 和 ABX 基因表达与 CV 小鼠进行比较,他们发现了失去节律性的转录本(图 1 G)。
SCN 是主要的昼夜节律起搏器,它通过核心时钟基因和蛋白质的转录-翻译负反馈回路协调广泛的昼夜节律功能,持续约 24 小时(例如Bmal1、Clock、Per1 / 2和Cry1/2),34其中包括维持适当的糖皮质激素昼夜节律。结合RNA-seq数据,他们首次表明对肠道微生物群的操纵会导致 SCN 中时钟机制的改变。GF 小鼠表现出Bmal1和Clock的心律失常水平,而 ABX 小鼠具有Cry2的心律失常表达和Bmal1的逆转节律,将峰值从黑暗阶段转移到光明阶段(图 1 H)。这些数据表明微生物群调节中枢昼夜节律。此外,GF 小鼠和 ABX 小鼠在转录组中整体上都表现出不同的节律模式,其特征是转录本的峰值相发生变化(图 1 I)。此外,主成分分析 (PCA) 和 PERMANOVA 表明,在评估的四个时间点中有三个时间点受到微生物群的影响(图 1 J)。
与 CV 小鼠相比,GF 和 ABX 小鼠的 SCN 中的基因都失去了昼夜节律性(图 1 K)。为了确定失去节律性的基因的功能,他们进行了有针对性的富集分析。SCN 中失去节律性的基因在昼夜节律调节的重要通路中富集。昼夜节律的负向调节和光周期对昼夜节律时钟的同步在 ABX 中富集,光刺激的检测在两个组中都富集(图 1 L)。然后,他们评估了与昼夜节律通路相关的转录本失调是否可能是皮质酮昼夜节律变化的基础。GO分析表明昼夜节律通路的变化与皮质酮和微生物状态的变化有关(图 1 M)。总之,他们证明了微生物群表现出昼夜节律并调节皮质酮的昼夜分泌,这与 SCN 中的昼夜节律通路中断有关。这些结果表明,肠道微生物群可以影响中枢昼夜节律和使外周组织与中枢时钟同步的下游信号机制。
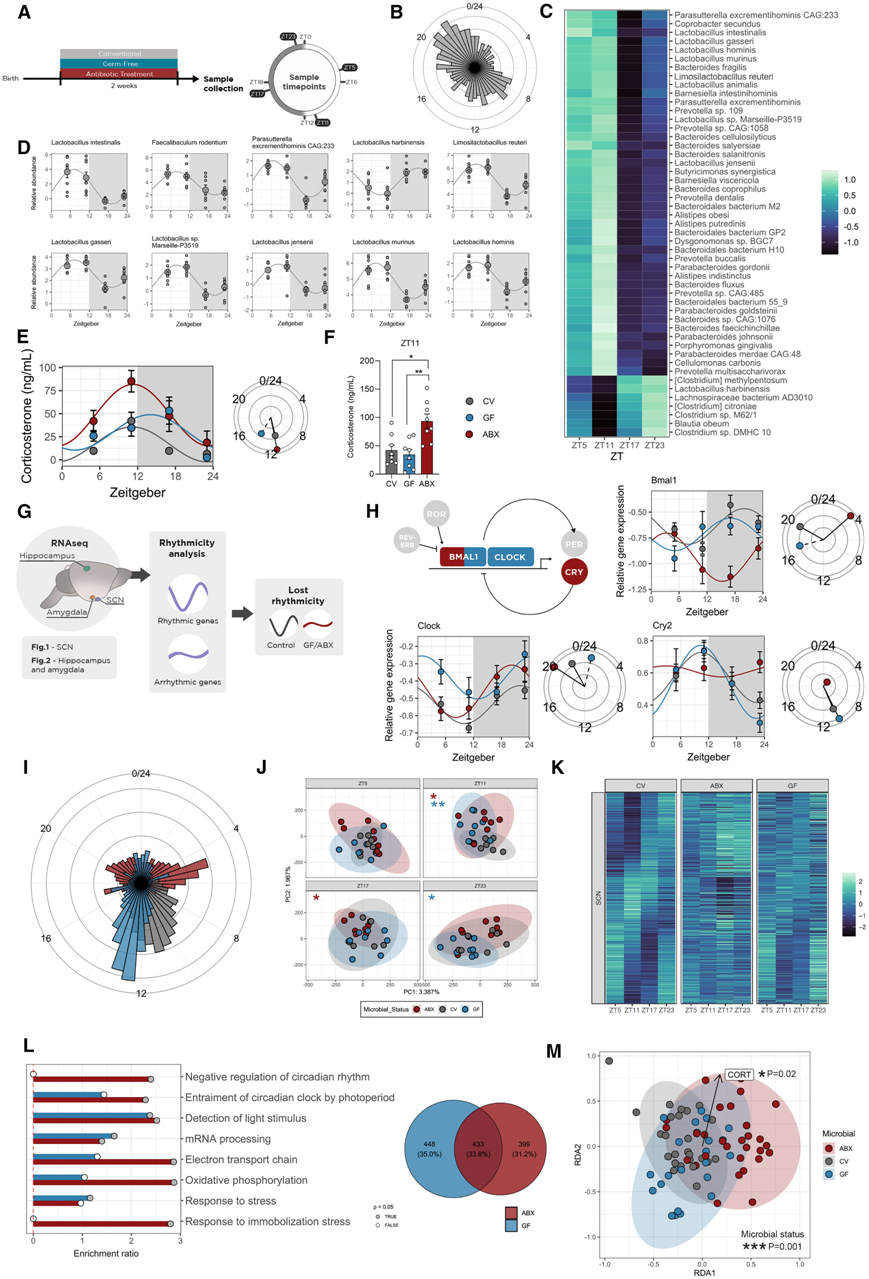
图1. 肠道菌群在一天中不断波动,调节皮质酮和 SCN 转录组的节律。
(A) 实验设计示意图。(B) 节律性分析后所有转录本的峰值期图。(C) 热图显示小鼠肠道内波动幅度最大的前50种细菌菌株。(D) 小鼠肠道中按最高振幅排序的 前10种细菌菌株。(E) 全天循环皮质酮水平。(F) ZT11 时的皮质酮水平。(G)节律性分析示意图。(H) 示意图表示核心时钟基因和蛋白质的转录-翻译反馈回路以及视交叉上核 (SCN) 中相应的改变的转录本。(I) 节律性分析后所有转录本的峰期图。(J) 在每个评估时间点对 SCN 转录组进行主成分分析。(K) GF 或 ABX 小鼠中失去节律性的 CV 小鼠的节律基因热图。(L) 失去节律性的基因的维恩图和靶向富集。(M) 对构成 Gene Ontology 中的昼夜节律通路的基因、微生物状态和皮质酮进行冗余分析的重叠图。
02
大脑中应激通路的节律受到微生物群的影响
因为大脑边缘系统对于应激反应至关重要,他们随后评估了海马和杏仁核转录组的节律变化,这两个区域也显示出昼夜节律的变化。微生物变化影响了海马中Bmal1、Clock、Per2、Cry2和Rorα以及杏仁核中Clock、Per2和Cry2的节律。此外,与 SCN 类似,GF 和 ABX 小鼠的转录组也显示两个区域的转录本峰期发生了改变(图 2 A-C)。海马中的 PCA 和 PERMANOVA 表明 ABX 小鼠在所有评估的时间点都有变化,而 GF 在暗期(ZT17 和 ZT23)有改变(图 2 B)。在杏仁核中,分析也表明 ABX 小鼠在所有时间点都发生了变化,ZT17 除外,而 GF 小鼠在暗期显示出变化,与海马体一致(图 2 D)。
GF 或 ABX 小鼠的海马体中有 1524 个转录本和杏仁核中的 505 个转录本失去了节律性(图 2E-G)。靶向富集表明,这些转录本在两个区域中都具有与应激系统相关的功能,对固定应激和糖皮质激素的反应发生了改变(图 2F-H)。为了更好地了解 GF 和 ABX 小鼠的应激系统紊乱以及它与皮质酮节律性改变之间的关系,他们采用了随机森林机器学习方法,创建的模型能够以 70% 的准确率识别杏仁核中的微生物状态,以 89% 的准确率识别海马中的微生物状态(图 2 I-K)。在海马中,Gsk3a是最重要的特征(图 2 J),该基因可以介导海马中的应激诱导神经炎症,这与对抑郁样行为的易感性有关。类似地,在杏仁核中,Hmgb1是分类的重要特征(图 2 L),据报道,该区域在受到应激后会发生改变并参与应激诱导的抑郁症。总之,这些数据表明,肠道微生物的操作会改变调节应激反应的关键区域中应激通路的节律性。
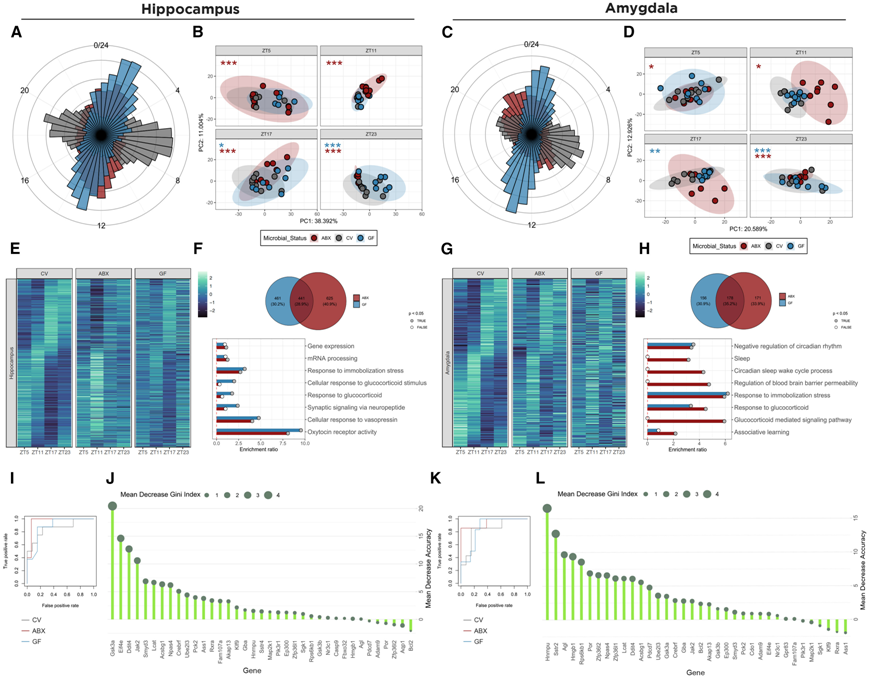
图2. 肠道微生物群的缺失影响了海马和杏仁核转录组的节律性波动。
(A, C) 对海马体和杏仁核进行节律性分析后,所有转录本的峰值期图。(B, D) 在每个评估时间点对海马体和杏仁核转录组进行主成分分析。 (E,G) CV 小鼠的节律基因热图。(F,H) 维恩图和针对海马和杏仁核中失去节律性的基因的靶向富集。(I,K) 随机森林模型的接收者操作特性曲线显示了分类模型在海马体和杏仁核中的表现。(J,L) 用于在海马体和杏仁核中生成随机森林模型的每个变量的重要性图。
03
微生物状态改变中枢谷氨酸代谢的昼夜波动
接下来,他们评估了 GF 和 ABX 小鼠海马和杏仁核代谢组的昼夜变化。与转录组类似,代谢物的节律性特征也因微生物状态而改变(图 3 A-B)。然后,他们使用多组学方法,基于 KEGG 数据库研究两个区域转录组和代谢组节律性之间的关联(图 3 C)。已知肠道菌群的耗竭会改变大脑代谢途径的日常模式,但转录本和代谢物的变化如何相互作用仍完全未知。与 CV 小鼠相比,ABX 和 GF 小鼠在评估区域的代谢组中均表现出节律性的丧失(图 3 D-E)。与一天中功能相关基因波动相关的代谢物的富集与杏仁核和海马中谷氨酸代谢的重要通路有关(图 3 F-G)。谷氨酸是大脑中最丰富的神经递质,已知它会受到海马和杏仁核中应激的影响,并且对于维持适当的应激反应很重要。杏仁核中的谷氨酸、谷胱甘肽和谷氨酰胺以及海马中的 2-酮戊二酸和半胱氨酸显示出与功能相关的转录本的相关性。谷氨酸和其他衍生代谢物的水平会因肠道菌群的破坏而全天发生变化(图 3 H-I)。通过联合通路分析,他们发现组成三部分谷氨酸突触的代谢物和转录本的波动在 ABX 和 GF 小鼠的两个脑区均受到干扰(图 3 J-K)。综合起来,这些数据表明,肠道微生物群变化引起的转录组变化表现为全天大脑谷氨酸代谢的功能变化,并可能导致应激反应的改变。
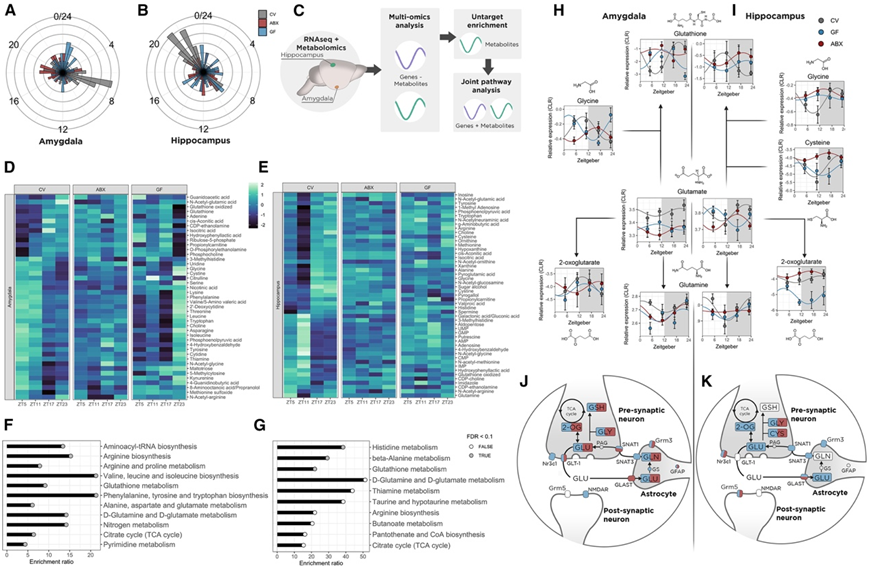
图3. 肠道菌群紊乱导致大脑谷氨酸代谢的昼夜模式不同。
(A-B) 波动代谢物的峰值相图。 (C) 多组学分析示意图。(D-E) 海马体和杏仁核中波动代谢物的热图。(F-G) 功能相关基因相关的代谢物的非靶向富集。(H-I) 杏仁核和海马中谷氨酸代谢的代表性通路。(J-K) 示意图表示杏仁核和海马中三部分突触中的谷氨酸代谢信号。
04
微生物耗竭破坏了 HPA 轴的节律模式
通过基因表达分析,他们研究了 ABX 小鼠 HPA 轴三个组成部分的昼夜节律和应激系统的关键基因(图 4 A):下丘脑的 PVN(图 4 B)、垂体(图 4 C)和肾上腺(图 4 D)。与接受载体处理 (VEH) 的对照组相比,他们观察到ZT11 时ABX 小鼠 PVN 中的Crh和Avp有所增加(图 4 B),并且在同一时间点 ABX 诱导的垂体中Pomc、Crhr1和Crhr2表达也有类似的增加(图 3 C)。在肾上腺中,没有观察到Star表达的变化,但催化类固醇激素水解的酶Cyp21a的节律在 ABX 动物和 VEH 动物之间有所不同,促肾上腺皮质激素 (ACTH) 受体Mcr2在 ZT23 时在 ABX 中增加(图 4 D)。糖皮质激素受体(Nr3c1)与循环激素相互作用并产生负反馈,从而维持适当的 HPA 轴功能和应激反应。这些受体的节律在 HPA 轴的所有三个组成部分中都发生紊乱(图4B-4D)。PVN 和肾上腺中的昼夜节律基因表达对于维持皮质酮的昼夜节律至关重要。ABX小鼠的 PVN 显示Per1的节律失常表达(图 4 B),并且在所有三个区域中都观察到核心时钟基因节律性的破坏。这些数据表明肠道微生物群调节 HPA 轴功能的节律模式,ABX 小鼠在昼夜节律高峰(ZT11)时表现出过度激活。由于大多数时间依赖性变化是在 PVN 和垂体中观察到的,因此数据还表明 ABX 小鼠皮质酮峰值的改变可能是由大脑驱动的。
血脑屏障位于大脑与循环微生物信号之间的界面。众所周知,这种屏障的功能具有昼夜节律性波动,可影响应激反应,并因慢性应激而改变。ABX 小鼠的 PVN 显示出紧密连接蛋白Ocln和Tjp1的失常表达(图 4E-F)。此外, ABX 小鼠的 ZT11 时Tjp1降低,而 ZT23 时表达呈增加趋势(图 4G)。为了确定这种改变的基因表达是否会导致血脑屏障功能的改变,他们进行了体内通透性试验(图 4 H)。在 ZT11(当Tjp1表达在 VEH 小鼠中达到峰值而 ABX 小鼠与基线相比没有变化时),他们观察到 ABX 小鼠下丘脑的通透性增加(图 4 I)。此外,皮质的通透性也有增加的趋势(图 4 J)。相反,在 ZT23,观察到 ABX 小鼠中Tjp1表达增加,下丘脑和皮质的血脑屏障通透性呈强烈下降趋势(图 4 K-L)。这些数据表明,在观察到 HPA 轴过度激活的同时,PVN 血脑屏障以一天中的时间依赖性方式对微生物信号的渗透性更强,这两者结合起来可能导致应激反应发生改变。
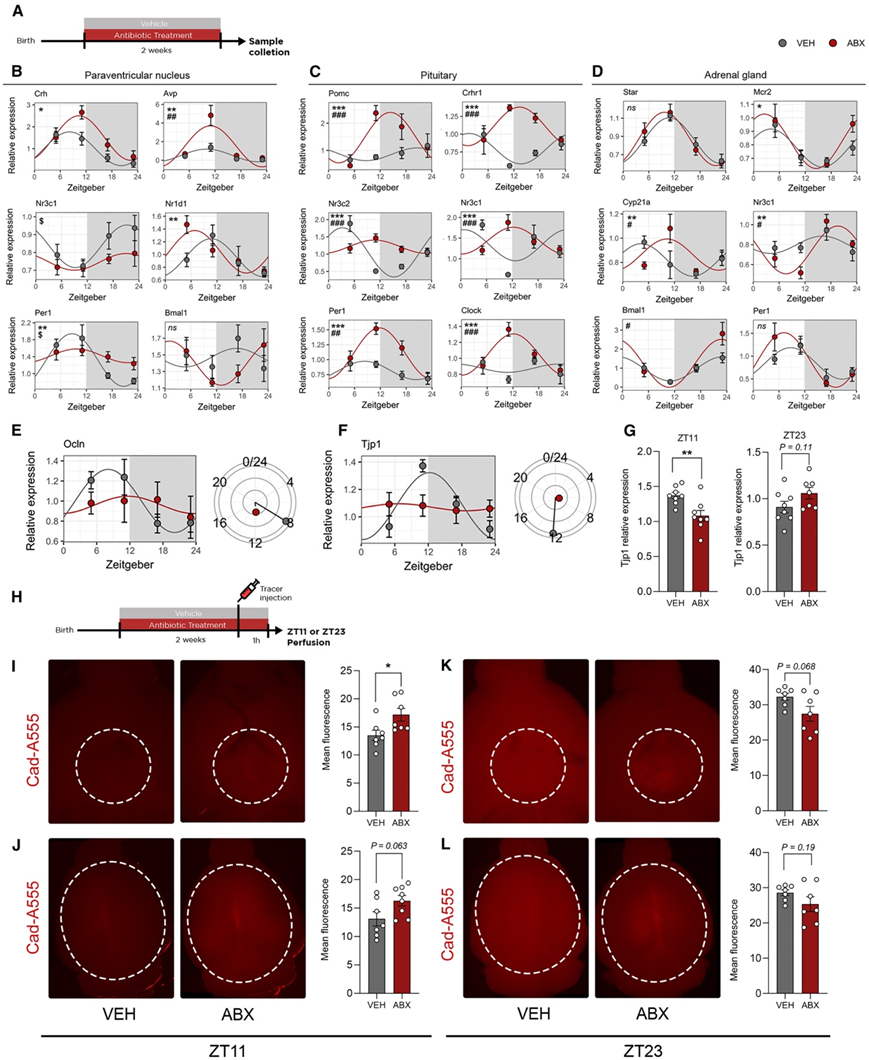
图4. 微生物耗竭会改变 HPA 轴的昼夜节律并破坏下丘脑血脑屏障。
(A) 实验设计示意图。(B-D) PVN、垂体和肾上腺中与应激和昼夜节律系统相关的基因表达。(E-F) PVN 中Ocln和Tjp1的全天表达。(G) Tjp1 在 ZT11 和 ZT23 的表达。(H) 实验设计示意图。(I-L) 体内血脑屏障通透性评估。
05
肠道微生物群对应激反应的调节与一天中的时间有关
他们提出假设:微生物群依赖的大脑节律波动和循环皮质酮的改变可能转化为应激环境下的生理和行为变化。为了更好地了解 ABX 诱导的糖皮质激素节律峰值过高对应激反应的影响,他们进行了急性束缚应激,因为海马和杏仁核中编码固定应激的通路都发生了改变(图 2)。小鼠在 ZT11(峰值)和 ZT23(谷值)束缚 15 分钟,剪尾后收集血浆以研究皮质酮应激反应(图 5 A)。虽然在非应激条件下没有发现实验手段引起的差异,但与 VEH 小鼠不同,在 ZT11 受到应激的 ABX 小鼠在应激之后与未接受处理的小鼠相比血浆皮质酮没有立即增加,而在 ZT23 时,两组都表现出强烈的应激反应(图 5B-C)。
由于社交和焦虑样行为受微生物群和应激系统的调节,他们在 ZT11 时进行了急性束缚应激后的旷场测试,并在 ZT11 和 ZT23 时进行了相互社交互动测试(图5D)。结果表明,在 ZT11,即节律性 HPA 轴功能障碍集中出现的时候,应激 VEH 小鼠与未接受过实验的小鼠相比,其社交互动总时间减少,而 ABX 小鼠没有表现出应激效应(图 5E-G)。此外,为了证实行为改变是由应激系统的昼夜差异驱动的,他们在 ZT23 时重复了行为测试,并证明 VEH 和 ABX 动物都表现出应激的影响(图 5F-G)。使用监督机器学习,他们分析了微生物耗竭和应激对社交和非社交行为的影响。鼻-身体相互作用是研究对象中最常见的行为类型,在 ZT11 时,VEH 小鼠的鼻-身体相互作用在应激下有所减少,但在 ABX 小鼠中没有(图 5 H)。与对照组相比,应激 VEH 组的肛门生殖器嗅探和鼻-鼻相互作用也有所减少,但是统计上并不显著(图 5 I-J)。不同类型的社交互动对急性应激的敏感性得到进一步确定,因为鼻-身体相互作用在 ZT23 时在 ABX 和 VEH 中都表现出应激效应,而其他类型的互动不受影响(图 5K-L)。旷场测试显示 ABX 小鼠的焦虑样行为增强,这表明 ZT11 时应激反应的改变将根据行为任务和结果测量而有所不同。为了确定这种行为改变是否由大脑驱动,他们在相互社交互动测试后 1 小时评估了 PVN 中对 HPA 轴功能和社会行为调节很重要的基因表达。在受到应激时,VEH 小鼠的Fos表达相对于对照小鼠和受到应激的 ABX 小鼠都有所增加(图 5 M),这表明在微生物群耗竭的小鼠中,该区域对应激的反应有不同的神经元活动。此外,Avp在受到应激的 VEH 动物中也增加了(图 5 O);由于Avp在调节社会行为方面至关重要,这进一步表明 ABX 小鼠的应激反应区域受到了破坏。
最后,为了证实这些应激引起的社会行为改变是由于应激时皮质酮释放特定时间受损所致,他们在行为测试前 40 分钟至 1 小时给 VEH 小鼠施用皮质酮合成阻滞剂甲吡酮(图 5 P)。首先,他们证实甲吡酮给药可阻止应激引起的皮质酮释放(图 5 Q)。行为数据表明,通过在应激暴露之前阻断皮质酮合成,可以预防应激引起的社会障碍(图 5 R)。此外,鼻-身体互动是施用甲吡酮后唯一恢复的社会行为类型(图 5 S-U)。甲吡酮还可以恢复梳理行为的改变(图 5 V)。这些数据表明,HPA 轴功能的基线变化会以一天中特定时间的方式转化为皮质酮应激反应的改变。这种改变的特征是,ABX 小鼠在 ZT11 时应激时皮质酮释放减少,这反过来又导致应激敏感型社交行为受损。
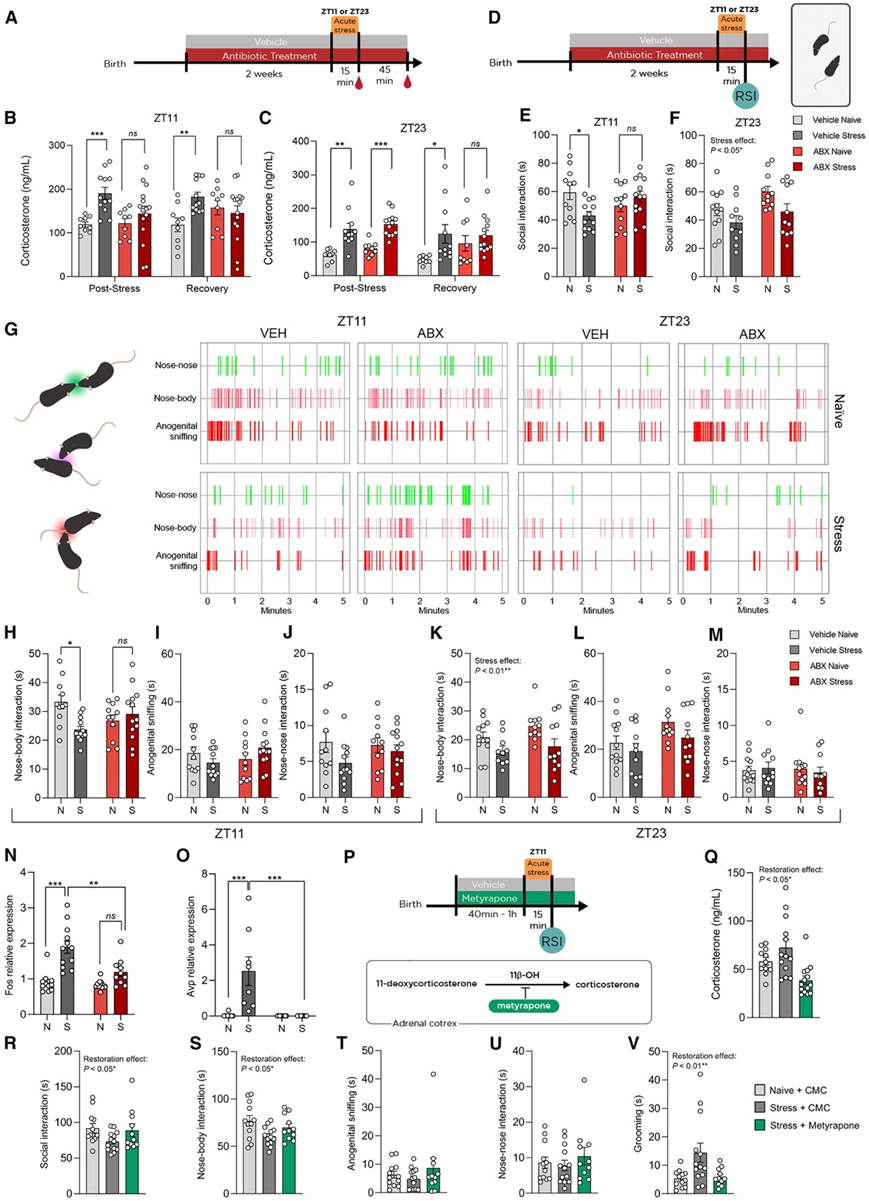
图5. 微生物耗竭对应激反应和应激敏感行为产生时间效应。
(A) 实验设计示意图。(B-C) 急性应激(15 分钟)和恢复(45 分钟)后ZT11 和ZT23 的皮质酮水平。(D) 实验设计示意图。(E) ZT11 时急性应激后的相互社交互动测试中的社交互动总时间。(F) ZT23 急性应激后,在相互社交互动测试中社交互动的总时间。(G) 评估的每种社会行为发生情况的Gantt图。(H-J) ZT11 时鼻与身体相互作用、肛门生殖器嗅探和鼻与鼻相互作用的持续时间。(I) (J) (K-M) ZT23 时鼻与身体相互作用、肛门生殖器嗅探和鼻与鼻相互作用的持续时间。(N-O) 在相互社交互动后,PVN 中Fos 和Avp的表达。(P) 实验设计示意图。(Q) 在 ZT11 接受甲吡酮治疗后,进行急性应激后的相互社会互动测试后的皮质酮水平。(R) 互社交互动测试中的社交互动总时间。(S-V) 美替拉酮给药后鼻体相互作用、肛门生殖器嗅探、鼻鼻相互作用和梳理的持续时间。
06
微生物群的破坏会调节皮质酮的峰值
为了确定循环糖皮质激素的变化是由于微生物的丢失还是 ABX 暴露后残留的微生物造成的,他们评估了用万古霉素 (VAN)(针对革兰氏阴性细菌)和庆大霉素 (GEN)(针对革兰氏阳性细菌)治疗的动物的皮质酮节律(图 6 A)。仅仅除去这些细菌群不足以对皮质酮的每日节律产生与全 ABX 鸡尾酒相同的影响(图 6 B)。接下来,他们用抗生素混合物的另外两种成分:亚胺培南 (IMP) 和氨苄西林 (AMP) 处理小鼠,并观察到ZT11 时皮质酮的升高仅由抗生素混合物引起(图 6 C)。遵循与皮质酮相同的模式,ABX 小鼠的血浆 ACTH 也在 ZT11 时显示出增加(图 6 D)。此外,与对照动物相比,雌性小鼠的皮质酮峰值也升高,表明这种变化与性别无关(图 6 E)。为了验证皮质酮升高是否可以逆转,在 2 周的抗生素处理后,ABX 小鼠去除抗生素混合物,并暴露于 VEH 小鼠的生活环境,并允许其恢复 1 或 2 周(图 6 F)。数据显示,1 周足以在 ZT11 恢复正常皮质酮(图 6 G)。
已确定肠道微生物群表现出昼夜些波,但抗生素混合物处理后这些波动如何变化仍未得到探索。为了了解肠道微生物的这些节律性昼夜变化是否驱动了 HPA 轴功能的改变,他们研究了 ABX 小鼠全天盲肠中的细菌负荷,并观察到ZT11 时细菌负荷明显达到峰值(图 6 H)。最后,他们给 GF 小鼠施用相同的抗生素混合物,并在 ZT11 时测量血浆皮质酮(图 6 I),峰值升高取决于抗生素对微生物群的破坏,而不是药物诱导的(图 6 J)。这些结果表明,通过抗生素进行的微生物耗竭改变了肠道细菌负荷的节律模式,导致细菌 DNA 出现异常峰值。总之,这些结果表明肠道微生物群的这种定时改变与一天中特定时间的血浆皮质酮增加有关。
为了进一步确定因果关系,他们随后将在 ZT11 和 ZT23 时从抗生素处理结束时的 ABX 小鼠收集的粪便微生物群转移 (FMT) 转移到 GF 动物中(图 6 K)。这将确认转移在 ABX 小鼠中观察到的微生物峰值是否会转化为受体小鼠中皮质酮的升高。数据表明,与接受在 ZT23 时收集的 FMT 的动物相比,接受在 ZT11 时收集的 FMT 的动物的皮质酮峰值升高(图 6 L)。基因表达分析表明,在 ZT11 时接受从 ABX 小鼠收集的 FMT 的小鼠的垂体中Pomc表达增加(图 6 M),PVN 中的Oxt减少(图 6 N),进一步表明在一天中的不同时间从 ABX 小鼠收集的细菌会对 HPA 轴产生不同的影响。为了确认肠道菌群的昼夜波动会影响皮质酮的释放,他们重复了实验,但这次使用的是 VEH 供体的菌群(图 6 O)。与 ZT23 相比,接受在 ZT11 收集的 FMT 的动物的皮质酮有增加的趋势(图 6 P)。
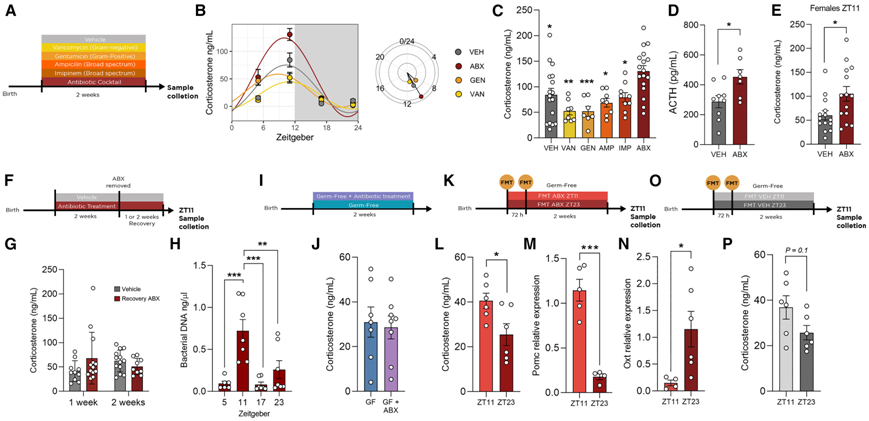
图6. ABX 暴露后残留的微生物调节糖皮质激素节律的峰值。
(A) 实验设计示意图。(B) 接受不同抗生素处理的全天皮质酮血浆水平。(C) 接受不同抗生素处理的动物在 ZT11 时的血浆皮质酮水平。(D) ZT11 时的血浆 ACTH 水平。(E) 雌性小鼠在 ZT11 时的皮质酮水平。(F) 实验设计示意图。(G) 恢复 1 或 2 周后的皮质酮水平。(H) ABX 小鼠的盲肠细菌 DNA。 (I) 实验设计示意图。(J) GF 小鼠和用抗生素处理的 GF 小鼠在 ZT11 时的皮质酮水平。(K) 实验设计示意图。(L) 从在 ZT11 或 ZT23 收集的 ABX 小鼠接受 FMT 的 GF 小鼠在 ZT11 时的皮质酮水平。(M-N) ZT11 时垂体中Pomc的表达和PVN 中Oxt的表达。(O) 实验设计示意图。(P) 在 ZT11 和 ZT23 收集的 VEH 小鼠接受 FMT 的 GF 小鼠的皮质酮水平。
07
肠道微生物的昼夜振波动是皮质酮释放变化的基础
最后,为了揭示皮质酮变化背后的微生物变化,他们对盲肠内容物进行了宏基因组测序。在属的水平上,他们观察到在 ZT11 时接受 FMT 的小鼠的肠道菌群组成与在 ZT23 时接受 ABX 和 VEH 小鼠的肠道菌群组成不同(图 7 A-B)。在菌株水平上的进一步分析表明 α 多样性指标没有变化,而 β 多样性分析证实,接受 ABX 或 VEH 动物 FMT 的受体 GF 小鼠的微生物群组成因收集时间的不同而不同(图 7 C-D)。在来自 VEH 供体的受体动物中没有观察到任何变化。在菌株水平上也观察到了 FMT 收集时间的影响(图 7 E-F)。尽管接受来自 VEH 和 ABX 动物的 FMT 的动物都显示出细菌菌株的改变,但这种变化在 ABX 动物中更为明显(图 7 E-F)。尽管在接受 VEH-FMT 的小鼠中评估的 5.9% 的菌株在 ZT11 组和 ZT23 组之间有所不同,但在接受来自 ABX 供体的 FMT 的小鼠中 64.5% 的菌株发生了改变(图 7 G)。为了进一步了解皮质酮与肠道菌群昼夜变化之间的相互作用,他们进行了冗余分析,结果显示,菌群的组成变化能与接受 ABX FMT 的小鼠中皮质酮的变化有关(图 7 H)。这些结果表明,接受 ABX FMT 的 GF 小鼠的微生物组成因采集时间不同而不同,这是循环糖皮质激素变化的基础。
接下来,他们利用来自 ABX 和 VEH 动物的 FMT 微生物群数据集;通过交叉引用,他们可以识别出可以在两个实验中改变的趋同细菌菌株。有趣的是,在比较 ABX 和 VEH-FMT 受体中的 ZT11 和 ZT23 时,L. reuteri 是唯一发生改变的菌株(图7 I-J)。为了进一步证实这种细菌物种可能是皮质酮微生物调节的基础,他们评估了VEH 和 ABX 动物中L. reuteri的昼夜节律。小鼠肠道中L. reuteri的相对丰度是有节律的,在光照期达到峰值(图 7 K)。此外,这种微生物还构成了昼夜振幅最高的前 10 种细菌菌株(图 1)。微生物耗尽后,罗伊氏乳杆菌的峰值移至与皮质酮峰值相同的时间(图 7 L),进一步表明这些细菌可能在驱动 ABX 小鼠中观察到的循环糖皮质激素变化方面发挥了作用。此外,之前的研究表明,罗伊氏乳杆菌能够通过迷走神经直接影响 PVN,从而对社会行为产生调节作用。为了证实罗伊氏乳杆菌调节皮质酮的昼夜波动,他们给小鼠管饲了一株罗伊氏乳杆菌,并在6小时后在 ZT11 或 ZT23 收集血浆(图 7 M)。罗伊氏乳杆菌导致 ZT11 时的皮质酮增加,但在 ZT23 时没有增加(图 7 N-O)。这里呈现的数据强调了肠道细菌波动对皮质酮循环水平的影响,进一步表明乳酸杆菌可以以一天中特定时间的方式调节皮质酮的释放。
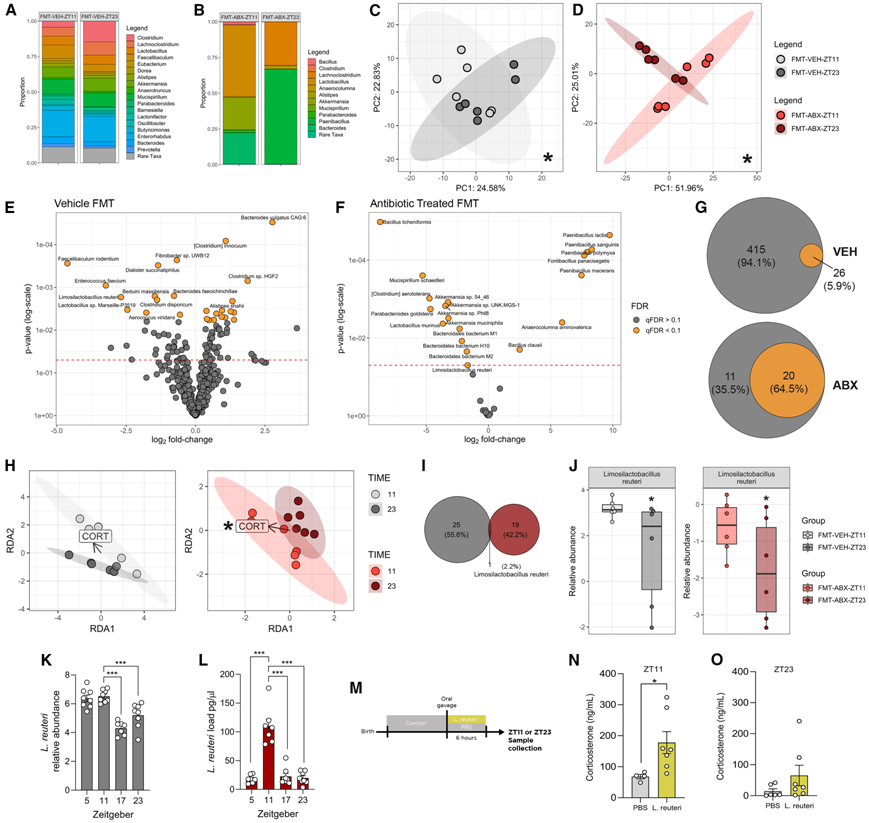
图7. 微生物组成的改变是循环皮质酮变化的基础。
(A-D) 条形图比较了 VEH和 ABX供体的 FMT 接受者的微生物群组成。(E-F) 火山图显示了 FMT 接受者盲肠中随时间变化的微生物。(G) 维恩图显示了 FMT 接受者中细菌分类群发生改变的百分比。(H) 对 VEH 和 ABX 供体的 FMT 受体的微生物组成和皮质酮进行三重冗余分析。(I) 维恩图显示了 VEH 和 ABX 的 FMT 受体中 ZT11 和 ZT23 之间发生改变的细菌类群之间的交集。(J) FMT 接受者中Limosilactobacillus reuteri的相对丰度。(K) VEH 小鼠Limosilactobacillus reuteri的相对丰度。(L) ABX 小鼠盲肠内容物中Limosilactobacillus reuteri的全天定量分析。(M) 实验示意图。(N-O) ZT11和 ZT23时收集的Limosilactobacillus reuteri口服管饲后的皮质酮水平。
+ + + + + + + + + + +
结 论
本项研究证明肠道微生物群是 HPA 轴节律的关键因素。微生物耗竭会扰乱大脑转录组和代谢组,这些转录组和代谢组位于海马体和杏仁核的应激反应通路中。这与大脑昼夜节律的失调相结合,导致糖皮质激素节律紊乱。由此产生的 HPA 轴在睡眠/觉醒转换时的过度激活会导致一天中特定时间的应激反应和应激敏感行为受损。最后,微生物群移植证实,肠道微生物的昼夜波动是改变糖皮质激素分泌的基础,而L. reuteri是此类影响的候选菌株。微生物群以昼夜节律的方式调节应激反应,并且对于全天对应激源做出适应性反应是必要的。
+ + + + +



 English
English


