文献解读|Sci Adv(11.7):多复发性脑膜瘤的多组学和临床分析揭示了风险因素、潜在生物学和进化见解
✦ +
+
论文ID
原名:Multiomic and clinical analysis of multiply recurrent meningiomas reveals risk factors, underlying biology, and insights into evolution
译名:多复发性脑膜瘤的多组学和临床分析揭示了风险因素、潜在生物学和进化见解
期刊:Science Advances
影响因子:11.7
发表时间:2024.10.23
DOI号:10.1126/sciadv.adn4419
背 景
世界卫生组织 (WHO) 的脑膜瘤分级系统包括 1-3 级,其中 WHO 3 级病变预后最差。世界卫生组织 (WHO) 2021 年更新的脑膜瘤分类增加了TERT启动子突变或CDKN2A/B纯合缺失,可独立将脑膜瘤归类为 WHO 3 级。一些小组根据分子标准提出了脑膜瘤的替代分类系统,包括转录组、基因组和表观基因组信息。整合这些分类器后,分子分类产生了三大类——MenG A、MenG B 和 MenG C,其中 MenG A 预后最好,MenG C 预后最差,以首次复发时间定义。然而,这些分子分类方案不考虑多发性复发脑膜瘤(MRM)或识别可预测多次复发的分子特征。此外,脑膜瘤的分子分析主要集中在原发性肿瘤上,因此,患者匹配的原发性和复发性脑膜瘤的纵向分子数据很少。
实验设计
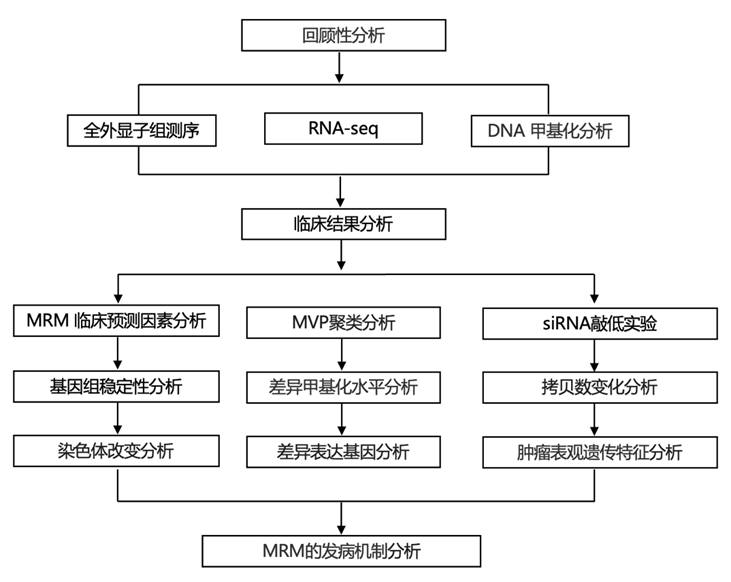
结 果
01
MRM 的临床预测因素
研究团队回顾性分析了 1186 名原发性脑膜瘤患者。其中 31 名原发性肿瘤出现多次复发,即治疗后放射学复发≥2 次,1155 名患者仍未复发(图 1A)。与非复发性脑膜瘤 (NRM) 患者相比,MRM 患者的随访时间明显更长,WHO 分级更高。匹配前,每个机构的 MRM 和 NRM 患者分布相对均匀。为了比较这些脑膜瘤组,他们进行了倾向评分匹配 (PSM),根据随访时间、WHO 分级和机构匹配 MRM 和 NRM 患者。
按照 1:3 最近邻 PSM,31 名 MRM 患者与 84 名 NRM 患者匹配,总共 115 名患者。PSM 后,随访时间、WHO 分级和机构均衡(图 1,B 和 C)。PSM 后,MRM 组和 NRM 组之间在随访时间(P = 0.451)、WHO 分级(P = 0.586)和机构(P > 0.999)方面不再存在显著差异。除 WHO 分级(SMD 为 0.211)外,所有标准化平均差异 (SMD) 均小于 0.1。在整个 PSM 队列中,66.1%(115 人中的 76 人)的患者来自机构 B,诊断时的中位年龄为 51 岁(四分位距为 48.5 至 65.0),67.8%(115 人中的 65 人)为女性,82.6%(115 人中的 95 人)为白人,90.4%(115 人中的 104 人)为非西班牙裔,39.1%(115 人中的 45 人)患有凸面脑膜瘤。在 MRM 中,复发次数中位数为 2,平均值为 2.77,范围为 2 至 7。
首先分析人口统计学、临床、组织病理学和影像学特征,以在单变量分析中确定 MRM 的预测因子(图 1D- F)。男性与 MRM 相关。然而,MRM 与种族、民族或诊断年龄之间无关。就诊时脑膜瘤数量较多的患者更有可能患有 MRM。接受辅助放疗的 MRM 和 NRM 患者之间没有显著差异。与 MRM 显著相关的唯一症状是视力障碍。视觉障碍可能是由直接的皮质障碍、视觉器官受压(包括视神经、视交叉或束以及控制眼外肌的脑神经)或因肿瘤体积或脑水肿导致的颅内压升高引起的。在出现视觉障碍的患者中,60.7%(28 例中的 17 例)的肿瘤位于前/中颅窝,可能直接影响视觉器官,或位于枕叶上方,可能直接影响视觉皮质。其他神经系统症状(如认知能力下降、步态异常、头痛、虚弱、疼痛、震颤或呕吐)不是 MRM 的显著预测因素。
在影像学检查中,肿瘤体积较大是 MRM 的预测因素。没有 MRM 在就诊时有营养不良钙化的影像学证据。然而,其他影像学特征,如脑膜瘤的位置、影像学上的坏死和影像学上的脑侵犯与 MRM 无关(图 1E)。次全切除术与 MRM 显著相关。组织病理学特征分析显示,片状结构、大核仁、坏死和细胞增多均与 MRM 独立相关。此外,每 10 高倍视野的平均有丝分裂数和 Ki67 指数也均与 MRM 独立相关。砂粒体(psammoma bodies)的存在与 MRM 呈负相关(图 1E-F)。其他一些组织学特征与 MRM 无关,例如核多形性、慢性炎症、脑侵犯、骨浸润、硬脑膜浸润、核内包涵体、明显的核仁、异形性和钙化(图 1E)。
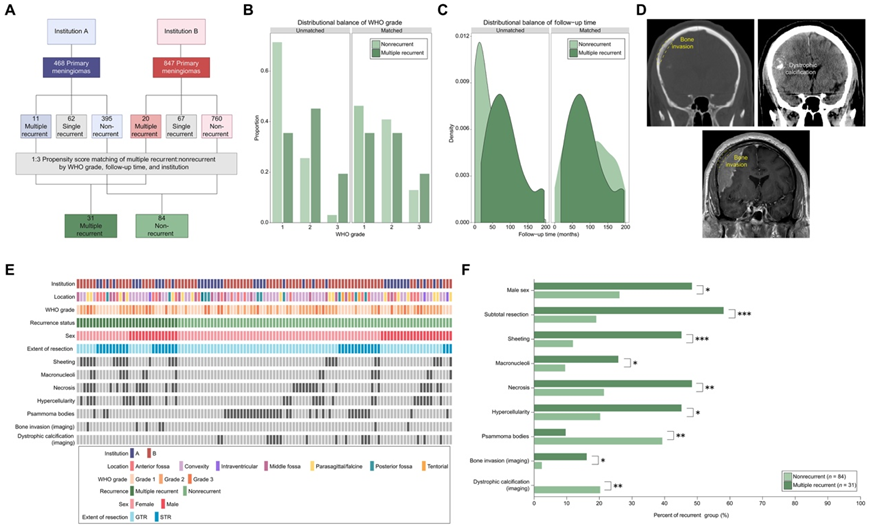
图1.患者的 PSM 揭示了 MRM 的临床预测因素。
(A) 表示 PSM 之前和之后患者机构分布的示意图。(B) 直方图描述倾向评分匹配 (PSM) 之前和之后非复发性脑膜瘤 (NRM) 和多次复发性脑膜瘤 (MRM) 组的 WHO 等级分布。(C) 密度图描绘了 PSM 之前和之后 NRM 和 MRM 组的随访时间(月)分布。(D) 代表性非造影头部 CT 和相关 T1 加权对比后磁共振成像,突出显示营养不良性钙化和骨质侵袭。(E) PSM 后临床队列中 115 名脑膜瘤患者的临床特征。(F) 单变量分析显示 MRM 与次全切除、片状、大核仁、坏死、细胞增多和影像学骨侵袭之间存在显著相关性。
02
WES 未产生可预测 MRM 的特定基因组变异
在对 MRM 预测因子进行临床分析后,他们研究了 MRM 的分子预测因子,从两个机构获得了测序数据,包括全外显子组测序 (WES)、转录组分析(RNA-seq) 数据和 DNA 甲基化阵列数据(图 2A-B)。首先,他们研究了多组学分析数据在预测脑膜瘤多次复发中的实用性。为了进行对照比较,仅使用原发性分子 MenG C 脑膜瘤(基于综合分子分类与复发相关的分子组来比较 MRM 与 NRM(图 3A)。对由 12 个 MRM 和16个 NRM 组成的样本集进行 WES 分析。有 10 个 WHO 3 级、10 个 WHO 2 级和 8 个 WHO 1 级脑膜瘤(图 3B)。鉴定了每个病变的非同义脑膜瘤相关基因组变异。由于缺乏与肿瘤样本匹配的正常组织来过滤种系变异,本研究不探究新的单核苷酸变异或结构变异,而是专注于先前与脑膜瘤相关的变异。MenG C MRM 和 NRM 之间的任何特定基因组变异没有显著差异,包括TERT启动子突变和CDKN2A/B缺失(图 3C)。以染色体改变形式出现的基因组不稳定性,尤其是 1p、14q 和 22q 染色体臂缺失,已确定为脑膜瘤复发的标志。因此,他们通过确定染色体臂丢失、获得或丢失或获得的负担,比较了 MenG C MRM 与 MenG C NRM 的基因组不稳定性(图 3D)。与 NRM 相比,MRM 的染色体臂丢失负担更大。还通过将基因组改变的百分比视为连续变量并检测片段级别的拷贝数改变(CNA),在更精细的层面上评估了基因组不稳定性。与臂级别不同,没有观察到统计学上显著的变化,但 MRM 中丢失的基因组百分比平均高于 NRM。为了评估染色体臂改变在 MenG C MRM 中的作用,对所有臂的染色体改变进行无监督聚类,以确定 MRM 和 NRM 是否分开聚类(图 3E)。值得注意的是,几乎所有 MenG C 脑膜瘤都有 1p 和 22q 丢失,因此这些丢失对聚类分析没有贡献。 MRM 和 NRM 在聚类分析中混合在一起,而不是彼此分离,这表明染色体臂变异模式本身无法预测 MenG C 脑膜瘤是否会多次复发(图 3E)。仅对完全切除的脑膜瘤进行亚组分析产生了类似的结果。因此,在 MenG C 脑膜瘤中,虽然没有与 MRM 相关的单一结构异常与 NRM 相关,但 MRM 在染色体臂水平上以染色体臂丢失的形式表现出更大的基因组不稳定性。
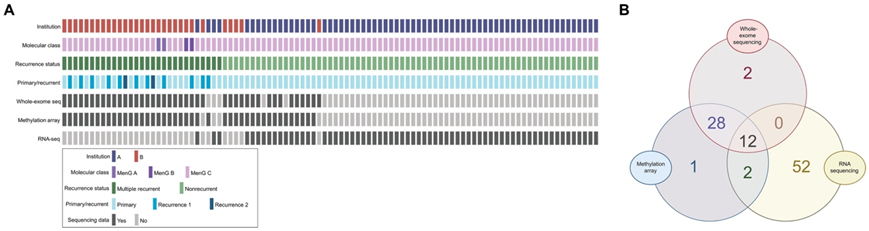
图2. 跨组学方法的样本表示。
(A) Oncoprint 表示跨组学方法的样本分布。(B) 维恩图显示跨方法的组学样本分布。
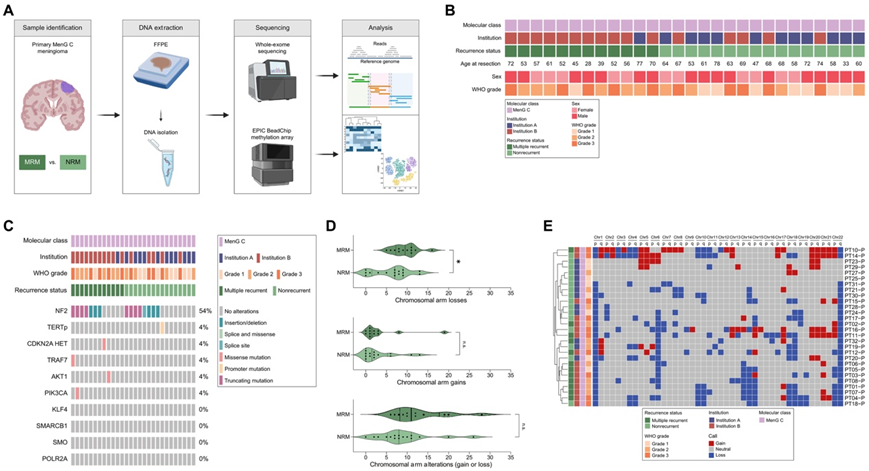
图3. WES 揭示了 MRM 中染色体丢失的负担更大。
(A) 示意图表示对福尔马林固定石蜡包埋 (FFPE) 组织进行 WES 和甲基化阵列分析的 MRM 和 NRM MenG C 脑膜瘤。(B) ) MenG C 脑膜瘤样本的患者信息。(C) 来自 MRM和 NRM的 WES 的脑膜瘤文献中常见的非同义基因组变异的状态。(D) MRM和 NRM之间的臂级拷贝数差异。(E) 基于从所有 MenG C 肿瘤的 WES 计算出的染色体臂改变的无监督聚类无法分别聚类 MRM 和 NRM。
03
甲基化分析揭示了 MRM 的独特分子特征
DNA 甲基化阵列分析已成为对中枢神经系统 (CNS) 肿瘤进行分类和预测的重要方法。因此,他们对接受 WES 的 MenG C 肿瘤队列进行了甲基化阵列分析(图 3A)。基于对该组 MenG C 脑膜瘤的前 10000 个最易变探针 (MVP) 进行监督聚类(图 4A)。β 值 (0.0 到 1.0) 表示给定基因座的甲基化程度,β 值越高表示甲基化程度越高。为了鉴定MRM 与 NRM 的整体甲基化水平是否存在总体差异,他们分析了每个样本的平均 β 值,发现 MRM 的 10000 个 MVP 的甲基化程度明显高于 NRM(图 4B)。排除部分切除的肿瘤时,MRM 的 10000 个 MVP 的甲基化程度仍然明显高于 NRM。
接下来,他们将分析 MRM 和 NRM 之间是否有任何特定的 CpG 位点存在甲基化水平差异,特别是启动子区域的 CpG 位点,这可能会影响下游基因的转录。比较组间的差异甲基化探针 (DMP) ,鉴定了 1034 个显著的 DMP,其中 395 个位于基因的启动子区域。总体而言,他们观察到 257 个基因在 MRM 中启动子甲基化增加,74 个基因在 MRM 中启动子甲基化降低(图 4C)。这些数据表明,分子 MenG C MRM 和 NRM 之间存在显著的整体和局部的甲基化差异。
他们试图确定特定位点的这些甲基化差异是否会影响基因表达,于是对一组 MenG C 脑膜瘤进行了RNA-seq,以确定 MRM 和 NRM 之间的差异表达基因(DEG)。通常,他们预计基因的启动子位点甲基化和 RNA 表达之间存在反比关系;因此,他们确定了两组基因:(i) 启动子位点高甲基化且RNA表达下调的基因和 (ii) 启动子位点低甲基化且 RNA 表达上调的基因(图 4D)。发现在 MRM 中启动子甲基化显著增加和 RNA 表达降低的基因包括BNIP2、CD34、CLVS1、CXADR、EDNRB、EVX1、GNG2、IRX1、MAPRE2、PCDH17、PLVAP、TF和ZBTB12。相反,在 MRM 中发现三个基因启动子甲基化显著降低、RNA 表达增加:LIG1、SLC9A8和ZNF512B(图 4D)。鉴于 MRM 和 NRM 在 CNA 负担方面的差异,他们还使用 SeSAMe 预处理流程对甲基化数据进行了联合分析,该流程基本上掩盖了后续分析中含有 CNA 的区域。将 SeSAMe 预处理数据的 DMP 分析与本研究始的 DMP 分析进行比较,发现原始分析的 13 个基因中有 8 个(EDNRB、GNG2、MAPRE2、ZBTB12、BNIP2、CXADR、PCDH17和TF)存在保守的启动子位点高甲基化和 RNA 转录降低,而原始分析的所有三个基因均存在保守的启动子位点低甲基化和 RNA 转录增加。具有高甲基化和 RNA 表达降低的基因可能代表预测 MenG C 脑膜瘤多次复发的重要标记,具有潜在的治疗意义。总之,分子分析表明,尽管特定的基因组变异和 CNA 数据不能可靠地预测脑膜瘤的多次复发,但甲基化分析和 RNA-seq分析数据可以提供更有用的预测性生物标记和对 MRM 生物学的见解。
他们能够成功敲低EDNRB的表达,EDNRB 是一个候选基因,其启动子甲基化增加,MRM 中的 RNA 表达降低(图 4E)。值得注意的是,即使排除原发性肿瘤部分切除的患者并使用 SeSAMe 预处理流程处理本研究的数据,EDNRB启动子高甲基化仍然存在。先前在三阴性乳腺癌和肝细胞癌中的研究强调了EDNRB下调与癌症预后较差之间的相关性,但EDNRB的功能尚未在脑膜瘤中研究过。因此,他们使用NF2突变脑膜瘤细胞系 CH157进行小干扰 RNA (siRNA) 介导的EDNRB敲低,并使用 CellTiter-Glo 测定法评估细胞增殖。siRNA对照细胞的EDNRB RNA 表达水平与未转染细胞相同。EDNRB敲低对所用三种 siRNA 构建体的平均敲低效率分别为 78% (EDNRBi.1)、95% (EDNRBi.2) 和 62% (EDNRBi.3)(图 4E)。与对照相比,EDNRB敲低细胞在转染三种 siRNA 构建体后 36 小时的增殖率显著升高(图 4F),这表明EDNRB的下调可能导致侵袭性脑膜瘤表型。
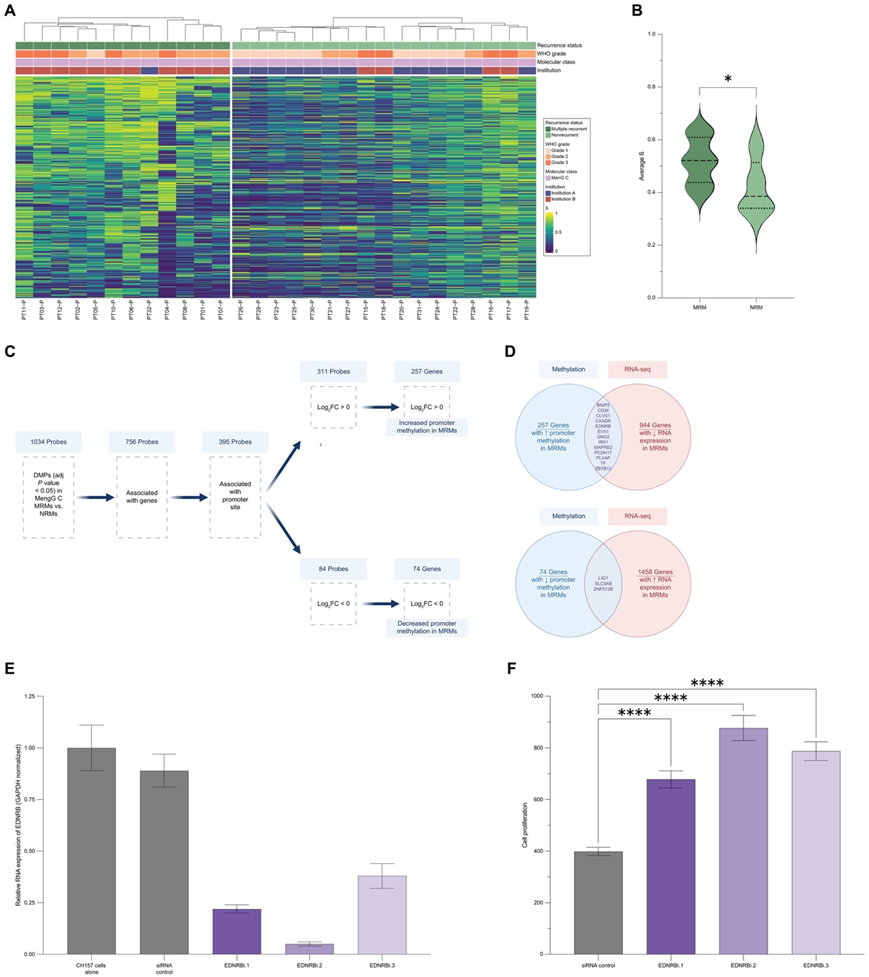
图4. 甲基化阵列分析阐明了 MRM 和 NRM 之间的差异。
(A) 监督聚类热图比较MenG C 脑膜瘤中MRM 与 NRM的前 10000 个变化最大的探针 (MVP) 。(B) 比较 MRM和 NRM之间前 10000 个 MVP 的平均 beta 值。(C) 对 MRM 和 NRM 之间的差异甲基化探针 (DMP) 进行定量,重点关注与基因相关的启动子位点探针。(D) 比较 MRM 和 NRM 时 (C) 中的甲基化分析和 RNA-seq 分析数据中基因的重叠。(E) 逆转录 - 定量聚合酶链反应 (qPCR) 验证CH157 脑膜瘤细胞系中三种不同EDNRB小干扰 RNA (siRNA) 构建体的敲低效率。(F) CH157 细胞中每个 siRNA 构建体的细胞增殖。
04
MRM 显示出从原发性肿瘤到复发的拷贝数增益增加
接下来,他们重点识别从原发性肿瘤到随后的患者匹配复发的 MRM 的纵向分子变化,确定了 11 名具有匹配的原发性复发样本的受试者,其中 10 名具有 WES 数据,10 名具有来自福尔马林固定石蜡包埋 (FFPE) 组织的甲基化谱(图 5A-B)。除一名患者外,所有患者在第一次切除后、复发切除前均接受过至少一轮放射治疗(分次或立体定向)(图 5B)。在每个队列的 10 个患者匹配的原发样本中,70%为大体全切除术,30%为次全切除术。大多数脑膜瘤属于分子类 MenG C(仅一名患者患有 MenG A 肿瘤,一名患者患有 MenG B 肿瘤)。
首先,从 WES 队列中鉴定出常见的脑膜瘤特异性基因组变异(图 5C)。由于NF2是数据集中观察到的最常见变异,因此进行了子分析以评估原发性组织和复发性组织中的NF2变异类型是否存在关联,复发和原发性肿瘤之间的NF2变异类型没有显著差异(图 5D)。对 WES 数据的进一步分析包括评估 MRM 中从原发性肿瘤到复发性肿瘤的 CNA 变化(图 5E)。他们假设:与原发性肿瘤相比,复发性肿瘤可能具有更大的基因组不稳定性,尤其是在放射治疗的情况下。因此,他们对原发性与匹配的首次复发 MRM 的拷贝数丢失、增加和总体改变进行了成对比较(图 5E-F),无论是在组水平还是作为基因组改变的百分比,拷贝数增加具有统计学意义。为了确定 MRM 患者中是否存在从原发性脑膜瘤到复发性肿瘤的亚克隆转移,他们使用来自接受原发性肿瘤全切除术的受试者组织的变异等位基因频率 (VAF) 进行了亚克隆分析,该受试者的原发性肿瘤和随后两次肿瘤复发的分子数据可用。这产生了四个亚克隆聚类,这些聚类从原发性肿瘤到第一次和第二次复发都保持相似性(图 5H)。因此,虽然全外显子组分析没有发现新的基因组变异或亚克隆转移,但它确实揭示了从原发性 MRM 到复发性 MRM 的拷贝数增益负担增加。
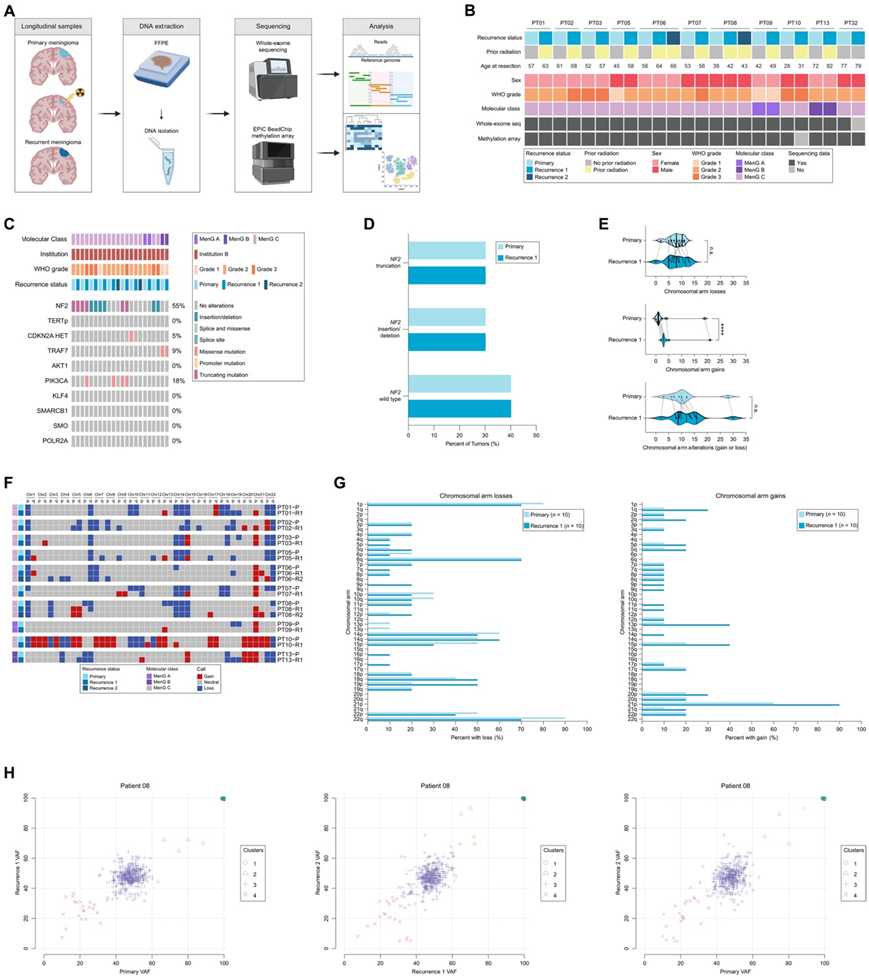
图4. 重复 MRM 未表现出基因组变异或亚克隆的变化,但拷贝数增益的负担增加。
(A) 对 MRM 患者的纵向匹配的原发性和复发性 FFPE 样本进行 WES 和甲基化阵列分析。(B) 11 个原发性、11 个首次复发性和 2 个二次复发性病变的患者信息。(C) 来自 10 个原发性和匹配的复发性对的 WES 的脑膜瘤文献中常见的非同义基因组变异。(D) 对 (C) 中的NF2变异进行量化,显示对于任何特定变异类型,原发性和首次复发之间没有显著差异。(E) 原发性和匹配的首次复发肿瘤之间的臂级拷贝数差异。(F) 10 名患者原发性和匹配的复发性肿瘤的染色体臂增加和丢失。(G) 直方图表示原发性和首次复发 MRM 之间的染色体臂总增加和减少。(H) 使用来自代表性患者的变异等位基因频率 (VAF) 对全外显子组数据进行亚克隆分析。
05
从原发性到复发性,MRM 中的甲基化分析结果相似
接下来,他们使用匹配的原发性和复发性肿瘤的表观遗传甲基化分析研究了 MRM。使用 10000 个 MVP 进行无监督聚类,将每个患者的原发性和第一次和第二次复发性病变分组在一起(图 6A),表明 MRM 患者的原发性和复发性肿瘤具有相似的表观遗传(DNA 甲基化)特征,即使接受放射治疗也是如此。值得注意的是,在 WHO 等级从原发性肿瘤升级为复发性肿瘤的三个肿瘤(PT2、PT4 和 PT6)中,复发的甲基化特征与原发性肿瘤保持相似,突出了这些肿瘤表观遗传特征的稳定性(图 6A)。在正交分析中,他们确定了 10000 个 MVP 中样本间甲基化状态保守的百分比,他们重新证明了患者匹配样本从原发到复发具有相似的甲基化谱(图 6B),进一步强调了 MRM 表观遗传谱的纵向稳定性。然而,比较 10000 个 MVP 的平均 β 值显示,与匹配的原发肿瘤相比,首次复发肿瘤的甲基化显著增加(图 6C)。
虽然聚类和 β 值比较显示匹配的原发性肿瘤和复发性肿瘤的甲基化谱相似,但原发性肿瘤和复发性肿瘤的成对比较揭示了复发性肿瘤的相对高甲基化。因此,他们研究了原发性病变和复发性病变之间是否存在具有不同甲基化状态的特定 CpG 位点。当使用配对方法(将每位患者的首次复发与其自己的原发性肿瘤进行比较)和非配对方法(将所有首次复发与所有原发性肿瘤进行比较)进行 DMP 分析时,发现匹配的原发性和复发性肿瘤之间没有显著的 DMP。虽然受样本量限制,但对于也有第二次复发数据的两名患者,第二次复发和原发性肿瘤之间没有显著的 DMP。即使在排除原发性病变次全切除 (STR) 的患者后,这些甲基化发现仍然成立(图 S5A-G)。总的来说,这些分析表明,尽管与原发性 MRM 相比,首次复发时 10000 个 MVP 存在高甲基化,但没有存在差异甲基化的特定 CpG 位点。总的来说,这些分析表明,虽然与原发性 MRM 相比,首次复发时 10000 个 MVP 存在高甲基化,但没有存在差异甲基化的特定 CpG 位点。
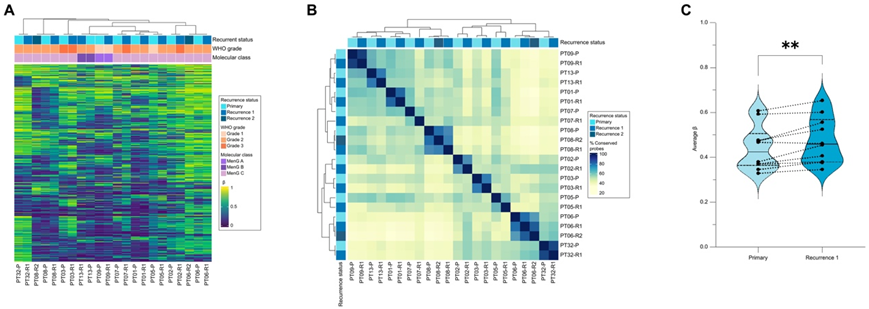
图6. 匹配的原发性和复发性脑膜瘤具有相似的甲基化谱。
(A) 无监督聚类热图,比较 MRM患者原发和匹配复发的 10000 个 MVP。(B) 样本中具有保守甲基化状态的 10000 个 MVP 百分比的热图。(C) 对每个 MRM 肿瘤的匹配原发和复发 1之间 10000 个 MVP 的平均甲基化 β 值进行成对比较。

图S5. 对匹配的初发和复发样本进行全外显子组测序和甲基化分析。
(A) 对匹配的原发性和复发性全切除(GTR)的多发性复发脑膜瘤(MRM)的NF2变异进行定量分析表明,任何NF2变异类型的原发性和首次复发之间没有差异。(B) GTR原发肿瘤和匹配的首次复发肿瘤之间臂水平的拷贝数差异。(C) GTR原发和匹配的复发肿瘤的染色体臂增益和缺失。(D) 直方图表示总染色体臂的增益和损失。(E) 无监督聚类热图比较匹配的GTR初次和首次复发样本的前10000个最可变探针(MVP)。(F) 原发肿瘤全切除样本中保守甲基化状态的前10000个MVP百分比的热图。(G) 对每个全切除的MRM肿瘤中匹配的原发灶和复发灶1的10000个MVP的平均甲基化β值进行配对比较。
+ + + + + + + + + + +
结 论
本项研究确定了MRM的临床、遗传和表观遗传预测因子,并评估了患者匹配样本中这些脑膜瘤的演变。在多变量二项逻辑回归中,MRM 与男性、次全切除术、就诊时脑膜瘤数量较多和组织病理学片状显著相关。原发性脑膜瘤的多组学分析显示,MRM 具有更多的拷贝数丢失和增加的 DNA 甲基化。在EDNRB敲低的脑膜瘤细胞中,启动子甲基化程度较高且 MRM 中基因表达降低的位点增殖增加。MRM 复发与原发性相似,但拷贝数增加和甲基化增加的负担更大。这项针对 MRM 的临床和多组学研究对这些具有挑战性的肿瘤的生物标志物和治疗剂的未来开发具有重要意义。
+ + + + +



 English
English


