文献解读|Nat Commun(14.7):蛋白质组学分析可识别具有独特生物学和对铂类化疗反应的肌肉浸润性膀胱癌
✦ +
+
论文ID
原名:Proteomic profiling identifies muscle-invasive bladder cancers with distinct biology and responses to platinum-based chemotherapy
译名:蛋白质组学分析可识别具有独特生物学和对铂类化疗反应的肌肉浸润性膀胱癌
期刊:Nature Communications
影响因子:14.7
发表时间:2024.02.01
DOI号:10.1038/s41467-024-55665-1
背 景
膀胱癌 (BC) 是最常见的癌症之一。全球每年有超过 570000 例新诊断病例和 212000 例死亡病例。BC 可分为非肌层浸润性 (NMIBC;75%) 或肌层浸润性 (MIBC;25%)。MIBC 是一种侵袭性肿瘤,约一半病例会进展为转移性尿路上皮癌 (mUC) 并导致死亡。对于适合使用顺铂的患者,MIBC 的最佳治疗方法是以顺铂为基础的新辅助化疗 (NAC),然后进行根治性膀胱切除术 (RC),5 年总生存率 (OS) 获益为 5-7%。接受 NAC 治疗的患者中约 40% 在 RC 时表现出显著病理反应(定义为没有肌层浸润性疾病和淋巴结浸润),ypT0 患者的 5 年生存率为 85%。残留 MIBC 患者面临 NAC 不良反应的风险,并且会延迟确定性局部治疗而无法获得治疗益处。迄今为止,尚无经过验证的分子标记可指导 MIBC 患者的治疗选择。因此,确定哪些人将从 NAC 和随后的 RC 中受益仍然是一个活跃的研究领域。
实验设计
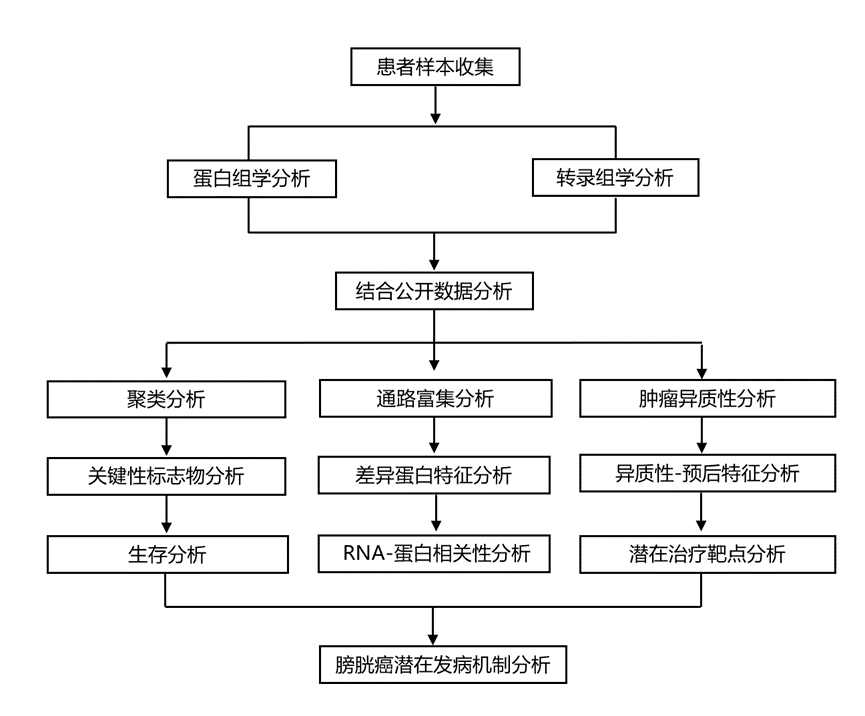
结 果
01
患者特征分析
研究团队分析了 107 名接受化疗(本研究中统称为“NAC”)的 MIBC 患者和N = 25 名 NMIBC 患者的蛋白质组。所有 MIBC 患者均接受了经尿道切除术 (TUR),随后接受 RC,其中 44% 显示淋巴结转移,49% 为 cT3-4 pre-NAC,RC 时完全缓解率为 30%,定义为 ypT0N0M0。
从所有 107 名 MIBC 患者中获取了NAC前 (pre-NAC) 的TUR 组织,另外收集了 36 个重复 TUR 样本,以研究肿瘤内异质性 (ITH),总共 纳入143 个 TUR 标本。107 名患者中有 75 名在 NAC 和 RC 后为部分有反应 (pTis/a/1N0M0) 和无反应 (≥pT2NXM0)。从中,他们收集了 55 个 NAC后(post-NAC)的RC 标本和 14 个额外的 RC 重复标本以研究 ITH,总共 69 个 NAC 后 RC 标本。他们还汇集了RC 时收集的N = 37 个良性输尿管 (BU) 样本。NMIBC 队列包括来自 25 名患有高级别 Ta (Ta-HG) 肿瘤的 NMIBC 患者的 29 个 TUR 组织标本,用于比较,样本总数为 278 个(图1a-b)。
他们将温哥华和伯尔尼 MIBC 队列合并为单个 MIBC“NAC”队列(包括 TUR 和 RC 样本)以进行进一步分析。来自TUR和RC的样本分开聚类,表明蛋白质组异质性根据样本类型和/或介入全身治疗而不是收集部位而存在。他们对 107 个来自 TUR 的 NAC 前的 MIBC 样本进行了共识聚类,使用肿瘤中 25% 变化最大的蛋白质(N = 1170)进行稳健量化。基于对共识矩阵和增量图的分析,重点关注共识累积分布函数 (CDF) 面积的变化,确定了四个具有独特生物学特征、对 NAC 的反应和预后相关性的高度分离的共识聚类(CC),包括CC1、CC2、CC3、CC4(图 1c),然后根据它们与其他已知亚型分类器相关的蛋白质表达谱以及它们丰富的生物学特征对这些聚类进行了命名。
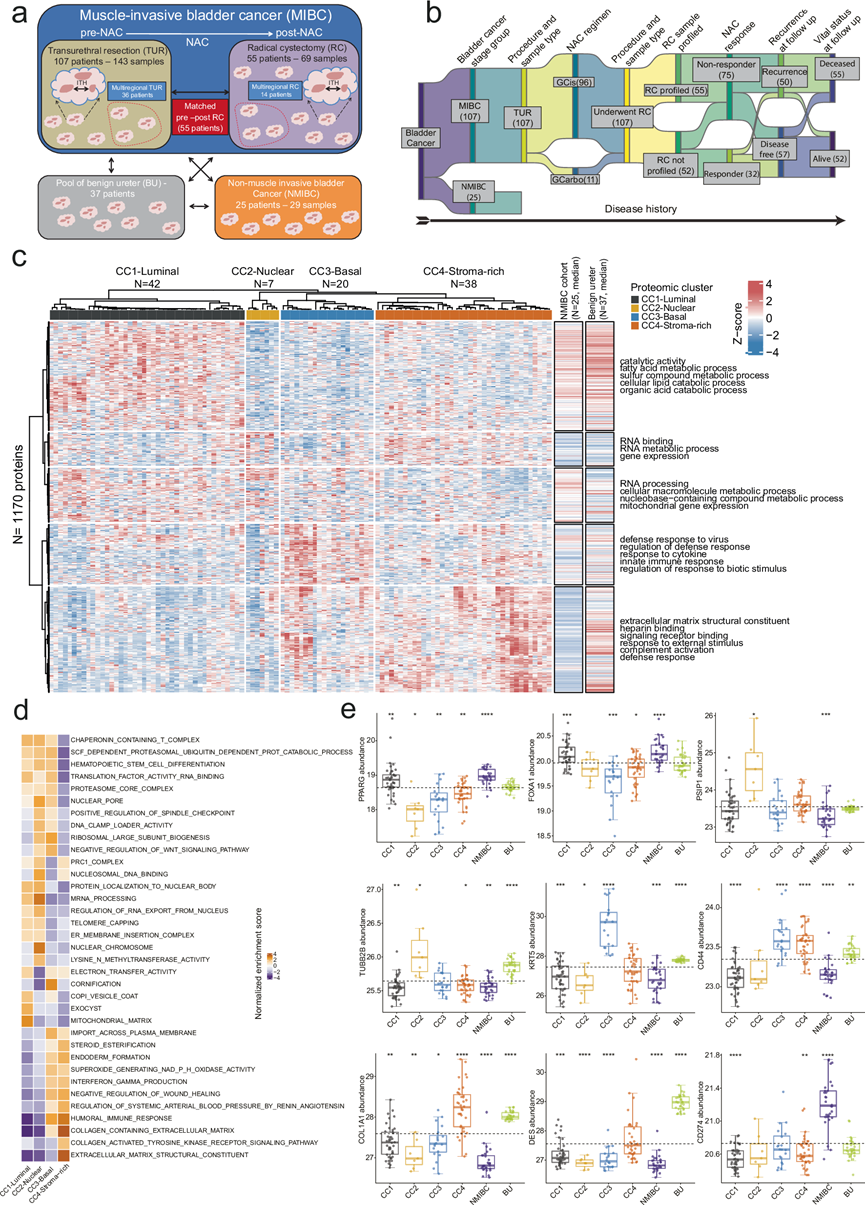
图1. 蛋白质组的一致性聚类揭示了化疗前肌肉浸润性膀胱癌 (MIBC) 样本中不同的生物亚型。
(a) 总结示意图,描述了本研究中执行的不同样本类型和分析。(b) 桑基图显示了研究概述和疾病史。(c) 热图显示了 NAC TUR 前样本之间的欧几里得距离的 k 均值共识聚类。(d) 热图显示所选生物过程在四个 NAC TUR 前蛋白质组聚类中的归一化富集分数。(e) 箱线图显示了四个 NAC TUR 前蛋白质组聚类中关键亚型特异性 MIBC 蛋白的相对蛋白质丰度。
CC1-Luminal占 39% (42/107) 的肿瘤,富含与尿路上皮分化一致的管腔标志物(例如PPARG、FOXA1)。CC1-Luminal通过基因集富集分析 (GSEA) 显示出高代谢和线粒体活性(图1d-e)。CC1-Luminal还具有更大比例的微乳头继发性组织学特征,以及对 NAC的最高病理反应率 (50%)(图 2a)。与使用基于转录组学的分类器的其他 MIBC研究一致,CC1-Luminal中的患者具有最佳 OS(图 2b)。
CC2-Nuclear(7/107 = 7%)富含核特征,包括涉及 mRNA 结合、RNA 代谢和组蛋白赖氨酸 N-甲基转移酶活性的细胞过程,表明肿瘤高甲基化(图 1d-e)。大约一半最常见的神经内分泌分化标志物在 CC2-Nuclear 中富集(例如 PSP1、TUBB2B)。CC2-Nuclear 捕获了五分之三的组织学小细胞/神经内分泌肿瘤(图 2a)。CC2-Nuclear 中的患者的结果最为有利(图 2b),这与使用转录组分类器的先前报告不同。这可能与该亚组样本量小以及 NAC 后 CR 率出人意料的高(80%)有关,其中一名患者在治疗前仅患有 T1N0M0 疾病。
CC3-Basal (20/107 = 19%) 的特征是基底细胞分化(例如 CD44)、角化(例如 KRT5、CD44)和免疫途径富集(例如 IFN-γ 产生)(图 1d-e)。该聚类中 44% 为女性,这一趋势与之前的报告一致。这些肿瘤与更高的临床 T 分期、鳞状分化以及聚类中最差的 RFS 和 OS相关(图 2a-b)。这些发现与 NAC 10或其他新辅助/辅助疗法中的报告一致,其中基底肿瘤高度免疫浸润(特别是细胞毒性T 细胞和自然杀伤细胞)并且与其他亚型相比,治疗反应和生存率更差。
CC4-Stroma-rich 型肿瘤(38/107 = 35%)表现出高基质相关蛋白表达,包括结构蛋白(如 COL1A1、DES)、细胞外基质 (ECM) 特征和高免疫浸润(图 1c-e),与先前研究一致。这些患者的 OS 结果 与 CC1-Luminal 型和 CC2-Nuclear 型患者相似(图2b),且 RFS 优于 CC3-Basal 型(图 2b)。CC4-Stroma-rich 型肿瘤的反应率趋于更高。与其他聚类相比,CC1-Luminal 和 CC4-Stroma-rich 与 BU 共有最多的聚类蛋白,包括 CC1-Luminal 的管腔标记物(如 SPINK1、SNCG 和 KRT20)以及 CC4-Stroma-rich 的基质标记物(如 COL2A1、COL1A1 和 CPA3)。通过欧几里得距离,它们的轮廓与 BU 最接近,表明这两个聚类的尿路上皮分化(CC1-Luminal)和基质含量(CC4-Stroma-rich)高于 CC2-Nuclear 和 CC3-Basal。其他人也使用转录组学描述了富含基质的组的存在,并鉴定出具有中等水平尿路上皮分化、更高比例的非肿瘤细胞和明显免疫浸润(例如 T 细胞和 B 细胞群)的肿瘤。其他人报告称,富含基质的肿瘤对 NAC 的病理反应趋势优于其基底肿瘤。在接受派姆单抗治疗的 PURE-01 试验患者以及接受阿替利珠单抗治疗的 ABACUS 试验患者中,它们对免疫疗法的反应似乎相对较差。
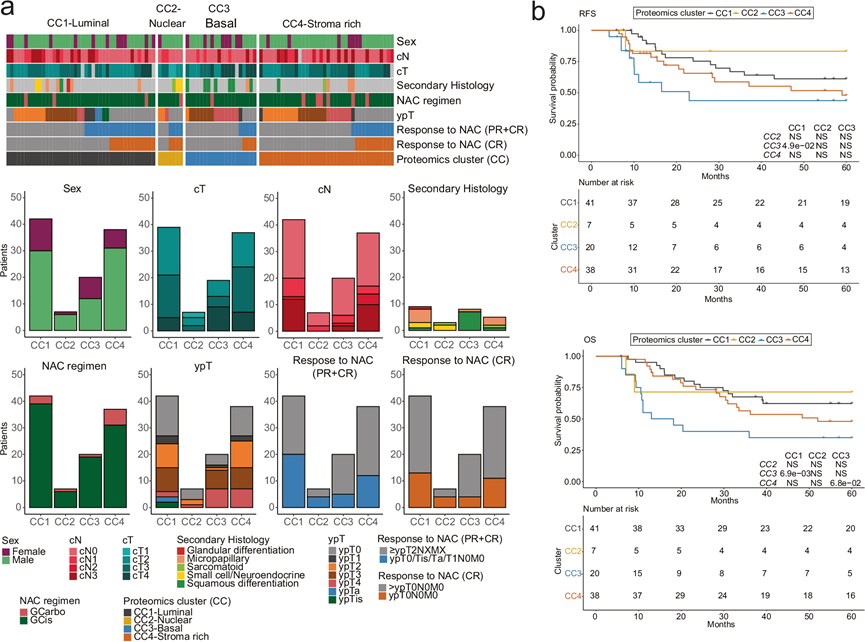
图2. 根据化疗前蛋白质组学聚类划分的肌层浸润性膀胱癌 (MIBC) 组的临床和病理特征。
(a) 堆积条形图显示每个 NAC TUR 前蛋白质组 CC 中患者的临床特征摘要。(b) Kaplan- Meier 图显示四个 NAC TUR 前蛋白质组 CC 的 RFS 和 OS。
02
新辅助化疗前后蛋白质组比较
为了研究与 NAC 耐药性相关的组织可塑性和生物学变化,他们对 55 名 NAC 前后肿瘤配对患者的残留肿瘤组织进行了分析(图 1a-b)。93% 为无反应者(≥ypT2NXM0),7% 为部分反应者(ypTis/a/1N0M0),58% 在 6 个月内出现局部或远处复发。
他们对 1170 种蛋白质(25% 变化最大的蛋白质)进行了一致性聚类,这些蛋白质在 BU 技术重复中表现出稳健的量化(BU 技术重复样本中的 CV < 10%)。他们确定了四个具有不同生物学和临床结果的 NAC 后聚类(图 3a-c),NAC 前后组织之间的蛋白质组质心分析显示聚类之间具有良好的一致性(图3d)。NAC 后 (PN)-CC1 蛋白质组(N = 3)类似于 NAC 前 CC2-Nuclear。与 CC2-Nuclear 一样,PN-CC1 肿瘤显示上调的核突起,并且该聚类捕获了两例具有残留肿瘤的 NAC 前 CC2-Nuclear 病例。三名 PN-CC1 患者中有两名随后复发。PN-CC2 肿瘤(N = 15)的特征是高免疫浸润,表明有适应性免疫反应,以及丰富的 ECM 蛋白表达。13 例 NAC 前 CC3-Basal 病例中有 11 例残留肿瘤,归类为 PN-CC2。随后在 15 例病例中 10 例出现复发。PN-CC3(N = 15)肿瘤的特征是中等免疫细胞和基质细胞浸润,富含抗体介导的免疫反应和伤口愈合途径。PN-CC3 捕获了 NAC 前 CC1-Luminal 和 CC4-Stroma 丰富肿瘤的混合体,15 名 PN-CC3 患者中有 9 名复发。最后,PN-CC4(N = 22)的特点是代谢途径活性高,主要来源于前 NAC CC1-Luminal 肿瘤,其次是前 NAC CC4-Stroma 富集肿瘤。21 例 PN-CC4 病例中有 11 例出现复发(一名患者在 RC 时缺少临床信息)。PN-CC1 的 RFS 和 OS 较差,而 PN-CC4 则显示出更长的 RFS 趋势(图 3b-c)。
对 NAC 前 CC 和 PN-CC 之间的聚类质心进行配对分析,显示出趋同的蛋白质组学谱,特别是在 NAC 前样本中鉴定的聚类定义蛋白方面。然而,在趋同的聚类质心之间也发现了一些生物途径差异。例如,与 PN-CC4 相比,CC1 表现出更高的线粒体活性和更低的免疫反应。与 PN-CC1 相比,CC2 具有更强的免疫反应和更低的线粒体活性。与 PN-CC2 相比,CC3 显示出更高的免疫途径活性,而 CC4 与 PN-CC3 相似,但转录和剪接活性也更高。 NAC 前 CC1-Luminal 和 CC4-Stroma-rich 在 NAC 后表现出最强的可塑性,CC1-Luminal 患者与 PN-CC3 或 PN-CC4 一致,而 CC4-Stroma-rich 患者与 PN-CC2、PN-CC3 或 PN-CC4 相关。NAC 前 CC2-Nuclear 和 CC3-Basal 与相应的 NAC 后 CC 最为一致(图 3d)。重要的是要认识到 TUR 和 RC 之间的蛋白质组差异可能受到 NAC、手术程序和相关伤口愈合过程的影响,并且不可能单独区分这些因素的影响。此外,在比较从 TUR 和 RC 标本中获得的肿瘤样本时,肿瘤和肿瘤免疫微环境可能存在固有差异。此外,NAC 后样本的蛋白质组组成与 BU 更接近,而不是 NAC 前样本,这可能是由于它们富含基质蛋白。因此,他们比较了 NAC 后和 NAC 前组织中富集的蛋白质与 BU 和 NAC 前组织中富集的蛋白质。该分析突出了单个蛋白质的差异,例如参与 ECM 和上皮-间质转化的 CTHRC1 和 NNMT,并且在 NAC 后仅上调(图 3e)。在通路水平上,RC 样本的 ECM 和抗体介导的免疫反应上调,而 TUR 则富集表观基因组过程和角质化(图 3f)。
对 NAC 有耐药性的肿瘤具有很高的复发率和进展率,导致 OS 较差。对 NAC 前后组织之间的蛋白质组表达进行分析可能会发现与铂类化学耐药性相关的蛋白质。NAC 后残留肿瘤中富集的蛋白质可能代表避免耐药性的治疗靶点(图 3g)。使用药物基因相互作用数据库中的相互作用评分 >40 ,他们确定了 NAC 后在其他癌症的铂类耐药性中发挥作用的蛋白质的富集,包括 SOD1 和 FN1,这两者都是 FDA 批准药物的靶点。PN-CC 显示出在有 FDA 批准的药物或正在研究的药物的聚类之间可用药蛋白质的差异表达。例如,PN-CC1 肿瘤表现出 MTOR、PARP1 和 PARP2 的均质富集,而 PN-CC4 在约 50% 的病例中表现出 NECTIN4 的富集。这些是临床批准药物的靶点,该分析确定了可用于临床治疗复发的聚类特异性疗法。
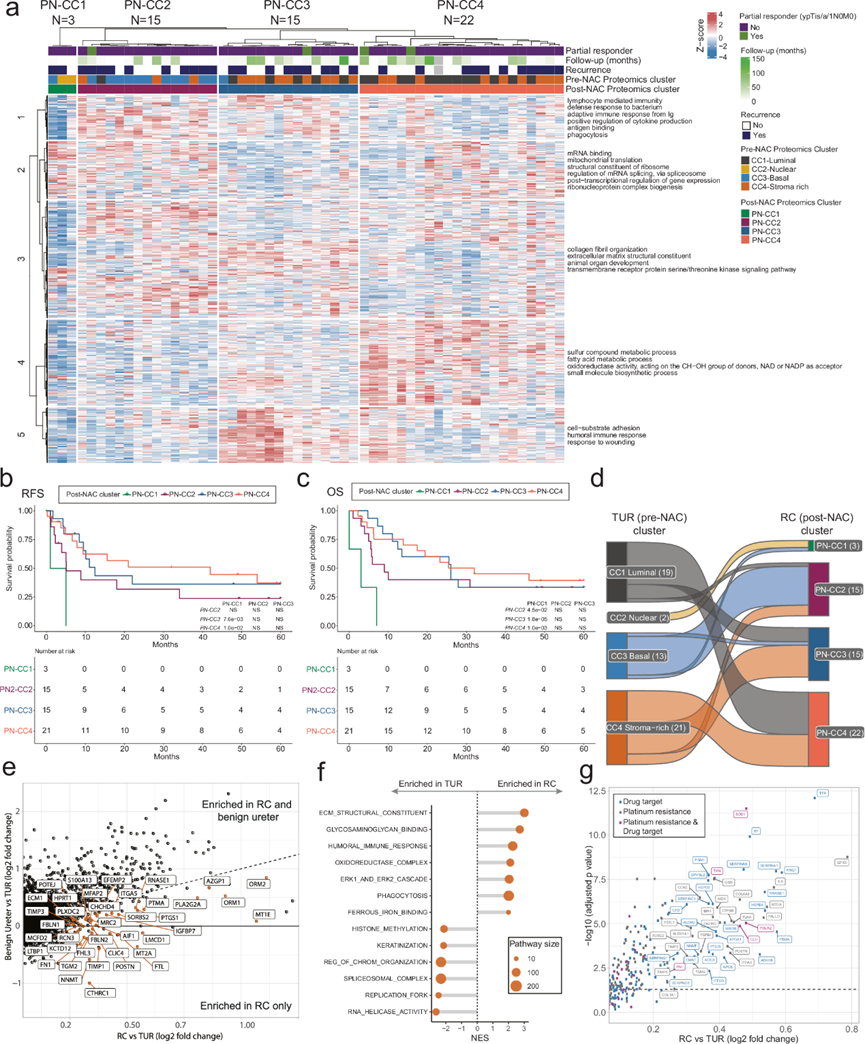
图3. 化疗后肿瘤蛋白质组的共识聚类揭示了四种不同的共识聚类蛋白质组亚型。
(a) 热图显示基于 25% 最易变蛋白质(N = 1170)对 55 个 RC(即耐药性肿瘤)后 NAC 样本进行欧几里得距离的 k 均值一致聚类。(b-c)生存分析。(d)桑基图显示来自 TUR 标本的 CC 转换及NAC 后 RC 共识聚类。(e) 散点图显示x轴上成对的 NAC 后 RC 和 NAC 前 TUR 的差异表达分析。(f)通路分析。(g) 散点图显示RC 样本与匹配的 TUR中富集的蛋白质。
03
整合 NAC 前 MIBC 的转录组学和蛋白质组学概况
根据 25% 最易变的蛋白质及其相应的转录组值,蛋白质组 CC 与之前描述的 RNA 亚型有很大重叠(图4a)。整合研究中使用的两个转录组平台显示,在整个 MIBC 队列中,蛋白质和 RNA 表达之间存在适度的正相关性(R = 0.34)。值得注意的是,与 RNA-seq 相比,微阵列数据中的转录组和蛋白质的相关性更高(图 4b)。根据转录组共识分类器,CC1-Luminal 捕获了 Luminal 乳头状(LumP)、Luminal 非特异性(LumNS)和 Luminal 不稳定(LumU)类肿瘤,蛋白质和 RNA 的表达高度一致(图 4a)。CC2-Nuclear 涵盖了所有根据 RNA 表达归类为 NE 样的肿瘤,此外还有两种归类为基底/鳞状 (Ba/Sq) 的肿瘤和一种归类为 LumU 的肿瘤。CC3-Basal 与 RNA 分类器最一致,且具有最高水平的 RNA 聚类分离。除一种 CC3-Basal 肿瘤外,所有肿瘤均归类为 Ba/Sq。CC4-Stroma-rich 显示所有 RNA 亚型的混合,表明肿瘤高度异质性,具有大量基质成分,这可能部分归因于 RNA 信号中基质成分的丢失和蛋白质水平上细胞外胶原蛋白的半衰期延长(图 4a)。
进一步探究 NAC 应答者和无应答者之间 RNA 和蛋白质组表达的差异,发现数据类型之间存在正相关性(图 4c)。虽然在蛋白质水平上未观察到应答者和无应答者之间的显著差异,但几种转录本显著上调或下调,表明 RNA 和相应蛋白质的表达存在差异。
为了描绘 NAC 前 CC 中的免疫成分,他们对蛋白质组学和转录组学数据集 进行了 ESTIMATE和 CIBERSORTx分析。与 CC1-Luminal 和 CC2-Nuclear 相比,CC3-Basal 和 CC4-Stroma-rich 具有最高的免疫和基质得分。CC3-Basal 和 CC4-Stroma-rich 中单核细胞和 B 细胞最富集,表明这些是免疫“热”肿瘤。相反,CC1-Luminal 和 CC2-Nuclear 表现出免疫“冷”特征,但 T 细胞群除外,T 细胞群似乎在所有 CC 中同样富集。这些结果与 公开数据一致,其中 U.III(基底)肿瘤定义为免疫“热”肿瘤,UI(管腔)肿瘤归类为“冷”肿瘤。
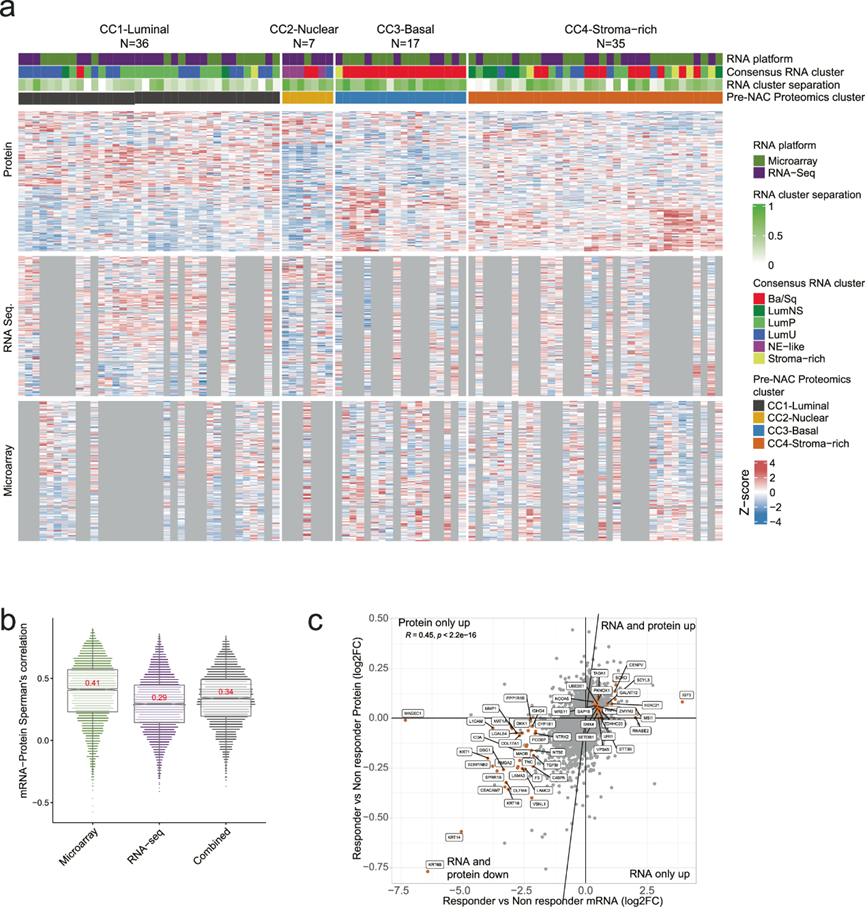
图4. 化疗前肌层浸润性膀胱癌(MIBC)的综合蛋白质组学和转录组学分析。
(a) 热图显示了 NAC TUR 标本的蛋白质组聚类。(b) 箱线图显示根据基因表达微阵列、RNA-seq 或组合 RNA 平台的 mRNA 与蛋白质 Spearman 相关性。(c) 散点图显示NAC TUR 组织样本中蛋白质和 mRNA 表达。
04
肿瘤内蛋白质组异质性分析及其与临床结果的关系
他们对 107 名 MIBC 患者中的 36 名进行了形态相似的 NAC 前组织切片的多区域取样。使用在所有 NAC 前 TUR 重复样本中识别的所有 5828 种蛋白质进行无监督聚类,结果显示肿瘤间异质性高,但整个队列的 ITH 低(图 5a)。然而,36 个样本对中有 4 个单独聚类,表明一些样本尽管具有相似的组织学特征,但 ITH 较高(图 5a)。
为了定量配对样本之间的 ITH 水平,他们通过欧几里得距离为每对样本分配了一个 ITH 分数。虽然临床特征相似,但肿瘤 ITH 高于中位数的患者与 ITH 低于 中位数的患者相比,NAC 反应率和生存结果较差(图 5b-e)。对单个 NAC 前 TUR 样本(N = 72)到 CC 质心的距离的分析证实,单个样本的 NAC 前聚类在成对之间是稳健的,只有四个标本在同一采样肿瘤内具有 CC 转换(两个从 CC1-Luminal 转换为 CC4-Stroma-rich,两个从 CC4-Stroma-rich 转换为 CC1-Luminal)(图 5f)。其中三属于高 ITH 组(图 5b)。对 NAC 治疗前后多区域样本(N = 8)进行主成分分析(PCA),结果显示 TUR 和 RC 样本之间存在高度异质性(图 5g)。
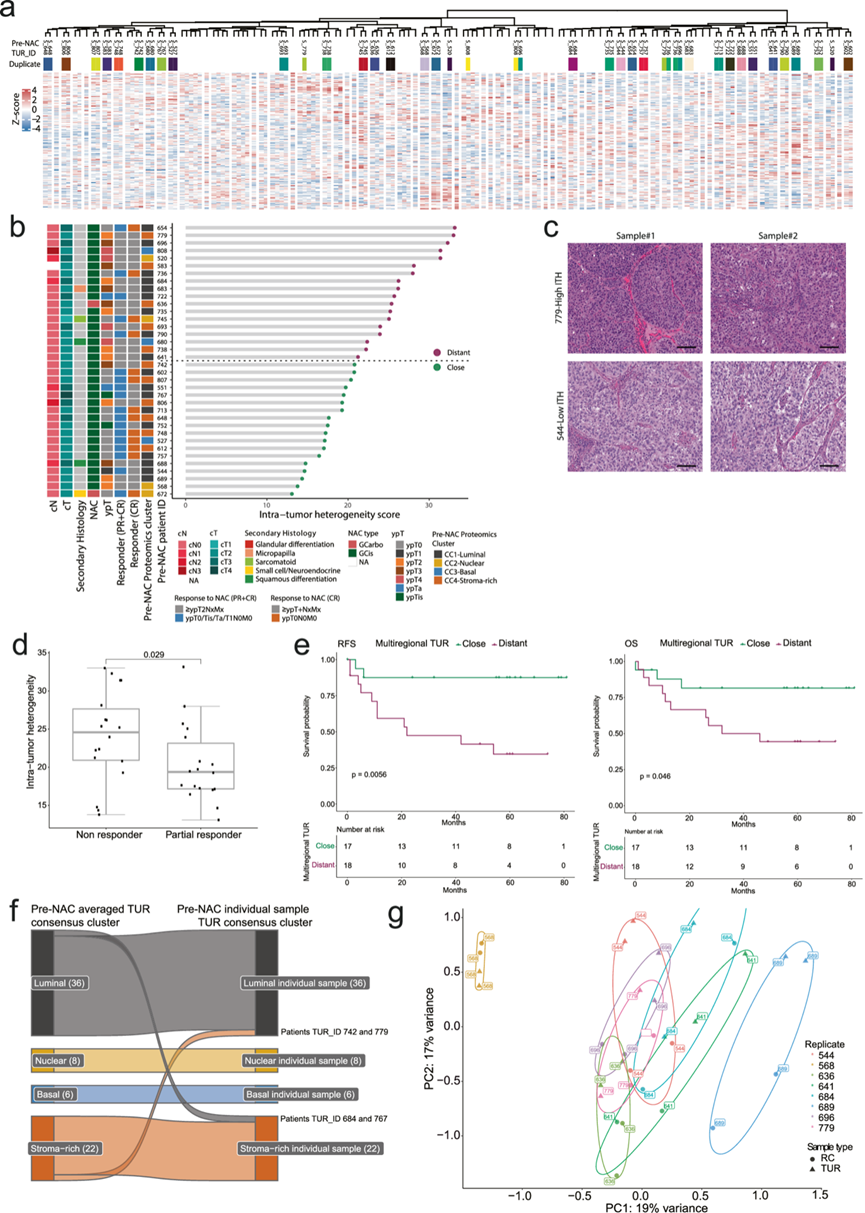
图5. 铂类新辅助化疗背景下蛋白质组肿瘤内异质性的临床影响。
(a) 热图显示了使用基于欧几里得距离的 Ward 层次凝聚聚类方法在所有 NAC TUR 前样本中识别的所有 5828 种蛋白质进行层次聚类。(b) 点图显示了所有具有重复 NAC TUR 前样本的患者的肿瘤内异质性 (ITH) 评分。(c) 两组重复 NAC TUR 前样本的代表性 H&E 图像。(d) 箱线图显示患者之间的 ITH 评分。(e)生存分析。(f) 桑基图显示每对 NAC TUR 样本的平均蛋白质表达的共识聚类。(g) PCA图突出显示形态相似匹配的重复 NAC TUR 样本及其相应的重复 NAC 后 RC 对应物。
+ + + + + + + + + + +
结 论
本研究对肌层浸润性膀胱癌新辅助化疗前后的整体蛋白质组进行了分析,确定了四个具有不同生物学和治疗反应的新辅助化疗前蛋白质组聚类,并将它们与转录组亚型和免疫组织化学相结合,观察到新辅助化疗后的蛋白质组可塑性,与新辅助化疗前相比,聚类与细胞外基质增加和角化减少有关。新辅助化疗后聚类似乎在可用药蛋白质方面存在差异富集。例如,在确定为神经元样的肿瘤中,MTOR 和 PARP 在蛋白质水平上过度表达。此外,本研究确定了新辅助化疗前组织中肿瘤内蛋白质组异质性高与预后较差有关。这些研究工作突出了与临床结果相关的肌肉浸润性膀胱癌生物学方面,并根据蛋白质组数据提出了生物标志物和治疗靶点。
+ + + + +



 English
English


