文献解读|Nat Commun(16.6):渐进式衰老程序会增加女性罹患衰老相关乳腺癌的内在易感性
✦ +
+
论文ID
原名:Progressive senescence programs induce intrinsic vulnerability to aging-related female breast cancer
译名:渐进式衰老程序会增加女性罹患衰老相关乳腺癌的内在易感性
期刊:Nature Communications
影响因子:16.6
发表时间:2024.06.17
DOI号:10.1038/s41467-024-49106-2
背 景
衰老是绝大多数癌症类型的最大危险因素。随着全球寿命的显著延长,癌症发病率和癌症死亡率的负担迅速增加,成为全球人类健康面临的主要挑战。尽管在分子、细胞和生物体水平上的衰老研究取得了广泛的进展,但癌症发病率与年龄之间的指数关联已经持续多年,这种病因表型的潜在生物学原理仍不清楚。因此,了解生理性衰老程序如何影响致癌作用尤为重要,也是预防癌症流行的重要研究方向。
实验设计
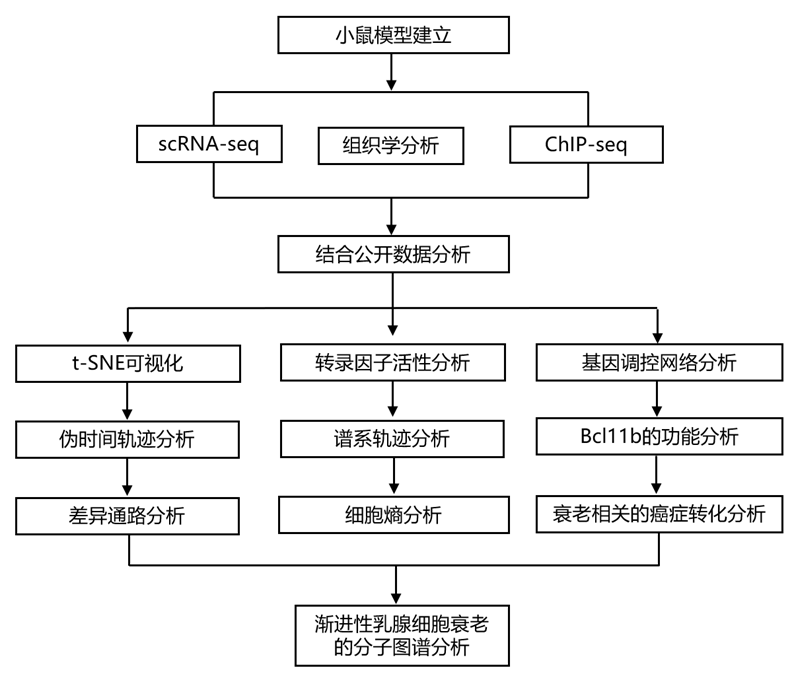
结 果
01
按时间顺序排列的单细胞转录组分析
由于最初的致癌突变发生在长寿的干细胞/祖细胞中,研究团队对乳腺干细胞富集人群中衰老的分子进展特别感兴趣。因此,他们对乳腺干细胞富集群体(CD49fhighEpCAMlow)进行了分类,其中包括迄今为止鉴定的所有乳腺干细胞,这些细胞来自2个月至29个月的不同生物年龄的小鼠,并进行单细胞转录组分析(scRNA-seq)(图1a)。他们从 25 只小鼠(每个年龄段 1-4 只小鼠)中收集了 1981 个细胞的转录组信息,并检测到 20629 个基因。随后的 t 分布随机邻域嵌入 (t-SNE) 分析显示,从不同年龄段的小鼠中获得的绝大多数乳腺细胞完全混合在一起(图 1b)。这些细胞具有相似的转录组,并在不同年龄组中均匀表达角蛋白14和角蛋白5(图 1c),表明它们具有相同的命运。
为了构建分子钟并从而测量转录组随年龄发生的动态变化,他们使用 Monocle 2 进行了轨迹分析。值得注意的是,不同小鼠年龄的乳腺细胞明显遵循时间顺序,从较年轻小鼠中分离出的细胞与早期伪时间阶段一致,而从较年长小鼠中分离出的细胞与后期伪时间阶段一致(图 1d)。这一发现表明与年龄相关的转录组程序定义了内在细胞状态。事实上,当根据伪时间对差异表达基因进行聚类时,乳腺细胞中的特征基因分为四种不同的状态,具有不同的基因表达模式(图 1e-f)。有趣的是,每只小鼠的乳腺细胞都包含所有四种状态的细胞,它们的相对丰度是唯一的差异(图 1g-h)。然后,他们定量了整个衰老过程中每种细胞状态下细胞的相对丰度,发现状态 1 的细胞数量随着年龄的增长而不断减少,而状态 4 的细胞数量呈现增加趋势。状态 2 的细胞数量保持相对恒定,而状态 3 的细胞数量暂时增加然后减少(图 1i)。即使在同龄小鼠中,他们也观察到四种细胞状态的相对丰度变化,这表明小鼠的衰老并不同步。但当按年龄组进行分析时,趋势很明显。这些数据表明乳腺 CD49 hi EpCAM low细胞是异质性的,具有不同的细胞状态,衰老表型可能通过各种细胞状态的相对丰度表现出来。
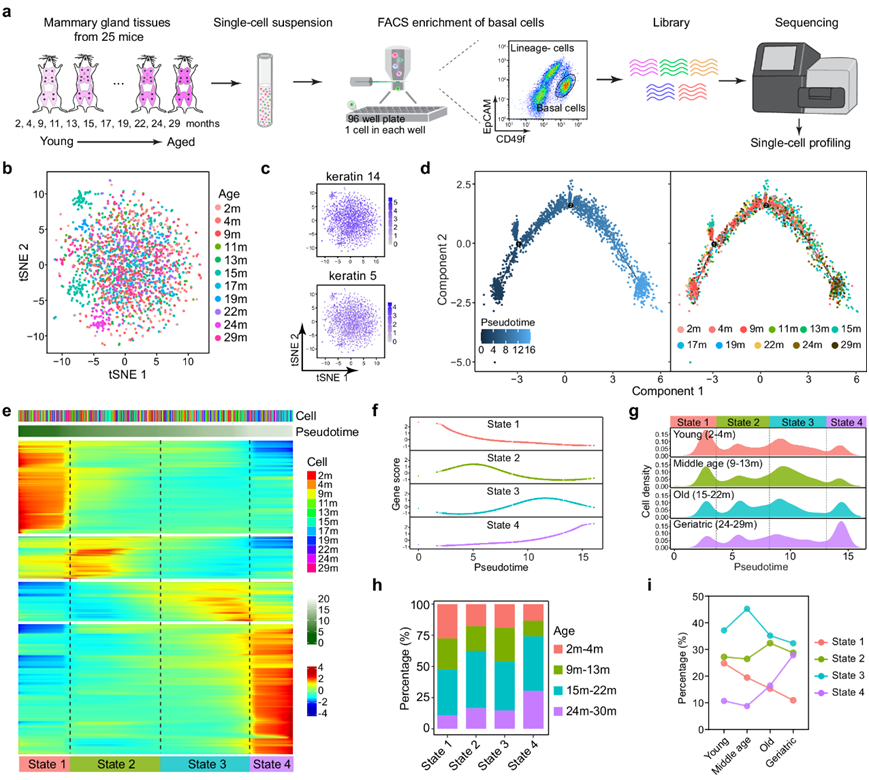
图1. 小鼠不同年龄的乳腺干细胞富集群体的 scRNA-seq 分析。
(a) 示意图显示了小鼠乳腺细胞 scRNA-seq 的流程。(b) t - SNE 图显示了来自不同时期小鼠的乳腺细胞的聚类情况。(c) t -SNE 上的基底细胞特异性基因(角蛋白 5和角蛋白 14)显示出均匀的表达模式。(d) 使用 Monocle 2 对单细胞转录组进行伪时间排序分析,推断乳腺衰老轨迹。 (e) 热图可视化伪时间内的动态基因表达。(f) 沿伪时间的每个细胞状态的特征基因聚类的表达模式。(g) 细胞密度图显示年轻(2 个月至 4 个月,n = 5)、中年(9 个月至 13 个月,n = 6)、老年(15 个月至 22 个月,n = 10)和老年(24 个月至 29 个月,n = 4)小鼠乳腺细胞的分布以及伪时间分析。(h) 每种细胞状态下每种小鼠年龄的相对细胞比例。 (i) 每个年龄组中四种乳腺细胞状态的相对细胞丰度。
02
不同的衰老乳腺细胞状态会诱发渐进性衰老动态
为了进一步表征每个细胞状态的生物学特性,他们进行了通路分析,绘制了每个信号通路在伪时间上的活性以可视化时间动态,并确定了六种不同的动态模式(图 2a)。模式 1 通路在状态 1 中表现出最高活性,在整个时间过程中逐渐下降到最后状态。这些通路包括“DNA 复制”、“错配修复”、“氧化磷酸化”、“β-丙氨酸代谢”和“缬氨酸、亮氨酸和异亮氨酸降解”。随着伪时间的进展,“DNA 复制”和“错配修复”活性降低,这与 DNA 突变在衰老过程中积累的特征相一致。此外,这一发现表明状态 1 细胞是较年轻的细胞,具有更高的 DNA 修复能力和代谢活性。与模式 1 一致,模式 2 通路在状态 1-2 转换期间活性短暂增加,然后迅速下降。模式 2 仅表现出一条激活的通路“线粒体核糖体”。低通路富集水平可能表明转录活性低且处于相对静止状态。事实上,当绘制与代谢相关的通路时,发现状态 2 的细胞表现出相对较低的代谢脂质、氨基酸和碳活性,但表现出比状态 1 的细胞更高的 TGFbeta 信号通路活性(图 2b)。此外,细胞周期分析表明与其他细胞相比,状态 2 的细胞包含相对较高比例的 G0 期细胞(图 2c-d)。鉴于状态 2 细胞的低代谢率,他们将这些细胞标记为静止年轻 (q-Young) 细胞,将状态 1 细胞标记为活跃年轻 (a-Young) 细胞。
模式 3-5 的活性也有类似的增加,但略有不同。模式 3 通路的活性(包括“NF-κB 信号通路”、“p53 信号通路”、“HIF1 信号通路”和“铁死亡”)在状态 3 达到峰值,然后在状态 4 中迅速下降(图 2a)。值得注意的是,NF-κB 和 p53 通路的激活与衰老表型相关。模式 4 通路在状态 3 激活,然后达到稳定水平,并持续到状态 4。这种模式包括“细胞衰老”、“细胞因子-细胞因子受体相互作用”和“Toll 样受体信号通路”(图 2a)。这一结果表明状态 3 和状态 4 细胞都有激活的衰老程序。根据这一假设,SASP 程序基因(衰老细胞的标志)的表达在状态 3 和状态 4 细胞中均升高(图 2e-f)。模式 5 包括在状态 3 和状态 4 中持续增加活性的通路。这些通路包括“IL-17 信号传导”、“JAK-STAT 信号传导”、“mTOR 信号传导”、“PI3K-Akt 信号传导”、“MAPK 信号传导”、“Ras 信号传导”、“TGFβ 信号传导”、“乳腺癌”以及最值得注意的是“调节干细胞多能性的信号通路”(图 2a)。这些基因通路的激活表明,尽管状态 4 细胞表达衰老程序,但它们已获得干细胞特性和细胞生长/存活程序,这可能使它们易于出现癌前表型。因此将状态 3 的细胞命名为早期衰老 (e-Sen) 细胞,而状态 4 的细胞称为晚期衰老 (l-Sen) 细胞。模式 6 包含在状态 3 和状态 4 之间稍后激活的通路,表明它们可能在功能上参与驱动从 e-Sen 表型到 l-Sen 表型的转变(图 2g)。这些通路包括“Hedgehog 信号”、“Notch 信号”和“Wnt 信号”(图 2a)。所有六种通路模式动态在不同年龄组中保持不变,这表明动态是细胞状态所固有的,与其生物年龄无关。一些信号通路通过免疫组织化学 (IHC) 染色得到证实(图2h-k)。这些有趣的独特衰老程序表明,衰老细胞是异质性的,生理衰老以复杂的方式进行,四种不同细胞状态之间的稳态发生改变,而不是通过年轻-老年二元转换。
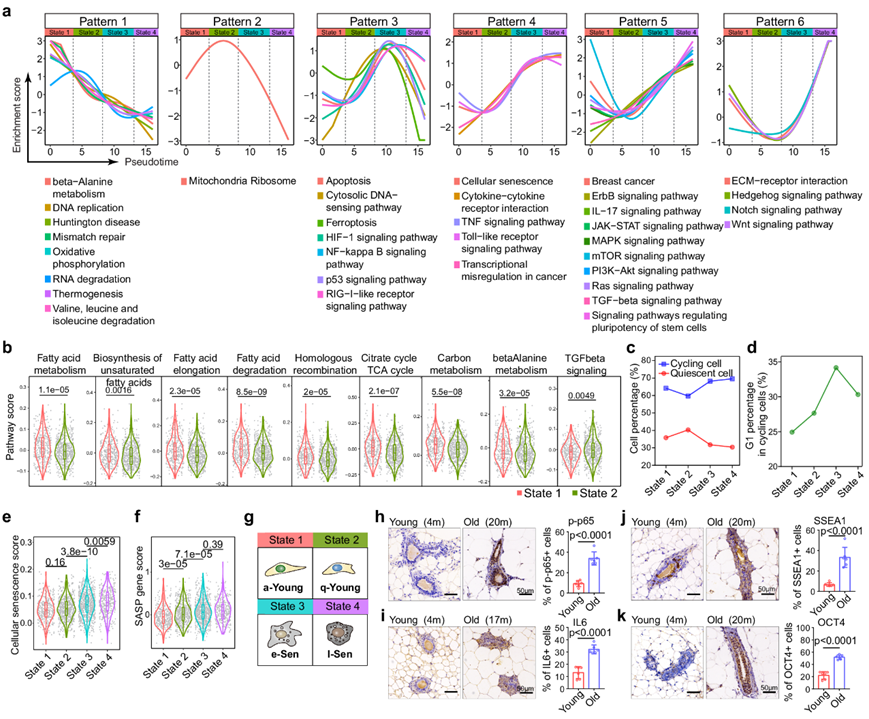
图2. 沿着衰老轨迹表征不同的乳腺细胞状态。
(a) 每个信号通路的活性以伪时间内的富集分数呈现。(b) 状态1和状态 2细胞之间的差异通路活性。(c) 细胞周期分析显示每个细胞状态下循环细胞(蓝色)和静止细胞(红色)的相对分数。(d) 每个细胞状态下 G1 期细胞的相对比例。(e-f) 衰老相关通路分析显示每个细胞状态下的细胞衰老水平和 SASP 表达水平。(g) 四种细胞状态的示意图,即活跃年轻状态 (a-Young)、静止年轻状态 (q-Young)、早期衰老 (e-Sen) 和晚期衰老 (l-Sen)。 (h-k) 免疫组织化学染色代表性图像。
03
乳腺癌的发生与 l-Sen 状态有关
l-Sen 细胞表现出异常激活的癌症和干细胞相关程序,并降低了 P53 活性并增强了 PI3K-Akt 活性。考虑到 P53 和 PIK3CA 是乳腺癌中最突出的两个突变基因,他们推测 l-Sen 细胞增加了其对癌症转化的易感性。于是,他们分析了 TCGA 数据库中配对的人类乳腺样本(肿瘤和肿瘤邻近正常组织)的通路活性和转录因子活性(图 3a)。有趣的是,与邻近正常组织相比,乳腺肿瘤中各种衰老相关通路和 l-Sen 程序相关通路显著升高,包括 Notch 信号、Wnt 信号(TCF7L1、LEF1)、Hedgehog 信号(GLI1、GLI2)和多能性相关因子(MYC、SOX2 和 KLF4),而 e-Sen 特异性 NFkB 通路发生下调(图 3b)。这表明乳腺肿瘤组织与 l-Sen 特征密切相关。
为了探究l-Sen程序是否在乳腺肿瘤起始阶段启动,他们利用二甲基苯并蒽 (DMBA) 介导的乳腺癌发展模型,该模型主要诱导乳腺肿瘤,并分析了非常早期的肿瘤起始病灶(图 3c)。与人类乳腺肿瘤一致,衰老相关信号和多能性相关信号都在肿瘤形成开始时上调(图 3d-h)。同时,他们发现DMBA除了引起基因突变的功能外,还能引发乳腺细胞衰老,表现为显著的l-Sen细胞扩增和衰老相关通路激活,表明肿瘤起始过程伴随着l-Sen程序的激活(图 3i-n)。与此想法一致的是,他们发现乳腺细胞集落形成能力从年轻小鼠到老年小鼠显著下降,但在老年小鼠中恢复,其中l-Sen种群显著扩增(图3o-p)。
为了进一步表征生理衰老过程的动力学,他们采用了单细胞信号熵算法来分析细胞熵的动态(图3q-r)。a-Young、q-Young 和 e-Sen 细胞的细胞熵保持在相对较低的水平,从 a-Young 到 q-Young 细胞略有下降,从 q-Young 到 e-Sen 细胞则有所增加。值得注意的是,与 e-Sen 细胞相比,l-Sen 细胞的熵显著升高,表明存在严重的全身紊乱和潜在的染色质重组。
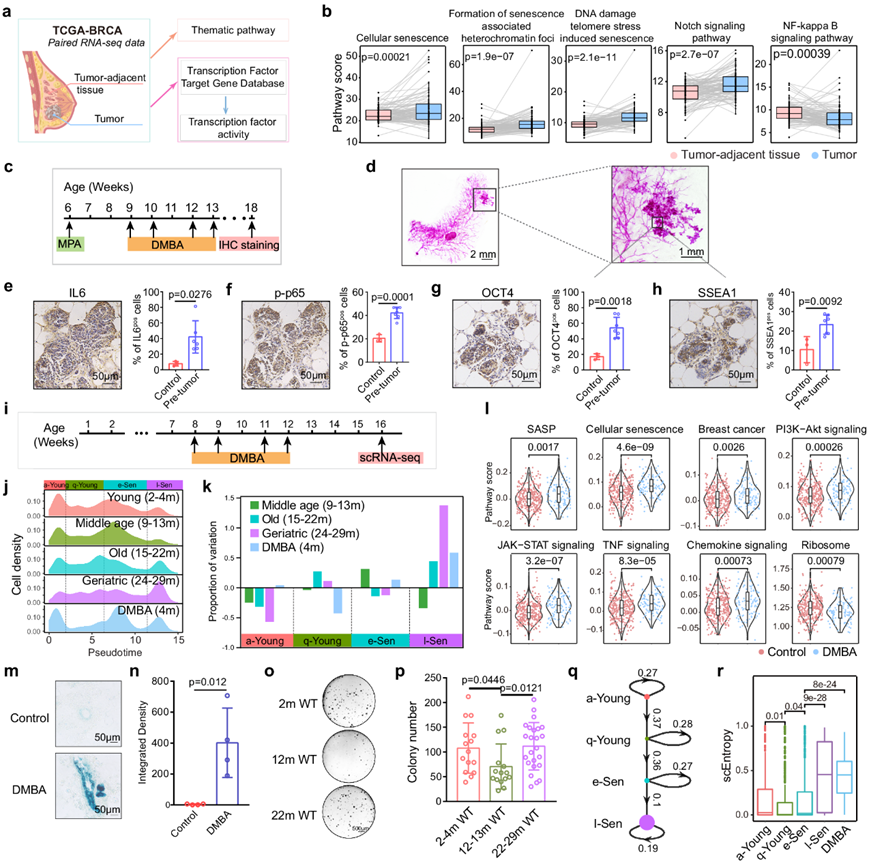
图3. 衰老细胞容易引发癌症。
(a-b) 图表显示了 TCGA 数据库中人类乳腺肿瘤和肿瘤邻近组织的主题通路评分和转录因子活性评分的分析工作流程。 (c) 示意图显示了 6 周大 WT 小鼠的 DMBA 诱发癌症检测。(d) 代表性的 DMBA 诱发乳腺肿瘤整体染色图像。(e-h) IHC 染色图像。(i) 图表显示 8 周龄小鼠用 DMBA(200 μL,5 mg/mL)处理并进行 scRNA-seq。(j) 各年龄组和 DMBA 处理组的乳腺细胞状态密度图。(k) 与年轻(2-4 个月)组相比,不同年龄组细胞状态相对丰度的变化。(l) DMBA 处理的乳腺 CD49fhigh EpCAMlow细胞中的衰老相关通路评分。(m-n) 代表性 β-gal 染色图像和定量。(o-p)克隆形成 能力的代表性图像和定量。(q) 线性谱系轨迹显示了四种细胞状态的转换概率,节点大小与信号熵相对应。(r) 不同细胞状态的熵分析。
04
q-Young 到 e-Sen 细胞的转变由乳腺干细胞因子Bcl11b介导
为了确定驱动从 q-Young 状态到 e-Sen 状态转变的因素,他们使用染色质免疫沉淀测序 (ChIP-seq)以及 ENCODE 和 ChEA 数据库以及文本整理的转录调控网络数据库 TRRUST 构建了一个有限的基因调控网络,并将网络叠加到四种衰老细胞状态的表达矩阵上,以推断每种细胞状态下的关键转录因子(图 4a-b)。通过转录推断算法,他们总共确定了 38 个状态特异性命运决定因素(图 4b),其中大多数存在于 l-Sen 状态细胞中。有趣的是,年轻状态细胞中的因子,例如Hcfc1和Srf,以前与长寿有关。
在确定启动 e-Sen 细胞状态的关键因素时,他们将注意力集中在 e-Sen 转录因子(TF)上。活性图显示,在 q-Young 到 e-Sen 的转变过程中,Tcf7l2、Rnf2、Fosl1、Gata3和Hsf1的活性都在增加,但Bcl11b的活性却急剧降低(图 4c)。Bcl11b是之前发现的乳腺干细胞自我更新和静止的调节因子,其丧失会导致干细胞衰竭。由于Bcl11b是一种主要的转录抑制因子,Bcl11b活性降低反映了Bcl11b抑制的靶标的激活。这一发现表明,早期衰老的启动可能是由Bcl11b功能的丧失介导的。
为了确定Bcl11b功能的机制,他们在乳腺中敲除Bcl11b表达,Bcl11b敲除(KO)乳腺组织表现出导管宽度减小,β-半乳糖苷酶活性增强(图4d),p16Ink4a升高(图4e),这些都是典型的衰老细胞标志物。多个衰老器官中,干细胞群体经常表现出扩增而功能下降。具体到乳腺衰老,据报道在衰老时会获得基础百分比增加的表型,这与对小鼠衰老过程中乳腺的观察结果一致(图 4f)。与同一只小鼠的对照细胞相比,Bcl11b -KO 细胞在年轻时表现出基础百分比显著增加(图 4g)。
衰老通常根据某些生物标志物或功能检测来定义;然而,当衰老细胞是异质性的时候,这些方法的价值就有限了。因为他们建立了乳腺细胞衰老的分子钟,所以尝试使用时间图来判断Bcl11b-KO 细胞的衰老程度。当他们将Bcl11b -KO 细胞纳入衰老伪时间分析并重建轨迹时,发现绝大多数Bcl11b -KO 细胞在后期自发聚集并与 l-Sen 细胞聚集在一起,q-Young 峰明显减弱(图 4h)。对每个衰老阶段进行定量后发现,与年龄匹配的野生型 (WT) 细胞相比,a-Young 和 q-Young 细胞的数量急剧减少,而 e-Sen 和 l-Sen 细胞的数量则大幅增加(图 4h-i)。这一发现表明,Bcl11b -KO 经历了显著加速的衰老进程,细胞迅速进入与衰老细胞非常相似的状态。
为了确定敲除Bcl11b会改变哪些与衰老相关的分子通路,他们进行了通路分析(图 4j)。KEGG分析表明,典型的与衰老相关的通路的活性水平,包括“MAPK 信号传导”、“PI3K-Akt 信号传导”、“IL17 信号传导”、“细胞衰老”、“NF-kB 信号传导”和“p53 信号传导”,在Bcl11b -KO 细胞中均显著上调,表明系统性衰老状态。此外,与衰老相关的 SASP 程序在Bcl11b -KO 细胞中也升高,并伴有细胞熵增加(图 4k-l)。总体而言,这些数据表明Bcl11b可能是调节 q-Young 到 e-Sen 转变的分子开关,最终促进 l-Sen 衰老。
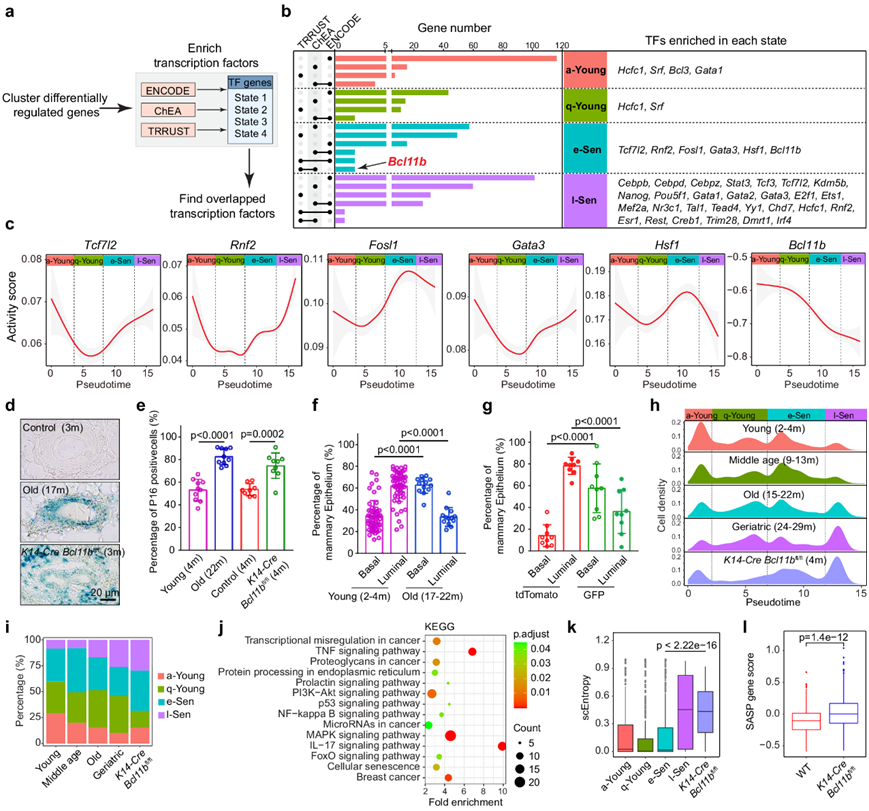
图4. q-Young 到 e-Sen 的转变由转录因子Bcl11b 介导。
(a) 图表显示了使用 ENCODE、ChEA 和 TRRUST 数据库对每个细胞状态进行转录因子富集分析的工作流程。 (b) 显示了基于每个细胞状态中的差异表达基因的富集转录因子。(c) 以伪时间内的目标基因指数呈现的 e-Sen 状态下富集的转录因子的活性得分。(d) 代表性β-gal 染色图像。(e) p16Ink4a 阳性细胞百分比。(f-g) 乳腺上皮的基底/腔比例。(h-i) 乳腺细胞状态的密度图和百分比。(j)通路分析。(k) scEntropy 得分分析。(l) SASP 基因得分比较。
05
Bcl11b KO 诱导的衰老乳腺细胞易发生癌症转化
接下来,他们尝试解决在基于 DMBA 处理的癌症引发模型中乳腺加速老化是否与癌症内在相关。在该肿瘤模型中,发现 DMBA 诱导的肿瘤细胞主要来源于 Krt14+ 基底细胞,并且乳腺细胞表现出明显的与年龄相关的对化学诱导的癌症转化的敏感性(图5a-c)。因此,他们决定通过 DMBA 诱导的 WT 和Bcl11b -KO 细胞乳腺肿瘤形成试验解决Bcl11b缺失引起的衰老乳腺细胞是否容易发生癌症转化。通过将对照和Bcl11b -KO 细胞以饱和剂量移植到受体小鼠体内,然后在乳腺树完全形成后进行 DMBA 治疗(图 5d),以防止微环境因素影响结果。有趣的是,接受Bcl11b -KO 细胞的小鼠比对照受体小鼠更早、更快地患上肿瘤,最终表现出随着年龄增长而更高的癌症发病率(图 5e-f)。
有趣的是,基因集富集分析 (GSEA) 显示 WT 肿瘤细胞显著富集 a-Young 特征基因,而Bcl11b -KO 肿瘤细胞富集 l-Sen 基因(图 5g)。此外,Bcl11b -KO 肿瘤细胞本身表现出高水平的衰老相关细胞因子 IL6 和高 NF-kB 活性(图 5h-i)。Bcl11b -KO还增加了免疫检查点通路(PD-L1 和 PD-1),与其在促进肿瘤形成中的作用一致。这些数据证明了敲除Bcl11b表达诱导的 l-Sen 细胞本质上易于转化为癌细胞。
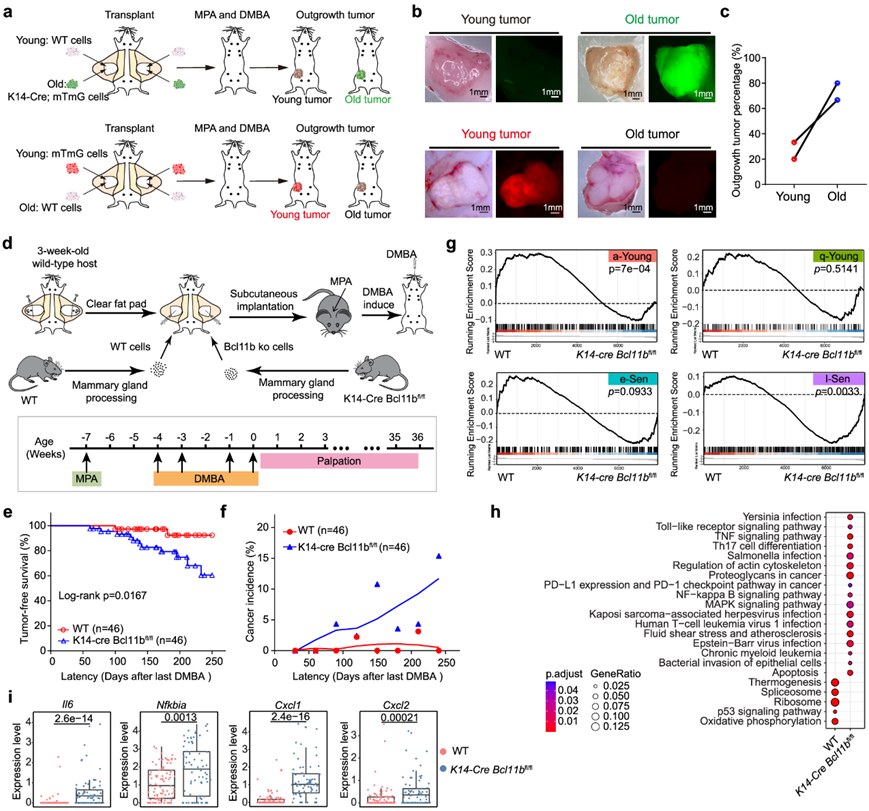
图5. 敲除Bcl11b表达诱导的 l-Sen 细胞本质上易于转化为癌细胞。
(a) 示意图显示了对年轻和老年移植乳腺细胞进行 DMBA 诱发癌症的实验。(b) 年轻和老年乳腺细胞肿瘤的代表性图像。 (c) 年轻和老年乳腺细胞的肿瘤生长百分比。(d) 示意图显示野生型和K14 - Cre Bcl11b fl/fl移植乳腺细胞的 DMBA 诱发癌症试验。(e) 无肿瘤生存曲线。(f) 癌症发病率。 (g) 基因集富集分析 (GSEA)。(h) KEGG 通路分析。
06
Bcl11b调控多种衰老和长寿相关通路
他们在基因组中检测到了 1197 个 Bcl11b 结合位点,其中 918 个启动子结合位点和 279 个增强子结合位点(图 6a-b)。KEGG 和 GO 通路富集分析显示,许多与衰老相关的通路是 Bcl11b 的直接靶点,包括能量/营养感应通路“PI3K-Akt 信号传导”、“mTOR 信号传导”、“AMPK 信号传导”,这些通路与长寿调节有关;炎症通路“TNF 信号传导”;命运决定通路‘Notch 信号’和‘Wnt 信号’以及癌症相关通路(图 6c-d)。他们还确定了与多能性和 NF-kB 通路相关的靶点,这些靶点受 Bcl11b 活性调控。这些通路还与 q-Young 到 e-Sen 和 e-Sen 到 l-Sen 细胞转变有关。这些发现表明,Bcl11b通过全面抑制与衰老相关的通路,成为衰老进程的主要调节因子。
作为一种应激感应通路,“NF-kB 信号”是公认的促进衰老过程的重要因素。NF-kB 荧光素酶活性测定表明,诱导Bcl11b表达可有效抑制由 TNFα、脂多糖 (LPS) 或佛波醇肉豆蔻酸酯 (PMA) 引发的 NF-kB 活性(图6e-h)。Bcl11b通过信号通路上游调节 NF-kB 表达,如 RelA 的核转运、IkBa 的降解和 IKKa/b的激活均由Bcl11b表达阻断(图 6i-k)。当分析 ChIP-seq 数据时,发现 Bcl11b 直接与Irak2(一种必需的 NF-kB 信号传导介质)、Nfkbia和Nfkb2的启动子区域结合,表明存在直接转录调控。诱导Bcl11b的表达时, Irak2的 mRNA 表达显著受到抑制(图 6l)。这些数据共同表明,Bcl11b直接调节乳腺细胞应激反应程序,这是减缓衰老进程的机制之一。
他们在WT细胞和Bcl11b -KO细胞中检测了NF-kB激活后的干细胞活性,发现IKKb的强制表达会触发NF-kB激活,但并没有显著降低WT细胞的乳腺重建能力(图 6m)。然而,当在Bcl11b -KO 背景的细胞中进行 NF-kB 激活时,乳腺重建能力显著降低(图 6n)。不同背景的细胞中 NF-kB 激活效应的差异意味着仅靠 NF-kB 活性不足以驱动干细胞耗竭,而再生能力下降是组织衰老的常见标志,它是由特定的表观遗传修饰程序启动的,该程序涉及依赖于 Bcl11b 表达的多种信号通路。他们观察到表达 IKKb 的 WT 和Bcl11b -KO 细胞的差异克隆形成率(图 6o),表明Bcl11b可能在 NF-kB 激活后保护乳腺细胞免于衰老。
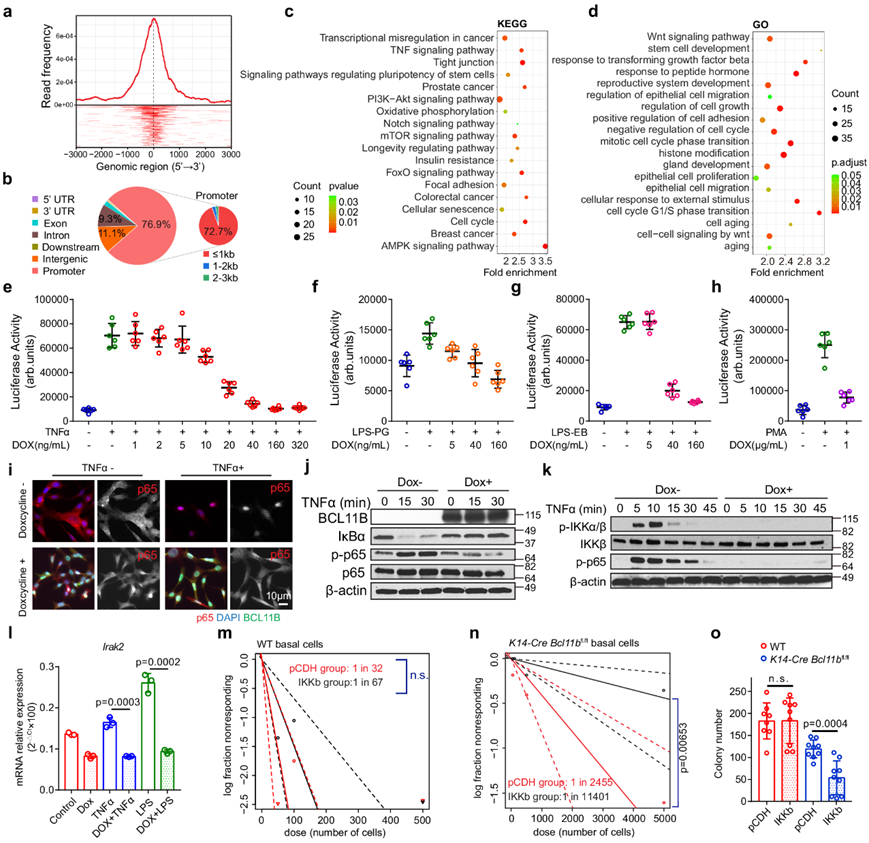
图6. 多种与衰老相关的通路由Bcl11b调控。
(a) 转录起始位点 (TSS) 处的整体 Bcl11b ChIP-seq 峰分布。(b) 饼图显示不同基因组区域中的 Bcl11b ChIP-seq 峰分布。(c-d) KEGG和 GO通路分析。(e-h) NF-kB 荧光素酶报告基因检测显示Bcl11b表达调节 NF-kB 活性。(i) 免疫荧光分析。(j-k)免疫印迹分析。(l) Irak2 mRNA 表达受诱导的Bcl11b表达调控。(m) 极限稀释分析 (ELDA) 图显示用 pCDH 或 pCDH-IKKb 载体转导的 WT CD49fhighEpCAMlow细胞的移植。 (n) ELDA 图显示用 pCDH 或 pCDH-IKKb 载体转导的K14 - Cre Bcl11b fl/fl CD49f high EpCAM low细胞的移植。 (o)克隆形成分析。
07
操纵 l-Sen 细胞可调节衰老相关的癌症转化
由于Bcl11b活性会随着年龄的增长而下降,他们筛选了一个小型定制药物池,以确定一种能够减少衰老细胞数量并增加年轻细胞数量的化学药物。他们检测了 PI3K-Akt-mTOR 抑制剂、NF-kB 通路抑制剂、Jak-Stat 抑制剂、wnt 抑制剂、notch 抑制剂和 hedgehog 抑制剂,以评估它们在增强Bcl11b表达方面的作用,Bcl11b 表达是年轻细胞状态的指标。他们发现 TPCA-1(一种双重 NF-kB 和 Jak-Stat 抑制剂)在恢复Bcl11b表达方面发挥了最显著的作用,而其他 NF-kB 或 Jak-Stat 单通路抑制剂在Bcl11b表达中起的作用很小,这表明衰老是一个渐进的、协调的过程,可能需要多种通路的输入(图 7a)。与 TPCA-1 在体外 促进Bcl11b表达的作用一致(图7b),当连续 1 个月给 12 月龄小鼠施用 TPCA-1 时,乳腺 CD49f high EpCAM low细胞明显更年轻,a-Young 细胞显著增加,同时 e-Sen 和 l-Sen 细胞数量急剧减少(图 7c-d)。TPCA-1 处理后,Bcl11b活性评分和代谢通路明显恢复,而衰老相关通路,包括衰老、NF-kB、Jak-Stat、MAPK 和 PI3K-Akt 通路均受到显著抑制(图 7e-h)。
为了确定TPCA-1诱导的年轻乳腺是否可以有效降低癌症发病率,他们在甲羟孕酮 (MPA) 和 DMBA 治疗后进行了 7 周的腹膜内注射 TPCA-1,并跟踪癌症发病率(图 7i),发现 TPCA-1 治疗成功有效地降低了肿瘤负担并显著提高了无瘤小鼠的存活率(图 7j-k)。这些数据表明,可以通过将衰老组织转录组重塑为年轻状态的组织转录组的策略来控制乳腺癌的形成,以降低癌症易感性。
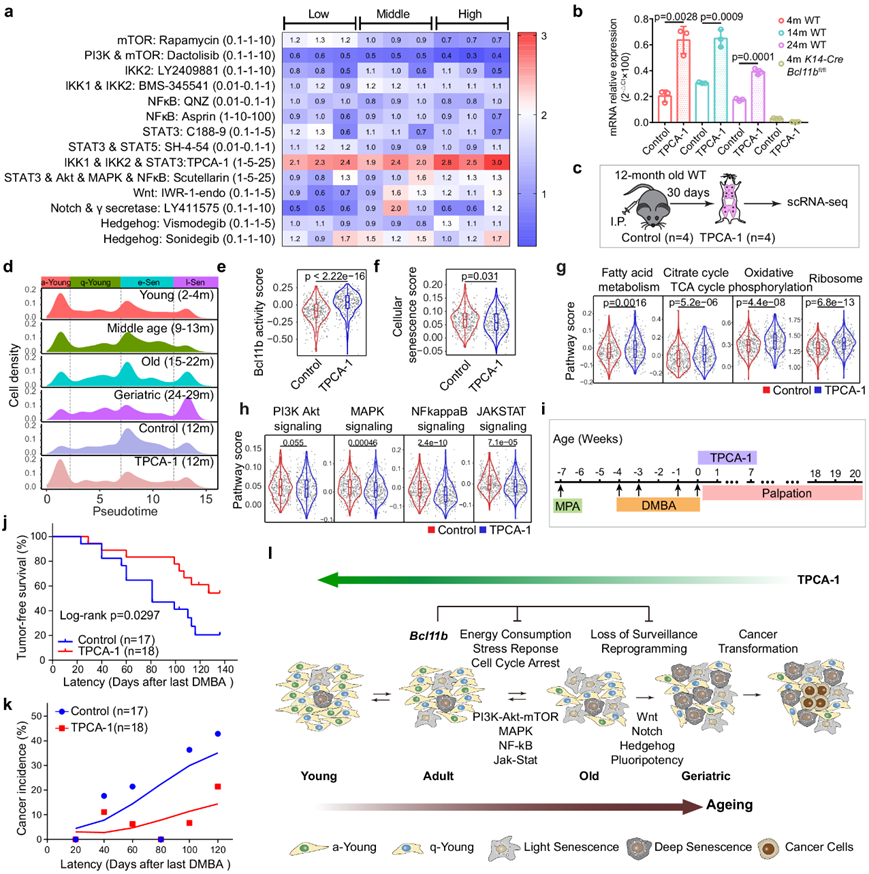
图7. TPCA-1 在转录组水平上重塑衰老程序。
(a) 评估可有效上调Bcl11b表达的药物。 (b) mRNA表达分析。(c) 示意图显示了 TPCA-1 (10 mg/kg) 对 12 月龄小鼠体内治疗的策略。(d) 细胞密度分布分析。(e-f) 小提琴图显示TPCA-1 处理组的Bcl11b活性评分增加且细胞衰老评分降低。(g-h) KEGG通路分析。(i) 示意图显示了用 DMSO (4%) 和 TPCA-1 (10 mg/kg) 处理的小鼠的 DMBA 诱发癌症试验。 (j) 无肿瘤生存曲线。(k) 小鼠的癌症发病率。(l) 示意图显示了渐进式衰老程序如何导致癌症易感性的假设。
+ + + + + + + + + + +
结 论
本研究利用富含乳腺干细胞的群体在单细胞转录水平上建立了一个按时间顺序排列的分子钟,以描述雌性小鼠的生理衰老动态,发现乳腺衰老过程是异步的和渐进的,由早期衰老程序启动,随后是熵晚期衰老程序,癌症相关通路升高,易患癌症。向衰老程序的转变受干细胞因子Bcl11b控制,该因子的缺失会加速乳腺衰老,并增强 DMBA 诱导的肿瘤形成。本项研究已经确定了一种可以使乳腺细胞恢复活力并显著降低与衰老相关的癌症发病率的药物 TPCA-1。该研究结果建立了渐进性乳腺细胞衰老的分子图谱,并阐明了连接乳腺衰老和癌症易感性的转录调控网络,这对老年人癌症患病率的管理具有潜在意义。
+ + + + +



 English
English


