文献解读|Cell Metab(27.7):巨噬细胞和成纤维细胞之间的烟酰胺代谢过程调控胃癌的微环境
✦ +
+
论文ID
原名:Nicotinamide metabolism face-off between macrophages and fibroblasts manipulates the microenvironment in gastric cancer
译名:巨噬细胞和成纤维细胞之间的烟酰胺代谢过程调控胃癌的微环境
期刊:Cell Metabolism
影响因子:27.7
发表时间:2024.06.12
DOI号:10.1016/j.cmet.2024.05.013
背 景
胃癌 (GC) 的特点是具有独特且异质性的肿瘤微环境 (TME)。虽然应用免疫检查点阻断 (ICB) 可以提高 GC 生存率,但近一半的 GC 患者对 ICB 治疗没有反应。之前的研究表明,TMEscore表征TME免疫浸润模式,比单独表达PD-L1更准确地识别将受益于ICB的GC患者(临床试验:NCT04850716)。这一观察结果表明,对ICB的反应实际上是TME复杂相互作用的结果。胃癌中显著的异质性,特别是肿瘤微环境的异质性,凸显了抗肿瘤反应是多因素相互作用的特征,然而目前还需要更深入的研究。
实验设计
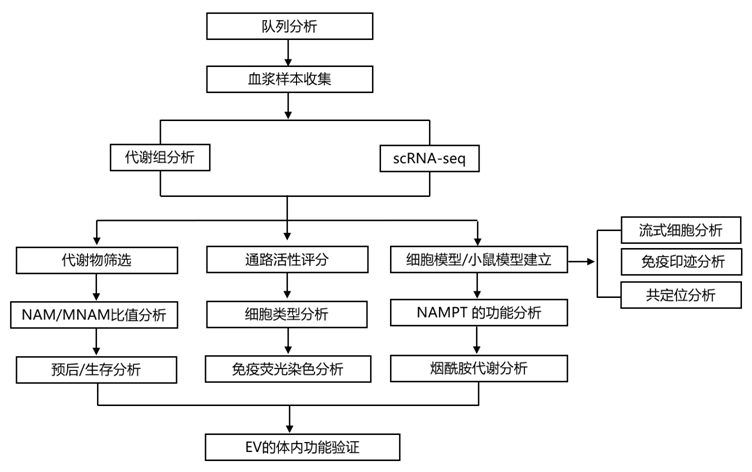
结 果
01
胃癌免疫治疗中NAM代谢的意义
代谢物是参与代谢相互作用的核心中间体。然而,缺乏对代谢物与肿瘤免疫微环境 (TIME) 之间关系的系统评估。研究团队根据亚洲癌症研究组(ACRG 队列)的 GC 队列和 PRJEB2578数据集中的代谢物-蛋白质相互作用网络对整体代谢物活性进行了评分(图 S1 A),他们分析了 1800 多种代谢物和 3000 种代谢反应的预后意义,其中烟酰胺 (NAM)和 1-甲基烟酰胺 (MNAM) 在 GC 中显示出最高的免疫相关评分(图 S1 B)。具体而言,NAM 与更好的预后相关,而 MNAM 与较差的预后相关(图 1 A)。NAM 可用于皮肤癌和黑色素瘤的化学预防,19其主要代谢产物 MNAM 可削弱卵巢癌的抗肿瘤免疫反应。这种代谢反应如何介导预后意义的差异值得探索。总体而言,这些数据揭示了 NAM 代谢物在 GC 预后中相反的临床意义,这可能意味着发生了代谢相互作用。
考虑到 NAM 代谢与 TIME 之间的潜在关系,他们进一步验证了 NAM 代谢物在 ICB 反应中的临床意义。他们分析了接受免疫疗法的胃癌患者的血浆样本,使用液相色谱-串联质谱(LC-MS/MS)检测的NAM/MNAM比值在对免疫疗法响应(R)良好的患者(PR:部分缓解)中显著高于对免疫疗法不响应的患者(NR)(SD/PD:稳定病情/疾病进展)(图1C)。ELISA 和 LC-MS/MS 结果之间存在很强的相关性(图 S1 D),然后,他们在更大的队列中进行了 ELISA 并获得了类似的结果(图 1 B)。有趣的是,在 ICB 前后患者的配对样本中,PR 患者的 NAM/MNAM 比率高于基线水平,但 SD/PD 患者的 NAM/MNAM 比率降低(图 1 C),比率较高的患者的无进展生存期较长(图 1 D)。此外,他们在与 ICB 反应相对应的多个时间点捕获了 NAM/MNAM 比率(图 1 E-1G)。当出现治疗反应时,NAM/MNAM 比率同时增加,但随着治疗后疾病的进展而降低。
鉴于对 NAM 和 MNAM 在 GC 中的预后价值的主要观察,他们进一步在癌症中对它们进行了评估。MNAM 活性与几种实体瘤的不良预后相关(图 S1 E)。然而,NAM 活性在不同癌症类型中表现出不同的预后价值(图 S1 F)。这种变化可能与通过烟酰胺腺嘌呤二核苷酸 (NAD + ) 代谢的复杂性和功能多样性有关。NAM/MNAM 比率在接受 ICB 治疗的非小细胞肺癌 (NSCLC) 或食管癌 (EC) 患者中表现出一致的显著性(图1H-K)。这些发现进一步支持使用 NAM 代谢物作为 GC 中 ICB 反应的指标及其在其他实体肿瘤中的类似临床价值。
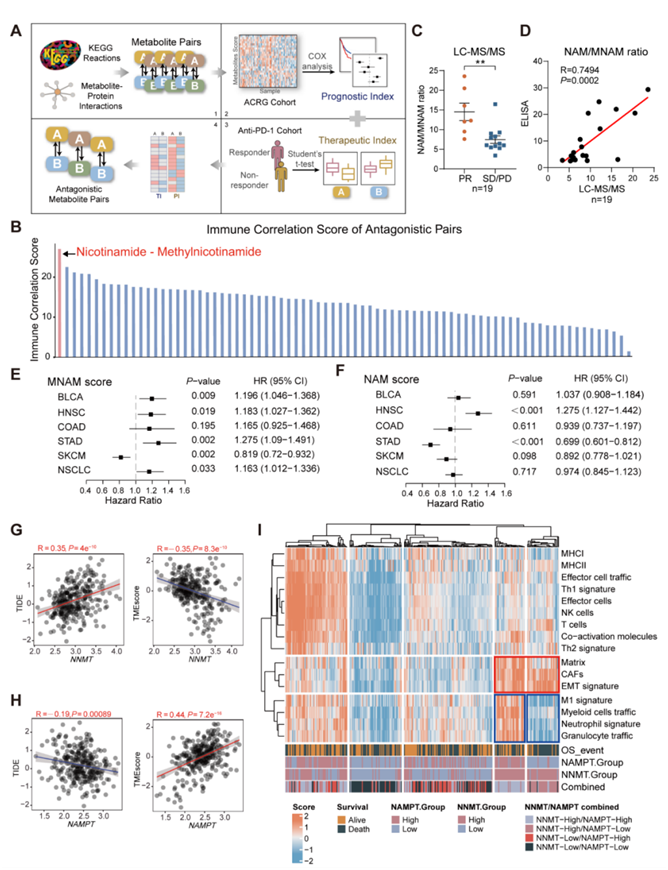
图S1. GC中以NNMT和NAMPT为主导的代谢物的筛选及TME特征。
(a) 代谢物对鉴定工作流程示意图。 (b) 筛选代谢物的免疫相关评分。(c) 采用LC-MS/MS法测定19例GC患者血浆NAM/MNAM比值。(d) 散点图显示LC-MS/MS与ELISA检测的NAM/MNAM比值的相关性。(e-f) 单因素Cox回归确定多发性肿瘤的MNAM和NAM活性评分的预后。 (g-h) NNMT和NAMPT的表达与TIDE和TMEscore相关性的散点图。 (i) 基于ssGSEA评分法的ACRG队列TME特征共识聚类热图。
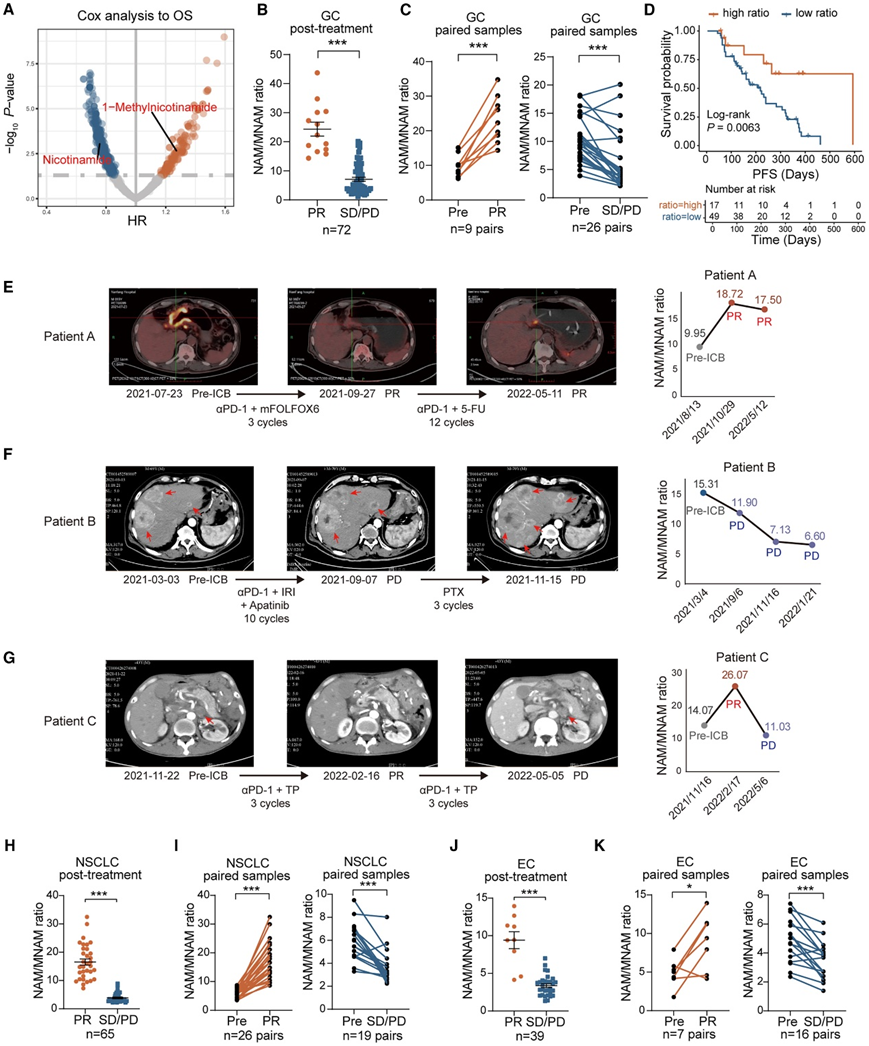
图1. 烟酰胺代谢在GC免疫治疗中的双重意义。
(A) 火山图显示单变量 Cox 分析中烟酰胺代谢物的预后意义。(B) 通过 ELISA 测量 GC 患者血浆 NAM/MNAM 比率。(C) GC 患者接受免疫治疗前后配对血浆样本的 NAM/MNAM 比率。(D) Kaplan-Meier 生存曲线显示 NAM/MNAM 比率在 GC 患者中的预后价值。(E–G) 疗效评估时测量 3 例接受免疫治疗的 GC 患者的影像学特征(左)和血浆 NAM/MNAM 比值(右)。(H–K) 通过 ELISA 测量 NSCLC 或 EC 患者的血浆 NAM/MNAM 比率。
02
巨噬细胞和成纤维细胞主导 GC 中的 NAM 代谢
代谢物是表征代谢反应活性的下游效应物,重点关注了涉及 NAM 代谢的反应。作为共有底物,NAM 可以由 NAM N-甲基转移酶 (NNMT) 催化,也可以通过 NAM 磷酸核糖基转移酶 (NAMPT)进入 NAD +挽救途径(图 2 A)。他们发现限速酶 NNMT 和 NAMPT 也表现出不同的预后意义,并与 GC 中的不同 TME 特征相关(图 2 B,S1 G-H)。NNMT 表达与肿瘤免疫功能障碍和排斥 (TIDE) 评分呈正相关,与 TMEscore 呈负相关。NNMT 表达还与高度活跃的基质和上皮-间质转化 (EMT) 途径相关(图 S1 I)。相比之下,NAMPT 表达与更高的 TMEscore 和炎症相关评分相关(图 S1 I)。总之,NAM 代谢酶 NAMPT 和 NNMT 对预后和 TIME 表型具有相反的影响。
免疫细胞是 TIME 的主要调节剂,他们对接受 ICB 的患者的 19 个 GC 组织样本进行了 单细胞转录组分析(scRNA-seq)(图 2 C)。T 细胞和上皮细胞是 GC 组织中的主要细胞类型。值得注意的是,无反应者(SD/PD)的成纤维细胞比反应者 (PR) 的成纤维细胞更丰富,而 PR 患者的巨噬细胞更丰富(图 2 D)。NAMPT 在巨噬细胞中的表达比在任何其他细胞类型中都高,而在 PD 患者中则明显较低(图 2 E)。相比之下,NNMT 表达基本上仅限于成纤维细胞,在 SD/PD 患者中表达更高(图 2 F)。GC 组织切片的相关性和共定位分析证实,NAMPT 信号与巨噬细胞标志物 CD68 信号重叠,NNMT 信号与成纤维细胞标志物 αSMA 重叠(图 2 G-H)。
总之,NAM 代谢在 GC TME 中的巨噬细胞和成纤维细胞中相对活跃。巨噬细胞和成纤维细胞中代谢酶 NAMPT 和 NNMT 的具体表达与 ICB 疗效相关。
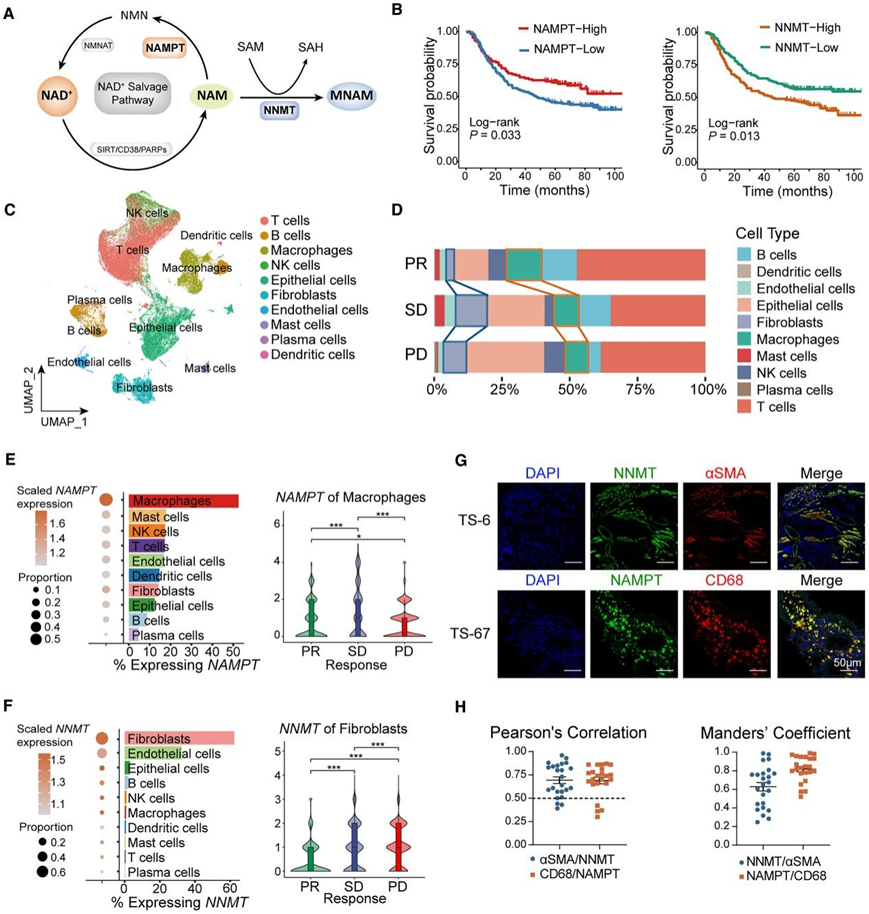
图2. 巨噬细胞和成纤维细胞主导 GC 中的烟酰胺代谢。
(A)烟酰胺代谢示意图。(B) ACRG 队列中 NAMPT 和 NNMT 高/低组的生存曲线。(C)按细胞类型标记的综合 101676 个细胞的均匀流形近似和投影 (UMAP)。(D) 不同 ICB 反应中细胞类型的比例分布。(E-F) 表达 NAMPT和NNMT的细胞比例,以及每种细胞类型中阳性细胞的标准化表达水平(左)及其在按 ICB 反应分组的样本中的表达(右)。(G-H) 胃癌组织中免疫荧光(IF)染色的共定位。
03
巨噬细胞衍生的含有 NAMPT 的 EV 介导 NAM 代谢与 CAF 的相互作用
接下来,他们研究了巨噬细胞和成纤维细胞通过 NAM 代谢所起的作用。NAD +代谢(其中 NAMPT 是限速酶)指导巨噬细胞炎症表型的维持和促炎细胞因子的产生。然而,NNMT 与卵巢癌或结直肠癌患者的预后不良有关。接下来,他们在人外周血来源的巨噬细胞中过表达 NAMPT,观察到 M1 巨噬细胞(标记 CD86)增加而 M2 巨噬细胞(标记 CD206)减少,而这种现象可以通过 NAMPT 抑制剂 FK866 逆转(图 3 A)。另一方面,在小鼠皮下肿瘤分离的 CAF (m-CAF) 中过表达 NNMT 会上调免疫抑制分子(Vimentin、Vegfa、Il10和Tgfb1)的表达(图 3 B)。
为了阐明巨噬细胞和成纤维细胞是否通过 NAM 代谢相互作用,他们建立了双向共培养系统。首先将小鼠骨髓来源的巨噬细胞 (BMDM)接种在下室中,这样可以直接接触分泌到上室中的 CAF 衍生小分子。在与 m-CAF共培养的 BMDM 中未观察到 NAMPT 表达的变化(图 3C)。随后,他们反转了接种位置,发现与巨噬细胞共培养显著抑制了 m-CAF 中的 NNMT 表达(图 3D)。他们推测巨噬细胞在代谢对抗中起主导作用,并通过 NAMPT 信号传导干扰 CAF 中的 NNMT 表达。NAMPT 以细胞内 (iNAMPT)和细胞外 (eNAMPT) 两种形式存在于哺乳动物中,其中 eNAMPT 表现出更广泛的功能。研究报告称 EV 是 eNAMPT 的主要载体之一。为了验证 EV 是否是参与相互作用的介质,他们首先将巨噬细胞培养上清液分离成囊泡(EV/EV +)和非囊泡(EV −)成分,观察到 EV/EV +成分(而非 EV −成分)下调了 NNMT 表达。免疫荧光 (IF) 染色显示 NAMPT 与巨噬细胞中的 EV 标志物 CD63 共定位(图 3 E)。纳米粒子跟踪分析 (NTA) 显示 EV和 EV2(分离的EV) 的直径范围为 100 至 120 nm(图 3 F),与传统外泌体的直径相似。将 CAF与 BMDM 共培养或用 BMDM 衍生的 EV 处理。随着 EV 浓度的增加,CAF中的 NNMT 表达逐渐降低。EV 处理也抑制了 MFC 中 EMT 标志物的表达。更重要的是,BMDM 衍生的 EV 增加了 NAMPT 水平并降低了 CAF中的 NNMT 表达(图 3 G)。这些数据共同表明,巨噬细胞分泌的含 NAMPT 的 EV 是抑制 CAF 中 NNMT 表达的 NAM 代谢相互作用的核心介质。
为了验证含 NAMPT 的 EV在体内的抗肿瘤作用,他们使用小鼠 GC 细胞系 YTN-16 产生皮下肿瘤(图 3 H)。氯膦酸盐脂质体 (Clo) 用于特异性地去除和消除内源性巨噬细胞的作用。经过 5 个周期的治疗后,观察到肿瘤中巨噬细胞浸润减少了 4 倍。自体注射 BMDM 或 BMDM 衍生的 EV 后肿瘤生长受到显著抑制(图 3 I-J)值得注意的是,用 NAMPT 过表达的 BMDM 或 EV 治疗导致小鼠血浆 NAM/MNAM 比率显著增加(图 3 K),这一发现与在 GC 患者中的发现具有相同的意义。
由于 CD8 + T 细胞是负责肿瘤杀伤作用的主要细胞,他们评估了小鼠原位的 CD8 + T 细胞群。用 NAMPT 过表达的 BMDM 或 EV 治疗会增加 T 细胞中细胞毒性分子颗粒酶 B (GZMB) 和 IFN-γ 的水平(图 3 L)。总体而言,巨噬细胞及其分泌的含有 NAMPT 的 EV 可以破坏 CAF 中的 NAM 代谢,并在体内GC 中产生有利的 CD8 + T 细胞介导的 TIME 。
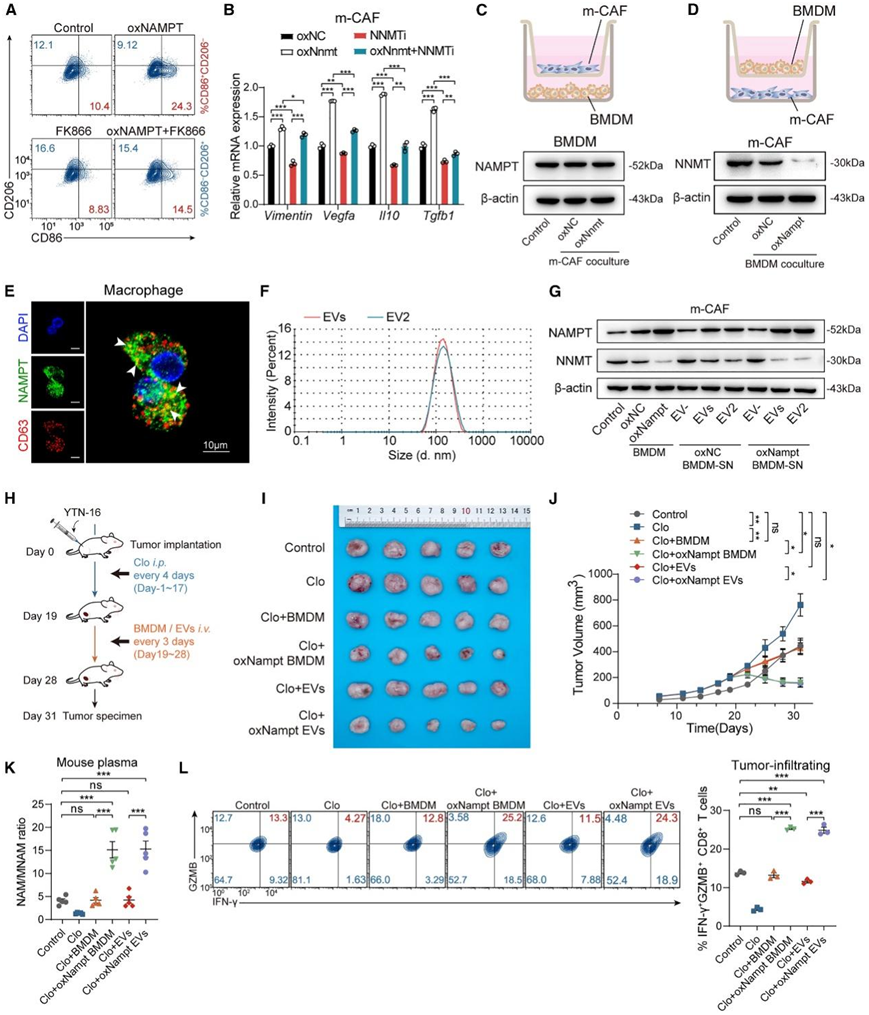
图3. 巨噬细胞衍生的 NAMPT EV 介导烟酰胺代谢与 CAF 的相互作用。
(a) 流式细胞分析。(b) RT-qPCR 分析。(c-d) 细胞共培养系统示意图(上)。免疫印迹分析(下)。(e) IF 图像显示 EV 标记物 CD63 和 NAMPT 在人类巨噬细胞中的共定位。 (f) 通过 NTA 分析 BMDM 衍生的 EV和 EV2 的尺寸分布。(g) 免疫印迹分析。 (h) 体内实验概述。(i-J) 皮下肿瘤的图像和生长曲线。(K) 通过 ELISA 测量小鼠血浆中的 NAM/MNAM 比率。(L)通过流式细胞检测肿瘤浸润性 IFN-γ + GZMB + CD8 + T 细胞。
04
巨噬细胞和 CAF 之间的 NAM 代谢相互作用调节 CD8 + T 细胞的细胞毒性
他们进一步分析了巨噬细胞和成纤维细胞是否通过 NAM 代谢串扰调节 CD8 + T 细胞功能。首先,对 40 个 GC 患者的组织切片进行了 IF。CD8 密度与 NAMPT 和 CD68 的表达呈正相关,但与 NNMT 和 αSMA 的表达呈负相关(图 4 A-B)。他们用不同比例(巨噬细胞:CAF = 1:3 或 3:1)的人 GC 组织分离的 CAF 和外周血来源的巨噬细胞的混合物刺激人外周血来源的 CD8 + T 细胞。当巨噬细胞比例更高或 NAMPT 水平更高时,T 细胞会转向活性表型(图 4C),从而减弱 CAF 的抑制作用。此外,T 细胞上清液的 NAM/MNAM 比率也升高了(图 4D)。如上所述,巨噬细胞通过 EV 主导与 CAF的代谢相互作用。接下来,他们用梯度浓度的巨噬细胞衍生的 EV 处理 CAF,然后将它们与 CD8 + T 细胞共培养。CAF显著降低了 CD8 + T细胞的细胞毒性,但增加 EV 浓度会恢复 CD8 + T 细胞活性(图 4E)。这些结果表明巨噬细胞衍生的 EV 可以逆转CAF 诱导的CD8 + T 细胞功能障碍。此外,外源性 MNAM 处理或 CAF 共培养减弱了 CD8 + T 细胞的细胞毒性(降低 IFN-γ 和肿瘤坏死因子 α [TNF-α]),这种影响很大程度上依赖于 NNMT 表达或活性(图 4 F-G),这表明表达 NNMT 的 CAF 通过代谢物 MNAM 抑制 T 细胞功能。
鉴于在患者、小鼠和细胞共培养系统中发现的 NAM/MNAM 比率的重要性,他们进一步研究了 NAM/MNAM 比率是否足以影响 T 细胞功能。NAM 和 MNAM 的添加也以剂量依赖性方式改变了 T 细胞功能(图 4 H),这表明巨噬细胞和 CAF 通过 NAM 代谢相互作用动态调节 CD8 + T 细胞功能。
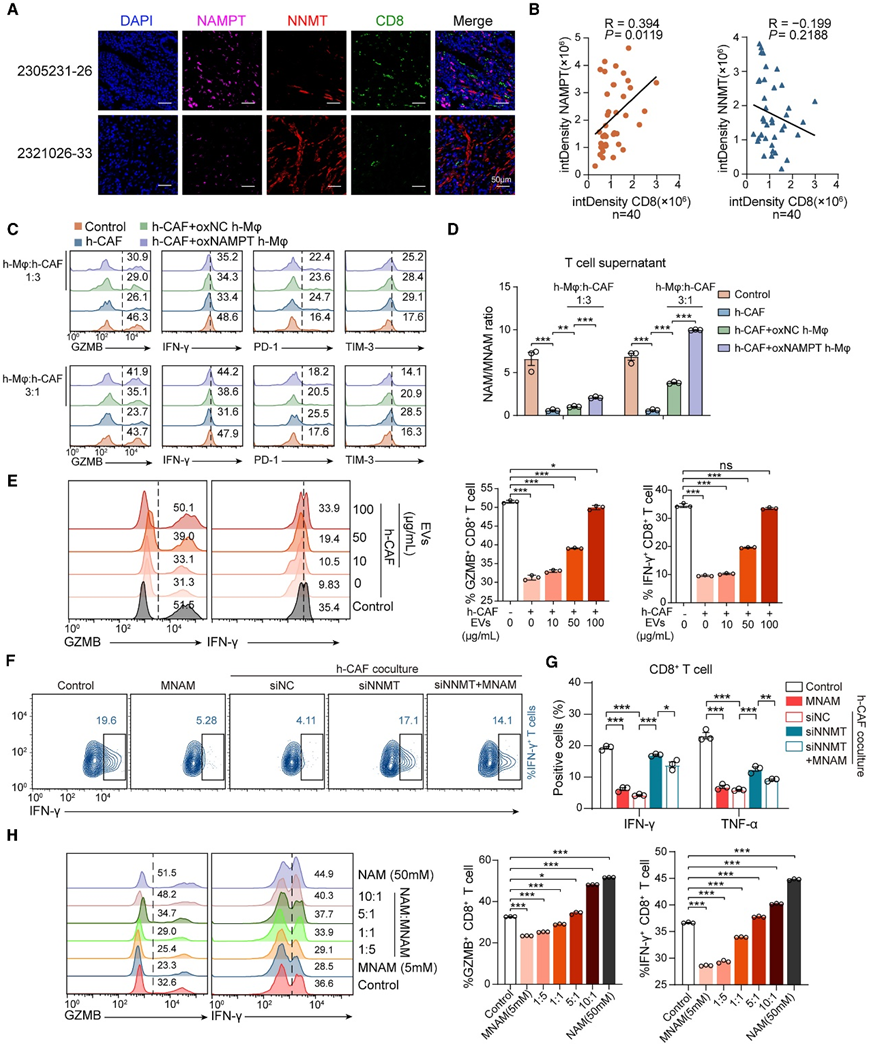
图4. 巨噬细胞和 CAF之间的烟酰胺代谢相互作用调节 CD8 + T 细胞的细胞毒性。
(a-B) IF 图像 (A) 以及 NNMT 或 NAMPT 荧光强度与 CD8 的 Pearson 相关性。(c-H)流式细胞分析和定量。
05
含有 NAMPT 的 EV 通过 SIRT1 依赖的 NICD 去乙酰化抑制 CAF 中的 NNMT 表达
接下来,他们探究了巨噬细胞衍生的 EV 抑制 NNMT 表达的机制。11 条致癌通路的差异分析表明,在 GC 中,NNMT 高表达组中 NOTCH、WNT 和 HIPPO 通路显著上调(图 5 A),其中 NOTCH 通路激活的基因与 NNMT 表达的相关性比 WNT 和 HIPPO 通路中的基因更强(图 5 B)。此外,WNT 激动剂和 HIPPO 抑制剂均不影响 NNMT 表达。因此,他们认为 NOTCH 通路可能与 NNMT 表达有关。CAF 中 NOTCH 信号失调会促进癌细胞增殖、EMT 和血管生成。他们观察到过表达 NOTCH 通路转录因子 RBP-J 会上调 NNMT 以及 NOTCH 通路靶基因(HES1 和 HEY1)的表达,而用RBP-J 抑制剂 RIN1 治疗会逆转 NNMT mRNA和蛋白质水平的变化(图 5C)。他们在JASPAR数据库中进行了预测分析,并在NNMT基因启动子区(转录起始位点[TSS]上游2000 bp)中确定了5个候选RBP-J结合位点,然后使用染色质免疫沉淀法验证这些候选位点(图5 D)。两个位点(site3,-1471∼-1462 bp;site5,-300∼-291 bp)在anti-RBP-J pull-down分析中富集,表明RBP-J 可以直接与NNMT启动子区结合(图5 E)。随后的荧光素酶报告基因检测证实两个位点均能够激活NNMT 转录(图5 F)。这些结果表明NNMT可能是NOTCH 通路的直接靶基因。
NAMPT 上调 NAD 消耗酶 SIRT 家族,从而维持 NAM 稳态。他们发现含有 NAMPT 的 EV 抑制了 NOTCH 信号传导(RBP-J、HEY1 和 HES1)和 NNMT 表达。用 SIRT1 抑制剂 Selisistat 治疗可逆转 NNMT 水平的下降,这表明 EV 可能通过 SIRT1 发挥作用(图 5G)。SIRT1 是一种脱乙酰酶,据报道可拮抗乙酰化诱导的 NICD 稳定。他们随后探究了 SIRT1 是否通过翻译后修饰影响 NNMT 表达,发现 EV 降低了 NICD 的乙酰化,而 Selisistat 挽救了 NICD 乙酰化(图 5 H)。从机制上讲,EV 增加了 NICD 的泛素化,从而增加了其蛋白酶体降解,从而影响了 NICD 蛋白的稳定性(图 5 I)。他们将突变质粒转染到 CAF 中可消除 NICD 的乙酰化,并且 NNMT 表达对 EV 处理具有抗性(图 5 J)。EV 对 CAF 代谢的破坏最终影响了 CD8 + T 细胞的细胞毒性(图 5 K)。这些结果表明,含有 NAMPT 的 EV 通过激活 SIRT1 介导 NAM 代谢相互作用,从而损害 NICD 核表达和 NNMT 转录激活。
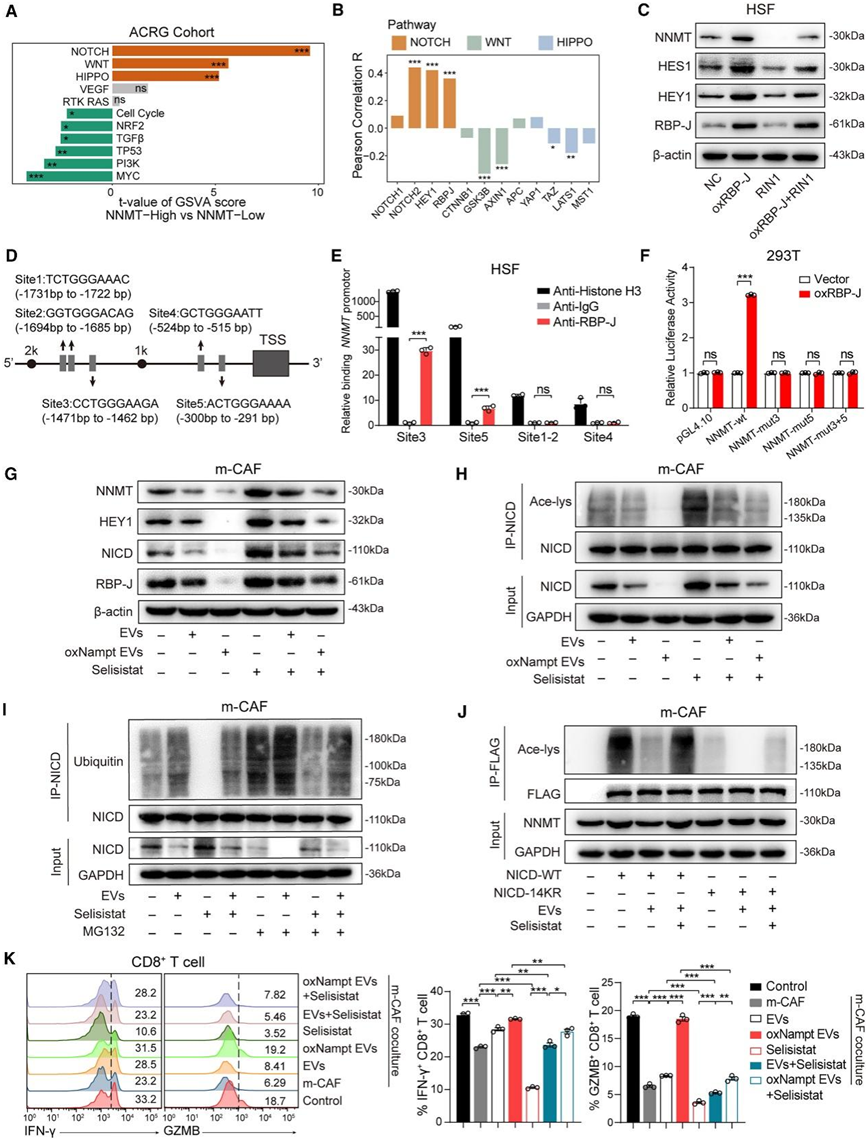
图5. 含有 NAMPT 的 EV 通过 SIRT1 依赖的 NICD 去乙酰化抑制 CAF 中的 NNMT 表达。
(a) NNMT 高组和低组的 ACRG 队列中的 11 条致癌通路评分的 Limma 差异分析。 (b) NOTCH、HIPPO和WNT通路分子与NNMT表达之间的相关性分析直方图。(c) 免疫印迹分析。(d) RBP-J 在 NNMT 启动子区上的结合位点示意图。 (e) 染色质免疫沉淀 (ChIP) 检测NNMT启动子周围 RBP-J 的富集。(f) 荧光素酶报告基因检测表明 RBP-J通过结合位点 3 和 5增强了NNMT启动子转录活性。(g-K)免疫印迹分析。 (K) 流式细胞分析。
06
含有 NAMPT 的 EV 重塑了 TIME 并增强了 GC 中的抗 PD-1 反应
他们进行了体内实验,以评估含 NAMPT 的 EV与抗 PD-1 + 联合化疗(CT)的疗效(图 6 A)。抗 PD-1 单药治疗对皮下肿瘤的作用有限,自体注射 BMDM 衍生的 EV后,肿瘤生长受到抑制(图 6 B-C)。流式细胞分析和免疫组织化学显示,NAMPT 过表达 EV组的 T 细胞浸润和活性最高,这表明含 NAMPT 的 EV 可以作为消除肿瘤的有力工具(图 6 D-F)。此外,IF 染色显示,EV 治疗后肿瘤中的 NNMT 水平降低(图 6 G)。NAM/MNAM 比率显著增加,对抗 PD-1 联合疗法的反应更好(图 6 H)。总之,通过施用含 NAMPT 的 EV(代谢相互作用的关键介质)来靶向调控NAM 代谢,可以恢复 GC 对抗 PD-1 治疗的敏感性,并正在成为一种有前途的治疗策略。
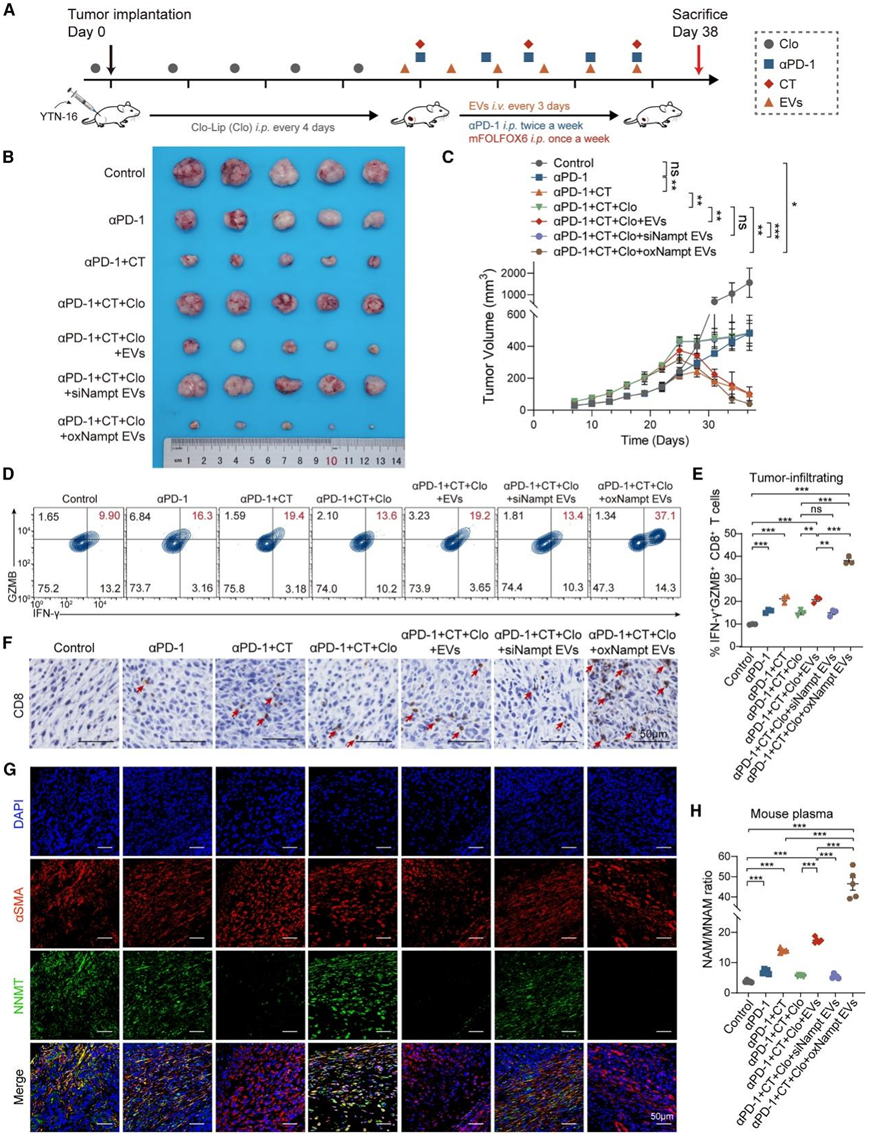
图6. 含 NAMPT 的 EV 重塑 TIME 并增强 GC 中的抗 PD-1 反应。
(a) 抗 PD-1 疗法治疗 YTN-16 皮下肿瘤小鼠模型的流程图。(b-c) 皮下肿瘤的图像和生长曲线。 (d-e)流式细胞分析。(f) 皮下肿瘤上 CD8 的免疫组织化学图像。 (g) IF 的代表性图像显示了 NNMT 和 αSMA 的表达和共定位。(h) 通过 ELISA 测量小鼠血浆中的 NAM/MNAM 比率。
+ + + + + + + + + + +
结 论
本项研究通过转录组分析和动态血浆样本分析,发现了肿瘤微环境中的代谢“对峙”机制,如烟酰胺代谢的双重预后意义所示。具体而言,分别表达限速酶烟酰胺磷酸核糖基转移酶和烟酰胺 N-甲基转移酶的巨噬细胞和成纤维细胞调节烟酰胺/1-甲基烟酰胺比率和 CD8+ T 细胞功能。从机制上讲,烟酰胺 N-甲基转移酶由 NOTCH 通路转录因子 RBP-J 转录激活,并进一步由巨噬细胞衍生的含有烟酰胺磷酸核糖基转移酶的EV抑制。通过自体注射细胞外囊泡来调控烟酰胺代谢可恢复胃癌中的 CD8 + T 细胞细胞毒性和抗 PD-1 反应。
+ + + + +



 English
English


