文献解读|Nat Metab(18.9):生酮饮食诱导的胆汁酸通过减少卡路里吸收来预防肥胖
✦ +
+
论文ID
原名:Ketogenic diet-induced bile acids protect against obesity through reduced calorie absorption
译名:生酮饮食诱导的胆汁酸通过减少卡路里吸收来预防肥胖
期刊:Nature Metabolism
影响因子:18.9
发表时间:2024.06.27
DOI号:10.1038/s42255-024-01072-1
背 景
低碳水化合物生酮饮食(KD)方式长期以来一直用于减肥,肠道微生物群和代谢物可介导KD消耗引起的代谢变化,但其潜在的机制仍然未知。
实验设计
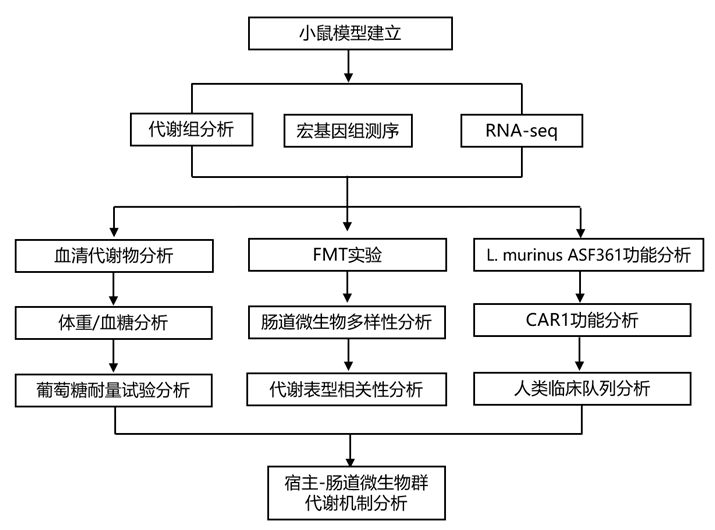
结 果
01
KD提高血清TDCA和TUDCA,降低体重
为了鉴定由生酮饮食 (KD) 调控的潜在生物活性血清代谢物,研究团队用KD或普通饲料 (CD) 喂养C57BL/6J小鼠7周。KD导致小鼠体重和空腹血糖水平显著降低(图S1a–c)。对这些小鼠空腹血清进行的靶向代谢组学分析显示,KD摄入显著改变了血清代谢组谱 (图S1d)。在KD喂养的小鼠血清中,共有22种代谢物,包括6种牛磺酸结合的胆汁酸 (BA) 上调,18种代谢物下调(图1a)。
补充蛋氨酸可以逆转由KD引起的体重减轻。已有报道表明,BA 可以调节能量平衡,他们推测蛋氨酸治疗可能会反向调节KD喂养小鼠的循环BA水平。为验证这一假设,他们将小鼠分别以CD、KD和含蛋氨酸的KD (KDM) 三种饮食方式7周。正如预期的那样,补充蛋氨酸不仅逆转了KD引起的体重和空腹血糖水平的下降(图S1e-f),还显著降低了六种牛磺酸结合胆汁酸的循环水平(图1b),即牛磺脱氧胆酸 (TDCA)、牛磺熊去氧胆酸 (TUDCA)、牛磺胆酸 (TCA)、牛磺鹅去氧胆酸 (TCDCA)、牛磺石胆酸 (THCA) 和牛磺鼠胆酸 (TαMCA/TβMCA)。这六种牛磺酸结合胆汁酸在三组小鼠中均与体重和空腹血糖呈负相关(图1c)。KD和蛋氨酸补充对其他检测到的胆汁酸的血清水平没有影响,并且这些胆汁酸也与体重或空腹血糖无关。进一步分析显示,KD导致小鼠血清中结合胆汁酸与非结合胆汁酸的比值显著增加,初级胆汁酸与次级胆汁酸的比值也显著增加,而补充蛋氨酸显著降低了结合胆汁酸与非结合胆汁酸的比值,但未影响初级与次级胆汁酸的比值(图S1g-j)。此外,KD或KDM的摄入对小鼠血清中游离牛磺酸水平没有显著影响(图S1k)。
接下来,他们用上述四种结合胆汁酸(TDCA、TUDCA、TCA 和 TCDCA)处理小鼠,发现,TDCA 和 TUDCA(而非 TCA 或 TCDCA)在喂以普通饲料 (CD) 或含蛋氨酸的生酮饮食 (KDM) 的小鼠中引起了体重和空腹血糖水平的显著下降,并改善了葡萄糖耐量(glucose tolerance)(图1d-k)。
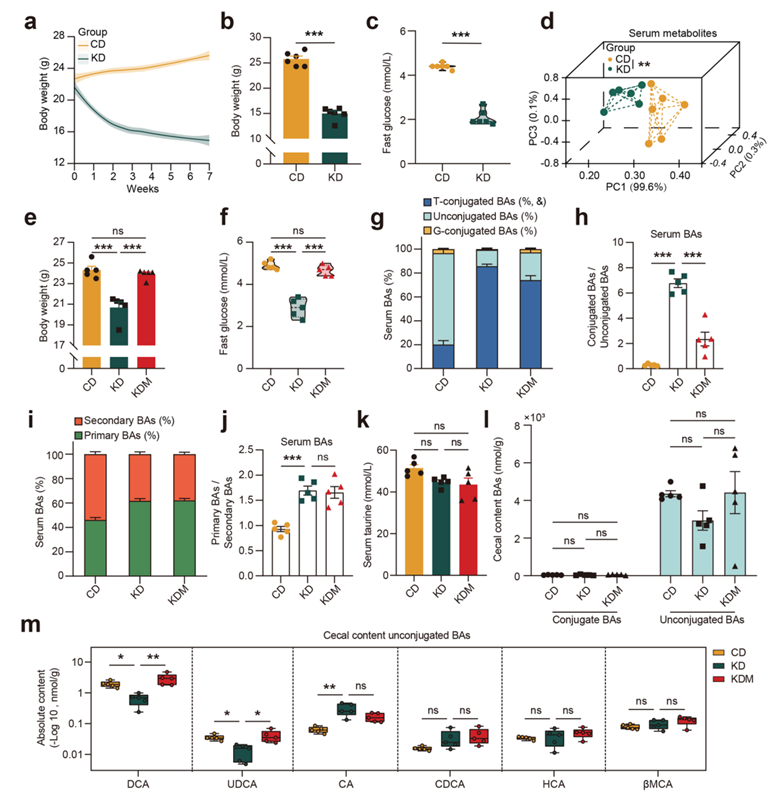
图S1. KD影响特定牛磺酸共轭BA的代谢。
(a) 小鼠体重变化曲线。(b-c) CD或KD消耗后的体重和空腹血糖。(d) 血清代谢组主成分分析(PCA)。(e-f) 体重和空腹血糖分析。(g) 血清中BA的百分比分层。(h) 血清中共轭BAs与非共轭BA的比值。(i) 血清中原发性和继发性BA的百分比分层。(j) 血清中初级与次级BA的比率。(k) 血清游离牛磺酸水平。(l) 盲肠内容物中共轭和非共轭ba的水平。(m) 箱线图显示盲肠中6种未结合的ba含量。
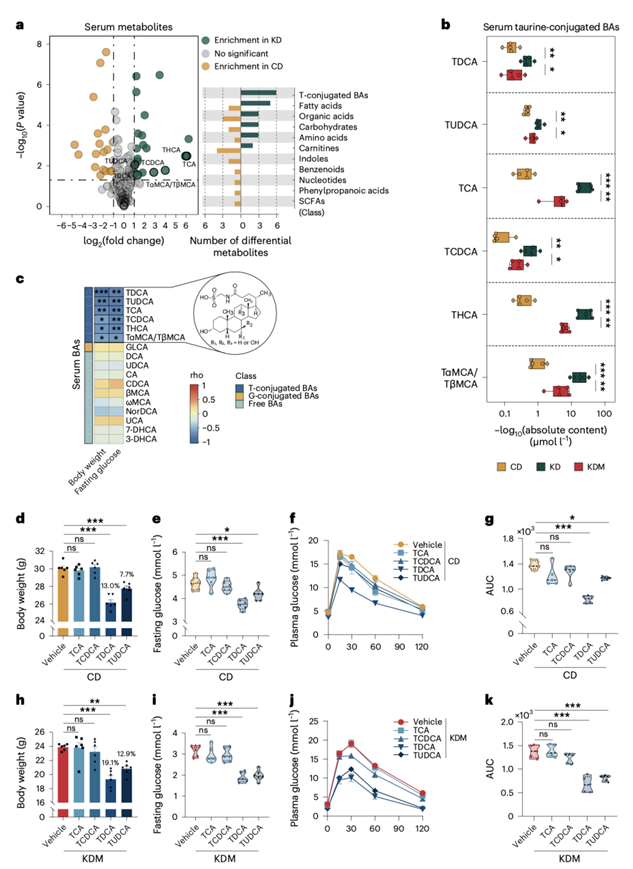
图1. KD提高血清TDCA和TUDCA水平,降低体重和空腹血糖水平。
(a) CD组和KD组小鼠血清代谢物的火山图。(b) 箱线图显示CD喂养、KD喂养和KDM喂养小鼠血清中6种牛磺酸结合的BA水平。(c) 热图显示CD、KD和KDM喂养小鼠的血清BA水平与体重和空腹血糖水平的相关性。(d-g) TCA、TCDCA、TDCA或TUDCA处理3周后CD喂养小鼠的体重、空腹血糖、葡萄糖耐量试验(GTT)和相关的曲线下面积(AUC)。(h-k) TCA, TCDCA、TDCA或TUDCA治疗3周后,KDM喂养小鼠的体重、空腹血糖、GTT和相关的AUC值。
02
肠道菌群对kd引起的体重减轻至关重要
牛磺酸结合胆汁酸的血清水平受肠肝循环的调节。因此,他们分析了三种不同饮食方式(CD、KD和KDM)喂养的小鼠的肠道胆汁酸,发现盲肠内容物中的胆汁酸主要是未结合的胆汁酸,且KD喂养的小鼠未结合的胆汁酸水平有下降趋势,这一趋势由蛋氨酸补充而逆转(图S1l)。KD的摄入减少了盲肠内容物中脱氧胆酸 (DCA) 和熊去氧胆酸 (UDCA) 的水平,这两者分别是TDCA和TUDCA的未结合形式(图S1m)。KDM逆转了KD引起的盲肠内容物中DCA和UDCA的变化,没有观察到其他四种未结合胆汁酸水平的类似趋势(图S1m)。血清中TDCA和TUDCA水平升高,盲肠内容物中DCA和UDCA水平升高,表明共轭和非共轭形式的BA发生了转变,这一过程主要受肠道微生物的调节(图1c,图S1l)。因此,他们接下来检测肠道微生物群是否在kd诱导的TDCA和TUDCA上调以及相关的代谢后果中发挥关键作用。
首先,他们通过用抗生素混合物 (ABX) 处理小鼠以清除其肠道微生物(图2a)。ABX处理消除了不同饮食组小鼠之间的体重差异(图2b-c)。同样,KD喂养和KDM喂养小鼠之间的空腹血糖水平差异减少,并且KD喂养和CD喂养小鼠之间的差异也显著减少(图2d)。这些数据表明,肠道微生物群对于KD和蛋氨酸补充引起的体重和葡萄糖稳态的变化是必需的。其次,他们进行了粪菌移植 (FMT) 实验。将CD喂养的小鼠分别移植了来自KD喂养的小鼠的肠道微生物群和KDM喂养小鼠的肠道微生物群,移植时间为6周(图2e)。移植后,移植了KD微生物群的受体小鼠平均体重下降了17.9%,而移植了KDM微生物群或载体对照的小鼠则正常增重(图2f-g)。移植KD微生物群也显著降低了受体小鼠的空腹血糖水平,并改善了葡萄糖耐量,而移植KDM微生物群则没有影响(图2h)。这些结果表明,移植KD微生物群足以引起宿主的体重减轻和改善葡萄糖稳态。
接下来,他们将KD微生物群移植到KDM喂养的小鼠体内,并将KDM微生物群移植到KD喂养的小鼠体内(图2i)。将KDM微生物群移植到KD喂养的小鼠体内抑制了饮食引起的体重和空腹血糖水平的变化。将KD微生物群移植到KDM喂养的小鼠体内略微降低了体重和空腹血糖(图2j-k)。当停止FMT后,受体小鼠的体重和空腹血糖逐渐恢复,并在两周后与对照组相比无显著差异(图2j-l)。这些观察结果表明,在没有外源微生物干扰的情况下,饮食会迅速重塑微生物群并逆转宿主的代谢状态。
此外,他们发现,通过ABX处理,饮食引起的血清TDCA和TUDCA水平变化消失了 (图2m-n),而饮食引起的血清TCA、TCDCA、THCA和TαMCA/TβMCA水平变化并未受到ABX处理的显著影响(图2o-p)。这些结果证明了肠道微生物在调节血清TDCA和TUDCA水平,从而影响宿主体重和葡萄糖稳态方面起着重要作用。
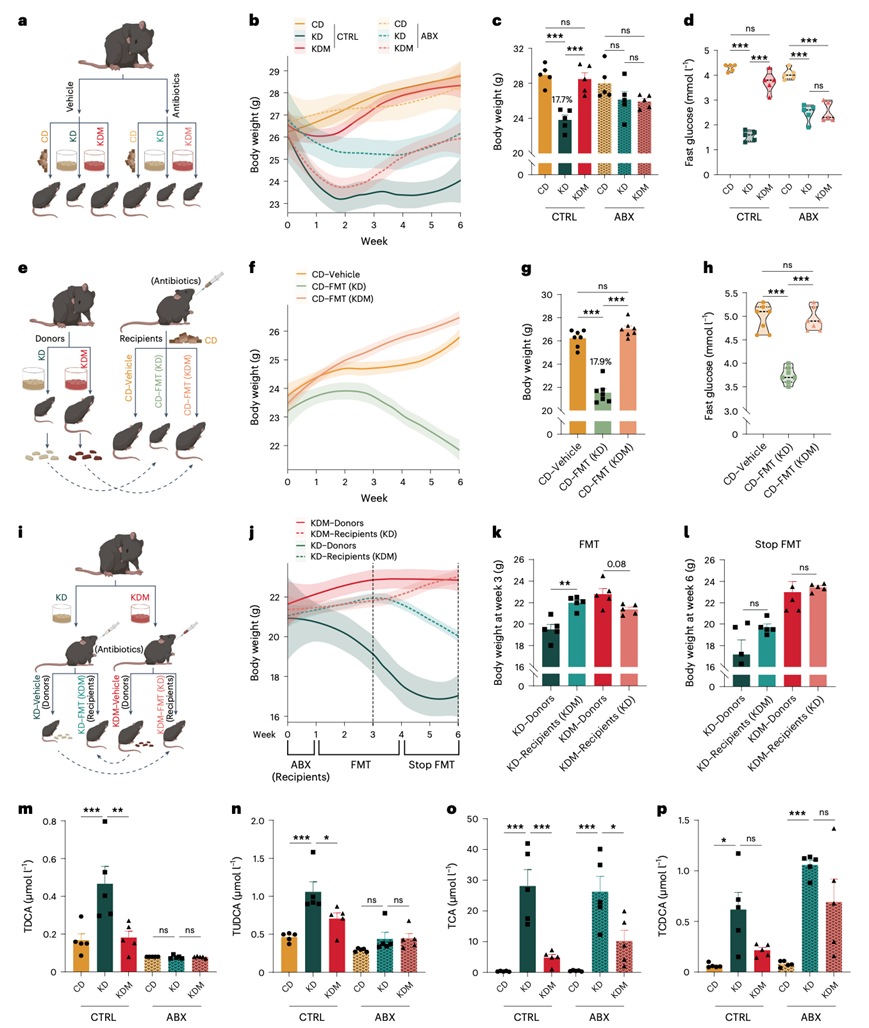
图2. 肠道微生物群是KD诱导的代谢益处和TDCA和TUDCA上调所必需的。
(a,e,i) ABX处理实验、FMT实验示意图。(b,f,j) 小鼠体重分析。(c-d) 饮食干预和ABX治疗后的体重和空腹血糖。(g-h) FMT后体重和空腹血糖。(k-l) FMT后体重和停止FMT后体重。(m-p) 饮食干预和ABX处理后血清TDCA、TUDCA、TCA和TCDCA水平。
03
特定的肠道微生物与kd诱导的效应相关
为了鉴定引起KD诱导的代谢表型的个体微生物,他们对三种不同饮食方式(CD、KD和KDM)喂养的小鼠的盲肠内容物进行了宏基因组测序。KD显著降低了α多样性,这一情况通过蛋氨酸补充得到恢复(图3a)。此外,KD和KDM均显著改变了肠道微生物群的结构(图3b)。KD减少了厚壁菌门、放线菌门和疣微菌门的相对丰度,增加了变形菌门的丰度,而蛋氨酸补充则恢复了这些门的丰度(图3c)。
他们使用线性判别分析效应量法确定了受饮食干预影响最大的10种菌株(图3d-e)。他们发现有四种菌株的丰度受KD影响最大,并且可以通过蛋氨酸补充恢复:即L. murinus ASF361、未分类的Lactobacillus reuteri、Akkermansia muciniphila ATCC BAA-835和Helicobacter hepaticus ATCC 51449。随后,他们进行了随机森林回归分析,结果显示上述四种菌株位列对宿主体重或空腹血糖水平预测准确率最高的前十种菌株之中(图3f-g)。他们基于Spearman相关性构建了这些菌株、血清TDCA和TUDCA水平、盲肠内容物DCA和UDCA水平以及宿主体重、空腹血糖和葡萄糖耐量之间的相关网络。选定的四种菌株中的三种,即L. murinus ASF361、未分类的Lactobacillus reuteri、Akkermansia muciniphila ATCC BAA-835与胆汁酸和代谢表型之间存在关联(图3h)。
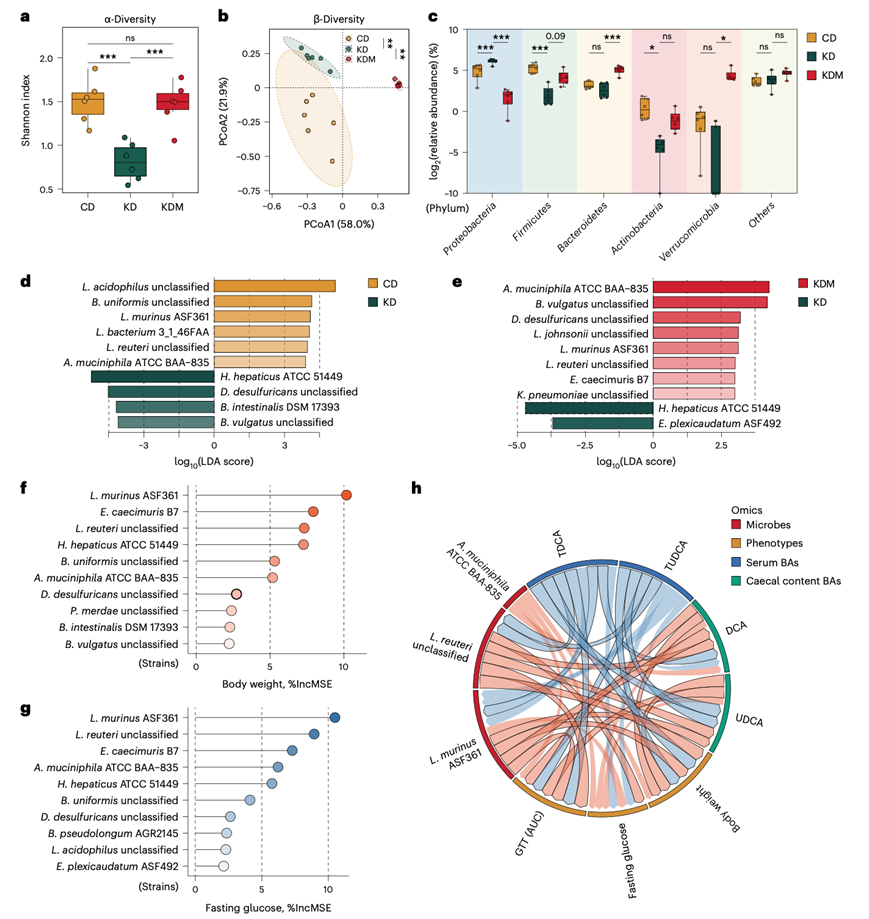
图3.肠道微生物与TDCA、TUDCA和KD驱动的代谢表型相关。
(a) 箱线图显示CD、KD和KDM喂养小鼠肠道菌群品系水平的α多样性。(b) 对菌株水平的宏基因组数据进行主坐标分析(PCoA),显示肠道菌群的β多样性。(c) 显示主要细菌门丰度的箱线图。(d-e) 采用线性判别分析效应量(LEfSe)图鉴定前10位菌株。(f-g) 通过随机森林回归均方误差(%IncMSE)检测到影响体重和空腹血糖增加的前10种细菌。(h) 显示菌株、血清BA、盲肠内容物BA与宿主代谢表型显著相关。
04
L. murinus ASF361通过表达BSH调控BA
L. murinus ASF361在宿主体重和空腹血糖的预测准确率最高(图3f-g)。他们对KD喂养小鼠进行了L. murinus ASF361灌胃,以检测其是否能逆转KD诱导的代谢变化。与对照组相比,L. murinus ASF361灌胃组的体重和空腹血糖水平没有显著差异(图4a–c)。他们推测KD可能限制了L. murinus ASF361在肠道的定植或生长,因此他们将饮食方式从KD转换为KDM。事实上,灌胃L. murinus ASF361的KDM饲食小鼠在饮食转换的第一天开始增重(图4a),并且在饮食转换后10天,其体重和空腹血糖水平显著高于对照组(图4b-c)。这些数据表明了L. murinus ASF361调节宿主体重和血糖稳态的能力。
他们发现,L. murinus ASF361处理显著降低了血清中TDCA和TUDCA的水平(图4d-e),并增加了盲肠内容物中DCA和UDCA的水平(图4f-g)。在其他四对胆汁酸的水平上没有观察到显著变化(图4h-k)。这些结果表明,L. murinus ASF361可能将TDCA和TUDCA分别转化为DCA和UDCA。
他们对L. murinus ASF361的整个基因组进行了测序,以探索其调节TDCA和TUDCA水平的机制。数据显示,L. murinus ASF361含有一个编码胆汁盐水解酶 (BSH) 的编码序列(图4l),该酶催化共轭胆汁酸中酰胺键的水解。为验证BSH活性,他们将TDCA和TUDCA与厌氧培养的L. murinus ASF361共同孵育2天,并观察到培养基中TDCA和TUDCA显著减少,同时出现DCA和UDCA(图4m–p),表明L. murinus ASF361有效地将TDCA和TUDCA转化为DCA和UDCA。此外,在KD饮食的小鼠的盲肠内容物中,编码BSH基因的丰度显著降低,并且通过蛋氨酸补充得以恢复(图4q)。乳酸菌是CD、KD和KDM处理小鼠之间BSH基因丰度差异的主要驱动细菌(图4r)。为确认微生物BSH的作用,他们用GR-7(一种特定的微生物BSH抑制剂),给KDM饮食的小鼠进行胃灌注,观察到BSH的抑制阻断了蛋氨酸补充对体重和空腹血糖的影响(图4s-t)。
这些数据表明,KD饮食影响了小鼠体内TDCA和TUDCA的循环。KD饮食减少了编码BSH的肠道微生物(包括L. murinus ASF361)的丰度,导致粪便中DCA和UDCA的水平降低,而TDCA和TUDCA的循环水平增加(图4u)。
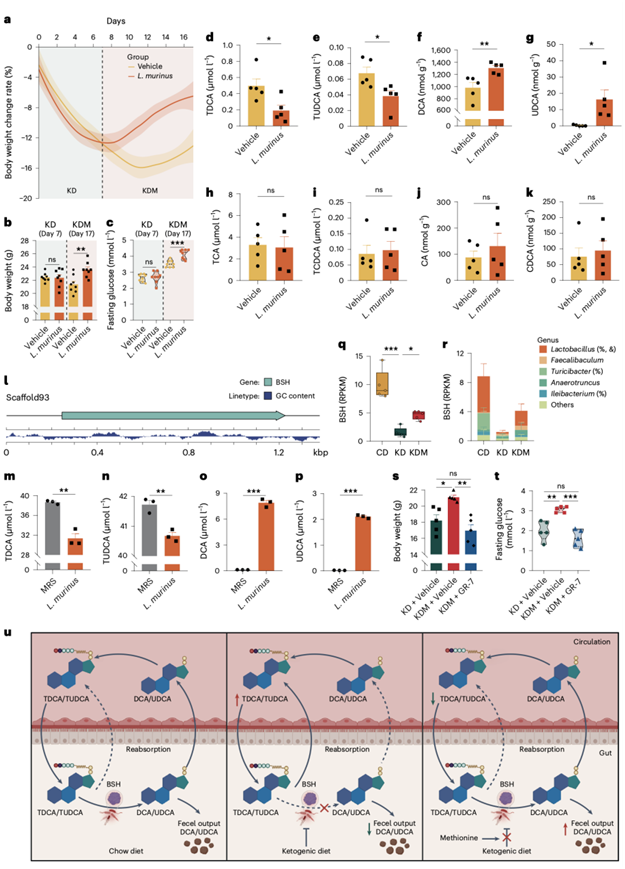
图4. L. murinus ASF361通过表达BSH调节TDCA和TUDCA的结合。
(a) 小鼠相对体重变化。(b-c) 体重和空腹血糖。(d,e,h,i) 血清TDCA、TUDCA、TCA和TCDCA的水平。(f,g,j,k) 第17天盲肠DCA、UDCA、CA、CDCA含量。(g) 显示L. murinus ASF361基因组中scaffold93中的BSH基因的基因箭头图。(m-p) 与L. murinus ASF361体外共培养后培养基中TDCA、TUDCA、DCA和UDCA的水平。(q) 比较宏基因组中BSH基因的总RPKM。(r) BSH基因的分属RPKM。(s-t) 体重和空腹血糖。(u) CD、KD或KDM背景下TDCA和TUDCA的多腔循环示意图。
05
TDCA和TUDCA通过抑制Car1减少脂质吸收
TDCA或TUDCA处理的小鼠粪便中含有比对照组具有更多的能量(图5a-b)。此外,他们用BODIPY标记的脂肪酸灌胃小鼠,然后对肠绒毛进行成像分析。与对照组相比,TDCA或TUDCA预处理的小鼠近端空肠中的荧光强度显著降低(图5c-d)。这些数据表明,TDCA和TUDCA处理降低了肠道对膳食脂肪酸的吸收。
对载药组、TDCA组和TUDCA组小鼠回肠组织的转录组分析(RNA-seq)显示,TDCA和TUDCA处理显著下调了碳酸酐酶(Car) 1的表达(图5e-f),这是一种吸收性肠细胞标志物,也是肥胖的潜在靶点。小鼠回肠组织的定量PCR和CAR1免疫染色验证了RNA-seq的结果(图5g-h)。接下来,他们检测了TDCA和TUDCA是否以细胞自主的方式调节Car1的表达和脂质吸收。与对照细胞相比,tdca处理或tudca处理的Caco-2细胞中Car1 mRNA和蛋白质的表达减少,脂质积累减少(图5i-l)。在体外实验中,用d-苯丙氨酸(一种CAR1激动剂)部分逆转了TDCA和TUDCA引起的体重减轻、空腹血糖水平降低(图5m-n)。这些结构表明,TDCA和TUDCA通过降低Car1的表达抑制肠道脂质吸收,从而导致小鼠体重和空腹血糖水平的降低。
TDCA或TUDCA在治疗肥胖及其并发症方面具有潜力。因此,他们在四种肥胖或糖尿病小鼠模型中检测了这些胆汁酸的效果:饮食诱导的肥胖(DIO)模型、链脲霉素诱导的2型糖尿病(STZ)模型、ob/ob模型和db/db模型。在每个小鼠模型中,他们分别用TDCA、TUDCA或车载剂处理小鼠3周。在所有四个模型中,TDCA和TUDCA处理的小鼠体重较低,空腹血糖水平较低(图5o-v),并且显示出比对照组小鼠更好的葡萄糖耐量。
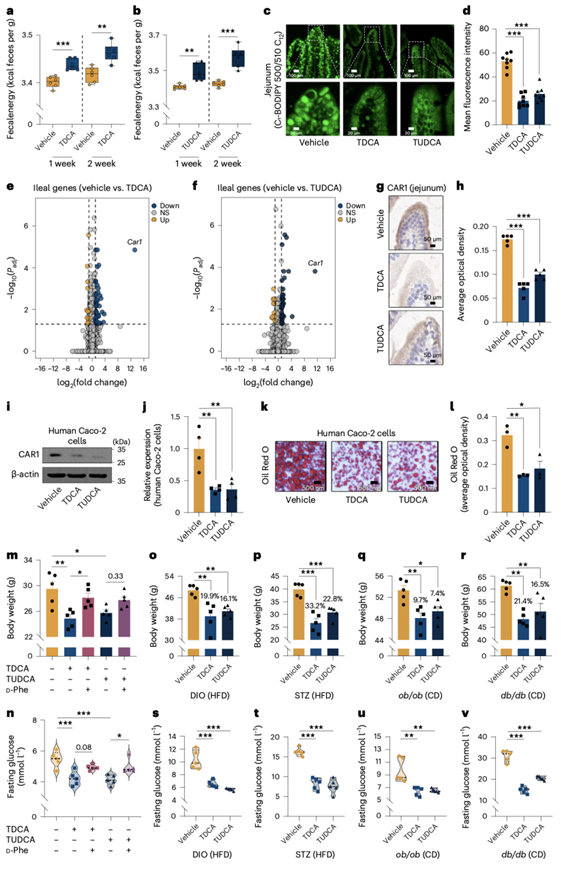
图5. TDCA和TUDCA通过下调Car1抑制肠道脂质吸收,保护小鼠免受肥胖。
(a-b) TDCA处理后第1周和第2周的粪便能量和TUDCA处理后的粪便能量。(c-d) 肠道切片的代表性图像和荧光定量。(e-f) TDCA或TUDCA治疗的小鼠中差异表达的回肠基因的火山图。(g-h) 肠切片CAR1免疫组织化学染色的代表性图像和定量分析。(i-j) 在Caco-2细胞中加入PBS(对照),TDCA或TUDCA后CAR1的蛋白表达和通过调节β-actin对CAR1表达的统计分析。(k-l) Caco-2细胞油红O染色的代表性图像及定量分析。(m-n) 小鼠体重和空腹血糖。(o-r)小鼠体重分析。(s-v)空腹血糖分析。
06
TDCA、TUDCA和微生物bsh与人类的体重指数相关
他们检测了416名自由生活的健康参与者(年龄从20岁到60岁)的血浆和粪便中的ba。DCA和UDCA有两种偶联形式(牛磺酸偶联和甘氨酸偶联)(即TDCA、GDCA、TUDCA和GUDCA)存在于人体内。用GDCA或GUDCA治疗也能降低小鼠的体重和空腹血糖(图S8a-b)。与在动物研究中的发现一致,所有这些共轭DCA和UDCA形式的较低血浆水平与人类较高的体重指数(BMI)或空腹血糖水平显著相关(图S8c)。此外,粪便中相应的未偶联DCA和UDCA水平越高,BMI或空腹血糖水平也越高(图S8c)。这些BA与BMI或空腹血糖水平的相关系数在男性和女性之间存在差异(图6a-b)。
与不超重的参与者相比,超重(BMI≥24 kg/m2)的参与者血浆中偶联DCA和UDCA水平较低,粪便中未偶联DCA和UDCA水平较高(图S8d-i)。其次,他们检测了25名低碳水化合物生酮饮食(LC)干预研究参与者的血浆和粪便BA水平,这些参与者在12周内平均体重减轻5.27 kg。与干预前基线水平相比,LC干预后血浆中TDCA、TUDCA、GDCA、GUDCA水平显著升高,粪便中DCA、UDCA水平显著降低(图6c-h)。
不同的微生物BSH种型具有不同的底物和酶活性。为了确定与人类BMI和空腹血糖水平相关的特定肠道微生物编码BSH,他们从健康参与者的宏基因组中构建了221个推定的BSH分类基因,发现19个单独的BSH基因(18个来自厚壁菌门,1个来自放线菌门)与BMI或空腹血糖水平正相关(图6i)。超重者中这些BSH基因的总丰度明显高于非超重者(图S8j)。这19个BSH基因,他们将其命名为“肥胖相关”BSH基因集,所有假定的BSH基因的中位数相对丰度累计贡献了25.6%(图6j)。每个参与者至少具有这19个BSH基因中的3个。他们对LC干预参与者的宏基因组数据进行了比对,发现LC干预显著降低了这些“肥胖相关”BSH基因的丰度(图6k)。

图S8. DCA和UDCA与BMI和空腹血糖有关。
(a-b) GDCA和GUDCA处理3周后cd喂养小鼠的体重和空腹血糖。(c)相关性分析。(d-g) Raincloud图显示了超重个体和非超重个体血浆中TDCA、GDCA、TUDCA和GUDCA水平的差异。 (h-i) 柱状图显示了超重个体和非超重个体粪便中DCA和UDCA水平的差异。(j) Raincloud图显示了超重个体和非超重个体中微生物“肥胖相关”BSH基因丰度的差异。
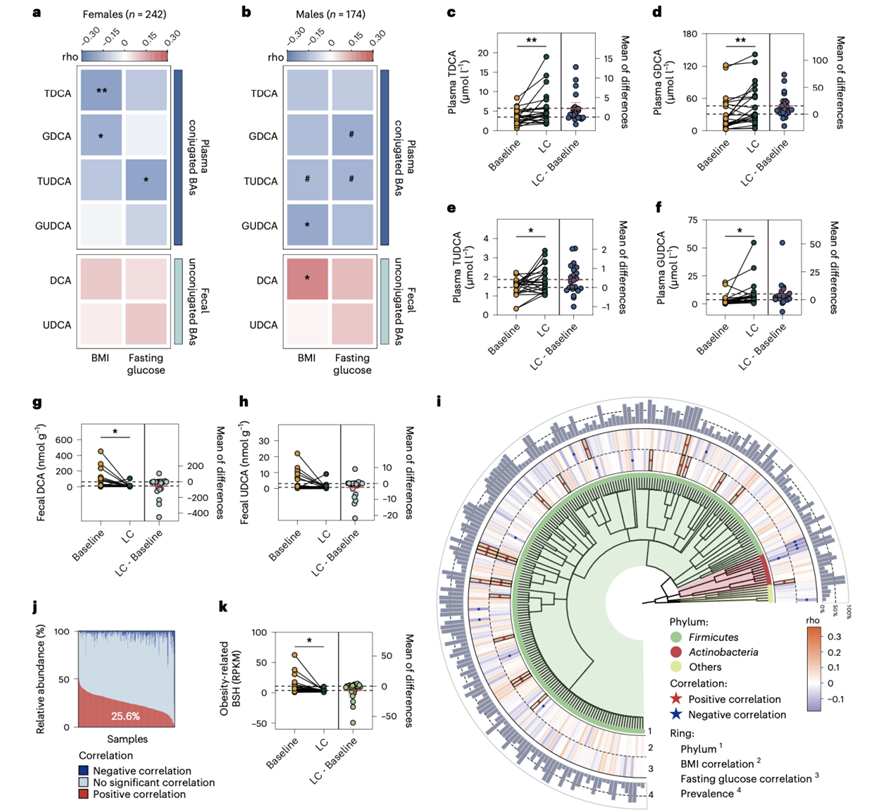
图6. TDCA、TUDCA和微生物BSH与人体BMI和空腹血糖有关。
(a-b) 热图显示男性和女性血浆牛磺酸或甘氨酸共轭DCA和UDCA水平或粪便非共轭DCA和UDCA水平与BMI或空腹血糖的相关性。(c-f) 散点图和估计图显示血浆TDCA、GDCA、TUDCA和GUDCA水平的变化。(g-h) 散点图和估计图显示粪便DCA和UDCA水平的变化。(i) BSH基因丰度与BMI或空腹血糖之间关联的可视化。(j) 100%堆叠条形图显示每个样本中BSH基因的相对丰度,通过与BMI或空腹血糖的相关性分层。(k) 散点图和估计图显示了LC干预12周前后微生物“肥胖相关”BSH基因丰度的变化。
+ + + + + + + + + + +
结 论
本项研究表明 KD 摄入可提高小鼠血清中TDCA和TUDCA的水平,从而降低体重和空腹血糖水平。从机制上讲,KD 喂养会降低L. murinus ASF361的丰度。L. murinus ASF361或 BSH 活性的抑制会增加 TDCA 和 TUDCA 的循环水平,从而通过抑制肠道碳酸酐酶 1 表达来减少能量吸收,最终导致体重减轻。已发现 TDCA 和 TUDCA 治疗可在多种小鼠模型中预防肥胖及其并发症。此外,在一项针对健康人类参与者的观察性研究和一项针对超重或肥胖参与者的低碳水化合物 KD 干预研究中均一致观察到上述胆汁酸、微生物 BSH 和代谢特征之间的关联。总之,本项研究发现了一种独特的宿主-肠道微生物群代谢相互作用机制,即 KD 消耗可降低体重和空腹血糖水平,并证明TDCA 和 TUDCA 是除 KD 之外治疗肥胖及其并发症的两种有希望的候选药物。
+ + + + +



 English
English


