文献解读|Nat Commun(14.7):环境昼夜节律紊乱改变肝脏昼夜节律蛋白质组
✦ +
+
论文ID
原名:Environmental circadian disruption re-writes liver circadian proteomes
译名:环境昼夜节律紊乱改变肝脏昼夜节律蛋白质组
期刊:Nature Communications
影响因子:14.7
发表时间:2024.07.01
DOI号:10.1038/s41467-024-49852-3
背 景
昼夜节律钟是一种细胞自主的、进化保守的计时系统。它已进化为生物体将内部生物节律的每日周期与外部环境条件同步的一种机制。时差、社交时差和轮班等环境因素会扰乱昼夜节律,此类扰动会加速神经、心脏代谢、免疫疾病以及癌症的发生。然而,昼夜节律基因表达系统如何受到轮班和时差等环境昼夜节律紊乱 (ECD) 的影响尚不明确。
实验设计
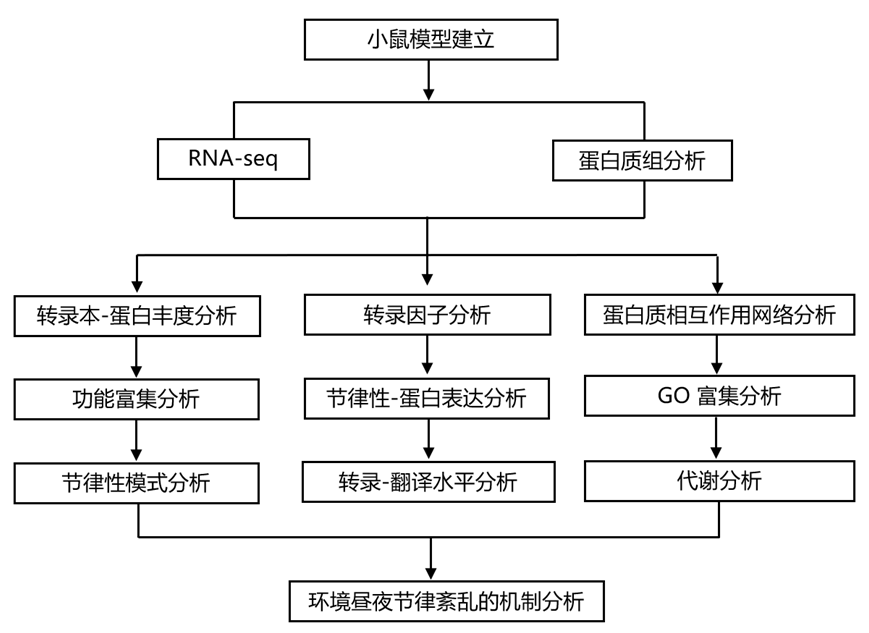
结 果
01
昼夜节律基因表达的拓扑结构
研究团队建立了标准昼夜节律 (STD) 条件下的小鼠和ECD(环境昼夜节律紊乱)小鼠模型,并进行了蛋白质组和转录组分析(RNA-seq)。他们在小鼠肝脏组织中成功地定量了全细胞和细胞核区域中 21061 个转录本时间序列和 7314 个蛋白质时间序列,发现了所有核心时钟 (core clock) 基因的转录本,包括Clock、Arntl、Per1/2/3、Cry1/2、Csnk1d/e和Nr1d1/2(图1a-b)。在 21061 个转录本时间序列中,5502 个(26%)表现出丰度的节律模式,峰值遍布整个周期(图 1c)。在全细胞蛋白质时间序列中,285 个(3.9%)是有节律的。这些蛋白质的峰值丰度呈双峰分布,集中在 CT7 和 CT17 附近。在细胞核区室中,678 个(9.3%)节律性核蛋白表达是有节律的,其周期分布与节律性全细胞蛋白质不同,呈以 CT20 为中心的单峰模式(图 1c)。总的来说,有 6036 个基因在 mRNA、全细胞蛋白质或核蛋白质水平上表现出丰度的节律模式。值得注意的是,只有 22 个基因在这三个水平上都表现出节律性(图 1b)。
转录本丰度的节律性已常规用于推断昼夜节律生物功能,但主要执行基因功能的是蛋白质。为了尽量减少RNA-seq和质谱之间检测水平差异对分析的影响,他们选择了转录组和蛋白质组中转录本和蛋白质相关的基因,然后检测它们在时间和空间上的关系,发现了6937个这样的基因,占所有定量转录本的33%和所有定量蛋白质的95%(图 1d-e)。在该亚群中,有3295个基因在转录本或蛋白质水平上具有节律性。更重要的是,不到5%的节律性转录本具有节律性全细胞蛋白,48%的节律性全细胞蛋白具有节律性转录本(图1f-g)。这些百分比表明大多数节律性转录本与节律性蛋白质不相关,并且大多数节律性蛋白质并非直接源自节律性转录本。节律性转录本和全细胞蛋白质进行GO分析,结果显示不同群体之间的富集通路存在明显差异。富集度最高的聚类(如核苷单磷酸代谢过程和早期到晚期内体运输)在一个节律群体中富集,而在另一个群体中没有富集(图 1h)。此外,许多在关键生物过程中发挥重要作用的基因[如Arntl/Bmal1(昼夜节律时钟建立)、Pgm2l1、Gtf2h2、Txndc9(基础转录)或Gc、Cyp4a14、Gpat4(代谢)]在转录本和蛋白质水平之间也表现出昼夜节律的差异(图 1i)。这些结果表明,转录本的昼夜节律性并不能准确反映其功能形式蛋白质的昼夜节律性。
为了分析亚细胞定位如何影响昼夜节律蛋白质节律,从而影响昼夜节律功能输出,他们检测了全细胞和细胞核昼夜节律性蛋白质之间的重叠。这些蛋白质组来自同一组组织,从组织收集到质谱分析并行处理。94% 的核节律蛋白在全细胞水平上不具节律性(图 1j),这些蛋白质的节律性(称之为 GOR PTA_STD)一定是在翻译后获得的,因为它们在全细胞水平上不具节律性,因此不太可能受到转录、转录后和翻译过程调控。此外,只有 14% 的全细胞节律性蛋白质可以归因于核区室的节律性(图 1k)。其余 86% 的蛋白质必须归因于其他区室的节律性,从而在全细胞水平上重新构建它们的节律性。这些结果表明核昼夜节律蛋白质组是在翻译后出现的。
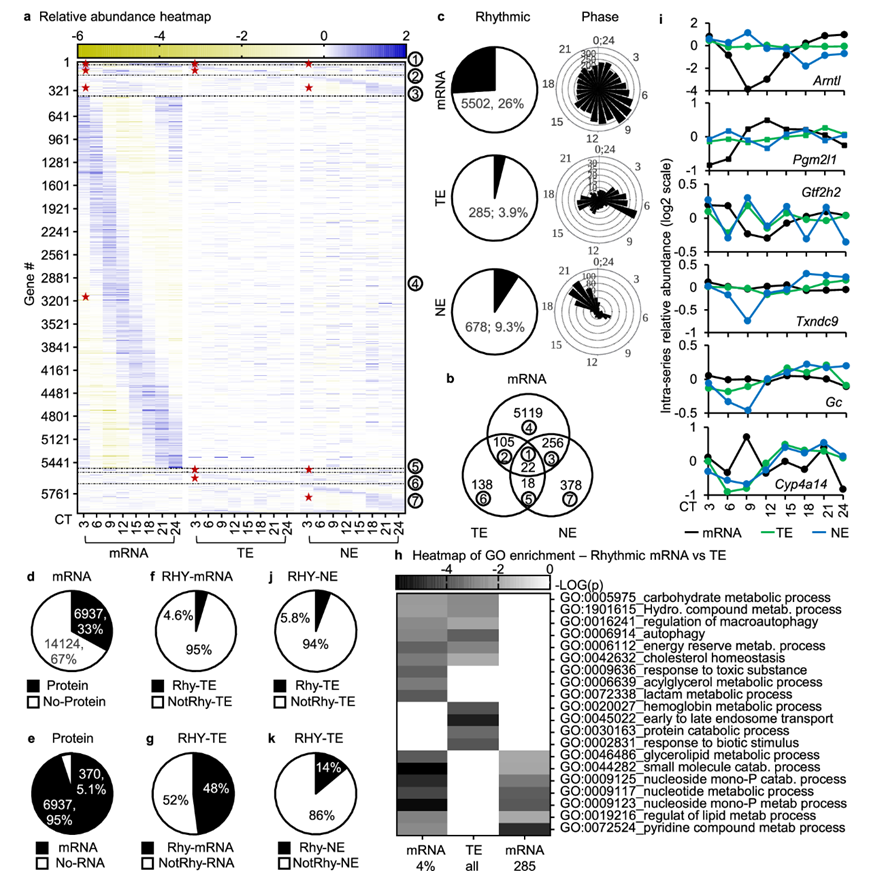
图1. 小鼠肝脏中昼夜节律基因表达的拓扑图。
(a-b) 节律性转录本 (mRNA)、节律性全细胞蛋白 (TE) 和节律性核蛋白 (NE)的相对丰度热图,以及它们重叠的维恩图。(c) 转录本、全细胞蛋白和核蛋白的节律时间序列百分比及其阶段分布。(d-g) 转录本百分比。(h)功能富集分析。(i) 差异转录本、全细胞蛋白质和核昼夜节律模式。(j-k)蛋白百分比分析。
02
ECD 调控了昼夜节律转录组
为了在转录水平上研究 ECD 对昼夜节律基因表达过程的影响,他们对 ECD 后的小鼠肝脏进行了昼夜节律RNA-seq,然后对其节律性转录本群与 STD 下的转录本群进行了比较分析。ECD 后,他们定量了 21061 个转录本时间序列,发现 3445 个(16%)转录本表现出昼夜节律的丰度模式,发现了所有核心时钟基因的转录本。在这些节律性转录本中,1061 个转录本(30.8%)在 ECD 后获得了节律性 (GORR),因为它们在 STD 下是不具有节律性的。其余 2384 个转录本从 STD 到 ECD 都保留了其节律性 (RORR),其中 504 个表现出的周期偏移大于 3 小时的采样时间分辨率。有趣的是,这 504 个 ROR 转录本中,除 1 个外,其余的都表现出阶段提前,与 ECD 节律的移动方向一致。在 5502 个 STD 节律转录本中,3118 个 (56.7%) 也在 ECD 反应中失去其节律性 (LORR )。总的来说,在6563 个节律性转录本中,72% 的节律性发生了改变,包括 64% 的完全改变和 8% 的阶段提前,这些都是在 ECD 反应中发生的。这些节律性种群在整个周期中表现出峰值丰度的分布模式(图 2a-d)。在核心时钟转录本中, Arntl、Per1/2、Cry1和Nr1d1的节律性在阶段或幅度上表现出轻微的扰动,但没有一个具有明显的节律性损失或获得(图 2e)。
因此,这种富集是预期的,也是分析的验证。与前5位std富集顺式元件结合的转录因子依次为ARNTL > ZFP143 > ZSCAN10 > CEBPG > YY2。在ecd节律性群体中,与富集程度最高的顺式元件结合的转录因子为BHLHE40 > ETS1 > ZFP143 > HIF > ZBTB33(图2f)。BHLHE40(也称为 DEC1)及其同源物 BHLHE41(或 DEC2)是已知的昼夜节律转录因子,它们也能够将 BMAL1 从其 E-box 结合位点上逐出,抑制 BMAL1 转录激活活性和对环境扰动的反应。
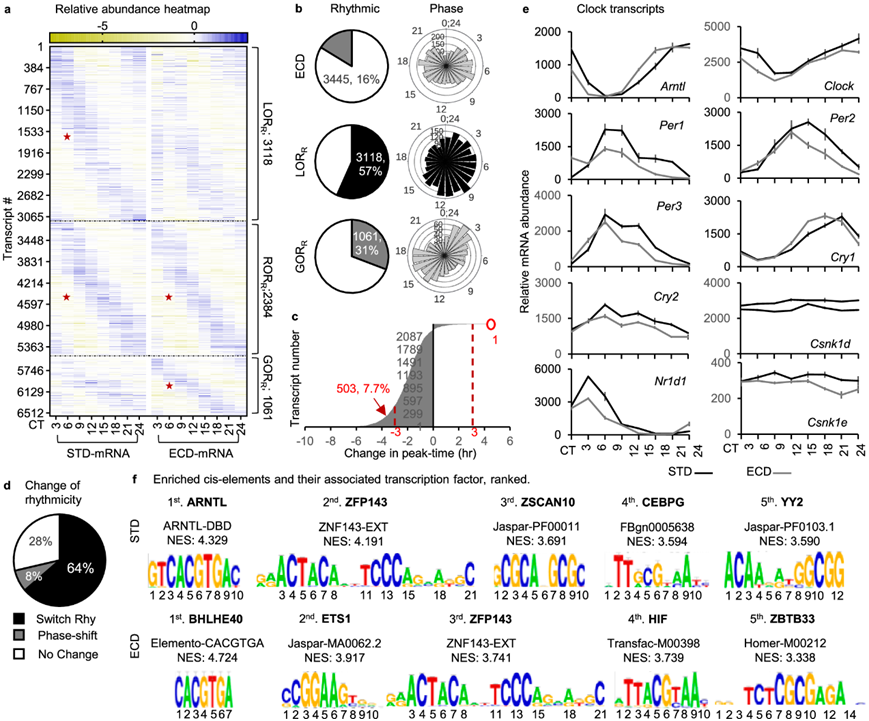
图2. ECD 调控了 4179 个转录本的节律性。
(a) 21061 个转录本中节律性转录本的相对丰度热图。(b) 节律性转录本时间序列的百分比,节律的转录本的相应周期分布。(c) ECD和 STD 之间ROR R群体中阶段的分布。 (d) 响应 ECD 而改变节律性的转录本百分比。(e) 整个昼夜节律周期中 STD 和 ECD 下核心转录本的丰度。 (f) 按标准化富集分数 (NES) 排序的 STD 或 ECD 节律转录本上游 20 kb 内的富集顺式元件的权重矩阵及其相关转录因子。
03
ECD改变昼夜节律全细胞和核蛋白质组
在全细胞水平上,909 个 (17%) 蛋白质表现出昼夜节律丰度模式。这种节律性群体在预计天黑 (CT9) 或黎明 (CT21) 前 3 小时左右显示出峰值丰度的尖锐双峰分布。它们的振幅曲线没有显著差异,p值为 0.5002。在 285 个全细胞 STD 节律性蛋白中,只有 24 个在 ECD 后也具有节律性 (RORTE)。261 个蛋白质(占 STD 节律蛋白的 92%)失去节律性 (LORTE),而 885 个蛋白质(约为 STD 节律蛋白数量的 3 倍)在响应 ECD 时获得了节律性 (GORTE)(图 3 a-e)。总的来说,ECD 改变了 1146 种蛋白质的节律性,这些蛋白在全细胞蛋白质水平上占两种条件下所有节律性蛋白质的 98%(图 3f)。
在细胞核区室中,359 个(7%)蛋白质时间序列是有节律的,它们的阶段分布在整个周期的很大一部分。678 种 STD 节律蛋白质中,633 种(93.4%)在 ECD 反应中失去了节律性(LORNE),而 314 种蛋白质获得了节律性(GORNE)。总共有 992 种蛋白质在细胞核区室中表现出节律性的丰度模式,其中 95% 的蛋白质在 ECD 反应中改变了它们的节律性(图 3b-f)。总体而言,在 STD、ECD 或两种条件下,分别有 12.7%、23.8% 和 33.5% 的蛋白质是有节律的(图 3g)。
为了探究昼夜节律蛋白质组的转换节律性是否与蛋白质表达水平相关,他们检测了 STD 和 ECD 之间整个昼夜节律周期内整体蛋白质丰度的百分比变化。与所有蛋白质相比,STD 节律群体或 ECD 节律群体的变化百分比分布曲线在全细胞或细胞核区室水平上没有显著差异。但是对转录组的类似分析表明,STD 节律或 ECD 节律转录本群体与全转录本群体之间存在显著差异(图 3h)。因此,ECD 改变了蛋白质的节律性,而不会改变群体范围内的累积每日丰度。昼夜节律转录组和昼夜节律蛋白质组之间转换节律性与表达水平关联的差异可能反映了它们节律性积累的分子基础的差异:转录本丰度的变化主要与新合成的转录本有关,而蛋白质丰度变化主要涉及合成后的转录后或翻译后加工。
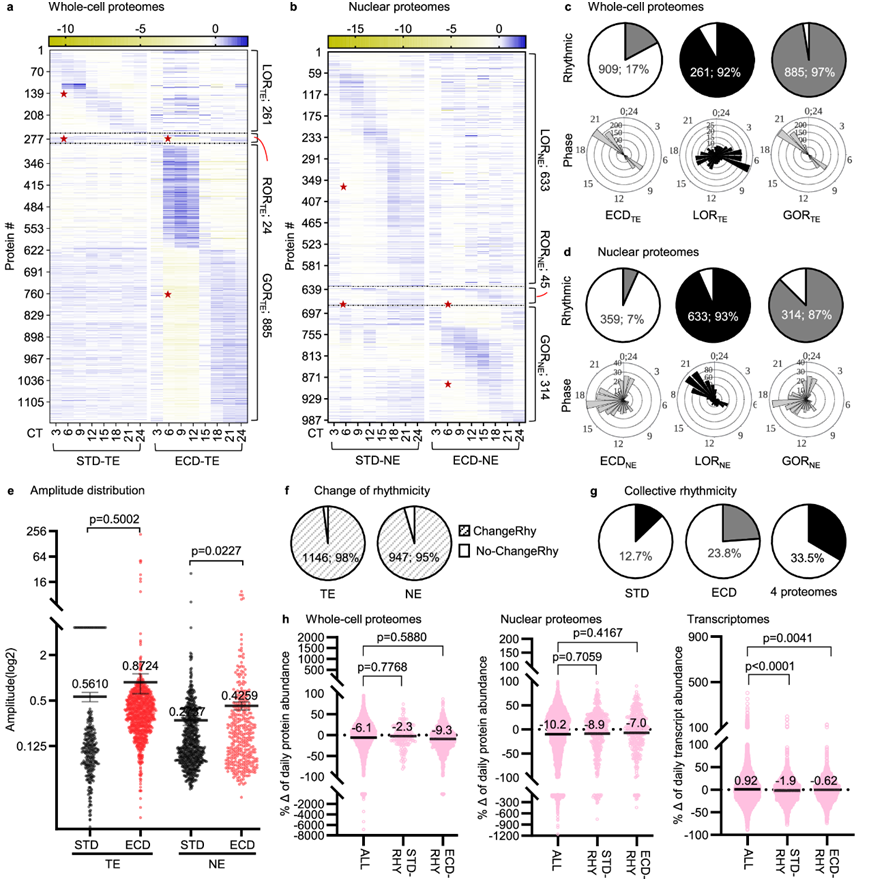
图3. ECD 调控昼夜节律全细胞 (TE) 和核 (NE) 蛋白质组的节律。
(a-b) STD 相比,ECD 下全细胞或核蛋白质组中节律性蛋白质的相对丰度热图。(c-d) 全细胞 (TE)或细胞核 (NE)昼夜节律蛋白质组中节律性蛋白质时间序列的百分比和相应的周期分布。(e) 所有 4 种昼夜节律蛋白质组的比较振幅。(f) 在全细胞或核区室水平上改变节律性的所有蛋白质的百分比。(g) 节律性蛋白质的百分比。(h) 所有STD 节律和 ECD 节律群体之间响应 ECD 的全细胞蛋白质组、核蛋白质组或转录组的累积每日丰度变化的比较分布。
04
ECD 调控昼夜节律蛋白质组
ECD 之后,他们定量了与5028 个转录本有关的全细胞蛋白质和细胞核蛋白质(图 4a-c)。在 5028 个亚群中,73% 的节律性全细胞蛋白质没有节律转录本(图 4d-e)。这一比例明显高于 STD 下的 52%。在细胞核节律性蛋白质亚群中,86% 在全细胞蛋白质水平上没有节律(图 4f-g)。这些蛋白质的节律性是在翻译后获得的(GOR PTA_ECD),类似于 GOR PTA_STD群体。因此,ECD 后转录是全细胞蛋白质节律性的主要贡献者,而翻译后加工是核蛋白质节律性的主要贡献者。
为了探究转录后对昼夜节律全细胞蛋白质组的贡献,他们在STD或ECD下转录本和全细胞蛋白都有节律的基因群体中检测了节律性、幅度变化特性。在基因表达过程中,转录本的平均半衰期为4.8分钟,其在蛋白质表达之前产生。因此,在对转录贡献较大的节律性基因群体中,转录期领先于蛋白质期的基因比例高于转录期落后于蛋白质期的基因比例。他们发现在 STD 下该比例为 ~4:1,但在 ECD 后为 ~ 1:1(图 4h)。
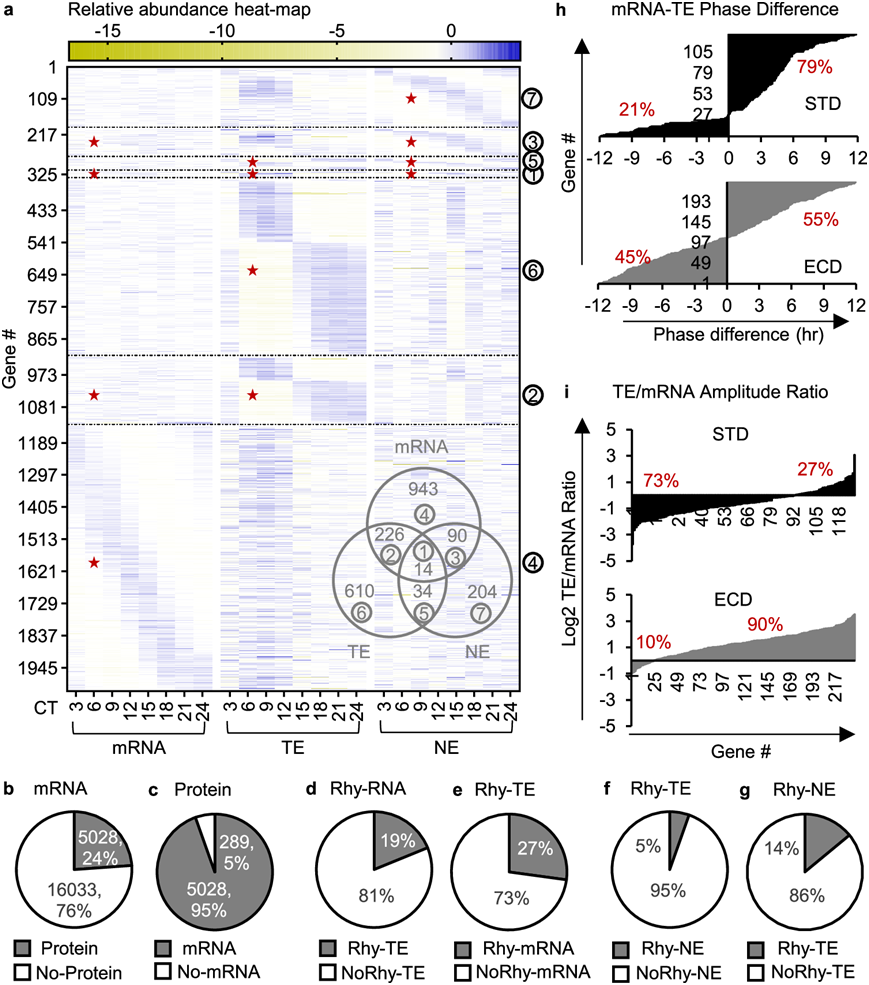
图4. ECD 条件下分析昼夜节律基因表达。
(a) 在 ECD 下定量 5028 个基因的节律性转录本、节律性全细胞蛋白和节律性核蛋白的相对丰度热图。(b-c) 蛋白质的转录本的百分比。 (d-e) 节律性全细胞蛋白的节律性转录本的百分比。(f-g) 节律性核蛋白的全细胞蛋白的百分比。(h) 在STD 或 ECD 下,转录本阶段领先或滞后全细胞蛋白阶段的基因百分比。(i) 在 STD 或ECD下,全细胞蛋白质节律幅度低于或高于相应转录本节律的基因百分比。
05
核蛋白质进出口过程与核昼夜节律蛋白质相关
核蛋白质进出 (PNIE) 过程是核蛋白质丰度的主要贡献者,核定位和输出序列 (NLS/NES) 是核进出口过程的关键组成部分。同时含有 NLS/NES 序列的核蛋白很可能利用 PNIE 过程进出细胞核。STRING分析显示,虽然 GOR PTA_STD群体中的 46 种含 NLS/NES 的蛋白质表现出高度的功能相互作用网络,蛋白质-蛋白质相互作用 (PPI) 富集p值小于 1.0e−16,在全细胞节律性群体中,功能相互作用网络没有发生富集(图5a-b),ECD后也观察到类似的结果(图5c-d)。这些结果表明,在 STD 和 ECD 条件下,核蛋白质进出过程与核昼夜节律蛋白质组之间存在密切关联。然而,它们并不排除其他过程(如蛋白质降解)的贡献,蛋白质降解也部分发生在细胞核中。
鉴于已经确定了核昼夜节律蛋白质组与 PNIE 过程之间的关联,他们随后检测了与该过程有关的所有蛋白质,探究在核区室中有节律的蛋白质。在所检测的 251 种蛋白质中,发现 5 种(LMNA、PHB2、PIK3R1、PPP3CA、RAN)和 2 种(CSE1L、SQSTM1)在 STD 或 ECD 下分别在核区室中有节律。在这 7 种蛋白质中,RAN 和 CSE1L(也称为 CAS)尤为突出。虽然两者都是 PNIE 过程的重要组成部分,但 RAN 主要调节蛋白质的输入,而 CSE1L 调节蛋白质输出。更重要的是,在核区室中,RAN 在 STD 下有节律,但在 ECD 后失去了节律,而 CSE1L 则相反。在 STD 下,两者在全细胞水平上都不具有节律性(图 5f)。这些结果表明,在正常条件下,RAN 在进入细胞核时获得节律性,而在 ECD 反应中则丧失节律性,而 CSE1L 仅在 ECD 中在细胞核区室中获得节律性。因此,这些蛋白质分别在 STD 下或 ECD 后是细胞核节律性蛋白质组的关键调控分子(图 5e-f)。
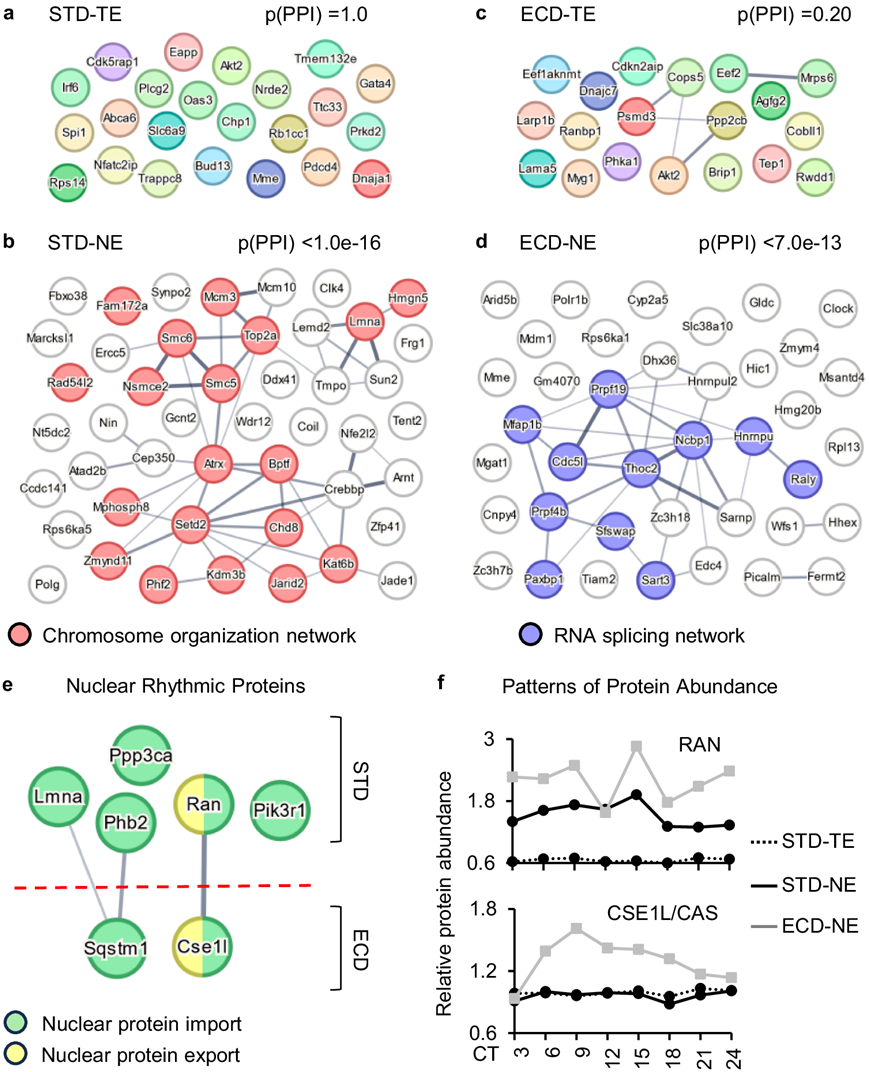
图5. 核蛋白质进/出与核昼夜节律蛋白质组的关联。
(a-d) 功能性蛋白质相互作用网络分析。 (e) 在STD 或 ECD 下在核区室中有节律性的 PNIE 涉及蛋白质。 (f) 在整个昼夜节律期间在 STD 和 ECD 下全细胞和核区室水平上 RAN 或 CAS 的蛋白质丰度比较。
06
ECD 改变了昼夜节律分子功能
由于蛋白质是基因的功能分子,并且转录本和蛋白质的昼夜节律之间关联较弱,因此他们通过对有节律的全细胞蛋白质群进行分析,以评估 ECD 对昼夜节律功能的影响。单独对 ECD 节律群体进行的GO富集分析表明,它富含许多已知的 ECD 相关通路,包括白细胞介素 6 的产生、C 型凝集素受体(适应性免疫系统)、KRAS(受体酪氨酸激酶信号传导)、TP53(FGFR 信号传导)或 GnRH(HIV 1 感染)(图6a)。该群体还富含许多过程,其中 mRNA 剪接、线粒体膜电位调节和受体酪氨酸激酶信号传导(图 6a)。
STD 节律与 ECD 节律全细胞蛋白质群之间的GO 富集分析表明,一些对昼夜节律功能很重要的通路发生富集,这些通路包括对外部和生物刺激的反应、消化、胰高血糖素信号通路和自噬,它们在 ECD 反应中有所降低。另一方面,还有其他几个过程,包括适应性免疫系统、肽代谢、TP53 调节转录和各种细胞内运输,在响应条件变化时发生了富集(图 6b)。大多数这些富集过程都发现于 ECD 富集过程中,这与节律性增益作为昼夜节律蛋白质组的主要贡献者相一致。在节律性发生显著变化的蛋白中,有些调节因子发生了改变,包括与昼夜节律相关的因子,如PRMT5、SRSF6、XRCC5 (mRNA加工)、RPLP0、EIF5、EIF4EBP2(翻译起始)、HRAS、AKT2(Ras信号传导)、SEC61B、ip9、EXOC6(蛋白质运输)(图6b-c)。此外,他们还发现与昼夜节律中断有关的几个基因的表达在全细胞或核蛋白水平上表现出模式变化以响应ECD,如KRAS、HSF1、SREBF1、CTNNB1、NFIL3和IRF8。
鉴于肝脏在代谢中的核心作用,他们仔细研究了 ECD 对代谢功能的影响。通过分析代谢通路的富集和网络相互作用,他们发现脂肪酸和羧酸代谢过程的富集程度减弱,而氨基酸代谢过程(在 STD 下也得到了富集)的富集程度显著增加(图 6d-e)。这些结果表明,在响应 ECD 时,昼夜节律调节的优先顺序从碳水化合物和脂肪代谢转变为蛋白质代谢。脂肪和碳水化合物代谢的丧失可能至少部分是 ECD 相关代谢紊乱的根本原因。
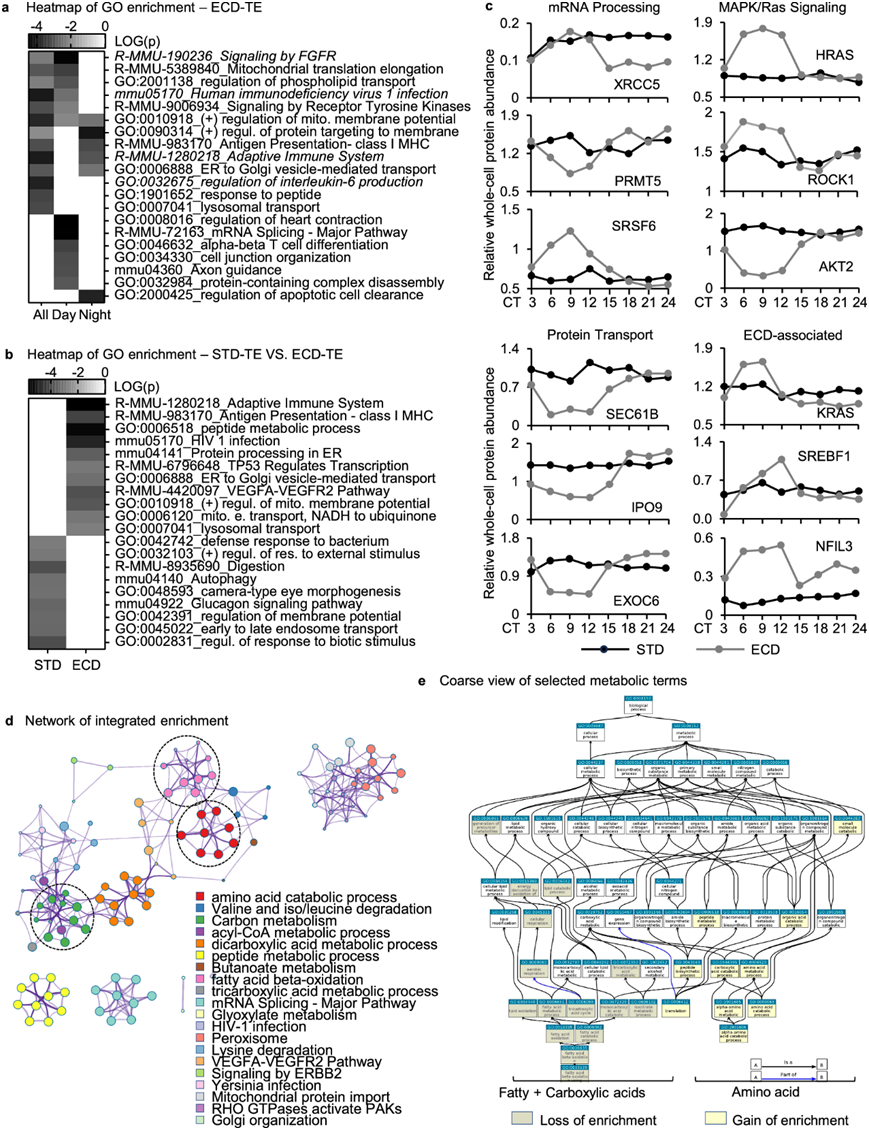
图6. GO 富集分析。
(a-b) GO 富集分析热图。(c) mRNA 加工、RTK/Ras 信号传导、蛋白质转运和 ECD 相关的代表性因子在整个昼夜节律周期中的全细胞蛋白质丰度比较。(d)富集分析。(e) Slim图显示与脂肪酸、羧酸和氨基酸相关的肽类的富集变化。
+ + + + + + + + + + +
结 论
本项研究对正常和 ECD 条件下肝脏昼夜节律基因表达进行了全面分析,ECD 改变了 64% 转录组、98% 全细胞蛋白质组和 95% 核蛋白质组的节律性。这种改变与昼夜节律调节顺式元件、RNA 加工和蛋白质定位的变化有关,它削弱了脂肪和碳水化合物代谢的昼夜节律调节,并且在 ECD 恢复一周后仍会持续存在。
+ + + + +



 English
English


