文献解读|Hepatology(12.9):脂质代谢重编程的全面分析拓展了 HCC 的精准医疗
✦ +
+
论文ID
原名:Comprehensive profiling of lipid metabolic reprogramming expands precision medicine for HCC
译名:脂质代谢重编程的全面分析拓展了 HCC 的精准医疗
期刊:Hepatology
影响因子:12.9
发表时间:2024.06.19
DOI号:10.1097/HEP.0000000000000962
背 景
肝癌是全球第二大癌症相关死亡原因,而治疗选择有限。原发性肝细胞癌(LIHC 或 HCC)占所有肝脏恶性肿瘤的 85%–90%。HCC 通常与由慢性肝病(例如 HBV 或 HCV 病毒感染和代谢相关脂肪肝疾病)引起的严重肝纤维化或肝硬化有关。由于疾病背景、肿瘤微环境和种族群体的差异,HCC 表现出明显的异质性。因此,迫切需要确定该疾病的关键驱动因素并寻找诊断和治疗的潜在靶标。
实验设计
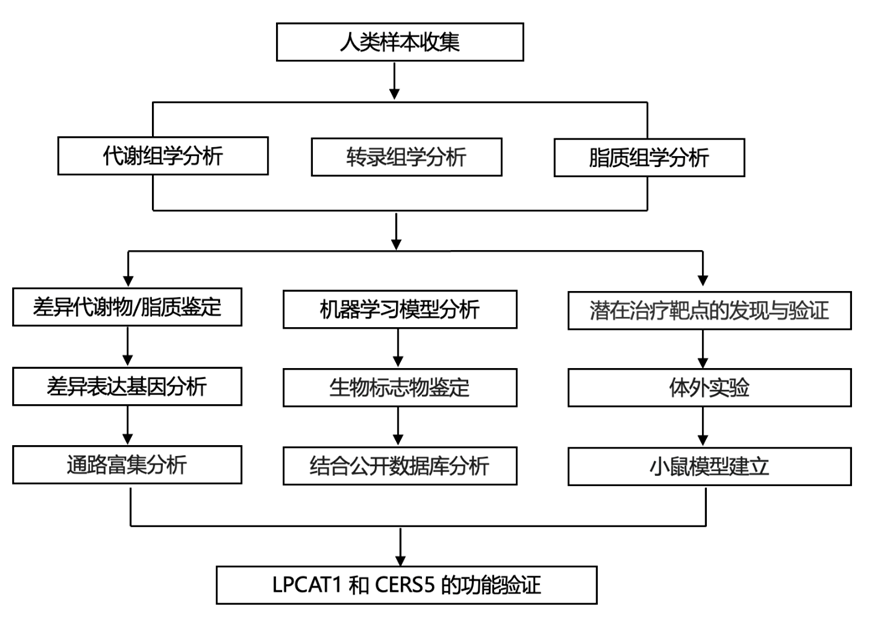
结 果
01
肝细胞癌极性代谢组、脂质组和转录组的综合分析
为了全面分析 HCC 中的细胞代谢,研究团队收集了 48 对高质量肿瘤组织 (TU) 和邻近正常组织 (NT) ,并进行了代谢组、脂质组和转录组分析(图1A)。他们采用靶向方法注释了总共 353 种极性代谢物,而采用非靶向方法注释了 3508 种脂质(图 1B),同时还确定了 19102 个基因,其中 5268 个差异表达基因(DEG)在 TU 和 NT 组中表现出显著差异(图1C)。
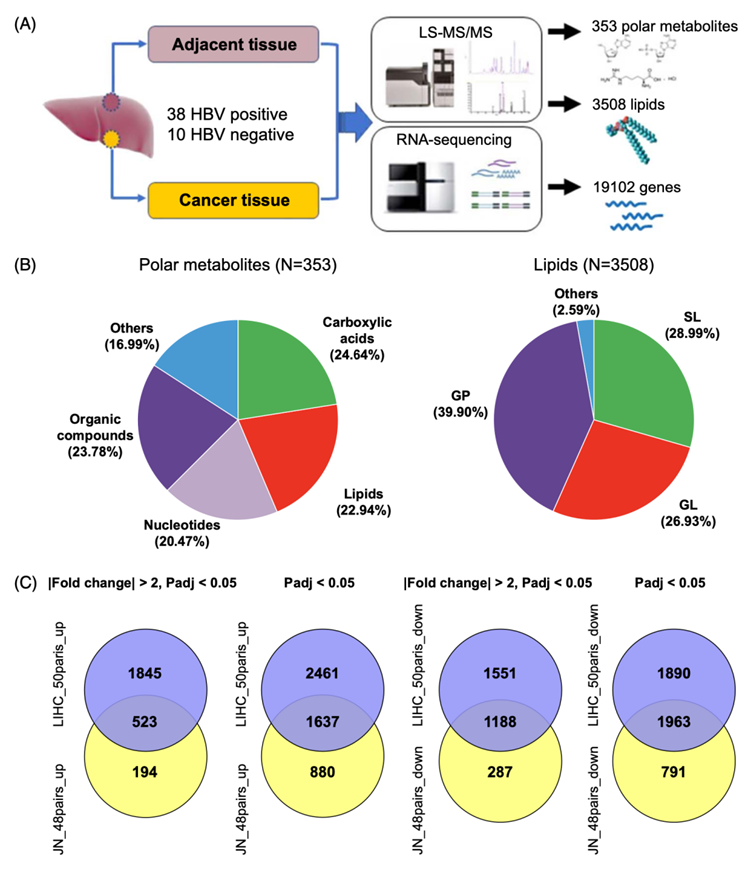
图1. HCC 代谢组、脂质组和转录组分析概述。
(A)示意图表示通过实施多组学方法进行的样本和分子识别。(B)本项研究中注释的代谢物和脂质类别的数量和比例。(C) JN_48pairs 队列和 TCGA LIHC_50pairs 队列之间的 DEG 比较。
02
转录组代谢分析揭示了肝细胞癌组织的异常代谢特征
根据差异表达分析,与附近的非肿瘤组织相比,肿瘤组织中有 2517 个基因上调,2751 个基因下调。结合KEGG分析,HCC 肿瘤组织中上调的 DEG 富集度很高。具体而言,这些 DEG 与细胞周期、DNA 复制和细胞外基质-受体相互作用显著相关,所有这些都与致癌作用有关(图 2A)。HBV 阳性样本仅与 microRNA 和衰老通路有关,而 HBV 阴性样本与孕激素介导的卵母细胞成熟通路更相关。有趣的是,无论 HBV 感染状况如何,表现出表达水平降低的 DEG 主要与代谢过程有关,例如碳代谢、脂肪酸代谢和药物代谢通路(图 2A)。
通过靶向代谢组学分析,他们鉴定出 353 种极性代谢物。其中,62 种代谢物的子集在肿瘤组织和正常组织之间表现出显著的丰度变化。KEGG分析显示,失调的代谢物在 HCC 中的 ABC 转运蛋白、中心碳代谢、胰高血糖素信号通路、胰岛素信号通路和甘油磷脂代谢通路中富集(图 2B)。在将肿瘤组织与正常组织进行比较时,检测到亚油酸、琥珀酸、鞘磷脂 (SM)、磷酸胆碱和乙酰肉碱水平的显著变化,表明脂质代谢发生了重大改变。
肿瘤样本中参与糖酵解和戊糖磷酸通路的关键酶的表达水平显著增加,而与糖异生相关的基因均下调(图 2C)。值得注意的是,下调的基因主要参与线粒体脂肪酸 β-氧化(例如CPT2、ACADS和ACADL)和过氧化物酶体 β-氧化(ACOX1、ACOX3和ACSS2)。参与替代 ω-氧化通路的基因(CYP4A11、ACAA1和ADH)的表达下调,这表明 HCC 细胞表现出利用脂肪酸产生能量的能力受损(图 2C)。相反,从头脂肪生成基因(包括LPL、FASN、ACSL和PPARγ)的上调表明肿瘤组织中的脂质生物合成发生激活。参与胆固醇和类固醇生成的重要基因(如 NPC2 和 SOAT2)在 HCC 肿瘤标本中高表达(图 2C)。他们检测了负责编码参与甘油磷脂、甘油脂和 SL 代谢的酶的基因的表达。基因表达分析显示,CERS5和LPCAT1-4在 HCC 样本中显著上调。相反, LPIN、PEMT和DGAT的表达水平显著下调(图 2C),这些数据表明这些脂质物种中存在潜在的代谢紊乱。
在LIHC_50pairs 队列和 JN_48pairs 队列之间,他们观察到酒精中毒、病毒致癌和癌症转录失调等通路的差异,这可能是由于种族和生活习惯的差异造成的。有趣的是,在这两个队列中,HBV 阳性和 HBV 阴性样本之间没有显著差异。这些结果与转录组-代谢组分析相结合,强调了葡萄糖和脂质代谢功能障碍作为 HCC 的主要特征的重要性(图 2D)。
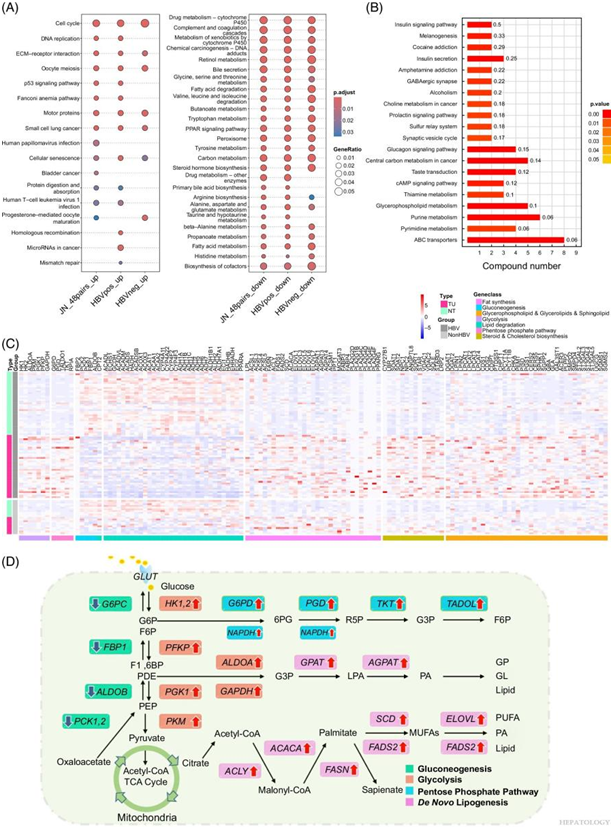
图2. 转录组-代谢分析说明了 HCC 中代谢重编程的特征。
(A) 根据来自 HCC 的转录组数据,KEGG 通路中上调基因(左)和下调基因(右)。 (B) 使用基于丰度评分的方法,通过肿瘤和正常组织之间的差异代谢物进行通路分析。 (C)差异表达基因的热图和定量分析。 (D) HCC 组织中异常葡萄糖和脂质代谢特征的示意图。
03
鉴定 HCC 的潜在诊断/预后生物标志物
他们使用随机森林方法从代谢基因表达数据创建机器学习模型。随后,在 LIHC_50pairs 队列中检测了建立的模型(图 3A)。使用受试者工作特征曲线评估性能,得出的 AUC 为 0.967(95% CI:0.9483-0.986)(图 3A),表明该模型具有预测功效,可以作为 HCC 的预后工具。他们发现了一些重要的基因,根据其准确性或基尼系数按降序排列。值得注意的是,这些基因在脂肪酸β-氧化、ω-氧化、脂肪酸吸收和酰化中起着至关重要的作用(图3B)。 Cox分析和TCGA数据库显示,这些显著失调的基因对HCC患者的总体生存有显著影响(图3C-D)。基因列表还显示,HCC肿瘤样本中大量糖酵解和戊糖磷酸通路基因上调,影响HCC患者的生存(图3C)。
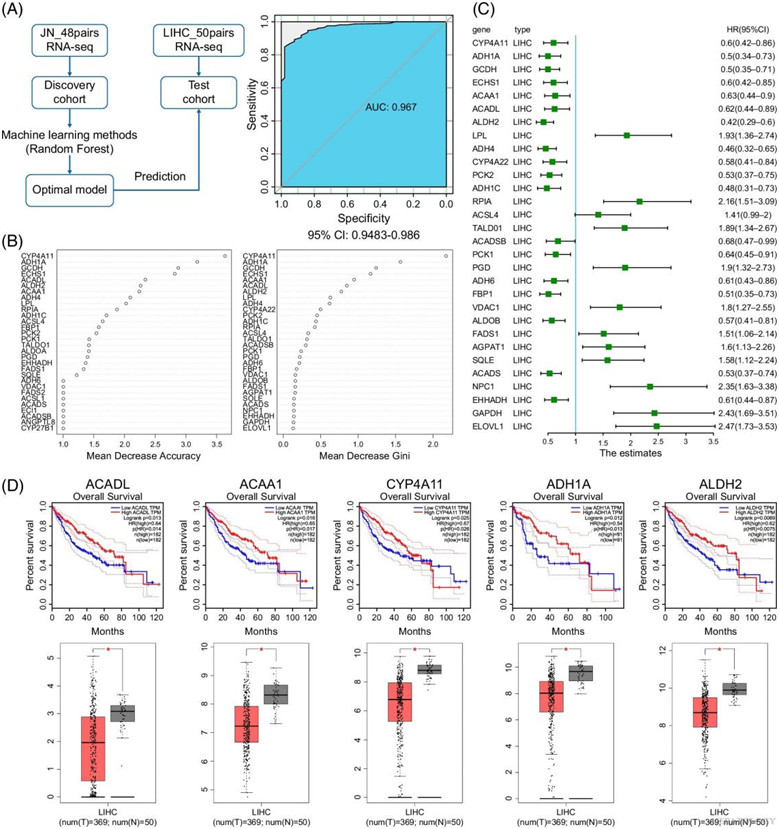
图3. 机器学习方法识别出 HCC 的代谢诊断生物标志物。
(A)该流程展示了随机森林方法的利用,该方法是使用发现队列和测试队列开发的,用于识别表现出高效率的诊断生物标志物。(B)排序靠前的基因对随机森林模型的贡献。(C)对模型中识别出的基因进行 Cox 分析。(D)感兴趣的生物标志物的表达水平及其与 HCC 预后的关联。
04
肝细胞癌的异常脂质代谢情况
转录组学结果表明 HCC 中甘油磷脂、SL 和甘油脂的代谢通路存在失调(图 2)。随后,进行非靶向脂质组学分析以证实 HCC 和正常组织中脂质代谢的改变。肿瘤组织中磷脂酰甘油、磷脂酰胆碱 (PC)、脂肪酸、乙酰辅酶A、神经酰胺、己糖基神经酰胺、单唾液酸神经节苷脂和胆固醇酯等脂类的含量较高。然而,肿瘤组织中三酰基甘油(TG)和鞘氨醇(Sph)的富集程度有所降低(图 4A)。他们在HCC肿瘤组织中发现了长链TG的显著减少(图4B-E)。在正常组织中主要观察到含有多不饱和脂肪酸的 PC,而肿瘤组织中含有饱和脂肪酸的 PC (SFA-PC) 和含有单不饱和脂肪酸的 PC 的丰富度较高(图 4C-F)。具体而言,这些结果表明神经酰胺及其衍生物,尤其是己糖神经酰胺和长链 SM,表现出明显的失调(图 4D-G)。相反,HCC 肿瘤组织中超长链 SM 的水平降低或没有变化(图 4G)。
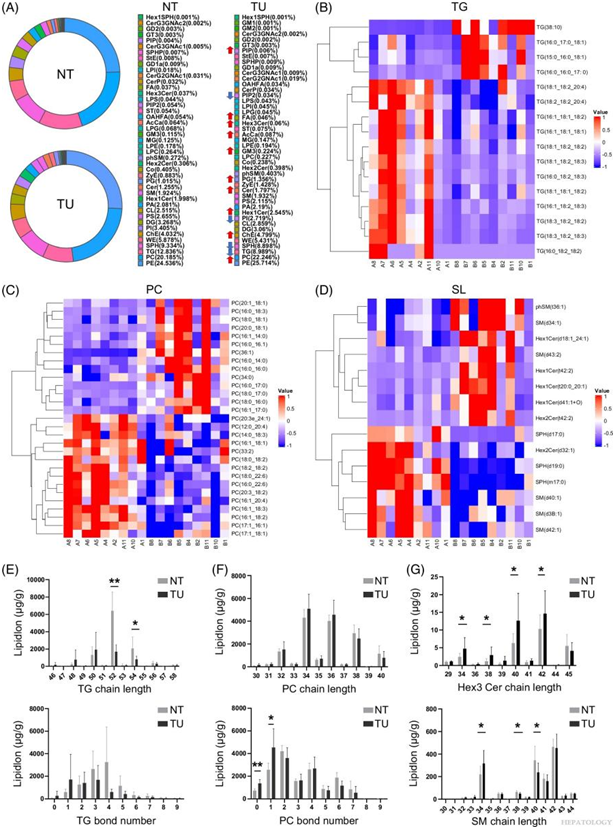
图4. HCC 异常脂质代谢图。
(A) HCC 肿瘤 (TU) 和正常组织 (NT) 中脂质类别的分布以饼图和总脂质百分比表示。(B-D)热图显示 NT(A1-A11)和 TU 组织(B1-B11) 中具有显著差异 (VIP >1) 的 TG 脂质、PC 脂质和鞘脂。(E) NT 和 TU 组织中 TG 的差异链长和键数。(F) NT 和 TU 组织中 PC 的差异链长和键数。(G) NT 和 TU 组织中 Hex3 Cers 和 SM 的差异链长。
05
验证LPCAT1作为 HCC 的潜在治疗靶点
与 PC 相关基因的失调一致(图 5A),脂质组学研究显示在 HCC 肿瘤组织中 SFA-PC 物种[包括 PC(32:0) 和 PC(34:0)]的丰度显著增加(图 5B)。然而,虽然磷酸胆碱在HCC肿瘤组织中积累,但并未导致PC种类的普遍增加。溶血磷脂酰胆碱酰基转移酶1 (LPCAT1) 优先将饱和酰基添加到溶血磷脂酰胆碱的sn-2位置,从而改变受体酪氨酸激酶EGFR/c-MET的功能,促进肿瘤的发展。转录组和定量逆转录PCR分析证实了TCGA数据库中LPCAT1在HCC肿瘤组织中表达上调(图5C)。根据TCGA数据库,高水平的LPCAT1表达与不良的预后结果相关(图5D)。使用HCC组织和细胞系的免疫印迹验证LPCAT1的蛋白质丰度(图5E)。
他们使用shRNA抑制肿瘤细胞中的LPCAT 1促进细胞凋亡(图5F)。同时,在LPCAT1敲低后观察到HCC细胞系中DNA复制和细胞周期明显停止(图5G-H)。免疫印迹分析的结果证实,抑制LPCAT1导致EGFR,蛋白激酶B (AKT) 和ERK1/2的磷酸化水平显著下降(图5I)。通过探针荧光测量,他们发现当LPCAT1受到抑制时细胞膜流动性增加(图5J)。体内实验还表明,LPCAT1的下调导致裸鼠皮下植入肿瘤时肿瘤体积减小(图 5K)。
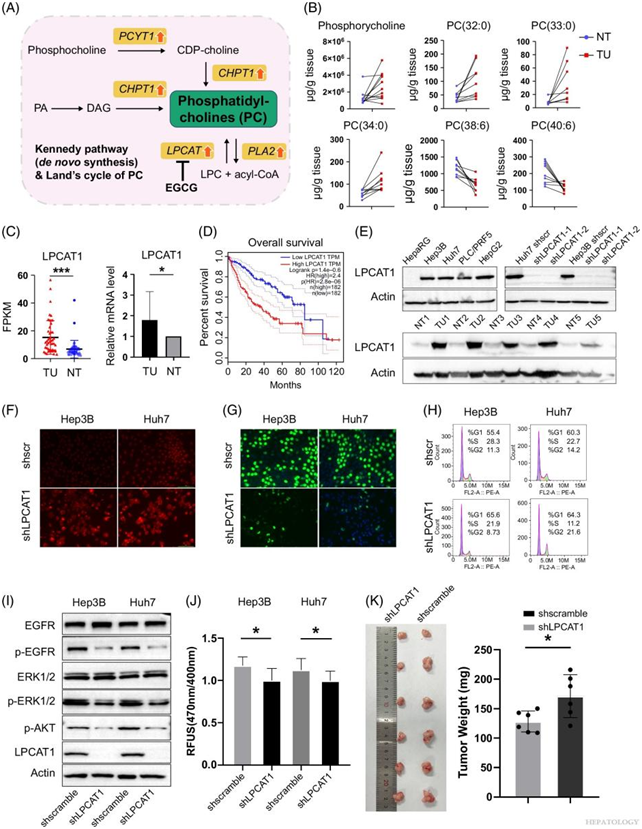
图5. 靶向LPCAT1可抑制 HCC 细胞系增殖并诱导其凋亡。
(A) PC 生物合成通路示意图。PC 的动态合成(Kennedy 通路)和重塑(Land 循环)会导致特定 PC 物种的积累。(B)HCC 肿瘤和正常组织中磷酸胆碱和代表性 PC 物种的富集。(C) HCC 样本中LPCAT1 mRNA 的表达。(D) LPCAT1 的表达水平及其与 HCC 预后的关系。(E) HCC 样本和细胞系中 LPCAT1 蛋白的表达。(F) TUNEL 分析表明敲低LPCAT1 导致 Huh7 和 Hep3B 细胞凋亡。(G) EdU 掺入显示对照 Huh7 和 Hep3B 细胞或敲低LPCAT1的细胞中出现 DNA 重复。 (H)流式细胞分析显示对照细胞或敲低LPCAT1的细胞中细胞周期的变化。(I)免疫印迹显示对照细胞和敲低LPCAT1的细胞中EGFR、磷酸化EGFR、ERK1/2、磷酸化ERK1/2、磷酸化AKT和LPCAT1蛋白的表达。(J)LPCAT1敲低细胞和对照细胞的膜流动性。(K)敲低LPCAT1显著抑制了皮下植入小鼠模型中Huh7衍生的异种移植瘤形成。
06
CERS5 衍生的 SL 是肝细胞癌中脂肪吞噬的关键调节剂
癌症代谢重塑的一个显著特征是“鞘脂变阻器”(Sphingolipid Rheostat)发生变化(图 6A)。HCC 肿瘤组织内鞘氨醇水平下降,同时神经酰胺衍生物积累(图 4)。转录组研究表明,HCC 肿瘤组织中神经酰胺合酶基因CERS2和CERS5的表达显著增加(图 2C)。这一发现表明 HCC 中 SL 的代谢发生了重大改变。鉴于神经酰胺合酶基因 (CERS5) 表现出最高的上调并且似乎对 HCC 有显著影响,他们进行了实验研究以探索 CERS5 的具体作用。与非肿瘤或正常肝细胞系 HepaRG 相比,HCC 肿瘤组织和细胞系(即 Huh7、Hep3B、HepG2 和 PLC/PRF5)中 CERS5 蛋白和 mRNA 的表达水平升高(图 6B-C)。根据 TCGA 数据库,HCC 中 CERS5 高表达与不良预后结果相关(图 6D)。
CERS5敲低导致细胞生长显著下降(图 6E),CERS5 抑制伴随着 LC3BII 形成障碍,表明CERS5衍生的神经酰胺在自噬中起着至关重要的作用(图 6F)。用 DAPRed 荧光分子和 BODIPY493/503 染色也显示在CERS5敲除细胞中自噬通量不足以及自噬体与脂滴共定位(图 6G)。无论培养条件如何,CERS5的敲低都导致脂滴积聚和 TG 含量显著增加(图 6H-I)。
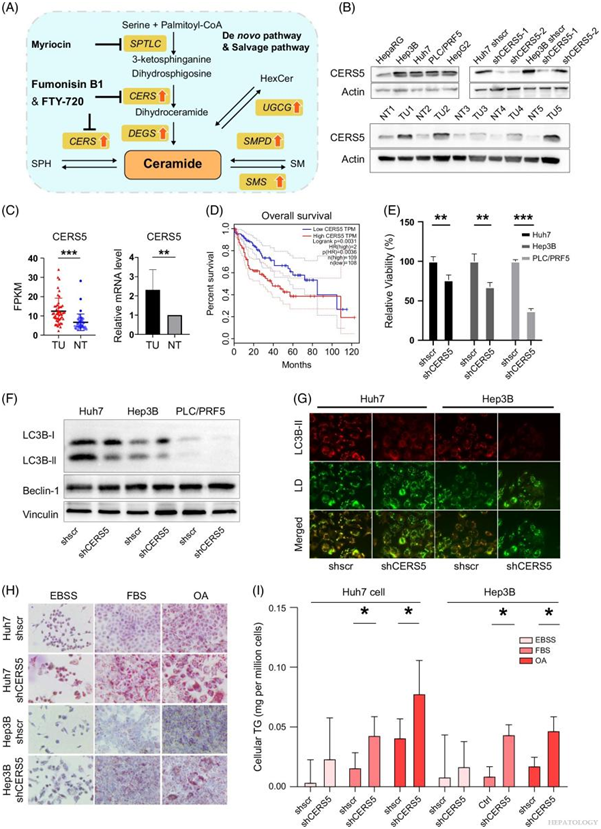
图6. ERS5对 HCC 细胞的生长和脂肪吞噬至关重要。
(A)示意图展示了“鞘脂变阻器”所涉及的通路。作为鞘脂代谢的枢纽,神经酰胺合酶、UDP-葡萄糖神经酰胺葡萄糖基转移酶和鞘磷脂合酶的上调导致特定鞘脂在 HCC 中积累。(B-C) HCC 样本和细胞系中 CERS5 蛋白和 mRNA 的表达。(D) CERS5 的表达水平与 HCC 预后的关联。(E) CCK8 测定评估了 Huh7、Hep3B 和 PLC/PRF5 细胞系中 CERS5 敲低后的相对细胞活力。 (F) 免疫印迹显示 LC3-II/LC3-I、Beclin1 和 Vinculin 在对照 Huh7、Hep3B 和 PLC/PRF5 细胞以及敲低 CERS5 的细胞中表达。(G) 用 DAPRed 和 BODIPY493/503 染色。(H) 油红 O 染色显示在饥饿条件(用 EBSS 处理)、正常条件下用 FBS 或用 OA 处理的 HCC 细胞中通过敲低 CERS5 积累了脂滴。 (I) 细胞内的TG 水平。
为了评估CERS5介导的体内脂质重编程,他们将可诱导的靶向CERS5的 Tet-on shRNA 植入 Huh7 细胞皮下,并将细胞植入裸鼠体内(图 7A)。诱导的靶向 CERS5 的 shRNA 4 天导致 CERS5 表达水平降低和肿瘤生长停止,如 Ki67 染色所示(图 7B)。对 CERS5 敲低的肿瘤体进行的脂质组学分析表明,所有已鉴定的长链 C16:0神经酰胺、己糖神经酰胺和 SM (与对照组相比)整体下降了约 30%(图 7C-F)。如预期的那样,在上调最多的脂质中,35 种 TG 和 DG 表现出 2 倍以上的增加(图 7D)。抑制 CERS5 衍生的 SL 可使 TG 水平恢复到与在非肿瘤组织中相似的水平(图 7G-H)。这些结果证明了CERS5衍生的 SL 在 TG 分解代谢中起着关键作用,这可能归因于脂肪吞噬的激活(图7I)。
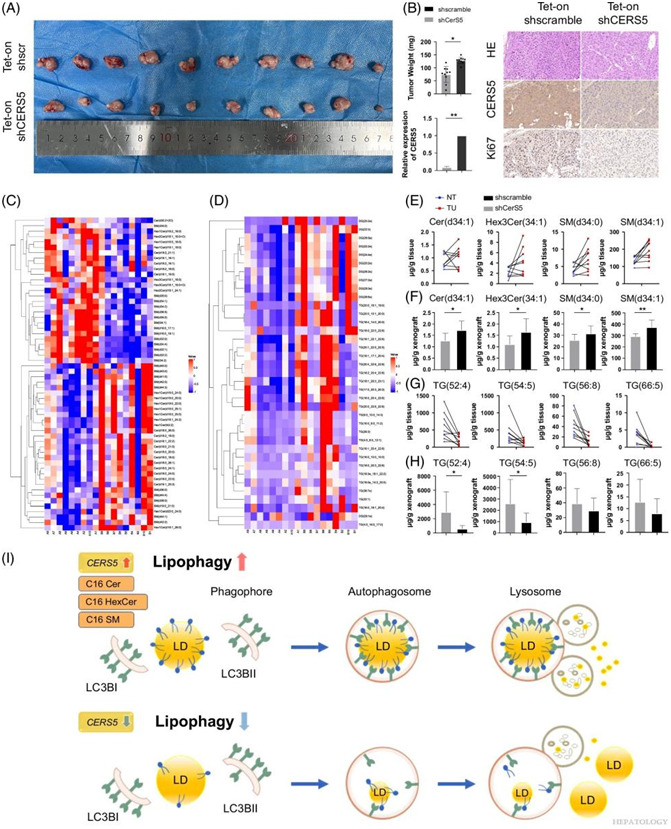
图7. CERS5 衍生的鞘脂参与细胞衍生异种移植肿瘤的脂质重塑。
(A)将慢病毒 Tet-on 系统与靶向 CERS5 的对照或 shRNA 稳定地引入 Huh7 细胞中,并皮下植入裸鼠体内以产生异种移植物。在诱导强力霉素 4 天后,对异种移植肿瘤进行脂质组学分析。(B)肿瘤重量和 CERS5 表达水平代表、异种移植肿瘤的 HE 染色和 Ki67 染色。(C) 热图显示对照和 CERS5 敲低肿瘤中鞘脂种类的富集。(D)热图显示对照和 CERS5 敲低肿瘤中 DG 和 TG 的改变最显著和最剧烈。 (E) 代表 HCC TU 组织与 NT 组织中改变最显著的 C 16:0神经酰胺、C 16:0 HexCer 和相关 SM 衍生物。(F) 代表对照异种移植肿瘤与 CERS5 敲低异种移植肿瘤中的鞘脂。(G-H) 代表 HCC TU 组织与 NT 组织中以及对照异种移植肿瘤与 CERS5 敲低异种移植肿瘤中改变的 TG。(I) CERS5 介导的 HCC 脂质重编程工作模型。
+ + + + + + + + + + +
结 论
本项研究通过结合转录组学、代谢组学和脂质组学研究的综合分析,发现 HCC 中与葡萄糖代谢、脂质氧化和降解以及从头脂肪生成相关的代谢通路发生了显著变化。脂质组学分析显示甘油脂质、磷脂酰胆碱和鞘脂衍生物发生异常改变。机器学习模型确定了一组与脂质代谢相关的基因,它们是HCC 的常见生物标志物。本项研究结果表明了CERS5在通过脂肪吞噬促进肿瘤进展方面的致癌作用。
+ + + + +



 English
English


