文献解读|Nat Commun(14.7):患者来源的胶质瘤细胞系的多组学和药理学表征
✦ +
+
论文ID
原名:Multi-omics and pharmacological characterization of patient-derived glioma cell lines
译名:患者来源的胶质瘤细胞系的多组学和药理学表征
期刊:Nature Communications
影响因子:14.7
发表时间:2024.08.08
DOI号:10.1038/s41467-024-51214-y
背 景
胶质母细胞瘤(GBM)是中枢神经系统最常见的恶性肿瘤。GBM的临床转化和治疗选择仍然是一个巨大的挑战。目前,GBM 的标准治疗是最大限度的手术切除,然后进行替莫唑胺化疗和辅助放疗。GBM的中位生存期仅为15个月左右,并且在过去几十年中并没有显著改善。
人类癌细胞系是肿瘤学研究中机制研究和药物筛选最常用的模型。在无血清神经干细胞培养基中培养的患者来源的神经胶质瘤细胞 (PDGC) 已广泛应用于神经胶质瘤研究,但是无血清培养基中培养的PDGC的基因组和药理学表征的数据相对较少。
实验设计
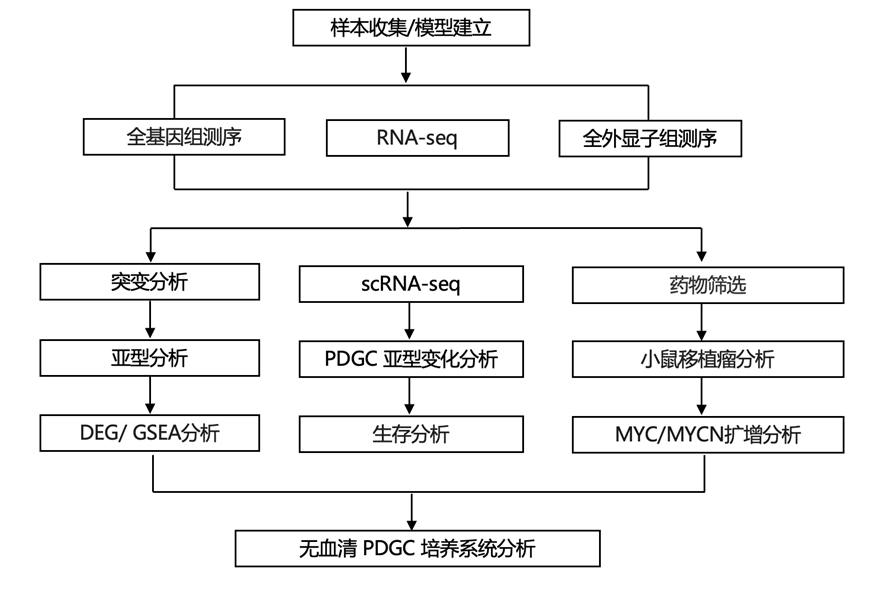
结 果
01
无血清培养基中培养的患者来源的胶质瘤细胞系的建立及多组学分析
为了详细鉴定患者来源的胶质瘤细胞,研究团队收集50 个 GBM 并建立了PDGC。他们对50个 PDGC 进行了转录组分析(RNA-seq),对 10 个 PDGC 进行了全外显子组测序 (WES),对 49 个 PDGC 进行了全基因组测序 (WGS),并对 12 个匹配的 PDGC GBM 肿瘤组织进行了RNA-seq(图1a)。他们发现PDGC含有基因组改变,包括PDGFRA和EGFR基因的扩增,PTEN和CDKN2A基因的缺失,以及TP53和NF1基因的突变(图1b)。GBM患者中复发性突变基因的总体改变频率在PDGC和TCGA GBM队列之间表现出高度一致性。
根据不同的转录模式,GBM在肿瘤体水平上可分为三种亚型:经典型(CLS Wang)、前神经型(PN Wang)和间质型(MES Wang)。在单细胞水平上,GBM肿瘤细胞可分为四种细胞状态:少突胶质细胞祖细胞样(OPC样)、神经祖细胞样(NPC样)、星形胶质细胞样(AC样)和间质样(MES样)。他们对50 个 PDGC 的 RNA-seq数据进行了非负矩阵分解 (NMF)分析,发现四个聚类获得了最高的共表型得分。然后他们确定了差异表达基因(DEG),并为 NMF 定义的每个聚类构建了一个 100 个基因的特征标签(图1c)。基因集富集分析(GSEA)显示,聚类1中的 PDGC 富含上皮-间质转化(EMT)和几种免疫相关通路(图 1d)。因此他们将该聚类指定为间质(MES)亚型。聚类 2中的 PDGC 富含神经元发育相关通路(图 1e),他们将该聚类指定为原神经(PN)亚型。聚类 4中的 PDGC 富含线粒体相关功能和氧化磷酸化通路(图 1f),他们将该聚类指定为氧化磷酸化(OXPHOS)亚型。由于聚类 3 中只有五种细胞系,并且无法识别与其他聚类相比有显著DEG特征,因此他们将重点放在剩下的三个聚类上。他们的MES亚型在MESWang和MES样状态表现出富集,表明间充质特征在三种亚型分型方法中是稳定的(图1g-h)。本研究PN亚型表现出PNWang和CLSWang的富集,并与祖细胞状态(NPC和OPC样)相关。OXPHOS亚型主要与PNWang和MESWang重叠,并与MES样细胞状态相关(图1g-h)。

图1. PDGC 转录亚型的定义。
(a) PDGC 实验流程的示意图。(b) Oncoprint显示 50 个 PDGC 的基因组改变。(c) 热图显示亚型特异性特征的表达水平。(d-f) 条形图显示 MES、PN和 OXPHOS亚型的富集通路。
02
PDGC 保留了其亲本组织的亚型特征和异质性
为了评估 PDGC 能够保留其亲本组织亚型身份的程度,他们使用了 12 个 GBM 组织及其匹配的 PDGC 的 RNA-seq数据来评估培养后亚型的变化。他们发现 58.33% (7/12) 的 PDGC 在培养后保留了其亲本组织的亚型。但是有1 个 MES 组织转化为 OXPHOS-PDGC、1 个 MES 组织转化为 PN-PDGC、1 个 OXPHOS 组织转化为 MES-PDGC,以及 2 个 PN 组织转化为 MES-PDGC。他们在另一份已发表的数据集中也观察到了类似的趋势,其中 60% (6/10) 的 PDGC 保留了其亲本组织的亚型,其中一个 OXPHOS 组织转变为 PN-PDGC,三个 OXPHOS 组织转变为 MES-PDGC(图 2b),这表明大多数 PDGC 保留了其亲本组织的亚型身份。
GBM 最大的特征是异质性,结合公开发表单细胞转录组分析(scRNA-seq) 数据,发现单个肿瘤组织内多种肿瘤细胞亚型共存。均匀流形近似和投影 (UMAP) 可视化表明从组织中分离的 GBM 细胞与培养的 PDGC 聚集在一起,证明了两种样品类型之间的转录相似性(图 2c)。与肿瘤组织类似,来自单个肿瘤组织培养的PDGC含有不同的细胞亚型(图 2d)。
随后,他们比较了培养的PDGC与其亲本组织中不同亚型的细胞组成。在患者BT333来源的的PDGC中,MES和PN亚型的细胞比例下降,而OXPHOS亚型的细胞比例增加。在患者 BT363和 BT368的 PDGC 中也观察到了类似的 MES 和 PN 亚型肿瘤细胞减少和 OXPHOS 亚型肿瘤细胞增加的趋势(图2e)。这些结果表明,虽然培养的 PDGC 保留了 GBM 母组织的多亚型肿瘤异质性,但其亚型组成略有变化。
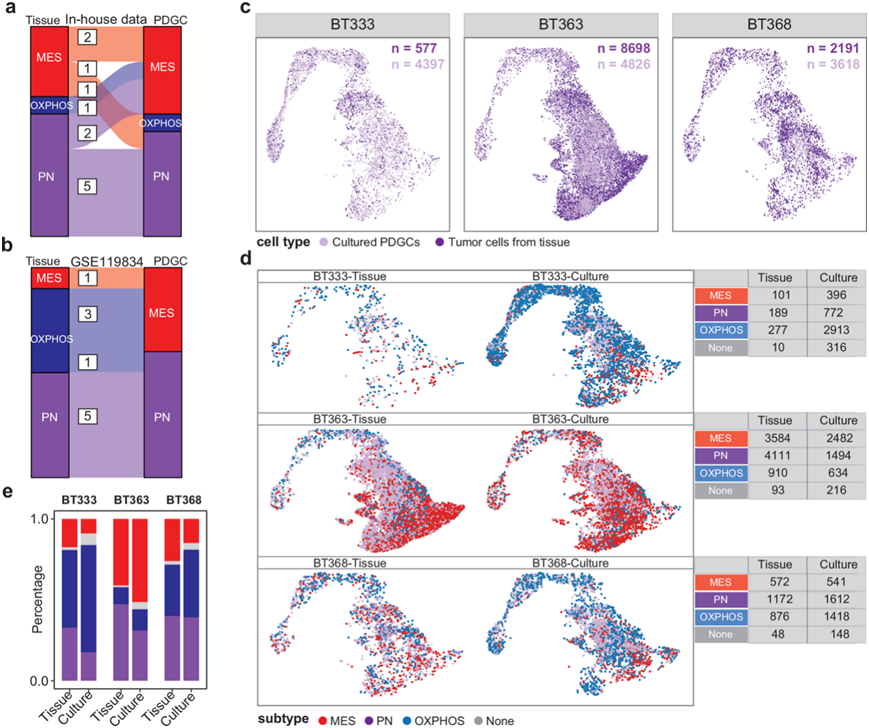
图2. 培养的PDGC亚型及其原始组织。
(a-b) Sankey 图显示培养的 PDGC 与其亲本组织之间亚型的变化。(c) 来自组织和培养的 PDGC 的 GBM 肿瘤细胞的均匀流形近似和投影 (UMAP) 可视化,按细胞类型着色。(d) 来自组织和培养的 PDGC 的 GBM 肿瘤细胞的UMAP可视化,按亚型分配着色。(e) 来自组织和培养的 PDGC 的 GBM 肿瘤细胞中每种亚型的百分比。
03
不同亚型 PDGC 的临床、基因组和致瘤性比较
生存分析显示,MES 亚型的 GBM 患者的总生存期 (OS) 明显短于其他两种亚型的患者(中位 OS:MES 亚型为 11.7 个月,PN 亚型为 14.4 个月,OXPHOS 亚型为 15.1 个月(图3a)。为了评估本研究定义的三种亚型对放射治疗的明显敏感性,他们使用了公开发表的原代胶质瘤细胞克隆文库,并检测了它们的基因表达以及对放射治疗的敏感性。在为胶质瘤细胞克隆分配亚型身份后,他们发现 MES 亚型细胞克隆似乎对放射治疗更具抵抗力(中位生存指数:0.60),而 PN 亚型细胞克隆相对敏感(中位生存指数:0.47)(图 3b)。为了识别本研究定义的亚型中的基因组改变,他们通过分析 PDGC 的 WGS 数据检测了拷贝数变异 (CNV) 和突变(图 3c)。结果表明,PTEN和NF1的基因组改变在MES亚型中富集,ATRX和CDK4的基因组改变在PN亚型中富集,而RB1和MYC/MYCN的基因组改变在PN和OXPHOS亚型中富集(图3c)。
为了评估不同亚型PDGC的致瘤能力,他们将5×105个PDGC移植到免疫缺陷小鼠的脑内。大多数PN(6/7)和OXPHOS(8/8)亚型的PDGC能够在裸鼠体内形成颅内肿瘤(图 3d)。虽然MES亚型的GBM患者(与PN和OXPHOS亚型相比)总生存期最短(图 3a),但MES亚型的PDGC具有最低的致瘤性。他们对来自G98和G709移植瘤的细胞培养物进行了RNA-seq,发现G709的亚型从MES转变为PN(图3e)。此外,移植了MES亚型PDGC的荷瘤小鼠比移植了非MES亚型PDGC的荷瘤小鼠的中位生存时间更长(图3f)。总的来说,这些结果显示了三种亚型在放射治疗敏感性、总体生存、基因组改变和致瘤能力方面的差异。
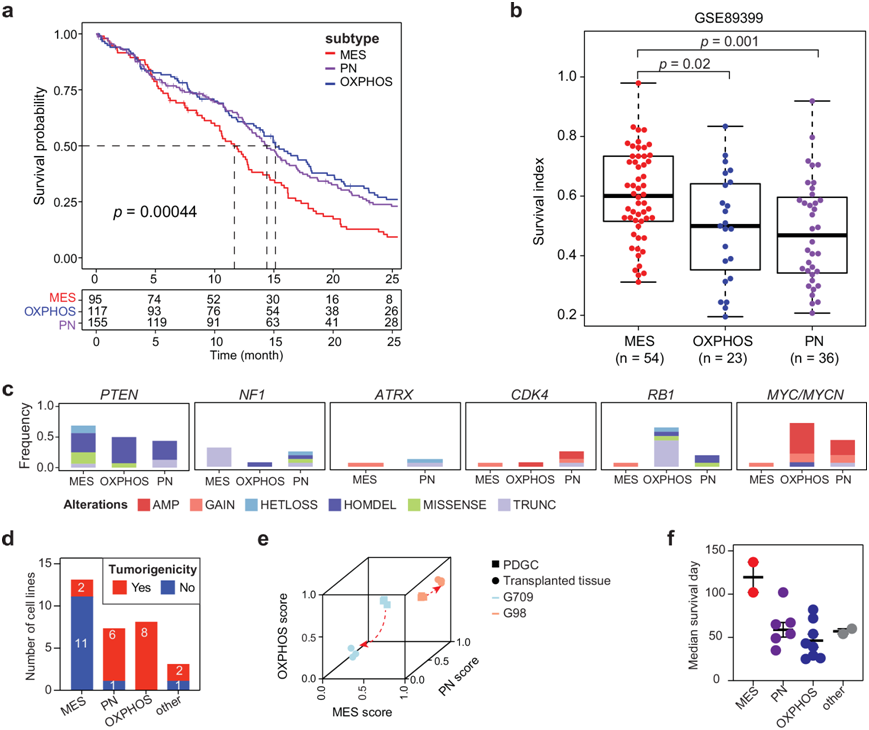
图3. 已定义亚型的临床、基因组和致瘤性比较。
(a) TCGA 队列中不同亚型 GBM 患者的 Kaplan-Meier 生存曲线。(b) 定义亚型对放射治疗的反应。(c) 不同亚型PDGC 中所示基因的基因组改变频率。(d) 堆叠条形图显示不同亚型 PDGC 的致瘤性。(e) 3D散点图显示 PDGC 的亚型评分及其移植肿瘤的细胞培养。(f) 散点图显示注射不同亚型 PDGC 后裸鼠的中位生存时间。
04
不同亚型的PDGC具有不同的药物反应
为了探索不同亚型PDGC对药物的反应,他们最初评估了1466种FDA批准的小分子对三种PDGC(G98、G118和G709)细胞活力的影响。经筛选,确定了214种小分子,它们在10μM浓度下对至少一种PDGC具有至少75%的抑制作用(图 4a)。随后他们检测了用这214种化合物(剂量为5μM)处理的41个PDGC的细胞活力。他们定义了标准化的细胞活力来衡量药物对PDGC的抑制作用。标准化的细胞活力越低,药物对细胞的抑制作用越强。
细胞活力分析表明,PDGC 对药物的反应是可变的。他们发现 96 种药物对任何 PDGC 均没有产生抑制作用,因此他们保留了剩余的 118 种药物进行进一步分析(图 4b)。总体而言,与 PN 和 OXPHOS 亚型的 PDGC 相比,MES 亚型的 PDGC 对药物的抵抗力更强(图 4c)。
为了捕捉PDGC亚型对药物的反应模式,他们对细胞活力进行了无监督聚类分析(图 4b)。聚类1中的药物能够抑制三种PDGC亚型的细胞生长,尤其是PN亚型(图 4b),例如抗生素药物氯喹 (Cloxiquine),多巴胺受体阻滞剂五氟利多(penfluridol)和酪氨酸激酶抑制剂(TKI)帕纳替尼 (ponatinib)(图 4d)。此外,PN亚型的PDGC对TKI(福替尼和恩曲替尼)、抗生素(西曲溴铵和氯己定2HCl)和抗组胺药特非那定(terfenadine)等药物敏感(图 4d-e)。OXPHOS亚型PDGC对线粒体活性抑制剂(Terfenadine和 Ebastine)、HDAC抑制剂(panobinostat、belinostat、pracinostat 和abexinostat)和HMG-CoA还原酶抑制剂(pitavastatin、 simvastatin和 lovastatin)敏感(图 4d-e)。这些结果表明不同亚型的PDGC对药物的反应存在差异。
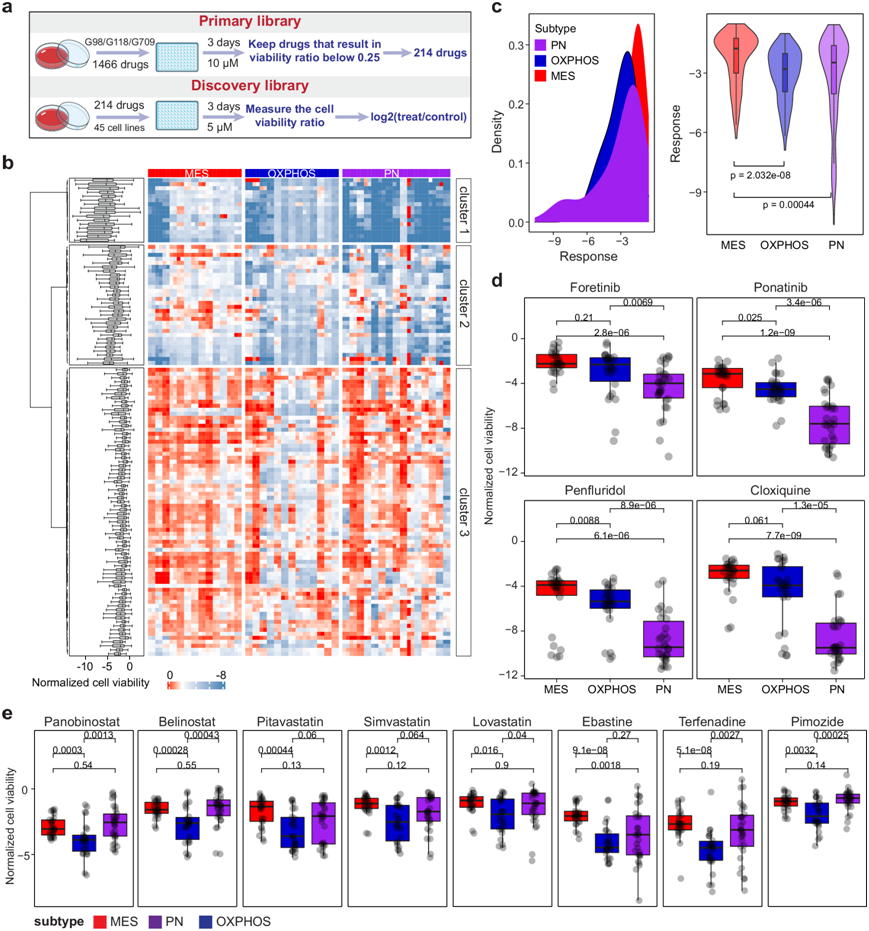
图4. 不同亚型PDGC的药物反应。
(a) 药物筛选过程示意图。(b) 热图显示不同亚型 PDGC 的药物反应。(c) 不同亚型 PDGC 的药物反应分析。(d-e) 不同亚型 PDGC 在用所示药物处理后细胞活力的标准化结果。
05
OXPHOS 亚型的 PDGC 对 HMG-CoA 还原酶抑制剂洛伐他汀敏感
他们发现在洛伐他汀处理的BIN423细胞中补充胆固醇(或其前体羊毛甾醇)可消除洛伐他汀的抑制作用(图 5a-b),这表明洛伐他汀通过降低胆固醇水平来抑制OXPHOS亚型PDGC的生长。
为了研究洛伐他汀处理 OXPHOS 亚型 PDGC 的下游机制,他们对有或没有 1 μM 洛伐他汀处理的 OXPHOS 亚型 PDGC(BNI274、BNI423 和 BNI7_11)进行了 RNA-seq 分析。基因集富集分析表明,洛伐他汀处理 18 小时后,氧化磷酸化通路活性受到显著抑制(图 5c)。这一观察结果促使他们检测洛伐他汀处理 OXPHOS 亚型 PDGC 是否会影响线粒体的数量。他们使用 MitoTracker 染色可视化了线粒体,与对照组相比,洛伐他汀处理的 BNI423 细胞中线粒体数量显著减少,并且这种缺陷可以通过补充胆固醇来逆转(图 5d)。
与 RNA-seq 分析结果一致,他们还发现用洛伐他汀或线粒体复合物 I 抑制剂鱼藤酮处理 BNI423 可导致 ADP/ATP 比率显著增加(图 5e)。同样,洛伐他汀处理后导致 ATP 生成减少可通过补充胆固醇而发生逆转(图 5f)。因此,用洛伐他汀处理 OXPHOS 亚型 PDGC 培养物可降低胆固醇水平,从而减少线粒体数量和氧化磷酸化通路的活性。每日口服管饲洛伐他汀可显著缩小皮下移植肿瘤 (OXPHOS 亚型 PDGC BNI17)的肿瘤大小(图 5g)。通过渗透泵颅内输注洛伐他汀(42 μg/天/小鼠)可显著降低移植脑肿瘤(OXPHOS 亚型 PDGC BNI423)的有丝分裂指数(图 5h),并增加裂解 Caspase-3 染色强度(图 5i)。
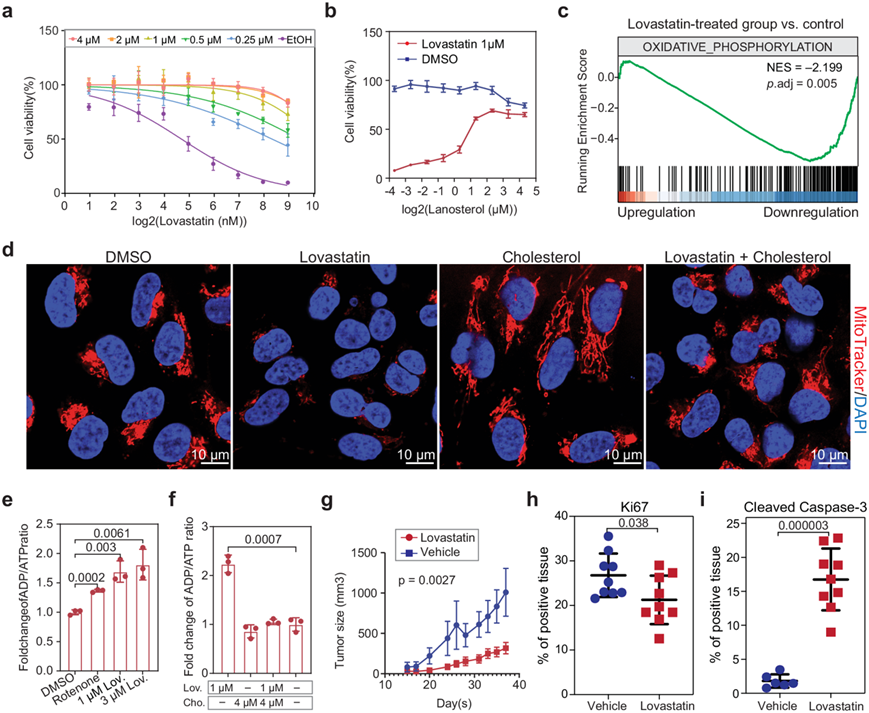
图5. 洛伐他汀通过减弱线粒体呼吸来抑制 OXPHOS 亚型 PDGC 的生长。
(a-b)细胞活力分析。(c) PDGC 的 GSEA 图。(d) 在不同处理下对 BNI423 进行 16 小时的代表性 MitoTracker 染色。(e) 不同处理下 BNI423 的相对细胞 ADP/ATP 比率。(f)细胞 ADP/ATP 比率。(g) 小鼠的肿瘤大小。(h-i) 定量Ki67和裂解 Caspase-3 染色的脑肿瘤组织。
06
无血清培养体系与MYC/MYCN扩增相关
为了探索MYC通路的活性是否受细胞培养体系的调控,他们比较了PDGC和相应肿瘤组织的转录组数据,发现培养后MYC通路水平显著升高(图 6a)。
本研究中的50个PDGC中,24个PDGC在短传代(<10代)阶段进行了WGS,而其他PDGC则经过了多次传代(>10代)。为了进一步验证MYC/MYCN扩增与PDGC培养体系之间的关系,他们利用WGS数据比较了短传代和长传代(>10代)PDGC中MYC/MYCN扩增的频率,发现长传代PDGC中MYC/MYCN扩增事件的频率明显高于短传代PDGC(图 6b)。同时,他们观察到36%的长传代PDGC表现出MYC/MYCN ecDNA扩增,而在短传代PDGC中这一频率仅为8%(图 6c)。当PDGC传代超过20代时,他们通过液滴数字PCR (ddPCR) 定量其MYC拷贝数,并将其与WGS确定的MYC拷贝数进行比较。根据WGS数据,PDGC CB1507和CB9261在短传代阶段不携带MYC扩增,在长时间传代后成为MYC扩增的细胞系(图 6d),证实MYC扩增与无血清PDGC培养体系有关。
由于MYC/MYCN扩增在低传代PDGC中也观察到,他们推测在原始GBM组织中可能存在少量MYC/MYCN扩增细胞。为了验证这一点,他们对PDGC匹配的肿瘤组织进行了荧光原位杂交(FISH)检测。他们对PDGC的WGS分析显示,CB5304和CB3145有MYC或MYCN扩增,而CB1838没有MYC或MYCN扩增。FISH结果显示MYC/MYCN扩增细胞存在于CB5304和CB3145的原始组织中,但在CB1838的原始组织中不存在(图 6e)。值得注意的是,他们发现分别有 1.2% 和 5.4% 的肿瘤细胞表现出MYC和MYCN扩增(图 6f)。他们还使用 FISH 检查了另外 96 个胶质母细胞瘤组织样本(33 个 II 级、24 个 III 级和 39 个 IV 级)。他们检测到了具有MYC扩增的细胞,这些细胞倾向于聚集在一起(图 6g)。此外,高级别胶质母细胞瘤组织比低级别胶质母细胞瘤组织更有可能具有MYC扩增细胞(II 级,12.12%;III 级,20.83%;IV 级,20.51%)(图6h)。总体而言,这些结果证明胶质瘤组织中存在罕见的MYC扩增细胞。
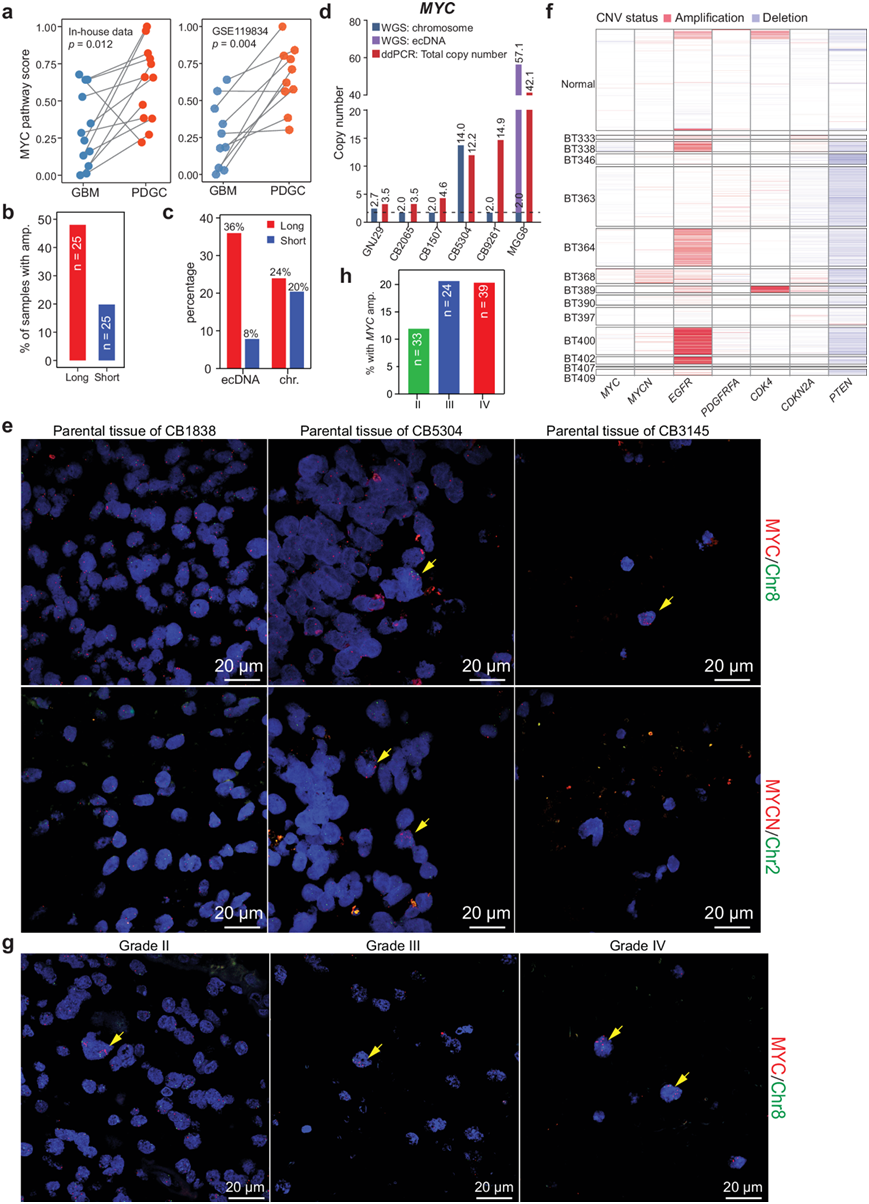
图6. 培养的 PDGC 中的MYC/MYCN扩增。
(a) PDGC 和匹配的 GBM 组织中的 MYC 通路表达评分。(b) 具有MYC/MYCN扩增的样本百分比 。(c) 具有MYC/MYCN DNA 扩增或MYC/MYCN ecDNA 扩增的样本百分比。(d) MYC的拷贝数。(e) 代表性FISH图像显示患者 CB1838、CB5304 和 CB3145 的原发性 GBM 组织中的MYC/MYCN扩增。(f) 热图显示指示基因的 CNV。(g) 代表性 FISH 图像显示II、III 和 IV 级胶质瘤组织中罕见的MYC扩增肿瘤细胞。(h) II 级、III 级和 IV 级胶质瘤组织中含有三个以上MYC扩增细胞的样本百分比 。
+ + + + + + + + + + +
结 论
本项研究收集了 50 个PDGC,并通过全基因组测序、RNA-seq和药物反应筛选对其进行表征,在 PDGC 中确定了三种分子亚型: MES、PN和OXPHOS。药物反应分析显示 PN 亚型 PDGC 对酪氨酸激酶抑制剂敏感,而 OXPHOS 亚型 PDGC 对组蛋白去乙酰化酶抑制剂、氧化磷酸化抑制剂和 HMG-CoA 还原酶抑制剂敏感。 PN 和 OXPHOS 亚型 PDGC 移植到免疫缺陷小鼠颅内后可在体内稳定形成肿瘤,而大多数 MES 亚型 PDGC 无法在体内形成肿瘤。此外,无血清培养基培养的 PDGC,尤其是长传代 PDGC 具有MYC/MYCN扩增,这在 GBM 患者中很少见。本项研究为了解原代胶质瘤细胞培养和临床转化提供了新的理论依据,并凸显了无血清 PDGC 培养系统不可忽视的问题。
+ + + + +



 English
English


