文献解读|Nat Commun(14.7):宿主-微生物多组学分析发现实体器官移植接受者存在明显的 COVID-19 免疫失调
✦ +
+
论文ID
原名:Host-microbe multiomic profiling identifies distinct COVID-19 immune dysregulation in solid organ transplant recipients
译名:宿主-微生物多组学分析发现实体器官移植接受者存在明显的 COVID-19 免疫失调
期刊:Nature Communications
影响因子:14.7
发表时间:2025.01.10
DOI号:10.1038/s41467-025-55823-z
背 景
2019 冠状病毒病 (COVID-19) 造成了巨大的社会负担,全球已造成数百万人感染和死亡。接受实体器官移植 (SOT) 的免疫功能低下患者更容易感染 SARS-CoV-2,并且在接种疫苗后产生的抗体反应较弱,但是他们可以通过多次接种疫苗获得有效的 T 细胞反应。此外,与一般人群相比,他们更有可能住院、出现不良临床结果并具有更长的传染性。尽管如此,倾向匹配研究表明,与免疫功能正常的个体相比,SOT 接受者的 COVID-19 死亡率并不会更高,但是使用其他匹配方法的研究发现了差异。
实验设计
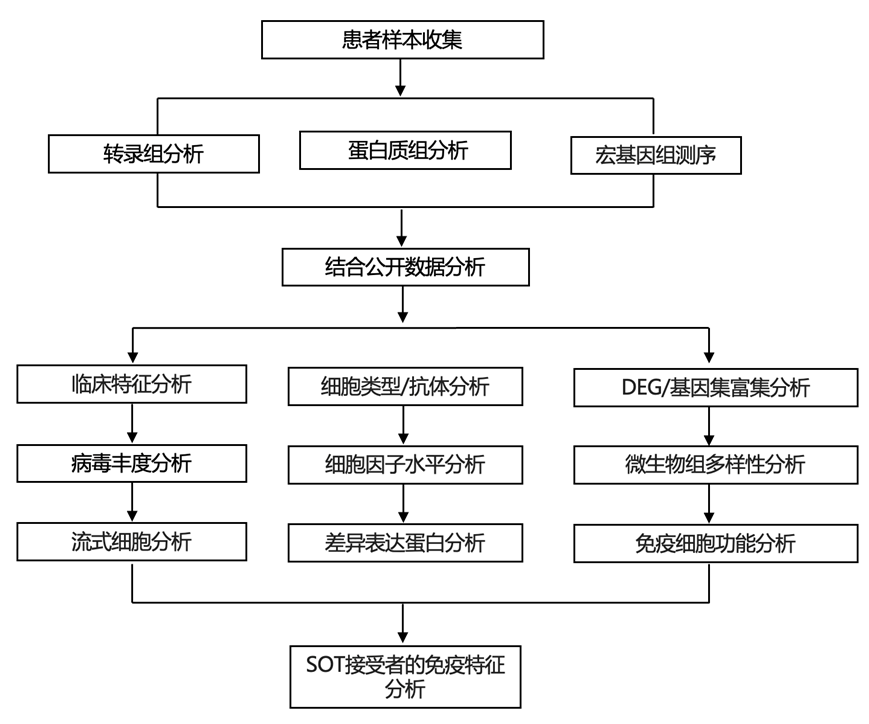
结 果
01
SOT 与 SARS-CoV-2 病毒丰度增加和病毒清除受损有关
本研究对 COVID-19 队列免疫表型评估 (IMPACC) 中因 COVID-19 住院的患者进行了病例对照研究,该研究包括 2020 年 5 月至 2021 年 3 月期间在美国各地招募的 1164 名患者。来自11 个医疗中心的86名 SOT 接受者按年龄、性别和研究地点以 2:1 的比例与来自同一队列的 172 名非 SOT 对照者匹配(图 1)。最常见的移植器官类型是肾脏,心脏、肝脏和肺的数量大致相等。入院时采取的免疫抑制方案在 SOT 接受者之间有所不同,但最常见的是霉酚酸酯(mycophenolate)和他克莫司(tacrolimus)。研究团队发现,SOT 接受者与非 SOT 对照者在 ICU 入院、插管状态或 COVID-19 严重程度方面没有差异,这通过五个已建立的 COVID-19 结果轨迹组 (TG) 18或 28 天死亡率来衡量。根据住院时间和呼吸支持水平,轨迹组 (TG) 1-3 患有轻度至中度疾病,而 TG 4 的特点是住院时间较长且需要长时间呼吸支持,TG 5 的特点是 28 天内死亡18。在接受霉酚酸酯治疗的患者中,37.7% 处于 TG 4-5,而未接受霉酚酸酯治疗的患者中这一比例为18 .接受他克莫司治疗的患者中,30.4% 处于 TG 4–5 期,而未接受他克莫司治疗的患者中,该比例为 28.6%(P =0.88)。
为了研究 SOT 接受者中与 COVID-19 相关的宿主免疫学和微生物特征,他们评估了入院后的血液中的质谱流式细胞数据 (CyTOF)、转录组分析(RNA-seq)、蛋白质组学和血清学分析数据,以及鼻拭子转录分析和宏转录组学数据,并在入院后长达约 28 天内纵向分析了多达 6 个时间点(图 1)
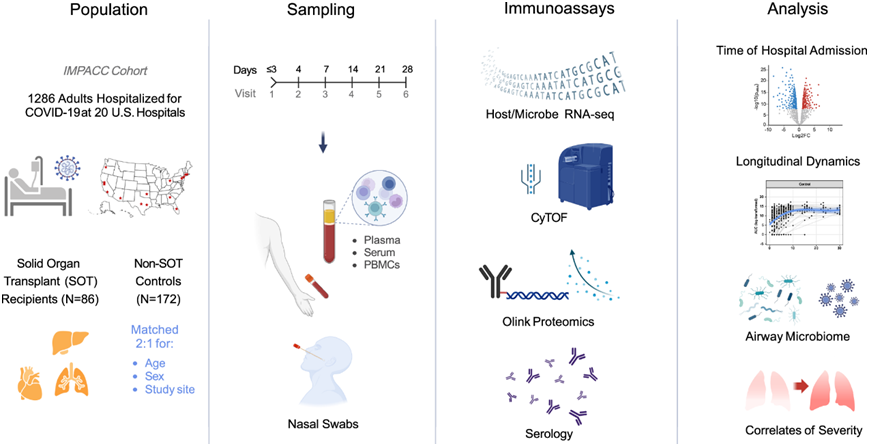
图1. 研究设计。
他们首先检测 SARS-CoV-2 病毒丰度,以鼻腔宏转录组和 N 基因逆转录 PCR 的每百万读段 (rpM) 为单位进行分析。SOT 接受者在访问 1(Visit 1) 时 SARS-CoV-2 病毒 rpM 明显较高(图 2a),这无法用症状出现时间的差异来解释,并且与移植器官类型或接受霉酚酸酯或他克莫司治疗无关(图 2b)。纵向分析显示,SOT 状态与病毒 rpM 之间存在显著关联,与非 SOT 对照者相比,SOT 接受者的病毒清除能力受损(图 2c)。
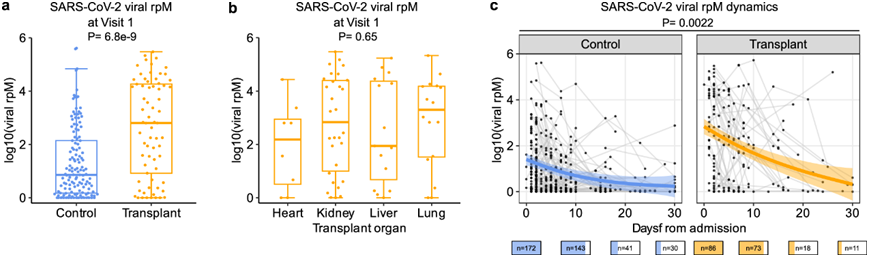
图2. 与对照组相比,SOT 接受者的 SARS-CoV-2 病毒 rpM 更高且病毒清除率受损。
(a-b) 箱线图显示第 1 次访视时移植组和对照组的每百万 SARS-CoV-2 病毒读数(rpM),以及 不同器官移植类型。(c) 该图显示移植组和对照组入院后长达 30 天内病毒 rpM 的动态。
02
免疫细胞群和 SARS-CoV-2 抗体水平
为了检测血液中的免疫细胞群,他们使用了质谱流式细胞 (CyTOF) 分析技术和一组包含 43 种抗体的方法,旨在识别细胞谱系和功能状态标志物。在访问 1 的 PBMC 样本中,他们发现 5 种与 SOT 状态相关的细胞类型(图 3a)。与对照组相比,SOT 接受者在访问 1 时浆母细胞和过渡 B 细胞明显较少(图 3a-b)。相反,SOT 接受者的 CD4+T(EMRA CD57hi)和 CD4+ T(EMRA CD57low)细胞以及 CD8+ T(EMRA CD57low)细胞比例增加(图 3a-b)。在调整 SARS-CoV-2 病毒 rpM 后,只有浆母细胞和 CD4+T(EMRA CD57low)细胞在比例差异方面仍然具有统计学意义,这表明这两种细胞类型与 SOT 状态以病毒丰度独立的方式相关。
他们还比较了两组之间的抗 SARS-CoV-2 刺突 IgG 水平。SOT 接受者在访问 1 时的抗体水平较低(图 3c),尽管增长率并未因 SOT 状态而有所不同(图 3d)。抗 SARS-CoV-2 刺突 IgG 水平也未因接受霉酚酸酯或他克莫司而有所不同。
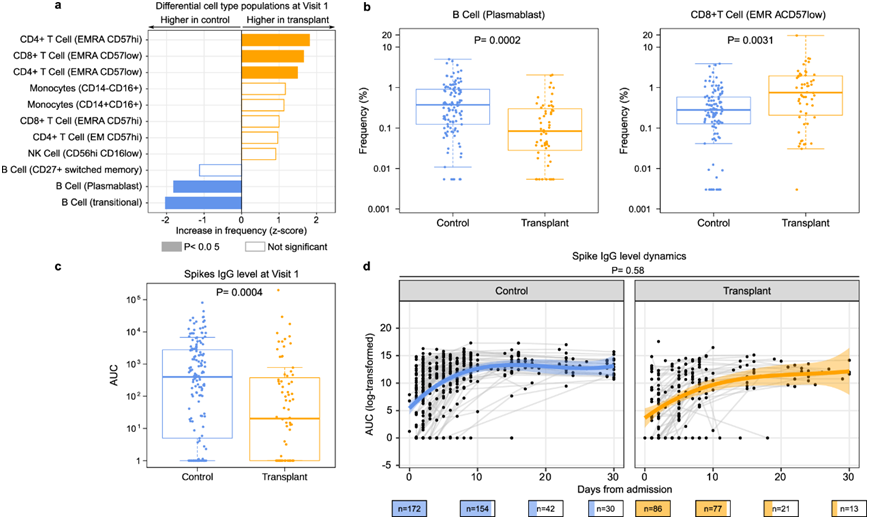
图3. 与对照组相比,SOT 接受者住院时的 B 细胞浆母细胞较低、EMRA T 细胞较高,且 SARS-CoV-2 抗体水平较低。
(a) 通过 CyTOF 测量的 SOT 接受者和对照组(蓝色,n = 107)的免疫细胞群频率差异。(b) 箱线图 突出显示了 SOT 接受者和对照组之间频率不同的两种细胞类型。(c) 通过曲线下面积 (AUC) 测量 SOT 接受者和对照组的尖峰 IgG 水平的箱线图。(d) 住院期间 SOT 接受者和对照组的尖峰 IgG 水平的纵向动态。
03
住院期间及随时间推移的细胞因子和趋化因子表达
对血清样本的邻近延伸试验 (Olink) 蛋白质组学数据分析发现,根据访视 1 中的 SOT 状态,18 种蛋白质存在差异表达(图 4a)。其中 14 种蛋白质的表达水平在 SOT 接受者中高于非 SOT 对照者,包括 CX3CL1、IL15RA 和 KITLG (图 4b)。SOT 接受者的 IFN-gamma (IFNG)、OSM、TNSF14 和 CCL4 水平较低。
为了评估 SARS-CoV-2 rpM 的差异是否可能导致观察到的差异蛋白表达,他们重复了分析并调整了病毒 rpM,结果变化很小,这表明病毒 rpM 对 SOT 接受者和对照组之间的差异表达蛋白没有显著影响(图S5a)。他们进一步分析了两个研究组中 SARS-CoV-2 rpM 与蛋白质表达之间的关系(图S5b),发现 SOT 接受者的病毒 rpM 与 CXCL8 之间存在正相关性,但在对照组中没有(图S5c)。
纵向血清细胞因子表达动态分析显示,IFN 诱导趋化因子 CXCL11 在对照组中随时间显著下降,但在 SOT 接受者中没有下降(图 4c)。调整病毒 rpM 差异后,两组之间的 CXCL11 动态仍然有显著差异,同时与对照组相比,SOT 接受者的 CCL3 和 CCL4 表达随时间上升更快(图S5d)。
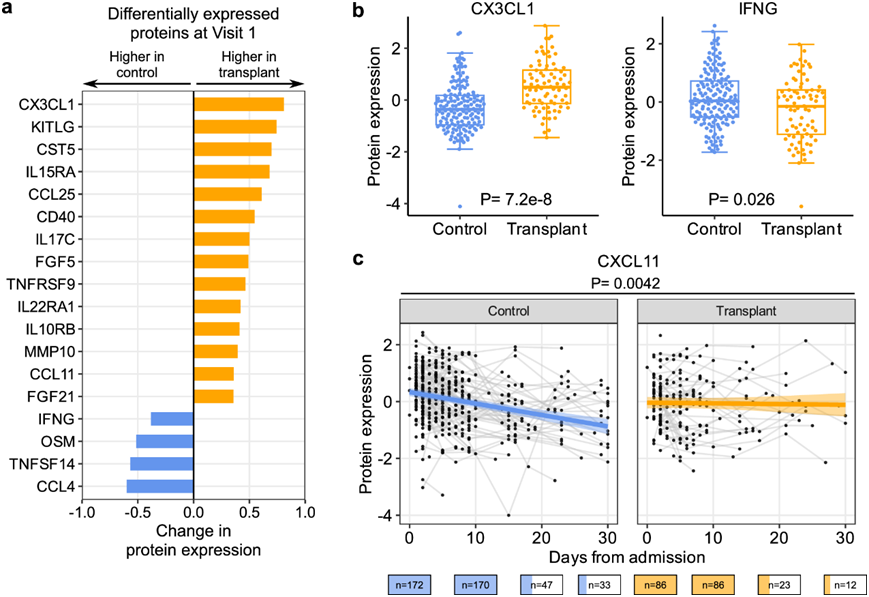
图4. SOT 接受者血清特定趋化因子水平较高,而 IFN-gamma 水平较低。
(a) 条形图显示 访视 1 时对照组和移植患者之间差异表达的蛋白质。(b) 箱线图显示访视 1 时 CX3CL1 和 IFNG 水平。(c) 散点图显示入院后 CXCL11 水平的动态变化(未调整 SARS-CoV-2 病毒 rpM)。带状图表示线性混合效应模型拟合的 95% 置信区间。
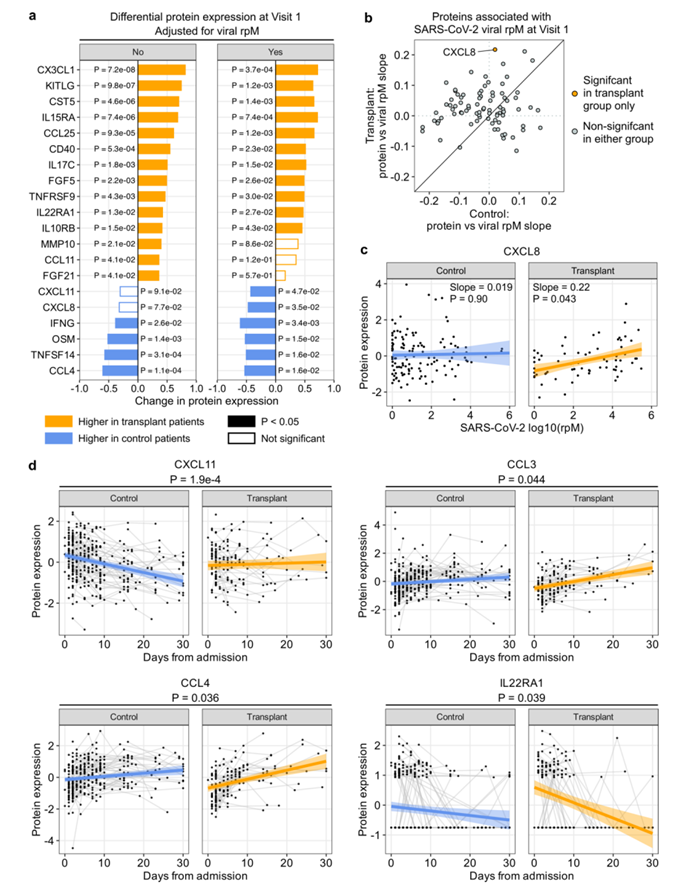
图S5. SARS-CoV-2病毒丰度对访问1时差异蛋白表达和免疫蛋白动态的影响。
(a) 条形图显示访问1时实体器官移植(SOT)接受者和非SOT对照组血清蛋白的差异表达。(b) 图显示血清蛋白表达对SARS-CoV-2 rpM的斜率。(c) 图显示CXCL8蛋白表达与对照组和SOT组病毒rpM的关系。(d) 散点图显示入院后CXCL11、CCL3、CCL4和IL22RA1蛋白水平的动态。
04
住院期间及随时间推移的 PBMC 基因表达差异
入院时,差异表达分析显示 SOT 接受者和对照组之间存在 1047 个差异表达基因(P adj <0.05)(图 5a)。基因集富集分析(GSEA)表明,SOT 接受者与 I 型 IFN、TLR 信号转导、补体活化、IL-1 信号转导和其他功能相关的先天免疫途径表达增加(图 5b)。SOT 接受者还表现出 B 细胞受体信号转导和细胞周期相关通路表达降低(图 5c)。在差异表达分析中调整 SARS-CoV-2 rpM 表明,补体活化、I 型 IFN 和 IL-1 信号通路表达的增加与病毒 rpM 无关。
接下来,他们评估了 SOT 接受者和对照组在住院过程中基因表达的动态。SOT 接受者表现出与几种免疫途径相关的基因表达随时间增加,包括 I 型和 II 型 IFN 信号传导、IL-10 和 PD-1 信号传导以及 CD28 共刺激(图 5d)。调整病毒 rpM 不会显著影响结果。与 SOT 接受者相比,非 SOT 对照中的一些信号通路(例如干扰素信号传导)随着时间的推移下降得更强烈(图 5e)。对于其他通路(例如血小板活化、信号传导和聚集),SOT 接受者表现出通路随时间上调,而在对照组中观察到下调(图 5e)。
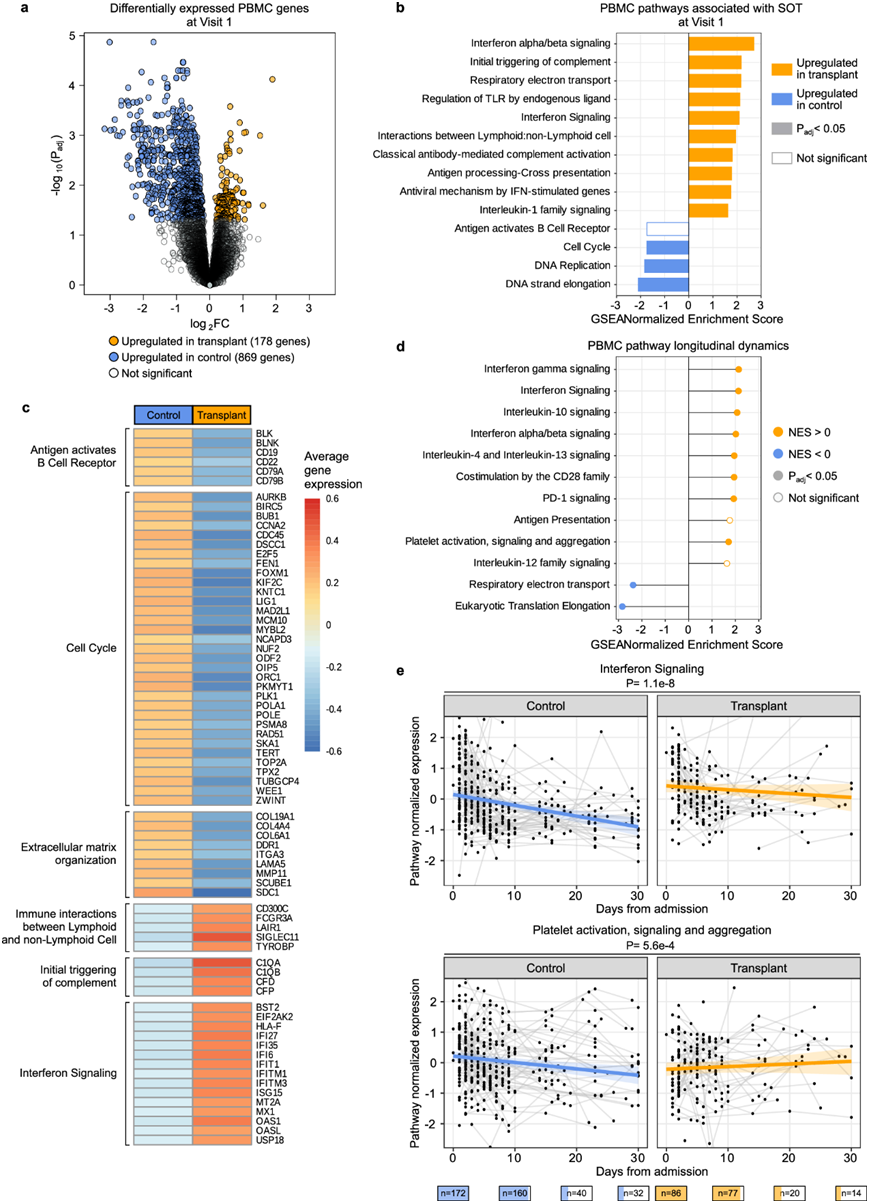
图5. PBMC 转录组学分析。
(a) 火山图突出显示了 住院时SOT 接受者和对照组之间差异表达的基因。(b) 基因集富集分析(GSEA)突出显示了 SOT 接受者与对照组中差异富集的通路。(c) 来自重要 GSEA 途径的前沿基因的平均基因表达图。(d) 信号通路纵向动态的差异。(e) 纵向图突出显示了SOT接受者与对照组中代表性免疫信号通路标准化表达的变化,这些变化随时间而显著不同。
05
SOT 接受者和对照组的上呼吸道基因表达差异
因为呼吸道是 COVID-19 活动性感染的部位,他们对鼻拭子样本进行了基因表达分析。令人惊讶的是,虽然鼻腔 SARS-CoV-2 rpM 存在显著差异(图 2a),但在入院时 FDR < 0.05 时两组之间未发现差异表达基因(DEG)。然而,GSEA 表明,SOT 接受者在入院时上呼吸道中表现出与 IL-10 信号转导、中性粒细胞脱颗粒、I 型 IFN 信号转导、IL-1 和 IL-4/IL-13 信号转导相关的基因表达增加(图 6a)。SOT 接受者中差异上调的大多数炎症途径不受病毒 rpM 调整的影响。
纵向鼻腔转录组数据分析显示,SOT 接受者中与 IFN 信号、TCR 信号和其他免疫信号通路相关的基因表达随时间推移而增加(图 6b-c)。相反,非 SOT 对照显示与中性粒细胞脱颗粒和 IL-36 信号相关的基因表达随时间推移而增加(图 6b)。调整病毒载量并没有显著改变结果。综上所述,这些结果表明,与非 SOT 对照者相比,SOT 接受者的上呼吸道和血液区域均在转录水平上表现出增强的先天免疫反应,并且对相关免疫信号通路具有一定的区域特异性。
接下来,他们使用鼻腔宏转录组学数据来评估入院时 SOT 接受者和对照组的呼吸道微生物组组成是否不同。在访问 1 时,以Shannon多样性指数 (SDI) 衡量,SOT 接受者的上呼吸道微生物组 alpha 多样性高于对照组(图 6d-e)。在访问1 时,以Bray–Curtis差异指数衡量,各组之间的细菌群落组成(beta 多样性)没有差异。最后,他们探究了各组之间的特定分类群是否不同,发现只有 SARS-CoV-2 在 SOT 接受者中明显更丰富(图 6f)。
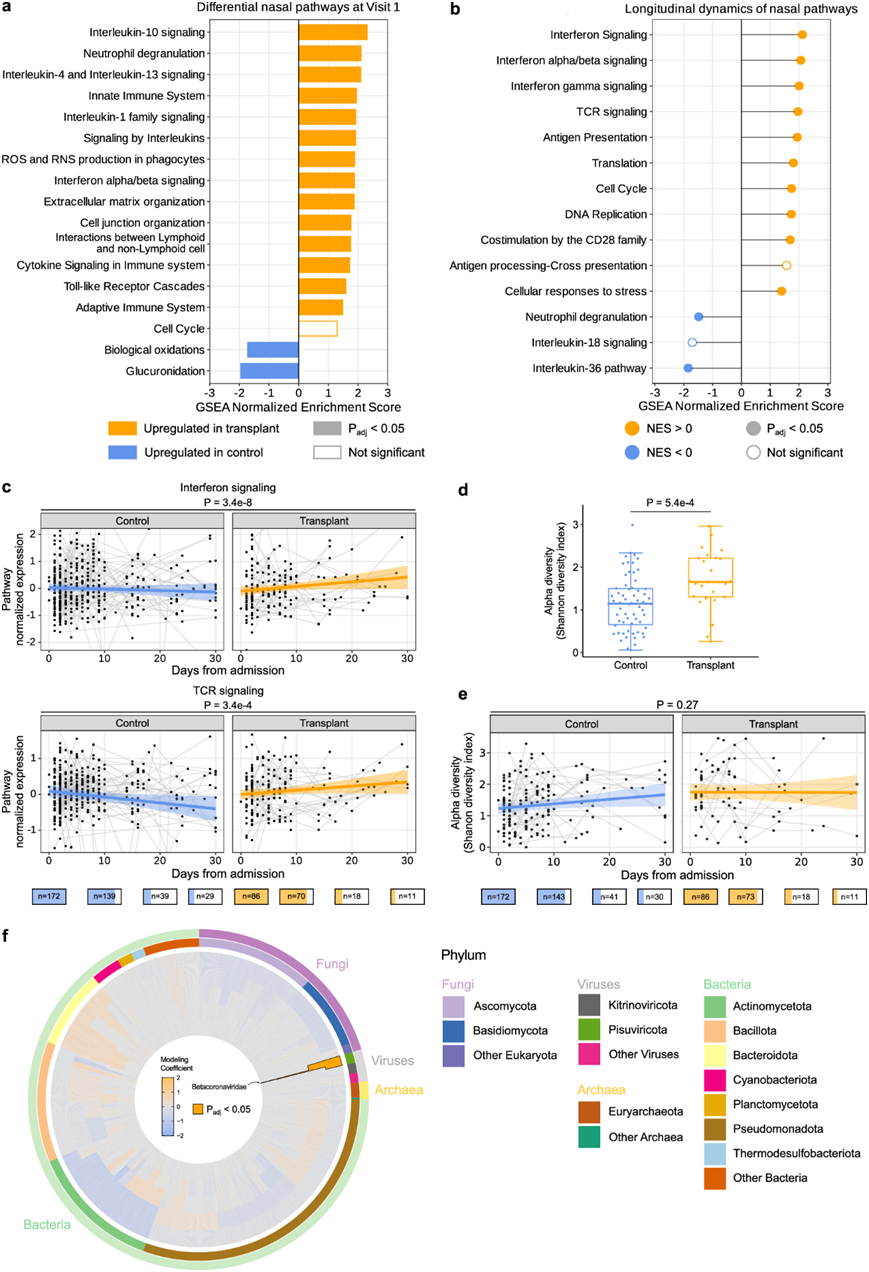
图6. SOT 接受者和对照组的上呼吸道宿主基因表达和鼻腔微生物群不同。
(a) 基因集富集分析 (GSEA) 突出显示了实体器官移植 (SOT) 接受者与对照组上呼吸道差异富集的通路。(b) 信号通路纵向动态的差异。(c) 纵向图突出显示了代表性免疫信号通路标准化表达的变化,这些变化在 SOT 接受者和对照组中显示出显著不同的动态。(d) 箱线图显示 SOT 接受者与对照组上呼吸道细菌微生物组 alpha 多样性的差异 。(e) 具有95% 置信区间的稳健回归突出显示住院后上呼吸道 alpha 多样性的纵向变化。(f) 径向图突出显示从属(最内圈) 到门(最外圈)的差异丰度和 SOT 接受者和对照组中差异富集的分类单元的系统发育相关性。
06
SOT 接受者和对照组的 COVID-19 严重程度的免疫相关性不同
他们通过比较重度 COVID-19患者(TG 4-5) 与轻度/中度COVID-19 患者 (TG 1-3)之间的细胞类型频率、基因表达和蛋白质表达差异,表征了 SOT 接受者和非 SOT 对照者之间 COVID-19 严重程度宿主相关性的差异。
在 SOT 接受者和对照组中,严重疾病的特征是几种免疫细胞群的减少,包括常规树突状细胞 (DC)、中间(CD14 + CD16 +)单核细胞和几种 CD4 + T 细胞亚群(图 7a)。然而,只有 SOT 接受者的 CD8+ 中央记忆 T 细胞、CD11C + CXCR5- B 细胞和 CD56 high CD16low NK 细胞在严重疾病中显著降低(图7a)。对照组中重症 COVID-19 与几种典型的促炎血清细胞因子和趋化因子(例如IL-6、CCL23 和 CXCL8)显著增加有关,但 SOT 接受者则不然(图 7b)。相反,SOT 接受者的重症 COVID-19 血清中 IFNG 和 IL12B 的水平显著降低,但在对照组中没有。
对 PBMC 转录组数据的类似分析显示,SOT 接受者和对照组在严重疾病中均表现出几种免疫信号通路的表达增加,包括中性粒细胞脱颗粒、先天免疫系统信号、IL-1 信号和细胞对压力的反应(图 7c)。与两组中的轻度/中度 COVID-19 相比,重度 COVID-19 中与 PD-1 信号相关的 PBMC 基因表达也有所降低。然而,SOT 接受者表现出与 TCR 信号、CD28 信号以及 CD3 和 TCR zeta 链磷酸化相关的基因表达较低(图 7c)。
在对上呼吸道数据的严重程度分析中,各组之间的差异更为显著。例如,对照组的严重疾病以与 Toll 样受体 (TLR) 信号传导相关的基因表达增加为特征,而在 SOT 接受者中则未观察到这种情况(图 7d)。非 SOT 对照组显示与中性粒细胞脱颗粒、IL-10、IL-4/IL-13 和先天免疫信号传导相关的基因表达增加。
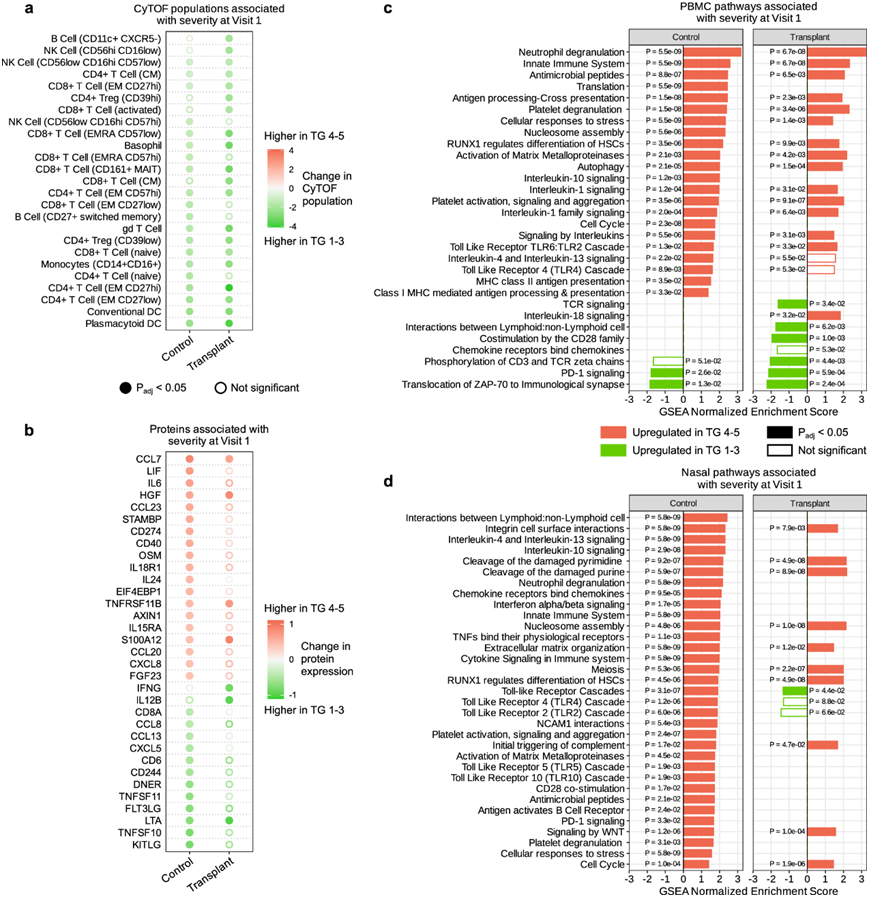
图7. SOT 接受者和对照组之间的 COVID-19 严重程度的宿主免疫相关性不同。
(a) 重症患者(TG 4-5,红色)与轻度/中度患者(TG 1-3,绿色)相比,在对照组和移植组中上调或下调的免疫细胞群的点图。(b) 重症患者与轻度/中度患者相比,在对照组和移植组中上调或下调的蛋白质的点图。(c) 图表突出显示了通过基因集富集分析(GSEA)从外周血单核细胞(PBMC)转录组学中确定的信号通路。(d) 突出显示了鼻转录组中 GSEA 识别的信号通路。
+ + + + + + + + + + +
结 论
本研究发现SOT接受者的鼻腔 SARS-CoV-2 病毒丰度较高且病毒清除受损,抗刺突 IgG 水平较低。此外,SOT接受者的浆母细胞和过渡 B 细胞减少,衰老 T 细胞增加。血液和鼻腔转录分析显示先天免疫信号通路意外上调,几种促炎血清趋化因子水平升高。然而,SOT接受者的严重疾病以促炎基因和趋化因子的诱导不太强烈为特征。总之,本研究揭示了实体器官移植接受者的独特免疫特征和改变的病毒动力学。
+ + + + +



 English
English


