文献解读|Nature(50.5):结直肠癌的预后基因组和转录组特征
✦ +
+
论文ID
原名:Prognostic genome and transcriptome signatures in colorectal cancers
译名:结直肠癌的预后基因组和转录组特征
期刊:Nature
影响因子:50.5
发表时间:2024.08.07
DOI号:10.1038/s41586-024-07769-3
背 景
结直肠癌 (CRC) 是男女中第三大常见和第二大致命肿瘤类型,每年新发病例 1900000 例,死亡 900000 例。大约 20% 的患者在诊断时已患有转移性疾病,另外 20% 的患者将在以后发生转移。从外显子组和全基因组测序来看,CRC的突变景观在编码区最为明显,而非编码区仍未得到充分研究。大约 80–85 %的 CRC归类为拷贝数改变的微卫星稳定 (MSS),10–16% 归类为高度突变且具有微卫星不稳定性 (MSI),1–2% 归类为由体细胞POLE突变导致的超突变。MSI 状态可预测对检查点抑制剂的反应,而KRAS、NRAS和BRAF突变则可预测对 EGFR 靶向疗法的反应不佳。
实验设计

结 果
01
突变景观分析
研究团队对 1063 例CRC 病例样本进行了全基因组测序(平均 53 倍覆盖率)以及肿瘤转录组分析(RNA-seq)(平均 3000 万个配对读数)。在 1063 个 CRC 中,943 个为原发性肿瘤手术标本,120 个为原发性肿瘤活检标本。522 例的对照样本取自外周血,541 例的对照样本取自邻近组织。在所有患者中,126 名(12%)在手术获取肿瘤标本前已接受过预处理,其中 92 个样本是手术前接受过放化疗或放疗的直肠癌。
总共鉴定出 96 个突变驱动基因,1056 个(99%)肿瘤至少在其中一种基因中发生体细胞突变(图1a)。根据总突变计数,242 个(23%)肿瘤为高突变(HM),每兆碱基突变数 >23.16(图1b)。与非高突变(nHM)病例相比,HM 病例年龄较大,女性患者较多,右侧、粘液性、高级别(低分化或未分化)和 II 期肿瘤较多(14 例)。223 名(21%)患者符合 MSI 标准(MSIsensor 评分 ≥ 3.5),其中仅 2 名是 nHM。该基于人群的队列代表了瑞典的 CRC 患者,与 MSI 患病率较低的年轻、健康患者队列形成对比。总共有 15 个 HM 肿瘤是具有POLE或其他 DNA 损伤修复基因突变的 MSS(图1c),6 个是具有高非编码肿瘤突变负担 (TMB) 但没有修复基因突变的 MSS。HM MSS 肿瘤中的修复基因突变并非都是驱动基因;因此,可能无法完全解释它们的高 TMB。对三组(HM、nHM 和整个肿瘤队列)的分析确定了 96 个独特的驱动基因,以及 13 个额外的亚型特异性驱动基因。在 HM 肿瘤中,超过 20% 的病例发生突变的基因属于 TGFβ-BMP、WNT、RTK-RAS、核糖体蛋白、表观遗传调控、PI3K、SCF 复合物、p53 和免疫系统途径,最常见的复发性突变是ACVR2A (p.K437Rfs*5; 78%)、BRAF (p.V600E; 65%) 和RNF43 (p.G659Vfs*41; 57%)。相应地,超过 10% 的 nHM 肿瘤中 WNT、p53、RTK–RAS、PI3K、SCF 复合物和 TGFβ 途径的基因发生突变(图1a)。nHM 肿瘤中最常见的热点突变是KRAS p.G12D (15%) 和 p.G12V (11%)。
在 96 个驱动基因中,有 24 个基因之前未指定为任何癌症的驱动基因,它们与 BMP(RGMB)和 EGFR(AREG)信号传导、细胞周期(CEP170和SKA3)、免疫系统(PIGR和CSF3)、离子转运(SLC12A2和CYB561A3)、代谢(PIGW、CYP2A6和CYP7B1)、mRNA 剪接(SREK1IP1)、蛋白质转运(WASHC2C和SLC46A3)、转录调控(FOXP2、NANOGP8、TBP和ZNF554)、核糖体蛋白(RPS15、RPS16和RPS6)和其他途径(CBWD1、PRAC2和ANKRD40)相关。CRC中以前未观察到的 9 个驱动因素与免疫系统(CDH1)、组蛋白修饰(SETD5)、转录调节因子(MIDEAS和NONO)、PI3K 信号传导(TYRO3)、细胞反应(FLCN)、核糖体蛋白(RPL10和RPL22)和UCH蛋白酶(MBD6)有关。
发现了两种不同的 RTK-WNT 通路共突变模式:(1) KRAS、APC和AMER1,以及(2) BRAF 和 RNF43(图S1a)。对于KRAS、APC 和 AMER1组,nHM 肿瘤具有共发生的PIK3CA和TCF7L2以及互斥的TP53和NRAS突变。在BRAF 和 RNF43肿瘤中, HM 肿瘤中的ACVR2A和nHM 肿瘤中的AKT1和TYRO3共现突变(图S1b)。在 TGFβ 通路中,nHM 肿瘤中的SMAD2和SMAD3中发现了共现突变,而HM 病例中的TGIF1与PIK3CA共现 。HM 肿瘤在B2M和HLA-A中存在相互排斥的突变,并且在KMT2B和CD58和ERBB3中存在共发生突变。总之,他们确定了 33 个额外的 CRC 驱动因素以及 CRC 通路内和跨 CRC 通路中以前未确定的共突变模式。

图1. 对 1063 个 CRC 基因组进行体细胞突变分析,确定了 96 个驱动基因。
(a) 该队列中有 96 个基因发生显著突变。(b) 每个肿瘤中总突变(蓝色)和非同义突变(红色)的患病率。(c) 21 例 HM 肿瘤病例中 15 例为 MSS,其中 DNA 损伤反应 (DDR) 基因突变。

图S1. 通过超突变状态显示的 96 个结直肠癌驱动基因中的互斥和共现基因突变。
(a-b)在非超突变和超突变肿瘤中检测到具有互斥或共现突变的显著基因对。
02
结构变异 (SV)和时序分析
为了涵盖 CRC 进展中的所有类型的基因组事件,他们汇总了拷贝数变异 (CNV) 和结构变异 (SV)。最常见的染色体臂畸变是约 50% 的肿瘤中 7p 和 20q 的增加,超过 40% 的肿瘤中 17p、18p 和 18q 的杂合性缺失 (LOH)(图2a)。在 nHM 肿瘤中发现的新的局灶性 CNV 包括包含MIR3713的 15q24.3 (25%) 、包含 ADAM 家族蛋白酶基因的 22q12.3 (24%) 和 8p11.22 (19%) 的缺失。与 HM 肿瘤相比,nHM 肿瘤中基因 CNV 的频率更高,平均影响 55% 的驱动基因,而 HM 肿瘤中为 11%。最常受 CNV 影响的驱动基因是GNAS和ASXL1,其中 82% 和 81% 的 nHM 肿瘤有增益和/或扩增,而SMAD4(79%)、SMAD2(77%)和TP53(76%)有更多的缺失和 LOH。在 HM 肿瘤中,抗原呈递基因HLA-B(26%)、HLA-A(25%)和TAP2(24%)的 LOH 频率最高,而TRPS1(26%)、ACVR1B(22%)、CYP7B1(22%)、MBD6(22%)和ERBB3(22%)的增益频率最高。缺失是最常见的 SV,主要发生在高级别肿瘤中,在 I 期肿瘤中较少。易位在老年患者以及 HM、MSI和高级别肿瘤中更常见。相比之下,倒位和串联重复在 HM、MSI肿瘤中不太常见(图2b)。一半的驱动基因 SV 是缺失,最常影响肿瘤抑制基因,包括RUNX1、PTEN 和SMAD3。最常受影响的 DNA 修复基因是RAD51B。在 250 个肿瘤 (24%) 中观察到染色体外 DNA (ecDNA),其中 91% 为 nHM。在 87 例(35%)ecDNA+病例中发现了环状扩增子,最常包含的致癌基因是ERBB2、FLT3、CDX2、CDK12和MYC。一项泛癌症研究24表明肿瘤 ecDNA 与较短的生存期相关,但在此未观察到总体生存期 (OS) 或无复发生存期 (RFS) 的 ecDNA 类型依赖性差异。
在大量 nHM 肿瘤中,CRC 进化过程中的基因组事件序列此前尚未确定。其中最早的事件是APC、TP53、KRAS、BRAF和ZFP36L2的体细胞突变,其次是TCF7L2、FBXW7、BCL9L和SOX9以及 17p 和 18 号染色体的丢失。其中(1) TP53和 17p 丢失是已知的早期突变,常见于多种癌症中;(2) APC、KRAS、BRAF和TP53突变驱动 CRC 发展;(3) ZFP36L2、TCF7L2、BCL9L和SOX9是癌症中此前未知的早期事件。晚期或亚克隆事件包括全基因组复制、1q、6p、9p、12、16p、17q 和 19q 的增加以及TRPS1、GNAS和CEP170的突变(图2c)。
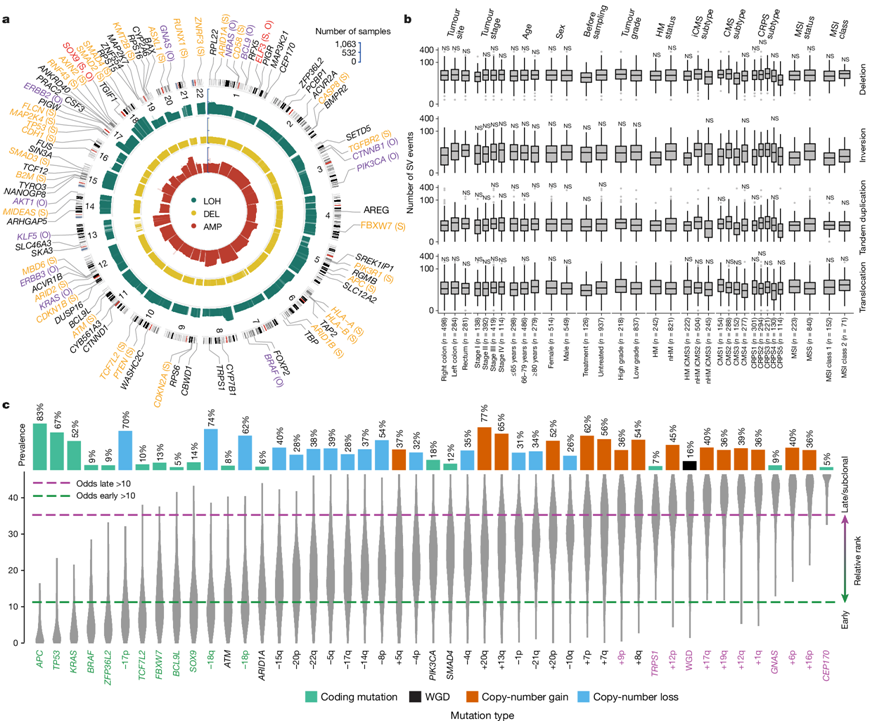
图2. CRC 中的结构变异和体细胞突变的相对时间。
(a) 驱动基因中的基因 CNV 按类型显示:LOH(绿色)、缺失(黄色)和扩增(红色)。条形高度与具有相应改变的肿瘤分数成正比。(b) 按临床、基因组和转录组特征显示的缺失、倒位、串联重复和易位的 SV 景观。(c) PhylogicNDT 统计的 801 nHM CRC 肿瘤中驱动基因突变和 SV 的流行率和相对时间。
03
突变特征分析
CRC 中的突变特征与衰老、错配修复 (MMR) 缺陷、聚合酶校对、大肠杆菌素暴露和未知病因有关。他们从头分析确定了 27 个单碱基替换 (SBS)、8 个双碱基替换 (DBS) 和 11 个小插入和缺失 (ID) 特征(图S3a-c)。在 27 个 SBS 特征中,25 个分解为 32 个 COSMIC SBS 特征(图S3a)。在 17 例肿瘤中发现了一种新的标记,称为 SBS-CRC1,均为 MSI 或POLE突变,并与有缺陷的 DNA MMR SBS15 标记相关。在 17 例低级别和 MSS 肿瘤中观察到另一个新的标记 SBS-CRC2,并与病因不明的标记 SBS128相关。值得注意的是,具有 DNA MMR SBS44 特征的 HM 肿瘤主要为右结肠,BRAF V600E 突变,较少见的 IV 期且 OS 更长(图S3d)。在 8 个 DBS 特征中,3 个可以分解为 6个 COSMIC DBS 特征(图S3b)。新的 DBS-CRC3 特征具有最高的体细胞突变密度,发生在 98% 的 MSI 病例中。缺陷的 DNA MMR 特征 SBS15 和 SBS44 与 DBS-CRC3 强相关,这与之前描述的 MMR 缺陷特征 DBS19 相似。与 MSS POLE突变肿瘤相关的特征 SBS10a 和 SBS10b与 SBS28同时出现和新的 DBS-CRC5 特征。最后,从 11 个 ID 特征中,9 个分解为 9 个 COSMIC ID 特征,其中最常见的 ID1(87%)和 ID2(98%)与复制过程中的 DNA 滑动有关(图S3c)。值得注意的是,新的 ID-CRC1 特征具有最高的体细胞突变密度(每 Mb > 10 个突变),89% 的 ID-CRC1 病例也具有缺陷的 DNA MMR 特征 SBS44。总共鉴定出 47 个已知突变特征和 9 个以前未知的突变特征(图S3e),其中 SBS28 和 DBS-CRC5 与POLE突变 MSS CRC 相关,SBS-CRC1、DBS-CRC3 和 ID-CRC1 特征与 MMR 相关,DNA MMR SBS44 特征与 OS 较长的 HM 肿瘤相关。

图S3. 识别新的和预后的体细胞突变特征。
(a-c) 单碱基替换、双碱基替换、和小插入和缺失的特征按每兆碱基突变负担中位数(红线)排序。(d) 具有 DNA 错配修复 SBS44 特征的 I-IV 期超突变肿瘤患者的总体生存率。(e) 新型和 SBS-CRC2、双碱基替换 DBS-CRC1、DBS-CRC2、DBS-CRC3、DBS-CRC4 和 DBS-CRC5 以及小插入和缺失 ID-CRC1 和 ID-CRC2 的特征分析。
04
驱动基因和融合基因的表达
来自同一批肿瘤的高质量基因组和转录组序列可以对基因突变和基因表达水平进行综合分析。RTK–RAS、PI3K、p53 和 TGFβ 通路基因EGFR、KRAS、PIK3CA、CDKN2A、TGFBR1和ACVR2A的肿瘤突变与基因表达增加有关,而APC、PTEN和TP53的突变在 nHM 和 HM 肿瘤中均有表达下降(图3)。尽管无义介导的衰变会使差异表达基因水平的解释复杂化,但在WNT通路驱动基因中,RNF43、AXIN2、SOX9、ZNRF3、CTNNB1和AMER1在肿瘤中的表达高出55-334%,而TCF7L2、APC和CTNND1在未受影响的对照结直肠组织中的表达高出15-24%。具有SOX9或TCF7L2突变的肿瘤相应基因的表达增加,而其他突变的WNT通路驱动基因的肿瘤表达降低。值得注意的是,与野生型肿瘤和仅携带一个基因突变的肿瘤相比,具有RTK/WNT通路BRAF和RNF43共突变的肿瘤具有较高的BRAF表达和较低的RNF43表达。与突变相关的表达降低表征了几个与抗原呈递(HLA-A、B2M和CDH1)、转录调控(ASXL1和NONO)、细胞凋亡(BAX)、组蛋白修饰(KMT2B)和核糖体功能(PPL22)相关的基因。
总共 621 个融合转录本在 338 个 nHM(41%)和 78 个 HM(32%)肿瘤中表达,其中 17 个是复发性的(图S6a)。最常见的融合基因是PTPRK、RSPO3、SEPTIN14、FBXO25和FBRSL1(图S6b)。在这些融合中,有 15 个是已知的 CRC 驱动基因,包括NTRK、BRAF和ERBB2融合,PTPRK-RSPO3融合可促进分化和干性丧失,以及未表征的FBXO25-SEPTIN14融合(图S6c)。

图3. CRC 信号通路中体细胞改变和基因表达水平的综合分析。

图S6. 结直肠癌预后亚型(CRPS)中的体细胞突变和拷贝数变异。
(a) CRPS 亚型显示的 1063 个结直肠肿瘤的 96 个驱动基因中的体细胞突变。(b) CRPS 亚型显示的 96 个驱动基因中的体细胞拷贝数变异的频率和类型。(c) 由 GISTIC 确定的 CRPS 亚型显示的局部拷贝数区域。
05
预后基因表达特征
共识分子亚型 (CMS) 分类系统是最先进的基于基因表达的 CRC 分类,但由于大多数 CRC 在反卷积时由几种 CMS 亚型组成,因此他们提出了一种单细胞分辨率 (iCMS) 的精细分类。在这个称为 CRC 预后亚型(CRPS)的新分类中,97% 的 CMS1 肿瘤归类为 CRPS1,CMS2 肿瘤分布在 CRPS2(39%)和 CRPS3(59%)之间,68% 的 CMS3 肿瘤归类为 CRPS5,CMS4 肿瘤分布在 CRPS2(38%)和 CRPS4(45%)(图4a)。重要的是,除 3 个肿瘤外,所有肿瘤均归类为 CRPS,其中大多数归类为 CRPS1 和 CRPS2。CRPS1 组包含 88% 的 HM 病例,而只有 56% 归类为 CMS1。因此,CRPS1 肿瘤最常发生在右结肠(79%)、老年(中位年龄 76 岁)和女性(61%)患者中,并且体细胞 SNV 患病率最高,CNV 患病率最低(图S6a-c)。CRPS2 和 CRPS3 亚型在解剖位置之间分布均匀,BRAF突变频率较低(图S6a)。CRPS4 肿瘤通常为直肠肿瘤(47%),并表现出基质、TGFβ 和 WNT 通路激活,与 CMS4 一致(图4b)。最后,CRPS5 肿瘤通常来自右结肠 (46%),显示 WNT 信号抑制,并且KRAS、PIK3CA和FBXW7突变的患病率最高,但与 CRPS2–CRPS4 相比,TP53突变和 CNV 较少(图4b,图S6a-b)。重新聚类的 CRPS 病例的分布对于去除 IV 期和预后病例具有稳健性。CRPS 亚型对 I-IV 期 OS ( P = 0.01)、I-III 期 RFS ( P = 0.025)(图4c)和复发后生存率 (P = 0.034)具有预后意义,其中 CRPS2 和 CRPS3 与最长的 OS 和 RFS 相关,CRPS4 与最短的 OS 和 RFS 相关,CRPS5 与较短的 RFS 相关,而 CRPS1 的复发后生存率最差。分配给 CRPS2 的 CMS4 病例与分配给 CRPS4 的病例相比具有更长的 OS(图4d),这可能反映 CRPS2 中的成纤维细胞、巨噬细胞和树突状细胞的密度介于 CRPS3 和 CRPS4之间(图4b)。为了加深对 nHM 肿瘤的了解,他们通过 CRPS、CMS 和 iCMS 亚型确定了预后特征。预后不良的 nHM iCMS3 肿瘤主要是 CRPS1 和 CRPS4–CRPS5,在突变谱和临床结果方面显示出相似性。与 iCMS2 肿瘤相比,它们的总体 CNV 负荷较低,但一些晚期 CNV 缺失与较短的生存期相关,而BRAF和RNF43突变则是早期事件。大多数 nHM iCMS2 肿瘤为 CRPS2-CRPS3。20q11 的扩增与较长的生存期相关,这与 CRPS2的主要贡献特征相一致。在 nHM CMS4 肿瘤中,归类为 CRPS4 的肿瘤分为 iCMS2 和 iCMS3,而归类为 CRPS2 的肿瘤主要是 iCMS2。这可以解释这些肿瘤从更广泛的 CMS4 类别中分离出 CRPS2 和 CRPS4 亚型,后者的 CMS4 病例生存期较短(图4d)。CRPS4 的预后相对较差可能源于大多数肿瘤表现出 iCMS3 特征。

图4. 从 1063 个 CRC 转录组数据中总结的预后亚型。
(a) 对同一数据集的 CRPS 与 CMS 进行比较。分配给每种亚型的样本比例显示为肿瘤总数的百分比。标出了每个 CRPS 和 CMS 亚组的主要分子和临床特征。(b) 根据 CRPS 分类的 1063 个样本的转录组特征。(c-d) Kaplan-Meier 生存曲线。
+ + + + + + + + + + +
结 论
本研究分析了长期随访的基于人群的队列中 1063 个原发性结直肠癌的全基因组和转录组数据。在 96 个突变的驱动基因中,9 个以前与结直肠癌无关,24 个与任何癌症无关。观察到两种不同的通路共突变模式,时间分析确定了九个早期驱动基因突变和三个晚期驱动基因突变,并确定了几种结直肠癌特异性突变过程的特征。WNT、EGFR 和 TGFβ 通路基因和 3 个调控元件的突变以及 21 个拷贝数变异和 COSMIC SBS44 特征与生存期相关。基因表达分类产生了五种具有不同分子特征的预后亚型,部分原因是潜在的基因组改变。这项研究构成了结直肠癌最大的综合基因组和转录组分析,并将突变、基因表达和患者结果相互关联。
+ + + + +



 English
English


