文献解读|Cell(45.5):对患有实体肿瘤的儿童进行系统级免疫监测以实现精准医疗
✦ +
+
论文ID
原名:Systems-level immunomonitoring in children with solid tumors to enable precision medicine
译名:对患有实体肿瘤的儿童进行系统级免疫监测以实现精准医疗
期刊:Cell
影响因子:45.5
发表时间:2025.01.20
DOI号:10.1016/j.cell.2024.12.014
背 景
近几十年来,强化风险疗法提高了癌症儿童的存活率,但改善率已趋于稳定。患有实体瘤的儿童亚群仍然预后不佳,目前的治疗方案与儿童癌症幸存者的严重晚期毒性有关。治愈癌症的能力依赖于多模式疗法,使用药物组合杀死癌细胞并支持对任何残留肿瘤细胞的有效免疫反应。增加对肿瘤生物学以及儿童免疫系统的了解,对于进一步提高儿童癌症幸存者的存活率和生活质量至关重要。癌症是儿童疾病死亡的主要原因。生存不仅取决于手术、细胞抑制药物和放射治疗,还取决于全身免疫反应。影响不同年龄和肿瘤类型儿童的这些免疫反应的因素尚不清楚。新型免疫疗法可以增强抗肿瘤免疫反应,但很少有儿童从中受益,而且缺乏有效反应的标志物。
实验设计
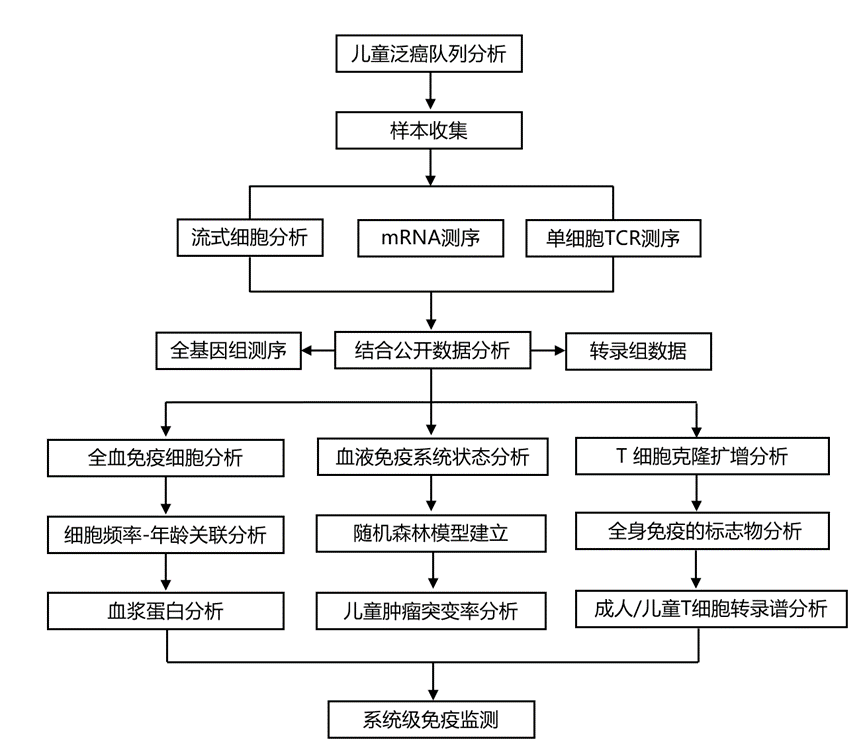
结 果
01
儿童癌症患者群体分析
为了了解不同实体瘤儿童的全身免疫系统差异,研究团队在瑞典斯德哥尔摩卡罗琳斯卡大学医院儿科肿瘤中心招募了 191 名儿童。这些儿童均在 2018 年 3 月至 2024 年 2 月期间确诊。儿童抗癌免疫系统(ISAC) 队列包括确诊时年龄为 0-18 岁的儿童,其中女性 94 人,男性 97 人(图 1 A),其年龄和性别分布与瑞典儿童癌症患者的人口分布一致。他们招募了患有所有形式实体瘤的儿童,包括罕见肿瘤和淋巴瘤,但故意排除了患有白血病的儿童,因为白血病儿童针对肿瘤细胞的免疫细胞反应很难与类似造血来源的恶性细胞区分开来。本文报告的 191 名患者患有 34 种不同类型的肿瘤,其中 44% 涉及中枢神经系统 (CNS),其余为颅外肿瘤,其中神经母细胞瘤、Wilms 肿瘤和霍奇金淋巴瘤是最常见的肿瘤类型(图 1 B)。确定不同实体瘤的治疗结果具有挑战性,但当考虑诊断后 1 年的临床反应(每种肿瘤类型都有唯一定义)时,他们发现非转移性颅外肿瘤患者大多 (82%) 在诊断后的第一年没有出现进展。在诊断时患有转移性颅外肿瘤(包括淋巴瘤)的儿童中,64% 的患儿在 1 年后病情无进展或稳定。 ISAC 队列反映了儿童时期的实体瘤疾病谱,纳入多种肿瘤类型可以进行跨肿瘤类型比较,并描述与年龄、性别、肿瘤类型和结果相关的全身免疫变化。
鉴于某些肿瘤(如视网膜母细胞瘤)在幼儿中发病率更高,而其他肿瘤(如骨肿瘤和淋巴瘤)在青少年中发病率更高(图 1 B),成熟程度不同的免疫系统对此类肿瘤的反应可能有所不同。另一方面,某些肿瘤类型(如胚胎中枢神经系统肿瘤和肝脏肿瘤)在诊断时呈现双峰年龄分布(图 1 C),这表明诊断时的年龄可能会影响抗肿瘤反应,即使在同一肿瘤类型中也是如此,这是因为临床实践中很少考虑到免疫成熟状态的差异。
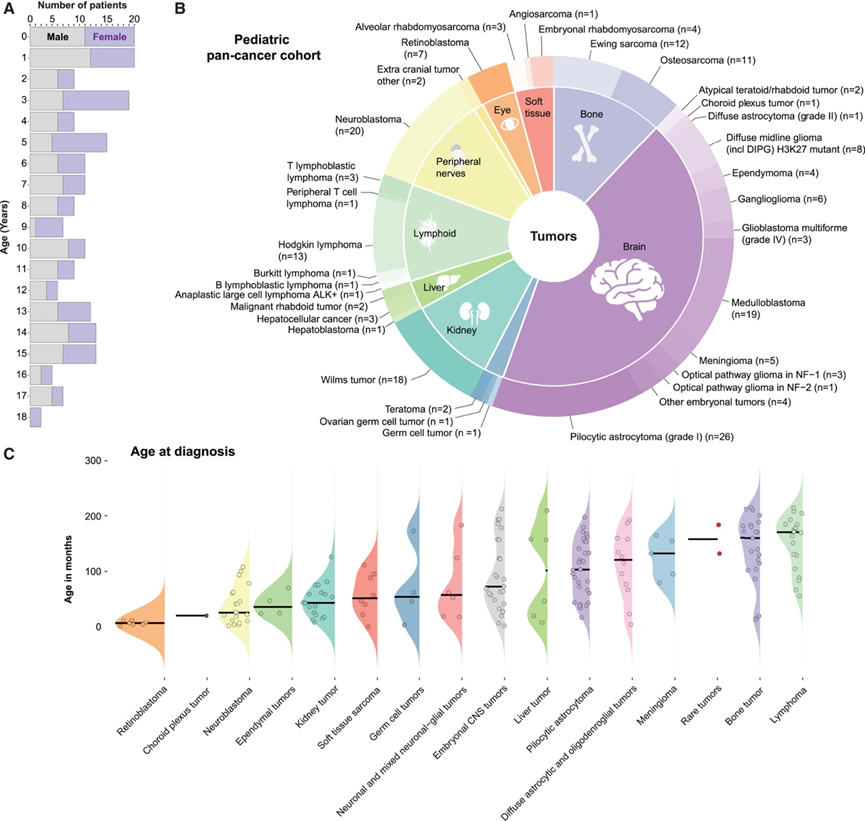
图1. 基于人群的儿童泛癌症队列。
(A) 按诊断年龄划分的男孩和女孩的数量。(B) ISAC 研究中纳入的 n = 191 名儿童中 34 种肿瘤类型的分布。(C) 以中位数条显示每种肿瘤类型的诊断年龄分布。
02
儿童的全身免疫力因年龄和肿瘤类型而异
他们重点关注诊断时和治疗前采集的血液样本,进行了系统级分析,包括单细胞分析、通过免疫测定分析(Olink、Target 96、Immune-oncology)、血浆蛋白组分析和全血 mRNA 测序(图 2 A)。总共通过质谱流式细胞分析了 20932184 个免疫细胞,并通过 FlowSOM(用于分析和可视化流式细胞数据的自组织映射 [SOM])将其分为 13 个细胞谱系的 114 个免疫细胞聚类。他们通过计算样本之间的成对距离(Aitchison)评估了整体免疫细胞组成,并通过经典多维缩放(MDS)将其可视化,按患者年龄(月)对样本着色(图 2 B)。虽然可以看到年龄梯度,但与没有癌症的儿童相比,年龄相关的变化程度较小(图2B)。同样,当使用主成分分析 (PCA) 可视化血浆蛋白丰度时,没有明显的年龄梯度,前两个主成分解释了总方差的 46%(图 2C)。他们也没有观察到其余主成分与年龄的相关性。为了更好地了解细胞组成差异的贡献者,他们使用线性模型回归出主要细胞类型的无法解释的方差和批次差异。然后,他们将剩余的方差分解为肿瘤类型、年龄、性别和年龄-性别(交互项),以捕捉可能的青春期效应(图 2D)。自然杀伤 (NK) 细胞和 γδT 细胞的性别差异最大,但其他细胞类型的差异较小,这一点很有趣,因为最近有研究显示性激素会影响细胞频率和功能,并且一些 ISAC 受试者在诊断时已进入青春期,而另一些受试者尚未进入青春期(图 2D)。他们发现肿瘤类型是解释不同免疫细胞频率的最重要因素,对单核细胞的影响最大(图 2D)。关于血浆蛋白测量,他们首先评估了变化最大的蛋白质,其中包括促炎性白细胞介素 (IL)-6、干扰素 (IFN)γ 和 IL-8(图 2E)。对于标准化方差高于平均值的前 27 种蛋白质,他们分解了肿瘤类型、年龄和性别的贡献。中位未解释方差和批次方差分别为 55%和 7%。血浆蛋白水平甚至更强烈地受肿瘤类型决定(图 2 F),这表明肿瘤特异性泄漏因子和免疫反应蛋白可指示儿童的特定肿瘤类型。
为了区分年龄相关变化与肿瘤免疫反应,他们对不同年龄段的健康儿童(n = 295)进行了取样,并通过质谱流式细胞技术分析了稳定的全血细胞。在健康儿童和癌症儿童中都观察到了显著的年龄相关变化。中性粒细胞丰度在出生的第一年最低,随后在 10 岁之前增加至成人水平,但在研究的每个年龄段,癌症儿童的中性粒细胞比例均升高(图 2G)。相反,癌症儿童的 NK 细胞频率较低(图 2H),而 B 细胞在研究的年龄段内变化较大(图2I)。与健康儿童相比,5 岁以下 ISAC 患者的CD4 + T 细胞较低,而癌症儿童的CD8+ T 细胞频率在整个年龄段内始终较低(图 2J-K)。中性粒细胞与淋巴细胞比率 (NLR) 反映全身炎症,与各种癌症成人的预后不良有关。在 100 项研究中的 40000 多名癌症患者中,NLR > 4 与不良预后相关,与肿瘤类型、分期和部位无关。健康儿童和癌症儿童的 NLR 都会随着年龄的增长而增加,但癌症儿童的 NLR 在每个间隔期都更高,进一步强调了实体瘤儿童的全身免疫力(图 2 L)。这些结果不仅扩展了先前在各个儿科肿瘤类型中的结果,而且还表明在制定癌症儿童的预后 NLR 阈值时,年龄至关重要。
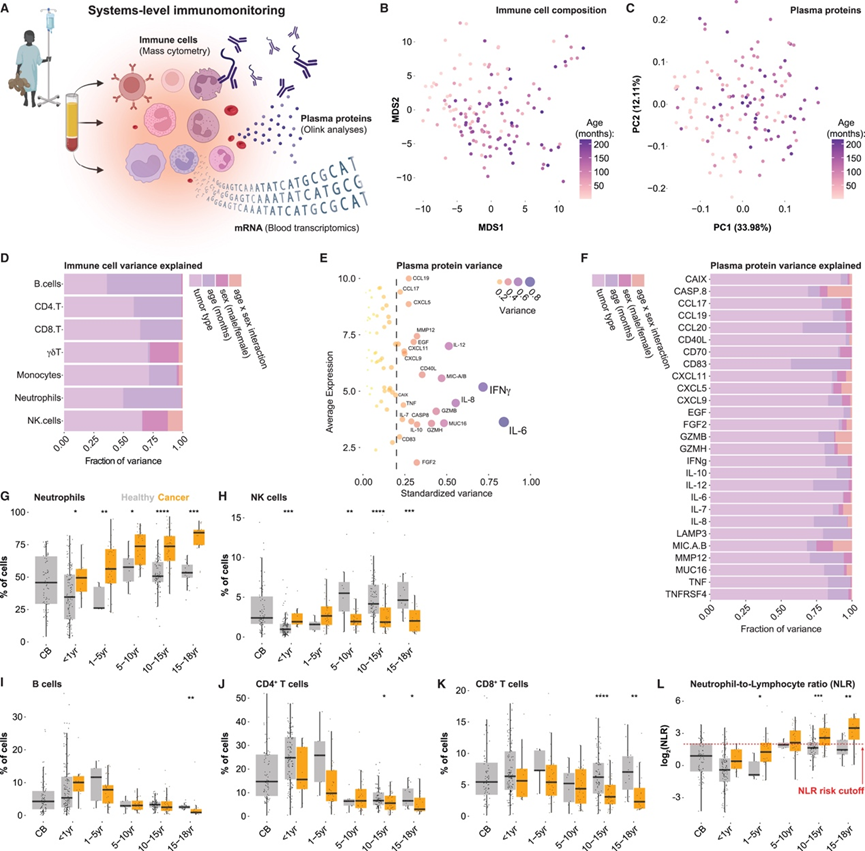
图2. 诊断患有癌症的儿童的免疫细胞组成和血浆蛋白的基线变化。
(A) 通过质谱流式细胞分析全血免疫细胞,用 Olink 检测法定量血浆蛋白,并研究转录组。(B) 基于n = 104 个免疫细胞群体,通过质谱流式细胞分析n = 140 个样本的多维尺度 (MDS) 图 ,并按基线采样时的年龄着色。(C) 通过 Olink 检测 77 种血浆蛋白,对n = 138 个样本进行主成分分析 (PCA)。(D) 通过质谱流式细胞检测的免疫细胞频率的变化。(E) 通过 Olink 检测测量的血浆蛋白的平均表达值与标准化方差。(F) 变化最大的蛋白质。(G) 对来自不同队列的n = 297 名健康儿童和ISAC 中的n = 140 名患者的全血细胞进行质谱流式细胞分析。(H-K)免疫细胞的相对频率。(L) 中性粒细胞与淋巴细胞比率 (NLR)。
03
血液免疫系统状态可区分肿瘤患者群体
为了更好地了解不同肿瘤类型对免疫系统状态的影响,他们比较了颅外和颅内肿瘤患儿的血细胞群丰度和血浆蛋白水平。使用随机森林分类器,能够将这些儿童组分开(图 3 A)。促炎细胞因子 IL-6 和促血管生成因子血管生成素-2 (ANGPT2) 与多种人类癌症的不良预后有关,也是颅外肿瘤患儿与颅内肿瘤患儿相比最显著的特征(图 3 B)。
一些血浆蛋白表现出肿瘤特异性表达模式,例如碳酸酐酶 9 (CAIX),这是一种在胆囊和胃肠道粘膜中高度表达的蛋白质。CAIX血浆水平升高仅见于患有肝肿瘤的儿童(图 3C)。CXCL13 是一种趋化因子,通常不是由循环中的免疫细胞产生的,而是由淋巴组织中的滤泡树突状细胞产生的。然而,在患有淋巴瘤的成人中已显示出异常表达,他们还发现患有霍奇金淋巴瘤和非霍奇金淋巴瘤的年轻人血浆 CXCL13 水平升高(图 3C)。肿瘤组也可以通过特定的血浆蛋白来区分,例如促炎细胞因子 IFNγ、IL-12 和肿瘤坏死因子 (TNF),它们参与抗肿瘤 1 型免疫,并且在患有肝肿瘤、肾肿瘤、神经母细胞瘤、淋巴瘤和视网膜母细胞瘤的患者中上调(图 3C)。患有胚胎中枢神经系统肿瘤和脑膜瘤的儿童中,这些 1 型细胞因子的全身水平较低(图 3C)。通过成对欧几里得距离对肿瘤血浆蛋白谱进行聚类,显示出三个主要聚类,其中肝肿瘤为异常值(图 3D)。随机森林分类和特征重要性测试表明,聚类 #2(强 1 型免疫)和聚类 #3(中等 1 型免疫)不仅由 TNF 分隔,还由血管生成因子 ANGPT2 分隔,该因子在聚类2肿瘤(肾、神经母细胞瘤、淋巴瘤和视网膜母细胞瘤)中较高(图 3E)。综上所述,这些结果进一步强调了肿瘤与全身免疫之间的相互作用,对改进诊断测试和疾病监测具有重要意义。
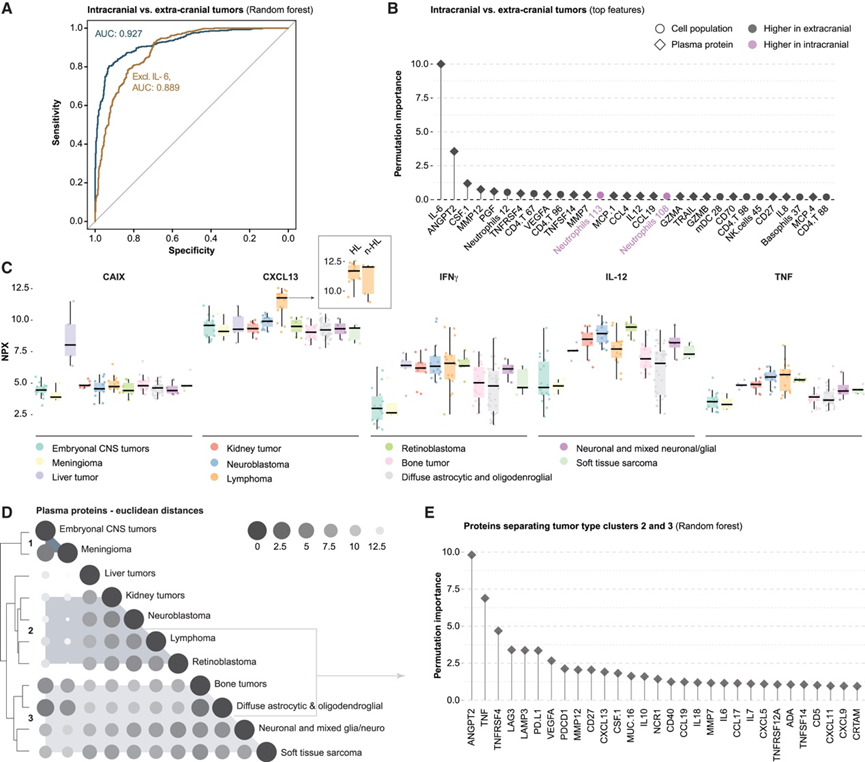
图3. 肿瘤特异性免疫特征。
(A) 基于质谱流式细胞测量的细胞群体频率和血浆蛋白测量 的双交叉验证随机森林分类器区分颅内和颅外肿瘤 。(B) 随机森林分类器中留一法分析颅内和颅外肿瘤的特征重要性。(C) 选定的血浆蛋白在肝肿瘤(碳酸酐酶 IX [CAIX])和淋巴瘤(CXC 基序趋化因子配体 13 [CXCL13])中表现出肿瘤特异性丰度。(D) 11 种肿瘤类型(n = 135 个血浆样本)血浆蛋白谱之间的成对距离(欧几里德距离)显示具有相似蛋白谱的三类肿瘤类型。(E) 双重交叉验证随机森林分类器将中的肿瘤类型聚类#2和#3分开,显示聚类2肿瘤的血浆样本中最高区分性的血浆蛋白均较高。
04
免疫细胞浸润、TMB 和全身免疫
除肿瘤突变负担 (TMB)外,许多成人癌症的另一个重要预后标志物是免疫细胞浸润程度,两者之间的关系很复杂,可能取决于全身免疫系统状态,而在儿童肿瘤中了解甚少。为了解决这个问题,他们使用EPIC(估计免疫细胞和癌细胞的比例)算法对来自肿瘤组织样本的mRNA 测序数据进行处理,分析了免疫细胞、肿瘤细胞以及癌症相关成纤维细胞和内皮细胞的频率。他们按肿瘤类型对 110 个肿瘤标本进行排序,并在每种肿瘤类型中按 TMB 对受试者进行排序,并根据 mRNA 测序数据显示每个肿瘤的相对细胞比例(图 4 C)。正如预期的那样,不同肿瘤类型在细胞组成方面存在重要差异;在肉瘤和 Wilms 肿瘤中发现高水平的癌症相关成纤维细胞,而在星形细胞瘤和其他脑肿瘤中存在大量内皮细胞(图 4C)。平均而言,神经母细胞瘤中的 T 细胞浸润最高,但在测序的标本中差异很大(图 4C)。当比较具有不同 TMB 的肿瘤时,突变负担较高的肿瘤中 T 细胞浸润呈更高的趋势(图 4C)。事实上,将测序的 110 个肿瘤中每种免疫细胞群的比例与 TMB 相关联时,他们发现神经母细胞瘤(图 4D)和 Wilms 肿瘤(图 4E)中肿瘤中的CD8 + T 细胞丰度与 TMB 之间存在统计学上显著的正相关性,但在分析了超过五名患者的其他肿瘤类型中并非如此。他们还研究了血液中的全身免疫参数及其与神经母细胞瘤和 Wilms 肿瘤中肿瘤免疫细胞组成的相关性,发现神经母细胞瘤和 Wilms 肿瘤患儿血液中的循环 CD8+ T 细胞比例与肿瘤浸润 CD8 + T 细胞之间存在负相关性。与神经母细胞瘤肿瘤中 CD8+ T 细胞浸润最密切相关的血浆蛋白是检查点分子淋巴细胞激活 3 (LAG3),而 CD8+ T 细胞浸润到 Wilms 肿瘤与血浆集落刺激因子 1 (CSF-1)、TIE2、腺苷脱氨酶 (ADA) 和程序性细胞死亡 1-配体 2 (PD-L2) 有关。TMB 和免疫细胞浸润是神经母细胞瘤和 Wilms 肿瘤中的相关特征,依赖于全身免疫,并与先前报道的作为有效抗肿瘤免疫反应标志物的血浆蛋白相关,例如 s-LAG3 和 s-PD-L2。
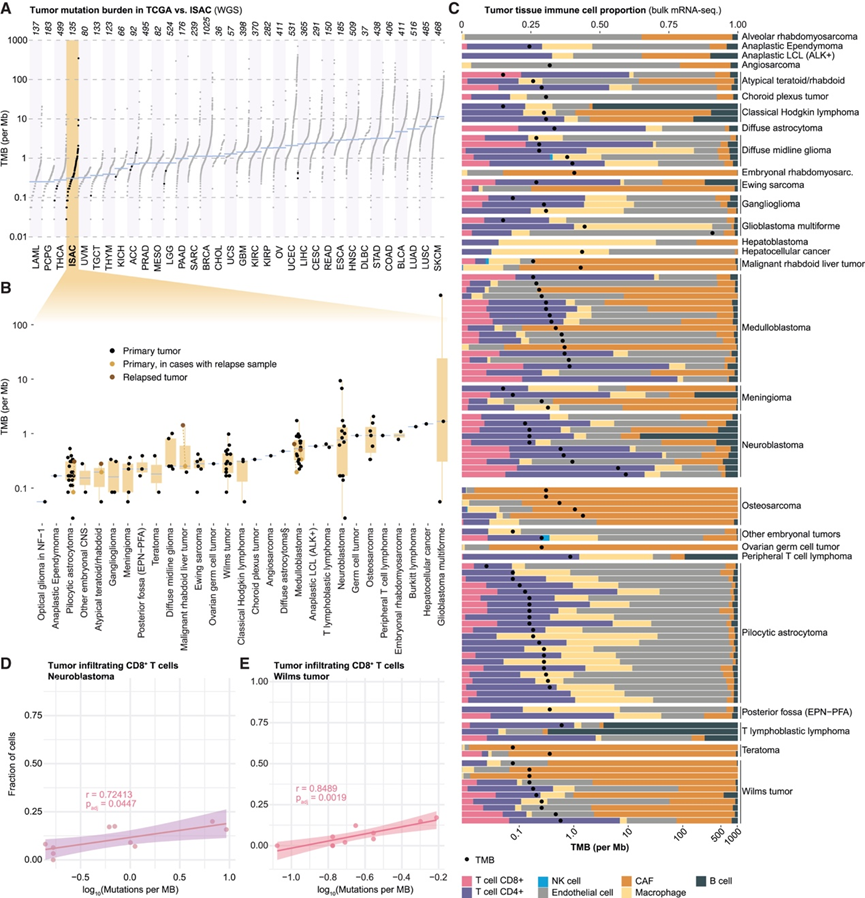
图4. 肿瘤遗传学与血液免疫系统状态。
(A) 全基因组测序中每兆碱基 DNA 的肿瘤突变负担 (TMB)。(B)ISAC 样本的 TMB 按肿瘤类型划分,基线样本或复发样本以不同的颜色划分,并连接到相应的原发性肿瘤样本。(C) 所示肿瘤样本的肿瘤组织mRNA 测序以及排除肿瘤细胞后估计的免疫细胞和基质细胞比例。(D-E) CD8+ T 细胞比例与神经母细胞瘤和Wilms 肿瘤组织样本中的 TMB 相关。
05
诊断时血液和肿瘤组织中克隆扩增的 T 细胞
遇到同源抗原并离开肿瘤引流淋巴结的肿瘤特异性 T 细胞将重新循环到血流中,可识别为血液中克隆扩增的 T 细胞。这种扩增的程度与肿瘤内的局部扩增相关。为了分析患有实体瘤的儿童的 T 细胞反应,他们首先使用 TRUST4(使用剪接转录本 4 进行肿瘤识别)算法在诊断时提取的肿瘤组织中的mRNA测序中寻找扩增的 T 细胞受体 (TCR) 基因(图 5 A)。鉴于神经母细胞瘤中 T 细胞浸润丰富,他们重点研究了七个神经母细胞瘤肿瘤和一个具有大量 mRNA 测序数据的骨肉瘤肿瘤,但发现 TCRA、TCRB、TCRG 和 TCRD 基因的指数非常低,表明在这些肿瘤中诊断时 T 细胞克隆扩增很少见(图 5 A)。他们还从这些患者的血液中分选了记忆 αβT 细胞和 γδT 细胞,并进行了单细胞 TCR(VDJ)测序和 mRNA 测序。他们检测了肿瘤和血液之间重叠的 TCR 基因,但发现重叠非常有限,患者 ISAC031(神经母细胞瘤)的 TCRA 基因除外,其中 30% 的 TCRA 基因在肿瘤和血液之间重叠(图 5B)。当比较来自n = 42 名患者的配对血液和肿瘤样本的更深层次的 mRNA 测序数据时,TCRA 和 TCRB 基因(图 5C)或 TCRG 和 TCRD 基因几乎发生重叠。用于血液 T 细胞的单细胞 TCR 测序方法可以精确分析具有配对受体链的克隆扩增,但每个样本只能对有限数量的 T 细胞进行测序。虽然儿科患者在诊断时表现出很少的克隆扩增(图 5 C),但在复发时(ISAC100)纳入的一名儿童在取样前接受过化疗,其 CD8 + T 细胞大量克隆扩增,表明可能存在治疗效果(图 5 D)。复发肿瘤内的 TCR 基因没有重叠,肿瘤本身的扩增也很少(图 5 A-5B)。当比较 1 年无进展生存期的儿童和未无进展生存期的儿童时,基线克隆扩增程度没有明显差异(图 5 D),在另外 5 名没有重叠肿瘤数据的儿童血液中也观察到了类似的结果(图 5E)。
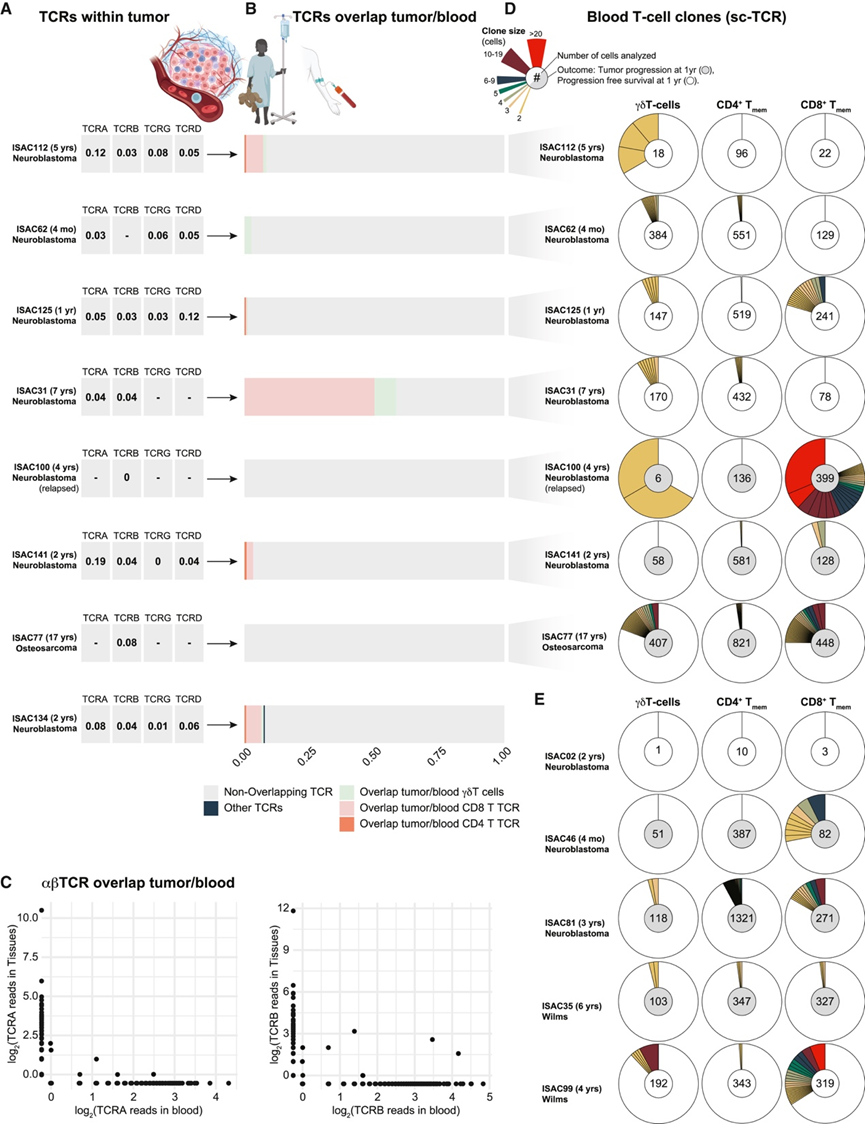
图5. 肿瘤内和血液中的T细胞克隆扩增。
(A) 使用 TRUST4 对诊断时肿瘤组织的大量 mRNA 测序,研究 TCR 基因 TCRA、TCRB、TCRG 和 TCRD 的相对扩增(克隆性指数)。(B) 同一患者的 mRNA 测序结果显示肿瘤和血液 TCR 序列重叠。(C) 来自患者的血液和肿瘤组织的大量 mRNA 测序数据中的 TCRA 和 TCRB。(D-E) 从所示患者中富集的记忆性 αβT 细胞 (CD45RA−) 和 γδT 细胞,并进行单细胞 VDJ (scVDJ) 测序 (BD Rhapsody)。
06
儿童癌症精准医疗
系统免疫监测抗肿瘤免疫反应所提供的增强分辨率对儿科肿瘤学的个性化医疗具有巨大潜力。为了说明这一点,他们分析了一名 2 岁患有高危神经母细胞瘤的儿童在治疗前和 22 个月治疗期间不同干预措施之间采集的纵向血液样本(图 6 A)。在每个时间点,他们分析了免疫细胞谱以及记忆 T 细胞的单细胞 TCR 和转录组(图 6 A)。该患者对治疗反应良好,并从 4 个月起在其 CD8 + T 细胞区室中表现出强烈的克隆扩增(图 6 A)。他们在连续样本中追踪了记忆 CD8 + T 细胞的单个克隆,分别揭示了克隆扩增和收减少(图 6 B)。为了将这些克隆映射到可能的特异性,他们使用通过互补位热点 2 (GLIPH2) 对淋巴细胞相互作用进行分组来对 TCR 序列进行聚类。将四个克隆映射到病毒特异性(流感 A/B 病毒 (FLUAV/FLUBV)、Epstein-Barr 病毒 (EBV) 或巨细胞病毒 (CMV))中,这些克隆来自先前分析的多聚体分选 T 细胞。在整个 22 个月的监测期内均可观察到这些病毒特异性 T 细胞,而其余 T 细胞克隆则遵循两种不同模式之一,即减少或扩增;在诊断后 5-9 个月,即高剂量化疗和自体干细胞移植 (auto-SCT) 后立即发生了急剧转变(图 6 C)。鉴于该儿童的临床反应良好,他们研究了 CD8 + T 细胞收缩和扩增克隆之间的转录差异(图 6 D)。从 9 个月开始扩增的克隆与减少克隆的不同之处在于,半乳糖凝集素 1 (LGALS1)、杀伤细胞颗粒酶 (GZMB) 和分形因子受体 (CX3CR1) 的表达更高,这些受体此前与多种癌症中有效的抗肿瘤 T 细胞反应有关(图 6D)。收缩克隆表达CD69 ,这是 T 细胞上的早期活化标记,而扩增克隆表达归巢受体S1PR1 ,这是 T 细胞通过淋巴结运输到远端组织时依赖的受体(图 6D)。9个月以后CD8+ T 细胞克隆替换的血浆蛋白相关性为CD40L /CD40、CXCL5和 IFNγ 增加,但全身炎症标志物 (IL-6、IL-8) 减少,血浆 GZMA、GZMB 水平降低(图 6E)。这项单一患者分析说明了全身免疫的动态性质以及系统级免疫监测在个性化干预方面的潜力,以便在未来以数据驱动的方式更好地促进抗肿瘤免疫反应。
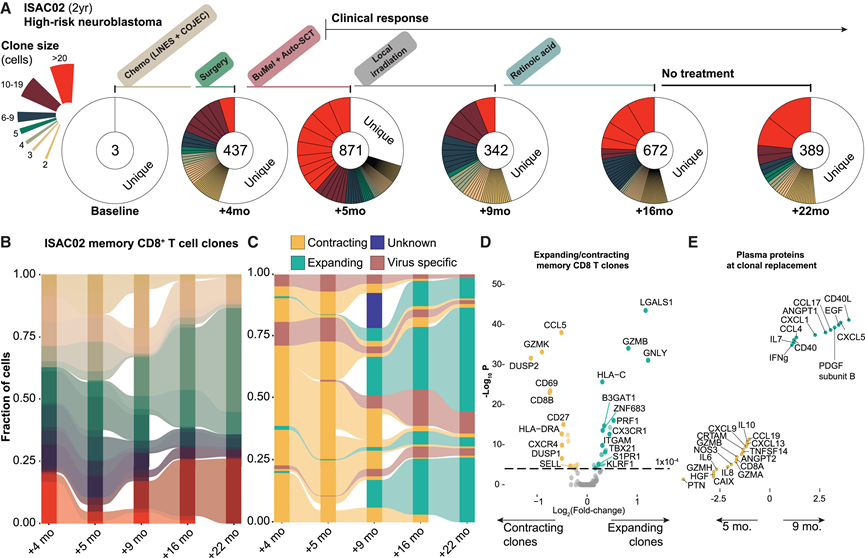
图6. 神经母细胞瘤患儿治疗期间T细胞克隆扩增。
(A) 使用 BD Rhapsody 从基线(治疗前)和指定干预后收集的六个纵向样本中对记忆性 CD8+ T 细胞 (CD45RA −) 进行分选和 scVDJ 和 mRNA 测序。(B) 与(A)中相同的儿童在治疗过程中的克隆扩张和收缩,每个流代表一个克隆。(C) 自体干细胞移植(ASCT)和高剂量治疗后5至9个月治疗期间的克隆替换。(D) 自体干细胞移植(ASCT)和高剂量治疗后5至9个月治疗期间的克隆替换。(E) 诊断后 5-9 个月断点处发生的导致缓解的克隆替换的血浆蛋白相关性。
07
儿童和成人CD8 + T 细胞反应比较
免疫检查点抑制剂为患有各种癌症的成年人带来了重要进展,但在患有实体瘤的儿童中报告的成功率有限。他们将ISAC 队列中儿童的克隆扩增记忆 CD8+ T 细胞反应与其他人先前发表的成年患者的反应进行了比较。通过靶向单细胞 mRNA 测序分析了四名患有低TMB 的神经母细胞瘤儿童、三名患有高 TMB 神经母细胞瘤的儿童、一名患有未知突变率神经母细胞瘤的儿童、两名患有 Wilms 肿瘤的儿童和一名患有骨肉瘤的儿童的 T 细胞 mRNA 转录本。对于每个数据集,他们根据转录本在克隆扩增的记忆 CD8 + T 细胞中的富集情况对其进行排序。他们将这些来自儿童 CD8 T 细胞的排序列表与来自成年结直肠癌患者(CRC)血液样本的可比列表进行了比较(图 7 A)。在儿童和成人癌症患者中,克隆扩增的 CD8 + T 细胞中最富集的转录本是细胞毒性标志物(NKG7、GZMH、GZMB、IFNG和PRF1)(图 7 A)。进一步将儿童样本与肾癌或肺癌(图 7 B)或非小细胞肺癌 (NSCLC)(图 7 C)成人的 CD8 + T 细胞进行比较,发现在各种肿瘤类型的儿童和成人 CD8 + T 细胞中克隆扩增和非扩增细胞中富集转录本的模式相似。这些结果表明,克隆扩增的 CD8 + T 细胞在成人和儿童以及多种类型的肿瘤中受到类似的转录调控。他们没有发现任何证据表明存在儿科特异性检查点分子或其他调节途径,可以解释:与患有实体瘤的成年人相比,检查点抑制对儿童的疗效较低。
他们假设儿童和成人之间在初始触发和克隆扩增 CD8 + T 细胞的总体频率方面可能存在差异。他们分析了成人和儿童每个样本中克隆扩增的记忆性 CD8 + T 细胞在总记忆性 CD8 + T 细胞中所占的比例。这些结果证实,儿科患者的扩增克隆比例低于成人患者,但三名患有高度突变和高风险神经母细胞瘤的儿童除外(图 7 D)。这些结果表明,未来增强儿童抗肿瘤 CD8 + T 细胞反应的策略应侧重于通过使肿瘤更具免疫原性来改善触发和克隆扩增,而不是应用检查点抑制来释放受抑制的 CD8 + T 细胞反应。
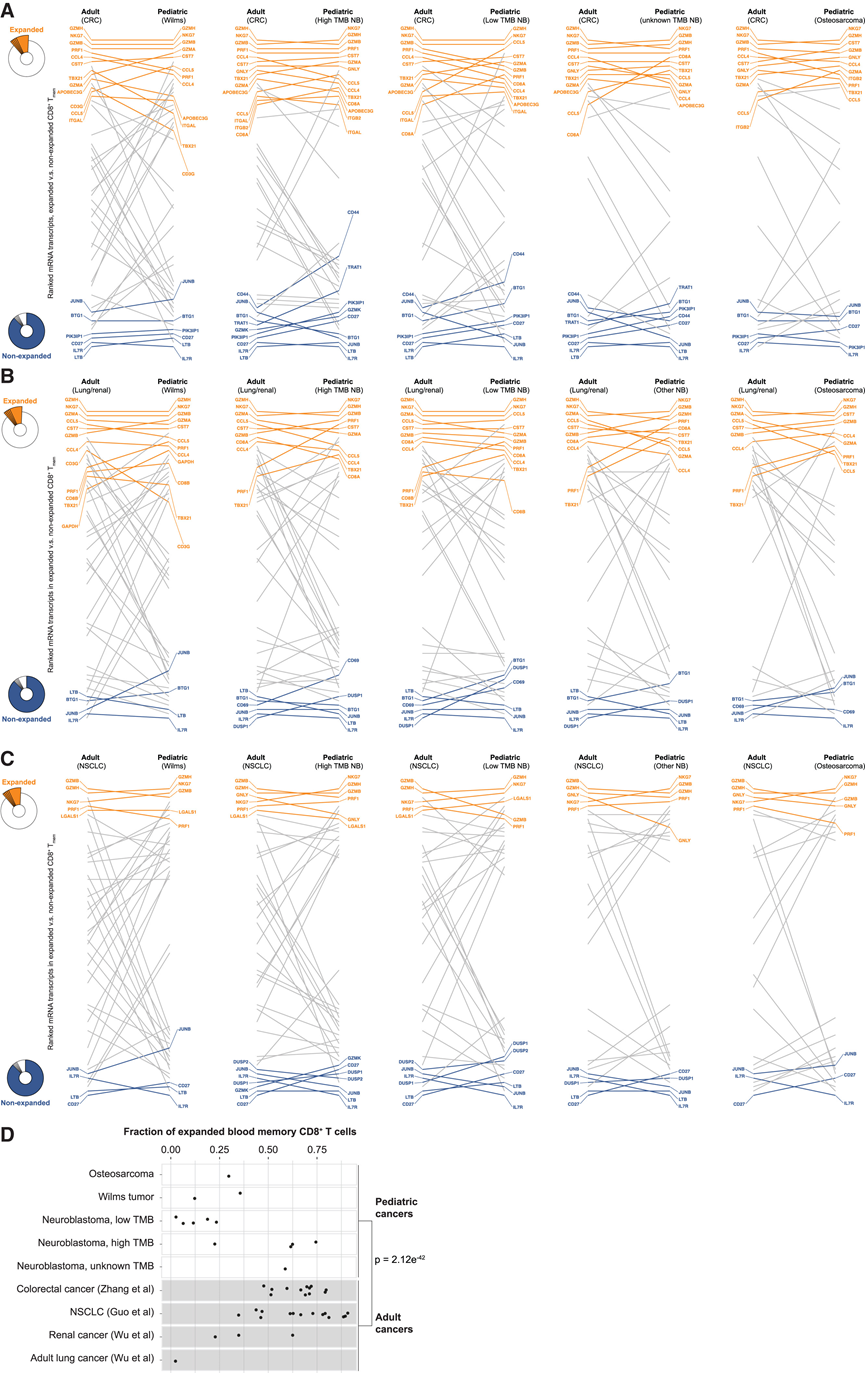
图7. 成人和儿童血液中扩增的 CD8 + T 细胞的转录谱。
(A) 对记忆性 CD8+ T 细胞进行单细胞 VDJ 测序和 mRNA 测序,以及按克隆扩增与未扩增的记忆性 CD8+ T 细胞中过表达排序的 mRNA 转录本。(B-C) 将儿科患者样本与成年肾肿瘤患者或肺癌患者的克隆扩增和非扩增 CD8+记忆 T 细胞进行比较。(D) 扩增的记忆性 CD8+ T 细胞在所有记忆性 CD8+ T 细胞中所占的比例。
+ + + + + + + + + + +
结 论
本研究对 191 名患有不同肿瘤的儿童群体中的免疫反应进行了系统性多组学分析,并揭示了年龄和肿瘤类型对免疫反应的影响不同。全身炎症和细胞毒性 T 细胞反应与肿瘤突变率和免疫细胞浸润相关。在诊断时,很少在血液或肿瘤中检测到克隆扩增的 T 细胞反应,但有时会在治疗期间引发。在患有更多免疫原性癌症的儿童和成人中,扩增的 T 细胞受到类似的调节,这项研究旨在促进针对癌症儿童的精准免疫疗法的发展。
+ + + + +



 English
English


