文献解读|Signal Transduct Target Ther(40.8):比较急性和艾滋病 ART 启动对 HIV-1 整合位点和克隆扩增的影响
✦ +
+
论文ID
原名:Comparing acute versus AIDS ART initiation on HIV-1 integration sites and clonal expansion
译名:比较急性和艾滋病 ART 启动对 HIV-1 整合位点和克隆扩增的影响
期刊:Signal Transduction and Targeted Therapy
影响因子:40.8
发表时间:2025.01.10
DOI号:10.1038/s41392-024-02113-7
背 景
在过去十年中,人们做出了巨大努力来减少持续性HIV储存库的规模并增强免疫控制,最终目标是实现HIV感染的功能性治愈。虽然做出了这些努力,但储存库的规模减少幅度仍然很小,完全根除仍然难以实现。此外,即使经过数十年的严格抗逆转录病毒疗法 (ART) 治疗,这些干预措施也未能抑制病毒反弹或在停止治疗后显著降低病毒设定点。此外,艾滋病毒感染经历三个阶段:急性HIV感染、慢性HIV感染和艾滋病期。急性感染包括病毒快速复制和流感样症状,而慢性期的特点是病毒水平较低和无症状持续存在;如果不及时治疗,它会发展为艾滋病,其特征是严重的免疫损伤和对机会性感染的高度脆弱性。研究表明,早期开始 ART 治疗可以改善免疫功能、降低死亡率并减少艾滋病毒储存库的规模;然而,它并不能根除病毒,而且常常导致在分析性治疗中断(ATI)后病毒载量迅速反弹。在 HIV 感染急性期开始 ART 的个体中,HIV病毒库和原病毒基因组的具体特征仍然知之甚少,这强调需要进一步研究以充分了解早期 ART 对 HIV 病毒库的影响。
实验设计
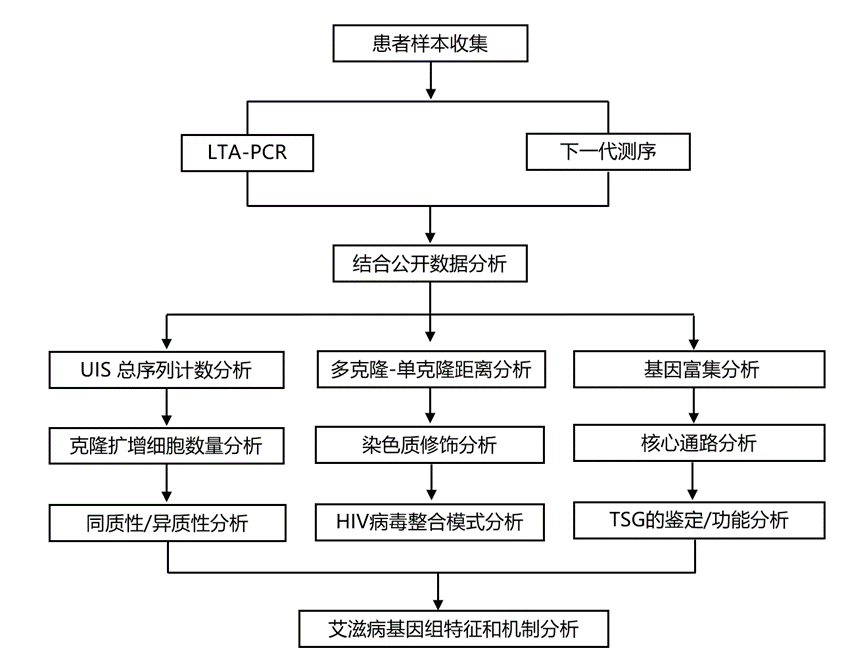
结 果
01
在艾滋病和急性期开始 ART 的 PLWH 中的 UIS 计数相似
人们普遍认识到,及早获得 ART 对于控制 HIV 进展和改善长期结果至关重要。研究团队纳入了两个队列进行分析,在急性期开始 ART 的人群(急性-ART 组)和在 AIDS 期开始 ART 的人群(AIDS-ART 组)(图1a)。他们收集了患者样本并使用线性靶放大(LTA)-PCR分析和下一代测序对原病毒整合位点进行分析(图1b)。在早期开始 ART的HIV 感染者 (PLWH) 中,与 AIDS-ART 组相比,急性-ART 组的病毒库水平较低(图1c)。基于 LTR DNA(分别由 β-actin 和 GAPDH 标准化)和 CD4+ T 细胞计数的主坐标分析(PCoA),然后进行 PERMANOVA 检验以评估两组之间的显著差异。结果显示,急性ART组和AIDS-ART组之间存在显著区别(图1d)。
他们进一步使用 log10 变换定量了独特整合位点 (UIS) 克隆计数、31 个标准化 UIS 计数和相对于 CD4+ T 细胞计数的总 UIS 序列计数。分析表明,与在急性期开始 ART 的 PLWH 相比,在 AIDS 期开始 ART 的 PLWH 的总 UIS 序列计数(标准化和未标准化)更高(图1e)。两组的标准化和未标准化的 UIS 计数相似(图1e)。在急性 ART 组中,UIS 计数随着 ART 持续时间增加直至 4 个月,但在 5 年后仍然较低。相比之下,AIDS-ART 组在 2-4 年期间表现出较低的 UIS 计数,随后略有增加(图1f)。
急性-ART 组的总 LTR DNA 水平在 0.5 个月时达到峰值,在 7-12 个月时降至最低,5 年后略有回升,随后稳定在与 AIDS-ART 组相似的水平(图1g)。CD4 + T 细胞计数显示,急性-ART 组 54 人中有 26 人(26/54)的计数超过 500 个细胞/µL,而 AIDS-ART 组 36 人中有 14 人(14/36)的计数超过 500 个细胞/µL(图1g)。急性-ART 组的总整合位点(IS)测序计数遵循与 CD4 + T 细胞计数相似的模式,在 0.5 个月时观察到最低水平。对于标准化的总 IS 计数,在急性-ART 组中观察到稳步增加,而在 AIDS-ART 组中计数一直保持较高水平(图1i)。
这些发现表明,虽然急性 ART 组和艾滋病 ART 组之间的 UIS 总序列计数和 LTR DNA 水平不同,但 UIS 计数在两组中相似。这种相似性表明,在艾滋病阶段开始接受 ART 的艾滋病毒感染者中,某些 UIS 与含有整合前病毒的克隆扩增细胞数量较多有关。
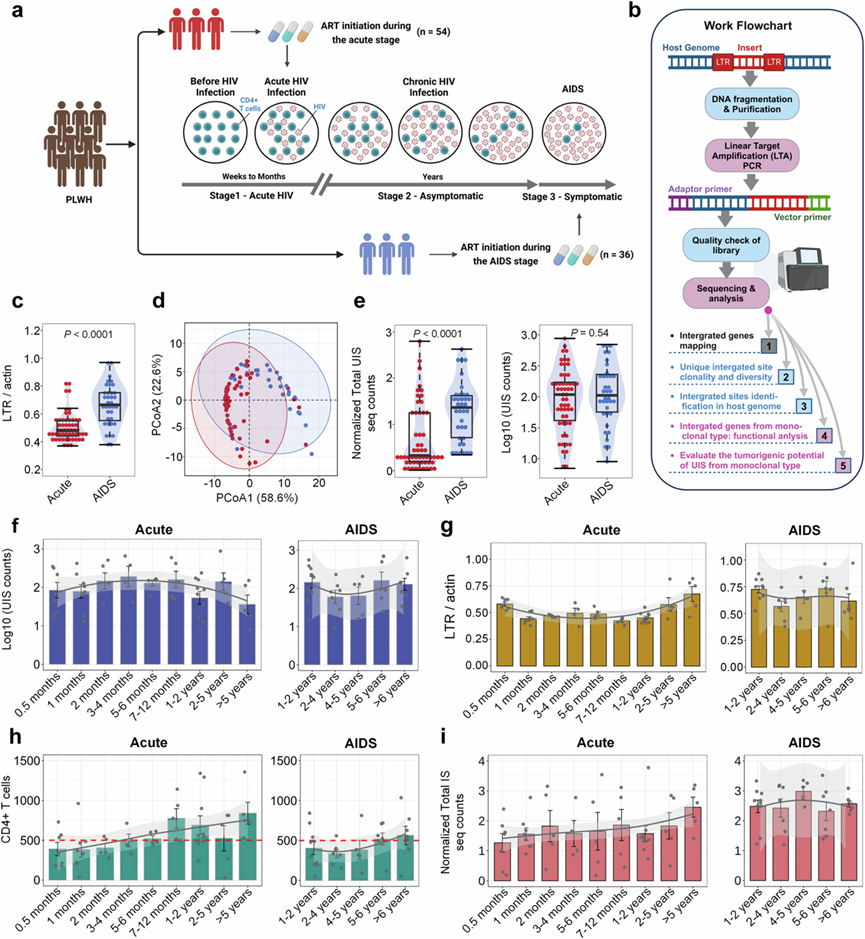
图1. 急性-ART 组和艾滋病-ART 组 HIV 总 DNA、整合位点和 UIS 的比较分析。
(a) 队列构建和 HIV 感染阶段的示意图。(b) 流程图说明了使用 LTA-PCR 和下一代测序对原病毒整合位点进行分析。(c) HIV 总 DNA 水平比较。(d) PCA 图显示基于 LTR 水平相对于甘油醛 3-磷酸脱氢酶 (GAPDH) 和 β-肌动蛋白 (LTR/GAPDH; LTR/β-肌动蛋白) 的患者组分离,以及 CD4 + T 细胞计数。(e) 急性-ART 组(红点,n = 54)与 AIDS-ART 组的标准化总 UIS 计数(左)和 Log 10转换的 UIS 计数(右)。(f-g) 纵向分析急性期(左)和AID期(右)开始ART的PLWH的[Log10 UIS]计数和总LTR DNA水平随时间的变化。(h-i) 急性期(左)与 AIDS 期(右)开始 ART 的 PLWH的 CD4 + T 细胞计数和标准化总 IS 序列计数随时间的变化的纵向分析。
02
单克隆 UIS 患病率增加和同质性降低
为了评估UIS的克隆性,他们分析了PLWH中每种UIS的百分比。在AIDS-ART组中,33%的PLWH有一个UIS且占总数的70%以上,而急性-ART组这一比例为16.7%。当单克隆UIS定义为单个UIS占总数的50%以上的克隆扩增时,AIDS-ART组中47.2%的PLWH符合这一标准,而急性-ART组这一比例为22.2%,显示出显著差异(P = 0.0257)。同样,当单克隆UIS定义为单个UIS占总数的40%以上时,AIDS-ART组中63.9%的PLWH符合这一阈值,而Acute-ART组这一比例为29.6%,再次显示出显著差异(P = 0.0013)(图2a)。
为了直观地了解两组中 UIS 的整体组成,他们分析了每个 UIS 相对于每个个体的总 LTR DNA 的百分比。通过比较两组之间的相对 UIS 百分比(图2b),他们观察到在 AIDS 期开始接受 ART 的 PLWH 中单克隆 UIS 的患病率高于在急性期开始接受 ART 的 PLWH。这表明在 AIDS 期开始接受 ART 的 PLWH 往往具有较大的 UIS 规模。值得注意的是,根据 ART 启动阶段观察到了不同的克隆分布模式:在急性期模仿 ART 的 PLWH 表现出更大的异质性,而在 AIDS 期开始接受 ART 的 PLWH 表现出更多的同质性(图2b)。
为了进一步评估 UIS 克隆性,他们进行了多克隆-单克隆距离 (PMD) 分析(图2c)。该方法使用两个关键维度来评估 UIS 细胞的多样性:(1)丰富度,指样本中存在的 UIS 的多样性,表示整合事件的广度;(2)均匀度,测量 UIS 在细胞中的分布,反映某些 UIS 是否不成比例地占主导地位。基于这些维度,他们对 UIS 细胞的克隆性进行了分类。如果没有显性克隆扩增,则样本是多克隆的,其特点是丰富度和均匀度高。相反,如果发生显性克隆,即一个或几个 UIS 占主导地位,导致均匀度较低,则样本是寡克隆(图2c)。
该分析确定两组中 IS 是广泛分布于多种细胞中(多克隆)还是集中在少数显性克隆中(单克隆)(图2c)。结果表明急性-ART 组的均匀度明显更高,表明 UIS 分布更均匀。相反,AIDS-ART 组的 PMD 明显较低,反映出显性克隆和单克隆性趋势更大。尽管存在这些差异,但两组之间的丰富度没有显著差异,表明两组中 UIS 的多样性保持相似(图2d)。
为了评估不同治疗期间单克隆 UIS 百分比的变化,他们分析了每个个体中排名前 1 的 UIS 占总 LTR DNA 的比例。对于那些在急性期开始治疗的患者,排名前 1 的 UIS 百分比在治疗后 0.5 个月最初较高。随后,这一百分比在 5-6 个月期间下降到较低水平,然后在治疗后 5 年内逐渐再次上升。然而,在所有时间点,它始终低于在 AIDS 期开始 ART 的 PLWH 中观察到的百分比。这些观察结果表明,虽然在急性 ART 组开始治疗后不久单克隆 UIS 百分比出现早期峰值,但克隆性会暂时下降,然后在长期内再次上升。然而,它从未达到 AIDS-ART 组观察到的高水平,表明急性 ART 组的克隆扩增受到更多控制且不那么占主导地位(图2e)。
接下来,他们根据均匀度和丰富度数据对所有具有单克隆 UIS 的 PLWH 进行聚类,并结合 ART 持续时间在聚类树中对它们进行排序。结果表明,大多数在急性期开始 ART 的 PLWH 在治疗的前 12 个月内出现单克隆 UIS,而在艾滋病期开始 ART 的 PLWH 通常在 12 个月后出现单克隆 UIS(图2f)。为了进一步探索两组中单克隆 UIS 随时间的积累情况,他们绘制了 ART 治疗期间单克隆 UIS 消失的个体的累积曲线。该曲线突出显示了治疗后单克隆 UIS 的出现和增长。通过可视化随时间推移单克隆 UIS 感染者累积百分比,他们观察到急性 ART 组在前 12 个月内迅速增加,随后上升较为缓慢。相比之下,AIDS-ART 组则立即急剧增加,在 180 个月后达到近 78%(图2g)。条形图进一步说明了与急性 ART 组相比,AIDS-ART 组在不同 ART 时间点的单克隆 UIS 积累延迟(图2g)。
总体而言,这些研究结果表明,在急性期开始接受 ART 治疗的PLWH的单克隆 UIS 积累会延迟,而在艾滋病期开始接受 ART 治疗的PLWH的单克隆 UIS 会随着时间的推移迅速大幅增加。ART 的持续时间进一步影响了这一过程。虽然延长 ART 可以有效抑制新的感染,但它允许现有的带有整合前病毒的感染克隆持续存在并增殖,并由于其寿命和增殖能力而逐渐占据病毒库的主导地位。前病毒整合动力学示意图(图2h)说明了 HIV 感染不同阶段前病毒整合的轨迹,强调了新整合事件的高频率和潜伏库的扩张。该图追踪了从初始感染到可检测的克隆扩增的进展,其中大多数新感染的细胞死亡,但一部分形成可检测的克隆。在急性期,前病毒整合细胞和 UIS 克隆的多样性增加。单克隆 UIS 和细胞克隆性在急性期结束时达到峰值,然后在慢性感染阶段下降,同时 HIV 整合的 CD4 + T 细胞减少。
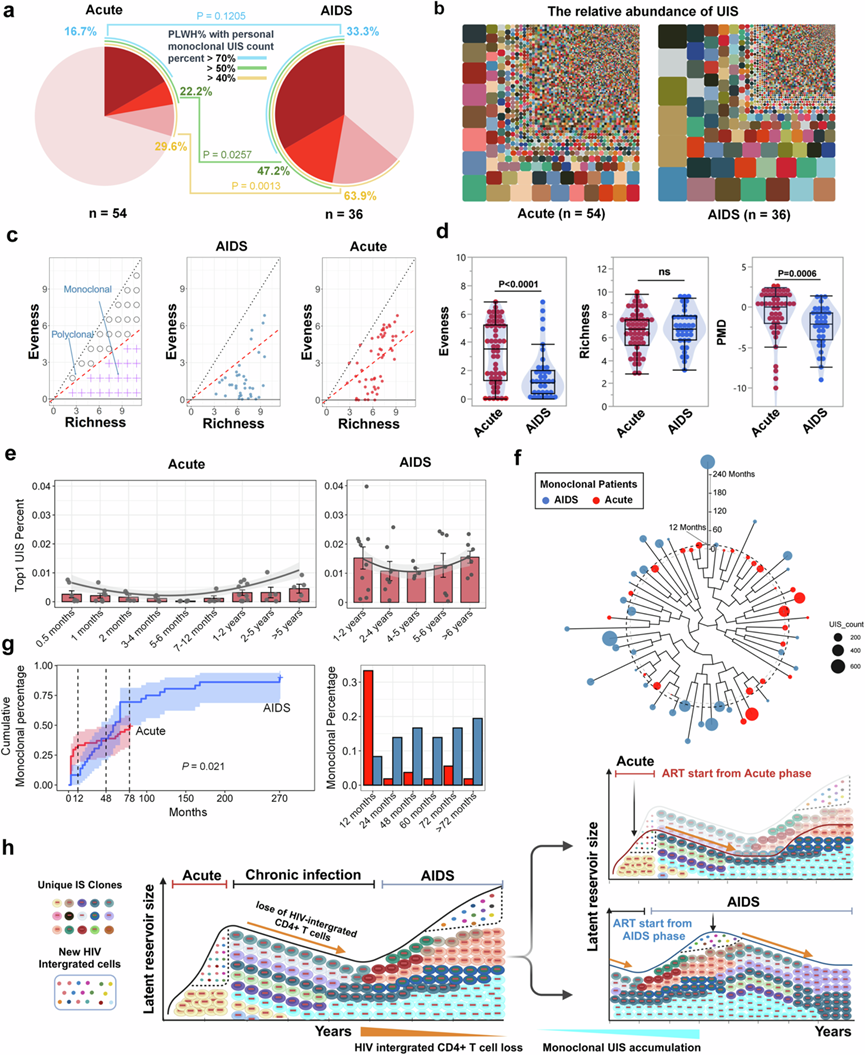
图2. 急性 ART 组与 AIDS-ART 组的 UIS 克隆性比较分析。
(a) 单克隆 UIS 比例的饼图分析。(b) UIS 分布的马赛克图。(c) PMD分析。该方法根据两个维度评估 UIS 克隆性:丰富度(UIS 的多样性)和均匀度(分布均匀性)。(d) 急性 ART 组与 AIDS-ART 组的 PMD 分析比较分析。(e) 个体 Top1 UIS 百分比的纵向分析。(f) 按均匀度、丰富度和 ART 持续时间对单克隆 UIS 进行聚类。(g) ART 治疗期间单克隆 UIS 患者百分比的累积曲线。(h) 病毒整合动力学示意图。
03
染色质修饰和安全港区域是艾滋病毒在急性期而非艾滋病期整合的首选位点,但在治疗期间更容易丢失
HIV 迅速将其 DNA 整合到宿主基因组中,染色质的结构和可及性在此过程中起着至关重要的作用。具有特定组蛋白修饰(如 H3K4me3、H3K9ac)的染色质区域由于其开放的染色质结构和活跃的转录状态而特别适合 HIV 整合。此外,安全港区域处于活跃状态但不太可能破坏基本宿主功能-支持稳定的病毒整合。增强子区域高度可及且有助于募集 HIV 整合机制,进一步促进有效的HIV整合。
当比较急性期和艾滋病期开始 ART 的艾滋病病毒感染者 (PLWH) 之间的 HIV 整合模式时,他们发现了几个关键点:(1)整合到基因组区域:HIV 前病毒 DNA 更多地整合到基因的基因内区域而不是 TSS 启动子区域上游,两组之间没有差异(图3a)。(2)整合的染色体分布:急性期和艾滋病期开始 ART 的艾滋病病毒感染者 (PLWH) 之间的 HIV 整合跨染色体模式大致相似,染色体分布没有显著差异(图3b)。(3)对染色质修饰和安全港区域的偏好:与 AIDS-ART 组相比,在急性-ART 组中,HIV 更频繁地整合到具有活性染色质修饰的区域和安全港区域内。相比之下,在艾滋病阶段开始 ART 治疗的艾滋病病毒感染者比在急性期开始 ART 治疗的艾滋病病毒感染者更倾向于将 HIV 整合到基因内区域(图3c-f)。
ART 对 HIV 整合的影响以及各组间 UIS 积累不平衡,在 Acute-ART 组治疗的前 12 个月内,染色质修饰区域内的单克隆 UIS 百分比较高,随后急剧下降(图3g)。相反,在 AIDS-ART 组中,染色质修饰区域中的 UIS 百分比随时间持续较低。在急性-ART 组中,治疗的前 12 个月内基因内区域的 UIS 积累明显高于后期(图3h)。在此之后,基因内区域的 UIS 趋于下降,而 AIDS-ART 组中基因内区域的 UIS 持续较高,前 12 个月除外。他们对AIDS 组和急性-ART 组在 12 个月内和 12 个月后对基因内和染色质修饰区域中 UIS 标准化克隆大小的比较统计分析。比较各组之间的UIS百分比,在最初12个月内,急性ART组的染色质修饰区域的UIS最高,而艾滋病ART组的基因内区域的UIS在12个月后达到最高水平(图3i)。这些发现表明,尽管大多数染色质修饰区域和安全港区域最初是 HIV 在急性期进行整合的首选,但它们在 ART 过程中往往不太稳定。这种不稳定性导致了转变,整合位点越来越多地存在于基因内和增强子区域内(图3j)
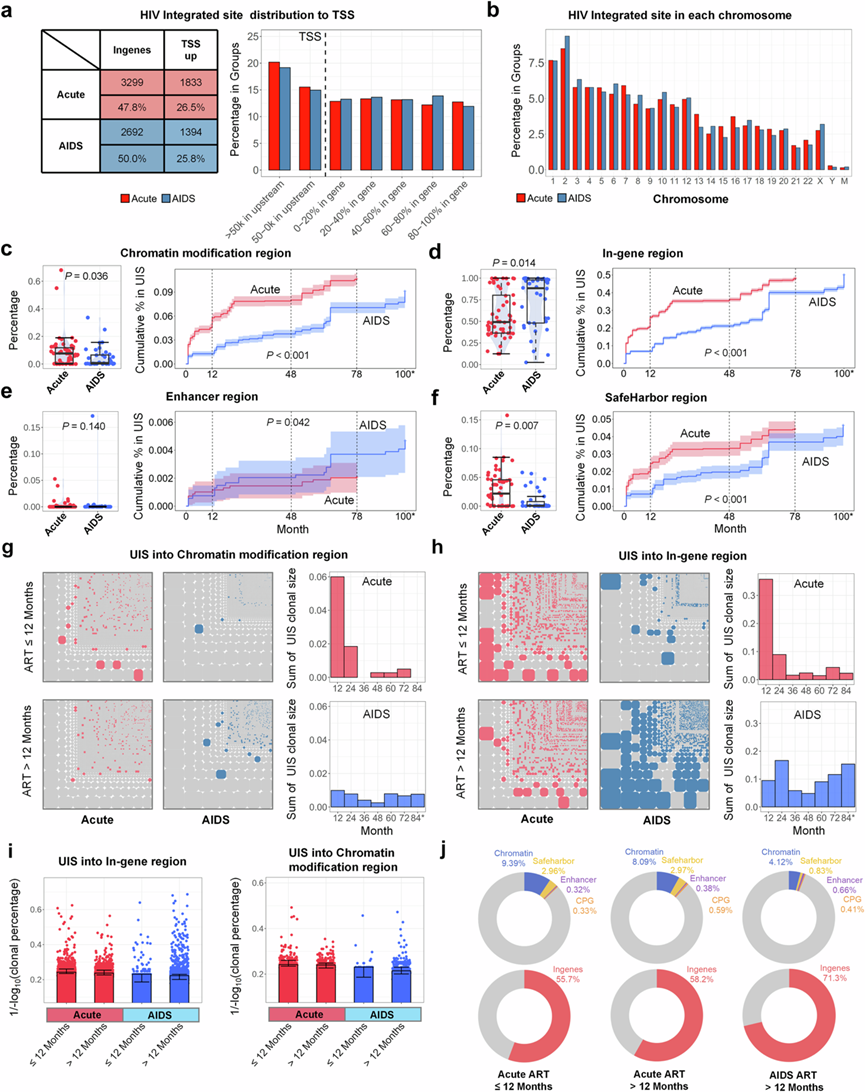
图3. 染色质修饰和基因组安全港区域(safe harbor regions)是急性-ART 组中 HIV 整合的优先位点。
(a) HIV 整合在基因组区域的分布。(b) HIV 整合位点的染色体分布。(c-f) 随着时间的推移,HIV 整合 UIS 进入染色质区域的累积偏好。(g-h) 不同疾病组之间染色质修饰和基因内区域的 UIS 分布马赛克图。(i) 四组中基因内区域(左图)和染色质修饰(右图)中 UIS 的归一化和对数转换克隆百分比。(j) 环形图显示了不同群体的 HIV 整合偏好。
04
单克隆 UIS 优先在基因区域内的 HIV 前病毒整合位点积累
当 HIV DNA 整合到特定基因组区域时,就会产生单克隆 UIS,从而导致携带这些 IS 的受感染细胞扩增。当病毒优先整合到活跃转录区域时,这一过程尤其明显,这些区域由于可及性和高转录活性而具有优势。这些前病毒在长期接受 ART 的 HIV 感染者中的分布由初始整合模式和选择压力决定,这些选择压力有利于具有这些有利整合位点的细胞存活和克隆扩增,从而导致单克隆UIS在基因区域内积累。
主成分分析 (PCA) 图显示,无论是在急性期还是艾滋病阶段开始治疗,单克隆 UIS 都可以与其他 UIS 明显区分开来(图4a)。比较两组之间的不同基因组区域,发现单克隆 UIS 比非单克隆 UIS 更容易整合到基因内区域(图4b)。此外,单克隆 UIS 主要位于真染色质中,在 1、17、3、16、12 和 19 号染色体上观察到的频率较高。相反,异染色质中的 IS 和单克隆 UIS 的频率低于真染色质。Y 染色体表现出的 IS 最少,单克隆 UIS 在所有染色质类型中是最不普遍的。在X染色体上,单克隆UIS比非单克隆UIS更少见(图4c)。
进一步的研究包括对前 1000 个 UIS 进行排序,并将它们分成 100 个组,每组包含 10 个 UIS。分析表明,排名靠前的组中 UIS 整合到基因中的百分比最高,并在各个组中逐渐降低(图4d)。即使在排名最低的 1000 个 UIS 中,也有近 50% 整合到基因中,各个组中没有显著差异(图4e)。有趣的是,PCA 图表明单克隆 UIS 并没有显著区分早期开始 ART 的患者和晚期开始 ART 的艾滋病患者。然而,一些处于急性期且治疗时间不到 12 个月的早期 ART 患者值得注意,这些患者位于 PCA 图的左侧和底部。他们将重点关注这些案例,并在下一阶段的研究中进行进一步的基因功能分析。此外,两组单克隆 UIS 的基因组区域没有显著差异。这些发现强调,在晚期阶段开始 ART 治疗的艾滋病病毒感染者中,单克隆 UIS 优先在基因内区域积累,表明具有这些整合位点的细胞具有选择性优势。这种选择性积累可能有助于 HIV 感染细胞的持续存在,强调尽管 ART 治疗时间较长,但根除病毒仍面临挑战。
虽然接受了 ART,但一些 HIV 前病毒 DNA 仍整合到长寿的记忆性 CD4 + T 细胞中,形成难以根除的潜伏病毒库。转录活性基因区域为 HIV 劫持宿主机制提供了有利环境,从而确保了有效的病毒复制。值得注意的是,单克隆 HIV 前病毒 DNA 富含参与淋巴细胞活化、细胞周期调控和染色质修饰途径的基因(图4f)。他们进行了卡方检验和 Fisher 检验,以比较急性组和 AIDS-ART 组之间 20 条富集通路中整合基因的百分比(图4g)。结果显示,与急性-ART 组相比,AIDS-ART 组的整合基因数量明显更多(p < 0.05),这些基因参与淋巴细胞活化的调节、染色体分离、染色体组织和对生物刺激的反应。然而,与细胞周期调控、死亡受体信号传导和相关通路相关的通路没有显著差异。
他们分析了急性和艾滋病 ART 组中的所有单克隆整合基因,重点关注那些富集的基因,这些基因参与调节淋巴细胞活化、染色体分离、染色体组织、对生物刺激的反应和细胞周期调节。他们还将克隆大小表示为气泡,并标注治疗持续时间,以探究克隆扩增与治疗持续时间之间的关系(图4h)。单克隆整合(单个感染细胞增殖为显性克隆)通常涉及SMARCE1、SMC2、MARK4、ARID2、CYLD和CCDC57等基因,这些基因调节感染细胞的存活和增殖。这些基因表现出随机整合模式,在急性 ART 组和 AIDS-ART 组之间没有显著差异。这种整合可能会破坏正常的细胞功能并促进不受控制的增殖,从而导致 HIV 的持续存在。HIV 还经常整合到淋巴细胞活化基因中,例如CD5、IL7R、STAT5B、TNFAIP3和MALT1,这些基因在免疫激活过程中发生主动转录,在 AIDS 组中的整合率更高。此外,整合到染色体修饰基因中可能会改变表观遗传景观,促进 HIV 感染细胞的存活和增殖。
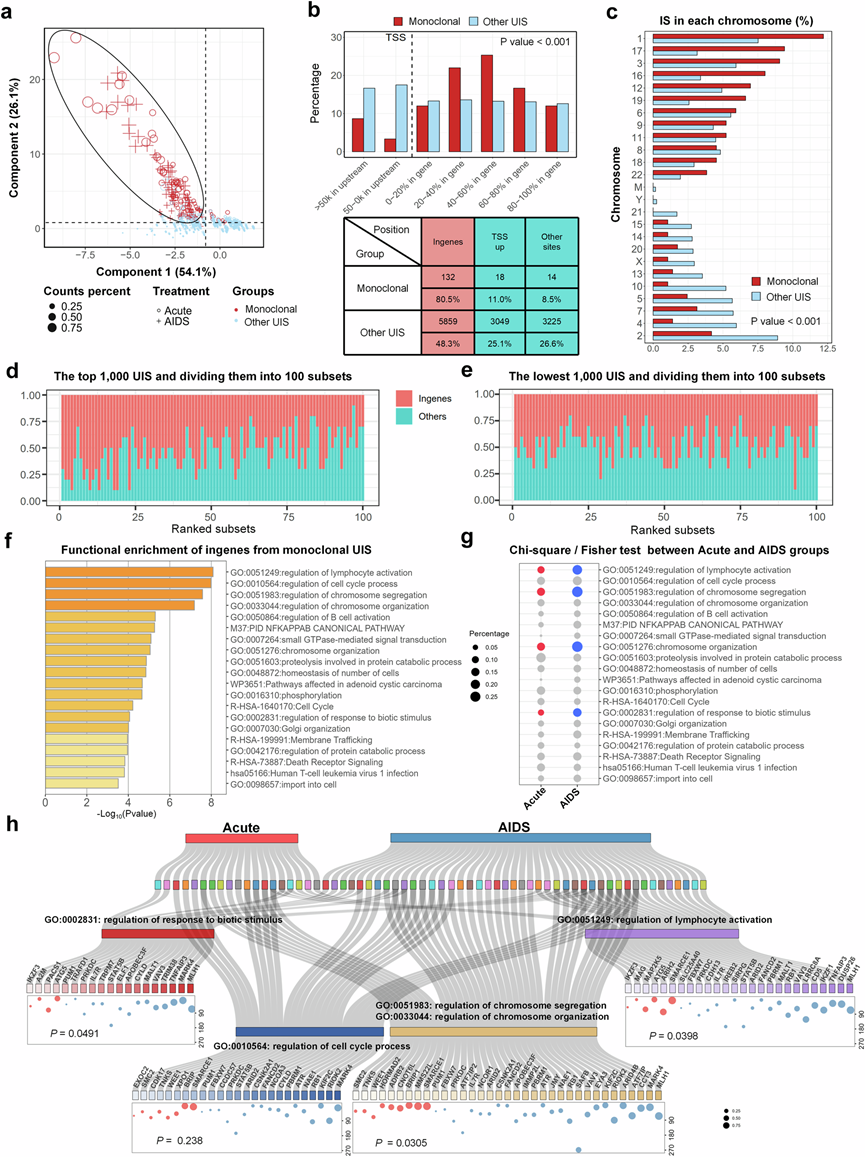
图4. 功能富集分析揭示了这些宿主细胞基因参与关键的生物过程。
(a) PCA图区分单克隆 UIS(红点)与其他 UIS(蓝点),聚类基于 LTR 百分比、丰富度、均匀度和 PMD。(b) 比较不同基因组区域之间的 UIS 克隆性分布。(c) 单克隆 UIS 的染色体分布,突出显示单克隆 UIS(红色条)中整合到 1、3、16、17、12 和 19 号染色体的频率较高,而其他 UIS(蓝色条)中整合到 2、4、5、7、10、13、14、15、21 和 Y 号染色体的频率较高。(d-e) 所有 UIS 的排序分析,分为 100 个集合。(f) 164 个单克隆 UIS 的基因内区域功能富集分析,突出显示在前 20 个生物过程中富集的基因。(g) 比较急性组和 AIDS-ART 组之间富集通路中 UIS 基因的百分比,显示 20 条富集通路中整合基因百分比的差异。(h) 图表说明了与淋巴细胞活化(GO:0051249)、染色体分离(GO:0051983)、染色体组织(GO:0033044)、细胞周期过程调节(GO:0010564)和对生物刺激的反应(GO:0002831)相关的富集基因。
05
急性-ART 组中的早期单克隆 UIS 与艾滋病-ART 组中的长期双单克隆 UIS 在功能上有所不同
他们根据均匀度和丰富度数据对所有单克隆 UIS 患者进行聚类,并结合 ART 持续时间在 PCA 图中对他们进行排序。该分析突出显示了两组之间不同的 UIS 模式,164 个单克隆 UIS 聚类为三个不同的组(A、B 和 C)。值得注意的是,来自急性 ART 组(聚类 A)的单克隆 UIS(治疗持续时间 <12 个月)与来自艾滋病 ART 组(聚类 C)的单克隆 UIS(治疗持续时间超过 12 个月)的分离(图5a)强调了早期 ART 对 HIV 病毒库克隆结构的潜在影响。这种区别可能反映了早期和晚期 ART 启动之间免疫激活、病毒复制动力学和整合位点偏好的差异。
他们对聚类 A 和 C 进行了排序基因集富集分析(排序 GSEA),使用克隆标准化大小作为排序因子。然后,他们对前 100 条富集通路进行了相似性分析,将其提炼为 15 条关键通路及其相关的核心基因。结果表明,急性-ART 组的核心基因包括BCL2(在 15 条通路中的 11 条中富集),参与线粒体相关的细胞凋亡;BRIP1(在 7 条通路中富集),与 DNA 构象和细胞周期调控有关;和SMARCE1(在 4 条通路中富集)(图5b)。相反,AIDS-ART 组的核心基因包括TNFAIP3(在 10 条通路中富集),与淋巴细胞活化的负调控有关;TRIM38(在 3 条通路中富集),与先天免疫反应的负调控有关;MAPK4(在 3 条通路中富集),与炎症小体复合物组装有关;APOBEC3F(在 2 条通路中富集),与对病毒的防御反应有关(图5b)。
HIV 前病毒整合到宿主基因,尤其是肿瘤抑制基因 (TSG) ,可显著影响细胞功能,对癌症发展具有深远影响。HIV经常以单克隆形式整合到特定基因中,这些基因可作为肿瘤发生的危险因子。TSG 在调节细胞生长和分裂方面发挥着关键作用,是防止细胞不受控制增殖的防御机制。然而,当 HIV 整合到TSG中时,它会破坏其正常功能,导致失去调节控制,增加细胞不受控制生长和癌症的风险。因此,评估单克隆UIS的致瘤潜力至关重要。他们通过交叉引用多个数据库(包括 TSGene2.0、COSMIC、Cancermine、NCG(癌症基因网络)和 OncoKB)识别 TSG,这些数据库共同提供了 3973 个基因的列表。然后,他们将此列表与 UIS 数据进行比较,在急性-ART 组中鉴定出 14 个 TSG,在 AIDS-ART 组中识别出 34 个 TSG。HIV 整合 TSG 的累积百分比表明,在 AIDS 阶段开始 ART 的 PLWH 比在急性期开始 ART 的 PLWH 具有更高的 TSG 整合单克隆 UIS 患病率(图5d)。
在 AIDS 期开始 ART 治疗的 PLWH 中,HIV 前病毒更频繁地以单克隆类型整合到特定基因中,与在急性期开始 ART 治疗的患者相比,其癌症风险显著增加(图5e-f)。克隆扩增进一步加剧了这种风险,其中含有整合到 TSG 或其他关键调控基因中的前病毒的细胞发生增殖,导致具有致癌潜力的细胞积累。为了说明这一点,他们列出了计数百分比 >40% 的顶级 UIS,其中 TSG 整合位点的克隆扩增有助于单克隆扩增,与在急性期接受治疗的 PLWH 相比,在 AIDS 期开始 ART 治疗的 PLWH 的癌症风险更高(图5g-h)。总的来说,这些发现强调了早期 ART 在防止受感染细胞的克隆扩增、减少稳定和持久性病毒储存库的形成以及最终克服实现艾滋病功能性治愈障碍的重要性。
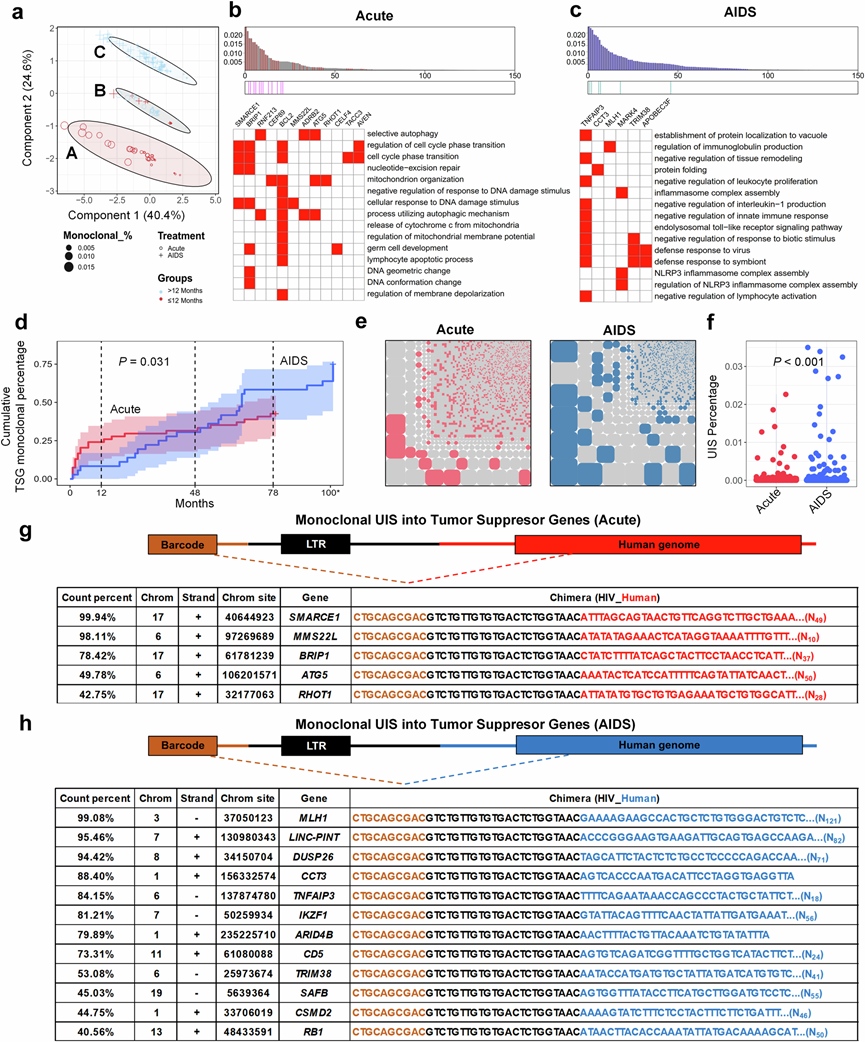
图5. 整合到 TSG 中的 HIV 前病毒更容易导致 AIDS-ART 组的单克隆扩增,与急性-ART 组相比,其癌症风险更高。
(a) 单克隆 UIS 的PCA图分析。(b-c) 基于克隆标准化大小对聚类A和 C 的 GSEA 进行排序。(d) ART持续时间内具有 TSG 单克隆的个体百分比的累积曲线。(e) TSG 单克隆 UIS 分布的马赛克图。(f) 条形图显示了两组 PLWH 中 TSG 单克隆百分比的比较:在急性期启动 ART 的患者(红色)和在 AIDS 阶段启动 ART 的患者(蓝色)。(g-h) 由HIV整合为单克隆 UIS 的 TSG。
+ + + + + + + + + + +
结 论
本研究使用LTA-PCR和下一代测序来比较在急性 HIV 感染期(急性-ART 组)启动 ART 的个体和处于艾滋病期(艾滋病-ART 组)的个体之间的UIS克隆计数,揭示了不同的克隆分布模式,急性-ART 组的 UIS 异质性更大,艾滋病-ART 组的同质性更高。单克隆 UIS 积累(主要在基因区域内)受 ART 时间和持续时间的影响,早期治疗延缓了这一过程。 HIV 前病毒以单克隆形式整合的宿主细胞基因在细胞周期和淋巴细胞活化途径中富集。在 AIDS-ART 组中,TSG更频繁地以单克隆形式整合,表明存在潜在的危险因素。总体而言,本研究引入了一种测序方法来评估人外周血中的前病毒大小,并确定了长期治疗后 AIDS-ART 组中 UIS 单克隆分布的广泛存在。早期干预有助于减缓感染细胞克隆扩增的进展,减少稳定和持久性储存库的形成,最终减少实现功能性治愈的障碍
+ + + + +



 English
English


