文献解读|Cell Metab(27.7):运动相对能量缺乏小鼠模型的多器官转录组图谱
✦ +
+
论文ID
原名:Multi-organ transcriptome atlas of a mouse model of relative energy deficiency in sport
译名:运动相对能量缺乏小鼠模型的多器官转录组图谱
期刊:Cell Metabolism
影响因子:27.7
发表时间:2024.09.03
DOI号:10.1016/j.cmet.2024.08.001
背 景
能量摄入不足以满足体力活动的能量消耗需求,会导致活动依赖性厌食症和运动相对能量缺乏 (RED) 中的全身神经内分泌和代谢异常。RED是一种影响许多器官系统的复杂综合征,对健康和体能有显著影响,但缺乏潜在的分子变化一直是更好地了解 RED 及其治疗的障碍。
实验设计
结 果
01
小鼠模型中相对能量缺乏的生理和行为
研究团队建立了“运动换食物”(exercise-for-food)的小鼠模型以模拟人类RED 的行为和生理学状态,其中跑轮活动与食物奖励相结合,对小鼠进行表型分析,并收集组织样本进行进一步分析(图1 A-B)。对照(Ctrl) 组小鼠可以持续获取食物,而能量缺乏组的小鼠在 3 周内食物奖励逐渐减少(图1 C)。两组小鼠都表现出高水平的运动,并且能量缺乏组的雄性小鼠在实验结束时运动量增加(图 1 D)。此外,在 19 天的实验中,雌性小鼠跑步的距离是雄性小鼠的两倍。在 3 周的时间里,能量缺乏组的小鼠在保持高水平跑轮活动的同时,食物消耗减少了 46%-49%,导致能量负平衡(图 1 E)。在整个实验过程中,能量缺乏组的小鼠体重减轻,雌性小鼠的体重减轻程度低于雄性小鼠(图 1 F)。此外,雌性小鼠体重减轻的开始时间(第 10 天)晚于雄性小鼠(第 4 天)。活动模式分析显示,能量缺乏组的小鼠表现出碎片化减少,特点是活动次数减少,而每天的活动量保持不变(雌性)或增加(雄性)(图1G-H)。这表明活动持续时间延长,可能导致睡眠中断,因为小鼠通常表现出多相睡眠模式,活动时间和睡眠时间都很短(2-4 分钟)。能量缺乏导致活动期延长,伴随着白天活动增加(雌性 61%,雄性 77%),而这些小鼠通常在随意条件下夜间活动(雌性 72%,雄性 48%),这为睡眠中断提供了额外的证据(图1G)。
身体成分分析显示,能量缺乏的小鼠既失去了脂肪,也失去了瘦肉质量(图 1 I-J)。对这种损失的进一步研究表明,能量缺乏的小鼠的器官质量减少了。在雌性中,子宫、脾脏和卵巢等器官的绝对质量和相对质量均减少,而在雄性肾脏中,脾脏和棕色脂肪组织 (BAT) 的质量减少(图 1 K)。有趣的是,肺的绝对尺寸没有减少,这表明能量缺乏组的小鼠投入能量来保存肺组织,可能是为了适应高运动负荷的需求。
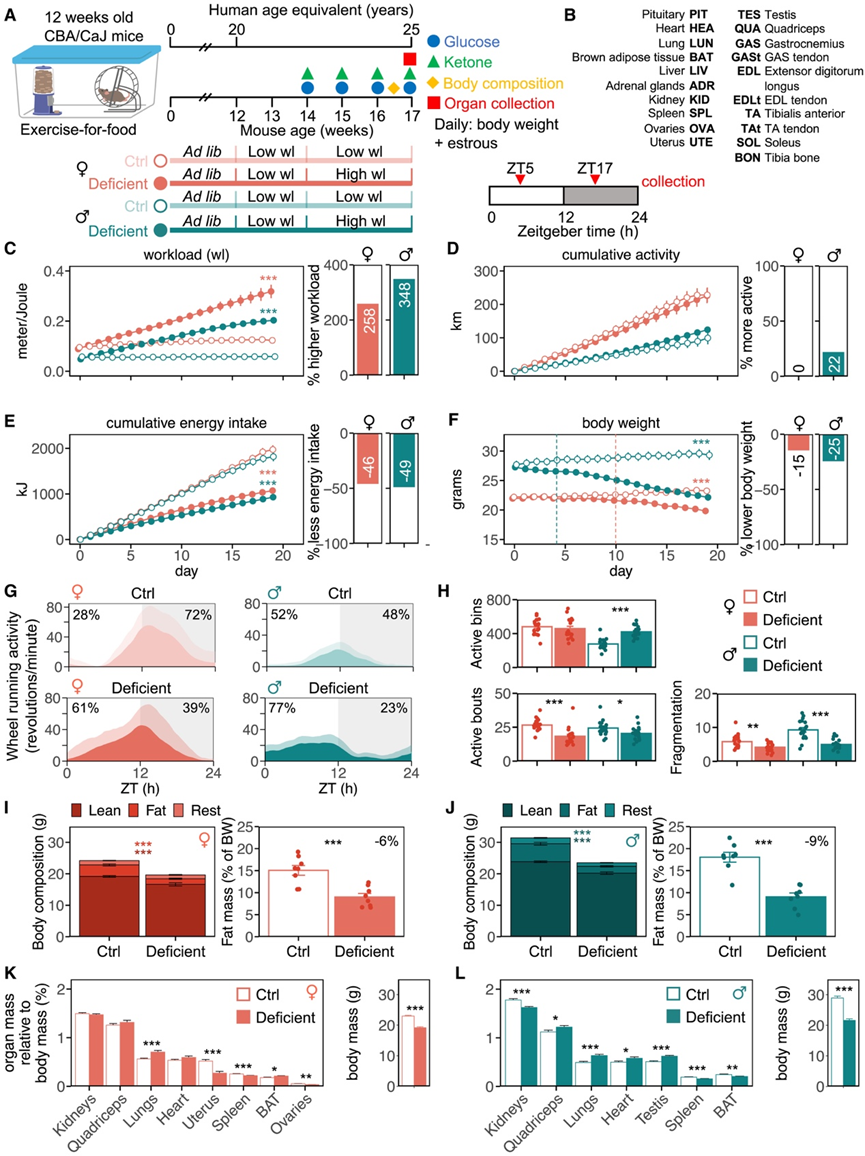
图1. 小鼠模型中相对能量缺乏的生理和行为。
(A)实验设计。(B) 收集的 20 个组织列表。(C) 小鼠运动量。(D) 累计跑轮活动。(E-F) 累计能量摄入和体重的每日变化。(G) 平均活动概况。(H) 最后 5 天内活跃箱体数量、活跃发作次数及碎片化数量(活跃发作次数/活跃箱体 × 100)。(I-J) 干预 3 周后,通过 echoMRI 测量雌性小鼠和雄性小鼠和的身体组成和脂肪质量。(K-L) 新鲜器官质量相对于体重(%)的比例为雌性(红色)和雄性(绿色)。
02
能量缺乏对发情周期和骨骼形态的影响
与人类约 28 天的月经周期相比,小鼠的发情周期通常持续 4-5 天。在人类中,能量可用性降低会导致月经紊乱(例如闭经),目的是在食物匮乏时期防止怀孕以节省能量用于重要过程。通过每日评估阴道涂片中的细胞类型组成(图 2A-C),他们没有发现 Ctrl 动物和能量缺乏动物的发情周期特征之间存在显著差异(图2D-E)。然而,能力缺乏组小鼠进入发情后期的频率较低,进入发情间期的频率较高。同样,体重减轻较多的小鼠进入发情后期的频率也会降低(图 2 D)。
为了评估能量缺乏的小鼠的骨骼健康状况,他们对雌性胫骨近端进行了 3D μCT 扫描,并定量了骨小梁(骨体积/总体积 [BV/TV]、小梁间距 [Tb.Sp]、小梁数量 [Tb.N] 和小梁厚度 [Tb.Th])和皮质(组织矿物质密度 [TMD]、皮质体积/总体积 [Ct.V/Tt.V] 和皮质厚度 [Ct.Th])骨形态学指标(图2 F-J)。公开研究发现,相比于男性运动员,女性运动员更容易受到应激损伤,并且胫骨是运动员应力性骨折最常见的部位。因此,他们决定评估雌性小鼠的骨骼形态。雌性小鼠的骨小梁形态显示能量缺乏组和 Ctrl 组之间存在显著差异。骨小梁多孔,骨髓和脂肪含量高,促进血管化、血流和骨转换(骨重塑),因此在能量缺乏一段时间后对骨小梁健康产生很大影响。在能量缺乏组的小鼠中还观察到 BV/TV和 Tb.Th降低的趋势(图2G-H)。骨小梁形态与体重减轻显著相关,体重减轻较多的动物表现出较低的 BMD、BV/TV、Tb.Th 和 Tb.N(图2I-J)。这些研究结果表明,能量缺乏的小鼠的小梁形态表明骨形成受损且骨质量较低,这可能会导致损伤敏感性增加。
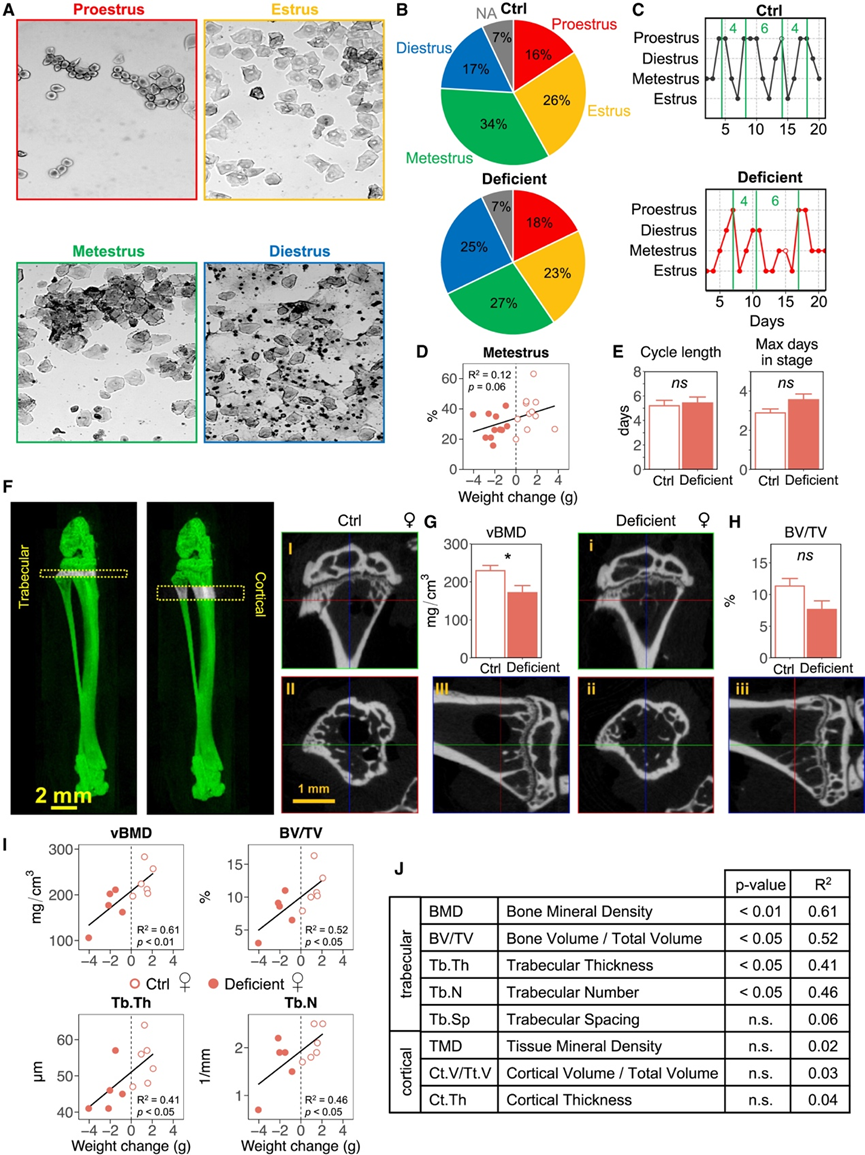
图2. 能量缺乏对发情周期和骨骼形态的影响。
(A) 用结晶紫染色的阴道涂片细胞学图像反映了发情周期的不同阶段。(B) 在过去 7 天内已识别发情阶段的频率图。(C) 小鼠发情周期图示例。(D) 进入发情后期的频率与体重减轻之间的相关性。(E) 发情周期长度和一个阶段的最大连续天数。(F) 骨小梁和皮质骨形态。(G-H) 骨小梁矿物质密度和骨体积/总体积 (BV/VT) 阶段。(I) 小梁参数与体重变化之间存在显著的相关性。(J) 形态参数的定义以及与体重变化相关性的p值和R2。
03
能量缺乏影响内分泌和代谢器官的基因表达
接下来,他们进行了差异表达分析,比较了 Ctrl 和能量缺乏小鼠的转录本,发现不同组织中差异表达基因(DEG)的数量存在很大差异,显示出对能量缺乏的组织特异性反应(图3A)。重要的是,他们将研究中的肝脏或肌肉中的 DEG与能量限制或运动下的小鼠的相应器官进行比较,结果显示重叠最小,因此支持了这样一种观点:即 RED 代表的分子状态并非主要由于能量不足或运动。总共在雌性任何一个组织中检测到 14837 个独特的 DEG,在雄性中检测到 11326 个DEG。然而,在能量缺乏的小鼠中,≥5 种组织之间也存在共同的变化(图 3 B)。与雄性相比,雌性中发现了更大比例的 DEG。这种性别特异性的基因表达表明性别连锁基因和性激素的作用。其中 643 个雌性特异性 DEG在距离 mRNA 5′端 -10 kb 至 +5 kb 范围内包含雌激素受体反应元件 (ERE),表明雌激素的变化可能是这些基因表达变化的原因。
催产素受体 (Oxtr) 在大部分雌性小鼠的组织中下调(图 3 C)。催产素是一种肽类激素,由下丘脑室旁核 (PVN) 的神经元产生,投射到垂体并释放催产素到血液中,在调节各种生理过程中起着至关重要的作用,包括社会行为、配对、饮食行为、新陈代谢以及分娩和哺乳的开始。P4ha1是参与胶原蛋白合成的关键酶,在 11/18 的雌性组织中下调。这一发现与多种与细胞外基质 (ECM) 组织相关的基因(Nrep、Apln、Aplnr和Sparc)的下调相一致,包括雌性和雄性(≥10 种组织)中的各种胶原蛋白(Col1a1、Col1a2、Col3a1和Col6a2)。Apelin(Apln) 及其受体 (Aplnr) 在多种组织中均下调。Apelin是一种脂肪因子(脂肪组织分泌的一种因子,用于发出能量代谢信号:胰岛素分泌、葡萄糖摄取、线粒体生物合成、脂肪酸氧化和脂肪分解),在肥胖症中含量增加。
一小部分基因在能量缺乏时显著上调(图 3 D)。其中,Pcif1是一种在基因表达调控中起重要作用的 mRNA 甲基转移酶,主要在雌性组织中上调。促生长受体Igf1r的上调表明缺乏能量的小鼠的 IGF 信号传导发生了改变。与这些发现一致,IGF-1 水平降低与人类的能量缺乏有关。
其他几个基因,包括Pcif1、Vps11、Galnt15、Cirbp、Apod、Hif3a、Igf1r、Ezh1、Gnmt、Slc25a28、Prodh、Mt1、Mt2和Pxmp2,在雌性和雄性的多个组织中均上调。冷诱导 RNA 结合蛋白 (Cirbp) 在各种组织中发生激活,并在对低温的适应性反应中发挥重要作用。事实上,在食物匮乏期间,小鼠和人类都会降低核心体温,作为减少能量消耗的适应性反应。载脂蛋白 D (Apod) 是高密度脂蛋白 (HDL) 的一种组成部分,也是脂质运载蛋白家族的成员,可运输小的疏水分子并与类固醇和胆红素结合,在多种雌性和雄性组织中表达增加。缺氧诱导因子Hif3a是一种通过调节基因转录来调节缺氧反应过程的转录因子(TF)。这一发现表明,能量缺乏的小鼠表现出组织缺氧的迹象,这可能是血红蛋白缺乏性贫血的结果,导致氧结合和运输受损,产生有害影响。长期缺氧会诱发骨质酸中毒,导致运动时 BMD 降低。RED 患者的长期营养不良会增加其对铁缺乏症的易感性。能量缺乏的小鼠中线粒体铁转运蛋白Slc25a28的上调表明这些小鼠缺铁。此外,多种肌肉组织中大分子中性氨基酸的转运蛋白Slc10a6的上调表明肌肉营养供应不足。此外,金属硫蛋白(Mt1和Mt2) 的表达在各种组织中上调。除了在调节必需金属平衡(锌和铜)中的作用外,它还可以由糖皮质激素诱导,能量缺乏的小鼠血浆中糖皮质激素水平升高。
总之,在一天中,多种组织中都存在这些基因表达变化,这表明能量缺乏通过多种途径对全身产生系统性影响。
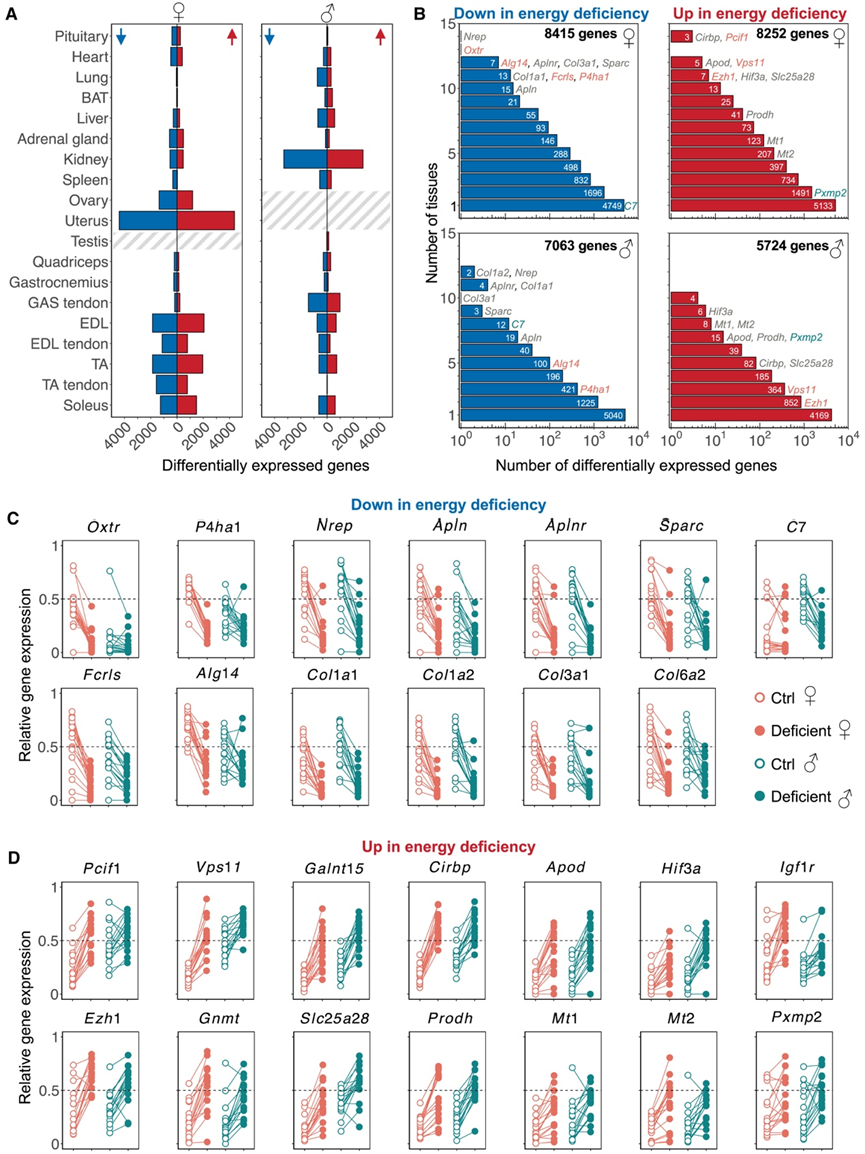
图3. 能量缺乏影响内分泌和代谢器官的基因表达。
(A) 雌性和雄性小鼠所有组织中时间独立分析的差异表达基因 (DEG)数量。(B) DEG 的组织分布。(C-D) 下调基因和上调基因的标准化表达。
04
能量缺乏小鼠的HPA轴和HPG轴基因表达变化
接下来,他们进行了有针对性的分析,以研究能量缺乏对内分泌功能的影响。下丘脑-垂体-肾上腺(HPA)/性腺(HPG)/甲状腺(HPT) 轴活性在 RED 中起着关键作用。虽然下丘脑 PVN 中关键的应激反应调节因子促皮质素释放激素 (Crh) 的表达不受影响,但另一种释放因子促皮质素释放激素结合蛋白 (Crhbp) 发生上调,而促皮质素释放激素受体 (Crhr2) 发生下调(图 4 A)。各种应激都可能引发大脑多个部位Crhbp表达升高,包括食物剥夺和滚轮运动。此外,缺乏该物质的小鼠中,精氨酸加压素 (Avp)的表达减少,该物质是垂体前叶促肾上腺皮质激素 (ACTH) 分泌的“控制器”。然而,Crhr1和Pomc的表达均未因能量缺乏而发生变化,这表明可能涉及糖皮质激素依赖性负反馈(图4B)。ACTH受体Mc2r在能量缺乏的小鼠的肾上腺中上调(图 4C)。糖皮质激素介导的负反馈作用于下丘脑 GR 复合体(Nr3c1和Fkbp5),后者在能量缺乏期间表达增加(图 4A)。与 HPA 轴相关的基因的变化表明,缺乏该物质的小鼠的神经回路发生激活,而这与应激有关。
能量平衡和生殖轴之间存在紧密联系。生殖轴的关键调节器——促性腺激素释放激素 (Gnrh1) 神经元位于下丘脑的视前区 (POA),在缺乏该物质的小鼠中,其表达水平呈降低趋势(图 4 A)。在垂体中,编码 HPG 轴释放因子受体、促性腺激素亚基和类固醇激素受体的基因在缺乏该物质的雌性动物中表达发生变化(图 4 B)。糖蛋白激素 α 亚基 (Cga) 可与 FSHb、LHb 或 TSHb 结合形成活性二聚体,并在能量缺乏时下调,而Fshb、Lhb和Tshb没有显著变化。在食物匮乏期间, Cga表达降低会限制垂体促性腺激素(FSH、LH 和 TSH) 激活整个外周身体靶器官中的下游信号通路。此外,在性腺中,Oxtr表达下调,而Nr3c2表达上调。这意味着在负能量平衡下,生殖组织会改变对糖皮质激素和催产素的敏感性,从而相应地调节下游生理过程(图 4C-D)。激素介导的负反馈会诱导几种下丘脑类固醇激素受体、孕激素受体 (Pgr) 和雌激素受体 (Esr1)的表达发生改变,以应对能量不足。总之,这些发现表明,负能量平衡主要在雌性中引起 HPA 轴激活和 HPG 轴活动失活。
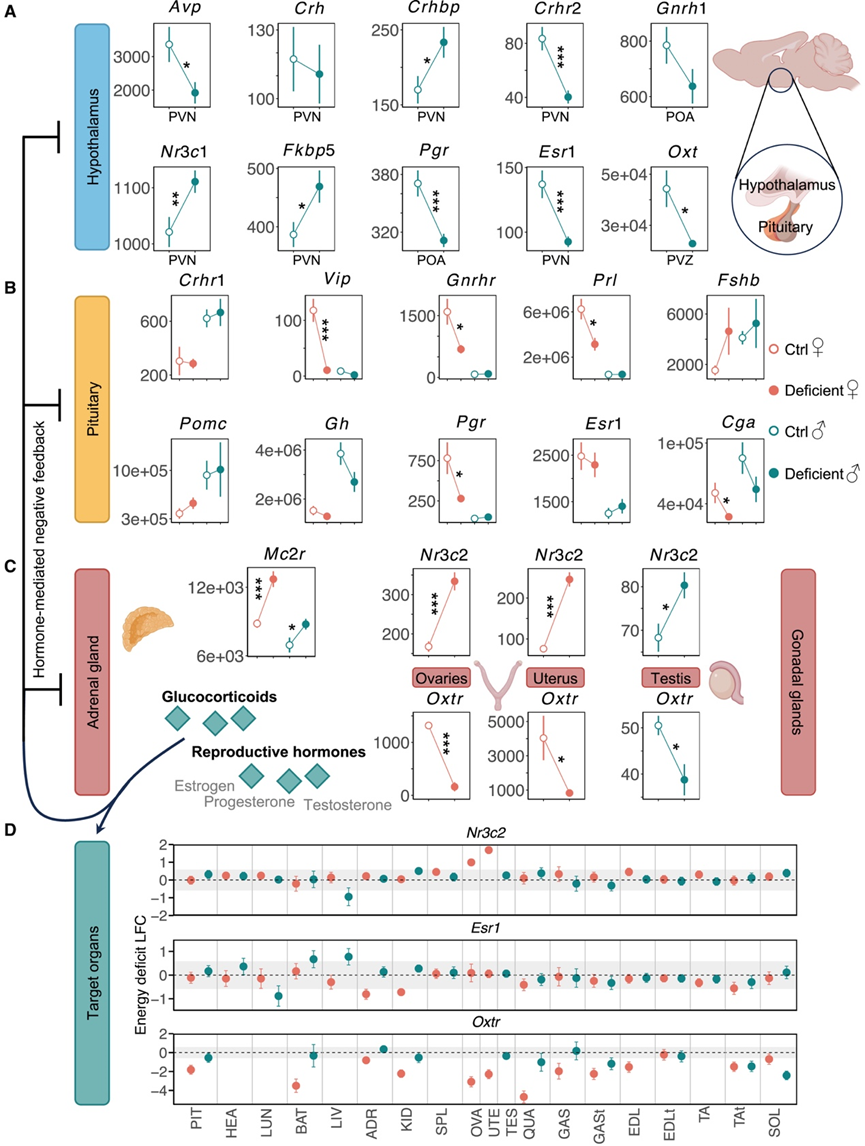
图4. 缺乏小鼠HPA轴和HPG轴基因表达变化。
(A-C)不同组织的特征基因表达。(D) 能量缺乏引起的靶器官受体变化。
05
能量缺乏影响多种肌肉和肌腱的基因表达
患有 RED 的运动员更容易发生肌肉骨骼损伤。为了研究过度运动时能量摄入不足对肌肉骨骼系统分子动力学的影响,他们重点研究了几种肌肉和肌腱中的 DEG,其中大多数在人类参与者中难以获取。相比于雄性组织,雌性的肌肉和肌腱受影响更大(图 5 A)。在雌性肌肉中,共鉴定出 6476 个 DEG,其中 3136 个下调,3340 个上调(图 5 B-C)。在男性肌肉中,检测到 3182 个 DEG,其中 1697 个下调,1485 个上调。基于全转录组水平的主成分分析 (PCA) 显示聚类:(1) 肌腱(EDLt、GASt 和 TAt)、(2) 糖酵解肌(EDL、GAS、TA 和 QUA)和 (3) 氧化肌肉 (SOL)(图 5D)。这些转录本的功能注释揭示了雌性和雄性小鼠中受能量缺乏影响的不同生物过程。雌性肌肉中富集排名前 5 的通路是 ECM 组织、粘着斑、染色质组织、超分子纤维组织和细胞死亡的正向调节(图 5E)。在雄性肌肉中,富集排名前 5 的通路是翻译起始、有氧呼吸、ECM 组织、粘着斑和 TCA 循环。
胶原蛋白是骨骼肌外基质中重要的结构蛋白,约占干肌质量的1%-10%。在能量缺乏的情况下,46 种胶原蛋白编码基因中有超过 50% 在至少一种肌肉组织中下调:雌性中有 25 种基因,雄性中有 23 种(图5 F)。在肌肉组织中,纤维形成胶原蛋白 I、III 和 XI 型受到的影响最大。胶原蛋白为(肌肉)组织提供力量和支撑。研究结果表明,能量缺乏可能导致结缔组织中胶原蛋白含量降低,可能导致结构改变和肌肉和组织支撑减弱,从而增加受伤的脆弱性。值得注意的是,肌肉胶原蛋白含量的降低与衰老一致。
Foxo3是肌肉中蛋白质合成和降解的主要调节因子,在所有肌肉中均上调(图 5 F)。分解代谢状态与人类和小鼠骨骼肌中Foxo3表达升高有关,从而促进自噬。赖氨酰氧化酶 (Loxl2) 是一种负责催化胶原交联形成的酶,在能量缺乏的情况下,它在所有肌肉中均下调。Rhobtb1提供制造参与肌动蛋白丝组织的蛋白质的指令,主要在经历能量缺乏的女性中下调。Fbxo32已知可促进肌肉蛋白质降解,在能量缺乏的肌肉中上调,尤其是在女性和含有糖酵解纤维类型的肌肉中。酰基辅酶 A 合成酶 (Acsl6)负责催化脂肪酸形成酰基辅酶 A,在能量缺乏的肌肉中上调。。C7编码一种参与先天免疫系统补体系统的蛋白质,该基因在雄性中专门下调,表明雄性对细菌感染的易感性增加。Aldh18a1编码一种对线粒体功能和脯氨酸形成很重要的蛋白质,在能量缺乏肌肉时下调。
在雌性肌腱中,共鉴定出 3823 个 DEG,其中 2426 个下调(图 5 B),1397 个上调(图 5 B-C)。同样,在雄性肌腱中也发现了 3,055 个 DEG,其中 1906 个下调,1149 个上调。雌性肌腱中富集的前五个通路是胶原形成(P4ha1)、mTOR 信号传导(Igfbp3)、线粒体组织、自噬和小分子分解代谢过程(图 5 G)。在雄性肌腱中,富集的前五个通路语包括胶原形成、氨基酸代谢、小分子分解代谢过程、磷酸盐转运调节和 mTOR 信号传导。例如,在能量缺乏反应中观察到参与胶原合成的酶P4ha1的下调(图 5 H)。此外,在缺乏IGF的小鼠的肌腱中,IGFbp3(一种通过与IGF结合来抑制细胞增殖的基因)上调。最后,肌腱成熟的特定标记物tenomodulin (Tnmd) 在腓肠肌腱中下调。有趣的是,这种基因与小鼠运动表现下降有关。
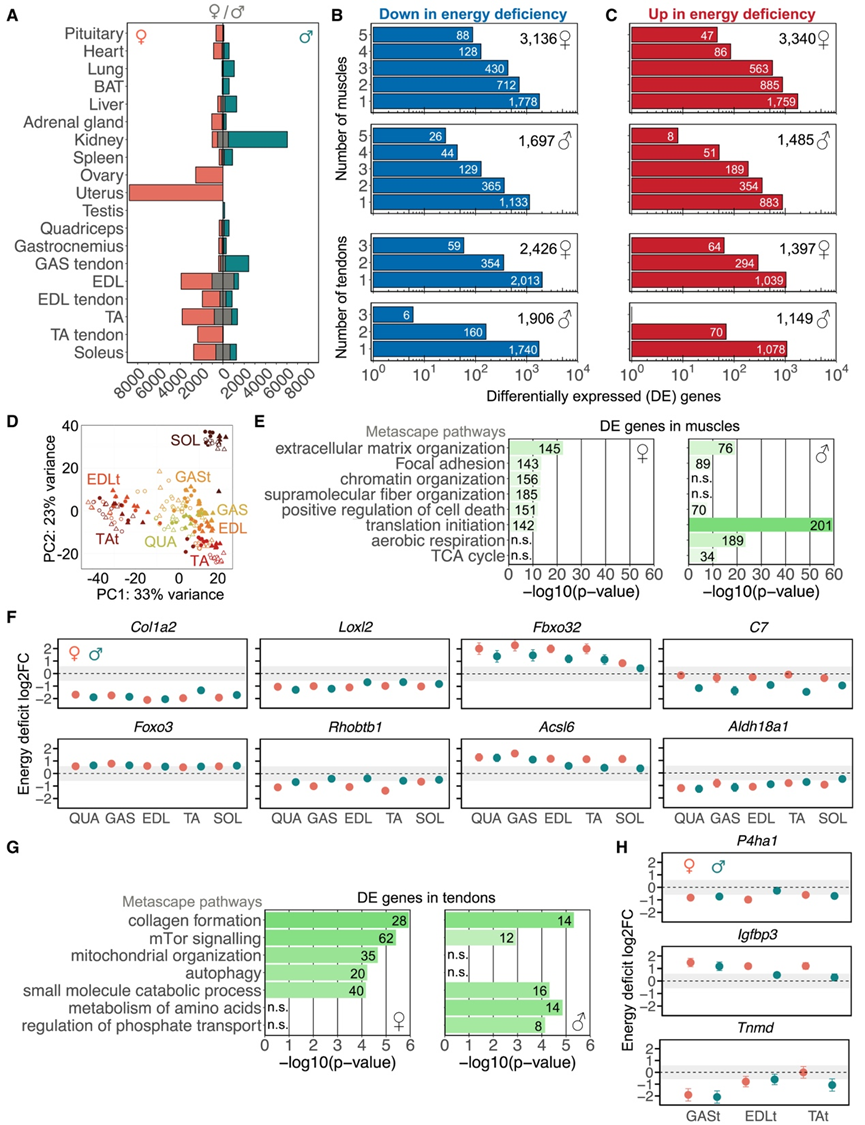
图5. 能量缺乏影响多块肌肉和肌腱的基因表达。
(A) 雌性和雄性小鼠所有组织能量缺乏时的时间独立分析中DEG基因的数量。(B-C) DEG基因的分布。(D) 对所有肌肉和肌腱组织进行主成分分析(PCA)。(E)GO分析。 (F) 基因表达变化分析。(G) 通路分析。(H) 基因表达变化分析。
06
子宫、卵巢和男性肾脏的转录组受能量缺乏的影响最大
在雌性中,子宫和卵巢是对负能量平衡反应最灵敏的组织。这些组织显示出最多的DE基因:子宫中有8785个(4407个下调和4378个上调)(图6 A-C)卵巢中有2563个(1368个下调和1195个上调)(图6 D-F)。在雄性中,肾脏是对负能量平衡反应最灵敏的组织,显示出6037个DEG(3301个下调和2736个上调)(图6G-I)。有趣的是,这些器官也显示出最大程度的能量减少,这意味着在能量可用性低的时期,小鼠体内“策略性”地为这些器官分配更少的能量以减少能量消耗(图1 K-L)。
子宫内 DEG的功能注释表明,与免疫反应(C3、Mx1和Oas2)、氧化磷酸化(Cox5a、Ndufa1和Atp5e)和细胞运动的正向调节(Ccr3、Lrg1和Cemip)相关的基因改变最多(图 6B)。雌性生殖道的子宫内膜含有许多免疫细胞,并在宿主和其环境之间形成屏障,以防止病原体进入。大多数与免疫功能相关的基因发生下调,例如补体成分(C3、Cfi和C4b)、抗原(Bsst2、Ly86和Ly6a)和趋化因子(Ccr3、Ccl8和Cxcl17)。这些研究结果表明,子宫内的先天免疫系统因能量缺乏而受损。这与先前的研究结果一致,表明 C3 水平与身体质量指数(BMI)之间存在正相关关系。鉴于免疫反应的能量成本高,免疫功能取决于宿主的能量状态。在能量缺乏的小鼠中,几种编码线粒体细胞色素c氧化酶 (Cox)、NADH 脱氢酶 (Nduf) 和 ATP 合酶基因的基因下调。这表明 ATP(能量)合成减少,导致代谢活动降低,进而有助于保存能量。与细胞运动正向调节相关的大多数基因下调。这与细胞运动减少和收缩力下降有关,表明由于能量缺乏导致子宫内膜为胚胎植入所做的准备受损,从而降低了在食物匮乏的情况下成功植入的可能性。
骨桥蛋白 (Spp1)是一种 ECM 分子和细胞因子,与重塑管腔上皮以确保成功植入有关,在能量缺乏的小鼠的子宫中显著下调(图 6 C)。此外,编码角蛋白 (Krt) 的基因发生下调,角蛋白是一种纤维结构蛋白。子宫角蛋白此前已证明可以促进胚胎植入。负责在妊娠期间灭活组胺以保护母体和胎儿的含铜胺氧化酶 1 (Aoc1) 在也发生下调。相反,紧密连接蛋白 Claudin 8 (Cldn8) 在能量缺乏的小鼠的子宫中上调。这种蛋白质可以通过类固醇进行调节,并且在宫颈癌中会升高。
在卵巢的 DG中,有几种基因编码与 ECM(Adamts4、Mmp17和Ntn4)和蛋白质折叠(Agr2、Qsox1和Hspa5)相关的蛋白质(图 6 D-E)。Cd7是免疫球蛋白超家族的成员,在能量缺乏小鼠中下调(图 6 F)。在卵母细胞衰老中发挥作用的神经肽 (Nnat)在能量缺乏小鼠中下调。此外,参与消化膳食甘油三酯的基因 (Lipf) 和神经肽 Y 受体 (Npy4r) 在能量缺乏小鼠的卵巢中也发生下调。对雄性肾脏中 DEG的功能注释表明,能量缺乏的小鼠中改变的DEG与氧化磷酸化(Ndufa13、Ndufa1和Ndufv3)、分解代谢过程(Akr1c18和Hpd)和巨自噬(Psen1、Mtor和 Ctsd )有关(图6G-H)。肾脏尺寸因能量缺乏而急剧减小,尤其是在雄性中,反映了雄性肾脏分子变化程度高。几种有机阴离子转运蛋白的表达发生了变化(Slc22a7和Slc22a29),表明由于血液中营养/蛋白质浓度降低,肾脏分泌和重吸收可能发生了变化(图 6 I)。此外,血管紧张素转换酶(Ace)(血压和体盐平衡的关键调节因子)也发生下调,可能导致在能量缺乏条件下的血压下降。
这些结果凸显了能量缺乏对不同器官的性别特异性影响。在雌性中,生殖器官受到严重影响,而在雄性中,肾脏主要受到能量缺乏的影响。
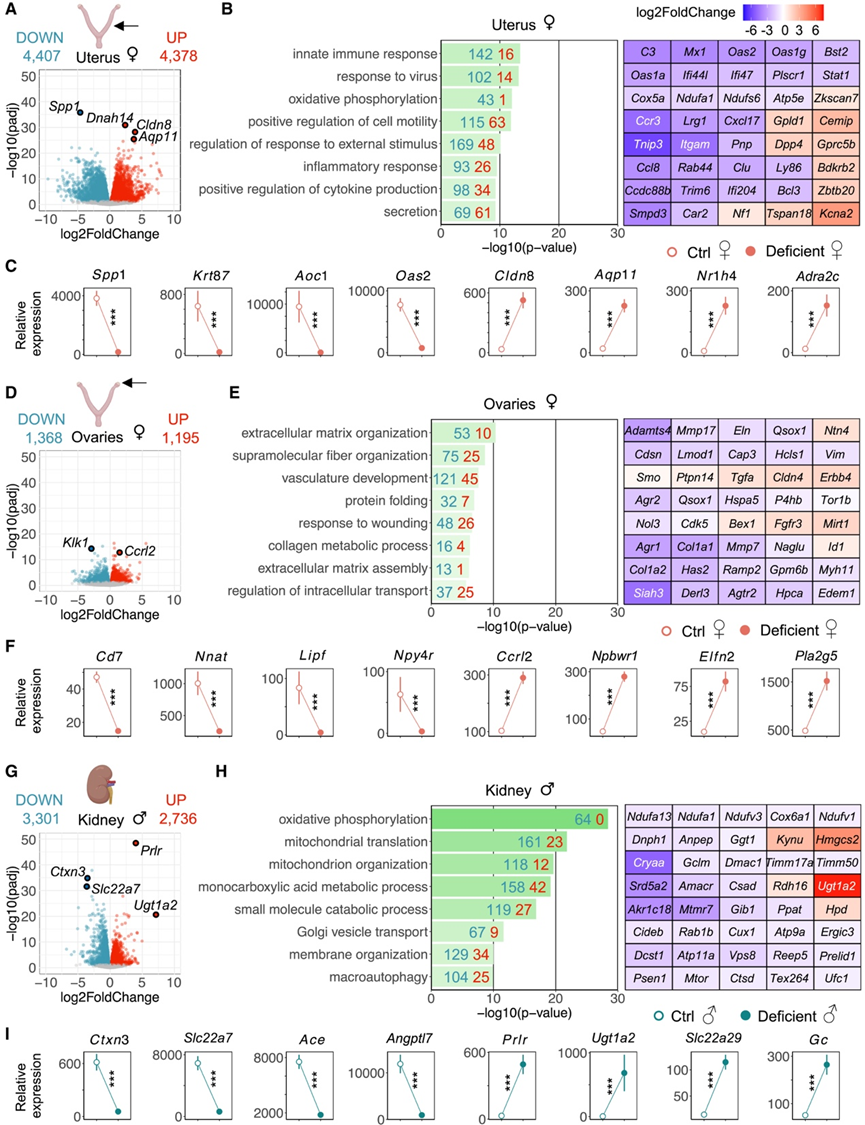
图6. 子宫、卵巢和男性肾脏的转录组受能量缺乏的影响最大。
(A) 子宫中时间独立分析的DEG的火山图。(B) GO分析。(C) 能量缺乏引起的子宫基因的变化。(D) 卵巢中时间独立分析的DEG的火山图。(E) GO分析。(F) 能量缺乏引起的卵巢中基因的变化。(G) 肾脏中时间独立分析的DEG的火山图。 (H) GO分析。(I) 能量缺乏引起肾脏中基因的变化。
07
能量缺乏小鼠的血浆蛋白质组学和代谢组学
他们采用了一种非靶向血浆蛋白质组学方法来识别能量缺乏引起的血液循环变化。他们总共识别出了 21144 个独特肽,它们映射到 3035 个独特蛋白质,平均每个样本有 10107 个肽和 1975 个蛋白质。通过过滤在 ≥50% 的样本中检测到的蛋白质并使用估算的归一化强度值,他们在雌性中识别出了 62 个显著变化的蛋白质(17 个下调和 45 个上调),在雄性中识别出了 380 个变化的蛋白质(189 个下调和 191 个上调)(图 7 A-E)。他们对所有 442 个改变的蛋白质进行了进一步分析,以根据对能量代谢的先前了解突出显示最相关的变化。31 个差异表达蛋白(DEP)在雌性和雄性之间重叠。在雌性中,前10个下调蛋白为COL1A1、LOXL1、COL1A2、RPL27、SEMA3D、SLC6A4、RPL18、IGFALS、RPS9、SERBP1,前10个上调蛋白为MBL2、PCK1、AHNAK、EHD2、ADIPOQ、LAP3、AMY2A、VAT1、GLUD1、ACLY(图7B)。在雄性中,前10个下调蛋白为SAA4、C6、CTH、NID2、LECT2、C4A、COL1A1、EGFR、SEMA3D、KAZALD1,前10个上调蛋白为CSRP1、FHL1、PF4、THBS1、SERPINE2、ANGPT1、CSRP3、LTBP1、AK1、PTMS(图7D)。
与在几个器官的转录水平上的发现一致(图 3 C),几种 ECM 蛋白的血浆水平降低。例如,COL1A1 蛋白在缺乏的小鼠的血浆中也降低(图 7 E)。同样,其他胶原蛋白(COL1A2、COL3A1、COL11A2、COL14A1、COL6A3 和 COL16A1)、前胶原蛋白 (PLOD3) 和胶原交联酶 (LOXL1) 在血浆中也降低(图 7 B-E),与各种组织中的转录水平相匹配(图 3 C)。运动可诱导啮齿动物和人类分泌胶原结合 ECM 蛋白 SPARC。相反,在能量缺乏的情况下,小鼠血浆中(图 7 E)和多个器官中的SPARC 含量均降低(图 3 C)。此外,能量缺乏的小鼠血浆中与免疫系统相关的几种因子发生了改变,例如甘露糖结合凝集素 (MBL2)、血清淀粉样蛋白 A4 (SAA4) 和补体成分 6 (C6)。
检测到雌性体内脂联素 (ADIPOQ) 水平升高(图7 E)。ADIPOQ 是一种厌食脂肪因子,可调节葡萄糖水平和脂肪酸代谢。在患有 RED 症状的女性中也发现循环 ADIPOQ 水平升高。在能量缺乏的小鼠中,胰岛素样生长因子 (IGF-1) /BP-3 比率降低,这表明游离 IGF-1 减少。在能量可用性低的人类中也观察到了类似的模式。最后,血浆 TNMD 水平降低,这与腓肠肌腱中检测到的Tnmd转录水平降低相一致。TNMD 与小鼠跑步表现下降有关。
他们还使用非靶向血浆代谢组学方法来识别能量缺乏引起的血液循环变化,总共识别出 990 种(雌性)和 989 种(雄性)独特的生化物质。他们在雌性中识别出 276 种变化的代谢物(148 种下调和 128 种上调),在雄性中识别出 387 种变化的代谢物(260 种下调和 127 种上调)(图 7 F)。缺乏能量的小鼠的血浆皮质酮水平升高(图 7 G)。能量缺乏时,血浆中各种脂肪酸和与脂肪酸代谢相关的代谢物,如甘油酸酯 (17:0)、亚油酸酯 (18:2n6)、12,13-DiHOME、异己酰甘氨酸、二十二碳三烯酸酯 (22:3n6) 和十四烷二酸酯 (C14) 都会发生变化。最后,能量缺乏的雌性和雄性小鼠的血浆甘油三酯水平降低(图 7 H),而只有能量缺乏的雄性小鼠的血浆胆固醇水平下调(图 7 I)。
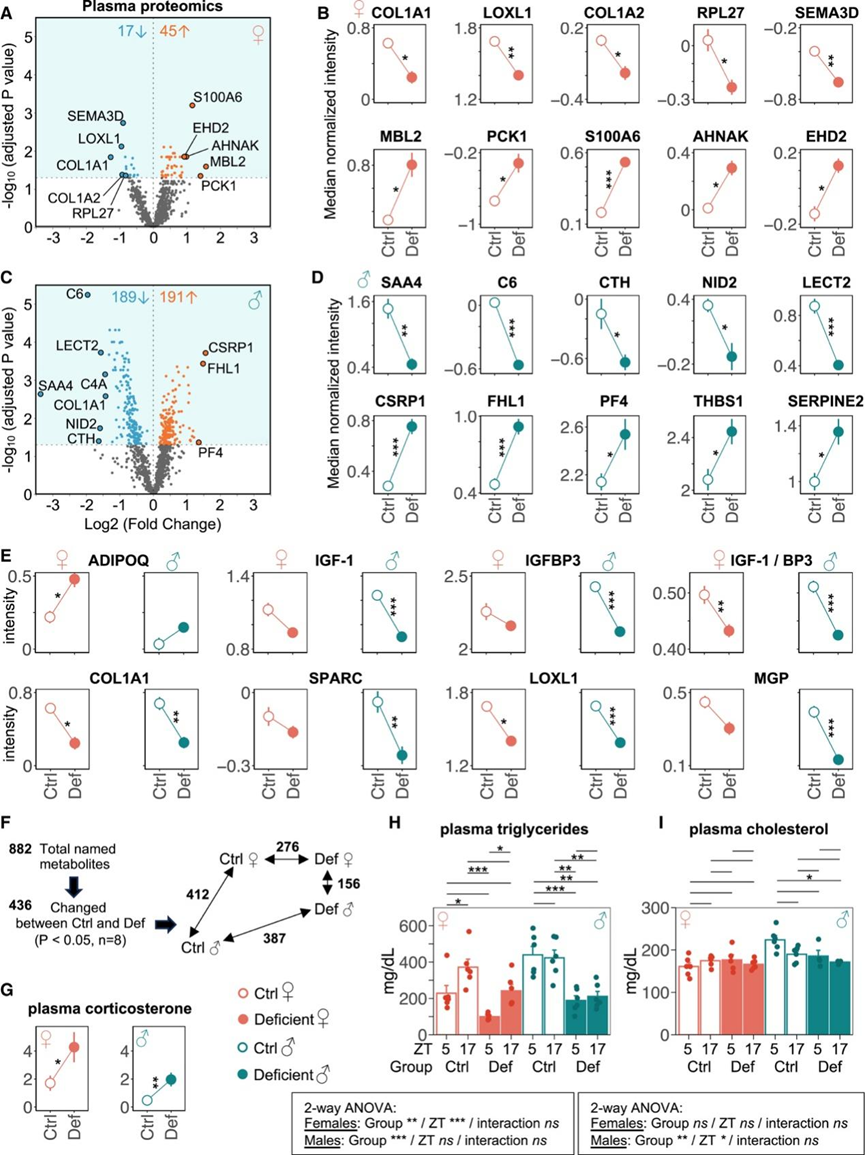
图7. 小鼠的血浆蛋白质组学和代谢组学分析。
(A) 雌性小鼠血浆中差异丰度蛋白质的火山图。 (B) 雌性小鼠中前十位差异表达血浆蛋白。(C) 雄性小鼠血浆中差异丰度蛋白质的火山图。(D) 雄性小鼠中前十位差异表达血浆蛋白。(E) 因能量缺乏而发生变化的其他血浆蛋白的例子。(F) 血浆中代谢物变化的总结。(G) 血浆皮质酮水平。(H-I) 血浆皮质酮水平。
+ + + + + + + + + + +
结 论
本项研究通过对“运动换食物”的小鼠模型模拟了人类的RED状态,这些小鼠体力活动量大,并逐渐减少食物摄入量,导致体重减轻、骨骼健康受损、器官特异性质量变化和静息活动模式改变。对于雌性来说,生殖器官和肌肉会因能量缺乏而受到很大影响,对于雄性来说,肾脏受能量缺乏的影响很大。
+ + + + +



 English
English


