文献解读|Genome Med(10.4):对来自原发性肺癌和脑转移的配对多组学数据的综合分析揭示了代谢脆弱性作为新的治疗靶点
✦ +
+
论文ID
原名:Integrated analyses of multi-omic data derived from paired primary lung cancer and brain metastasis reveal the metabolic vulnerability as a novel therapeutic target
译名:对来自原发性肺癌和脑转移的配对多组学数据的综合分析揭示了代谢脆弱性作为新的治疗靶点
期刊:Genome Medicine
影响因子:10.4
发表时间:2024.11.26
DOI号:10.1186/s13073-024-01410-8
背 景
肺癌是第二大常见癌症,也是癌症相关死亡的主要原因之一,2020 年全球肺癌确诊病例和癌症相关死亡病例中分别占 11.4% 和 18.0%。肺癌脑转移 (LC-BrM) 是肺癌患者最常见的并发症之一。多达 20% 的肺癌患者在诊断时出现 LC-BrM,复发时则为 50%。尽管癌症治疗方法已经得到改进,患者往往可以带着原发性肿瘤存活更长时间,但 LC-BrM 的发病率却一直在迅速上升。
实验设计
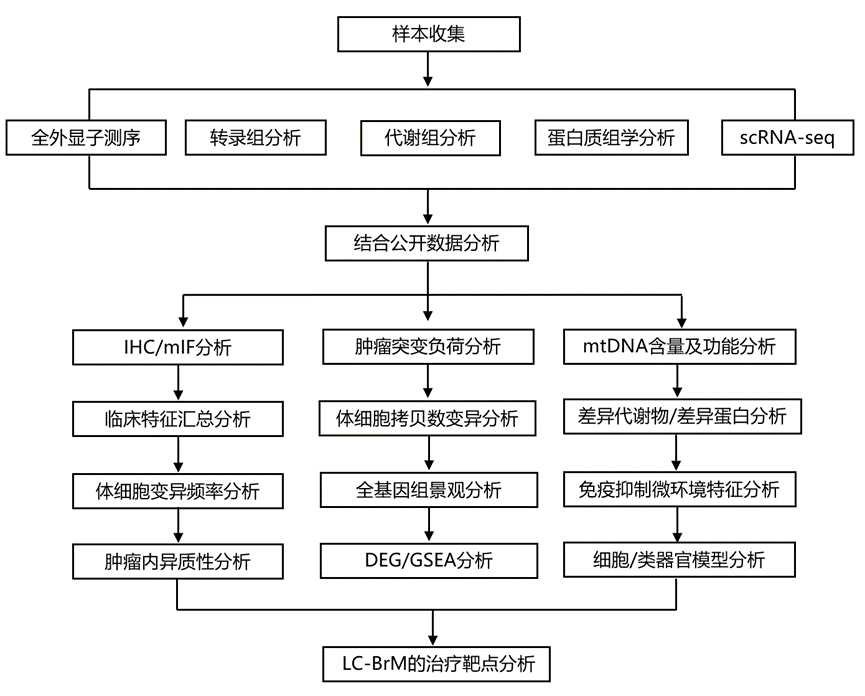
结 果
01
患者群体和临床病理学特征
在本研究中,他们汇集了目前最大的原发性肺癌和 BrM 病变配对患者队列,所有这些患者都有多组学数据。他们综合分析了来自三个已发表数据集的全外显子测序 (WES)、转录组分析(RNA-seq)和反相蛋白阵列 (RPPA)数据(图 1 a)。此外,他们还对中山大学肿瘤防治中心(SYSUCC)新生成的患者队列进行了 WES、RNA-seq、蛋白质组学和代谢组学分析(图 1 a)。总体而言,共有 119 例原发性肺癌和 BrM 病变配对患者纳入基因组分析;56 例患者纳入转录组分析;16 例患者纳入蛋白质组学分析(4 例用于蛋白质组学,12 例用于 RPPA);并纳入4名患者进行代谢组学分析。
为了验证多组学数据的结果,他们研究了一个独立的单细胞转录组分析(scRNA-seq)数据队列,该队列包括来自 15 个原发性肺癌的 45149 个单细胞和来自 10 个 BrM 病变的 29060 个单细胞。此外,他们进一步组装了来自 SYSUCC 和华西医院 (WCH) 的两组配对原发性肺癌和 BrM 病变患者队列,用于免疫组织化学 (IHC)和多重免疫荧光 (mIF)染色(图 1 a)。此外,还纳入了 SYSUCC 队列中的 24 名患者用于分析线粒体 DNA (mtDNA)含量变化。
由于SYSUCC队列中的DHP18患者接受的治疗过程具有代表性,因此以该患者为例:第0天通过计算机断层扫描(CT)扫描发现左上叶肺肿块,第17天确诊为病理学III期(T4N0M0)肺低分化腺癌。虽然在第33天肺叶切除后进行了辅助化疗,并于第272天因局部复发进行了放疗,但在第505天检测到BrM,随后于第507天切除(图 1 b)。进行H&E染色以确认原发性肺癌和BrM病变的病理诊断.
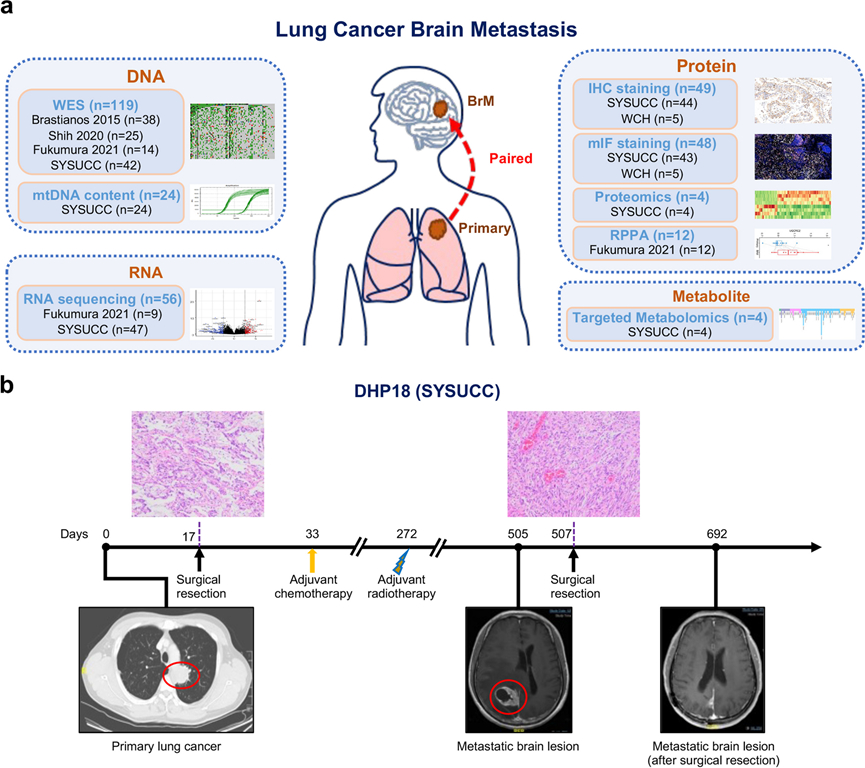
图1. 研究工作流程、患者和样本概述以及队列特征。
(a) 患者队列和各种实验平台概述。(b) 一名代表性原发性肺癌患者(DHP18),后来出现脑转移。CT 扫描发现原发性肺病灶,并进行手术切除以获取原发性肺癌样本。
02
原发性肺癌和 LC-BrM 的体细胞变异频率
他们评估了体细胞突变的稳定性、获得性和丧失性对原发性肺癌脑转移的影响。他们使用病例/对照体细胞改变分析来比较 LC-BrM与原发性肺癌,并分别展示配对原发性肺癌和 LC-BrM 的前 25 个突变(图 2a-b)。他们观察到,一组基因的突变几乎总是由原发性肺癌和脑转移瘤(BrM)病变共有,包括TTN(62%、64%)、MUC16(46%、45%)、LRP1B(43%、42%)、TP53(42%、49%)、OBSCN(26%、25%)、FAT3(25%、26%)和EGFR(22%、20%),这些基因在肺癌中常见突变(图 2a-b)。这些结果与之前的报告一致,表明这些体细胞突变在肺腺癌中很常见。UTRN 、DGKH、IL17RA、ITGA6、CUL1、DDX50、MTFR1、EXOC7、NUP188和KDM5B这十个基因中每一个的较高频率与原发性肺癌显著相关,而MUC2和ELAVL2的优势比(OR)在BrM群体中显著小于1。这些数据表明MUC2和ELAVL2在LC-BrMs中发生了特异性突变。然而,还需要进一步研究来确定这些突变是否在脑转移的发展或进展中发挥驱动基因的作用。
他们还通过聚类变异等位基因频率 (VAF) 推断了原发性肺癌和 BrM 病变的肿瘤内异质性 (ITH)。原发性肺癌的中位绝对偏差平均值为 4.92,而 BrM 病变的中位绝对偏差平均值为 8.25,原发性肺癌的平均突变等位基因肿瘤异质性 (MATH) 为 35.15,而 LC-BrM 为 42.32。原发性肺癌和 LC-BrM 之间的两个评分差异均有显著性,表明与原发性肺癌相比,LC-BrM 表现出更高的 ITH(图 2 d-e)。例如,源自患者 DHP18 的原发性肺癌未显示克隆分离,其平均变异频率为 ~ 35%,MATH 得分为 2.92,而 LC-BrM 则显示两个克隆明显分离,其主要克隆聚类为 ~ 35%,次要克隆聚类为 ~ 65%,MATH 得分为 33.66(图 2c)。另外两对原发性肺癌和 LC-BrM 也显示了类似的结果。总之,驱动因素的持续存在和一致性变化的缺乏表明,与配对的原发性肺肿瘤相比,BrM 病变具有更高的 ITH 特征。
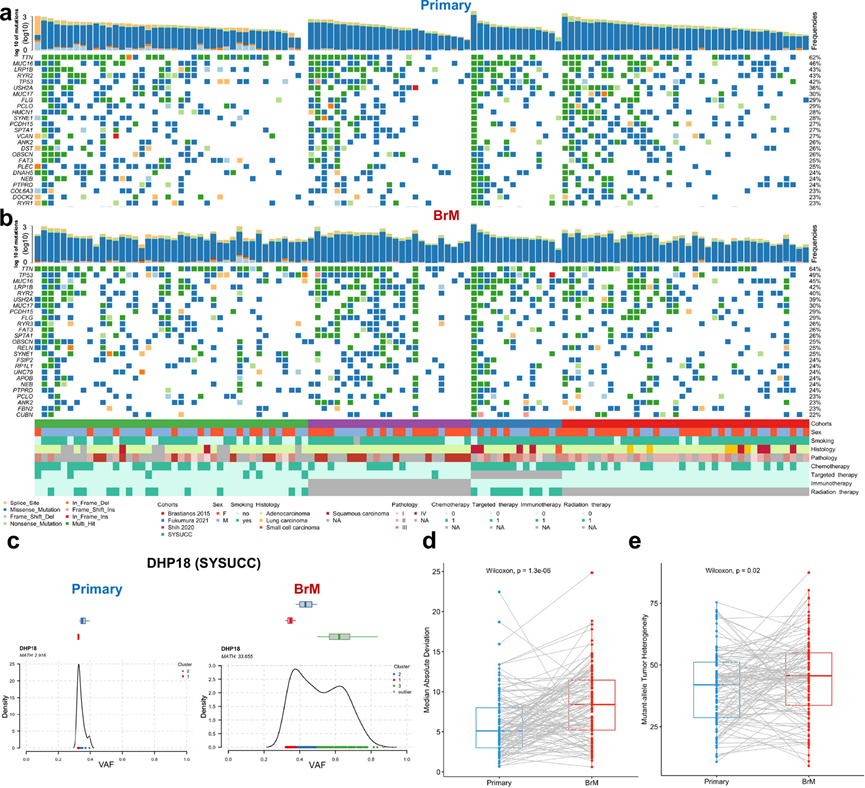
图2. 肿瘤图显示了配对原发性肺癌和脑转移 (BrM) 标本中 25 个最常突变的基因。
(a-b) 反复突变的致癌驱动基因。(c) 来自代表性患者 DHP18 的原发性肺癌(左)和 BrM 样本 (右)的聚类图。(d-e) 配对原发性肺癌和脑转移病变中中位绝对偏差和突变等位基因肿瘤异质性的箱线图。
03
原发性肺癌和 LC-BrM 的躯体状况
随后,他们通过比较肿瘤突变负荷 (TMB),包括单核苷酸多态性 (SNP)、小插入和缺失 (INDEL) 和拷贝数变异 (CNV),以了解原发性肺癌及其配对 BrM 病变的一般模式。原发性肺癌和 LC-BrM 表现出的 TMB 与之前报道的癌症基因组图谱计划 (TCGA) 肺腺癌 (LUAD) 队列的结果相当,该队列包含 516 个样本,中位 TMB 为 7.78。原发性肺癌和 BrM 病变的中位 TMB 分别为 6.22 和 5.21,以每兆碱基 (Mb) 的 SNP 和 INDEL 定义。 15 名BrM 患者表现出的 TMB-SNP增加,104 名患者表现出 TMB 减少(图 3 a)。接下来,他们评估了原发性肺癌和 BrM 之间的 TMB、SNP、INDEL 和 CNV 的差异。原发性肺癌和 BrM 之间的 TMB 和 SNP 没有显著差异;然而,原发性肺癌和 LC-BrM 之间的 INDEL TMB、CNV TMB 有显著差异。
原发性肺癌和 LC-BrM中体细胞改变的相似性和差异性也对癌症体细胞突变目录 (COSMIC) 突变特征的组成部分有所贡献。正如预期的那样,特征活动与体细胞突变密切相关,因为他们观察到原发性肺癌和 LC-BrM表现出相似的突变特征模式(图 3b-c)。特征 1—5-甲基胞嘧啶的自发或酶促脱氨、特征 4—接触烟草和特征 7—紫外线照射几乎始终是所有队列中的主要特征。特征 2—病毒感染、逆转录转座子跳跃或组织炎症和特征 13—APOBEC C > G 在 Brastianos 和 Fukumara 队列中均以检测到为主;有趣的是,特征 2 归因于 APOBEC 胞苷脱氨酶家族的活性,该酶存在于 22 种不同类型的癌症中,但最常见于宫颈癌和膀胱癌。
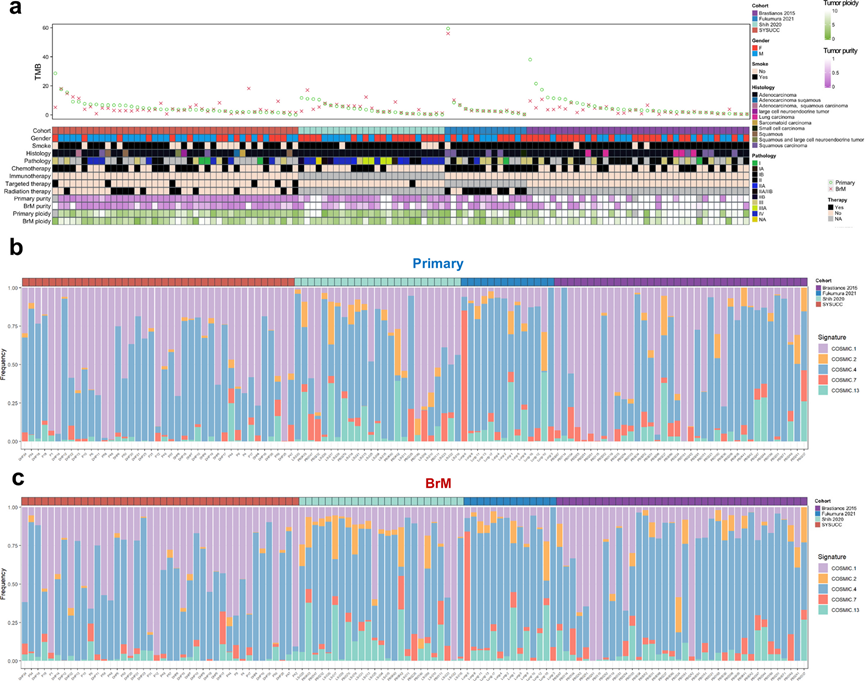
图3. 肿瘤突变负担和突变特征。
(a) 对四个独立队列进行综合分析。(b) 每个原发性肺癌标本中突变特征贡献的百分比。(c) 每个BrM标本中突变特征贡献的百分比。
04
体细胞拷贝数变异 (SCNA) 概况
他们接下来评估了 SCNA,发现原发性肺癌和 LC-BrM 之间的 SCNA 的全基因组景观相似(图 4 a-b)。四个队列中染色体臂级拷贝数事件发生的频率相似。 在这四个队列中,这些分析显示,LC-BrM 表现出 20 个臂级增益和 31 个臂级损失,而原发性肺癌表现出 25 个臂级增益和 33 个臂级损失。在这些 SCNA 区域中,20 个增益中的 18 个和 31 个损失中的 28 个是原发性肺癌和 BrM 病变所共有的。此外,他们在 LC-BrM 中发现了 24 个扩增和 45 个缺失的峰值,而原发性肺癌中发现了 29 个扩增和 57 个缺失的峰值。在这些峰值中,5p15.33、7p11.2、10q11.21、11q13.1、11q13.3、12q15、14q13.3 和 20q13.33 染色体臂的增加是原发性肺癌和 BrM 病变所共有的,而 1p36.21、6p21.33、6q25.3、9p21.3 和 17p11.2 的丢失是原发性肺癌和 BrM 病变所共有的。在这些共同的峰值中,最大的峰值是 20q13.33 的扩增,有 149 个基因受到影响。影响单个基因座的最窄峰包括 7p11.2、11q13.1、11q13.3、12q15 和 14q13.3 的扩增,以及 6q25.3、9p21.3 和 17p11.2 的缺失。在原发性肺癌和 LC-BrM 中,最常见的三个体细胞拷贝数峰分别出现在 7p11.2(26% vs. 37%)、12q15(12% vs. 15%)和 11q13.3(21% vs.12%)中。他们应用了癌症中重要靶点的基因组识别 (GISTIC),这是一种成熟的方法,用于计算每个基因组位置的 SCNA 阳性选择分数。该方法评估了样本中 SCNA 的幅度和频率,并确定了可能由正向选择导致的 SCNA 显著复发的区域。原发性肺癌和 LC-BrM 队列中排名最高的基因包括CCNL2、DVL1、ATAD3A、AGRN和 ISG15,其中突变模式在患者中聚集在一起。
虽然原发性肺癌和 LC-BrM 之间的拷贝数景观具有广泛相似性,但确定了四个不同的基因组区域,它们的正向选择评分存在显著差异(图 4c-f)。他们在 BrM 中鉴定了 226 个独特缺失中的 52 个和 15 个独特扩增中的 5 个。两个独特局部扩增区域在 BrM 中显著富集,包括(1) 5p15.33 包含SDHA、PDCD6、AHRR、CCDC127、PLEKHG4B和LRRC14B;(2) 20q13.33 包含DAD1、MYT1、PTK6等。两个独特局灶性缺失区域,包括 (1) 包含HKR1 的13p12和 (2) 包含CD74 的 5q33.3。除此之外,他们还发现了独特缺失:包含CDKN2A的 6p21.2、包含SCYL1 的11q12.3、包含NTRK1和MDM4 的1q21.1以及包含PRDM1 的 9q33.2。研究发现,5p15.33 的增益是与肺癌风险可重复关联的区域之一,而 20q13.33 的增益是结直肠癌的主要染色体异常。
本研究中确定的 SCNA 区域包含已知的转移驱动基因。例如,MYC和CDKN2A经常分别参与基因组扩增和缺失,正如之前在 LUAD 患者 BrM 的测序研究中发现的那样。SCYL1激活端粒酶逆转录酶和 DNA 聚合酶 β 基因的转录。SMAD4是TGF-β信号通路功能所必需的,与癌症转移有关。NTRK1融合触发组成性TRKA激酶活性,从而激活细胞生长和分化的信号通路。MDM4是一种p53调节因子,通过p53独立途径充当致癌基因。PRDM1基因编码一种蛋白质,可作为β-干扰素基因表达的抑制因子和TP53活性途径的调节因子。
总之,SCNA的鉴定进一步表明,原发性肺癌和 BrM 病变具有相似的 SCNA全基因组景观,而 BrM 病变包含独特的染色体获得和丢失,可能在基因组水平上有助于 BrM的发展。
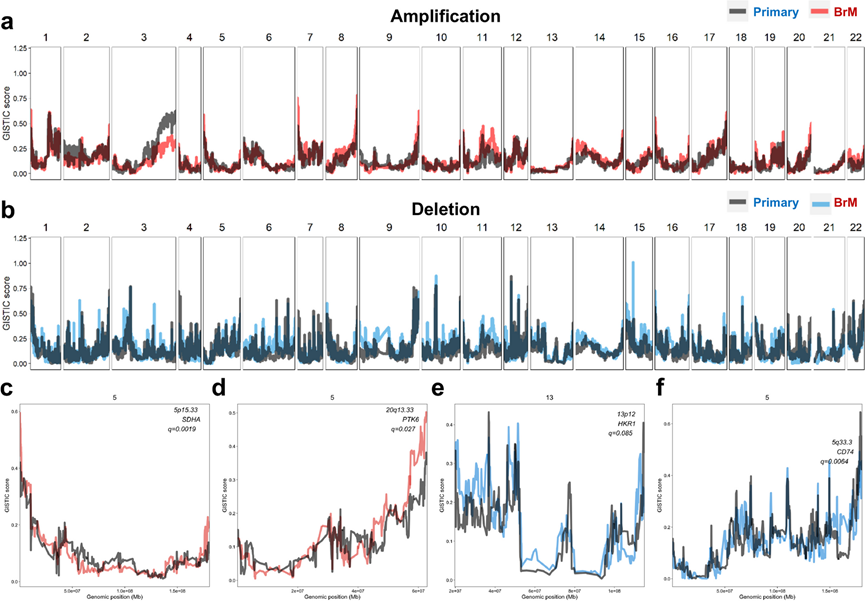
图4. 原发性肺癌和脑转移样本中体细胞拷贝数变异情况。
(a-b) 原发性肺癌和 BrM样本的GISTIC 扩增和缺失图。(c-f) 四张代表性 GISTIC 图显示 BrM 与原发性肺癌相比的候选驱动基因区域。
05
氧化磷酸化 (OXPHOS)在 LC-BrM 中富集
他们总共确定了 108 个在 BrM 病变中显著上调的差异表达基因 (DEG)(图 5a)。为了在 MSigDB Reactome 集合中识别与 BrMs 表型呈正相关的基因集,他们实施了基于 DEG 排序基因列表的基因集富集分析 (GSEA),确定了 298 条显著富集的通路,按归一化富集得分 (NES) 对筛选出的通路进行排序,并重点关注排名前 20 的通路进行进一步分析。在排名前 20 的通路中,有 5 条与线粒体生物合成和氧化磷酸化有关,包括 (1) 柠檬酸 TCA 循环、(2) 呼吸电子转运、(3) 呼吸电子转运通过化学渗透偶联合成 ATP 并通过解偶联蛋白产热、(4) 复合物 I 生物发生和 (5) 丙酮酸代谢(图 5 b)。
接下来,他们通过分析一组独立的 scRNA-seq数据来验证这些结果,该数据包括来自 15 例原发性肺癌的 45149 个单细胞和来自 10 例 BrM 病变的 29060 个单细胞。他们在上皮细胞中进行了单样本基因集富集分析 (ssGSEA),结果显示 (1) 与原发性肺癌相比,这 5 条线粒体通路在 BrM 中确实显著富集,(2) 与原发性肺癌相比,BrM 中 5 条线粒体通路的 ssGSEA 得分均显著更高(图5c-d)。
mtDNA 在编码许多对线粒体呼吸复合体的组装、活动和功能至关重要的蛋白质方面起着关键作用。为了从功能上验证线粒体生物合成是否在 BrM 病变中得到增强,他们确定了 24 对原发性肺癌和来自 SYSUCC 队列的 BrM 病变中的相对 mtDNA 拷贝数,为此纯化了基因组 DNA。与原发性肺癌相比,17 个 (70.8%) BrM 病变的 mtDNA 拷贝数显著较高(图 5e)。
为了在 mRNA 水平上证实这些发现,他们进一步使用 4 对原发性肺癌和 BrM 病变的新鲜冷冻标本进行了无偏和整体蛋白质组学分析。总共有 117 种差异表达蛋白质在 BrM 病变中显著上调(图 5f)。其中,与配对的原发性肺癌相比,BrM 病变中许多与线粒体生物合成相关的蛋白质上调,包括 NDUFAF2、SDHB、COX5A 和 ATP5PO。为了确定在 BrM 中正向富集的信号通路,他们实施了基于差异表达蛋白质排序列表的蛋白质富集分析,确定了 141 条显著上调的通路,按 NES 对筛选出的通路进行排序,并重点关注排名前 20 的通路进行进一步分析。在排名前 20 的通路中,有 4 条通路与线粒体生物合成和氧化磷酸化有关,包括 (1) 复合物 I 生物合成、(2) 呼吸电子转运、(3) 呼吸电子转运通过化学渗透偶联合成 ATP 并通过解偶联蛋白产热、和 (4) 柠檬酸 TCA 循环,与基于 RNAseq 数据分析的富集通路完全重叠(图 5g)。
此外,他们利用公开的 RPPA 数据,分析了原发性肺癌和 BrM 中 3 种代表性呼吸链复合物相关蛋白的表达,包括 MTCO1、UQCRC2 和 COXIV。与原发性肺癌相比,BrM 病变中的 MTCO1、UQCRC2 和 COXIV 表达水平较高。此外,他们对 SYSUCC 和 WCH 队列中的 49 对原发性肺癌和 BrM 病变进行了 IHC 染色,以在蛋白质水平上独立验证 MTCO1、UQCRC2 和 COXIV 的表达(图 5h)。正如预期的那样,与配对的原发性肺肿瘤相比,他们观察到 BrM 病变中的 MTCO1、UQCRC2 和 COXIV 的 IHC 评分明显更高。
为了进一步阐明与原发性肺癌相比,BrM 中的线粒体代谢重塑,他们进行了基于 LC-MS/MS 的靶向代谢组学,以检测68 种能量代谢代谢物。与原发性肺癌相比,BrM 肿瘤中共有 10 种代谢物上调(图 5 i)。基于差异丰富代谢物的通路分析表明,三羧酸循环(TCA 循环)和丙酮酸代谢通路在 BrM 肿瘤中显著富集,而糖酵解/糖异生通路在原发性肺癌肿瘤中显著富集(图 5 j)。基于 RNAseq、蛋白质组学和靶向代谢组学数据的综合分析的结果表明,线粒体特异性代谢适应在肺癌的 BrM 中发生激活。
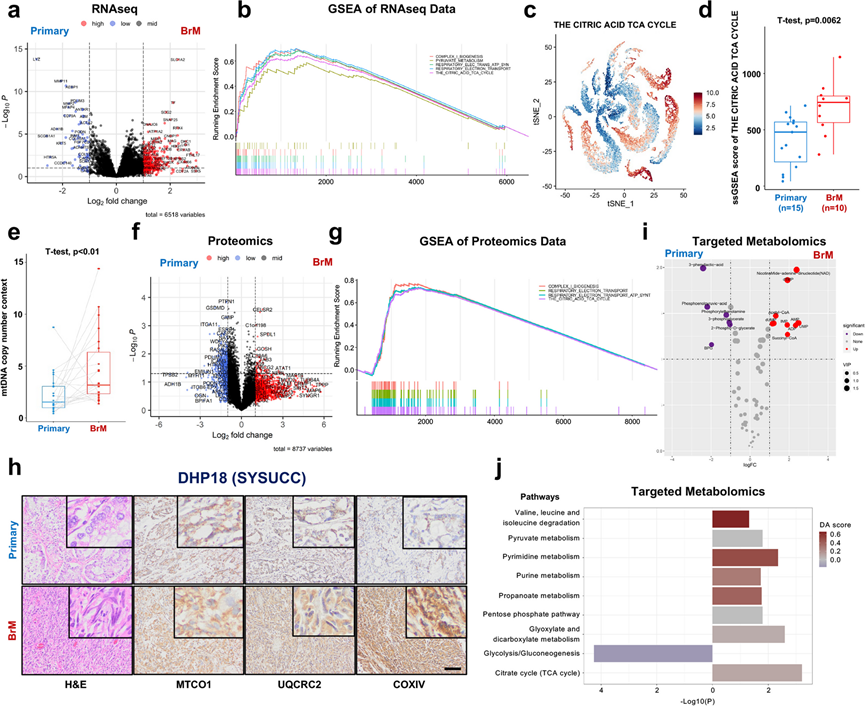
图5. 氧化磷酸化在肺癌脑转移(LC-BrM)中富集。
(a) 两组 56 名患者中原发性肺癌和 LC-BrM之间差异表达基因的火山图。(b) 5 条线粒体通路的基因集富集分析(GSEA)图。(c-d) 原发性肺癌和脑转移的单个上皮细胞中TCA 循环途径富集得分的tSNE 图和箱线图。(e) 配对原发性肺癌和脑转移病变中线粒体 DNA (mtDNA) 相对含量的箱线图。(f) 原发性肺癌和LC-BrM之间差异表达蛋白的火山图。(g) 4条线粒体通路的 GSEA 图。(h) 代表性患者 (DHP18) 的 MTCO1、UQCRC2 和 COXIV 的H &E 和免疫组织化学 (IHC) 染色。(i) 原发性肺癌和 LC-BrM之间差异表达代谢物的火山图。(j) 原发性肺癌和 LC-BrM 之间差异表达代谢物的通路分析箱线图。
06
LC-BrM 呈现免疫抑制微环境
他们还鉴定出在 BrM 肿瘤中显著下调的共 119 个 DEG(图 5a),基于 DEG 排序基因列表的 GSEA 鉴定出在 BrM 病变中显著下调的 126 条通路。他们还根据 NES 对筛选后的通路进行了排序,并重点关注排名前 20 的通路,BrM 肿瘤中显著降低的 5 条通路与免疫系统信号通路有关,包括(1)干扰素 αβ 信号通路,(2)白细胞介素 2 家族信号通路,(3)干扰素 γ 信号通路,(4)免疫调节相互作用淋巴系统,和(5)白细胞介素 4 和 13 信号通路(图 6a)。
为了定量研究原发性肺癌和 BrM 病变之间免疫浸润的差异,他们进一步使用四种算法对 RNA-seq 数据进行了计算分析,包括(1)使用表达数据估计恶性肿瘤组织中的基质和免疫细胞(ESTIMATE),(2)微环境细胞群计数器(MCP-counter),(3)通过估计 RNA 转录本的相对子集进行细胞类型识别的新版本(CIBERSORTx),和(4) xCell。MCP-counter 的结果显示,与原发性肺肿瘤相比,BrM 病变的 T 细胞、细胞毒性淋巴细胞、B 谱系、NK 细胞和成纤维细胞的评分明显较低(图 6b)。ESTIMATE 的结果显示,与原发性肺癌相比,BrM 病变的肿瘤纯度评分明显较高,但 ESTIMATE 评分、免疫评分和基质评分较低(图 6c)。xCell 的结果显示,与原发性肺癌病变相比,BrM 肿瘤中几种类型的 T 细胞评分,包括 CD4+ T 细胞和 CD8 + T 细胞,明显较低。CIBERSORTx 的结果显示,与原发性肺癌相比,BrM 病变的 gamma delta T 细胞评分明显较高,但单核细胞、活化 NK 细胞和 CD8 + T 细胞评分较低。
对 4 对新鲜冷冻原发性肺癌和 BrM 病变的蛋白质组学数据分析还发现 756 种差异表达蛋白在 BrM 病变中显著下调(图 5 f)。他们进一步根据差异表达蛋白的排序列表进行蛋白质富集分析,确定了 247 条显著下调的通路,根据 NES 对筛选后的通路进行排序,并重点关注排名前 20 的通路进行进一步分析。排名前20的通路中,有4条通路与免疫调节有关,包括(1)抗原呈递折叠组装,(2)流感感染,(3)干扰素αβ信号传导,和(4)PD-1信号传导(图 6d)。他们用 CD3、CD68、PD-1、PD-L1、Pan-CK 和 Ki-67 抗体对 SYSUCC 和 WCH 队列中的 48 对原发性和 BrM 肿瘤进行了染色。正如预期的那样,与原发性肺癌相比,BrM 肿瘤表现出明显较少的 CD3+免疫细胞浸润,但 CD68+肿瘤相关巨噬细胞则更多(图6e-g)。
对 RNA-seq、蛋白质组学和 mIF 染色数据的综合分析表明,BrM 病变确实具有免疫抑制微环境的特征。
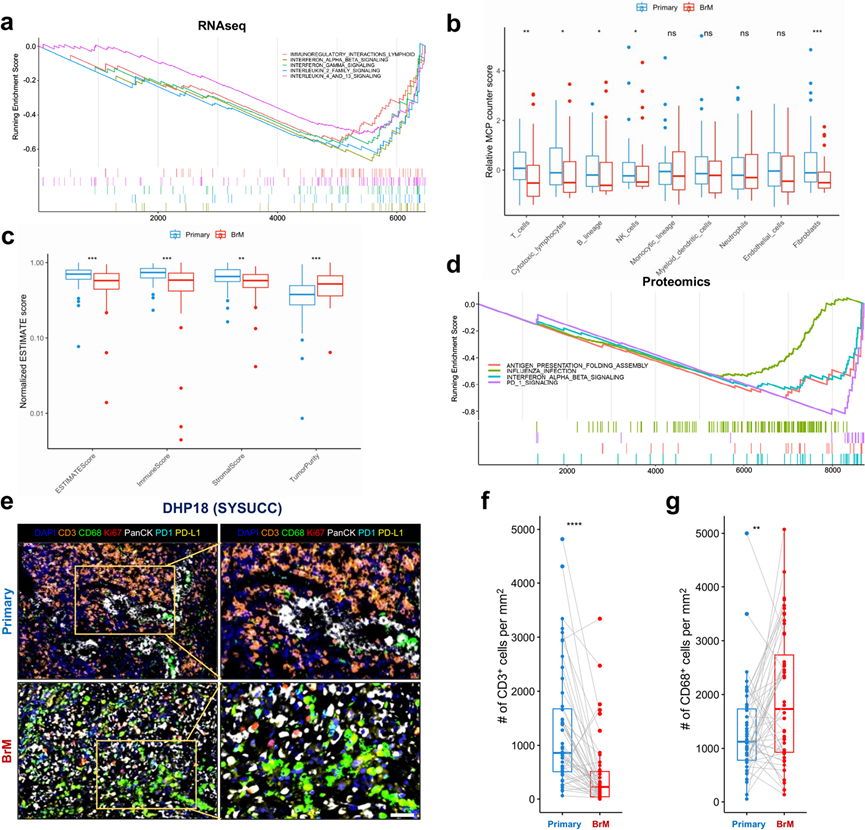
图6. 脑转移 (BrM) 病变呈现出免疫抑制性肿瘤微环境。
(a) 基于 RNA 测序数据的 5 种免疫相关信号通路的基因集富集分析 (GSEA) 图。(b-c) 箱线图表示配对原发性肺癌和 BrM 的标准化 MCP 计数器分数和 ESTIMATE 分数。(d) 基于蛋白质组学数据的 4 种免疫相关信号通路的蛋白质集富集分析。(e) 来自患者 DHP18 的配对原发性肺癌和 BrM 病变的代表性多重免疫荧光 (mIF) 染色。(f-g) 箱线图表示配对原发性肺癌和 BrM 病变中每平方毫米 CD3+和 CD68+ 细胞计数。
07
加米替尼通过抑制 BrM PDO 中的 OXPHOS 发挥其抗肿瘤活性
考虑到 BrM 肿瘤与成对的原发性肺癌相比表现出的转录改变,他们想知道是否存在原发性肺癌和 BrM 病变成对特有的转录亚型转换现象。之前已定义了四种肺癌肿瘤内在 (TI) 亚型,包括 TI1(肺去分化癌)、TI2(肺腺癌)、TI3(肺鳞状细胞癌)和 TI4(肺大细胞神经内分泌癌)。值得注意的是,50% (28/56) 的患者发生了从原发性肺癌到 BrM 的亚型转换(图 7a)。
接下来,他们分析了 Fukumura 和 SYSUCC 队列中每个患者的 5 条线粒体通路和 5 条免疫通路的 ssGSEA 评分。有趣的是,他们观察到免疫和 OXPHOS 信号通路之间存在负相关性,这表明有一部分 BrM 病变具有激活的线粒体生物合成和 OXPHOS,但免疫微环境受到抑制(图 7b)。在一个独立的 63 个 BrM 病变队列中也观察到了这一结果,该队列中有 mRNA 微阵列数据。他们根据 ssGSEA 评分将 LC-BrM 患者分为两个亚组,分别线粒体低/免疫高和线粒体高/免疫低,并进行 Kaplan-Meier 生存分析。事实上,与线粒体高/免疫低亚组的患者相比,线粒体低/免疫高亚组患者的生存结果有所改善(图 7c)。
由于 OXPHOS 在 LC-BrM 肿瘤中富集,他们想知道 OXPHOS 抑制是否会在 LC-BrM 中具有抗肿瘤活性。首先,他们测试了一种特定的 OXPHOS 抑制剂加米替尼在 LC-BrM-患者来源的类器官 (PDO) 中的治疗效果,加米替尼的 IC50范围为 0.14 至 2.65 μM,中位 IC 50为 1.06 μM。此外,对于相同的 LC-BrM PDO,加米替尼的IC 50明显低于替莫唑胺 (TMZ) 的 IC50,表明 LC-BrM PDO 对加米替尼的敏感性高于 TMZ。他们进一步使用用加米替尼处理 4 天的三种代表性 LC-BrM PDO进行活细胞和死细胞染色。结果表明,加米替尼诱导 BrM PDO细胞死亡(图 7 d-f)。为了研究加米替尼是否能抑制 BrM PDO中的 OXPHOS,他们对用 DMSO 或加米替尼处理的 PDO进行了 RT-qPCR。事实上,在用加米替尼处理的 BrM PDO 中, 3 个 OXPHOS 代表基因(包括ATP5B、COX7B和SDHB)的表达水平显著降低(图7g)。毫不奇怪,靶向代谢组学数据分析进一步证实,在用加米替尼处理的 BrM PDO 中,与 OXPHOS 相关的途径(如 TCA 循环和丙酮酸代谢)受到显著抑制(图 7h)。总之,这些结果表明,加米替尼可以通过抑制 BrM PDO 中的 OXPHOS 表现出抗肿瘤活性。
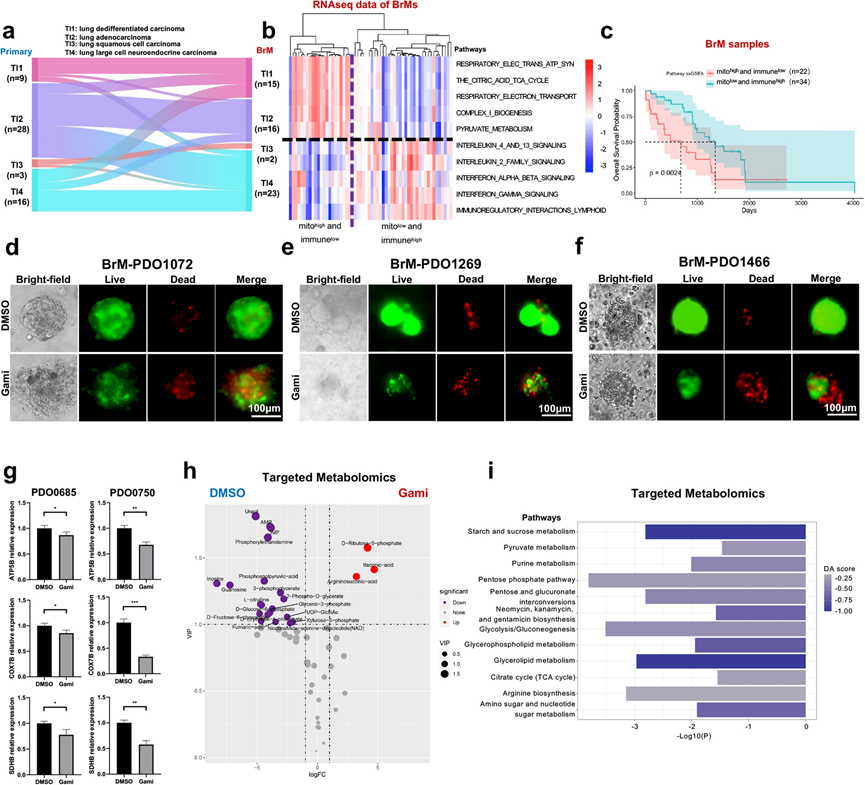
图7. 加米替尼通过抑制肺癌脑转移(LC-BrM)患者来源的类器官(PDO)中的OXPHOS发挥其抗肿瘤活性。
(a) 桑基图表明从配对的原发性肺癌到脑转移病变的转录亚型转换。(b) 热图显示使用 RNA -seq数据显示 LC-BrM 病变中 5 种线粒体通路和 5 种免疫通路的富集。(c) 根据线粒体通路和免疫通路的ssGSEA得分将 LC-BrM 病变患者分层为低亚组和高亚组,得出的 Kaplan-Meier 生存图。(d-f) 明视野和免疫荧光染色的显微镜图像。(g) OXPHOS 基因的相对 mRNA 表达。(h) 差异代谢物分析的火山图。(i) LC-BrM 差异表达代谢物的通路分析箱线图。
+ + + + + + + + + + +
结 论
本项研究发现 LC-BrM 表现出显著更大的肿瘤内异质性,原发性肺癌和 LC-BrM 病变几乎总是共有一组基因突变,包括TTN、TP53、MUC16、LRP1B、RYR2和EGFR。此外,原发性肺癌和 LC-BrM 病变之间体细胞拷贝数变异的全基因组景观相似。尽管如此,LC-BrM 中的几个局部扩增区域显著富集,包括 5p15.33 和 20q13.33。有趣的是,转录组学、蛋白质组学和代谢组学数据的综合分析显示,线粒体特异性代谢发生激活,但 LC-BrM 中的肿瘤免疫微环境受到抑制。在治疗方面,用加米替尼靶向患者衍生的 LC-BrMs 类器官中的氧化磷酸化可诱导细胞凋亡并抑制细胞增殖。线粒体代谢基因表达较高但 LC-BrM 病变中免疫基因表达较低的患者往往生存结果较差。
+ + + + +



 English
English


