文献解读|Cell(45.5):健康和动脉粥样硬化条件下跨器官代谢物的产生和消耗
✦ +
+
论文ID
原名:Cross-organ metabolite production and consumption in healthy and atherogenic conditions
译名:健康和动脉粥样硬化条件下跨器官代谢物的产生和消耗
期刊:Cell
影响因子:45.5
发表时间:2025.05.20
DOI号:10.1016/j.cell.2025.05.001.
背 景
哺乳动物的身体就像一个复杂的网络,多个器官相互连接,协调循环代谢物的生成和消耗。这些血液代谢物是能量、结构单元和信号分子的关键载体。科里循环(Cori cycle)体现了器官间代谢相互作用的根本重要性,在这个循环中,肝脏向肌肉供应葡萄糖,葡萄糖分解后以乳酸的形式返回肝脏进行葡萄糖再生。此后,人们发现了越来越多的循环代谢物及其在器官间协调的生成和消耗。葡萄糖和胆固醇等循环代谢物的稳态失衡会导致心脏代谢疾病 (CMD),影响多个器官的功能。哺乳动物的器官持续不断地产生和消耗循环代谢物,以维持其健康和生存。然而,这一基本过程的概况及其受饮食和疾病干扰的情况尚不清楚。
实验设计
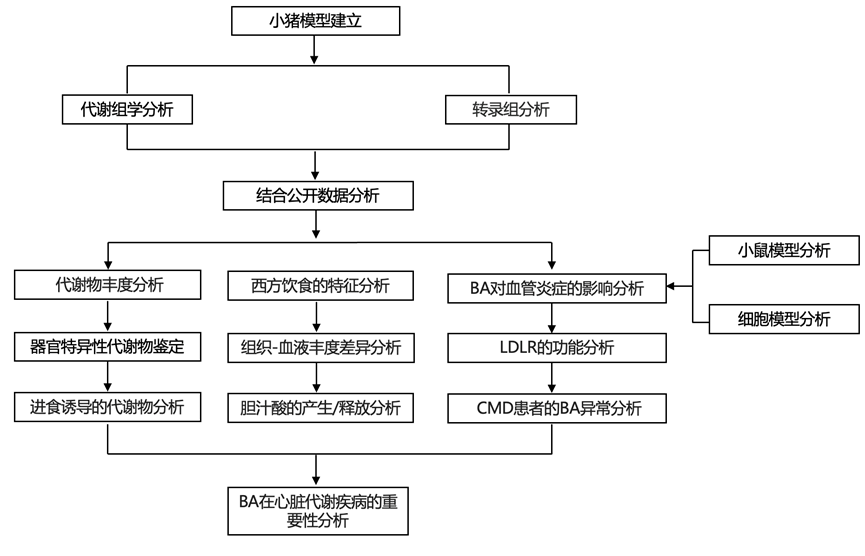
结 果
01
禁食/进食对器官代谢物产生和消耗的影响
本研究在各种病理生理条件下的尤卡坦小型猪中进行了动静脉(AV)代谢组学分析(图 1 A)。研究团队将小型猪(约 50 kg)禁食过夜,并于第二天在麻醉下采集全身动脉血和器官特异性静脉血以评估基础禁食状态(图 1 B)。接下来,通过胃管提供流质饮食以模拟食物摄入,并在喂食后 30、60 和 120 分钟再次进行连续采血。他们选择了以下 10 个单独的器官或身体部位进行静脉血采样:头部(大脑)、耳朵(皮肤)、肺、心脏、肾脏、脾脏、肠(小肠和大肠合并)、结肠、肝脏和腿(肌肉)。在每个区室中,使用液相色谱-串联质谱法(LC-MS/MS)确定代谢物的特征和丰度。然后,他们分析了各器官中各代谢物的浓度梯度(图 1 C)。正如预期,饲喂可提高门静脉和全身血液中膳食来源营养物质的水平,包括维生素、蔗糖、氨基酸和脂质。
本研究追踪了 1305 种循环代谢物,这些代谢物经化学标准确认或由 MS/MS 图谱预测,涉及 10 个器官。在这些代谢物中,有 217 种在给定器官/或时间点表现出统计学上显著的变化,如代谢物摄取或释放模式热图所示,其中 x 轴表示器官和时间点,y 轴表示聚类分析后的代谢物(图 1 D)。例如,在热图的顶部,BA(左侧以粉红色标记)显示出肠道释放和肝脏摄取(图 1 D),这与已知的胆汁酸 (BA)肠肝循环一致,一些代谢物表现出恒定的器官特异性生产或消耗,无论进食与否(进食依赖性),例如肠道释放丙氨酸,而其他代谢物在进食后以不同的方式运输(进食依赖性),例如腿部对葡萄糖的吸收(图 1 E)。他们发现 540 个与进食无关的代谢物,包括肠道释放氨基酸以及肾脏吸收氨基酸和微生物代谢物。大多数代谢物在腹部内脏器官中富集(图 1 F)。他们还发现 958 个与进食相关的代谢物,其中肾脏和皮肤的代谢物最多(图 1 G)。对进食依赖性事件和与进食无关事件进行比较后发现,皮肤对进食最敏感(图 1 H)。例如,进食会诱导皮肤吸收循环葡萄糖、柠檬酸盐和牛磺酸(图 1 I)。这些代谢物可以作为餐后皮肤重塑的燃料或构建模块(例如核苷酸和脂肪酸)。相反,进食后,皮肤对循环脂肪酸的消耗减少,反映出能量从脂肪酸向葡萄糖氧化的转变(图1 J)。这些数据集阐明了标准饲料喂养猪的器官特异性和进食诱导代谢物的产生和消耗。
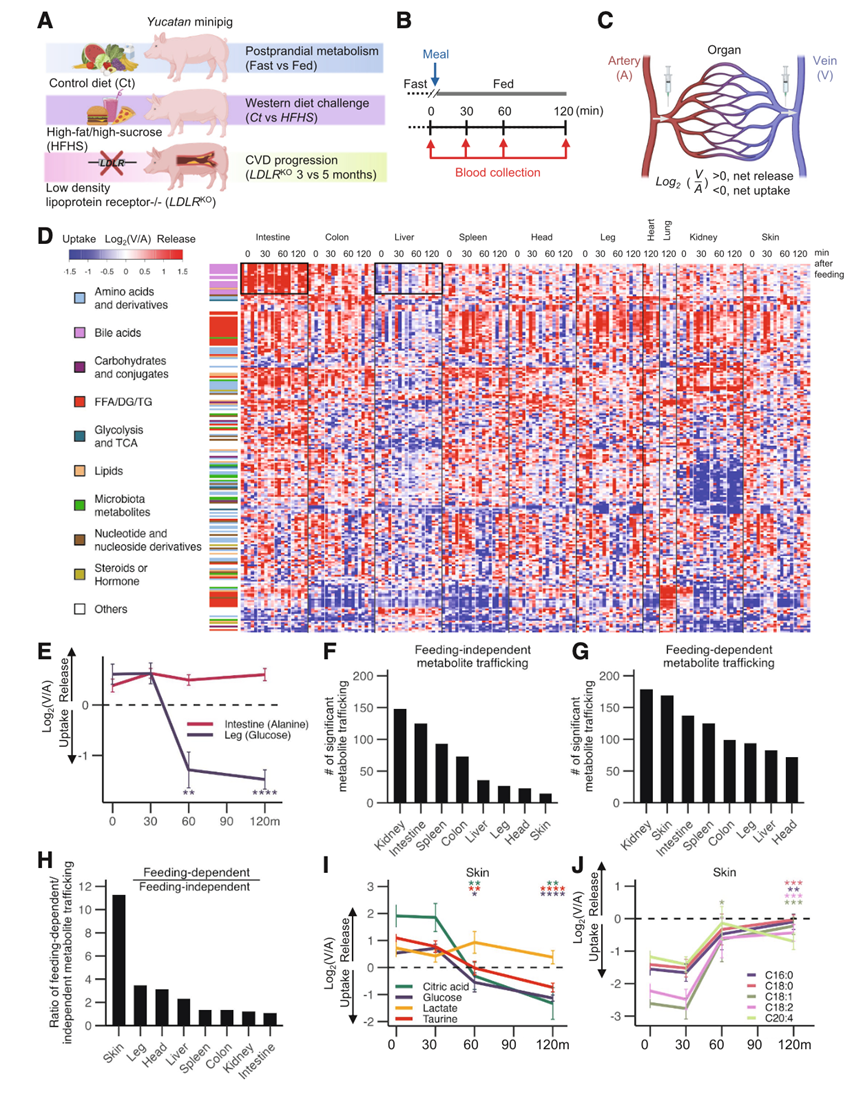
图1. 禁食和进食对器官特异性代谢物运输的影响。
(A)实验示意图。(B) 提供流质饮食之前和之后 AV 血液采样的时间过程示意图。(C) AV 梯度测量示意图,用于确定器官特异性净吸收或代谢物的释放。(D) 热图显示,在Ct饮食喂养的猪中,217种循环、分类代谢物在至少一个器官特异性时间点表现出显著的运输。(E)依赖和不依赖进食的器官特异性代谢物运输示例。(F-G) 跨器官代谢物运输数量,非摄食依赖性和摄食依赖性。(H) 依赖喂养和不依赖喂养的代谢物运输事件的比例。(I-J) 进食引起的变化示例,显示皮肤对代谢物的吸收增加或减少。
02
西方饮食对器官代谢产物和消耗的影响
鉴于西方饮食与 CMD 的因果关系众所周知,他们接下来研究了富含高脂肪/高蔗糖 (HFHS) 的饮食如何影响器官代谢物的产生和消耗(图 2 A)。先前的研究给猪喂食不同时间(从第 1 天到第 60 天)的 HFHS 饮食,结果表明 2周是诱发动脉、门静脉和肝静脉血中代谢物水平异常以及总胆固醇和低密度脂蛋白 (LDL) 胆固醇增加的最短时间。17、18、28之后,长达60天均未观察到显著变化,表明在晚期疾病表现之前建立了代谢假稳态。与这些结果一致,与饲喂对照 (Ct) 饮食的猪相比,饲喂 2 周 HFHS 的猪在饲喂后动脉血代谢组学特征发生改变,例如脂质、核苷酸和碱性磷酸酶升高。2 周 HFHS 饲喂还显著增加了体重(图 2 B)、胰岛素水平(图 2 C)和胰岛素抵抗稳态模型评估 (HOMA-IR)(图 2 D),反映了胰岛素抵抗。空腹血糖水平、呼吸频率或体温不受影响。
对 HFHS 饮食喂养猪的 AV 梯度测量表明,在禁食和进食期间,器官产生和消耗了 1368 种代谢物。数据表明,几乎所有器官的代谢物产生和消耗都普遍减弱,如与 Ct 饮食喂养猪的热图相比(图1 D),HFHS 饮食喂养猪的热图颜色较浅(图2 E)。为了系统地分析 HFHS 饮食对进食引起的代谢物产生和消耗的影响,他们分析了禁食和进食状态下 AV 比率差异的绝对值(|ΔLog 2 V/A|)。例如,在 Ct 饮食喂养的猪中,腿部显示出|ΔLog 2 V/A|为 1.9∼2.1,反映了喂食引起的肌肉葡萄糖吸收(图 2 F)。相比之下,HFHS 饮食喂养的猪没有产生显著变化(图 2 F),反映餐后葡萄糖吸收受损,可能是由于胰岛素抵抗(图 2 D)。在 HFHS 饮食喂养的猪中,皮肤和头部(反映大脑)显示出类似的葡萄糖吸收缺陷,而肝脏在喂食后表现出糖异生抑制受损。对所有代谢物和器官的类似分析表明,相当一部分(∼78%)的代谢物显示HFHS 饮食喂养的猪的|ΔLog 2 V/A| < 1.0,而 Ct 饮食喂养的猪为 29%(图 2G-H)。因此,HFHS 饮食喂养总体上会抑制器官代谢物的产生和消耗。
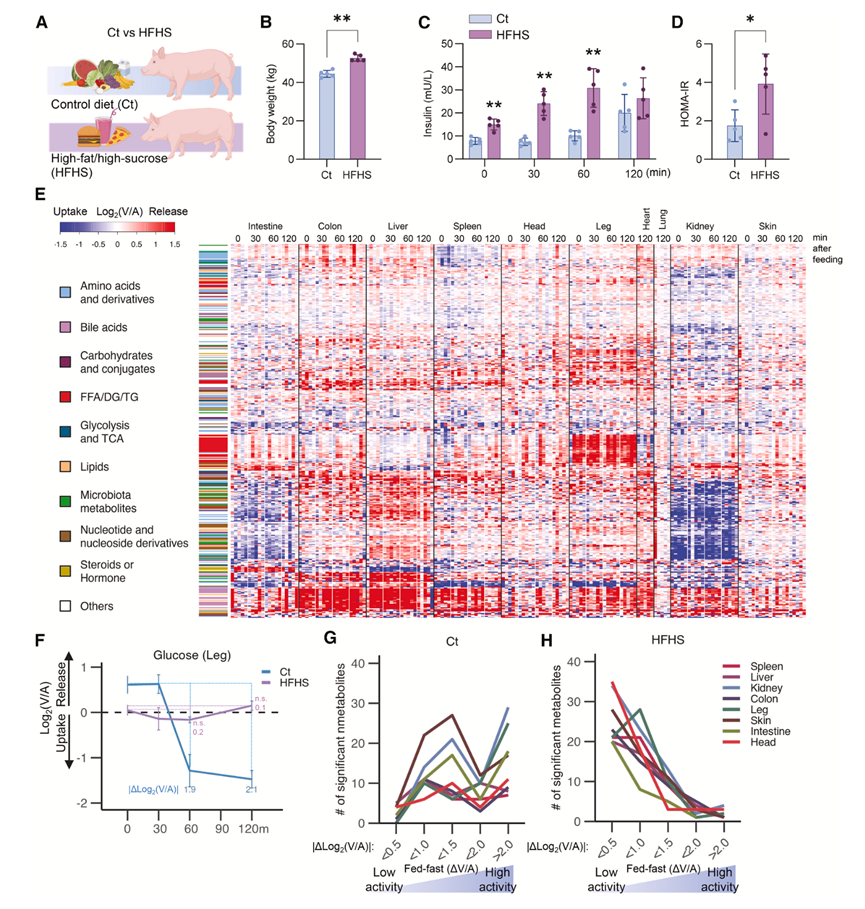
图2. 西方饮食喂养对器官特异性代谢物运输的影响。
(A) 饲喂 Ct 或 HFHS 饮食的猪的 AV 研究示意图。(B-D) HFHS饮食增加体重、动脉血胰岛素以及通过空腹血糖和胰岛素计算出的HOMA-IR 。(E) 热图显示,在HFHS饮食喂养的猪中,403种循环、分类代谢物在至少一个器官特异性时间点表现出显著的变化。(F) 比较Ct和HFHS饮食喂养猪腿部葡萄糖运输情况。(G-H) Ct 组和 HFHS 组饲喂的猪,60 分钟时相对于 0 分钟时表现出显著变化的代谢物数量。
03
西方饮食对代谢物产生部位的影响
因为本研究的 AV 梯度测量涵盖了几乎所有主要器官,所以他们试图利用这些数据来绘制循环代谢物的主要来源和目标器官。因此,他们对每种代谢物进行了统计分析,以确定显著释放或吸收该代谢物的器官。对于苹果酸(三羧酸 [TCA] 循环中间体),腿、肠和脾脏会释放它,而肾脏会吸收它(图 3A)。这种释放-吸收关系可以用所示的弦图中的箭头来描述(图3B)。对所有代谢物和器官的平行分析表明 HFHS 饮食对器官之间餐后代谢物运输的整体影响(图3C-D)。该分析还揭示了一些 HFHS 饮食转换代谢物产生器官和消耗器官的情况。例如,在 Ct 饮食喂养的猪中,肠道主要产生瓜氨酸(图 3E)。然而,在 HFHS 饮食喂养的猪中,肝脏产生了瓜氨酸(图 3 F)。为了验证这一发现,他们采用 [U- 13C ]-谷氨酰胺示踪剂追踪饲喂 Ct 和 HFHS 饮食的小鼠(图 3 H)的瓜氨酸合成(图3 G)。与 HFHS 喂养的猪一样,饲喂相同饮食 2 周的小鼠表现出体重增加和胰岛素抵抗。它们还将瓜氨酸合成从肠道稍微转移到肝脏(图 3 I -J)。因此,HFHS 饮食会影响代谢物产生和消耗的器官部位。
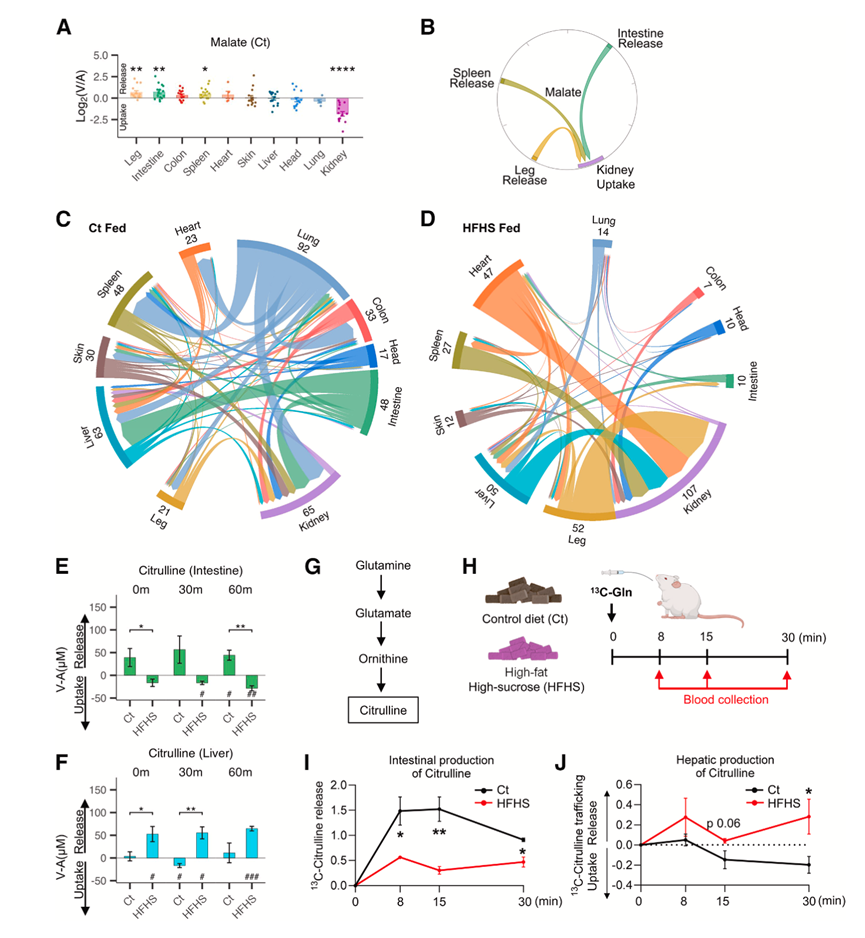
图3. 西方饮食喂养对器官间代谢物运动的影响。
(A-B) 在所有时间点,Ct 饮食喂养猪的腿部、肠道和脾脏释放的苹果酸以及肾脏的吸收情况,绘制为弦图,其中钝端表示源器官(腿部、肠道和脾脏),箭头端表示汇器官(肾脏)。颜色表示每个颜色编码的器官。(C-D) Chord 图显示 Ct 组或 HFHS 组猪在进食状态(120 分钟)下器官间代谢物的运动情况。(E-F) Ct 和 HFHS 饮食喂养的猪的肠道和肝脏中的瓜氨酸运输比较。(G-H) 谷氨酰胺合成瓜氨酸的示意图和喂食 Ct 和 HFHS 饮食的小鼠体内[U-13C]-谷氨酰胺 (Gln) 的时间过程追踪。(I-J) 肠道(门静脉/动脉)和肝脏(下腔静脉/门静脉)中13C -瓜氨酸的产生。
04
代谢物产生和消耗的调节
接下来,他们研究了 HFHS 饮食如何影响器官代谢物产生和消耗的机制。代谢物运动可以由浓度梯度驱动(即被动运输)或主动促进浓度梯度(即协助运输)(图 4 A)。为了首先探索被动运输机制,他们使用 LC-MS/MS 定量了组织和血液中每种代谢物的丰度,并对组织-血液丰度差异与释放/摄取进行了相关性分析(图 4 B)。在 Ct 饮食喂养的猪中,鉴定出 229 种代谢物,它们在组织-血液浓度梯度和运输之间表现出显著相关性,包括 2-辛烯酸(图 4 C)和几种有机酸,表明它们的运动受浓度驱动。用不同浓度的这些代谢物处理的培养细胞显示细胞摄取增加,与其在培养基中的浓度成比例。在 HFHS 饮食喂养的猪中,他们观察到许多代谢物的浓度梯度和运输之间的关系发生紊乱,包括 2-辛烯酸(图 4 C)、氨基酸、脂肪酸、脂质和核苷酸(图 4 D-E)。Ct 与 HFHS 饮食喂养的猪的器官代谢物转运蛋白的转录组分析表明,HFHS 喂养的猪器官中代谢物转运蛋白水平的改变可能至少在一定程度上导致了这种浓度驱动的代谢物运动的减弱。
接下来,他们研究了主动调节机制。首先分析了胰岛素诱导的组织葡萄糖摄取作为阳性对照(图 4F)。在 Ct 饮食喂养的猪中,发现血液胰岛素水平与腿部或皮肤的葡萄糖摄取之间存在很强的相关性(图 4G-H),胰岛素水平越高,组织葡萄糖摄取越多。然而,在 HFHS 饮食喂养的猪中,这种相关性消失(图 4G-H),反映了胰岛素抵抗(图 2D)。对所有代谢物和器官进行系统分析,预测了代谢物的运输可能受胰岛素调控,并由 HFHS 饮食破坏(图 4I)。该分析表明肝脏是对胰岛素最敏感的器官,其次是肾脏和皮肤。一些代谢物仅在 HFHS 饮食喂养的猪中表现出与胰岛素的相关性,这可能反映了它们的运输受血液胰岛素升高的驱动(图 2C)。除了胰岛素,他们还分析了另外11种激素,包括胃肠道激素(生长素释放肽、GLP-1和GLP-2、PYY和GIP)、脂肪因子(抵抗素和瘦素)以及胰腺衍生激素(胰淀素、C肽、PP和胰高血糖素)(图4 J)。与这些激素运输相关的代谢物总结于表S3中,包括先前提出的异亮氨酸运输与C肽之间的负相关性。
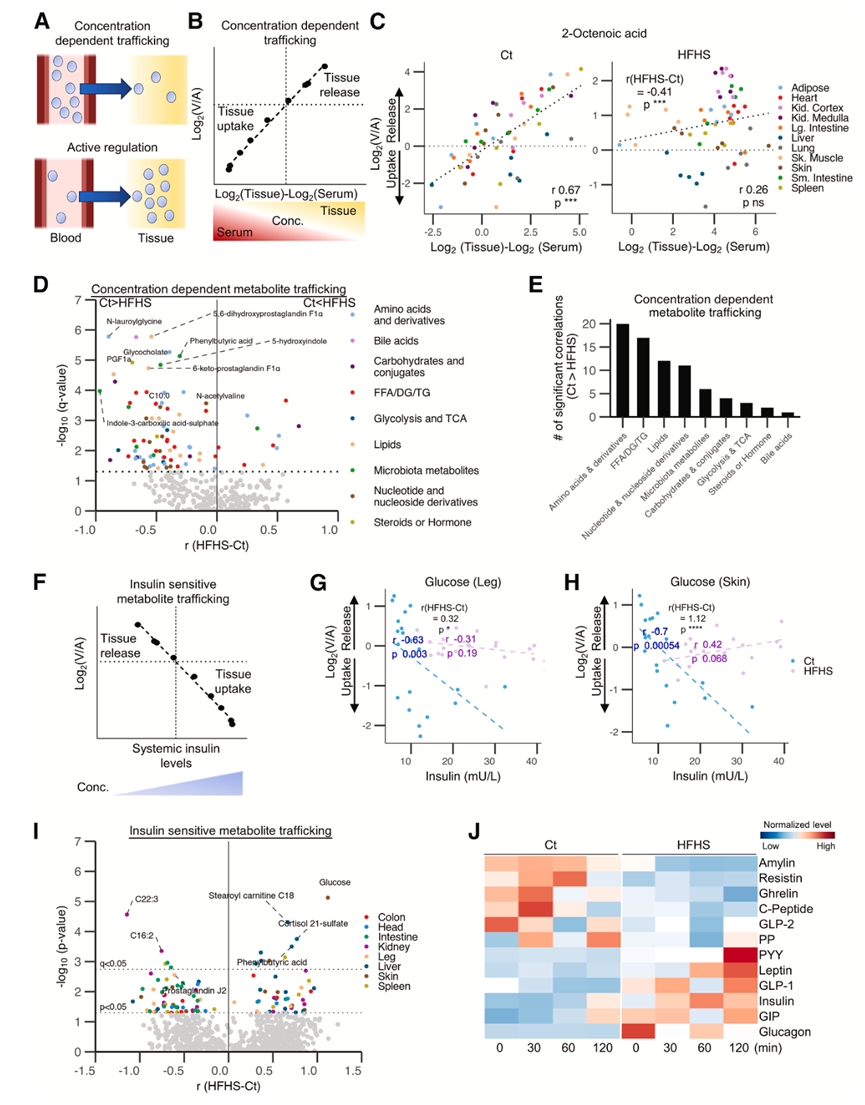
图4. 通过浓度梯度或激素调节的代谢物运输。
(A) 由浓度梯度或主动调节驱动的代谢物运输示意图。(B) 代谢物组织-血液浓度梯度(x轴)与运输(y轴)相关性分析示意图。(C) Ct(左)和 HFHS(右)饮食喂养猪中 2-辛烯酸的组织-血液浓度梯度与跨器官运输之间的相关性。(D) 火山图突出显示了在线性回归拟合后饮食之间的相关系数 r (HFHS-Ct) 存在显著差异的代谢物。(E) 不同饮食之间相关系数存在显著差异的不同类别代谢物的数量。(F) 血液胰岛素水平(x轴)和代谢物运输(y轴)之间的相关性分析示意图。(G-H) Ct 和 HFHS 饮食喂养猪的血液胰岛素水平与腿部或皮葡萄糖摄取量之间的相关性。(I) 火山图突出显示了经线性回归拟合后,不同饮食间相关系数r(HFHS-Ct)存在显著差异的代谢物。(J) 热图显示Ct和HFHS饮食喂养猪的动脉血中相应内分泌激素的标准化水平。
05
HFHS饮食下肝外器官的BA释放
虽然 HFHS 饮食通常会抑制器官代谢物的产生和消耗(图 2),但酰基肉碱和各种胆固醇衍生的代谢物(如 BA)在 HFHS 饮食下表现出器官产生增加。例如,在 Ct 饮食喂养的猪中,肠道将 BA 释放到门静脉循环中(图 5 A),反映了 BA 的肠肝循环:从肝脏通过胆管释放到肠腔,由回肠重吸收,并通过门静脉循环送回肝脏。出乎意料的是,在 HFHS 喂养的猪中,许多器官将 BA 释放到全身循环中(图 5 B),包括两种最丰富的主要 BA,即胆酸(HCA)和鹅去氧胆酸(CDCA)。这种异常可能导致了HFHS饮食喂养猪全身血液BA水平升高(图5 C)。基于VA浓度梯度数据和已发表的器官血流数据进行的定量分析表明,肝脏和结肠主要释放BA,而其他器官的贡献也很大,尤其是在喂食后(图5 D)。
接下来,他们研究了多个器官释放BA的机制。HFHS饮食可诱发肝损伤、肠道菌群失调和渗漏,导致肝脏和肠道物质释放到血液中。因此,他们推测HFHS饮食会诱导肝脏和肠道BA渗漏到体循环中,导致BA在其他器官中沉积并随后排出。然而,他们并未观察到组织内BA水平与其释放之间的密切关系。鉴于哺乳动物的脑、肺和转移性癌细胞以及原始脊椎动物的肠道都可能合成BA,他们推测BA是由器官合成的。泛器官的转录组分析(RNA-seq)分析显示,与 Ct 饮食喂养的猪相比,HFHS 饮食喂养的猪的器官中胆酸合成酶和转运蛋白的表达增加(图5 E),包括关键的启动酶(CYP7A1 和CYP27A1)和胆酸合成后期的过氧化物酶体酶(AMACR、HSD17B4、SCP2和ACOT8),已知它们在肝外组织中基础表达。
然而,基因表达和代谢物合成并不总是定量相关的。因此,为了直接分析器官的BA合成,他们收集了饲喂任一饮食的猪的新鲜组织,并将其与13C-胆固醇(BA的前体)一起孵育。只有Ct饮食饲喂猪的肝脏释放标记的HCA,但HFHS饲喂猪的几种组织释放了标记的HCA(图5F)。他们进一步研究了HFHS饲喂条件如何促进BA合成。考虑到循环成纤维细胞生长因子19(FGF19)抑制肝脏中的BA合成,他们比较了饲喂任一饮食的猪的FGF19水平,发现HFHS饲喂猪的循环FGF19减少了3倍(图5G)。鉴于FGF19在全身循环中存在,且其受体广泛表达,循环中FGF19水平降低可能促进多个器官中胆碱的合成。鉴于胆固醇在体内无法降解,胆固醇合成胆碱的增加可能是一种机制,可以缓解HFHS饮食引起的循环胆固醇升高。
长期以来,有报道称患有代谢紊乱和心血管疾病的患者的循环 BA 水平会异常升高,血液 BA 水平较高与更严重的脂肪性肝炎和冠状动脉狭窄相关。因此,他们研究了系统性升高的 BA 的潜在致病作用。他们推测具有细胞毒性作用的 BA会对血管内皮细胞 (EC) 产生有害影响,而血管内皮细胞是直接且持续暴露于血液 BA 的细胞类型。为了验证这一假设,他们使用了 3D 培养的 EC 和成纤维细胞(图 5 H)。与载体对照相比,使用微流体系统灌注 CDCA 或 HCA 会增加 EC 中的活性氧 (ROS) 水平(图 5 I)并增强单核细胞在 EC 上的附着(图 5 J),表明 BA 会引发 EC 中的氧化应激和炎症。他们还评估了循环中BA升高对体内血管炎症的影响。他们以稳定的速率给小鼠输注BA(HCA和CDCA的1:1混合物),持续24小时(图5K),使其循环中BA水平达到与HFHS饮食喂养的猪相似的水平变化。BA输注使心脏中EC炎症标志物Vcam-1和Icam-1的基因和蛋白质表达增加,其程度与阳性对照脂多糖(LPS)相似(图5L-M)。因此,全身血液中BA升高可能引发血管炎症,导致动脉粥样硬化。
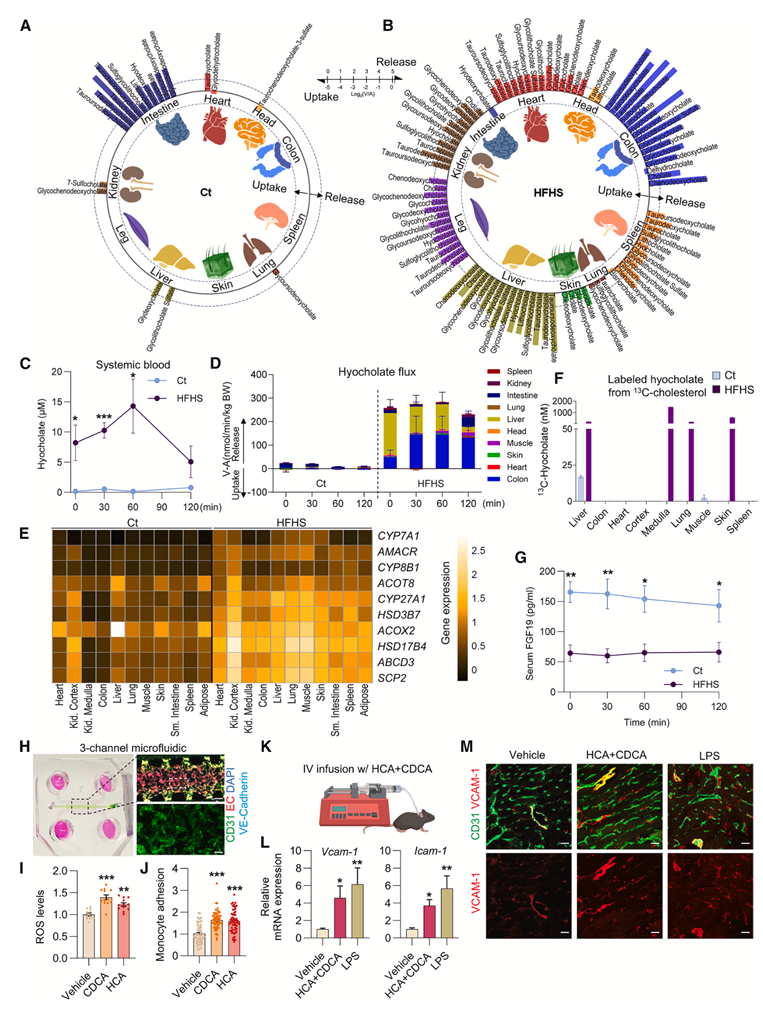
图5. HFHS饮食导致多个器官胆汁酸释放异常。
(A-B) 圆形图显示,Ct 饮食喂养猪的肠道和 HFHS 饮食喂养猪的多个器官均显著释放 BA(餐后 60 分钟)。(C) Ct组和HFHS组猪血液HCA水平比较。(D) Ct 和 HFHS 饮食喂养猪的器官 HCA 流出量比较,通过 VA 浓度梯度和局部血流计算。(E) 热图显示了代表性胆碱合成酶和转运蛋白的 RNA-seq的基因分析。(F) 从Ct和HFHS饮食喂养的猪体内新鲜分离的离体培养器官,在含有13C-胆固醇的培养基中孵育24小时后,产生的标记HCA的培养基浓度。(G) Ct组和HFHS组猪动脉血FGF19水平比较。(H) 用CD31(绿色)、VE-钙粘蛋白(青色)和DAPI(蓝色)染色的RFP标记EC的3D培养。(I-J) ROS 水平。(K) 使用自由移动的颈静脉导管小鼠的 BA 静脉(IV)输注装置示意图。(L) Vcam-1和Icam-1基因的表达情况。(M) 小鼠心脏中输注载体、BA 或 LPS 后 CD31(绿色)和 VCAM-1(红色)的代表性免疫荧光染色图像。
06
LDLR缺乏的猪和人类CMD患者的肝外BA合成
人们推测肝脏是 CMD 患者循环中 BA 升高的来源器官,但未考虑其他器官的作用可能性。为了测试 CMD 患者的 BA 是否源自多个器官,他们使用了 LDLR 缺陷(LDLR KO) 猪,给它们喂食致动脉粥样硬化饮食(HFHS 加 1% 胆固醇) 3 和 5 个月(图 6A)。这些LDLR KO猪逐渐出现高胆固醇血症、高甘油三酯血症、胰岛素抵抗、肝脏脂肪变性和冠状动脉粥样硬化病变,与人类 CMD 患者非常相似。与 HFHS 饮食喂养的野生型 (WT) 猪相似,LDLR KO猪的各器官 AV 测量显示多个器官均有 BA 分泌(图 6B-C)。与 HFHS 饮食喂养的猪的器官总 HCA 流出量相比(图 5 D),这些LDLR KO猪的器官总 HCA 释放量明显更高(图 6 D)。它们的全身血液 BA 也表现出更急剧的升高(图 6 E)。与 HFHS 饮食喂养的 WT 猪相比,LDLR KO猪的循环 FGF19 水平也较低。在研究的所有猪中,循环 BA 水平与 FGF19 水平呈负相关(图 6 E),进一步表明循环 FGF19 降低可能导致血液 BA 水平升高。因此,他们分析了公开的转录组学数据集,并评估了对照组和CMD患者组织样本中BA酶的表达情况。与对照组相比,CMD患者多种组织中BA合成酶的表达显著升高(图6 F)。总之,BA合成可能发生在CMD患者的肝外器官中,这种异常可能促进病情进展。
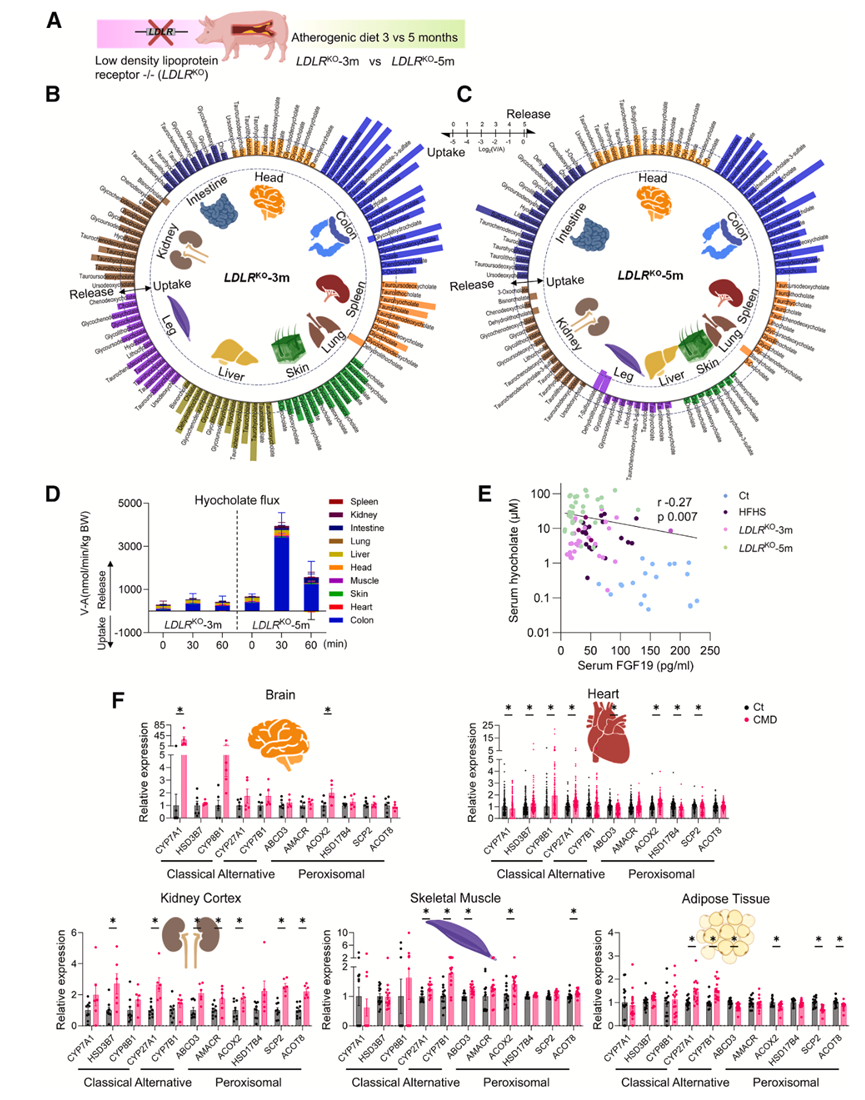
图6. LDLR缺陷猪和人类CMD患者肝外器官BA合成。
(A) 饲喂致动脉粥样硬化饮食 3 或 5 个月的LDLRKO猪的示意图。(B-C) 圆形图显示LDLRKO -3 个月和LDLRKO -5 个月猪的多个器官显著释放 BA(餐后 30 分钟)。(D) LDLR KO -3个月和LDLR KO-5个月猪器官HCA流出量。(E) 动脉血 FGF19 和 HCA 水平之间的相关性。(F) 已发表的11种胆碱合成酶及其相关基因在对照组和CMD患者中的组织基因表达情况。
+ + + + + + + + + + +
结 论
本研究利用动静脉代谢组学和转录组学分析,在猪的多种病理生理条件下,构建了10个跨器官代谢物生成和消耗的图谱,这些图谱涵盖了禁食/进食、西方饮食以及低密度脂蛋白受体缺陷诱发的心血管疾病进展,发现了许多器官存在进食依赖性和不依赖性的代谢物生成和消耗的情况,并提出了西方饮食通过改变代谢物浓度梯度和激素来干扰这些代谢物的机制。西方饮食和LDLR缺陷都会触发肝外器官释放BA,这可能导致循环BA水平异常升高,并由此引发血管炎症和动脉粥样硬化。这些数据揭示了病理生理条件下复杂的器官间代谢相互作用,为饮食影响和心脏代谢疾病提供了生化见解。
+ + + + +



 English
English


