文献解读|Nat Commun(15.7):SCFA 生物疗法通过重塑粘膜稳态和代谢组延缓人源化无菌小鼠的糖尿病
✦ +
+
论文ID
原名:SCFA biotherapy delays diabetes in humanized gnotobiotic mice by remodeling mucosal homeostasis and metabolome
译名:SCFA 生物疗法通过重塑粘膜稳态和代谢组延缓人源化无菌小鼠的糖尿病
期刊:Nature Communications
影响因子:15.7
发表时间:2025.03.25
DOI号:10.1038/s41467-025-58319-y
背 景
肠道菌群是肠道稳态的关键驱动因素,也是免疫系统发育的关键调节因素。肠道菌群失调是导致 1 型糖尿病 (T1D) 等自身免疫性疾病的一个可能因素。T1D 是由 T 细胞驱动的自身免疫攻击胰腺胰岛中产生胰岛素的 β 细胞引起的,通常在儿童期诊断出来。多项研究报告称,在 T1D 发病之前,肠道菌群组成发生了变化,拟杆菌属物种增加,厚壁菌门减少,β 多样性降低。虽然观察到的分类学变化在研究之间并不总是一致的,但在不同的疾病阶段,常见的功能缺陷与 T1D 有关。在小鼠、新诊断儿童以及长期患有T1D的成人中,短链脂肪酸(SCFA)以及产生乙酸盐、丙酸盐和丁酸盐的细菌减少与胰岛自身免疫反应相关。因此,微生物SCFA产生的功能缺陷,而非特定物种的缺陷,可能与胰岛自身免疫和T1D的进展有关。
实验设计
结 果
01
短链脂肪酸 (SCFA) 生物疗法后人类粪便蛋白质组重塑
在 非肥胖糖尿病 (NOD)小鼠中,施用可产生乙酸盐和丁酸盐的生物疗法可通过增加紧密连接和IL22基因表达来改善肠道稳态。研究团队假设增加短链脂肪酸(SCFA)输送也会影响人类的粘膜免疫和肠道屏障功能。为了研究这一点,他们使用了在为期 6 周的 SCFA 生物疗法干预期间从患有长期 T1D 的成年人身上采集的粪便样本,研究访问时间为第 0 周(基线)、第 6 周(干预结束)和第 12 周(随访)。该研究是一项单臂先导试验,招募了 21 名参与者,其中 18 名完成了试验,并使用了本研究中使用的粪便和血浆样本(图 1A)。
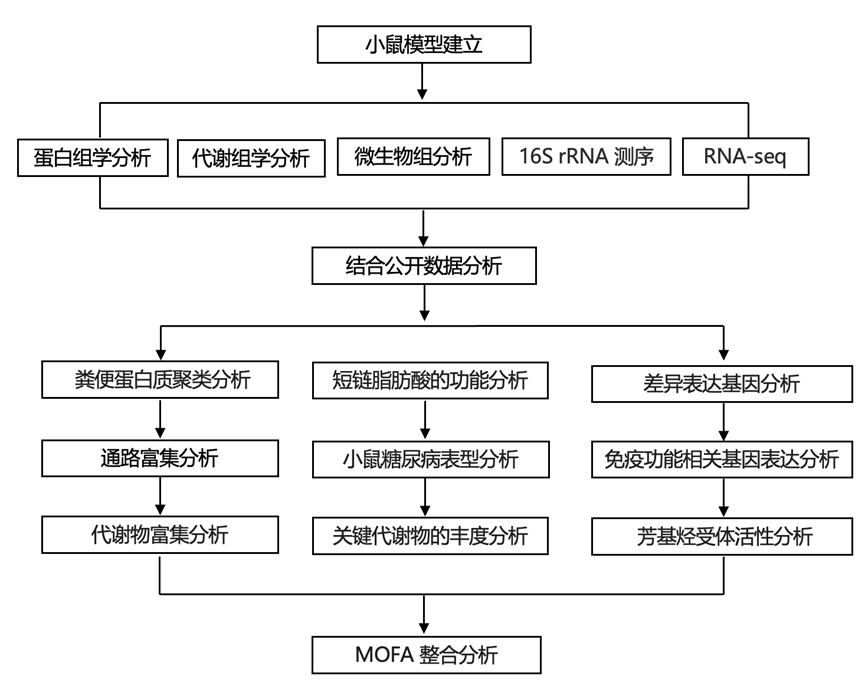
为了研究这些个体的肠道屏障稳态,他们对可溶性粪便蛋白进行了非靶向蛋白质组学分析,这些蛋白质富含来自肠道上皮和胰腺外分泌部的人类蛋白质。将检测到的肽与人类蛋白质组数据库进行搜索,过滤后鉴定出 738 种人类蛋白质。使用偏最小二乘判别分析 (PLS-DA) 的监督聚类表明,宿主粪便蛋白质组在所有三个时间点都是独一无二的,并且通过 PERMANOVA证实了这一点,干预停止后,随访时间点没有回到基线(图 1B-D)。单变量线性混合模型分析发现 159 种蛋白质在不同时间点存在差异。
对 SCFA 生物疗法后增加的蛋白质进行 Gene Ontology 通路富集分析,发现 6 周时有 201 个生物过程富集(图 1E)。最富集的过程是细胞氧化还原稳态,其中包括抗氧化剂过氧化物酶-6 (PRDX6)、硫氧还蛋白 (TXN) 和硫氧还蛋白还原酶 1 (TXNRD1),它们可以防止氧化应激。与此一致的是,与缺氧反应和氧水平降低反应相关的蛋白质也富集了,这表明氧环境较低。肌动蛋白丝通路、纤维组织和上皮细胞分化增加,由上皮细胞连接蛋白 CAPZB、CAPZA1 和根蛋白 (RDX) 驱动。与中性粒细胞和髓系细胞相关的多种先天免疫过程富集,包括抗炎蛋白酶前颗粒蛋白 (GRN)、抗菌防御蛋白 NOX2 以及参与细胞粘附、迁移和血管生成的蛋白质,例如粒钙蛋白 (GCA)、整合素亚基 αM(ITGAM 或 CD11b)和基质金属肽酶 9 (MMP9)。在随访中,上皮细胞、中性粒细胞和髓系细胞通路仍然富集,表明干预结束后效果持续存在。
使用KEGG进行通路富集分析,发现19条通路在6周时显著富集(图 1F)。这些通路包括先天免疫通路,表明中性粒细胞和吞噬体强烈参与。由TUB1A、RDX和SLC9A3R1驱动的紧密连接通路增加,内质网中的蛋白质加工也增加,包括参与抑制错误折叠蛋白聚集的热休克蛋白(CRYAB、HSP90B1和PRKCSH)。丙氨酸、天冬氨酸和谷氨酸代谢以及精氨酸生物合成的富集包括精氨酸琥珀酸合酶-1 (ASS1)、CAD 蛋白 (CAD)、4-氨基丁酸氨基转移酶 (ABAT)、一氧化氮合酶 (NOS2) 和醛脱氢酶 2 (ALDH2),这些在SCFA生物疗法后均有所增加。在随访中,溶酶体和吞噬体途径均有所富集,表明存在持久的先天免疫反应。
SCFA 生物疗法后减少的 KEGG 通路包括铁死亡和坏死性凋亡细胞死亡通路(图 1G)。这些通路由铁储存蛋白、铁蛋白轻链和铁蛋白重链 1 以及电压依赖性阴离子选择性通道蛋白(一种促凋亡蛋白)驱动。坏死性凋亡是一种炎症形式的细胞死亡,通常由病原体引起的细胞损伤引起。铁死亡是一种与铁相关的细胞死亡形式,与抗氧化防御失败有关,并与肠上皮功能障碍和肠道疾病有关。类似的通路在随访中持续存在,坏死性凋亡仍然下调。总之,这些数据表明中性粒细胞介导的组织修复过程可能在 SCFA 生物疗法后激活,同时伴随紧密连接蛋白的增加和细胞死亡通路的减少。
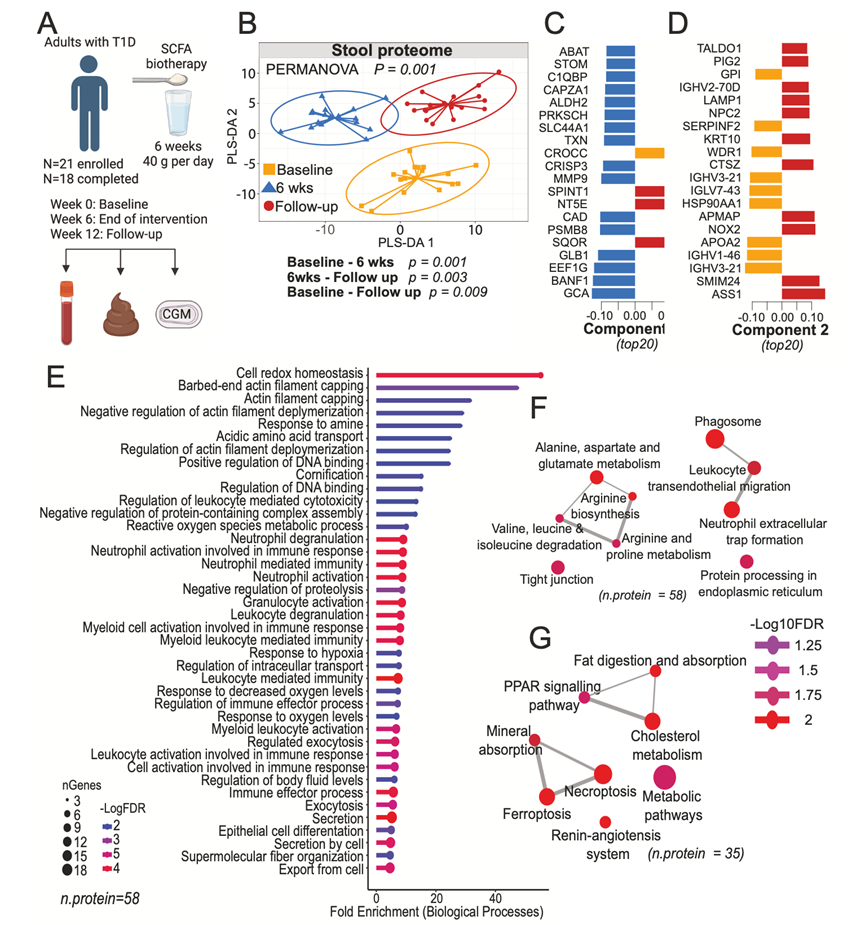
图1. SCFA 生物治疗后通过粪便蛋白质组学揭示的肠道屏障蛋白重塑。
(A)实验示意图。(B) 人类粪便蛋白的多变量 PLS-DA。(C-D) PLS-DA 成分 1 和 2。(E)GO分析。(F-G) KEGG通路蛋白质富集分析。
02
SCFA 生物疗法后,肠道代谢物的产生发生显著改变
由于肠道菌群产生的代谢物可能是 SCFA 生物疗法对肠道上皮产生任何影响的介质,他们采用非靶向代谢组学对粪便代谢物进行广泛分析,包括由菌群和宿主产生的代谢物。LC/MS 分析检测到 603 种假定注释的代谢物。监督多变量分析显示,6 周的粪便代谢组与其他两个时间点不同(图 2A)。单变量分析发现 101 种代谢物的p < 0.05,其中 8 种的 FDR < 0.05(图 2B)。 MetOrigin 通路分析发现,在 6 周和随访中,多种通路均富集,包括丙氨酸、天冬氨酸和谷氨酸代谢、丁酸代谢、精氨酸生物合成、TCA 循环和嘌呤代谢,其中大多数通路为宿主和微生物所共有(图 2C-D)。嘧啶代谢部分由微生物特异性通路驱动,在随访中得到富集(图 2C-D)。在这些通路中,6 周和 12 周时琥珀酸和丁酸的增加促进了丁酸通路的富集。丁酸是结肠细胞通过 TCA 循环(包括琥珀酸)的主要能量来源。精氨酸途径的富集是由6周时1-吡咯烷-5-羧酸的增加和12周时肌酸的增加以及鸟氨酸、谷氨酰胺和2-氧代精氨酸的减少所驱动。丙氨酸、天冬氨酸和谷氨酸途径的富集是由丙氨酸、氧代戊二酸和谷氨酰胺的减少以及琥珀酸的增加所驱动。嘌呤和嘧啶核苷酸代谢途径包括脱氧肌苷、脱氧尿苷和假尿苷,它们在6周时均呈增加趋势,在12周时显著下降。脱氧肌苷和脱氧尿苷,以及含有一个谷氨酸和两个缬氨酸的三肽 (Glu/Val/Val)、4-羟基-2-氧代庚二酸和γ-谷氨酰丙氨酸与 HbA1c 呈负相关,与估计的 C 肽呈正相关(图 2E)。
对粪便代谢物、代谢途径和粪便蛋白质的综合分析支持以下假设:SCFA 生物疗法正在驱动 TCA 循环和丙氨酸、天冬氨酸和谷氨酸代谢,导致谷氨酸和谷氨酰胺转化为嘌呤和嘧啶核苷酸,以及驱动尿素循环和精氨酸代谢(图 2F)。从基线到 6 周的大部分变化是参与精氨酸生物合成的前体代谢物,例如粪便代谢物 N-乙酰谷氨酸、谷氨酰胺和谷氨酸。而从基线到随访的变化是参与精氨酸利用的代谢物,例如粪便代谢物肌酸、肌酐和 2-氧代精氨酸(图 2F)。
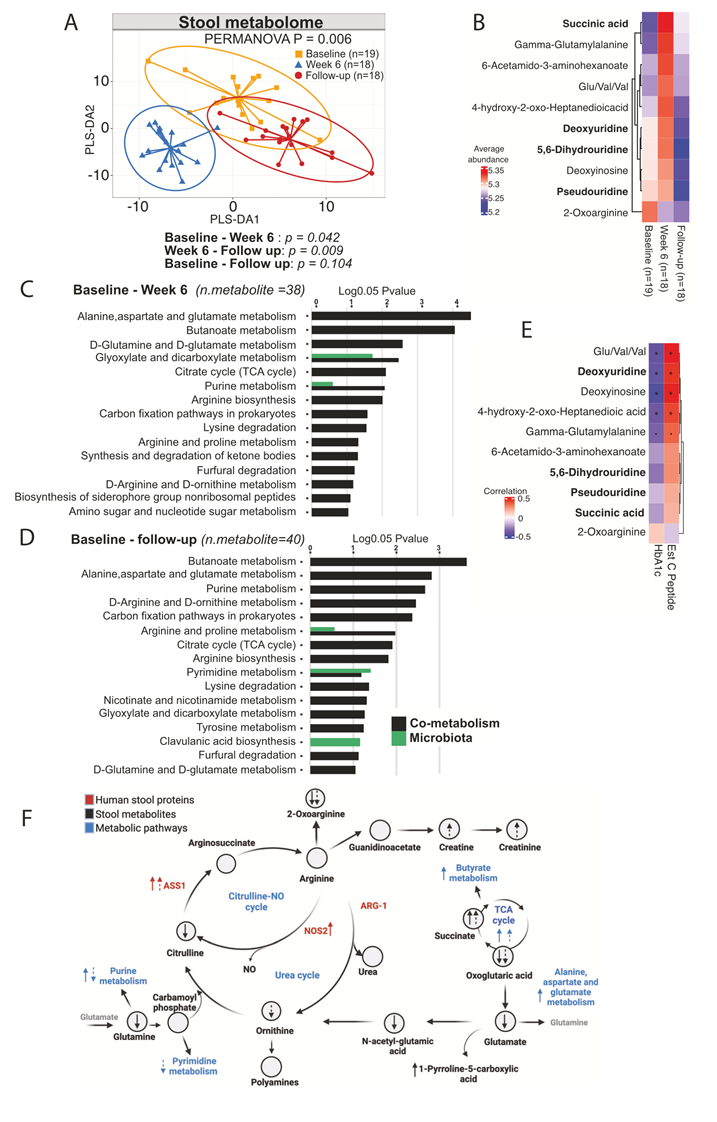
图2. SCFA 生物疗法后肠道代谢物的产生发生显著变化。
(A) 人类粪便代谢物的多变量 PLS-DA。(B) 通过线性混合效应模型确定的粪便代谢物丰度热图。(C-D) 从基线到六周和从基线到随访富集的显著 KEGG 通路。(E) 重复测量FDR < 0.1的代谢物与血糖变量的相关性。(F) 通路示意图显示干预后关键人类粪便蛋白质、粪便代谢物和代谢通路的变化。
03
血浆代谢组学揭示短链脂肪酸生物疗法后的全身代谢效应
为了进一步了解 1 型糖尿病成人患者接受 6 周 SCFA 生物疗法后,微生物组和代谢物的相关变化如何对宿主产生全身影响,他们研究了血浆中的循环代谢物。对血浆进行非靶向代谢组分析,鉴定出 619 种推测注释的代谢物。多变量 PLS-DA 显示随访中对血浆代谢物的影响最大,PERMANOVA 检验显示显著(图 3A-B)。单变量分析发现, 使用线性混合模型,92 种代谢物的p < 0.05。与 6 周相比,随访中琥珀酸增加,2-氧代精氨酸在第 12 周减少,与粪便代谢物相似。探索性富集分析发现,色氨酸代谢以及苯丙氨酸、酪氨酸和色氨酸的生物合成是12周时受影响最大的途径(图 3C),这归因于色氨酸、犬尿氨酸和吲哚丙酮酸。缬氨酸、亮氨酸和异亮氨酸的生物合成和降解也得到了富集。这些数据表明,SCFA生物疗法对代谢途径具有持续的系统性影响。
图3. 随访中血浆代谢物发生显著改变。
(A) 血浆代谢物的PLS-DA分析。(B) PLS-DA组分1的载荷图。(C) MetaboAnalyst通路富集分析,分析从第6周到随访以及从基线到随访的血浆代谢物变化。
04
微生物组对疾病的改善作用
他们接下来使用人-鼠粪便微生物群转移模型来研究 SCFA 生物疗法后人类微生物群的功能变化是否可以改变疾病进展(图 4A)。鉴于 HAMSAB 显著增加了小鼠和人类粪便和循环中乙酸盐、丁酸盐和丙酸盐的浓度,他们根据 6 周时粪便 SCFA 的增加情况对试验参与者进行分类,差异倍数 ≥2 称为“反应者”,<2 称为“无反应者”(图4B)。他们选择了n = 2 的SCFA 无反应者(供体 A 和 B)和n = 2 的反应者(供体 C 和 D),他们也具有高活菌数量。虽然反应者和无反应者受试者在生物疗法补充图 3后同样改变了他们的 alpha 和 beta 多样性,但反应者个体往往具有更高的 alpha 多样性。将人类供体粪便样本的悬浮液在交配前灌胃给雌性无菌NOD小鼠,并研究其雌性后代的微生物群落定植、代谢物水平和糖尿病进展(图 4A)。对照组母鼠用无菌生理盐水(PBS)灌胃,其后代保持无菌状态。所有小鼠在整个实验过程中均保持标准饮食。有趣的是,与无反应定植小鼠相比,干预后应答者样本(6周供体样本)定植的小鼠后代粪便中丁酸盐是唯一显著更高的SCFA,并且高于基线供体样本定植的两组小鼠(图 4C)。
6 周时,与无应答组在相同时间点和 PBS 对照无菌组相比,定植了应答者 SCFA 生物治疗后微生物群的小鼠糖尿病进展明显延迟 (图 4D)。相反,与 PBS 对照组相比,定植了应答者或无应答者基线样本的小鼠未能显著延缓定植小鼠的糖尿病(图 4E)。第二组无菌雌性 NOD 小鼠在 10 周龄时进行类似定植,并分析其免疫细胞和胰腺表型。组织学和免疫荧光染色显示,与无应答定植小鼠相比,应答者的胰岛单核细胞浸润和胰岛素含量趋于减少(图 4F)。在生物疗法后定植菌群的应答小鼠的胰腺淋巴结中,通过四聚体染色鉴定的BDC2.5胰岛特异性CD4 + T细胞比例较低。此外,应答小鼠的脾脏和胰腺淋巴结中的Foxp3+ CD8+调节性T细胞有所增加 。数据表明,SCFA干预在人体中引起的微生物变化在小鼠过继转移后仍会影响其自身免疫的发展,其保护作用主要与丁酸反应有关。
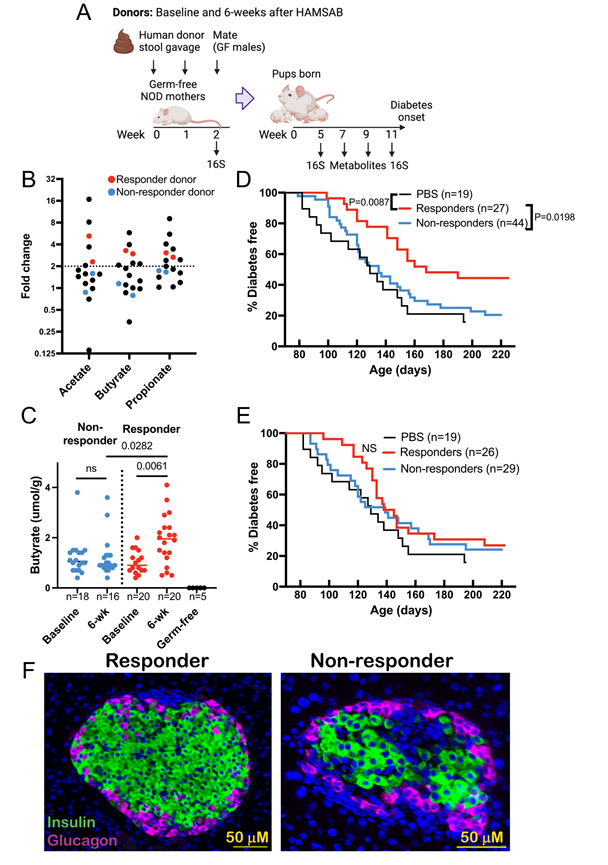
图4. 将响应者的微生物群从人移植到小鼠可延缓 NOD 小鼠的糖尿病。
(A)实验设计。(B)不同粪便代谢物的变化情况。(C) 7-9周龄小鼠雌性后代粪便丁酸盐含量。(D-E)生存曲线分析。(F) 胰腺切片经免疫荧光染色。
05
糖尿病保护应答小鼠的聚集是由粪便代谢物而非微生物群组成决定的
使用 16S rRNA 测序研究了管饲母体和雌性后代粪便微生物群的定植。与以前的研究相似,定植小鼠样本的 alpha 多样性低于人类供体样本。然而,多变量 PLS-DA 显示人类供体样本与其各自的定植小鼠样本聚类。虽然供体人类样本和小鼠之间的分类单元丰度存在差异,但 50.1% ± 3.6%(平均值± SD)的供体来源物种定植到母体中。从母体到后代的传播率很高(5 周龄时供体物种平均为 44.1% ± 8.3%),并且定植随时间相对稳定(11 周龄时供体物种平均为 44.8% ± 9.9%)。无监督主成分分析(PCA)多元分析表明,来自四个供体的小鼠的菌群组成各不相同(图 5A)。虽然按时间点(基线或6周供体样本)存在聚类,但供体效应占主导地位,四个供体之间有83个类群存在显著差异。值得注意的是,“应答者”和“无应答者”供体并未聚类在一起,其中供体D的差异性比其他三组更大。他们仍然发现,在响应组和非响应组之间,有 42 个分类单元存在显著差异,其中包括Parasutterella、Lachnospiraceae、Alistipes和Blautia等属在响应组中较高,而Enterococcus、Turicibacter和Butyricimonas在非响应组定植小鼠中较高。
接下来,他们分析了定植后代(仅限 6 周样本定植组)的粪便代谢物,过滤后鉴定出 527 种代谢物。与微生物群组成相比,PCA 多变量分析显示,两个应答组具有与无应答组相似的代谢物谱(图 5B)。PERMANOVA 分析证实,供体之间的代谢物存在显著差异,应答组与无应答组之间有 302 种单独的代谢物存在差异。通路富集发现,与无应答组相比,嘌呤、嘧啶、精氨酸和谷氨酸代谢是应答组中最富集的通路(图 5C)。应答组小鼠中多种嘌呤和嘧啶途径成分含量较高,精氨酸前体代谢物谷氨酸和氧戊二酸含量也较高,而精氨酸本身和鸟氨酸含量较低(图 5D-E)。此外,应答组小鼠的色氨酸代谢发生了改变(图 5D),这是由于应答组小鼠中奎尼酸(一种仅在微生物群中发现的途径代谢物)含量显著升高所致。应答组中这些代谢物变化和富集的通路与人类试验参与者在接受SCFA生物疗法后观察到的富集途径高度相似(图 2C-D)。
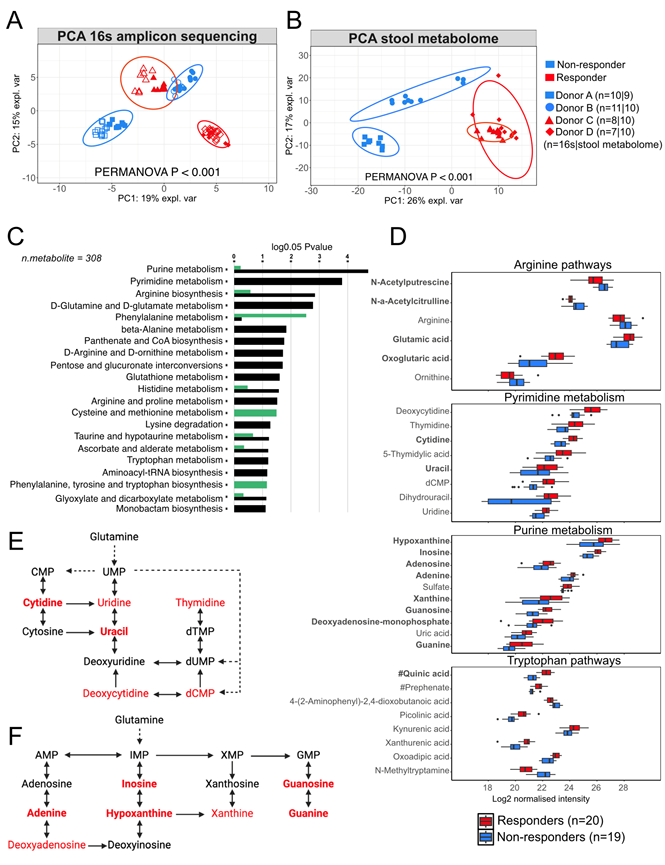
图5. 在人鼠微生物群移植研究中,粪便代谢物(而非肠道微生物群组成)决定了受体小鼠的聚集。
(A) 对 5 周龄人类微生物组定植小鼠的雌性 NOD 后代粪便进行 16S rRNA 测序的稀疏主成分分析。(B) 对7-9 周龄雌性 NOD 小鼠幼崽粪便代谢物的主成分分析。(C)通路富集分析。(D) 富集分析中确定的通路中关键代谢物的丰度。(E-F) 嘌呤代谢通路和F嘧啶代谢通路示意图。
06
应答者定植小鼠的粘膜B细胞基因网络减少
接下来,他们通过转录组学分析技术(RNA-seq)研究了定植有应答者和无应答者供体微生物群的小鼠的粘膜免疫和肠道屏障。在 10 周龄时,收集结肠和回肠组织,并对已定植有应答者(供体 C)或无应答者(供体 B)6 周样本微生物群的小鼠进行 RNA -seq。回肠中有 143 个差异表达基因(DEG),结肠中有 16 个DEG(图 6A)。GO分析发现,与 B 细胞活化和免疫球蛋白产生、先天免疫反应、炎症反应、对细菌的防御反应和对脂多糖的反应相关的多条通路在无应答者回肠组织中富集(图 6B)。在无应答小鼠中,B 细胞通路的强烈富集包括Ighg1、Ighg3和Ighd抗体重链基因,但没有 IgA 重链基因,以及与 B 细胞活化相关的基因,如Cd40,这表明分泌到粘膜层和管腔中的抗体类型在应答小鼠和无应答小鼠之间转换。 KEGG 富集确定了几个参与色氨酸代谢的基因,这些基因在应答小鼠中下调,包括Cyp1a1、Kmo和HAAO(图 6C)。Cyp1a1是通过芳烃受体 (Ahr) 负调节色氨酸代谢物信号的基因,可降解 Ahr 配体。 KEGG 富集还发现 NFκB 信号和细胞因子受体相互作用以及 B 细胞受体信号在应答小鼠中下调(图 6C)。这些数据表明,炎症粘膜免疫,特别是抗体的产生,因来自 SCFA 生物疗法响应者供体的微生物群的定植而降低。
为了进一步研究小鼠免疫细胞的激活状态,tm 分析了一组10周龄幼鼠的抗原呈递细胞表型。与基因表达数据一致,在移植了6周龄无应答小鼠样本菌群的小鼠中,IgM-B细胞的CD40表达水平更高(图6D)。与此同时,在无应答小鼠中,总常规树突状细胞和2型树突状细胞的CD40表达水平也更高(图6D)。这表明,在无应答小鼠中,类别转换的IgM-B细胞和树突状细胞均更加活跃。
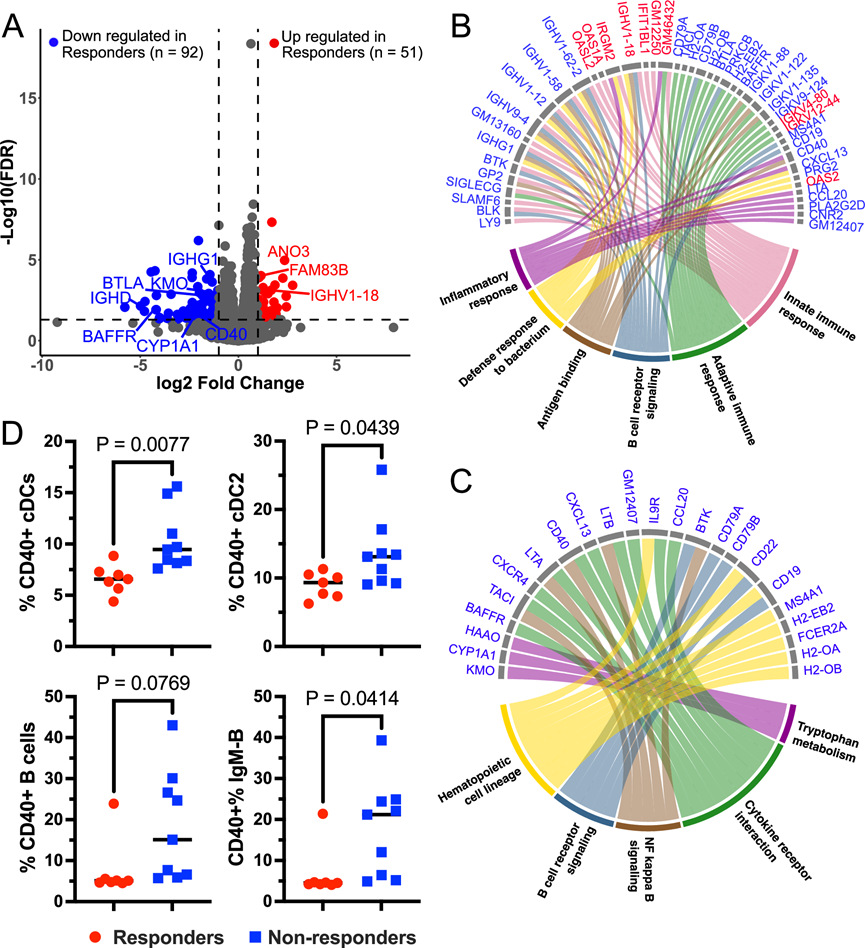
图6. 响应微生物群定植小鼠的回肠 B 细胞、先天免疫和色氨酸代谢基因特征的变化。
(A)RNA-seq。(B-C)通路分析。(D) 细胞CD40 表达分析。
鉴于色氨酸代谢为 Ahr 配体是肠道菌群维持肠道稳态的关键介质,他们研究了应答定植小鼠体内的 Ahr 配体活性。他们用从定植小鼠粪便颗粒中分离的粪便水刺激 Ahr-荧光素酶报告细胞(图 7A)。他们发现应答小鼠粪便液体的 Ahr 刺激活性高于无应答小鼠,无论是在基线还是 6 周样本定植小鼠中都是如此。两组 6 周样本定植小鼠的 Ahr 刺激活性均增加。然后他们使用了来自人类研究参与者的粪便液体,并证实 Ahr 配体活性在干预后 6 周显著增加(图 7B)。值得注意的是,在所有三个时间点,两名应答小鼠的Ahr活性均高于无应答小鼠。通过免疫荧光染色,他们发现应答小鼠的回肠组织中Ahr和IgA蛋白的含量均高于无应答小鼠(图 7C)。这表明SCFA-生物疗法后Ahr配体可用性的提高与糖尿病保护相关。
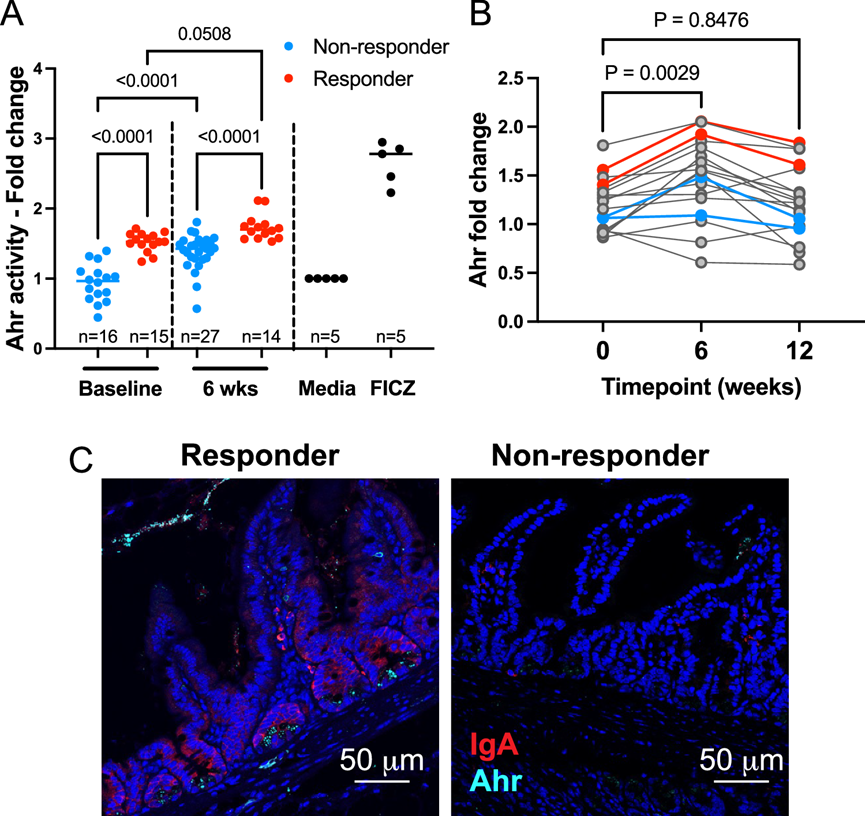
图7. 响应微生物群定植小鼠中芳基烃受体活性增强。
(A) 使用来自 7-10 周龄人类微生物组定植小鼠后代的粪便水提取物来刺激 Ahr 荧光素酶报告细胞。(B) 使用来自人类研究参与者(n = 18)的粪便水提取物来刺激 Ahr 荧光素酶报告细胞。小鼠研究中使用的人类供体用颜色表示。(C) 10 周龄人类微生物组定植小鼠后代的回肠组织代表性图像。
07
多组学因子分析
接下来,他们使用多组学因子分析 (MOFA) 来分析人类研究中的不同数据集(粪便蛋白质组和代谢物组、血浆代谢物组和粪便宏基因组、微生物分类群和途径)、临床指标、SCFA 和 Ahr 之间的关系。MOFA 方法可识别潜在因子,这些因子包含从模型中的不同数据集中选择的相关变量,这些变量解释了数据中的潜在变化。然后,他们将这些潜在因子与血糖控制、SCFA 和 Ahr 活性的临床指标相关联。MOFA 模型确定了 6 个潜在因子,所有 5 个数据集均有贡献。潜在因子 3 与所有三种粪便 SCFA 和估计的 C 肽呈正相关(图 8A)。潜在因子 3 的正向变量主要是血浆代谢物,包括色氨酸代谢物吲哚乳酸、犬尿氨酸、色氨酸和吲哚丙酮酸(图 8B)。对潜在因子 3 产生负面影响的变量包括许多粪便代谢物,例如假尿苷、黄嘌呤、酮戊二酸和鸟氨酸,这些代谢物在生物治疗后有所减少。潜在因子 4与粪便和血浆丁酸及 Ahr 活性呈正相关,而与 HbA1c (%) 和基础胰岛素 (%) 呈负相关。潜在因子 4 由青春双歧杆菌和在 6 周时增加的微生物途径(例如 TCA 循环、糖酵解途径和同型乳酸发酵)驱动。潜在因子1与粪便Ahr活性和血浆醋酸盐呈负相关,并受到类群(Parabacteroides distasonis和Bacteriodes uniformis)以及与嘧啶和嘌呤代谢相关的宏基因组通路的负向驱动,这些变量在6周时增加。潜在因子2受到类似类群的负向影响,并且与Ahr活性、糖化血红蛋白(HbA1c)和基础胰岛素百分比呈负相关。总之,这项综合分析支持SCFA、血浆色氨酸代谢物和粪便Ahr活性均与T1D血糖控制的临床特征相关。
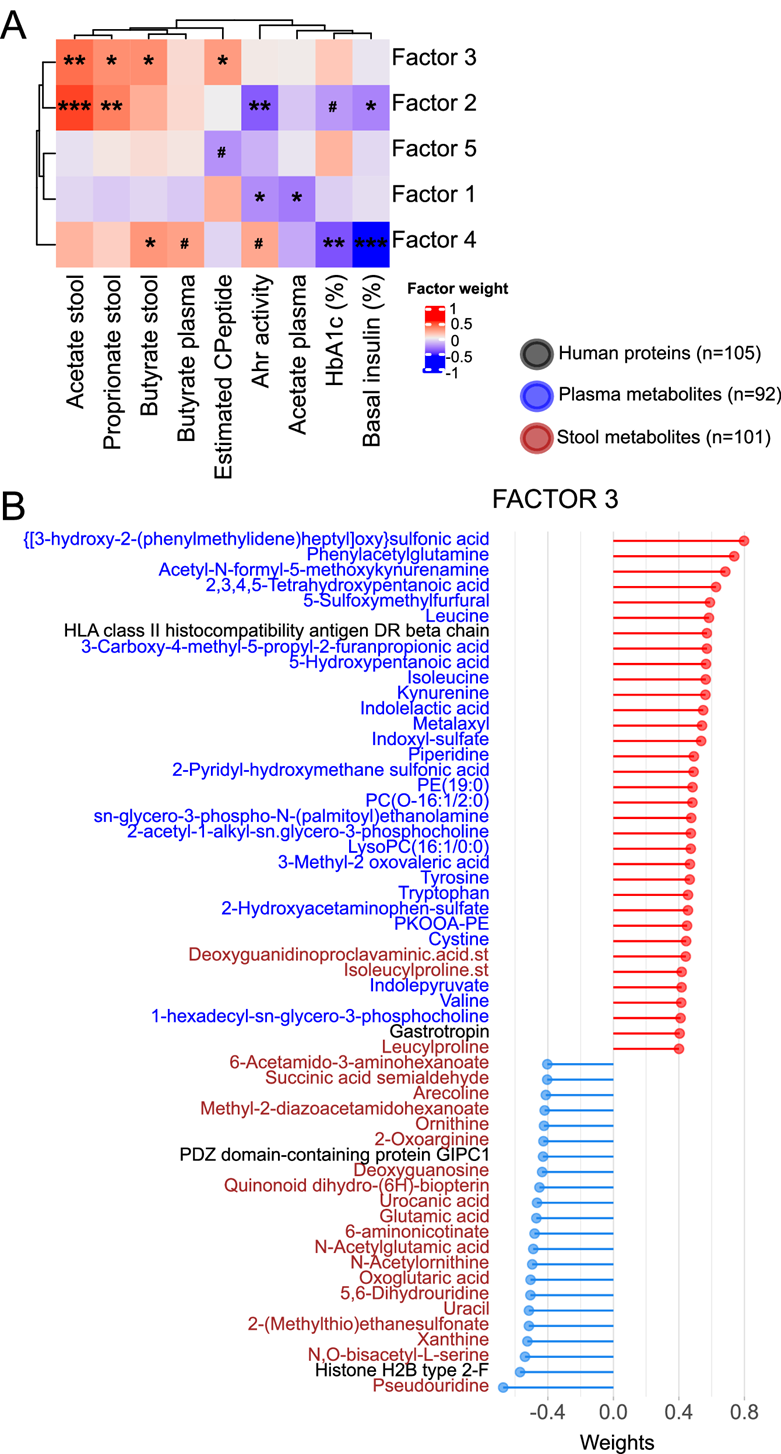
图8. 多组学因子分析 (MOFA) 识别与血糖控制、SCFA 和 Ahr 活性相关的潜在因素。
(A) 热图显示临床变量和模型因子之间的双侧 Pearson 相关性。(B) 对潜在因子 3 有贡献的变量。
+ + + + + + + + + + +
结 论
本研究显示,人类接受 SCFA 生物疗法后,肠道蛋白质组和黏膜免疫稳态会发生重塑。代谢组学研究表明,在接受 SCFA 生物疗法后,精氨酸、谷氨酸、核苷酸和色氨酸代谢得到丰富,并发现了与血糖控制相关的代谢物。粪便菌群转移表明,SCFA 应答者的菌群延缓了人源化无菌小鼠的糖尿病进展。受保护的小鼠增加了与人类相似的代谢途径,包括产生芳基烃受体配体、降低炎症性黏膜免疫力以及增加肠道免疫球蛋白A的生成。这些数据表明,强效SCFA免疫调节剂能够促进多种有益途径,并支持以微生物群为靶点对抗T1D。
+ + + + +



 English
English


