文献解读|Nat Microbiol(20.5):21,561 名个体的纯素、素食和杂食饮食的肠道微生物组特征及其相关健康结果
✦ +
+
论文ID
原名:Gut microbiome signatures of vegan, vegetarian and omnivore diets and associated health outcomes across 21,561 individuals
译名:21,561 名个体的纯素、素食和杂食饮食的肠道微生物组特征及其相关健康结果
期刊:Nature Microbiology
影响因子:20.5
发表时间:2025.01.06
DOI号:10.1038/s41564-024-01870-z
背 景
饮食与人类健康密不可分。在全球范围内,缺乏未经加工的植物性食物的不良饮食造成的死亡人数超过任何其他风险因素,其中心血管疾病、癌症和 2 型糖尿病是饮食相关死亡的主要原因。不健康的饮食还会带来各种负面的环境影响。动物性食物对气候、土地和淡水利用以及生物多样性的影响比植物性食物对全球环境变化的贡献更大。因此,人们对植物性食物比例较高的饮食越来越感兴趣,因为这种饮食既能降低疾病风险,又能减少负面的环境影响。然而,人们对不同人群饮食模式特异性宏基因组学谱知之甚少。
实验设计
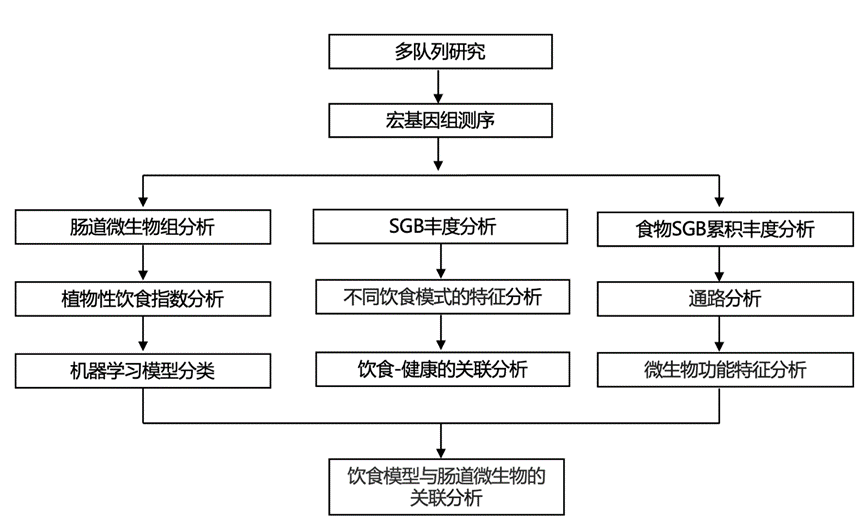
结 果
01
饮食数据的多队列肠道宏基因组学分析
本研究旨在阐明长期饮食偏好如何影响人类肠道微生物群的结构和功能,无论是在整体层面还是在单个物种层面。为此,研究团队整合了 ZOE PREDICT 计划的三个队列,它们分别来自英国(P1 n = 1,062 人、P3 UK22A n = 12,353 人)和 美国(P3 US22A n = 7,931 人)。他们还纳入了 另外两个由意大利参与者组成的公开队列(图1a)。五个队列的每个参与者都报告了他们的营养习惯,分别为“杂食者”(包括肉类、奶制品和蔬菜)、“素食者”(不吃肉)或“纯素食者”(不吃肉、奶制品和其他动物产品),并收集了经过宏基因组测序的粪便样本。总共考虑了 656 名纯素食者、1,088 名素食者和 19,817 名杂食者(图1a)。除了参与者的整体饮食习惯外,ZOE PREDICT 队列还包括每个个体习惯性消费超过 150 种单一食物的数据。通过基于 DNA 的粪便微生物组中的食物检测部分证实了饮食模式。
为了定量植物性食物的消费量,他们使用了植物性饮食指数 (hPDI),该指数对健康的植物性食物给予较高的分数,对不太健康的植物和动物性食物给予相反的分数。在三个 PREDICT 队列中,正如预期的那样,不同饮食模式之间的 hPDI 存在显著差异(图1c),纯素食者的 hPDI 明显高于素食者,素食者与杂食者相比也明显更高。
在 PREDICT 队列中,肠道微生物丰富度因饮食模式不同而存在显著差异,纯素食者[中位数在 209 到 266 个物种级基因组箱(SGB)之间]和素食者的观察到的丰富度低于杂食者(中位数为 217-299)(图1b),但纯素食者和素食者之间没有显著差异。这突出表明 alpha 多样性可能与潜在更加多样化的饮食模式相关。
整体肠道微生物组成也因饮食模式而异(图1d-h)。此外,当使用机器学习分类器时,基于定量肠道微生物概况,饮食模式具有高度可区分性。通过评估在交叉验证变体中训练的模型的性能,其中训练折叠与外部队列合并,他们获得了所有饮食模式和所有五个队列的受试者工作特征(ROC)曲线下平均面积 (AUC) 为 0.85。在将纯素食者与杂食者区分开时,可预测性最高(平均跨 LODO AUC = 0.90),其次是将素食者与纯素食者区分开(0.84),最后是将素食者与杂食者区分开(图2)。当使用不考虑目标队列的任何训练折叠的 LODO 方法时也得到了类似的结果。因为他们没有记录饮食模式可能何时改变,所以他们假设不完美的分类可能是由于最近改变饮食模式的个体造成的。总之,这些结果值得进一步研究造成这些差异的具体微生物组成分。
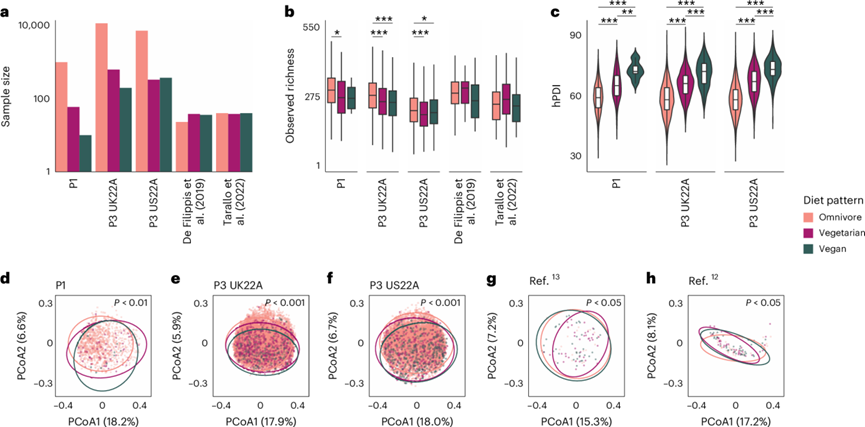
图1. 包含详细饮食信息的大型综合宏基因组数据集。
(a) 五个队列中每种饮食模式的样本大小。(b) 在五个队列中观察到的每种饮食模式的肠道微生物组的丰富度。(c) 五个队列中每种饮食模式的 hPDI 分布。(d-h) 使用未加权 UniFrac 距离解释系统发育多样性的肠道微生物组成的 Beta 多样性。
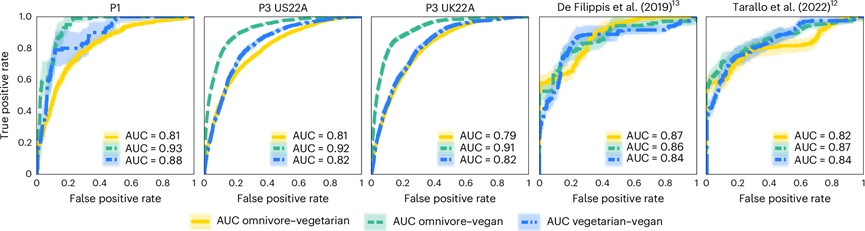
图2. 根据肠道微生物特征对个体饮食模式进行高度准确的分类。
02
纯素食者、素食者和杂食者的肠道微生物特征
为了探索哪些微生物与纯素食者、素食者和杂食者之间的不同肠道微生物组成相关,他们对 5 个队列中每个个体及其各自饮食模式中每种 SGB 的差异相对丰度进行了meta分析。总体而言,杂食者中 488 个 SGB 的丰度差异显著,而素食者微生物组中有 112 个 SGB;杂食者中 626 个 SGB 的丰度差异显著,而纯素食者中只有 98 个 SGB;素食者中 30 个 SGB 的丰度差异显著,而纯素食者中只有 11 个 SGB。当关注前 30 种微生物标记物时,这些最强的关联中的大多数与限制最少的饮食模式有关(图3a-h,图4a-b)。
了解与各种饮食模式相关的 SGB 的预测功能揭示了潜在的饮食特异性生态位。杂食者微生物群中增加的几种 SGB 与肉类饮食有关,它们通过例如蛋白质发酵(Alistipes putredinis)、利用氨基酸和通过胆汁酸抵抗力(Bilophila wadsworthia)帮助消化,或者是与炎症性肠病相关的炎症的粘液溶解指标(Ruminococcus torques )(图3b-h)。相比之下,纯素食微生物群中过度代表的几种 SGB 是已知的丁酸生产者(Lachnospiraceae、 Butyricicoccus sp.和Roseburia hominis),并且高度专注于纤维降解(Lachnospiraceae)(图3h,图4b)。此外,嗜热链球菌是一种常见的乳制品发酵剂和成分,它在素食者和纯素食者的肠道微生物群中具有最高的效应大小,标准化平均差异 (SMD) 为 -0.67,在杂食者和纯素食者的肠道微生物群中具有第二高的效应大小 (SMD = -0.62)。因此,当饮食模式之间的主要区别特征在于乳制品饮食时,最能区分这些饮食的 SGB 大量存在于奶酪和酸奶产品中。其他与乳制品相关的 SGB 与杂食和素食的联系比与纯素食的联系更密切,例如嗜酸乳杆菌、德氏乳杆菌、乳酸乳球菌、副干酪乳杆菌和鼠李糖乳杆菌。基于这些发现,他们接下来探讨了这些饮食模式特异性微生物与区分饮食模式的主要食物组之间的联系。
他们进一步研究了主要食物类别(如红肉和白肉、奶制品、水果和蔬菜)在区分不同饮食模式下的肠道微生物组方面的作用。杂食者摄入的肉类(红肉或白肉)量与绝大多数与杂食饮食相关的 SGB 呈正相关,而素食者(图3c)或纯素食者的 SGB 则呈正相关(图3i)。此外,与杂食者的肠道微生物组相比,肉类与所有 5 个与素食者肠道微生物组强烈相关的 SGB 呈负相关,与 11 个与纯素食肠道微生物组强烈相关的 SGB 中的 10 个呈负相关。与杂食者肠道微生物组强烈相关的 SGB 与红肉消费的相关性比与白肉消费的相关性更强。除一种情况外,红肉和白肉都与相同的SGB相关:“Candidatus Avimicrobium caecorum”,存在于人类肠道微生物群中,与杂食者肠道微生物群与素食者和纯素食者的白肉消耗呈正相关(图3c-i)。
相比之下,水果和蔬菜与素食者肠道微生物群中 5 个 SGB 中的 3 个呈正相关(图3c),与纯素食者和杂食者肠道微生物群中 11 个 SGB 中的 10 个呈正相关(图3i)。这些相关性中的大部分与蔬菜的关系比与水果的关系更大。任何与杂食者肠道微生物群密切相关且与水果或蔬菜相关的 SGB 都显示出负相关性而不是正相关性。
乳制品是纯素食者与素食者之间的区别,也是纯素食者与杂食者饮食之间的区别之一。区分素食者和纯素食者肠道微生物组的 SGB 与素食者的乳制品呈正相关,与纯素食者的乳制品呈负相关(图4c)。同样,区分杂食者和纯素食者肠道微生物组的 SGB 与杂食者的乳制品呈正相关,与纯素食者的乳制品呈负相关(图3i)。因此,这三种饮食模式的肠道微生物特征与主要食物组的纳入或排除有关。
无论比较哪种饮食模式,hPDI 和每种饮食模式的 SGB 特征之间的相关性都是一致的(图3d-j,图4d)。这意味着,如果 hPDI 与杂食者肠道微生物群中的特征 SGB 呈正相关或负相关,那么在素食者和纯素食者中也会显示出类似的相关性。因此,整体饮食因素可能超越饮食模式,这表明如果杂食者在饮食中也包含类似多样性的植物性食物,那么它们可以与其他饮食模式共有有益的肠道微生物特征。然而,在实践中,杂食者摄入的健康植物性食物通常明显少于素食者或纯素食者(图1c)。
为了研究三种饮食模式和人类健康之间的肠道微生物联系,他们使用了ZOE Microbiome Ranking 2024(心脏代谢健康),简称ZOE MB健康排名,它为发现与心脏代谢标志物显著相关的SGB分配了一个数字排名。当比较纯素食和素食微生物组的 SGB 特征排名时,纯素食相关的 SGB 比素食相关的 SGB 具有更有利的排名。在考虑饮食模式之间最可区分的30个SGB时,这些模式得到了反映。与素食者和纯素食者肠道微生物组相比,杂食者肠道微生物组的大多数SGB特征与较差的心脏代谢健康 (CMH) 相关,而素食者和纯素食者肠道微生物组的情况相反(图3e-k)。当将素食者和纯素食者的肠道菌群进行比较时,后者再次显示了大多数的特征性SGB与CMH阳性相关,而前者的模式则更分裂,只有不到一半的素食者特征性SGB与更有利的CMH相关(图4e)。因此,杂食特征微生物与较不利的CMH相关,而典型素食微生物与较有利的CMH相关。
他们从主要食物类别转向 FFQ 中的整个食物集合,接下来测试了饮食习惯信息与三种饮食模式中每个相关 SGB 的存在或不存在之间的关联程度。与饮食最相关的 SGB 是那些最能区分杂食和纯素肠道微生物组的 SGB,尤其是嗜热链球菌,可从整个 FFQ 项目预测,AUC = 0.72,R. torques(0.63),几种毛螺菌科 SGB(全部 0.65)和不解糖劳森杆菌(0.78;图3f-l,图4f),与咖啡消费密切相关。当比较素食者和纯素食者的肠道微生物组时,可预测性最高的标志性素食微生物是与乳制品消费相关的微生物,例如嗜热链球菌(AUC = 0.72)、鼠李糖乳杆菌(0.66) 、德氏乳杆菌 (0.70)、副干酪乳杆菌( 0.62 )、乳酸乳杆菌(0.65) 和嗜酸乳杆菌(0.68)(图4f)。这些 AUC 表明,摄入的食物与特定物种的存在之间存在非随机的、虽然是轻微的联系,但是表明存在因果关系以及微生物从食物到肠道的潜在转移。
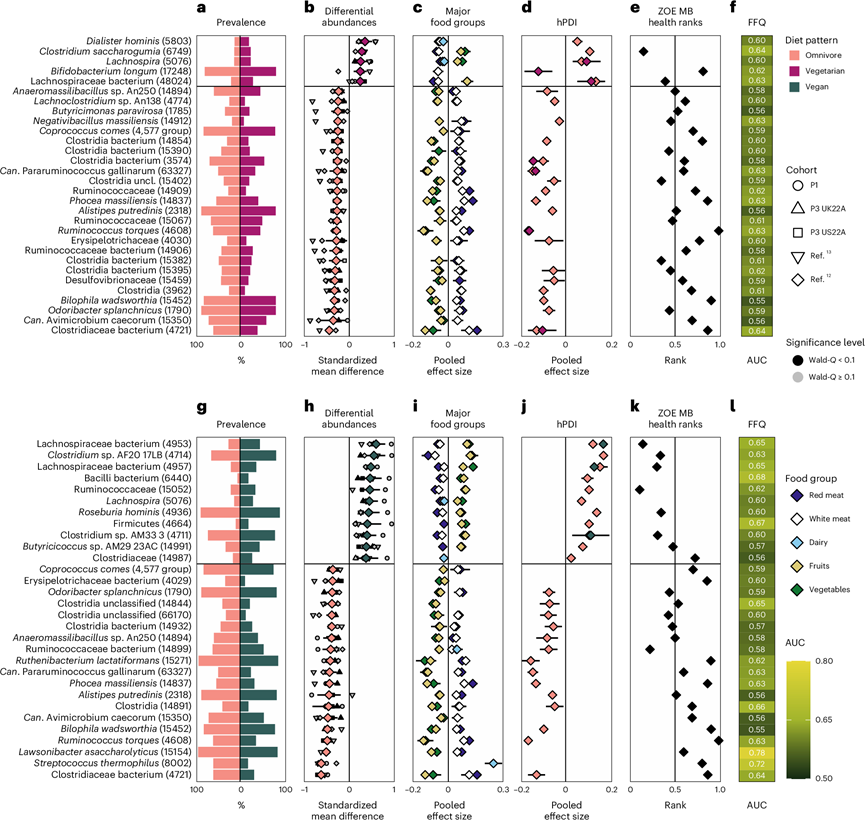
图3. 杂食者与素食者的肠道微生物特征。
(a) 杂食者(左)和素食者(右)肠道微生物群中前 30 个特征 SGB(括号中为各自的 SGB ID)的流行率。(b) SGB相对丰度与饮食模式之间的meta分析相关性。(c) 对 SGB 相对丰度与五大食物类别。(d) 对杂食者和素食者中 SGB 相对丰度与 hPDI 之间的相关性。(e) 每个特征 SGB 的 ZOE MB 健康等级。(f) 基于FFQ的机器学习预测(随机森林交叉 LODO AUC;方法)杂食者和素食者之间每种特征微生物的存在情况。(g) 杂食者(左)和素食者(右)肠道微生物组中前 30 个特征 SGB(括号中为各自的 SGB ID)的流行率。(h) 与(b)相同,但杂食者和纯素食者之间除外。(i) 与(c)相同,但杂食者与素食者之间除外。(j) 与 (d) 相同,但杂食者与素食者之间除外。(k) 与 (e) 相同,但杂食者与纯素食者之间除外。(l) 与 (f)相同,但杂食者与素食者之间除外。
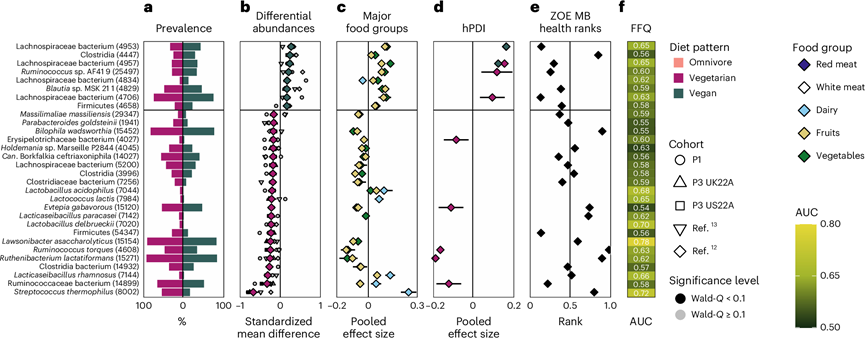
图4. 素食者和纯素饮食的肠道微生物特征。
(a) 素食者(左)和纯素食者(右)肠道微生物群中前 30 个特征 SGB(括号中为各自的 SGB ID)的流行率。(b) SGB 相对丰度与饮食模式之间的meta分析相关性。(c) 对 SGB 相对丰度与五大食物类别。(d) 对素食者和纯素食者中 SGB 相对丰度和 hPDI 之间的相关性进行meta分析。(e) 每个特征 SGB 的 ZOE MB 健康排序。(f) 基于 FFQ 的机器学习预测(随机森林交叉 LODO AUC)素食者和纯素食者之间每种特征微生物的存在情况。
03
饮食依赖性肠道微生物组对食物微生物的贡献
研究结果表明饮食模式有可能选择肠道微生物,但肠道微生物也可能直接来自食物本身,例如嗜热链球菌,它是乳制品的常见成分,他们发现它是乳制品消费量不同的饮食模式之间最有区别的 SGB 之一(图3h,图4b)。为了确定每种饮食模式的肠道微生物组中有多少 SGB 可能来自食物,他们在 5 个队列的“curatedFoodMetagenomicData”(cFMD)中检索了整合的食物 SGB ,发现存在260 个。不同食物 SGB 的数量因饮食模式而异,纯素食者的微生物组与杂食者和素食者相比,食物 SGB 的数量明显较少,但素食者和杂食者之间并无差异(图5a-b)。
如果这些食物 SGB 在这些食物组中的流行率 >0.1%,则当将这些食物 SGB 标记为肉类、奶制品和/或水果和蔬菜的标志时,食物组的影响显著且大于饮食模式的影响,其中奶制品的食物 SGB 数量较多,其次是水果和蔬菜。因此,影响食物到肠道物种共有的最大因素是 SGB 来源的食物组,其中奶制品所占比例最大,肉类最低。杂食者和素食者的食物相关 SGB 数量最多,他们都吃传播率最高的食物组(奶制品、水果和蔬菜),而纯素食者的食物相关 SGB 数量最少,他们不吃肉类,更重要的是不吃奶制品,因此可能最大限度地降低了食物到肠道的传播率。
他们进一步发现,素食者肠道微生物群中食物 SGB 的累积相对丰度显著高于杂食者和纯素食者的肠道微生物群,而纯素食者的肠道微生物群显著低于杂食者(图5a)。事实上,素食者的食物 SGB 累积相对丰度高于杂食者,但不同食物 SGB 的数量相似,这可能反映了摄入的食物 SGB 丰富度相似(尤其是因为,与来自乳制品、水果和蔬菜的 SGB 相比,肉类衍生的 SGB 起的作用较小),但素食者摄入的水果和蔬菜比肉类更多(图1c),这反过来又导致食物 SGB 的累积相对丰度更高。总而言之,饮食选择与肠道微生物群的变化有关,不仅通过潜在选择,还通过食物到肠道的获取。
然后,他们确定了五个队列中流行率最高的 20 种食物 SGB以及这些 SGB 是哪些主要食物组的标志(图5c-d)。正如预期的那样,嗜热链球菌位列其中,在乳制品中的流行率最高,而在纯素食者中的流行率最低(图5c)。常见的乳制品 SGB,例如嗜酸乳杆菌、德氏乳杆菌、乳酸乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌,也观察到了类似的模式,所有 SGB 在纯素食和非纯素食饮食模式之间差异最大。
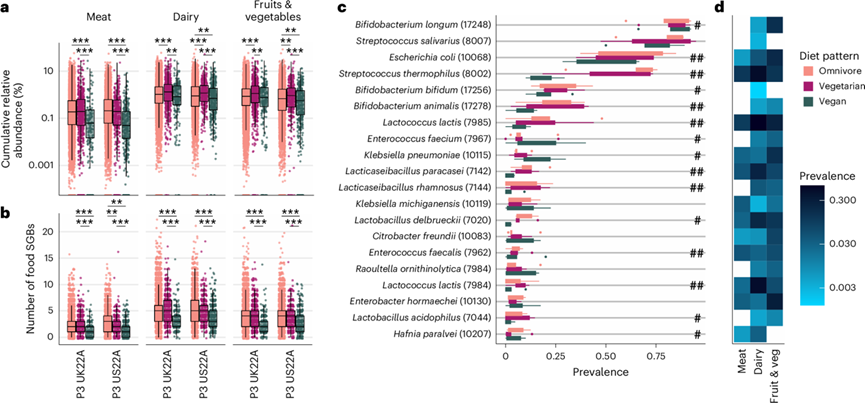
图5. 不同饮食模式下食物微生物对肠道微生物群的贡献。
(a-b) 累积相对丰度(log 10)和、每个个体肠道微生物群中食物 SGB(肉类、奶制品或水果和蔬菜衍生的 SGB)的数量。(c) 所有n = 5 个队列中每种饮食模式中 20 种最常见食物 SGB(括号中为各自的 SGB ID)的流行率。(d) 三大食物类别(肉类、奶制品、水果和蔬菜)中 20 种最常见食物 SGB 的流行率。
04
植物和肉类特定的微生物途径和饮食模式
由于本项研究结果表明肠道微生物结构似乎适应了主要食物类别的摄入,他们通过观察饮食模式的肠道微生物功能潜力来探索这一假设。这揭示了与杂食性饮食相比,素食和纯素饮食中富含的一系列植物相关微生物途径。这些包括简单碳水化合物的转化(例如,D-半乳糖降解途径 6317)和生物活性化合物的转化(图S4-6)。在后者中,他们确定了myo-、chiro-和scillo -肌醇降解途径 7237,其分子(即肌醇/维生素B7的生物活性形式)代表了植物相关环境中最丰富和最易获取的碳和能量来源。该途径在土壤和根际细菌中尤为广泛,可能为植物相关生态位中的微生物(如纯素食或素食者肠道微生物组)提供生长和底物利用的竞争优势。纯素食和素食者肠道微生物中也富含分支酸(ARO 和 6163)的生物合成途径,分支酸是生产各种必需代谢物(例如某些芳香族氨基酸、维生素 E 和 K 以及泛醌)的中间体。这些酶促途径之所以引人注目,是因为它们为原核生物(包括植物内共生蓝藻)以及几种真核生物(包括子囊菌)所共有。这再次强调了纯素食和素食者肠道宏基因组中与植物生态位相关的功能的富集。
相比之下,杂食者肠道微生物群中过度表达的途径参与了动物源性食物的分解和氨基酸代谢(图S4-6)。这些包括L-苏氨酸 (THRESYN )超途径和L-丝氨酸和甘氨酸生物合成途径(SER-GLYSYN),其底物常见于红肉和白肉以及乳制品中。此外,他们发现杂食者微生物群表现出必要的酶促机制,这些酶促机制对于挽救动物源性食物中丰富的必需辅因子必不可少。这些辅助因子包括来自饮食前体的腺苷钴胺素(维生素B12)和叶酸(维生素 B 9)。总之,肠道微生物功能潜力揭示了与动物或植物源性食物代谢相关的饮食特异性生态位,证明饮食及其包含或排除主要食物组在分类学和功能上塑造肠道微生物景观中的作用。
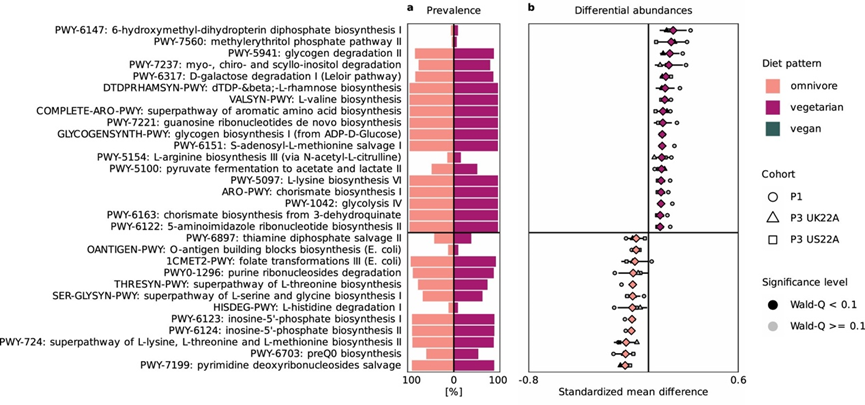
图S4. 杂食者和素食者肠道微生物组的潜在微生物功能特征。
(a) 杂食者(粉色,左侧条)和素食者(紫色,右侧条)肠道微生物群中每种功能途径(y 轴)的流行率。(b) 对绝对标准化均值差最大的前 30 条途径、上下置信区间,进行途径相对丰度与饮食模式(杂食者 vs 素食者)之间的Meta分析相关性。
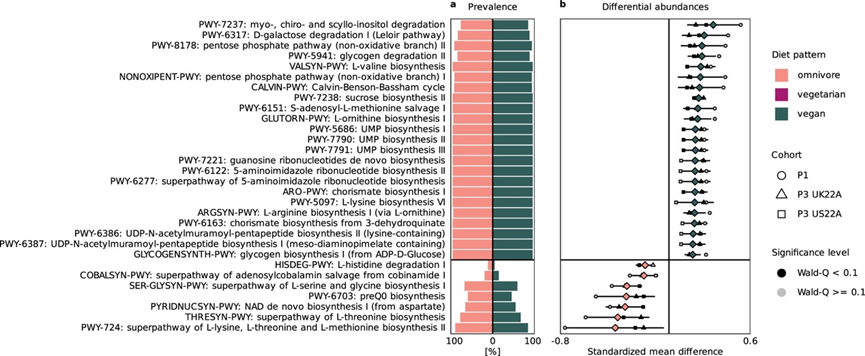
图S5. 杂食者和纯素者肠道微生物组的潜在微生物功能特征。
(a) 杂食者(粉色,左侧条)和纯素食者(绿色,右侧条)肠道微生物群中每种功能途径(y 轴)的流行率。(b) 对绝对标准化均值差异最大的前 30 条途径、上下置信区间进行途径相对丰度与饮食模式(杂食者 vs 纯素食者)之间的Meta分析相关性。
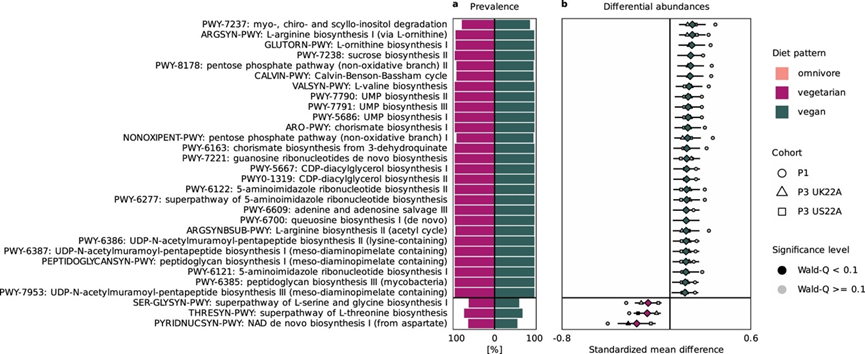
图S6. 素食和纯素食肠道微生物组的潜在微生物功能特征。
(a) 素食(紫色,左侧条)和纯素食(绿色,右侧条)肠道微生物群中每种功能途径(y 轴)的流行率。 (b) 对绝对标准化均值差异最大的前 30 条途径、上下置信区间进行途径相对丰度与饮食模式(素食者 vs 纯素食者)之间的Meta分析相关性。
+ + + + + + + + + + +
结 论
本研究纳入了 5 个独立的跨国人类队列的 21,561 名个体,通过分析微生物组数据,以绘制饮食模式(杂食、素食和纯素食)的差异如何反映在肠道微生物群中。微生物谱可以很好地区分这些常见的饮食模式(平均 AUC = 0.85)。红肉是杂食者微生物群的强大驱动因素,相应的特征微生物(例如,Ruminococcus torques、Bilophila wadsworthia和Alistipes putredinis)与宿主的心脏代谢健康呈负相关。相反,纯素食特征微生物与有利的心脏代谢标志物相关,并且在食用更多植物性食物的杂食者中富集。饮食特异性肠道微生物与食物微生物群有部分重叠,尤其是乳制品微生物,例如嗜热链球菌,以及纯素食者的典型土壤微生物。常见的西方饮食模式的特征可以支持未来的营养干预和流行病学。
+ + + + +



 English
English


