文献解读|Nat Commun(7.1):骨骼肌衰老过程中转录多样性的变化
✦ +
+
论文ID
原名:Transcriptional Diversity in Response to Aging Across Skeletal Muscles
译名:骨骼肌衰老过程中转录多样性的变化
期刊:Aging Cell
影响因子:7.1
发表时间:2025.07.09
DOI号:10.1111/acel.70164
背 景
骨骼肌是动物身体的主要组成部分,约占体重的 40%。与心脏一样,骨骼肌贡献了静息能量消耗的近 30%,以及运动时增加的能量需求的近 100%。随着年龄的增长,肌肉质量在中年左右开始下降(每年约 1%),在严重的情况下,到 80-90 岁时肌肉质量损失可能高达 50%。这种下降会降低肌肉力量和身体机能,这种情况称为肌肉减少症。除了损害活动能力之外,肌肉减少症还与代谢功能障碍、炎症反应增强和慢性疾病风险增加密切相关。衰老会导致肌肉功能逐渐下降,但不同骨骼肌应对衰老的机制尚不清楚。
实验设计
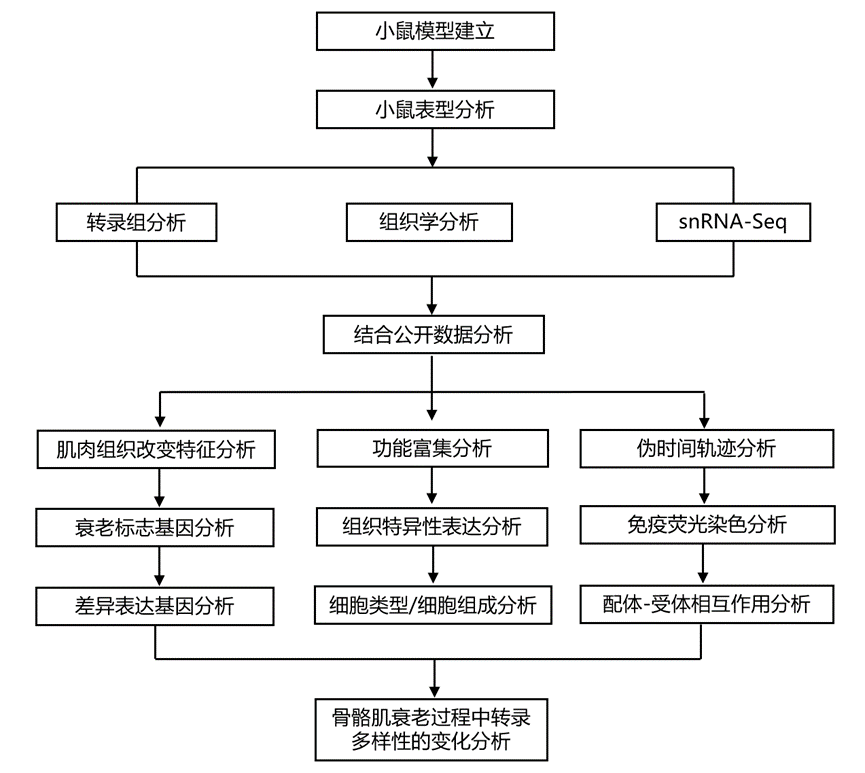
结 果
01
衰老小鼠肌肉组织学改变的特征
为了阐明肌肉衰老的表型和分子特征,研究团队研究了年轻(3 个月)和老年(24 个月)雌性小鼠的肌肉组织(图 1a)。在老年小鼠中观察到体重显著增加,这与之前的研究一致,表明雌性 C57BL/6J 小鼠在正常衰老过程中体重增加(图 1b)。观察到骨骼肌相对重量下降,同时悬挂时间减少,表明随着年龄增长肌肉质量和功能逐渐下降,这是骨骼肌衰老的标志(图 1c-d)。此外,检测到心脏相对重量显著增加,表明与年龄相关的心脏肥大(图 1d)。SDH 染色显示,超过一半的受检组织肌纤维直径显著减小,与年龄相关的纤维类型萎缩相一致(图 1e)。值得注意的是,随着年龄的增长,比目鱼肌(慢肌)、EDL 和 胫骨前肌 (TA)的肌纤维直径也同样减小(图 1d-e)。进一步分析表明,比目鱼肌和 TA(p < 0.01)中 II 型肌纤维直径显著减小 ,而 TA 中 I 型肌纤维直径的减小幅度大于比目鱼肌,但并不显著(图 1f-g)。在 EDL 中,I 型和 II 型肌纤维均呈减少趋势,但并不显著(图 1f-g)。此外,老年组比目鱼肌中 I 型肌纤维的比例显著增加(图 1h)。此外,所有老化肌肉均出现了肌肉老化和退化的典型特征,包括HE染色可见中心核比例增加、肌肉脂肪浸润,以及炎症和衰老标志基因显著上调(图 1i)。Masson染色显示明显胶原沉积,电子显微镜(以LDM表示)显示线粒体肿胀(图 1j-k)。
为了研究与年龄相关变化相关的转录组改变,对年轻小鼠(n = 4)和老年小鼠(n = 4)的肌肉组织进行了转录组分析(RNA-seq)。主成分分析 (PCA) 显示心室(作为心肌)与骨骼肌之间存在明显区别(图 1l)。在骨骼肌中,横膈膜、比目鱼肌和咬肌与其他组织相比表现出显著差异,形成不同的聚类(图 1l)。表达水平相似性分析始终表明不同肌肉类型之间存在明显差异,证实了生物学重复之间的高度一致性,确保了数据的可靠性(图 1m)。
骨骼肌由肌纤维组成,小鼠的肌纤维根据Myh表达分为四种类型。据推测,观察到的组织特异性源于肌纤维组成的差异。为了验证这一点,通过分析肌球蛋白重链异构体的表达水平来量化不同纤维类型的相对丰度(图 1n)。聚类分析支持整体基因表达结果,强化了心室与其他骨骼肌之间的区别。心室表现出较高的Myh6表达,这对于心肌收缩和心肌粗丝的形成至关重要。Myh4表达高的骨骼肌(IIB 型肌纤维)聚集在一起。
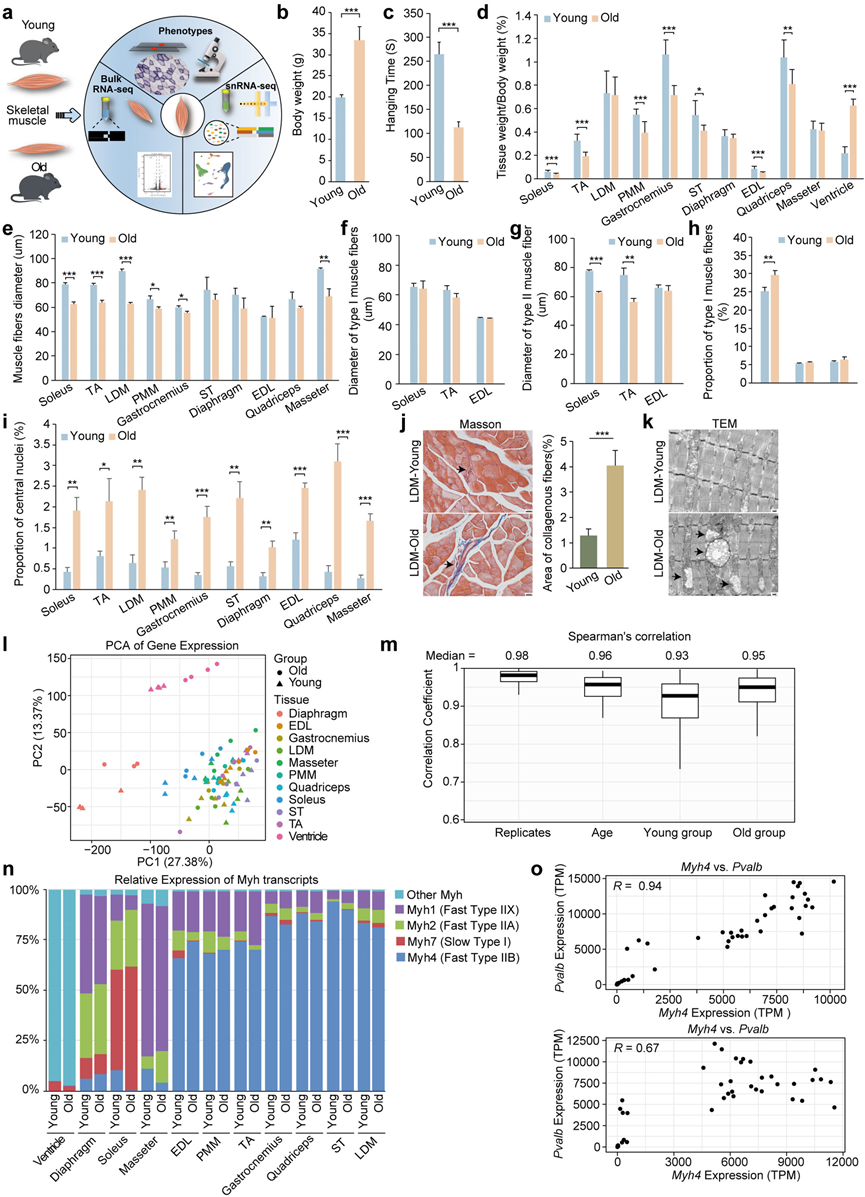
图1. 小鼠骨骼肌中与衰老相关的表型和基因表达。
(a) 年轻和老年小鼠骨骼肌的多组学分析。(b) 年轻和老年小鼠的体重。(c) 倒置悬挂时间(秒)。(d) 年轻和老年小鼠 11 种不同组织的组织重量与体重之比。(e) 肌纤维直径。(f-g) I 型和 II 型肌纤维的直径。(h) I 型肌纤维的比例。(i) 具有中央核的肌纤维百分比。(j) 通过 MASSON 染色评估年轻和老年小鼠的胶原面积百分比(以 LDM 为代表)。(k) 通过 TEM 观察年轻和老年小鼠的线粒体形态。(l) 年轻和老年小鼠 11 种不同组织中 mRNA 表达的主成分分析 (PCA)。(m) 不同重复、不同年龄组以及年轻和老年小鼠内部的 Spearman 相关系数的小提琴图。(n) 年轻和老年小鼠 11 种骨骼肌组织中肌球蛋白重链 (Myh) 转录本的相对表达。(o) 年轻和老年组中Myh4与Pvalb 的表达分析。
02
衰老肌肉基因表达的组织特异性和共有途径
比较年轻组和老年组,共鉴定出3615个差异表达基因(DEG)(图 2a)。值得注意的是,DEG的数量取决于解剖位置而非肌肉纤维类型,后肢肌肉似乎更容易受到衰老的影响。
不同组织中差异表达基因的差异倍数(OY)热图表明,大多数差异表达基因的鉴定具有组织特异性(图 2b)。干扰分析结果表明,只有约12.8%的上调基因和5.9%的下调基因在至少三种组织中表达,进一步支持了衰老的组织特异性(图 2c-d)。通过对不同骨骼肌区域特有表达基因的功能富集分析,例如比目鱼肌中的氧化磷酸化富集、TA中的骨骼肌收缩和心室中的无机离子跨膜转运,进一步验证了这一特性。
然而,功能富集分析显示,大多数上调基因在多种组织的炎症和免疫通路中富集。值得注意的是,10 条通路在至少 6 种组织中持续富集,包括炎症反应、细胞因子-细胞因子受体相互作用和细胞-细胞粘附调节。这些发现与先前炎症标志物Il-1b的定量结果一致,所有组织均表现出不同程度的炎症损伤。有趣的是,膈肌中与呼吸道炎症相关的炎症反应基因(IRG)比例最高,例如Ccl3和Tbx21 (图2e)。免疫荧光染色始终显示老年膈肌组 TNF-α 阳性细胞核显著上调。膈肌的通路富集分析显示,上调的基因在免疫反应相关通路中显著富集,包括促炎因子如Ifng和Irf8(图 2f)。GSEA 分析得出了一致的结果,主要分泌促炎细胞因子的 Th17 细胞分化通路显著上调,而 ECM 通路在横膈膜中下调。
多个基因在不同组织中表现出相似的变化模式(图 2g)。例如,Nnt是一种关键的线粒体氧化还原调节蛋白,可促进与衰老和代谢疾病相关的慢性炎症,在所有 11 种组织中均显著下调(图 2g)。相反,诱导各种类型骨骼肌萎缩的 Mt2在相同组织中显著上调(图2g)。其他基因,包括Dbp(昼夜节律因子),Cd163(炎症标志物),Nfil3(免疫调节因子)和Sncg(肌肉萎缩因子),也在大多数骨骼肌区域中表现出显著的变化(图 2g)。
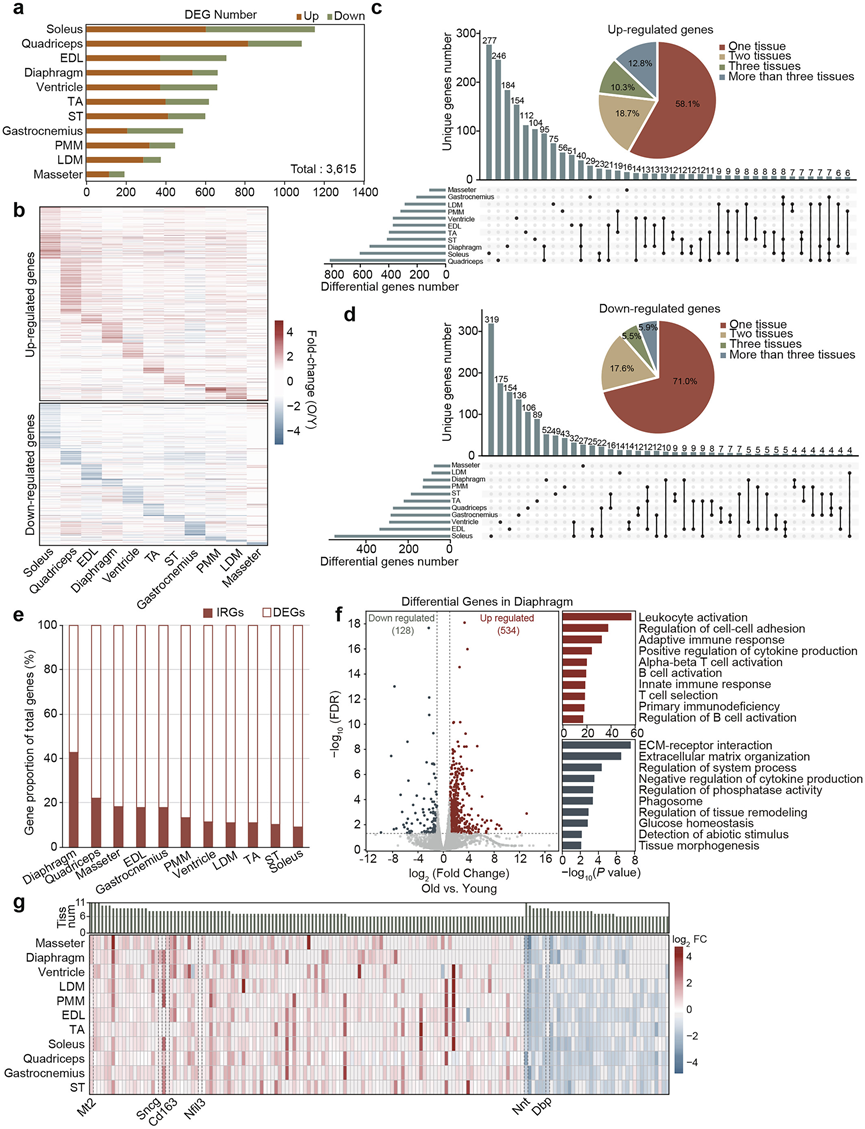
图2. 衰老过程中多种组织的响应表征。
(a) 条形图显示不同组织中差异表达基因 (DEG) 的数量。(b) 热图可视化了多种组织中 DEG 的差异倍数。(c-d) 在一种、两种、三种和三种以上组织中鉴定出的上调基因和下调基因的百分比和扰乱分析。(e) 条形图显示炎症反应基因 (IRG) 在所有组织中差异表达基因 (DEG) 的百分比分布。(f) 左图:火山图显示老年小鼠和青年小鼠 (O/Y) 膈肌中 DEG 的相对表达水平。右图: GO 分析和 KEGG 通路分析。(g) 热图显示不同组织中基因表达。
03
鉴定骨骼肌中细胞类型和基因表达的年龄相关变化
为了比较年轻和年老骨骼肌中的细胞群,对 LDM 和 PMM 进行了单细胞核转录组分析 (snRNA-seq)。从 8 个独立文库中保留了 73170 个高质量单核转录组。使用均匀流形近似和投影 (UMAP) 分析,鉴定出几个主要群体,每个群体都表现出不同的转录组特征。根据标记基因表达确定细胞核的细胞来源,将其分类为肌细胞核、纤维脂肪形成祖细胞 (FAP)、免疫细胞、脂肪细胞、血管内皮细胞 (BEC)、肌肉干细胞 (MuSC)、平滑肌细胞 (SMC)、雪旺细胞、淋巴管内皮细胞 (LEC) 和未鉴定的细胞核(图 3a)。
随后分析了LDM和PMM中年轻组和老年组细胞组成的变化。肌细胞核已确定为主要的细胞类型,非肌肉细胞群,包括FAP、免疫细胞和脂肪细胞,也构成了总细胞群的相当一部分(图 3b-c)。随着年龄增长,LDM和PMM中的基本细胞类型组成基本保持不变。
为了阐明细胞水平上与衰老相关的基因表达变化,他们鉴定了所有主要细胞类型的DEG。衰老对脂肪细胞、肌细胞核、FAP和免疫细胞的影响最为显著(图 3d)。对不同组织中相同细胞类型的DEG进行比较分析,发现DEG的共有比例在13%至47%之间,这表明相同细胞类型中与年龄相关的转录改变遵循相似的生物学途径(图 3d)。功能富集分析鉴定出一些通路,例如肌肉细胞分化(肌细胞核)、冷诱导产热调控(脂肪细胞)、细胞外基质(ECM)组织化(FAP)以及白细胞活化(免疫细胞)。然而,肌肉系统过程通路在所有细胞类型中均持续下调。
进行单细胞调控网络推断和聚类 (SCENIC) 分析以评估不同细胞类型的转录因子活性。在年轻组和老年组中共鉴定出 101 个活性调控子(图 3e)。根据调控子活性评分,将细胞核分类为预期类型,并鉴定出细胞类型特异性转录因子。例如,参与成肌分化的Pitx1在肌细胞核中富集;与脂质合成相关的Cebpa在脂肪细胞中富集;参与免疫反应的Tbx21在免疫细胞中富集。
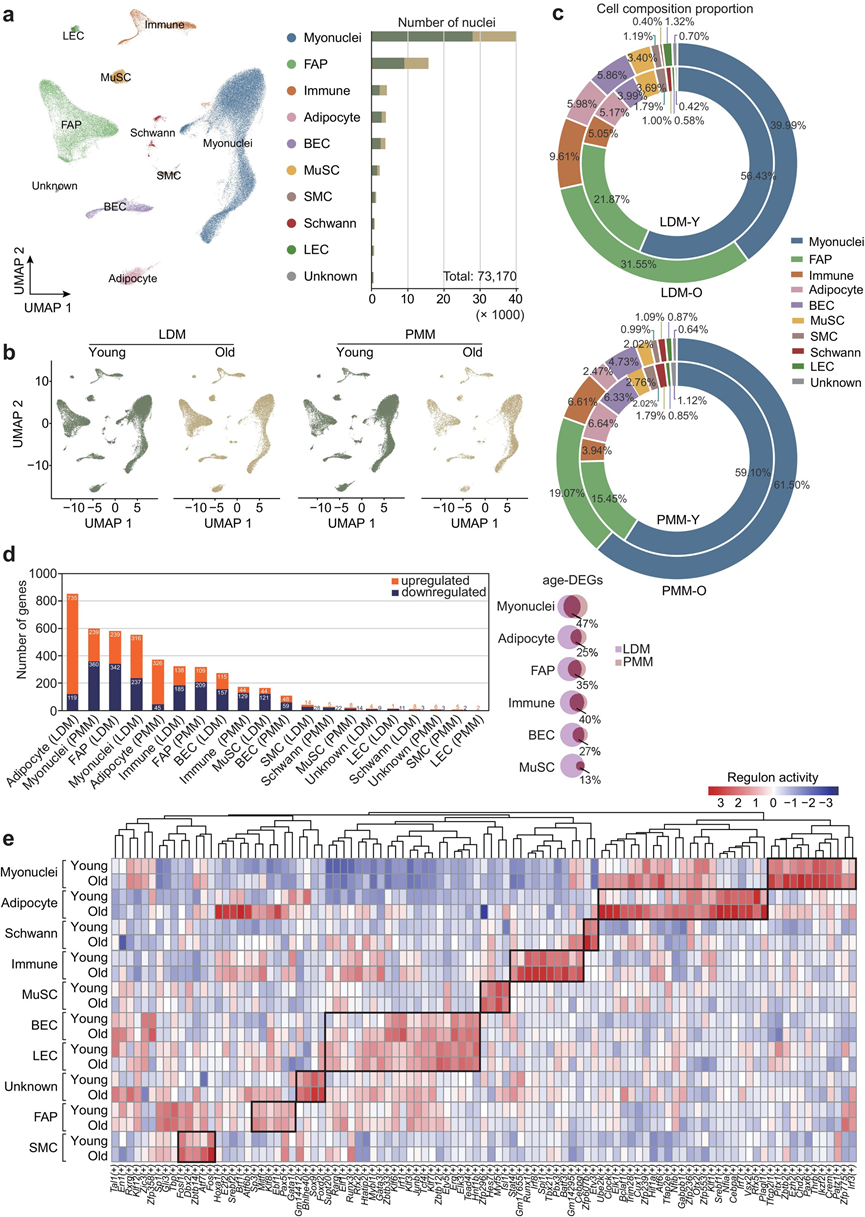
图3. 小鼠骨骼肌衰老的单核转录组图谱。
(a) 年轻和老年骨骼肌的均匀流形近似和投影 (UMAP) 图(左)。细胞类型包括肌细胞核、成纤维脂肪祖细胞 (FAP)、免疫细胞、脂肪细胞、血管内皮细胞 (BEC)、MuSC、平滑肌细胞 (SMC)、雪旺细胞 (Schwann)、淋巴管内皮细胞 (LEC) 和未知细胞核(未知)。显示了每种细胞类型的细胞核数量(右)。(b) UMAP 图显示了年轻和老年组中不同组织中的细胞核聚类。(c) 饼图显示了年轻和老年组中 LDM(左)和 PMM(右)中聚类的比例组成。(d) LDM 和 PMM 中所有细胞簇中上调和下调的 DEG 数量。(e) 通过SCENIC分析预测的年轻组和老年组所有细胞类型的转录因子(TF)活性热图。
04
衰老引起的肌细胞核异质性
在所有聚类中,肌细胞核占大多数。他们进一步对它们进行重新聚类,并鉴定出 8 个不同的亚聚类:I 型肌细胞核(表达Myh7)、IIa 型(Myh2)、IIx 型(Myh1)、肌腱连接点(MTJ、Col22a1)和 NMJ(Ache)(图 4a-b)。值得注意的是,IIb 型进一步分为三个亚聚类:IIb-1(Myh4)、IIb-2(Abca8a)和 IIb-3(Tnnc2)(图 4b)。标记基因功能富集分析表明,IIb-1 与骨骼肌发育有关,IIb-2 显著富集于磷脂酰肌醇介导的信号传导,IIb-3 富集于氧化磷酸化。
为了检查不同肌细胞核亚型随年龄变化的轨迹,他们使用 Monocle 3 进行了伪时间轨迹分析。Cytotrace 分析揭示了一条连续轨迹,从 IIb 型开始,发展到 IIx 型和 IIa 型,最后到 I 型(图 4c)。有趣的是,IIb 型亚群遵循从 IIb-1 到 IIb-2 再到 IIb-3 的动态轨迹(图 4d)。然而,在老年组中,这一轨迹发生紊乱,没有从 IIb-1 到 IIb-3 的转变。这种紊乱伴随着 IIb-2 型和 IIb-3 型肌细胞核的显著减少,这表明衰老会削弱 IIb-1 型向 IIb3 型发展的动态轨迹(图 4d-e)。年轻和老年肌肉中标记基因的免疫染色证实了它们在肌纤维中的表达。 IIb-1 型肌细胞核的比例保持不变,而 IIb-2 型和 IIb-3 型肌细胞核明显下调,老年组平均荧光强度明显降低(图 4f-g)。
先前的研究已将高氧化磷酸化活性与线粒体稳态和防止骨骼肌衰退联系起来。然而,他们观察到 IIb-3 型肌细胞核中氧化磷酸化途径显著下调,包括Chchd10、Park7和Cox5a等关键基因,这些基因对于维持线粒体结构和功能至关重要(图 4h)。这些基因的突变与各种神经肌肉疾病有关。Tnnc2 与 Cox5a 的共免疫荧光染色证实了这一发现,老年组的 Cox5a(线粒体复合物 IV 的亚基)的平均强度显著降低(图 4i)。与这些结果一致,显著改变的基因的拟时间动力学显示,下调的模块 3 与肌肉系统过程有关,这表明氧化磷酸化下调导致肌肉功能衰退,特别是在衰老过程中的 IIb-3 型纤维中(图 4j-k)。
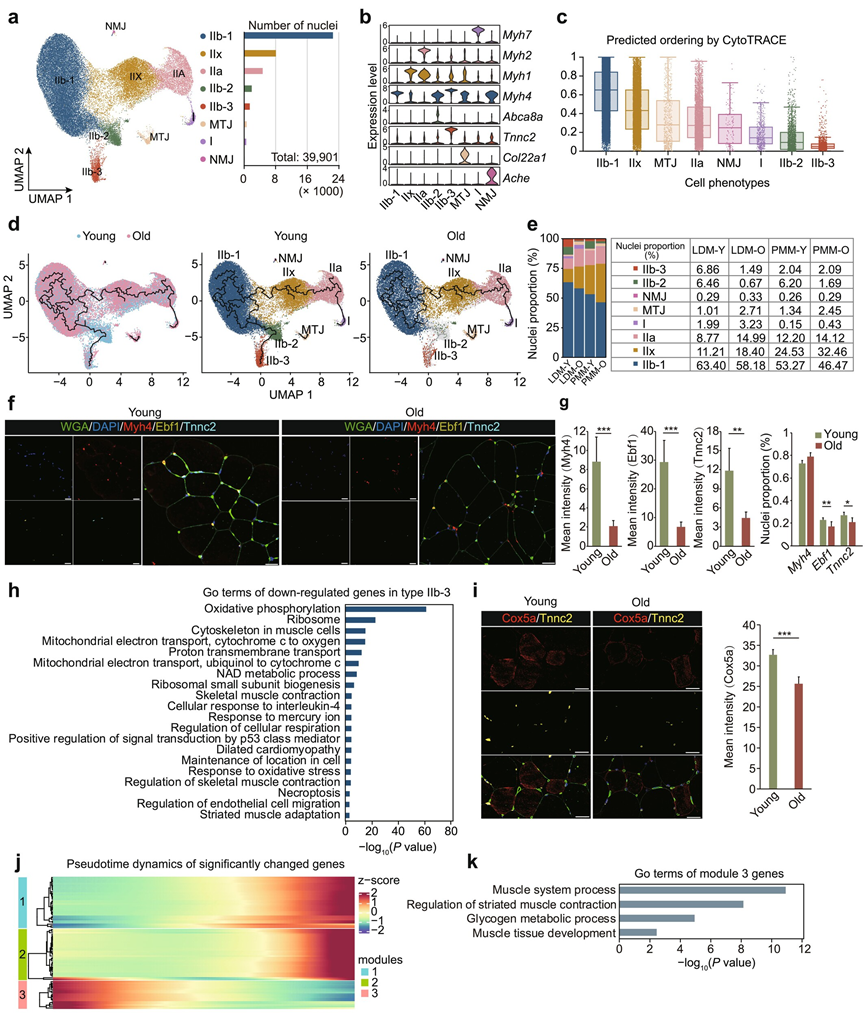
图4. 重新聚类和伪时间轨迹可识别肌细胞核的转录动力学。
(a) 年轻和老年骨骼肌中肌细胞核亚聚类的均匀流形近似和投影 (UMPA) 图(左)。每个亚聚类中的细胞核数(右)。(b) 小提琴图显示不同聚类中标记基因的表达。(c) 箱线图说明每种细胞类型的分化潜力得分(范围:0-1),其中得分越高表示分化潜力越大,分化状态越低。(d) 年轻组和老年组肌细胞核轨迹的 UMAP 可视化(左)。肌细胞核按亚型用颜色编码(中间和右)。(e) 年轻组和老年组中每个肌细胞核亚聚类的比例。(f) 年轻组和老年组中 IIb-1 型(Myh4)、IIb-2 型(Ebf1)和 IIb-3 型(Tnnc2)标记基因的代表性免疫染色图像。(g) 标记基因免疫荧光强度和细胞核比例。(h)通路分析。(i) 代表性免疫染色图像和荧光强度分析。(j) 显著改变的标记基因的基因表达动态伪时间热图。(k) 模块3中的GO分析和KEGG通路。
05
衰老过程中非肌肉细胞核的转录变化
多种非肌细胞核细胞群构成了骨骼肌微环境。为了探索非肌细胞核细胞在衰老肌肉微环境中的作用,他们将主要的细胞类型(包括脂肪细胞、FAP、免疫细胞和MuSC)划分为不同的亚型。
脂肪细胞可细分为三个不同的亚群:脂肪细胞1,与脂质稳态相关(Fasn阳性);脂肪细胞2,与细胞粘附相关(Bcl2阳性);脂肪细胞3,参与能量代谢和产热(Ucp1阳性)(图 5a)。轨迹分析表明脂肪细胞具有高度可塑性,脂肪细胞1作为动态轨迹的起点,分支为脂肪细胞2和脂肪细胞3(图 5b)。免疫荧光染色证实了细胞核比例的变化,显示老年组Abca8显著下调,而Bcl2和Ucp1显著上调。 GSEA 分析显示出一致的结果,衰老诱导脂肪细胞 2 中黏附连接和自噬途径上调,而脂肪酸代谢和 PPAR 信号通路在脂肪细胞 3 中富集。基于伪时间动态表达模式,下调的模块 2 与肌肉系统过程有关,而模块 3 与细胞粘附、凋亡和脂质积累有关。转录因子活性评分将所有脂肪细胞分为预期的亚型(图 5c)。不同的转录因子在每个亚型中表现出高活性。在脂肪细胞 1 中,与脂肪细胞发育(Nr4a1)和肌纤维成熟(Bhlhe41、Maf、Myf6)相关的转录因子的活性在老年组中增强。在脂肪细胞2中,与神经退行性疾病、2型糖尿病和癌症相关的转录因子(Ctcfl、Etv3、Atf4、Zmiz1、Sp3)在老年组中活性降低(图 5c)。在脂肪细胞3中,与棕色脂肪形成相关的转录因子(Gata6、Deaf1)在老年组中活性增加(图 5c)。这些发现表明脂肪细胞表现出很强的可塑性。随着衰老,脂质合成和代谢相关的脂肪细胞1转变为脂肪细胞2,其特征是细胞粘附途径增强,以及与神经退行性疾病相关的转录因子上调。
FAP 是位于骨骼肌间质区域的间充质祖细胞,在肌肉维持、再生和生长中起着关键作用。其中最丰富的亚型是Lum+ FAP 和Fbn1+ FAP,这与之前在小鼠股四头肌和膈肌中的发现一致。根据标记基因表达,FAP 可分为四种亚型:Tenm2+ FAP、肌成纤维细胞、Fbn1+ FAP 和Lum + FAP(图 5d)。轨迹分析显示,在正常肌肉中,连续的轨迹从Fbn1 + FAP 延伸到Lum + FAP,远端形成两个分支,分别分化为Tenm2+ FAP 和肌成纤维细胞。在衰老过程中未观察到核比例的显著变化(图 5d)。转录因子活性谱与聚类结果一致,证实了这些分类(图 5e)。标记基因的免疫荧光染色基本保持不变,除了Fbn1,它在老年组中显著上调。然而,DEG 的功能富集分析揭示了肌肉组织发育、ECM 组织和细胞形态发生等途径的改变,主要在Lum + FAP 和Fbn1+ FAP 中富集(图 5f)。这些发现表明,作为维持肌肉结构和功能的关键成分,Lum +和Fbn1+ FAP 在衰老过程中会发生更明显的变化。过多的ECM积聚引起的纤维化会导致肌肉衰竭和组织功能障碍,最终导致死亡。因此,Lum+和Fbn1 +FAP可能在与年龄相关的肌肉病理中发挥潜在作用。
免疫细胞的重新聚类鉴定出 8 个不同的亚群,包括 4 种巨噬细胞亚型:血管周样巨噬细胞 (PVM)、非血管周样巨噬细胞 (NPVM)、增生性巨噬细胞 (PM) 和调节性巨噬细胞 (RM)(图 5g)。其余 4 个亚群注释为 B 细胞、T 细胞、树突状细胞 (DC) 和肥大细胞(图 5g)。巨噬细胞是骨骼肌中的主要免疫细胞,其 NPVM、PVM 和 RM 数量有所下降(图 5g)。虽然发生了这些变化,但标记基因的免疫荧光染色强度基本保持不变。值得注意的是,PVM 和 NPVM 的 DEG 分析显示免疫反应激活途径显著富集。转录因子活性分析支持该分类,在每个聚类中都鉴定出不同的转录因子。E2f1和E2f2是细胞周期的关键调节因子,在 PM 中表现出独特的激活(图 5h)。有趣的是,几种转录因子——包括Zfp46、Foxc1、Foxo1、Meis1、Hoxa7、Tbx15、Myog和Tfap4——在老年组的所有细胞类型中都受到抑制(图 5h)。功能富集分析显示,靶基因在肌肉系统过程中显著富集,这表明衰老过程中免疫细胞的转录变化可能影响骨骼肌的功能和维持(图 5i)。
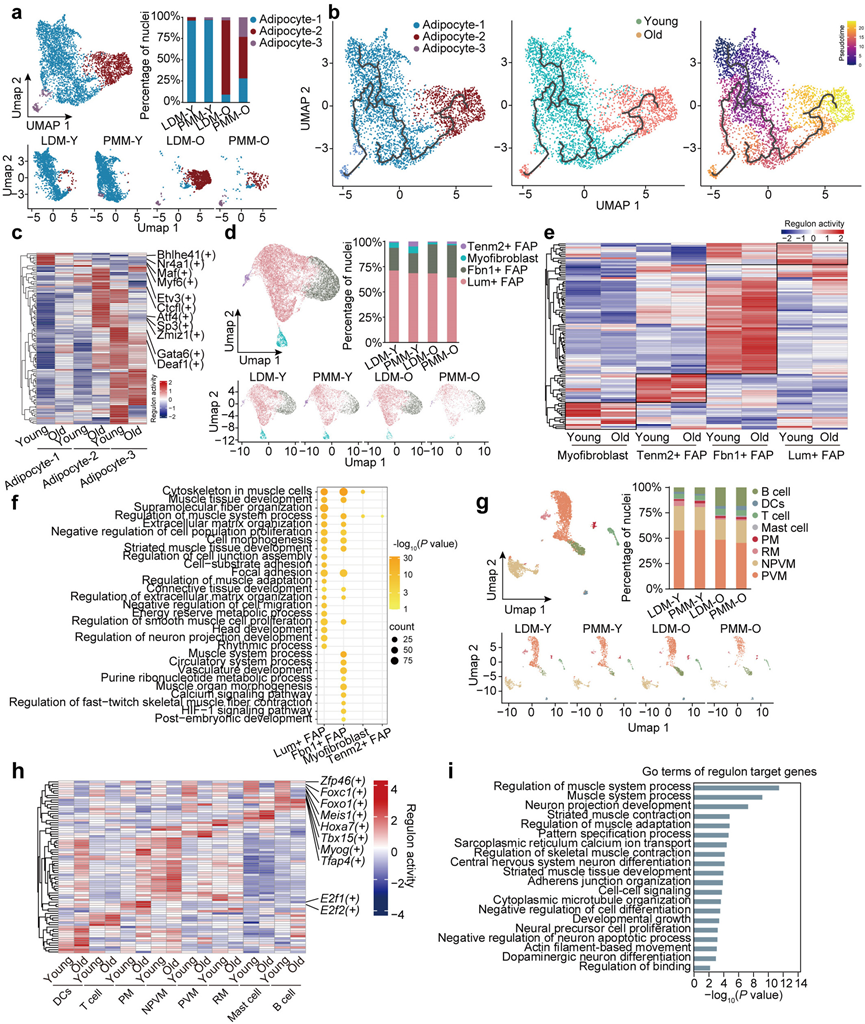
图5. 重新聚类揭示了非肌肉细胞核的转录动力学。
(a) 年轻和老年骨骼肌脂肪细胞亚簇的 UMAP 图(左上)。不同组中每个脂肪细胞亚聚类的比例(右上)。UMAP 图可视化了年轻和老年组中不同组织的细胞核聚类(下图)。(b) UMAP 显示从年轻和老年组中获得的脂肪细胞亚聚类的轨迹(左)。细胞核根据组(中间)和伪时间(右)着色。(c) 通过 SCENIC 分析预测的年轻和老年组中脂肪细胞亚聚类的转录因子 (TF) 基因活性热图。(d) 年轻和老年骨骼肌 FAP 亚聚类的 UMAP 图(左上)。显示不同组中每个 FAP 亚聚类的比例(右上)。UMAP 图可视化了年轻和老年组中不同组织的细胞核聚类(下图)。(e) 通过对年轻和年老群体的 FAP 亚聚类进行 SCENIC 分析预测的 TF 基因活性热图。(f) GO 分析和 KEGG 通路的点图。(g) 年轻和年老骨骼肌免疫细胞亚簇的 UMAP 图(左上)。显示了不同组中每个免疫细胞亚聚类的比例(右上)。UMAP 图可视化了年轻和年老群体中不同组织的细胞核聚类(下)。(h) 通过对年轻和年老群体的免疫细胞亚聚类进行 SCENIC 分析预测的 TF 基因活性热图。(i) GO 分析和 KEGG 通路分析。
06
EGF/EGFR信号通路介导细胞衰老过程中的炎症
骨骼肌作为内分泌器官,能够产生和分泌各种细胞因子。为了研究骨骼肌微环境内的细胞间串扰如何受到衰老的影响,使用 CellChat 分析了由配体-受体相互作用介导的细胞间通讯模式。总体而言,配体-受体相互作用主要涉及单核细胞,而非肌纤维(图 6)。例如,在老年组中,脂肪细胞分泌 IGF1 配体及其与其他细胞类型上IGF1R受体的相互作用增强,这种相互作用先前已证实与脂肪细胞分化的诱导有关。
随着年龄的增长,相互作用的总数增加,特别是在肌细胞核中,相互作用的百分比增加了近四倍,表明老年骨骼肌中的细胞间通讯更为密切。与年轻组相比,老年肌细胞核中EGF 配体和EGFR受体之间的相互作用显著增加(图 6b)。研究表明,EGF 是 EGFR 的主要配体,EGFR 激活可诱导细胞衰老,同时通过 Ras 信号通路促进炎症细胞因子的分泌。这与在组织水平观察到的炎症通路的上调相一致。这些研究结果表明,衰老会增强肌细胞核中 EGF 的分泌,EGF 与分布在其他细胞类型表面的跨膜受体 EGFR 相互作用,从而诱导组织中炎症细胞因子的表达。
为了验证衰老肌纤维中EGF表达的变化,用485 μM H2 O2处理C2C12细胞,建立细胞衰老模型。与对照组相比,H2 O2处理组细胞分化减少,肌管形成减少。定量结果显示,H2 O2处理组中Egf、Cdkn1a、Il-1b和Il-6显著上调,而Egfr保持不变(图 6c)。这些结果证实了衰老模型的成功建立以及Egf和炎症标志物的上调。Cdkn1a和Il-1b的表达水平在50 nM EGF时最高。与对照组相比, Cdkn1a和Il-1b的表达几乎翻倍,表明50 nM EGF显著诱导C2C11细胞衰老。
使用小分子 EGFR 抑制剂吉非替尼研究 EGF 与 EGFR 之间的相互作用。与对照组相比,单独添加 EGF 显著上调Cdkn1a,Il-1b和Il-6基因表达(图 6e)。然而,当同时添加 EGF 和吉非替尼时,这种上调受到显著抑制(图 6e)。有趣的是,与对照组相比, 单独添加吉非替尼导致Il-1b表达显著下调(图6e)。此外,对成肌因子Myog进行了定量,显示出与炎症标志物相反的趋势。单独使用 EGF 显著抑制Myog表达,而同时添加 EGF 和吉非替尼显著增加Myog表达(图 S11d)。这些结果表明,EGF不仅通过EGFR信号通路调节炎症反应,还可能影响肌肉生长因子的表达。
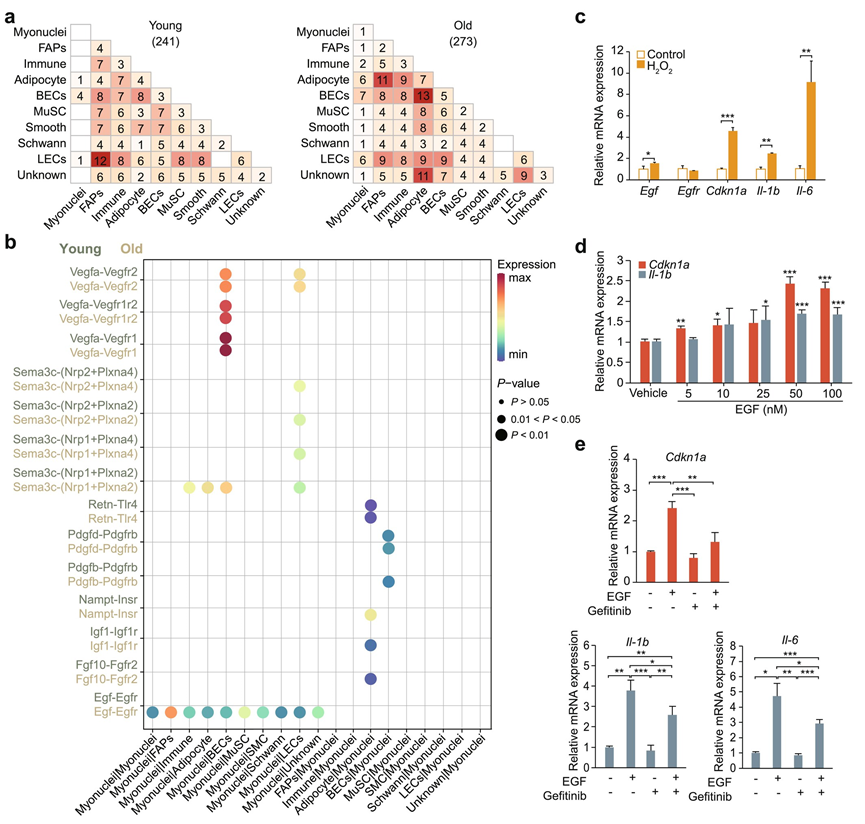
图6. 分析了肌细胞核与其他细胞类型之间的潜在配体-受体相互作用。
(a) 热图显示年轻(左)组和老年(右)组之间的种群间通讯次数。(b) 配体-受体对在年轻组和老年组之间显示出特异性的显著变化。(c) 通过 qRT-PCR 验证Egf、Egfr、Cdkn1a、Il-1b和Il-6的相对表达。(d) 通过 qRT-PCR 验证了用不同浓度的 EGF 处理 3 天的细胞中炎症(Cdkn1a)和衰老(Il-1b)标志基因的相对表达。(e) 通过 qRT-PCR 验证对照组和用 EGF、吉非替尼或两者治疗后Cdkn1a、Il-1b和Il-6的相对表达。
+ + + + + + + + + + +
结 论
本研究构建了11块骨骼肌的转录图谱,这些骨骼肌来自年轻和老年小鼠,具有广泛的转录多样性。与年龄相关的基因表达变化呈现出不同的组织特异性模式,涉及肌肉疾病和代谢过程。值得注意的是,与其他骨骼肌相比,富含线粒体的比目鱼肌表现出更优异的抗衰老能力。此外,本研究还构建了代表性骨骼肌的单核转录组图谱,分析了73170个细胞核,发现不同骨骼肌的细胞组成发生了与年龄相关的变化,并且老年小鼠出现了新的细胞状态。在不同类型的肌细胞核中,II型肌细胞核对衰老表现出特殊的敏感性,IIb型肌细胞核的代谢活性随着年龄的增长而降低。非肌肉细胞核群体(包括脂肪细胞、成纤维脂肪祖细胞和免疫细胞)中发生了细胞特异性变化,从而加速了肌肉衰老及其相关病理。细胞间通讯分析显示,衰老骨骼肌中的细胞间相互作用更为密切,尤其是在肌细胞核与其他细胞类型之间。具体而言,本研究验证了EGF/EGFR轴在年龄相关炎症过程中的调控作用。这些发现有助于深入了解肌肉生物学和衰老机制,并揭示了年龄相关肌肉疾病的潜在治疗靶点
+ + + + +



 English
English


