文献解读|Science(44.7):JAK 抑制和 PD-1 免疫治疗联合治疗非小细胞肺癌患者
✦ +
+
论文ID
原名:Combined JAK inhibition and PD-1 immunotherapy for non–small cell lung cancer patients
译名:JAK 抑制和 PD-1 免疫治疗联合治疗非小细胞肺癌患者
期刊:Science
影响因子:44.7
发表时间:2024.06.21
DOI号:10.1126/science.adf1329
背 景
炎症是癌症的一个特征,但也是产生最佳抗肿瘤免疫反应的必要条件。虽然短时间接触干扰素 (IFN) 等细胞因子可以增强肿瘤免疫力,但长时间接触会导致免疫抑制。炎症的双重性质使得在癌症免疫治疗期间利用细胞因子激活的有益作用同时避免有害后果变得具有挑战性。因此,有效调节这些通常相互对立的细胞因子信号传导功能的治疗策略可以提高免疫治疗效果并减轻耐药性的产生。
实验设计
结 果
01
延迟施用 JAKi 可改变增殖的 CD8 T 细胞并改善小鼠的检查点阻断免疫疗法
已有研究证明,在小鼠模型中,在开始免疫检查点阻断 (ICB)后给予 JAK1 和 2 抑制剂 (JAKi) (ruxolitinib) 可使多种癌症类型的 ICB 耐药肿瘤重新敏感。为了检测 JAK1 选择性抑制剂伊替替尼是否能同样改善 ICB 反应,研究团队使用了 Res 499 肿瘤模型,这是一种源自 B16-F10 黑色素瘤的 ICB 耐药肿瘤。在开始 ICB 7 天后通过抗 PD-L1 加抗 CTLA4或单独使用抗 PD-1给予伊替替尼可改善肿瘤反应(图 1A-C)。由于 JAKi 除了可以抑制 IFN 之外,还可以抑制许多细胞因子信号通路,他们还比较了伊替替尼与抗 IFNAR1 的效果(图 1B)。该比较表明,抗 IFNAR1 在很大程度上表型复制了伊替替尼,这表明抑制 IFN-I 信号传导是发挥JAKi 效应的重要通路。
与 IFN-I 在 CD8 T 细胞功能障碍中的作用一致,在抗 PD-L1 加抗 CTLA4 中添加伊替替尼或抗 IFNAR1 后,CD8 T 细胞是改变最显著的白细胞之一。因此,他们专注于非幼稚 CD8 T 细胞,并系统评估了治疗小鼠的肿瘤、引流淋巴结 (dLN) 和脾脏的变化。通过流式细胞分析,非幼稚 CD8 T 细胞分为 12 个聚类(图 1D-E)。为了富集治疗相关的 CD8 T 细胞,他们接下来将分析限制在 Ki67 +增殖细胞。这些 Ki67+增殖细胞在 dLN、脾脏和肿瘤之间呈现差异分布(图 1F)。他们重点关注属于聚类 5 和 11 的 Ki67 + CD8 T 细胞,因为这两个聚类在 JAKi 加 ICB 与单独 ICB 相比在 dLN 中发生了显著或接近显著的变化,且效应大小最大。聚类5 由表达 TCF1、Ly108、低或中等 PD-1 和 TOX 以及混合表达 CX3CR1 的 CD8 T 细胞组成,类似于记忆前体和/或祖细胞样 CD8 T 细胞(TPRE/PROG)(图 1D-E)。聚类11 高表达 PD-1 和 TOX 以及 CX3CR1、KLRG1、Ki67 和 GZMB,与具有效应样特征的中间或循环耗竭 CD8 T 细胞亚群(PD-1hi TEX -INT)相一致。
作为 Ki67+细胞的一部分,当 JAKi 添加到 ICB 中时,dLN 中的TPRE/PROG 样聚类 5 细胞增加,脾脏中也有类似的趋势(图 1F)。同时,PD-1hi TEX -INT样聚类 11 细胞在周围呈减少趋势,但在肿瘤中按比例和每克肿瘤的细胞绝对数量均增加(图 1F)。JAKi 和 ICB 的组合也增加了每克肿瘤中非幼稚 CD8 T 细胞的总数。总之,这些临床前数据表明伊替替尼可提高以高 ISG 为特征的耐药肿瘤的 ICB 疗效,并通过拮抗 IFN-I 信号发挥作用。
受临床前发现的启发,他们启动了派姆单抗 (pembrolizumab) 和延迟伊替替尼治疗初治转移性 NSCLC(肿瘤 PD-L1 ≥50%)的 II 期临床试验。共 21 名患者接受了治疗和评估,以检测在派姆单抗中添加伊替替尼的疗效(图 1G)。患者首先接受两轮派姆单抗治疗,然后接受两轮伊替替尼和派姆单抗治疗(从第 3 和第 4 轮开始)。在第 5 轮开始时,患者继续使用派姆单抗,不使用伊替替尼,直至病情进展。在派姆单抗的前两轮治疗(第 6 周,第 3 轮)后进行影像学检查,然后在伊替替尼治疗后(第 12 周,第 5 轮)进行影像学检查。客观缓解率 (ORR) 定义为第 12 周扫描中完全缓解(CR)或部分缓解 (PR)的可评估患者比例,最佳总体缓解 (BOR) 定义为任何时间的最佳缓解,包括 12 周后的额外随访。
12 周 ORR 为 62%,12 周后额外随访的 BOR 为 67%(图 1H)。只有一名患者的疾病进展为 BOR。中位随访时间为 27.6 个月后,中位 PFS 为 23.8 个月,中位缓解持续时间 (DOR) 尚未达到(图 1I)。
除了 12 周反应评估外,他们还评估了 6 周时的反应。该分析显示,5 名患者在添加伊替替尼之前对派姆单抗有早期(第 1 和第 2 周期)放射学反应。相比之下,8 名患者在初始派姆单抗治疗后无反应或肿瘤生长,但在伊替替尼治疗后第 12 周(第 3 和第 4 周期)有反应。根据这些反应模式(图 1J-K),他们将患者分为 6 周抗 PD-1 反应者 (αPD1.R)、12 周伊替替尼后反应者 (JAKi.R) 或 12 周无反应者 (NR)。这三个缓解组具有相似的临床病理学特征,但按这些组分层的 PFS 预计不同(图 1I)。总之,这些发现表明,在抗 PD-1 后延迟给予伊替替尼可使肿瘤 PD-L1 ≥50% 的 NSCLC 患者获得高缓解率和持久缓解。在具有临床益处的患者中,一些患者在抗 PD-1 后早期缓解,而其他患者仅在抗 PD-1 中添加 JAKi 后才客观缓解,只有一名患者的疾病进展为 BOR。
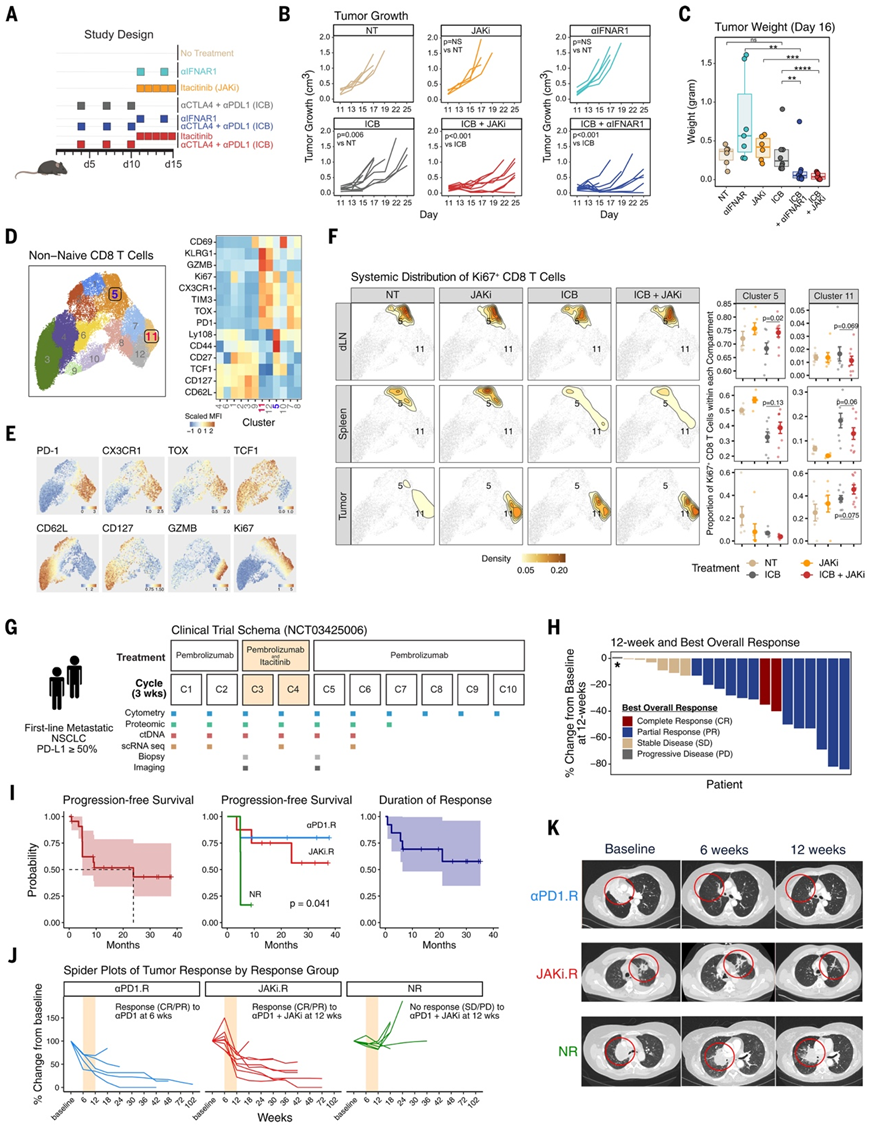
图1. 抗 PD-1 免疫疗法和 JAK1 抑制剂治疗 NSCLC 的临床前和 2 期临床试验结果。
(A) 对于具有耐药性 B16 衍生的 Res 499 肿瘤的小鼠,采用 ICB 加伊替替尼、JAK1 抑制剂 (JAKi) 或抗 IFNAR1 抗体 (αIFNAR1) 的临床前治疗方案。(B) 小鼠肿瘤生长曲线。(C) 小鼠肿瘤在指定治疗后第 16 天的重量。(D) 来自 Res 499 小鼠肿瘤、引流淋巴结 (dLN) 和脾脏的非幼稚 CD8 T 细胞的流式细胞特征投影在 UMAP 空间上。显示 12 个 FlowSOM 聚类(左) 以及按层次聚类排列的所有标记蛋白的缩放中值荧光强度 (MFI) 热图(右)。(E) 选定蛋白质标记的 MFI 表达叠加在聚类均匀流形近似和投影 (UMAP) 上。(F) 在 dLN、脾脏和肿瘤中所有 Ki67 + CD8 T 细胞的全身分布比较(左),与 (D) 的 UMAP 叠加(浅灰色点)。聚类5 和 11 的位置标记在密度图叠加层上。还显示了属于聚类 5 或 11 的细胞在每个组织区室中的相对频率(右)。(G) 针对肿瘤 PD-L1 ≥50% 的一线转移性 NSCLC 的派姆单抗和延迟给予伊替替尼的 II 期临床试验示意图。(H) 每位患者 12 周肿瘤反应的瀑布图。(I) 生存曲线。(J) 蜘蛛图表示每个反应组患者的肿瘤测量值相对于基线的变化。(K) αPD1.R、JAKi.R 和 NR 在基线、6 周和 12 周时的代表性计算机断层扫描 (CT)。
02
JAKi 调节增殖的 CD8 T 细胞亚群组成
在接受 1 至 2 个周期的抗 PD-1 治疗后,71%(7 名患者中的 5 名)的 CD8 T 细胞增殖爆发低于 1.5 倍阈值的患者病情出现进展(图 2A)。在抗 PD-1 加 JAKi 试验中也观察到了这种在接受 1 至 2 个周期的抗 PD-1 治疗后的早期增殖爆发;然而,相比之下,9 名低于 1.5 倍阈值的可分析患者中均未出现病情进展(图 2B)。所有患者的平均情况是,在 JAKi 治疗期后观察到第二次 CD8 T 细胞增殖爆发(图 2B),但在持续抗 PD-1 单药治疗中很少观察到。因此,尽管某些患者缺乏针对抗 PD-1 的早期 CD8 T 细胞反应,但可以观察到临床反应和 JAKi 后 CD8 T 细胞增殖爆发,这表明当延迟 JAKi 添加到抗 PD-1 免疫疗法中时可能产生临床和免疫效果。
治疗期间 Ki67 +、CD127 +和 CXCR5 + CD8 T 细胞频率的时间变化也显示出不同反应组的显著差异(图 2C )。例如,在初始抗 PD-1 后,除 JAKi.R 患者外,所有反应组均观察到Ki67 + CD8 T 细胞的增加。相反,CXCR5 +和 CD127 + CD8 T 细胞的增加仅在 JAKi.R 患者中观察到,并且发生在同时使用 JAKi 和抗 PD-1(第 4 个周期)的窗口期间。在 JAKi.R 患者中观察到的这种增加随后是 KI67 + CD8 T 细胞在 JAKi 后增加。因此,表达 Ki67、PD-1、CXCR5 和/或 CD127 的 CD8 T 细胞的变化区分了 JAKi 治疗的效果和患者反应。
为了定量治疗期间 Ki67 + CD8 T 细胞组成的变化,他们首先从非幼稚外周 CD8 T 细胞中定义了 T 细胞状态。无偏聚类分析显示循环 CD8 T 细胞有 12 个聚类(图 2D)。聚类12 由 Ki67 + PD-1 hi CD39 + CD8 T 细胞组成,这些细胞类似于血液中可检测到的已知 T EX中间体群(表示为 PD-1 hi T EX-INT 样Cl.12)。PD-1 hi T EX-INT 样Cl.12 细胞占对治疗有反应的 Ki67 + CD8 T 细胞的大部分,还有一小部分 Ki67+CD127+ TEFF/MEM 样Cl.1+2 细胞,而这些细胞大多不增殖(图 2E)。治疗期间,这两个群体的Ki67 + CD8 T 细胞组成动态变化方向相反。在 JAKi.R 患者中,增殖的 CD127 + TEFF/MEM 样Cl.1+2 细胞比例增加,而 Ki67+PD-1 hi T EX-INT 样Cl.12 细胞比例在 JAKi 窗口期内减少(图 2E)。此外,JAKi 窗口期内增殖的 Ki67 + CD8 T 细胞的这种相互组成变化也与 PD-1 +CXCR5+ T PRE/PROG 样Cl.7 群体(图2E)。轨迹分析预测了将 PD-1 + CXCR5 + T PRE/PROG 样Cl.7 细胞与 CD127 + T EFF/MEM样Cl.1+2 和 PD-1 hi T EX-INT 样Cl.12 群体连接起来的分化路径(图2F)。
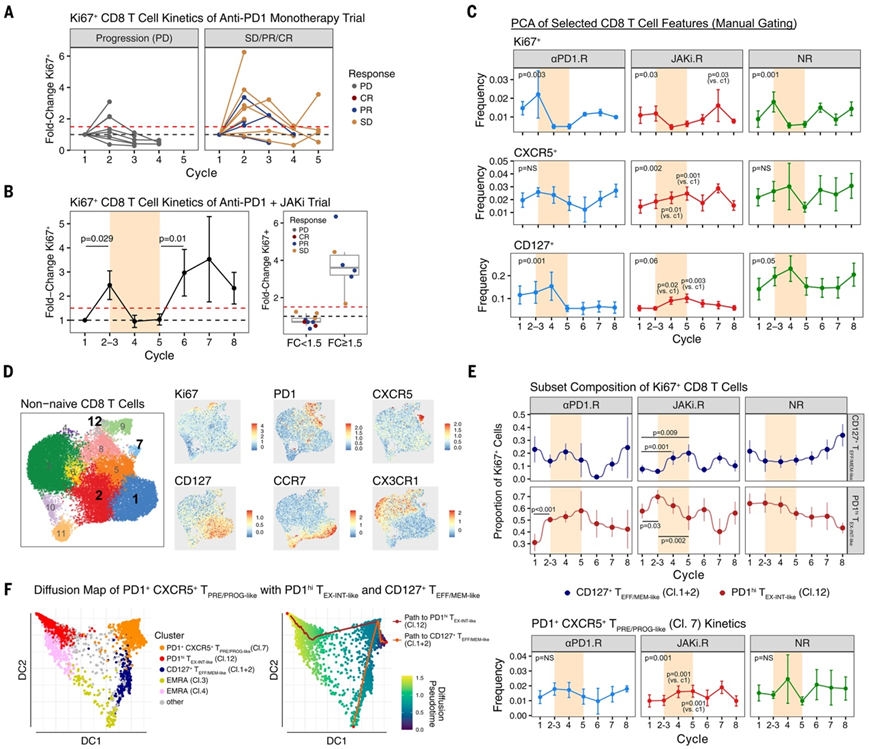
图2. 抗 PD-1 免疫疗法或 JAK 抑制后的患者反应与 CD8 T 细胞的纵向变化相关。
(A) 接受抗 PD-1 单药治疗的一组 NSCLC 患者中Ki67 + CD8 T细胞百分比的差异倍数。 (B) (左) 在抗 PD-1 + JAKi 临床试验(本研究)中接受治疗的所有可分析患者的 Ki67+ CD8 T 细胞百分比的差异倍数 (FC)。(右)按抗 PD-1 第 1 和第 2 个周期后 Ki67+ CD8 T 细胞 1.5 倍阈值变化状态分组的患者反应。(C) 治疗周期内Ki67+、CXCR5+和 CD127 + CD8 T 细胞频率的变化。(D) 通过流式细胞分析外周非幼稚 CD8 T 细胞的 UMAP 和聚类分配(左)以及指示标记蛋白的 MFI 值叠加(右)。(E) Ki67 + CD8 T 细胞的比例和PD-1 + CXCR5+ TPRE/PROG 样细胞的频率。(F)轨迹分析。
03
JAK 抑制后,祖细胞样、效应记忆和耗竭 CD8 T 细胞克隆型协调变化
由于幼稚 T 细胞大多具有独特的 T 细胞受体 (TCR),因此具有相同 TCR(克隆型)的 T 细胞在发育上是相关的。因此,为了更直接地分析 JAKi 对 T 细胞发育关系的影响,他们在基线(第 1 周期开始)、抗 PD-1 治疗后(第 2 周期开始)、同时进行 JAKi和抗 PD-1 治疗期间(第 4 周期开始)以及恢复抗 PD-1 单药治疗后(第 6 周期开始)对每个临床反应组的患者进行了单细胞转录组分析和T细胞受体测序 (scRNA-seq/scTCR-seq)。创建了 40 个样本的参考 CD8 T 细胞图谱,该图谱由 13 个聚类组成,这些聚类通过关键基因的表达和 CD8 T 细胞图谱基因集的富集进行注释(图3A-C)。
在本研究中,CXCR5.Tem和Exh.Prog基因组富集在pre.prog的聚类中。这个pre.prog聚类还高表达TCF7、CXCR5、GZMK、EOMES、IFIT1以及多个表征先前描述的 TEX祖细胞的基因(图3B)。该pre.prog聚类可能捕获了流式细胞鉴定出的命运灵活的 PD-1+ CXCR5+ TPRE/PROG 样Cl.7 细胞,不表达 CXCR5 转录本或蛋白质的细胞也包含在该聚类中(图 2D)。使用EMRA基因集鉴定出其他功能失调和/或终末 CD8 T 细胞亚型,包括两种 EMRA 亚型(emra和emra.nk),其中emra.nk表达高水平的自然杀伤 (NK) 受体。
他们从 124534 个 CD8 T 细胞中鉴定出 5867 种不同的克隆型。属于pre.prog、exh和em.cd127聚类的克隆型的累积频率变化近似于通过流式细胞鉴定的 PD-1+CXCR5+TPRE/PROG 样 Cl.7、PD-1hi TEX-INT样 Cl.12 和 CD127+ TEFF/MEM样 Cl.1+2 群体观察到的关键模式(图3D-E)。JAKi.R 患者在抗 PD-1 治疗后第 2 周期的exh反应减弱,而 JAKi 治疗第 4 周期期间pre.prog和em.cd127克隆型增加。这种模式之后是 JAKi 后exh克隆型的增加,这可能与 JAKi.R 患者的晚期 CD8 T 细胞增殖爆发相对应(图 2C)。
为了开始评估 PD-1 + CXCR5 + T PRE/PROG 样、CD127 + T EFF/MEM 样和 PD-1 hi T EX-INT 样CD8 T 细胞之间的发育关系是否会受到 JAKi 影响,他们检测了这些群体之间的克隆型扩增和 TCR。在将 JAKi 与抗 PD-1 联合使用后有反应的 JAKi.R 患者中,JAKi 不仅导致pre.prog克隆型频率增加,而且还导致克隆性增加(克隆多样性降低),而这在其他患者反应组中并未观察到(图3F)。
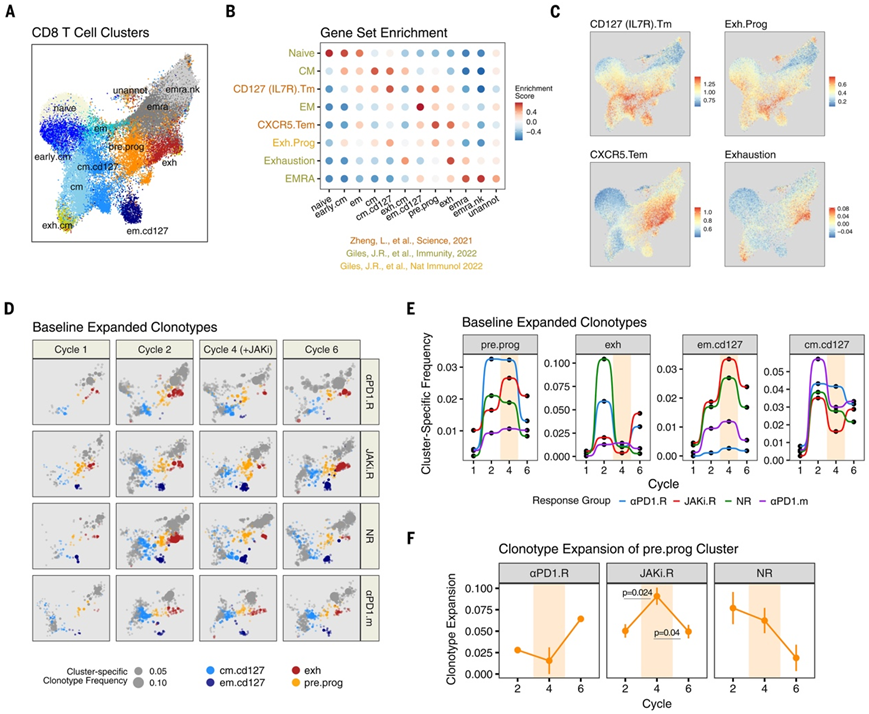
图3. 抗 PD-1 免疫疗法和 JAK 抑制后 CD8 T 细胞克隆型的演变与治疗和反应相关。
(A)UMAP可视化。(B) 使用指示的 CD8 T 细胞亚型基因集(y轴)的每个 CD8 T 细胞聚类的基因集变异分析 (GSVA) 富集分数(x轴)。(C) 选定基因集的富集分数叠加在 (A) 的 UMAP 上。(D) UMAP 显示属于指示的颜色编码的 CD8 T 细胞亚型的克隆型的频率 (扩增)。(E) 属于所示 CD8 T 细胞亚型的扩增 TCR 克隆型的累积频率。(F) 来自每个所示反应组的pre.prog CD8 T 细胞的克隆型扩增分数。
04
JAK 抑制后患者的反应与具有命运灵活特征的 CD8 T 细胞克隆型扩增有关
克隆性的增加表明pre.prog群体的扩增可能是由抗原驱动的,而不是稳态增殖或选择性生存的结果。为了研究 JAKi 期间pre.prog克隆型的扩增以及其他克隆型频率的增加是否可能归因于发育关系,他们使用了成对转换指数 (pTrans-index)来检测两种 T 细胞状态之间 TCR 共有的程度。该分析表明,pre.prog CD8 T 细胞与多种不同亚型具有高度的发育相关性(图 4A),这与pre.prog具有命运灵活的特性相一致。在 JAKi.R 患者中,在第 4 周期添加 JAKi 后, pre.prog细胞与em.cd127或cm.cd127 (Path.Cd127)之间的 TCR 共有程度增加,但在其他患者反应组中没有增加(图 4B-C)。同时,从pre.prog到exh或 EMRA 亚型 (Path.Exh.EMRA)的 pTrans 指数在 JAKi 治疗后也增加,但在第 6 个周期时 JAKi 治疗后降低。在 αPD1.R 或 NR 患者或接受抗 PD-1 单药治疗的患者中未观察到 pTrans 指数的显著变化。因此,这些发现表明,在 JAKi.R 患者中,在添加 JAKi 时命运灵活的pre.prog CD8 T 细胞会发生特定扩增,从而导致克隆性和频率增加。在 JAKi 治疗期间,这些pre.prog克隆型在发育上与em.cd127克隆的扩增有关,但也同时产生了exh细胞。这些影响与 JAKi 阻碍 IFN-I 信号传导的已知功能(驱动祖细胞向下游 TEX亚群分化)相一致。
JAKi 影响祖细胞 CD8 T 细胞分化平衡的能力预计在将 JAKi 添加到抗 PD-1 后对单个 CD8 T 细胞克隆型的命运产生广泛影响。这种影响会导致单个克隆型的亚型组成发生变化,包括更多非终端和非耗竭的 T 细胞状态。为了检验这一假设,他们使用 pTrans 指数得出每个 CD8 T 细胞亚型的可塑性评分 (PS)。在这种情况下,如果与其他亚型和 T 细胞状态的 TCR 相对均匀,则亚型具有较高的 PS,如果共有仅限于少数亚型或状态,则亚型具有较低的 PS(图 4D)。克隆型 PS(PS clono)是所有对克隆型组成有贡献的 T 细胞亚型的 PS 值的平均值。对于从非幼稚 CD8 T 细胞扩增的每种克隆型,他们随后确定了第 2、4 和 6 个周期开始时与基线相比的PS克隆的变化(∆PSclono)。该分析显示,在 JAKi.R 患者中,JAKi 第 4 个周期期间和 JAKi 后第 6 个周期期间,多种克隆型的∆PSclono增加(图4E-F)。
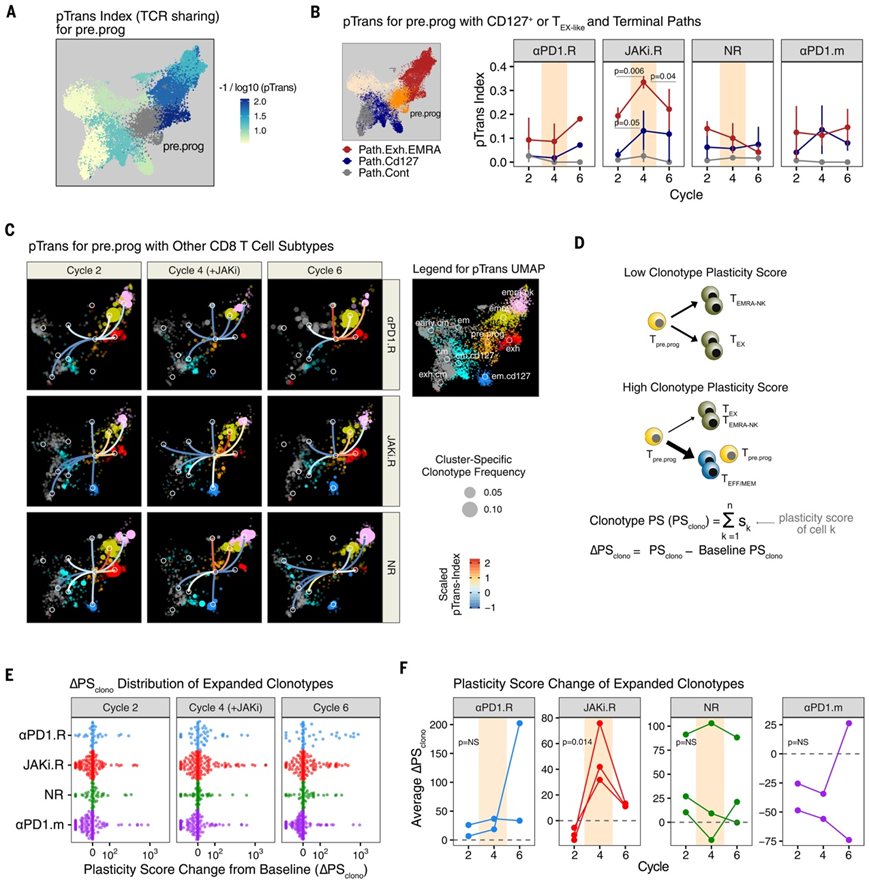
图4. JAK 抑制和抗 PD-1 免疫疗法联合治疗的反应与 CD8 T 细胞分化动力学和克隆型可塑性的改变有关。
(A) UMAP 上叠加了从pre.prog亚型到其他亚型的成对转换 (pTrans) 指数值。(B) pre.prog CD8 T 细胞与exh和终端 EMRA(emra、emra.nk)聚类(Path.Exh.EMRA,红色)或em.cd127和cm.cd127聚类(Path.Cd127,蓝色)之间的 pTrans 指数值。(C) pre.prog亚型与其他亚型(右边距中的图例)之间的 pTrans 指数值叠加在按治疗周期和反应组划分的扩增 CD8 T 细胞克隆型的 UMAP 。(D)图解和推导。(E) 所有扩增克隆的 ∆PS克隆按反应组着色并按治疗周期分布。(F) 每个指示反应组患者的平均 ∆PSclono。
05
抗 PD-1 免疫疗法和 JAK 抑制疗法无效与持续性炎症有关
与对抗 PD-1 和 JAKi 有反应的患者相比,NR 患者的 CD8 T 细胞可塑性特征变化不大(图 4E-F),这表明 NR 患者可能至少部分对 JAK 抑制有抵抗力。为了验证这一观点,他们使用 Olink 分析了 92 种血浆蛋白,并使用 CytoSig 从免疫细胞的转录变化中推断出 43 种细胞因子信号通路(图 5A)。对于血浆蛋白分析,k均值聚类显示41 种差异表达蛋白具有四种不同的时间模式(Cy.kclust)(图 5B)。
与 αPD1.R 和 JAKi.R 患者的蛋白质表达相比,NR 患者的蛋白质表达,无论是按组平均还是在个别患者中,都大致符合Cy.kclust.1模式(图 5B)。NR患者的Cy.kclust.1蛋白表达在基线时高于其他组,在抗 PD-1 治疗后略有下降,但随后在 JAKi 窗口期间稳定增加(图 5C)。相比之下,JAKi.R 和 αPD1.R 患者中的大多数这些蛋白质都呈现出Cy.kclust.2模式(图 5B)。这些蛋白质在 αPD1.R 和 JAKi.R 患者中的基线表达并不高,在 JAKi 期间短暂下降然后上升,而是基线表达较低,在 JAKi 期间和之后进一步下降(图 5C)。因此,无反应者表现出一种特定的模式,即循环炎症和免疫调节蛋白的基线水平较高,平均而言在 JAKi 治疗期间和之后进一步上升。
为了研究持续升高的细胞因子如何影响免疫细胞中的信号传导,他们接下来评估了外周血单核细胞 (PBMC) 中信号通路的活性。正如预期的那样,该分析显示,在 JAKi 治疗后,已知使用 JAK(JAK1、2 和 3)的许多信号通路发生了显著改变。接下来,仅使用 JAKi 之前或之后反应组之间不同的信号通路(CytoSig 通路),他们再次应用k均值聚类来确定时间模式(CS.kclust)(图 5D)。在 NR 患者中,超过一半的信号通路属于CS.kclust.2(图 5D,右侧冲积图中的蓝色堆积条),其中包括 IFN-I 以及 IL-10 和 CSF1 等抑制性细胞因子通路。与循环炎症蛋白的表达类似, NR 患者的CS.kclust.2信号通路表现出较高的相对基线活性,与 αPD1.R 和 JAKi.R 患者的活性相比,在抗 PD-1 治疗时降低,但在 JAKi 治疗期间升高(图 5E)。相比之下,这些通路在 αPD1.R 患者中显示出CS.kclust.3模式,在 JAKi.R 患者中主要显示出CS.kclust.4模式(图 5D)。具体而言,在 αPD1.R 患者中,NR CS.kclust.2通路具有最低基线活性,在抗 PD-1 治疗后升高,然后在 JAKi 治疗期间降低。在 JAKi.R 患者中,抗 PD-1 治疗后的诱导并不明显,但在 JAKi 治疗后观察到(图 5E)。因此,NR 患者的特点不仅在于对 JAKi 有抵抗力的高炎症,而且在于免疫信号似乎不一致。
将来自 CD8 T 细胞的所有 43 个 CytoSig 信号通路评分与来自轨迹分析的伪时间值相关联,结果显示 IFN-I 和 IFN-γ (IFNG) 与exh和emra.nk终末分化 CD8 T 细胞状态的发展之间存在很强的正相关性(图 5F)。事实上,IFN-I 信号传导(以及 TGFB1)是少数几个在整个治疗周期内都存在显著变化并且因反应组而异的通路之一(图 5F-G)。
因此,在 αPD1.R 患者的emra.nk和exh CD8 T 细胞亚型中,抗 PD-1(第 2 周期)都会强烈诱导 ISG ,在 JAKi.R 患者中不一致地增加,但在 NR 患者中保持不变(图 5H)。 NR 患者 T EX-INT 样和 EMRA CD8 T 细胞亚型中这些持续升高的 ISG 模式与exh和emra.nk CD8 T 细胞中克隆性的增加相关(图5H),这提示这些群体中存在进行性终末分化。
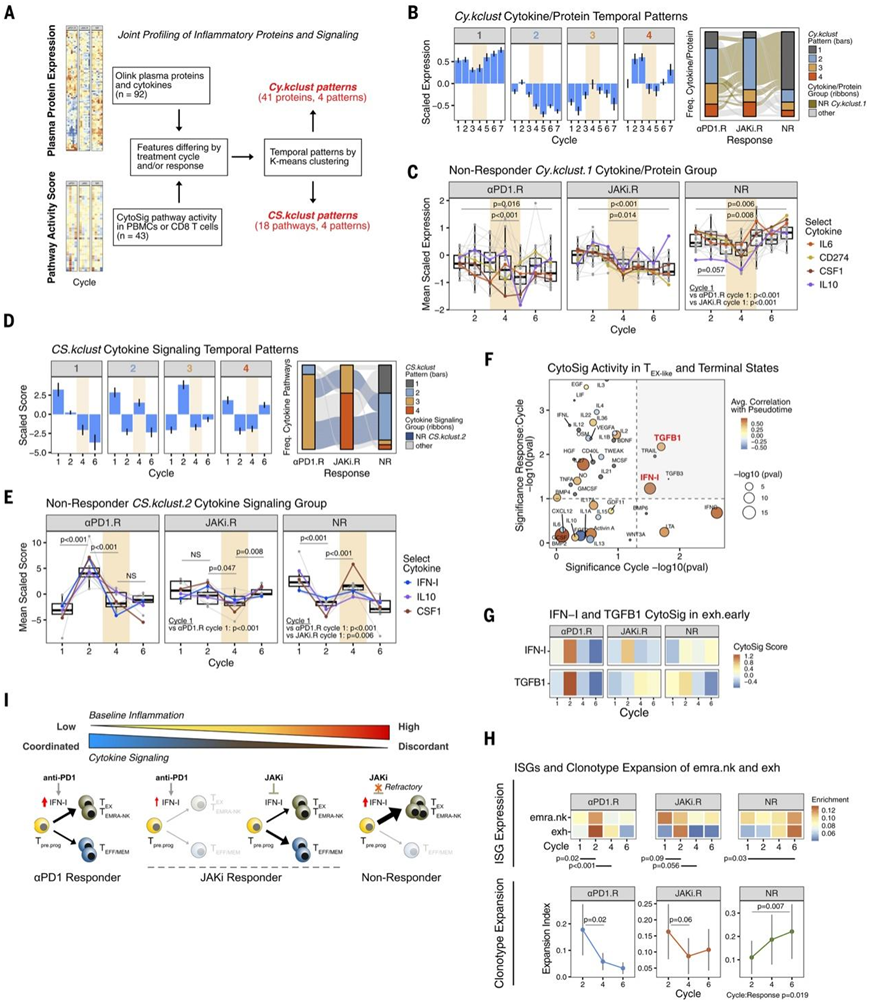
图5. JAK 抑制的抵抗性和持续性炎症与终末 CD8 T 细胞分化和治疗失败相关。
(A) 血浆细胞因子和免疫信号活性联合分析示意图及其按时间表达模式分类。(B) 血浆细胞因子/蛋白质 (Cy.kclust,左侧条形图) 的时间表达模式及其在每个反应组中的分布 (右侧冲积图)。 (C) 显示了所有反应组中 NR 患者的Cy.kclust.1模式的细胞因子/蛋白质的表达。(D) 免疫细胞中细胞因子信号传导或许的时间表达模式及其在每个反应组中的分布。(E) 显示了所有反应组的属于 NR 患者的CS.kclust.2模式的细胞因子通路活性评分。(F) 与 CD8 T 细胞分化、治疗周期和反应相关的细胞因子通路活性。(G) exh中 IFN-I 和 TGFB1 推断的 CytoSig 信号活性治疗周期内的 CD8 T 细胞。 (H) 治疗周期内每个反应组的终末exh和emra.nk亚型中的平均 ISG 表达,以及这些亚型的平均扩增指数(克隆性度量)。(I) 总结炎症、抗 PD-1 后免疫细胞中的细胞因子信号传导、IFN-I 对 CD8 T 细胞向终末或低承诺状态分化的影响以及 JAK 抑制的结果之间的关系的模型。
+ + + + + + + + + + +
结 论
本项研究表明,在抗 PD-1免疫疗法后使用 JAK1 抑制剂伊替替尼可改善小鼠的免疫功能和抗肿瘤反应,并在转移性非小细胞肺癌的 2 期临床试验中产生高反应率 (67%)。对初始抗 PD-1 免疫疗法无反应但在添加伊替替尼后有反应的患者具有多种对单独使用抗 PD-1 免疫功能较差的特征,这些特征在 JAK 抑制后得到改善。伊替替尼促进 CD8 T 细胞可塑性和耗竭和效应记忆样 T 细胞克隆型的治疗反应。对伊替替尼有抵抗力的持续性炎症患者表现出进行性 CD8 T 细胞终末分化和进行性疾病。因此,JAK 抑制可通过改变 T 细胞分化动力学来提高抗 PD-1 免疫疗法的疗效。
+ + + + +



 English
English


