文献解读|Cancer Discov(29.7):空间分析肿瘤生态系统和细胞状态在胃腺癌的进展和进化
✦ +
+
论文ID
原名:Spatially Resolved Tumor Ecosystems and Cell States in Gastric Adenocarcinoma Progression and Evolution
译名:空间分析肿瘤生态系统和细胞状态在胃腺癌的进展和进化
期刊:Cancer Discovery
影响因子:29.7
发表时间:2025.01.28
DOI号:10.1158/2159-8290.CD-24-0605
背 景
胃癌(GC) 是全球主要的健康问题,在全球癌症发病率和死亡率中排名第五(占所有癌症病例的4.8%;6.8%的癌症死亡)。胃癌在亚洲、中欧/东欧和南美洲的患病率较高,目前的许多治疗方法受到内在或获得性耐药的挑战,包括免疫疗法。癌症基因组图谱 (The Cancer genome Atlas,TCGA)将胃癌在组织学上分为弥漫型和肠型(Lauren分型),在分子上分为染色体不稳定型(CIN)、基因组稳定型(GS)、微卫星不稳定型(MSI)和EB病毒(EBV)阳性亚型。除了TCGA,其他胃癌分类方案也相继提出,凸显了精准肿瘤学面临的挑战。
实验设计
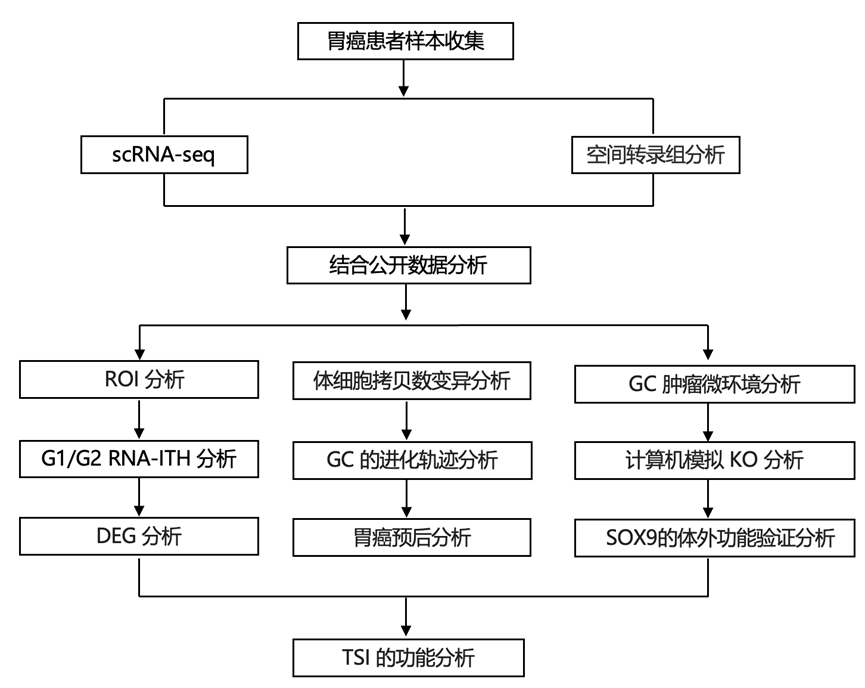
结 果
01
胃癌ITH的空间分辨模式
为了探索胃癌的空间瘤内异质性(ITH)模式,研究团队整合了121例个体胃癌患者的226个样本中的2138个GeoMx 数字空间分析(DSP) 的感兴趣的区域 (ROI) 和152423个单细胞单细胞图谱。这些包括包含15例胃癌的发现队列、6例患者的独立全切片的GeoMx DSP验证队列、来自86例患者的180个胃癌样本的GeoMx DSP组织微阵列(TMA)队列,其中每个胃癌由两个区域代表:肿瘤核心和肿瘤边缘,以及通过单细胞转录组分析 (scRNA-seq) 检测出的另外14例胃癌。
在发现队列中,每个ROI由两名专业的病理学家(S. Srivastava和h.y.j Lum)精心分析并独立注释为肿瘤、间质、淋巴聚集(LA)、肠上皮化生和邻近的正常上皮区域。研究团队的注释是基于每个ROI内的主要细胞类型,通过结合细胞形态[使用连续配对的苏木精-伊红(H&E)玻片]和荧光免疫组织化学(IHC)标记来确定(图1B)。每个ROI表达谱产生了约3800个可测量的基因(IQR = 2058-5265)。为了验证ROI注释,他们评估了GeoMx DSP数据中已发表的细胞类型特异性标志物,并发现在肿瘤ROI中具有较高的可重复性,例如肿瘤标志物KRT8和EPCAM的表达。ROI类别也与配对的scRNA-seq数据确定的细胞类型高度相关。通过比较肿瘤和邻近正常上皮ROI之间的基因表达差异,证实了先前报道的胃癌肿瘤ROI中显著上调的基因(如CLDN4和CD44)和致癌通路[例如上皮-间质转化 (EMT) 和血管生成]。当通过统一流形近似和投影(UMAP)进行可视化分析时,肿瘤ROI表现出患者特异性的聚类,而非肿瘤ROI(例如LA、基质等)则根据ROI类别进行聚类,这与其他研究相似,在这些研究中,由于肿瘤非整倍体的个体化模式,肿瘤表达谱通常是患者特异性的(图1C)。
选择一个具有代表性的胃癌样本(NGC531),他们对36个肿瘤ROI进行聚类分析(图1D)。无监督聚类和UMAP分析均证实了两个不同的表达亚组,称为“G1”和“G2”(图1D)。重要的是,当映射到它们在胃癌NGC531内的地理空间坐标时,通过空间自相关分析,亚组映射到不同的空间区域,表明存在基于空间表达的ITH (RNA-ITH)(图1D)。其他胃癌组织中也观察到类似的空间RNA-ITH模式(图1E)。为了确定这些RNA-ITH模式是否可以通过组织学结构的明显差异来解释,他们检测了G1和G2 ROI内泛细胞角蛋白 (PanCK)、平滑肌肌动蛋白(SMA)和CD45阳性细胞的比例,发现无显著差异(图1F)。此外,病理学家(S. Srivastava)对33个G1/G2 ROI进行了检测,证实G1和G2 ROI具有相似的肿瘤细胞组成(图1G),这些结果表明,G1/G2 RNA-ITH模式不能用肿瘤组织学的明显差异来解释,而可能与癌症的内在表达状态有关。
他们重点研究了G1和G2 RNA-ITH聚类的特征,因为这两个聚类在2-5个聚类范围中具有最稳健的聚类统计量,平均剪影评分最高。为了比较G1和G2 RNA-ITH区域之间的通路差异,他们进行了基因集分析,确定了G1和G2 ROI之间的差异表达基因 (DEG)。在多例患者中,他们发现G2 RNA-ITH区域通常表现出与EMT等侵袭性临床行为相关的肿瘤通路的上调,这与代表更侵袭性肿瘤亚群的G2区域一致。在基于全断面的GeoMx DSP验证队列中观察到类似的G1/G2 RNA-ITH和通路差异。将G1和G2特征映射到SGCC TMA上(图1H),他们发现肿瘤核心ROI类似于G1亚组,而肿瘤边缘ROI与G2亚组相关。为了验证在发现的GeoMx DSP数据中,G2 RNA-ITH区域也更接近肿瘤边缘,他们采用k最近邻法比较了G1或G2 ROI与TSI ROI之间的空间距离,TSI ROI代表包含肿瘤细胞和基质细胞的肿瘤边界。与SGCC的TMA结果一致,G2 ROI是更接近TSI ROI的主要瘤内亚型。
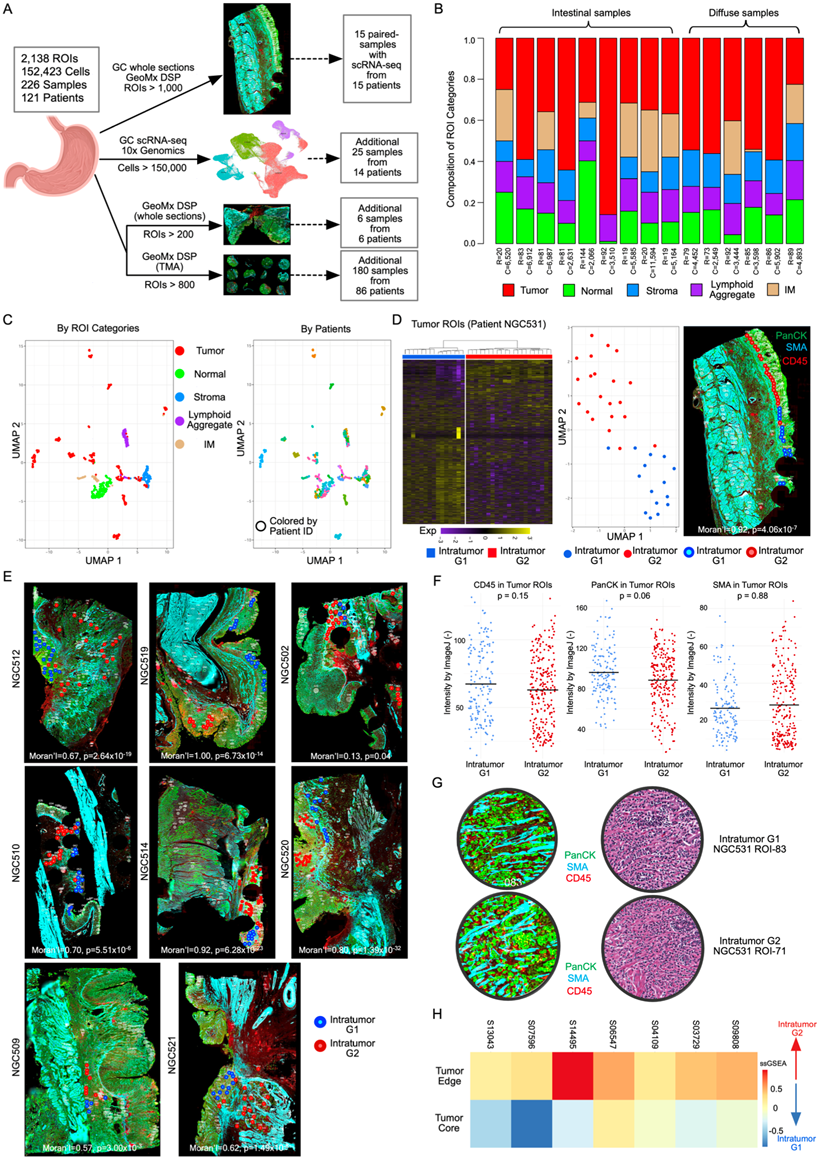
图1. 胃癌的空间分辨肿瘤内异质性(ITH)。
(A) 研究数据集的示意图。(B) 15个样本(9个肠型和6个弥漫性)ROI类型比例分布的柱状图。(C)UMAP可视化。(D) 无监督热图聚类显示了基于NGC531患者基因表达的两个不同的肿瘤内亚组,每一行代表一个基因,每一列代表单个ROI。(E) 染色的GeoMx DSP切片注释了来自另外8个样本的无监督聚类的瘤内亚组特征。(F) CD45/PanCK/SMA免疫组化信号在不同样本的肿瘤ROI中的强度。(G) 组织切片显示G1 RNA-ITH和G2 RNA-ITH肿瘤区域。(H) 基于GeoMx DSP肿瘤内亚组特征的评分热图应用于TMA数据。
02
G2 RNA-ITH区域表现出免疫抑制性TME
他们探索了G1和G2 RNA-ITH亚组是否可能与其局部肿瘤微环境(TME)的差异有关。利用配对的scRNA-seq注释的细胞类型,他们专注于分析免疫细胞类型。以聚集的方式分析样本,与G1区域相比,G2 RNA-ITH区域的T细胞比例显著降低,同时浆细胞显著增加(图2a)。为了验证CIBERSORTx反卷积的准确性,他们在SGCC TMA数据中通过正交多重免疫组化(mIHC)证实,与G1样肿瘤核心ROI相比,G2样肿瘤边缘ROI同样表现出T细胞比例下降(CD3+细胞减少约2.19倍)(图2B-C)。他们进一步测试了两个免疫耗竭特征,其中一个包含LAG3、TIGIT和PD1等基因。这两个特征在G2 RNA-ITH区域中的表达均显著高于G1区域,这与G2区域的免疫抑制状态一致(图2D)。为了扩大研究范围,他们分析了之前确定的24种抑制性免疫检查点的表达水平。该分析证实,与G1区相比,G2 RNA-ITH区有11个检查点的表达显著升高,2个检查点的表达降低,其余检查点的表达相似(图2E)。10种抑制性趋化因子表达升高(如CXCL16和CXCL5),验证了G2 RNA-ITH区域的免疫抑制特性 (图2F),6种抑制性细胞因子的表达也显著升高,包括TGFB1和TNFSF1。此外,G2 RNA-ITH区域的血管生成标记评分也显著上调。
为了在一个独立队列中验证这些结果,他们在SGCC TMA数据集中的G1样肿瘤核心ROI和G2样肿瘤边缘ROI之间分析了相同的抑制性免疫检查点、抑制性趋化因子和抑制性细胞因子。肿瘤边缘ROI具有更高的抑制性趋化因子表达水平(图2G)、抑制性细胞因子(图2H)和抑制性免疫检查点。综上所述,这些发现揭示了肿瘤内空间共定位的亚群具有不同的TME免疫特征。值得注意的是,观察到的免疫耗竭标志物差异针对肿瘤ROI的TME,而未在相同胃癌的LA ROI中观察到。
为了研究G2 RNA-ITH亚区的潜在治疗意义,他们分析了已发表的治疗耐药特征,包括(i)来自结直肠癌和胰腺癌II期试验的免疫检查点阻断治疗耐药特征,以及(ii)来自泛癌症研究的不同免疫检查点阻断治疗耐药特征。这些结果显示,G2 RNA-ITH亚区在两例患者中均表现出更高的抵抗评分(图2I)。探索已建立和新出现的治疗靶点的表达水平,G1 RNA-ITH亚区显示CAPRIN1表达升高,这是近期临床试验报告的一个有前景的靶点。
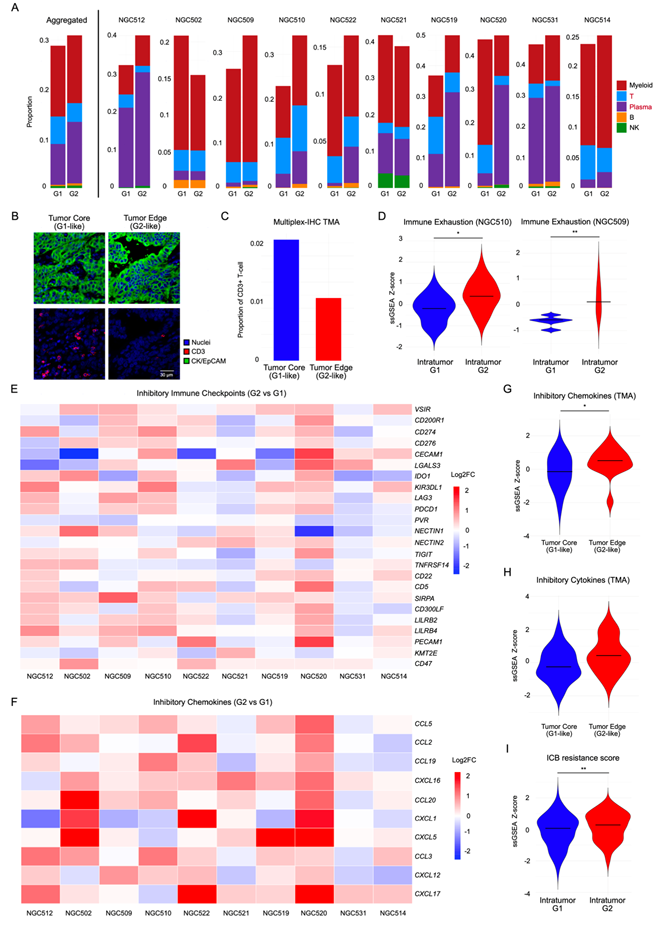
图2. 空间肿瘤内亚群的免疫异质性。
(A) 在10个聚集的GeoMx DSP样本(垂线左侧)和每个单独样本(右侧)中,肿瘤ROI中肿瘤内亚组(G1, G2)的反卷积免疫细胞类型比例柱状图。(B) TMA样本S03729中肿瘤核心(左)和肿瘤边缘区域(右)多重免疫组织化学(mIHC)的代表性染色切片。(C) TMA mIF检测肿瘤核心和边缘ROI中CD3+T细胞比例的条形图。(D) 两个代表性样本的G1和G2亚区免疫耗竭特征(包括LAG3、TIGIT和PD-1)的ssGSEA评分的小提琴图。(E) 肿瘤内亚组(G2 vs G1)之间抑制性免疫检查点表达的log2倍变化的热图。(F) 肿瘤内亚组(G2 vs G1)之间抑制性趋化因子表达变化的热图。(G) 使用GC TMA队列测量肿瘤核心和边缘ROI的抑制性免疫趋化因子的ssGSEA评分的小提琴图。(H) 使用GC TMA队列测量肿瘤核心和肿瘤边缘ROI上抑制性细胞因子的ssGSEA评分的小提琴图。(I) 10个样本中G1和G2亚区ICB抗性标记的ssGSEA分数的小提琴图。
03
G1和G2 RNA-ITH关系与不同的肿瘤内进化模式相关
含有CIN的癌症可能通过慢性cGAS-STING通路的激活以非自主的方式诱导区域免疫抑制。事实上,他们发现G2 RNA-ITH区域表现出较高的HET70非整倍体标记评分,表明较高水平的体细胞拷贝数变异(sCNA),也显著较高的cGAS-STING通路富集评分。与cGAS-STING活性升高一致,IFNα和IFNγ特征也在G2 RNA-ITH亚区上调。为了验证G2 RNA-ITH亚区中较高水平的非整倍体,他们使用CopyKAT从29个肿瘤样本的sCNA -seq肿瘤上皮细胞中推断出sCNA,进一步使用5个样本匹配的全外显子组测序(WES)数据验证。对scRNA-seq sCNA矩阵进行无监督聚类,可以区分出具有不同sCNA模式的不同瘤内亚组(图3B)。亚组之间的sCNA水平比较显示,一个亚组的sCNA水平显著升高,并与G2样特征相关。他们还从两个原发性胃癌的空间转录组分析的样本中推断出肿瘤细胞中的sCNA,并证实G2肿瘤细胞的sCNA水平显著高于G1肿瘤细胞。
利用基于DNA的sCNA模式,结合配对的scRNA-seq数据在单细胞水平分析肿瘤进化轨迹(图3B)。值得注意的是,在一些胃癌(N = 21)中,sCNA亚组表现出共同的基因组增益/缺失的特征,很少有独特的染色体改变。这一模式提示了一种“分支进化”模型,在该模型中,肿瘤随着时间的推移逐渐积累sCNA,最终形成各种亚组。然而,在其他胃癌中,sCNA亚组显示出更不同的图谱,不同的增益/缺失主导了它们的基因组(图3B)。第二种模式更接近“内部离散”或快速原位进化,即肿瘤亚组在进化早期迅速获得不同的sCNA,每个亚组随后走上自己的进化轨迹。为了进一步检验两种独立进化的肿瘤轨迹(分支进化和内部离散进化)的可能性,他们使用邻接树和最大简约树方法进行系统发育分析。
系统发生模型证实,基因组相似度较高的群体倾向于从二倍体祖先逐渐分支(分支进化),而具有独特sCNA模式的群体则表现出早期分化,从发病(内部离散)开始建立不同的分支。使用Monocle、Slingshot和PAGA等多种方法,基于表达的轨迹和伪时间分析进一步证实了这一系统发育分支(图3D)。值得注意的是,单细胞sCNA分析显示了两种主要的进化模式(图3E),这与之前大量胃癌WES研究的结果一致,从而证明了肿瘤进化模式在宏观和微观尺度上的一致性。
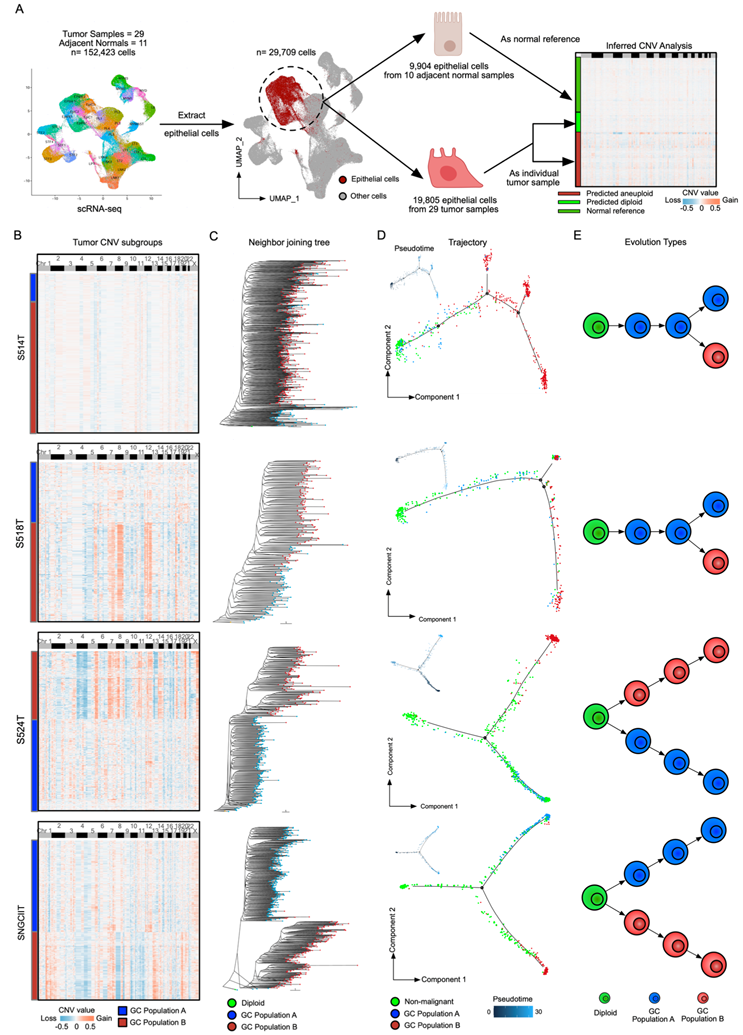
图3. 单细胞分析GC的进化轨迹。
(A) 从scRNA-seq单细胞数据推断sCNA的工作流程描述。(B) 热图显示样本S514T,S518T, S524T, SNGCIIT单细胞数据中肿瘤亚组的推断sCNA值。(C) 根据推断的sCNA值构建邻接(NJ)树,并将树重新根到二倍体状态以供参考。(D) 主面板显示轨迹图,而左上方面板显示非恶性细胞和肿瘤细胞的伪时间图。(E) 两种确定的肿瘤进化模式。
04
内部离散进化对胃癌预后的临床影响
通过scRNA-seq分析观察到两个独立的进化轨迹,促使他们研究与分支进化和内部离散进化相关的临床和分子特征。TCGA分子亚型显示,内部离散样本主要与CIN,而分支进化样本相当均匀地分布在各种亚型。CIN肿瘤细胞的cGAS-STING通路评分高于GS肿瘤细胞。在Lauren组织学亚型(肠型、弥漫性)方面,内部离散型胃癌和分支进化型胃癌之间未观察到显著差异(图4B)。所有scRNA-seq样本EB病毒编码区(EBER)原位杂交检测均为阴性。
为了研究这两种进化轨迹的临床意义,他们将来自样本的分支进化和内部离散特征应用于TCGA胃癌。与具有分支进化的患者相比,具有内部离散进化的胃癌患者的生存结局显著较差(图4C)。采用多变量Cox回归分析校正性别和肿瘤分期作为混杂因素,他们发现内部离散进化与死亡风险升高独立相关。内部离散胃癌患者的预后显著差于分支进化胃癌患者(图4D)。多变量Cox回归分析进一步支持这一结果,内部离散进化对低生存率仍然显著。对于EBV胃癌,对两个EBV胃癌队列的分析未发现两种进化亚型之间的生存关联。
值得注意的是,虽然在TCGA和GASCAD队列中,内部离散进化与更差的预后显著相关,但CIN与更差的预后无关。这表明,基于DNA的CIN只能部分解释内部离散胃癌的不良临床结局。通过分析29例胃癌样本,发现与分支进化胃癌相比,内部离散进化的胃癌具有显著较高的ITH水平(图4E)。然而,在比较肿瘤进化模式和基于DNA的ITH水平的多变量Cox回归分析中,突变等位基因肿瘤异质性(MATH)作为协变量,内部离散进化仍然与较差的预后显著相关,而ITH MATH水平则不相关。因此,与CIN相似,内部离散进化的胃癌的侵袭性临床行为不能完全归因于基于DNA的ITH水平。随后,他们进行了差异表达基因分析,比较了分支进化和内部离散型胃癌之间的肿瘤细胞群。该分析表明,内部离散肿瘤细胞显示出与EMT和缺氧通路相关的基因显著上调(图4F)。在内部离散胃癌细胞中表达的基因包括胶原相关基因(COL1A1、COL1A2和COL3A1)、舍平类基因(SERPINE1和SERPINE2)和生长因子结合蛋白(IGFBP6和IGFBP7)(图4G)。值得注意的是,由于这一表达分析采用了单细胞肿瘤上皮谱,因此排除了这些特征由非肿瘤间质群产生的可能性。当比较一致的sCNA谱与分支进化胃癌时,内部离散胃癌在不同样本中均显示出两个主要获得的区域(CHR1q 21-23和CHR12q 13),涉及RAB13等已知在癌细胞迁移中起作用的基因(图4H)。综上所述,这些结果表明,与分支进化的肿瘤细胞相比,内部离散的肿瘤细胞具有不同的分子特征。
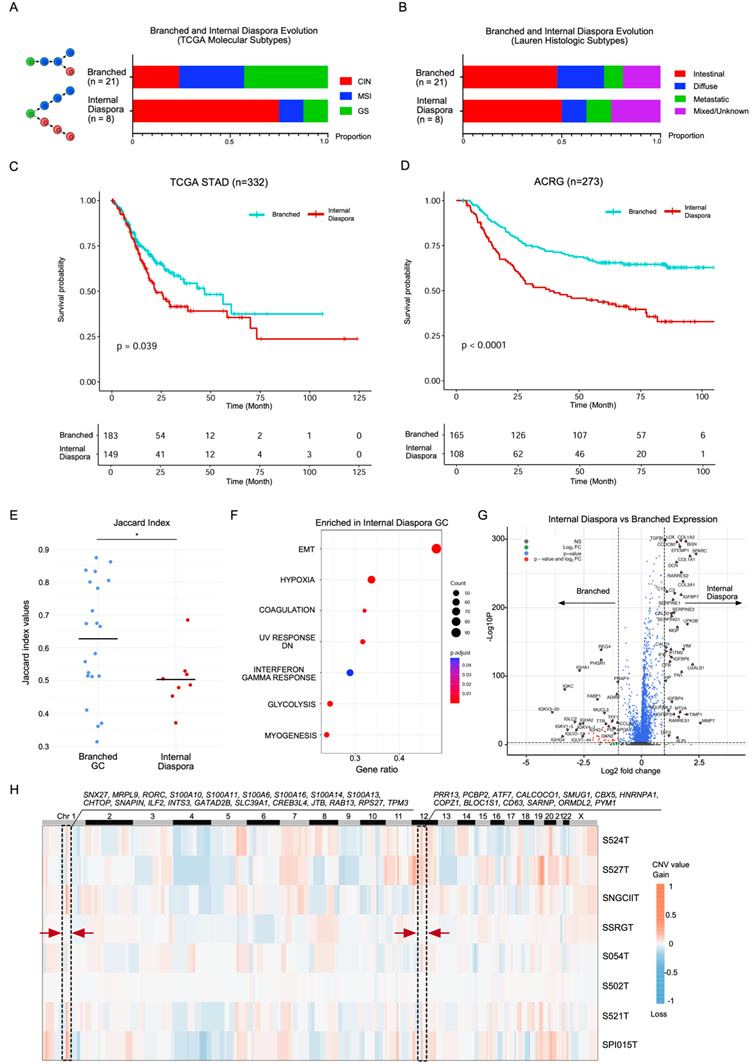
图4. GC进展与预后的内部离散进化。
(A) 条形图显示了TCGA分子亚型在内部离散和分支进化GC样本中的比例,用条形图上的样本计数表示。(B) 条形图显示了内部离散和分支进化GC样本中Lauren组织学亚型的比例,用条形图上的样本计数表示。(C-D)生存分析。(E) 两种sCNA进化类型的Jaccard指数柱状图。(F) GSEA点图显示了与分支进化样本相比,内部离散进化样本中上调的通路。(G) 火山图比较内部离散和分支进化样本在单细胞水平的基因表达。(H) 显示内部离散样本非整倍体细胞平均sCNA模式的sCNA热图。
05
内部离散型胃癌具有特定的间质微环境
他们探索了不同进化模式的胃癌是否也与不同的TME相关。内部离散胃癌与较高比例的内皮细胞、成纤维细胞和巨噬细胞相关,而分支进化样本显示较高比例的浆细胞(图5A)。scRNA-seq密度图与聚合分析一致(图5B),并使用GeoMx DSP数据进一步验证(图5C)。为了在RNA-seq队列中正交验证这些结果,他们对TCGA胃癌数据集进行了CIBERSORTx细胞类型反卷积,并发现分支进化和内部离散胃癌之间存在一致的TME差异(图5D)。这些结果表明,不同肿瘤演化轨迹的胃癌也与不同的肿瘤细胞外源性TME相关。
为了更精确地定义与这些TME差异相关的细胞状态,他们对内皮细胞和巨噬细胞进行了详细的亚聚类和注释。使用Seurat聚类将内皮细胞分层为三种亚型(Endo1-Endo3)(图5E)。在这三种内皮亚型中,以VWF和ACKR1高表达为特征的Endo2亚聚类细胞在内部离散型胃癌中的比例显著增加(图5F)。先前的研究表明,Endo2细胞可加速肿瘤血管生成,这可能促进了内部散散性胃癌的侵袭性,这一结果也在GeoMx DSP数据中得到了验证,其中,与分支进化样本相比,来自内部离散型胃癌的ROI显示出更高的Endo2特征(图5G)。值得注意的是,Endo2细胞在来自内部离散型胃癌的GeoMx DSP基质ROI中也存在。
对于巨噬细胞,聚类分析鉴定出6种肿瘤相关巨噬细胞(TAM)亚型(TAM1-TAM6)(图5H),分别由不同的基因表达标志物定义。其中,内部离散型胃癌显示出较高比例的TAM1亚型巨噬细胞,其特征是表达SPP1和FN1(图5I)。已知TAM1巨噬细胞通过与癌症相关成纤维细胞(CAF)以及通过与CD8+耗竭T细胞的相互作用。TAM1巨噬细胞也与肿瘤转移相关。与Endo2细胞相似,他们也观察到TAM1在肿瘤ROI中富集更高(图5J)和来自内部离散型胃癌的LA ROI。为了验证这些结果,他们使用配对的scRNA-seq数据进行反卷积分析,再次发现内部散散的胃癌比分支进化的胃癌有更高的TAM1细胞比例。去除腹膜样本仍然导致内部离散性胃癌,表现为Endo2细胞和TAM1细胞的比例显著增加。这些结果揭示了内部散散进化胃癌中独特的基质成分,以已知促进肿瘤生长和转移的细胞类型的存在为标志,如VWF+ ACKR1+内皮细胞和SPP1+ FN1+ TAM细胞。
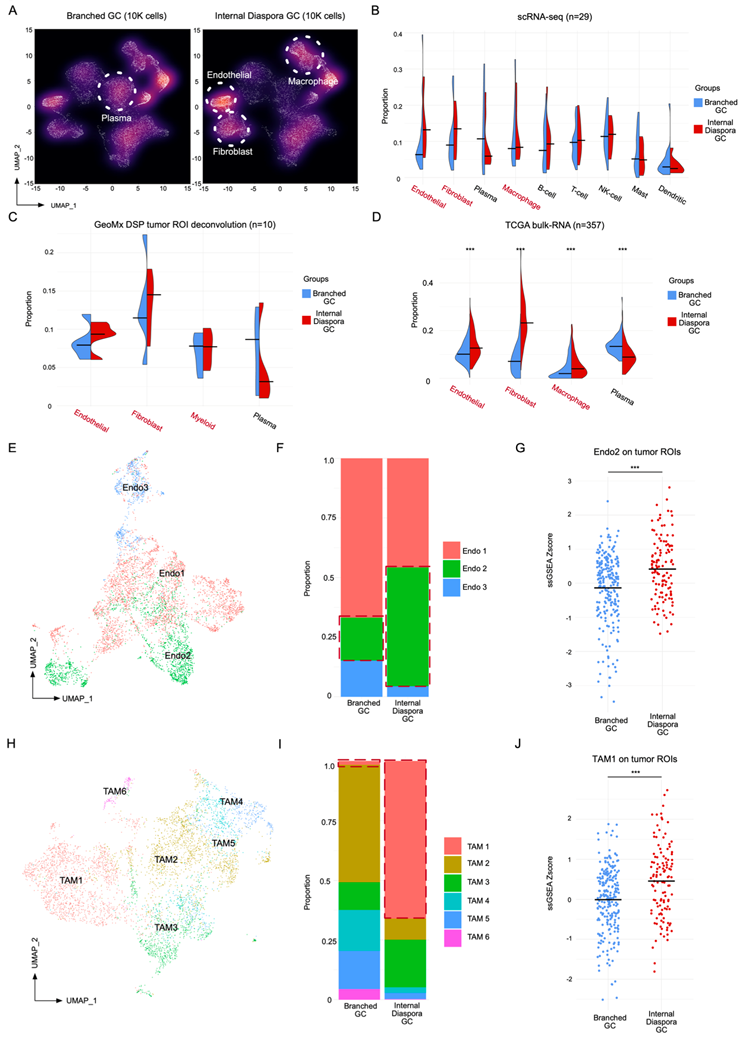
图5. 内部离散的GC具有独特的肿瘤微环境。
(A)UMAP可视化。(B) 从GC scRNA-seq肿瘤样本中比较分支进化和内部进化样本的细胞类型比例的分裂小提琴图(29例患者)。(C) 从GC GeoMx DSP肿瘤ROI中比较分支进化和内部进化样本的反卷积细胞类型比例的分裂小提琴图(10例患者)。(D) 从单细胞衍生特征(357例患者)绘制的TCGA样本中比较分支和内部进化的细胞类型比例的分裂小提琴图。(E)UMAP可视化。(F) GC scRNA-seq中不同内皮亚聚类的比例条形图。(G) GeoMx DSP肿瘤ROI上Endo2标记映射评分的点图。(H)UMAP可视化。(I) GC scRNA-seq数据集中各种TAM亚聚类的分布条形图。(J) GeoMx DSP肿瘤ROI上TAM1标记映射评分的点图。
06
SOX9是候选内部离散驱动因子
分支进化和内部离散型胃癌均表现出RNA-ITH,反映在G1样和G2样肿瘤群体中(图1)。他们鉴定了在G2样群体中特异性上调的基因,如TSPAN8、SOX9和AGR2(图6A)。在这些基因中,已知SOX9通过与TSPAN8的启动子结合来增强TSPAN8的表达。SOX9也与肿瘤进展相关,是肿瘤进展和转移的一个新鉴定的驱动因子。为了研究SOX9在驱动内部离散进化中的功能作用,他们使用了最近描述的基因调控网络建模方法CellOracle,该方法允许在scRNA-seq数据中对转录因子(TF)进行计算机模拟敲除(KO)。作为阳性对照,他们首先在一个公共数据集上验证了CellOracle,观察到成肌素(MYOG) KO可显著将72h培养的原代人成肌细胞的细胞状态转变为0 h培养的细胞,这与MYOG是肌肉发育和肌肉发生的关键驱动因子一致。接下来,为了证明CellOracle对胃癌的适用性,他们比较了TP53非靶向性(TP53-NT)和TP53 KO (TP53-KO)胃细胞系,通过scRNA-seq获得了11999个TP53-NT细胞和4164个TP53-KO细胞的数据。随后在TP53-NT细胞数据中对TP53进行计算机模拟KO,导致细胞状态向实际TP53-KO细胞中观察到的状态显著转变。然后,他们对内部离散型的胃癌肿瘤细胞进行了SOX9基因敲除分析。CellOracle模拟证实,在SOX9 KO后,G2样谱显著地向G1状态偏移(图6B-D),这一偏差与随机TF KO模拟引起的偏移明显不同。
除计算机模拟验证外,他们还进行了体外功能验证。首先,为了验证内部散光G2标记物SOX9, TSPAN8和AGR2,他们在多个细胞系(SNU1967,AGS,YCC21和TMK1)中进行了siRNA敲低,然后进行了多种功能分析,包括细胞活力鉴定、细胞迁移和克隆形成实验。对于所有这三个基因,敲低显著降低了至少两个(通常是三个)细胞系的细胞活力、细胞迁移或克隆形成,表明这些功能效应不是任何单个细胞系所特有的(图6E-F)。其次,除了siRNA介导的沉默外,他们还在三个细胞系(SNU1967、AGS和YCC21)中对SOX9进行了CRISPR介导的KO实验。对于每个细胞系,与对照(野生型)细胞相比,SOX9 KO导致细胞活力和细胞迁移显著降低(图6G)。第三,为了进一步证明SOX9是关键驱动因字,他们对YCC21胃癌细胞中配对的CRISPR敲除的SOX9细胞和阴性对照细胞进行了scRNA-seq(图6H)。SOX9 KO后,与对照细胞相比,肿瘤增殖相关的通路如G2M检查点,E2F靶点和有丝分裂纺锤体基因集显著降低(图6I),这与实验观察到的SOX9 KO表型一致,这些结果提示SOX9在促进内部离散型胃癌的肿瘤进展方面具有潜在作用。
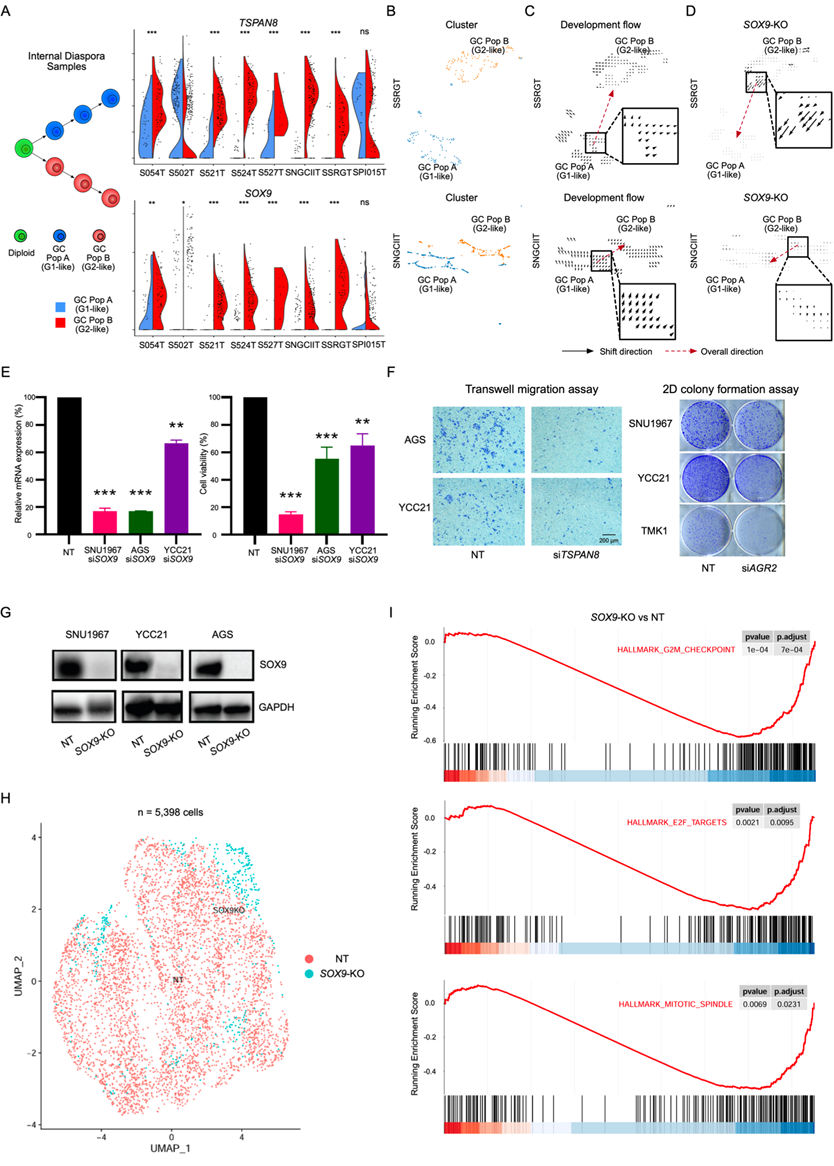
图6. 内部离散进化的候选驱动因子。
(A) GC群体A和B之间TSPAN8和SOX9表达的分裂小提琴图。(B)UMAP可视化。(C) 使用CellOracle在两个内部样本(SSRGT和SNGCIIT)中绘制发展向量场图。(D) 使用CellOracle在两个内部离散样本(SSRGT和SNGCIIT)中绘制SOX9 KO模拟矢量场图。(E) NT和SOX9 siRNA胃上皮细胞(SNU1967、AGS和YCC21)的mRNA相对表达量(左)和细胞相对活力(右)。(F) 胃上皮细胞(AGS和YCC21)中TSPAN8 siRNA后的迁移实验(左)和胃上皮细胞(SNU1967、YCC21和TMK1)中AGR2 siRNA后的克隆形成实验(右)。(G) 在NT和SOX9 CRISPR敲除胃上皮细胞的蛋白水平证实SOX9 CRISPR敲除(KO)。(H)UMAP可视化。(I) 绘制SOX9 KO与NT细胞之间富集最高的通路的GSEA富集评分曲线。
07
TSI的空间分析揭示了一种独特的TGF-β介导的状态
最后,他们利用本研究的空间数据来探索肿瘤基质界面(TSI)。在癌症生物学中,TSI是肿瘤细胞和周围正常组织之间功能相互作用的场所,为了解肿瘤进展的关键方面提供了一个窗口。他们仔细分析了数据集中的85个TSI ROI,这些ROI是通过对肿瘤样本的高倍检查选择的,并根据每个ROI内显示PanCK染色的肿瘤细胞和SMA染色的间质混合的区域进行定义(图7A)。在UMAP空间中,TSI ROI并列在肿瘤和间质区域之间,反映了肿瘤和间质细胞的混合(图7B)。
他们研究了在TSI区域中高表达但在肿瘤ROI和基质ROI中低表达的基因和通路(图7C)。通过分析每例患者的Lauren和进化亚型特征,他们确定了以特定通路激活为特征的TSI。在肠型胃癌中,TSI ROI显著参与细胞周期调节和细胞外基质重塑,而弥漫型胃癌TSI ROI显著激活了与EMT、凝血和缺氧反应相关的基因。有趣的是,Gremlin 1 (GREM1) 是一种与TGF-β信号传导相关的基因,已知在CAF中表达,在弥漫性胃癌和肠型胃癌的TSI ROI中,Gremlin 1通常上调。当映射到scRNA-seq数据时,他们发现TSI特征主要映射到一个以TGF-β驱动的活性而闻名的肌纤维母细胞样CAF (myCAF) 聚类(Fib1) (图7D-E)。利用来自GeoMx DSP样本的TSI特征,使用Seurat中的AddModuleScore方法对TSI中myCAF的富集进行了正交验证。他们还观察到TSI中TGF-β通路活性增强,与Fib1 myCAFs的富集一致(图7F)。为了在实验上验证这些发现,他们将两个GREM1+ CAF细胞系(PT13CAF和PT54CAF)与胃癌类器官细胞(PT25GC)共培养,并通过RT-PCR观察到两个CAF细胞系中GREM1表达显著上调。综上所述,这些数据显示了TSI特异性方式下独特的相互作用和基因程序,而GREM1和增强的TGF-β信号作为潜在的生物标志物来确定这些区域。
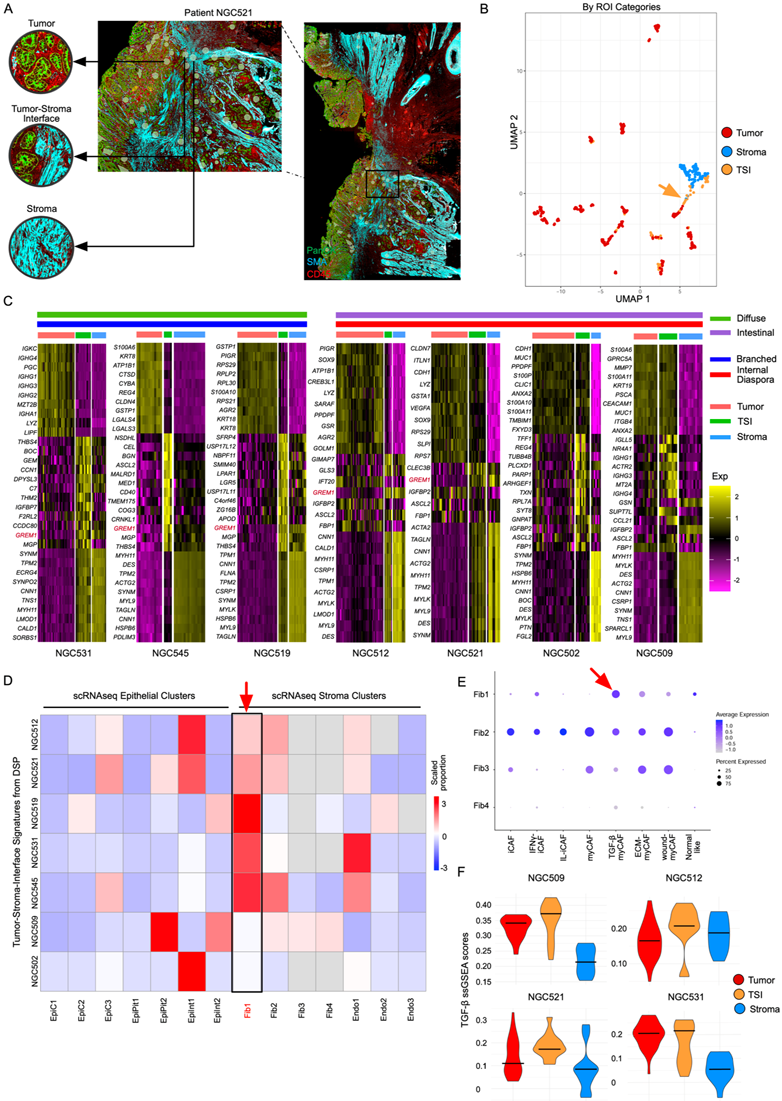
图7. TSI 代表了一种独特的TGF-β介导的细胞状态。
(A) 来自患者NGC521的特定区域的GeoMx DSP切片染色显示了肿瘤的选择,TSI和间质ROI。(B)UMAP可视化。(C) 根据TSI ROI区个数筛选得到7例样本肿瘤、TSI和间质ROI区特征基因表达热图。(D) 热图显示相应的GeoMx DSP样品中GC scRNA-seq聚类特征的比例,由CIBERSORTx确定。(E) 点图显示GC scRNA-seq成纤维细胞聚类中CAF亚型特征的表达。(F) 在GeoMx DSP数据中,小提琴图显示上皮,TSI和基质ROI中TGF-β基因程序的表达。
+ + + + + + + + + + +
结 论
本研究将 121 名患者的 226 个癌症样本中的 2138 个感兴趣的空间转录组区域与 152423 个单细胞表达谱数据整合在一起,观察到普遍存在的基于表达的肿瘤内异质性,通过与特定免疫微环境、检查点谱和遗传驱动因素 (SOX9) 相关的空间局部化和功能有序的亚群重现肿瘤进展。系统发育分析揭示了两种不同的进化轨迹(分支进化和内部离散进化),与不同的分子亚型、临床预后和基质邻域(包括VWF + ACKR1 + 内皮细胞)相关。跨多种胃癌的肿瘤-基质界面的空间分析强调了新的生态系统状态,这些状态不能归因于单纯的肿瘤/基质混合,其标志是GREM1表达增加。本研究结果提供了有关个体胃癌的细胞生态系统如何受到肿瘤内在和外在选择压力的影响,最终形成个体化的患者特定癌症绘图的见解。
+ + + + +



 English
English


