文献解读|Nat Med(58.7):重度子痫前期患者蜕膜化抵抗的多组学分析
✦ +
+
论文ID
原名:Multi-omics-based mapping of decidualization resistance in patients with a history of severe preeclampsia
译名:重度子痫前期患者蜕膜化抵抗的多组学分析
期刊:Nature Medicine
影响因子:58.7
发表时间:2025.01.07
DOI号:10.1038/s41591-024-03407-7
背 景
子宫蜕膜化涉及子宫内膜内发生的功能和形态变化,改变母体子宫内膜以适应侵入性滋养细胞。子宫内膜基质细胞转化受激素调节,由孕酮水平升高和局部 cAMP 的产生所驱动,从而刺激细胞内和分泌蛋白复杂网络的合成。它始于月经周期早期分泌期,与受孕体的存在无关,位于子宫螺旋动脉附近的区域,随后扩散至整个子宫内膜。蜕膜化抵抗(DR)是指子宫内膜无法发生这些特定变化,已在生殖障碍中得到证实,包括子宫内膜异位症、流产、复发性流产和重大产科综合征。后者包括先兆子痫 (PE)、宫内生长受限( IUGR) 和/或胎盘粘连谱系障碍,目前仍不知道DR的分子机制
实验设计
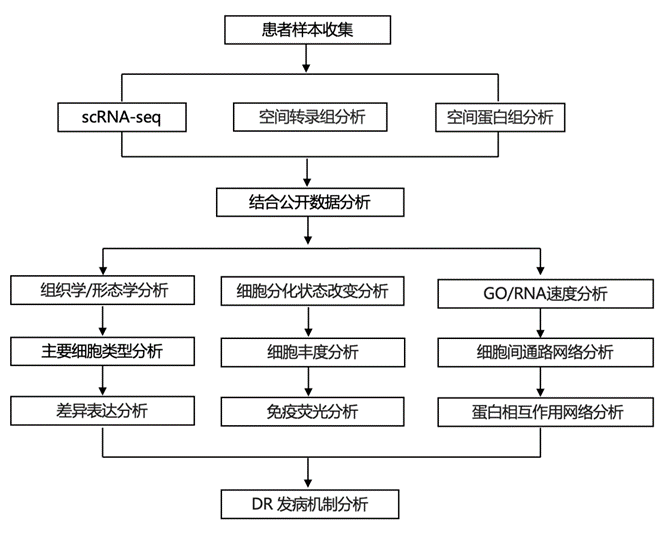
结 果
01
sPE 中的宏观、微观和单细胞变化
PE 是一种主要的产科并发症,影响 8% 的初次妊娠。其特征是新出现的高血压、蛋白尿和血管内皮损伤等其他体征。这种危及生命的疾病称为重度 PE (sPE),其诊断依据是血压较高(收缩压 ≥ 160 mm Hg或舒张压 ≤ 100 mm Hg)、中枢神经系统功能障碍症状、肝脏异常、血小板减少、肾脏异常和/或肺水肿。研究团队使用 sPE 作为临床模型,结合不同的组学技术,包括单细胞转录组分析 (scRNA-seq)技术、空间转录组学技术和空间蛋白组学技术(LCM-MS)进行多组学分析,其目标是深入了解这种病理状况。
子宫内膜组织的宏观可视化显示,与对照组(图 1e-f)相比,患者的腺体开口扩张(图 1a-b)。对曾患有 sPE 的患者样本(图1c-d)和对照组(图1g-h)样本的苏木精和伊红 (H&E) 染色的组织切片进行扫描和数字化分析,证实了这一发现。他们开发了一套分析流程来分割腺体切片(图1i)。具体而言,数据显示扩张主要见于面积和直径较小、圆度增加的管状肺泡腺切片(图1j)。此外,与对照组相比,sPE 患者的管腔面积百分比更高,不规则性更多(实性较差)(图1k),并且在管状和管状肺泡腺切片中观察到腺上皮细胞数量更多(锯齿状更多)(图1l)。他们将这些发现作为 sPE 患者在周期后期分泌期存在 DR 子宫内膜缺陷的初步证据。
他们采用了 scRNA-seq 方法来揭示观察到的形态差异背后的分子相关性,总共对 65381 个细胞进行了分析,整合了转录组数据并将它们投影到 sPE 和对照组的均匀流形近似和投影 (UMAP) 中(图1m-n)。确定了以下九种主要细胞类型:上皮、基质、循环基质、血管周围、内皮、自然杀伤 (NK) 细胞、T 细胞、巨噬细胞和 B 细胞。整合患者和对照数据集的使他们能够初步比较两组子宫内膜活检的细胞组成(图1o)。
差异表达分析显示,C2CD4B在 sPE 的内皮细胞中上调,与急性炎症有关。免疫细胞,包括巨噬细胞、NK 细胞和 B 细胞,表现出炎症失调,白细胞介素-1-β ( IL-1B )、CCL5和SCGB1D2表达较高。巨噬细胞中IL-1B和TNF的上调导致内皮功能障碍和血管阻力增加,而NK 细胞中IL32的增加促进了中性粒细胞活化和 sPE 的发展。
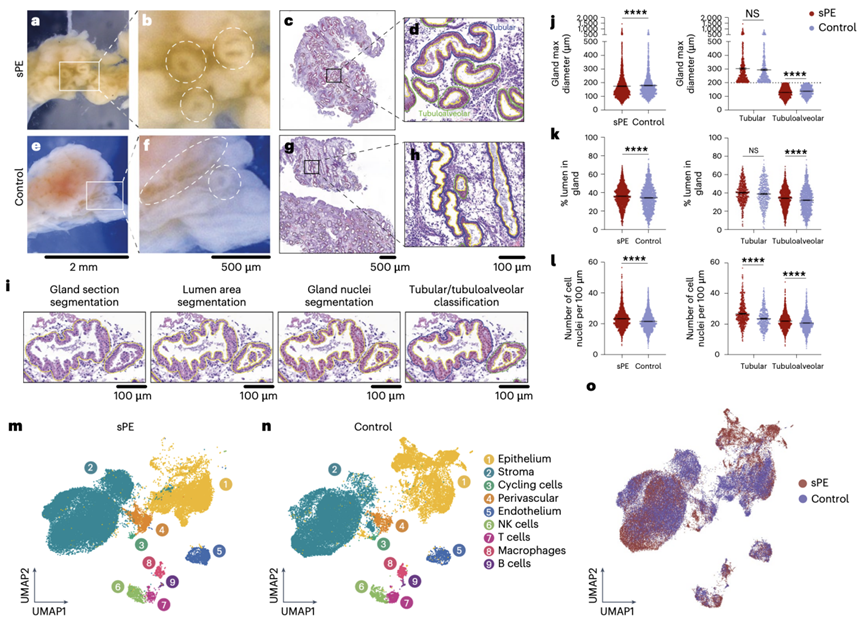
图1. sPE 和控制条件下单细胞图谱反映的 DR 形态特征。
(a-b) 从一位曾患过 sPE 的女性身上采集的晚期分泌期子宫内膜组织的代表性图像。(c-d) 代表性 H& E载玻片染色 sPE 样本的子宫内膜组织。(e-f) 从一位对照女性身上采集的晚期分泌期子宫内膜组织的代表性图像。(g-h) 代表性 H&E 载玻片染色对照样本的横截面子宫内膜组织。(i) 对管状和管状肺泡腺进行分割和分类以供后续分析。(j) 小提琴图表示 sPE和对照样本中的最大腺体直径以及详细 的管状 和管状肺泡腺分类。(k) 小提琴图表示 sPE和对照样本中腺体管腔的百分比 以及详细的管状和管状肺泡腺分类。(l) 小提琴图表示 sPE和对照样本中腺体中 100 µm 内的细胞核数量以及详细的管状和管状肺泡腺分类。(m-o) UMAP 可视化。
02
间质性PE中的子宫内膜细胞分化缺陷
基质和血管周围细胞转录组的整合鉴定出几个亚群(图2a)。蜕膜化的基质 1 细胞表达与核糖体活性(RPS29和RPL37A)和孕酮相关子宫内膜蛋白(PAEP)相关的基因。蜕膜化的基质 2 细胞分别共同表达蜕膜前和蜕膜状态的标志物EGR1和CXCL2。蜕膜化的基质 3 细胞表达众所周知的蜕膜化标志物(如IGFBP1和TIMP3和ATF3)和与晚期蜕膜化相关的转录因子,包括CSRNP1。
他们还鉴定了基质上皮-间质转化 (EMT) 亚群;该聚类表达参与子宫内膜再生的PDGFRA。另一个聚类是增殖性基质,表达月经周期增殖期的标志物—— SFRP4、MMP11、DIO2、SFRP1和PGRMC1。他们还捕获了两种不同的血管周细胞亚群,它们与蜕膜化过程中的基质细胞密切相关。血管周 1(STEAP4 +)和血管周 2(MYH11 +)亚群聚集在调节基质血管生成的细胞附近,这些细胞表达CCBE1,它是VEGFC的调节因子。
细胞身份映射可以识别在 sPE 或对照样本中差异富集的亚群(图2b-c)。蜕膜化基质 1、2 和基质过渡亚群在对照样本中富集,而蜕膜化基质 3 和增生性基质在 sPE 样本中增加。这种嵌合状态——增生性基质细胞(MMP11+和SFRP4+)与IGFBP1+蜕膜化细胞共存——似乎是 sPE 中 DR 的标志(图2c)。
在 sPE 患者中,TIMP3在蜕膜基质 1 和 2 中上调,而IGFBP1和IGFBP6在蜕膜基质 3 中上调。增殖性基质亚群显示SFRP4和FOS表达增加,这些标志物与增殖期和子宫内膜异位症相关。免疫荧光 (IF) 证实,与对照组相比,曾患 sPE 的患者的基质 SFRP4 更高(图2d)。这些结果表明 sPE 中的基质群体不平衡,以增殖的基质细胞为主,与促炎微环境内的蜕膜细胞共存。
他们整合了上皮细胞转录组,鉴定出以下上皮细胞亚型(图2e):纤毛上皮、纤毛上皮细胞和 sPE 纤毛上皮。纤毛上皮表达TPPP3、RSPH1和C1orf194;此外,这些细胞表达FOXJ1和PIFO。纤毛上皮细胞表达CDC20B和CCNO 3。他们还鉴定出仅存在于既往 sPE 患者中的特定PDGFRA+纤毛上皮细胞(sPE 纤毛上皮)。
具体而言,该细胞亚群中差异表达基因 (DEG) 的基因本体 (GO) 分析揭示了纤毛上皮的关键生物学特征,包括细胞外基质 (ECM) 和纤毛组织、上皮增殖和伤口愈合。在上皮和基质之间转换的群体表达基质标志物,如TIMP3和DCN 。腔上皮细胞通过TGS1和MSLN来识别,而最丰富的类型腺分泌细胞表达PAEP、CXCL14和SPP1。上皮细胞亚群还显示出增殖期的标志物,包括IHH、MMP7和EMID1。
sPE 患者的增生性上皮、沉淀纤毛上皮、纤毛上皮和 sPE 纤毛上皮亚群数量较多(图2f-g)。纤毛上皮细胞在增生期增加,表明 DR 中上皮分化异常。对照组中富集的细胞类型(腺上皮细胞和上皮转变)占 sPE 样本的一小部分,结果证实了上述细胞类型的显著差异丰度。
在既往患有 sPE 的患者的增生上皮中,VIM、孕酮受体 (PGR) 和MMP7上调。免疫荧光(IF)分析证实了 sPE 患者子宫内膜组织中 MMP7 显著增加(图2h)。sPE 上皮亚群的特点是SRFP4和IGF1上调, CXCL14、PAEP和TIMP3下调;纤毛上皮细胞下调MT1G、CXCL14和GPX3。既往患有sPE的患者样本中存在较少的亚群,这些个体的腺上皮细胞有几种分泌球蛋白的表达失调,并且转录调节因子MECOM的 mRNA 水平降低。此外,上皮过渡细胞中SERF4、FOS和JUN的表达较高,而CXCL14和TIMP3等的表达较低。总之,有 sPE 病史患者的上皮细胞群存在明显的不平衡,其特征是异常的增生上皮和纤毛上皮为主,与腺分泌上皮和腔上皮共存,同时还存在异常的上皮细胞类型,这可能导致宏观和微观观察到的上皮表型。
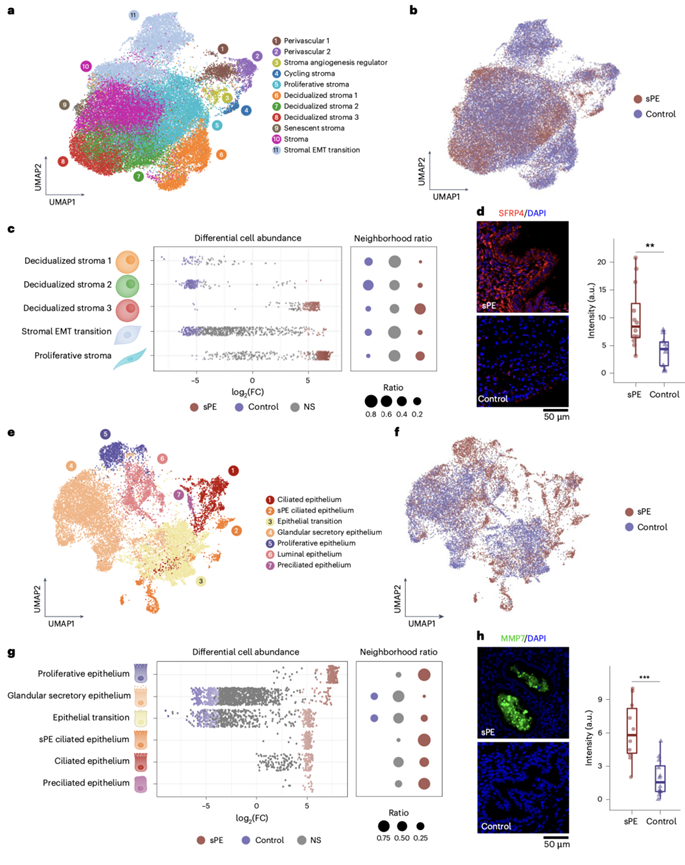
图2. sPE 患者的 DR 基质和上皮细胞分化状态改变。
(a) 晚期分泌期子宫内膜基质和血管周围部分的细胞亚群识别的UMAP。(b) sPE和对照样本的基质合并细胞的UMAP。(c) 按基质细胞亚型划分的差异细胞丰度的Beeswarm图。(d) 样本中SFRP4的IF验证 和荧光强度的定量。(e) 晚期分泌期子宫内膜上皮部分的细胞亚群鉴定。(f) sPE和对照样本的上皮合并细胞的 UMAP。(g) 按上皮细胞亚型划分的差异细胞丰度的 Beeswarm 图。(h) 样本中 MMP7 的 IF 验证 和荧光强度的定量。
03
sPE 中上皮-基质转化缺陷
他们整合了上皮到基质过渡区亚群的转录组数据(图3a),并在 UMAP 中投影以比较病例和对照样本的差异(图3b),该分析纳入的细胞群体包括基质、上皮、上皮-基质过渡、纤毛上皮和循环细胞。差异丰度分析显示 EMT 中对照细胞数量增加,而 sPE 患者中细胞数量大大减少(图3b-c)。
为了深入了解上皮到基质的转变,他们进行了 RNA 速度分析。结果揭示了一个时间动态转录过程,该过程起源于上皮细胞并延伸到基质细胞。谱系 1 代表了上皮、上皮-基质转变和基质细胞群之外最有趣的进展,它经投射到 sPE 患者和对照参与者的样本中(图3d-e)。在对照参与者的样本中,存在从分泌性腺上皮到基质的明显转变,描述了与晚期分泌性蜕膜状态相关的 EMT,而在 sPE 患者的样本中,显著的密度紊乱似乎与 DR 有关。最后,不同条件下的差异表达突出了对照对转变的重大贡献(图3f)。DEG 的 GO 分析揭示了与 EMT 相关的富集生物学过程,例如细胞骨架组织、ECM 组织、生长/增殖平衡、迁移和形态发生,以及激素反应(图3g)。这些结果表明,在从以前患有 sPE 的患者身上采集的子宫内膜样本中,基质细胞向上皮表型转变的基本方面不仅有所减少,而且失调。
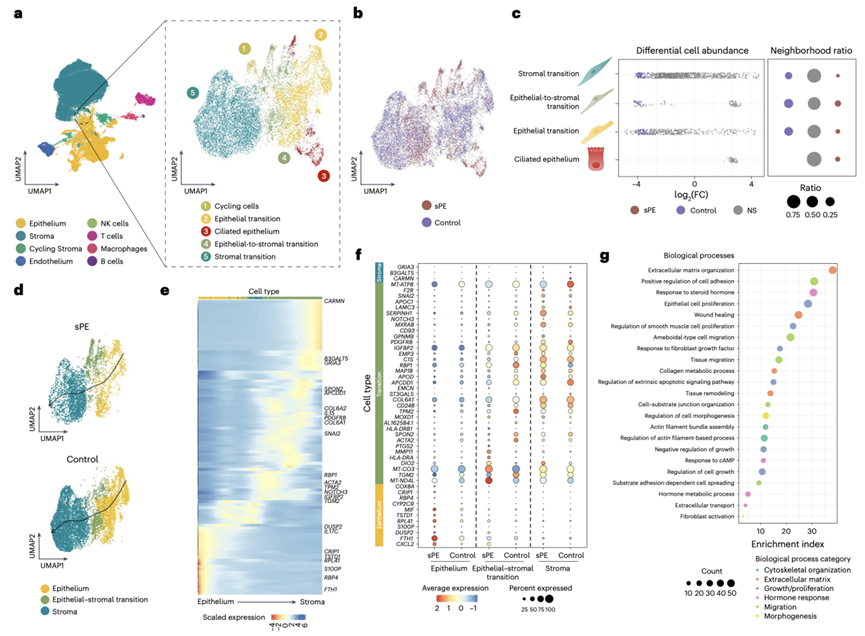
图3. sPE 患者 DR 子宫内膜无 EMT。
(a) 晚期分泌期子宫内膜 EMT 和细胞亚群识别的放大图。(b) sPE和对照样本的 EMT 合并细胞的 UMAP。(c) 按 EMT 细胞亚型划分的差异细胞丰度的Beeswarm 图。(d) 使用 scVelo 对上皮转变、上皮-基质转变和基质转变亚群的 sPE 和对照样本生成的 RNA 速度。(e) 谱系 1 分化过程标志性基因的表达模式。(f) 在伪时间内鉴定的与基质、上皮-基质转变和上皮相关的 sPE 与对照中的 DEG 的点图。(g) 包括标记为 EMT 群体的所有细胞亚型的 DEG 的 GO 分析。
04
sPE 中的细胞间通讯失调
在 sPE 患者的样本中,NRG、BMP、CX3C 和 EGF 通路中观察到较强的信号,而对照样本中 IL-1 和 MADCAM 信号较强。总体而言,sPE 前患者的细胞信号传导增强。
然后,他们研究了导致 sPE 相关细胞间通讯 (CCC) 网络扰动的配体-受体对以及所涉及的细胞类型。在对照样本中,内皮素介导的信号在内皮和腺分泌上皮之间传递到各种亚型的基质细胞(图4a)。然而,在 sPE 患者的子宫内膜样本中,信号主要在上皮早期增殖细胞和不同基质细胞亚群之间重新分配,包括 EDN1–EDNRA 信号的减弱和 EDN3–EDNRB 信号的出现(图4b)。典型和非典型 WNT(ncWNT)信号是蜕膜化的关键调节因子。在对照样本中,基质过渡亚群强烈地自我调节并与内皮细胞和血管周围细胞通讯。在 sPE 患者的子宫内膜样本中,这些信号减弱,导致产生新的自分泌增殖调节(图4c),以及涉及新的配体-受体对(如 WNT5A-FZD10)的调控(图4d)。对照样本中的典型 WNT 信号传导主要涉及基质过渡细胞的自分泌调节和与蜕膜基质细胞的通讯。在 sPE 患者中,基质过渡细胞和早期分泌基质细胞向未分化基质细胞发出信号(图4e),涉及对照样本中不活跃的至少四个典型 WNT 配体-受体对(图4f)。
SEMA3A 和 SPP1 也发生了显著变化。在对照组样本中,在增殖期高度表达的 SEMA3A 信号主要局限于基质细胞和内皮细胞之间。然而,在 sPE 患者的样本中,这些信号转向增殖上皮细胞和其他细胞类型,并出现了新的通路。SPP1 在分泌中晚期上皮细胞中高度表达,通常由上皮细胞、基质细胞和腺上皮自我调节,在 sPE 患者的信号传导减弱(图4i)。IF 证实 sPE 患者腺上皮中的 SPP1 减少(图4j)。此外,通常在基质细胞和上皮细胞之间进行的腱糖蛋白信号传导在 sPE 患者中表现出新的相互作用,突显出广泛的信号传导改变。
总之,这些数据表明,在 DR 患者的子宫内膜中,分子和细胞类型的信号通路发生了非常显著的重塑,主要是细胞的增殖表型导致异常蜕膜化。
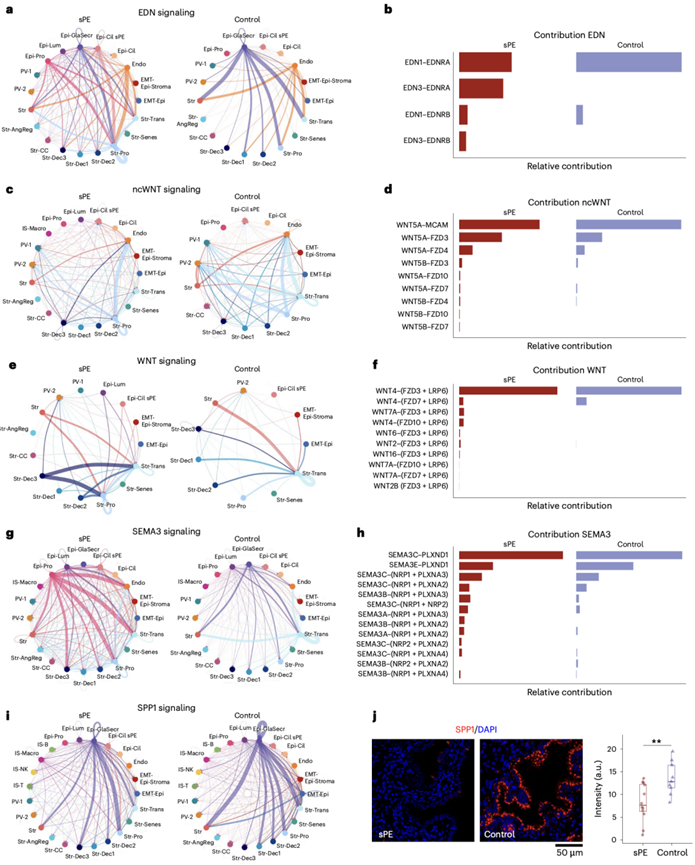
图4. DR 中与细胞组成改变相关的细胞间通讯网络功能障碍。
(a,c, e, g, i) 弦图显示 sPE 和对照样本中 EDN、ncWNT、典型 WNT、信号蛋白(SEMA3)和 SPP1的 CCC 网络。(b, d, f, h) 对 EDN、ncWNT、WNT和 SEMA3的 CCC 有贡献的每个配体-受体对的条形图。(j) sPE与对照样本中 SPP1 的 IF 验证 和荧光强度的定量。
05
sPE 中的 DR 空间转录组学
他们通过空间转录组学对福尔马林固定石蜡包埋的晚期分泌期子宫内膜进行空间解析,分析了 sPE和对照中的 95 个感兴趣区域(ROI)。ROI 是根据子宫内膜组织结构分为以下三类的区域:(1)富含基质(VIM +)和内皮细胞(CD31 +)(图5a),(2)富含腺上皮(PanCK+)(图5c)和(3)富含腔内上皮和基质细胞的腔内上皮区域(PanCK +和 VIM +)(图5e)。差异表达分析(患者与对照组)显示基质 ROI 中有 430 个 DEG,(2)腺上皮 ROI 中有 575 个 DEG,(3)腔内 ROI 中有 456 个 DEG。除少数例外,sPE 和对照样本分别聚类。
他们合并了 scRNA-seq 和空间转录组学分析中的 DEG。总体而言,DEG 在两种分析中具有相同的上调或下调模式,这交叉验证了研究结果。在富集的基质 ROI 中(图5b),两种技术鉴定的 DEG 包括参与细胞骨架组织的 DEG。TPM1下调,MYL9(增加蜕膜收缩力)和与 DR相关的ANXA2发生下调。SEMA3和KDM6b上调,后者参与调节蜕膜 DNA 甲基化和调节靶基因表达。
腺上皮 ROI 基因在 sPE 患者中上调,与上皮的 scRNA-seq 分析结果一致,包括TNFRSF21和GREB1受体(图5d),这些基因在复发性流产和子宫内膜异位症患者中也上调。
在 sPE 患者中上调并与基质 scRNA-seq 共享的管腔上皮 ROI 基因包括LIMA1、SCARB1和MMP7(图 5f)。MMP7在管腔上皮 ROI 和单细胞分析中上调,与月经周期的增殖期有关。对 sPE 患者中的 MMP7 进行的 IF 分析交叉验证了scRNA -seq 和空间转录组学获得的结果(图2h),DUSP2和ACADSB存在相同的调控模式。
总之,结合scRNA-seq 和空间转录组的数据表明 sPE 患者的上皮细胞和基质细胞不平衡,这归因于晚期分泌期子宫内膜,保留了增殖期的特征。具体而言,在蜕膜化过程中,上皮细胞向基质表型转变的基本方面存在失调。
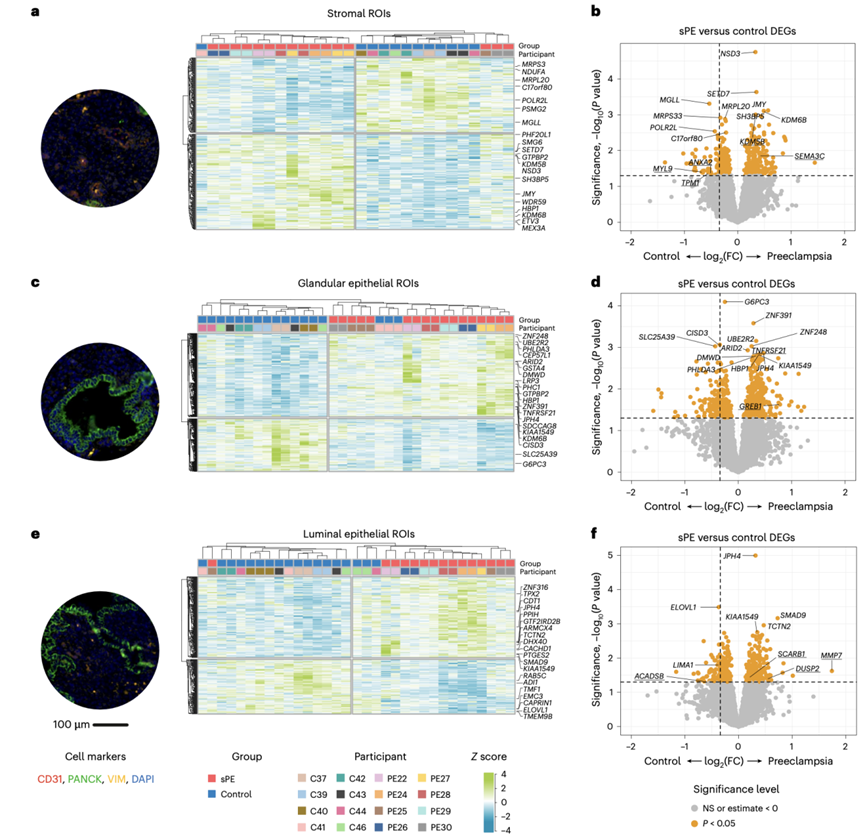
图5. 通过空间转录组学确认 sPE 患者样本中的 DR。
(a) 从一个代表性 sPE 样本中选择的富集基质 ROI 的 IF,以及无监督层次聚类。(b) 火山图描绘了基质 ROI内 sPE 和对照之间的 DEG。(c) 从一个代表性 sPE 样本中选择的富集腺上皮 ROI 的 IF,以及无监督层次聚类。(d) 火山图描绘了腺上皮 ROI内 sPE 和对照之间的 DEG。(e) 从一个代表性 sPE 样本中选择的富集腔上皮 ROI 的 IF,以及无监督层次聚类。(f) 火山图描绘了腔上皮 ROI 内 sPE 和对照之间的 DEG。
06
sPE 中 DR 的空间蛋白质组学
他们采用 LCM-MS 分析了从独立捐赠者群体(sPE)(图6a)中获取的晚期分泌期子宫内膜的腺上皮、腔上皮和基质。
基质区室具有最多的差异表达蛋白质。其中,401 个(43.9%)为 sPE 患者样本所特有,53 个(5.8%)为对照样本所特有(图6b)。sPE 样本特有的蛋白质包括 STAT3,它参与 PGR 下游的蜕膜化,在子宫内膜异位症中异常增加。sPE组对类固醇激素(特别是雌激素)的反应较强,如衰老和细胞生长(图6c),这与增殖增加相一致,并得到肿瘤发生中细胞增殖标志物(如 ARG1 和 B2M)的差异表达的支持。对照组显示 ECM 组织和 EMT 的富集。蛋白质-蛋白质相互作用网络分析确定雌激素受体 1(ESR1)和 STAT3 为关键蛋白,支持激素信号在 sPE 影响通路中的核心作用(图6d)。
对照组的腺上皮有 401 种(27%)独特蛋白质,而 103 种(6.9%)仅存在于 sPE 样本中,982 种蛋白质是两组共有的(图6b)。对照组的蛋白质组富集激素分泌,而 sPE 蛋白质组富集响应 ROS 和上皮细胞分化的细胞存活(图6c)。蛋白质-蛋白质相互作用网络显示这些途径与 ESR1 和 PGR 显著相互关联(图6e)。因此,中断的激素信号传导可能导致增殖/分化失衡,通过包括 ROS 生成和细胞骨架组织缺陷等机制影响子宫内膜腺体的分泌功能。与这种表型相关的显著蛋白质是对照组特有的,例如 EGFR 和 LRP1。此外,与对照组相比,sPE 患者的基质区室 PGR IF 染色显示表达降低(图6i),强化了影响这种情况的激素紊乱。
大部分腔内上皮蛋白质(562 种)在患者和对照组之间共存;67 种为对照组所特有,254 种(28.8%)为病例组所特有(图6b)。该蛋白质组富集了对类固醇的反应,特别是雌激素(图6c),雌激素是增殖期的主要激素。因此,sPE 特有的蛋白质参与细胞增殖、代谢增加,从而抑制凋亡信号传导。相反,对照组独有的蛋白质在 ECM 组织中富集。然后,他们建立了一个网络,其中包含与这些通路的代表性特征有关的蛋白质,这些蛋白质表达在 sPE 中受到严重干扰(图6f),证明这些通路之间存在紧密的互连性,以及 ESR1 和 PGR 的关键作用。
最后,他们确定了 scRNA-seq 和 LCM-MS 分析所识别的生物学过程之间的交集(图6g)。就 sPE 样本或对照所特有的数据而言,两个数据集之间存在高度一致性。在许多情况下,映射到两个或多个区室的相关生物学过程也有重叠。sPE 组的特征是参与表皮调节、对氧化应激/ROS 和衰老的反应的过程/分子。对照组的特征是蛋白质分泌、细胞生长、ECM 组织、白细胞粘附和 IL-2 产生等过程。sPE 组还因缺乏对照组中显著代表的过程而引人注目,例如腺体发育、对白血病抑制因子的反应和 EMT。
因此,通过将与 sPE 和对照样本相关的蛋白质组学通路与单细胞数据集中的 DEG 重叠,他们确认了在多组学水平上塑造 DR 的关键分子特征。单细胞分析显示, sPE 样本基质区室中SOD2上调,蛋白质组学分析显示,SOD2 在 sPE 基质区室中也富集。通过 IF 证实了这些发现,显示与对照组相比,sPE 患者的荧光强度显著增加(图6h-i)。总体而言,主要特征是子宫内膜各个区域增殖/分化不平衡,与对类固醇激素(特别是雌激素)的反应紊乱有关,这最终可能影响上皮-基质串扰和腺体的分泌功能。总之,这些结果提供了迄今为止对 DR 最深入的表征,不仅对了解 sPE 的发病机制有潜在的临床意义,而且对子宫内膜异位症和其他与 DR 相关的病理状况也有潜在的临床意义。
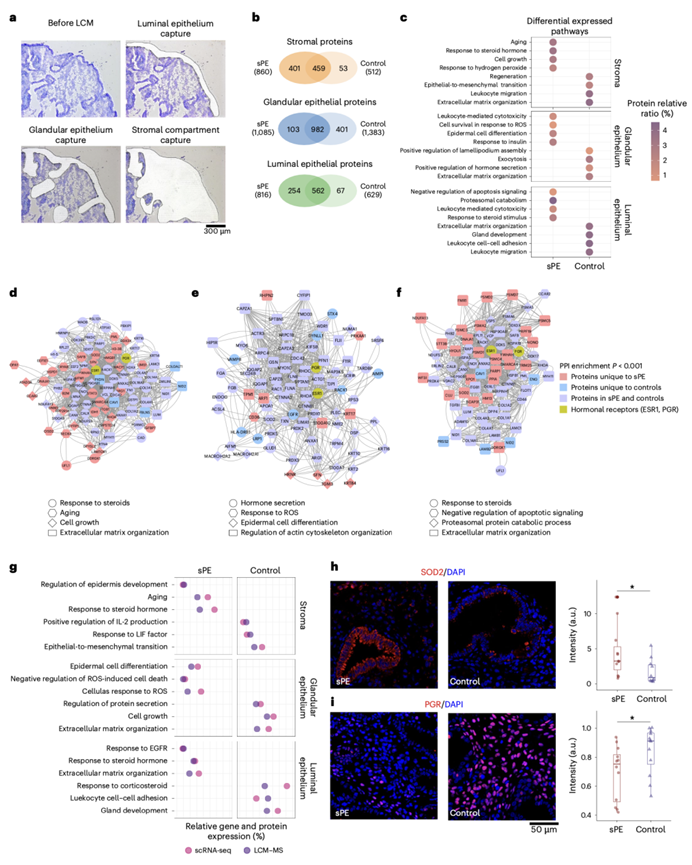
图6. 与对照组相比,sPE 患者中与 DR 相关的差异子宫内膜蛋白质组。
(a) 激光捕获显微切割之前和分离 ROI 之后的子宫内膜切片。(b) 维恩图显示在基质、腺上皮和腔上皮区室中 sPE 和对照之间鉴定出的蛋白质总数。(c) 每个分析区域中对照和 sPE 特有的差异表达通路。(d) PPI 网络包括参与基质区室中突出显示通路的蛋白质。(e) PPI 网络包括参与腺上皮中突出显示通路的蛋白质。(f) PPI 网络包括参与腔上皮中突出显示通路的蛋白质。(g) 点图显示空间蛋白质组 (LCM-MS) 和单细胞分辨率 (scRNA-seq) 下的 DEG 之间的功能富集一致。(h) sPE与对照样本中 SOD2 的 IF 验证和荧光强度的定量。(i) sPE与对照样本中 PGR 的 IF 验证和荧光强度的定量。
+ + + + + + + + + + +
结 论
本研究使用多组学策略,揭示了sPE患者的 DR 细胞和分子特征。形态学分析发现显著的腺体解剖异常。对 sPE 患者和对照组的子宫内膜样本进行scRNA-seq揭示了与 sPE 相关的细胞组成变化,表现为基质镶嵌状态,其特征是增生性基质细胞(MMP11和SFRP4) 以及IGFBP1+蜕膜化细胞,同时存在上皮镶嵌性和与蜕膜化相关的上皮-基质转化缺乏。细胞间通讯网络映射强调了特定细胞类型之间的异常相互作用。空间转录组学数据验证了 DR 相关特征。空间蛋白组学数据证实了几个 scRNA-seq 发现,特别是在通路水平上没有基质到上皮的转变,这表明对类固醇激素(特别是雌激素)的反应中断。
+ + + + +



 English
English


