文献解读|Signal Transduct Target Ther(40.8):时空转录组学阐明暴发性病毒性心肌炎的发病机制
✦ +
+
论文ID
原名:Spatiotemporal transcriptomics elucidates the pathogenesis of fulminant viral myocarditis
译名:时空转录组学阐明暴发性病毒性心肌炎的发病机制
期刊:Signal Transduction and Targeted Therapy
影响因子:40.8
发表时间:2025.02.10
DOI号:10.1038/s41392-025-02143-9
背 景
心肌炎是一种心脏炎症性疾病,主要由病毒感染引起,例如柯萨奇病毒B3(CVB3)、细小病毒B19、腺病毒和流感病毒。其他病因,例如细菌、原虫和真菌,以及毒素、药物和全身免疫疾病,也可诱发心肌炎。近年来,免疫检查点抑制剂 (ICI) 等抗肿瘤药物的广泛使用和COVID-19的流行导致心肌炎发病率和死亡率上升。心肌炎可影响所有年龄段的人群,但最常见于儿童和 40 岁以下的青壮年。暴发性心肌炎(FM)是最严重的心肌炎,其特征是突然发病并迅速发展为心脏功能障碍,需要正性肌力和机械循环支持。FM中严重的心肌炎症可导致扩张型心肌病、恶性心律失常和意外的心源性死亡。多中心临床研究报道,FM患者住院死亡率或心脏移植率为 25.5%,5 年生存率不足 50%。儿童住院期间死亡率更高,可达 48%。虽然以生命支持为基础的综合治疗方案已将 FM 患者住院死亡风险降至 5% 以下,但长期预后仍然不佳。
实验设计
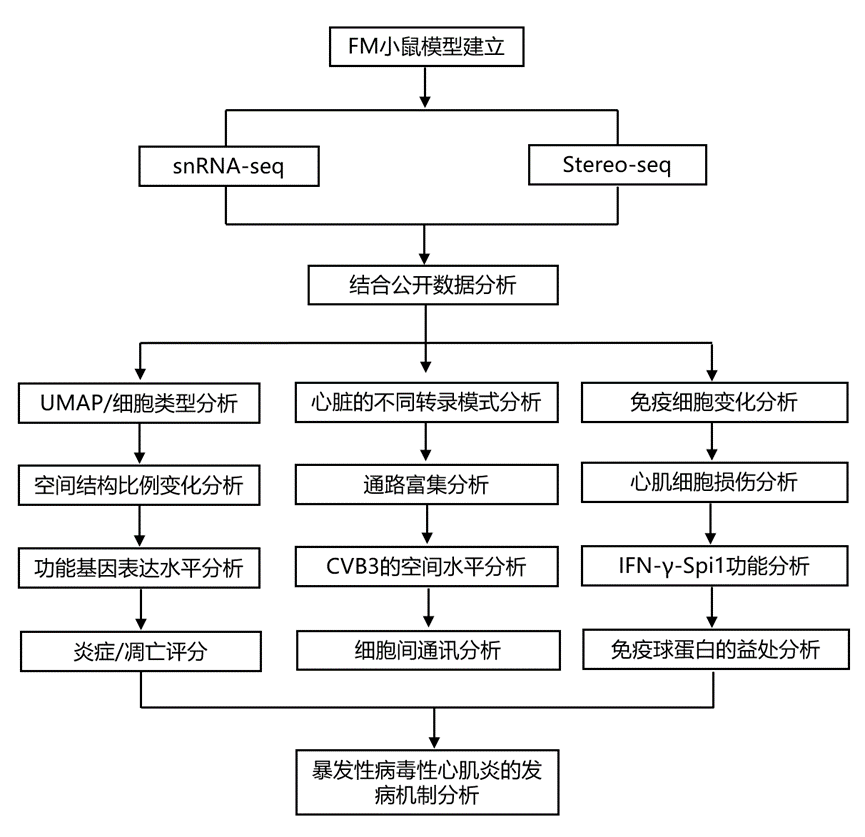
结 果
01
CVB3 感染心脏的单细胞核转录组分析和空间转录组测序
为了彻底探索FM的病理生理学,研究团队对感染后1-7天(dpi:感染后天数)从健康和CVB3感染的A/J小鼠中提取的心脏切片细胞进行了单细胞核转录组分析(snRNA-seq)和空间转录组分析(stereo-seq)(图1a),确定了包含14种主要细胞类型的细胞图谱(图1b-c)。 全面的细胞成分分析显示心肌细胞比例减少,免疫细胞部分成反比增加,巨噬细胞和T淋巴细胞明显增加,与病理状态的进展时间一致(图1d)。同时,收缩蛋白和心脏源性因子的表达水平降低,而趋化因子和分泌因子的表达水平升高(图1e)。从受感染的心脏和模拟对照中分析了从 1 到 7 dpi 的总共 467017 个 bin50 分辨率的 bin[50×50 DNA 纳米球(DNB)]进行聚类,揭示了明显的时间依赖性转录变化。
心肌炎感染区域以苏木精和伊红 (H&E) 染色显示的炎症区域为界,在 1-2 dpi时呈初始分散分布,随后融合,在 6-7 dpi 时几乎占据整个心脏组织(图1f)。与对照组相比,7 dpi 时上调基因定义的感染反应评分也有所增加(图1g)。此外,定量空间面积分析一致显示受影响的心肌炎区域明显扩大,同时心室区域成比例缩小(图1h)。通过整合 snRNA-seq 和 stereo-seq数据,研究描绘出了心肌炎区域的细胞景观,确定了巨噬细胞、T 细胞、中性粒细胞和 B 细胞是主要细胞群(图1i),其中巨噬细胞的患病率最高(图1i-j)。
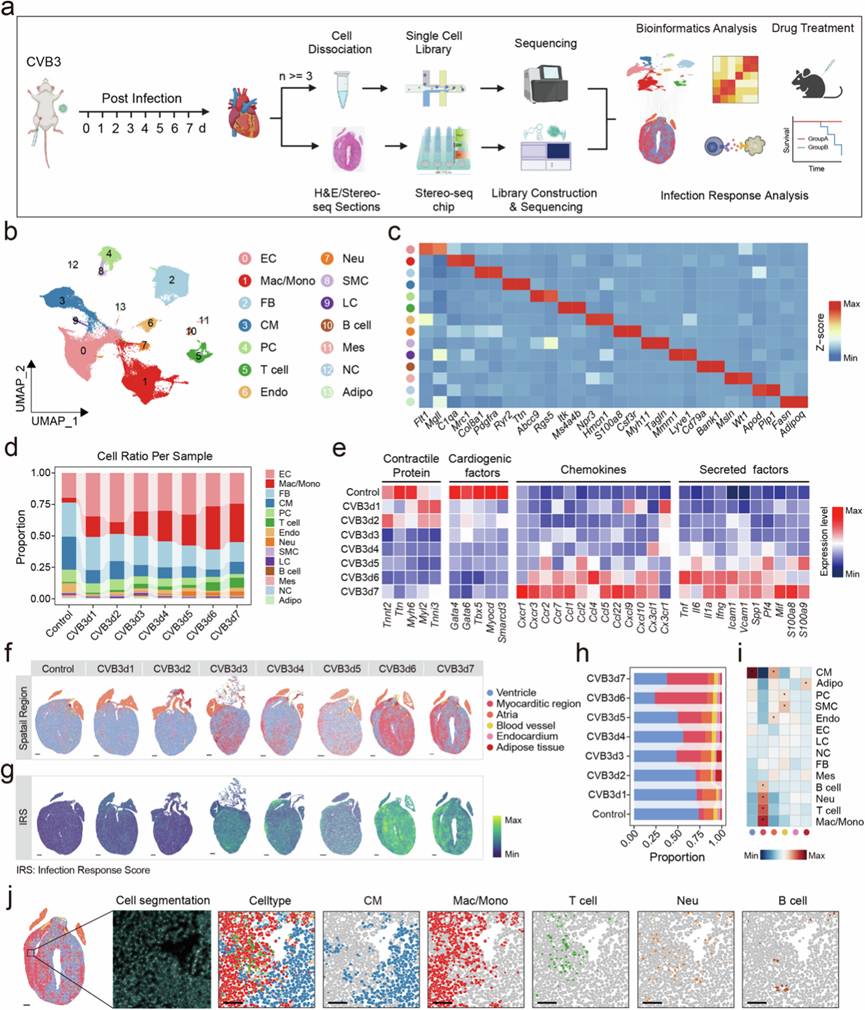
图1. FM 小鼠的时空景观。
(a) 本研究工作流程示意图。(b)UMAP可视化。(c) 热图显示每种细胞类型中细胞分型基因的表达水平。(d) 不同时间点之间的细胞成分变化。(e) 热图显示不同时间点特定功能基因的表达水平。(f-g) 1至 7 dpi 对照组和 CVB3 感染小鼠心脏组织切片的空间结构和感染反应评分。(h) 不同时间点之间的空间结构比例变化。(i) 热图显示 snRNA-seq 中定义的细胞类型与立体测序数据中定义的空间结构之间的 Pearson 相关性。(j) 7 dpi 时CVB3感染小鼠心脏组织切片上的空间免疫细胞浸润。
02
心肌炎组织中的空间限制基因表达模式
为了研究 FM 进展过程中的转录动态,他们基于立体测序数据研究了 FM 小鼠心脏中的基因表达模式。共确定了 9 个模块(图2a)。几个模块表现出不同的空间模式,例如模块 5 在心房心肌中稳定富集。模块 2 表达的显著下降表明心肌细胞收缩功能丧失,而模块 2 在横纹肌收缩功能中富集(图2a-b)。这与 FM 进展过程中观察到的心脏功能下降一致。随着疾病的进展,模块 3 变得更加普遍,并且主要在炎症相关通路中富集(图2a-b),表明在 CVB3 感染期间免疫反应逐渐激活。在 1 dpi 时,模块 8 表现出显著的富集(图2a-b) ,该模块主要在对病毒的防御反应和对干扰素 α (IFN-α) 途径的反应中富集。为了证实这些结果,他们根据 snRNA-seq 数据计算了基因得分。在 FM 小鼠的心脏中,炎症和凋亡评分也显示出时间依赖性的升高,而心肌收缩评分下降,干扰素 α 评分在 1 dpi 时达到峰值(图2c-f)。除此之外,Mfuzz 揭示了 4 个具有相似时间依赖性表达模式的聚类。聚类 2 中的基因(543 个基因)随着时间的推移表现出表达升高。这些基因在与免疫系统抵抗感染和炎症的能力相关的生物过程中高度富集。聚类 4(615 个基因)显示与心脏收缩功能相关的基因表达随时间下降。聚类 3(364 个基因)在 1 dpi 时高表达并与病毒反应过程相关。为了确定 1 dpi 时 IFN-α 释放增强的来源,他们分析了 CVB3 阳性细胞周围的免疫细胞比例,发现中性粒细胞最为丰富。此外,中性粒细胞在 1 dpi 时具有最高的 IFN-α 评分,表明它们是该疾病的第一反应者。在第 0 天而不是第 4 天消耗中性粒细胞可降低 FM 小鼠的死亡率和心脏炎症,改善心脏功能。这与之前的发现一致,即中性粒细胞在 FM 早期阶段发挥了重要作用。
接下来,他们探索了不同空间区域的基因表达模式。PROGENy 分析表明,心室区域主要与磷酸肌醇 3-激酶 (PI3K) 和肿瘤坏死因子 (TNF) 相关凋亡诱导配体 (TRAIL) 通路有关(图 2g)。PI3K 通路支持健康心肌的收缩功能。同时,由于 TRAIL 是死亡受体5的配体,因此观察到其改变的表达会影响细胞凋亡在抑制炎症中的保护作用,表明 FM 中心肌细胞受损的风险。心肌炎区域显示炎症反应相关通路的激活,包括 TNF-α 和核因子-κB (NF-κB) 通路(图2g-h),巨噬细胞显著激活(图2i)。进一步分析发现,这些炎症通路在疾病后期明显升高,有趣的是,在疾病发生6 dpi时,心室区细胞也表现出明显的炎症激活和缺氧通路,这表明正常的心肌细胞在疾病后期也发生了炎症(图2j)。
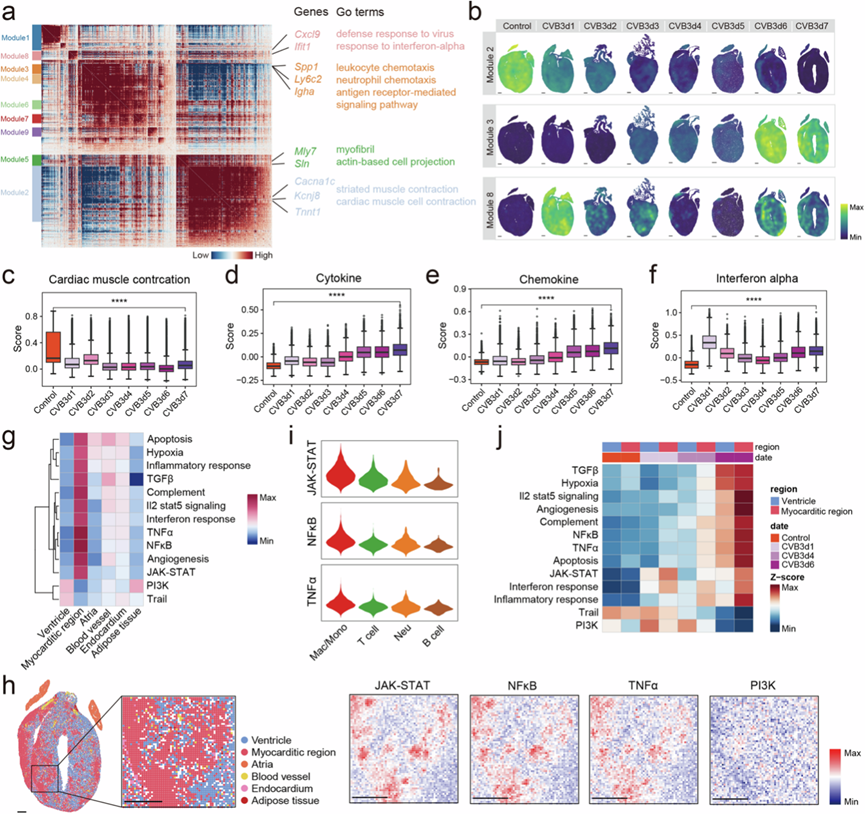
图2. FM 进展过程中心脏的不同转录模式。
(a) 热图显示具有显著空间自相关的基因,根据心脏组织切片上的成对空间相关性将其分组为不同的模块。(b) 1至 7 dpi 对照组和 CVB3 感染小鼠心脏组织切片上模块基因的表达。(c-f) 1 至 7 dpi 对照组和 CVB3 感染小鼠的心肌收缩评分、细胞因子评分、趋化因子评分和干扰素 α 评分的箱线图。(g) 不同空间结构上通路富集的热图。(h) 7 dpi 典型心脏组织切片上的通路激活状态。
03
间皮细胞触发宿主先天免疫反应
为了更好地描述FM的发展过程,他们使用Pearson相关性分析确定了疾病的早期(1-3 dpi)和晚期(4-7 dpi)(图3a)。与早期相比,免疫基因表达更为剧烈,晚期免疫相关通路显著激活(图3b-c)。同时,病毒应答相关通路在早期显著富集(图3c)。如预期的那样,CVB3水平呈现时间依赖性增加,表明注射CVB3后病毒复制(图3d)。为了在空间分辨率下评估病毒入侵状况,他们分析了1至7 dpi的感染心脏的空间转录组数据。CVB3阳性细胞最初在早期分散,然后在晚期急剧增生到整个心脏,尤其是在6和7 dpi(图3e)。接下来,他们分析了 CVB3 在每种细胞类型中的分布。结果表明,在所有细胞类型中均检测到了 CVB3(图3f)。值得注意的是,CVB3 RNA 的空间分布与心肌区域相匹配,心肌区域的病毒表达最高(图3g-h)。这表明在疾病晚期,迫切需要具有强大免疫功能的细胞来吞噬和处理病毒。
为了研究发病机制的启动,他们分析了结构细胞中的 CVB3 水平。结果表明,间皮细胞在 1 dpi 时具有最高 CVB3 水平(图3i)。间皮细胞在疾病进展过程中也表现出最高的感染反应评分(图3j)。为了更详细地探索感染细胞的异质性,他们使用 snRNA-seq 数据重新聚类了心肌细胞、内皮细胞和成纤维细胞。他们在心肌细胞、内皮细胞和成纤维细胞中发现了三个发炎亚聚类(CM2、EC2 和 FB2),它们的 CVB3 水平和感染反应评分分别较高。然而,与早期的三个炎症亚聚类相比,间皮细胞显示出更高的 CVB3 水平和感染反应评分。由于间皮细胞主要分布在心脏的心包中,心包可能是心脏中第一个受到CVB3 感染的区域。这与炎症首先出现在心包附近,然后蔓延到整个心脏的观察结果一致(图3k)。为了确定这一点,他们分析了心肌炎区域到心脏边界的距离(图3l)。结果表明,在疾病进展过程中,心肌炎区域的分布更靠近心脏的外缘(图3m)。免疫荧光染色实验也验证了在 1 dpi 时间皮细胞中存在病毒 RNA(图3n)。
CellChat 分析显示,早期巨噬细胞与间皮细胞之间存在密切的细胞间通讯(图3o)。这表明间皮细胞可能通过C3 / C3ar1和C3/(Itgam+Itgb2)激活巨噬细胞。此外,间皮细胞在感染后表达了几种与损伤相关的分子模式,例如Ubb,这加剧了炎症反应(图3p)。他们检测了免疫细胞中模式识别受体的表达,发现它们主要在巨噬细胞上表达(图3q),并且主要在疾病早期表达。间皮细胞也是支持巨噬细胞生长的集落刺激因子(CSF)信号通路的重要介质(图3r)。
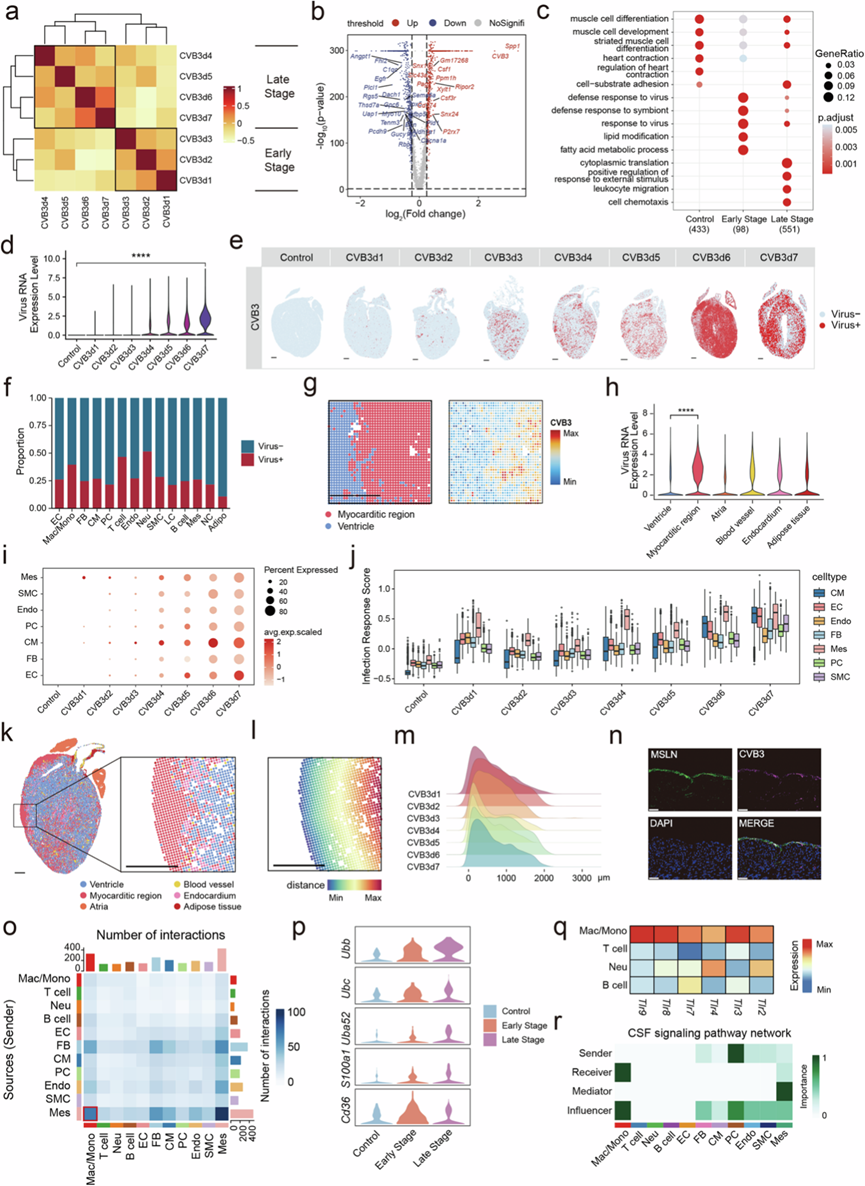
图3. CVB3感染心脏结构细胞和免疫细胞。
(a) 基于Pearson相关性的疾病进展阶段划分。(b) 比较早期和晚期细胞时调控基因的火山图。(c)GO分析。(d) 小提琴图显示snRNA-seq数据中1至7 dpi对照和CVB3感染小鼠心脏细胞中CVB3水平。(e) 1至7 dpi对照和CVB3感染小鼠心脏组织切片中CVB3水平。(f) snRNA-seq数据中CVB3阳性细胞在所有细胞类型中的比例。(g) 心脏切片中CVB3 mRNA分布的典型图像。(h) 不同空间区域CVB3水平的小提琴图。(i) 气泡图显示 snRNA-seq 数据中 1 至 7 dpi 时对照和 CVB3 感染小鼠心脏每种细胞类型中 CVB3 的水平。(j) 1 至 7 dpi时对照和 CVB3 感染心脏的 snRNA-seq 数据中心脏结构细胞的感染反应评分。(k) 4 dpi时分布在 CVB3 感染小鼠心脏边界区域附近的心肌区域的代表性空间图像。(l) 4 dpi 时心肌区域到 CVB3 感染小鼠心脏边界区域距离的代表性空间图像。(m) 1 至 7 dpi 时心肌区域到 CVB3 感染小鼠心脏边界区域的距离。(n) 1 dpi 时MLSN和 CVB3 的免疫荧光染色显示感染的间皮细胞。(o) 热图显示早期免疫细胞与结构细胞之间的信号传导相互作用数量。(p) 小提琴图显示不同阶段对照组和 CVB3 感染小鼠间皮细胞中损伤相关分子模式基因的表达水平。(q) 热图显示主要免疫细胞类型中 toll 样受体的表达水平。(r) 热图显示心脏免疫细胞与结构细胞之间的 CSF 信号通路相互作用。
04
巨噬细胞表现出强烈的促炎活性并募集细胞毒性 T 细胞
在疾病晚期可观察到明显的局灶性免疫浸润积聚。为了更好地描述FM的特征,他们定义了晚期心脏切片中紧密包围心肌炎区域的边界区(图4a)。如预期的那样,心肌炎区域主要富集与炎症相关的过程,而心室区域主要与心脏收缩功能有关。然而,发现几种胶原相关通路在边界区富集,这与该区域中成纤维细胞的最高丰度相一致(图4b)。在空间切片中也观察到了成纤维细胞的边界区富集模式及其代表性基因表达(图4c)。边界区的细胞外基质(ECM)评分也升高,成纤维细胞基因表达与ECM评分呈正相关(图4d)。细胞相互作用分析表明,髓系细胞释放多种炎症介质,诱导成纤维细胞的积聚和活化。
从心室区到边界区再到心肌区,TNF-α、NF-κB、Janus 激酶-信号转导和转录激活因子 (JAK-STAT) 和缺氧通路等几种通路均升高,表明心肌区炎症反应增强。然后他们分析了从心室区边界区到心肌区的免疫细胞变化。巨噬细胞和 T 细胞在心肌区显著富集(图4e),表明它们在心脏炎症反应中的重要作用。
他们使用无偏聚类方法鉴定了 FM 不同阶段的不同髓样细胞亚群。根据相关标志基因的表达鉴定了九种不同的巨噬细胞和树突状细胞群(图4f)。在 1-2 dpi 时,Mac_Mrc1 是主要的巨噬细胞亚型,而 Inflammatory_Mac、Mac_IFNIC、Mac_Gpnmb、Mono_Ccr2 和 Mac_Mertk 的比例随着疾病的进展逐渐增加。在这些细胞中,Inflammatory_Mac 具有最高的促炎和细胞因子评分,并且在几种炎症相关通路中富集(图4g-h),表明这种细胞类型在炎症过程中起着重要作用。Mono_Ccr2 从外周血中迁移。该细胞群命名为Mac_IFNIC,高表达IFN-α,主要与IFN相关通路相关。为了探索Inflammatory_Mac的起源,他们对所有巨噬细胞亚群进行了轨迹分析,并确定了3条不同的轨迹(图4i)。轨迹3表明Inflammatory_Mac是由Mono_Ccr2沿着Mac_IFNIC发展而来的(图4j-k)。使用Monocle2进行轨迹分析也获得了类似的结果。这些结果表明外周血中的单核细胞在受到CVB3激活后发育成Mac_IFNIC。之后,这些细胞发育成Inflammatory_Mac,并发挥各种促炎作用。
接下来他们对高粒度的T细胞进行了分析。注释了四个T细胞和NK细胞亚群(图4l),Cd8 +效应T细胞在晚期最为丰富(图4m)。空间转录组数据也表明在7 dpi时Cd8 +效应T细胞的丰度较高。此外,Cd8 +效应T细胞表现出最强的T细胞细胞毒作用,Fasl和Gzmb表达较高(图4n)。Cd8 +效应T细胞的通路富集表明它们与病毒应答通路有关,并释放干扰素γ(IFN-γ)(图4n)。 Cd8 +效应T细胞也高度表达CCR家族的趋化因子,例如Ccr2和Ccr5,表明它们汇集于炎症部位。
细胞通讯分析显示巨噬细胞与 Cd8+效应 T 细胞有强烈的相互作用,并且 Inflammatory_Mac 趋化作用通过 MHC-I 和 CCL 分子激活 Cd8 +效应 T 细胞(图4o)。炎症巨噬细胞也表现出与 Cd8+效应 T 细胞的强烈空间共定位(图4p)。
总体而言,心肌炎区域巨噬细胞和T细胞显著富集。迁移到心脏后,外周单核细胞发育为Mac_IFNIC和Inflammatory_Mac。Inflammatory_Mac趋化激活Cd8+效应T细胞,导致组织损伤。
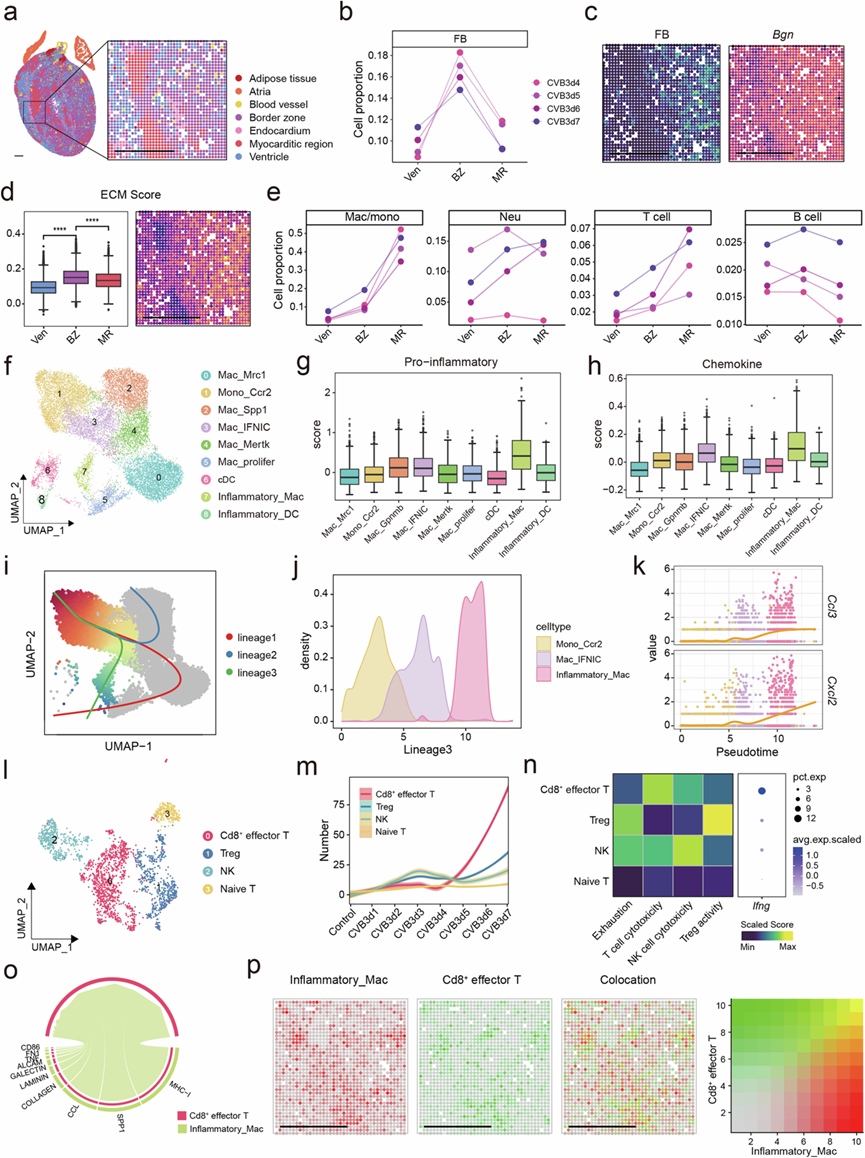
图4. 巨噬细胞趋化性激活细胞毒性 T 细胞。
(a) CVB3 感染小鼠心脏组织切片的空间转录组图。(b) 受感染心室内预测的平均成纤维细胞比例的变化。(c) 成纤维细胞的空间分布(左)和空间切片上Bgn的表达(右)。(d) 心室区域、边界区和心肌炎区域之间的 ECM 评分箱线图(左)和空间切片上的 ECM 评分(右)。(e) 受感染心室内预测的平均细胞类型比例的变化。(f)UMAP可视化。(g-h) 不同巨噬细胞亚聚类之间的促炎和趋化因子评分的箱线图。(i)UMAP可视化。(j) Mono_Ccr2、Mac_IFNIC 和 Inflammatory_Mac 沿发展轨迹的密度。(k) Ccl3和Cxcl2沿发展轨迹的表达。(l)UMAP可视化。(m)疾病进展过程中的 T 细胞亚群数量。(n) T 细胞亚群中的功能基因集和Ifng表达水平。(o)相互作用分析。(p) Inflammatory_Mac和Cd8 +效应 T 细胞的空间共定位。
05
Cd8+效应 T 细胞释放的 IFN-γ通过 Spi1 诱导心肌细胞死亡
心肌细胞 (CM) 是心脏最重要的结构和功能细胞,它们在 FM 进展过程中会大量丢失(图1f)。从心室区域到边界区再到心肌区域,CM 的比例显著下降(图5a),表明炎症部位的心肌细胞受到损伤。随着病情的进展,snRNA-seq 数据中 CM 的死亡基因表达显著增加(图5b)。除了 CVB3 阳性心肌细胞外,CVB3 阴性心肌细胞的死亡评分也高于对照组,凸显了其在免疫介导的组织损伤中的重要作用。他们进一步根据 CVB3 水平和死亡评分在 snRNA-seq 数据中鉴定了四个心肌细胞亚群(图5c)。健康心脏中大多数 CM 为具有正常收缩功能的 virus--deathlow CM(图5d-e),健康心脏中仅存在少部分 virus--deathhigh CM(图5d)。随着病情的进展, virus--deathlow CM的数量显著减少,而两种具有高死亡基因表达的细胞群—virus--deathhigh CM和virus+-deathhigh CM 显著增加,它们表达更高的炎症和死亡基因(图5d-e)。有趣的是,virus--deathhigh CM的比例远远高于virus+-deathhigh CM(图5d)。这些结果表明免疫介导的损伤可能对 CM 造成剧烈损害。如前所述,Cd8+效应 T 细胞表现出高细胞毒性并表达高水平的 IFN-γ(图4n),这可能导致心肌细胞损伤。空间共定位分析表明,心脏收缩基因和 T 细胞细胞毒性基因的表达受到强烈排斥(图5f)。此外,靠近 Cd8+效应 T 细胞的 CM 比远离 Cd8+的 CM具有更高的凋亡、坏死性凋亡和焦亡评分效应T细胞(图5g)。此外,病毒死亡高CM的特异性基因与Cd8+效应T细胞具有很强的共定位,突出了T细胞介导的CM损伤的重要性(图5h)。如前所述,Cd8+效应T细胞特异性表达Ifng(图4n),并且感染期间T细胞中Ifng的表达增加(图5i)。相关性分析表明CM的死亡评分与干扰素γ反应具有高度相关性,而不是Gzmb的表达。晚期用CD8α中和抗体消耗Cd8+效应T细胞可降低FM小鼠的死亡率,改善心脏功能,减少心脏炎症浸润,心脏中IFN-γ水平也降低。为探讨IFN-γ在心肌细胞死亡中的作用,他们用重组IFN-γ处理小鼠原代心肌细胞,发现IFN-γ能强烈诱导CM中死亡基因的表达(图5j)。此外,IFN-γ抗体处理可显著降低FM小鼠的死亡率,改善心脏功能并减轻心脏炎症浸润。
接下来,他们探究了 Cd8 +效应 T 细胞释放的 IFN-γ介导 CM 损伤背后的机制。调节子调节分析表明,病毒死亡低的健康细胞受 Hand2 等转录因子的调节,据报道这些转录因子可维持心肌细胞的正常功能。但病毒死亡高的细胞主要受 Spi1 和 Gatad1 等转录因子调控(图5k)。为了增加这些结果的临床相关性,他们对 4 个 FM 患者和 3 个健康对照的心脏样本进行了批量 RNA 测序。结果表明,FM 小鼠心肌区域中的大多数上调基因也存在于 FM 患者的心脏样本中。有趣的是,在调节病毒死亡高CM的转录因子中,SPI1 是唯一在 FM 患者心脏中升高的转录因子(图5l)。此外,SPI1 的表达与几种死亡基因的表达呈正相关。因此,他们在后续研究中主要关注Spi1。在之前报道的 FM 小鼠心脏的转录组数据中,Spi1也显著升高(图5m)。此外,IFN-γ可直接诱导小鼠原代心肌细胞中Spi1的表达(图5n)。此外,Spi1 的活性与响应 IFN-γ的基因有很强的相关性(图5o)。为了探索Spi1与 IFN-γ介导的心肌细胞死亡的关系,他们分离了小鼠原代心肌细胞并用 IFN-γ 和 si-Spi1 处理。结果表明沉默Spi1可以在mRNA(图5p)和蛋白质水平(图5q)上挽救IFN-γ介导的心肌细胞死亡。此外,他们用Spi1抑制剂治疗FM小鼠,FM小鼠的死亡率显著降低,免疫浸润减少,FM小鼠的心脏功能显著改善(图5r-u)。
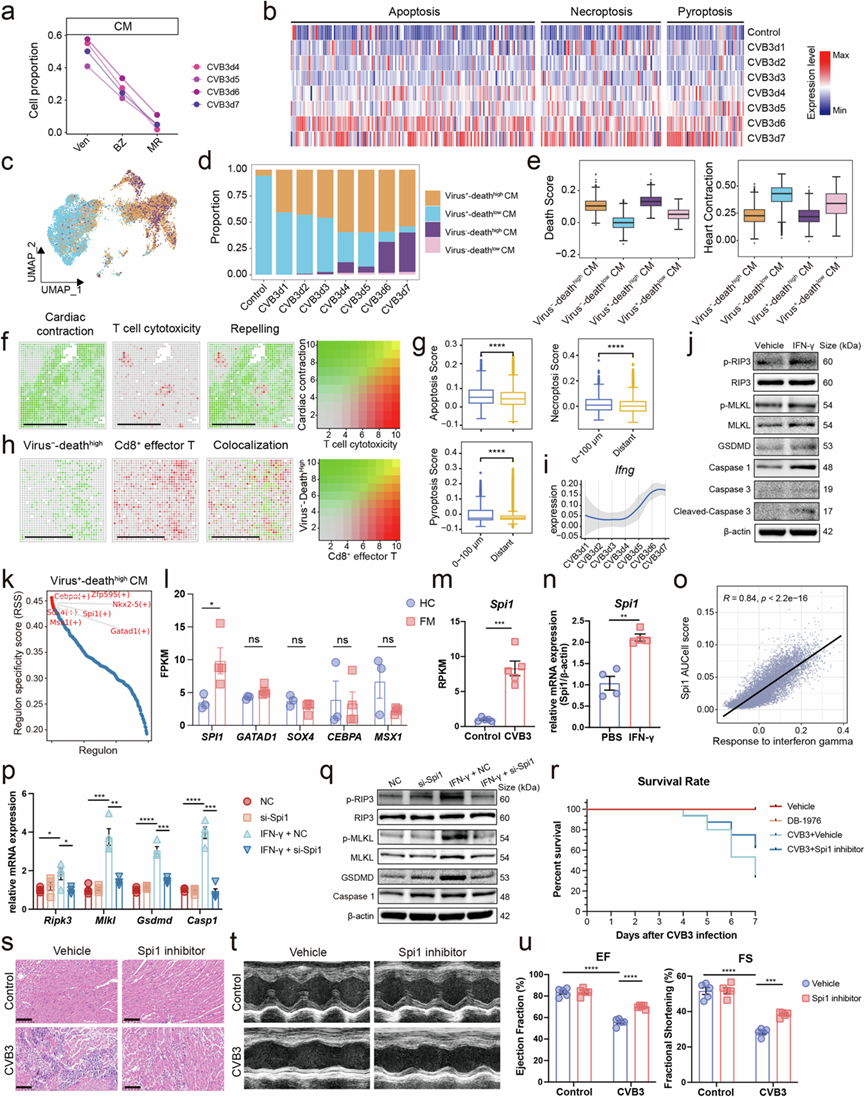
图5. Cd8+ 效应T细胞诱导心肌细胞损伤。
(a) 后期感染心室内心肌细胞平均预测比例的变化。(b) snRNA-seq数据中疾病进展过程中凋亡、坏死性凋亡和细胞焦亡基因的表达。(c)UMAP可视化。(d) 不同时间点心肌细胞的细胞比例变化。(e) 不同心肌细胞亚聚类之间的死亡评分和心脏收缩评分的箱线图。(f)空间共定位分析。(g) 靠近 Cd8 +效应 T 细胞和远离 Cd8 +效应 T 细胞的心肌细胞凋亡、细胞焦亡和坏死性凋亡评分的箱线图。(h)细胞间的空间共定位分析。(i) 同感染时间 T 细胞中Ifng的表达趋势。(j)免疫印迹分析。(k)调控因子分析。(l) FM 患者心脏中关键转录因子的表达。(m) Spi1在FM 小鼠和对照组心脏中的表达。(n) Spi1在 IFN- γ处理的小鼠原代心肌细胞中的表达。(o) 干扰素γ反应评分与心肌细胞 Spi1 AUCell 评分之间的相关性。(p) IFN-γ 和 si-Spi1 处理的小鼠原代心肌细胞中死亡基因的 mRNA 水平变化。(q) IFN-γ 和 si-Spi1 处理的小鼠原代心肌细胞中死亡基因的蛋白质水平变化。(r-u) FM 和 Spi1 抑制剂处理小鼠的存活率、H&E 染色图像、代表性超声心动图图像和心脏功能(射血分数和缩短分数)变化。
06
静脉注射免疫球蛋白 (IVIG) 治疗可减轻 FM 的炎症
由于过度激活的免疫反应与 FM 的发病机制有关,他们探索了众所周知的免疫调节药物 IVIG 对 FM 的治疗作用。他们对 1-7 dpi 时从对照和 IVIG 治疗的 CVB3 感染的 A/J 小鼠中提取的心脏切片进行了多组学分析(图6a)。IVIG 的给药将 FM 小鼠的死亡率从近 70% 降低到 0%。主成分分析还表明,在转录水平上,治疗后的样本分布更接近对照样本而不是 CVB3 样本(图6b)。IVIG 治疗后,炎症评分和病毒 RNA 均降低(图6c-d)。从空间上看,大多数改变的基因在心肌炎区域表达(图6e-f),治疗后心肌炎区域的面积减少,表明 IVIG 具有强大的免疫调节作用。IVIG 还减少了几种免疫细胞的浸润,尤其是促炎性巨噬细胞(图6g)。由于巨噬细胞在趋化和激活 Cd8+效应 T 细胞中起关键作用,炎性巨噬细胞数量的减少导致巨噬细胞和 Cd8 +效应 T 细胞之间的通讯减少(图6h)。巨噬细胞趋化因子释放减少进一步减少了 Cd8+效应 T 细胞的数量(图6i-k)。因此,治疗组T细胞表达的细胞毒分子和Ifng数量也减少(图6l-m),从而降低了心肌细胞中Spi1的活性(图6n),心肌细胞死亡也减少。这些结果证明了 IVIG 强大的免疫调节作用,凸显了其对 FM 的治疗潜力。
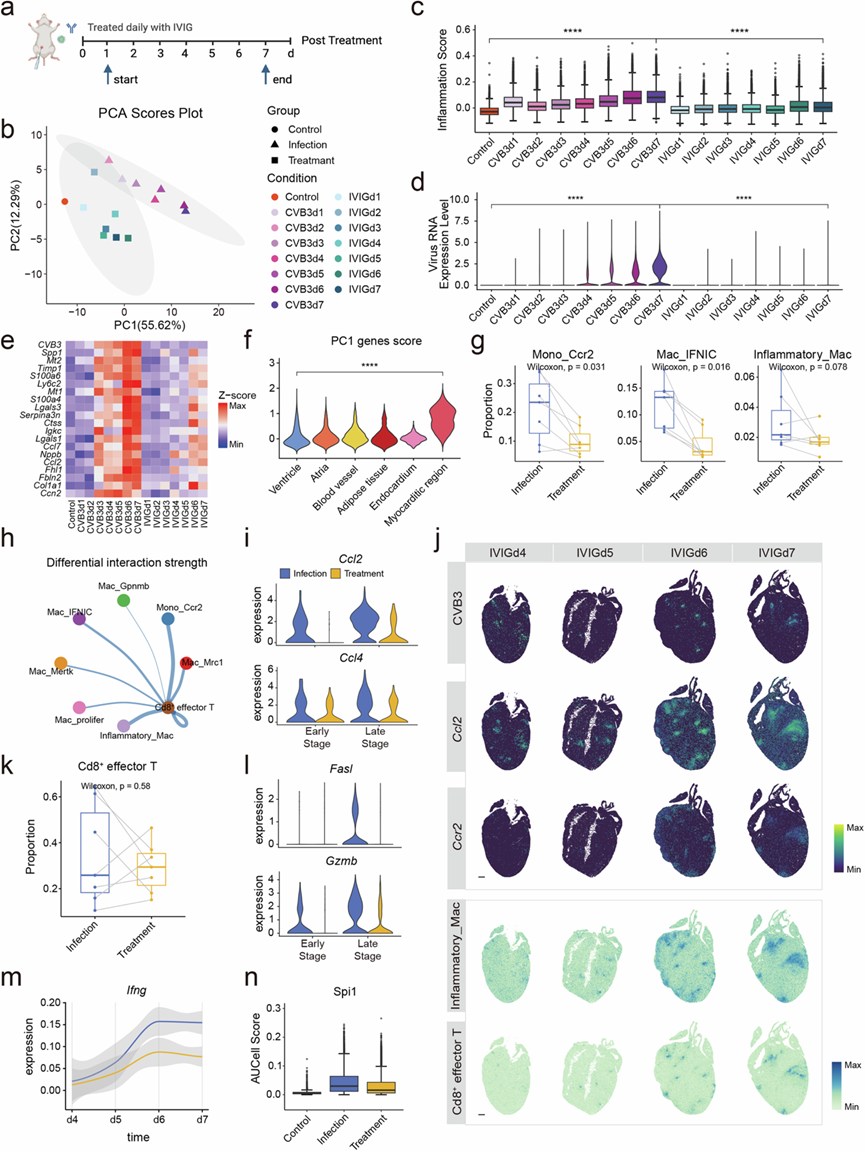
图6. IVIG对FM小鼠的治疗效果。
(a)实验示意图。(b) 1至7dpi对照、感染和治疗样品的PCA分析。(c) 1至7dpi对照、感染和治疗样品的炎症评分水平。(d) 1至7dpi对照、感染和治疗样品的CVB3水平。(e) 显示PC1基因表达水平的热图。(f) 小提琴图显示PC1基因在不同空间区域的表达。(g) 感染组和治疗组Mono_Ccr2、Mac_IFNIC和Inflammatory_Mac的比例。(h) 感染组和治疗组心脏巨噬细胞与T细胞之间细胞相互作用的差异强度。(i) 不同阶段感染组和治疗组中Inflammatory_Mac对趋化因子(Ccl2和Ccl4)的表达。(j) 治疗组晚期心脏切片CVB3水平、Ccl2、Ccr2表达及Inflammatory_Mac、Cd8+效应T细胞分布。(k) 感染组与治疗组Cd8 +效应T细胞比例。(l) 感染组与治疗组不同时期Cd8 +效应T细胞细胞毒分子(Fasl、Gzmb)表达情况。(m) 感染组与治疗组T细胞中Ifng随感染时间变化趋势。(n) 对照组、感染组与治疗组Spi1的AUCell评分。
+ + + + + + + + + + +
结 论
本研究结果表明,间皮细胞在心肌炎早期阶段发挥着关键作用,是 CVB3 感染的主要靶点,这会触发巨噬细胞的激活,引发炎症级联。随后,促炎性 Inflammatory_Mac 和 T 细胞渗入心肌,导致组织损伤。本研究还发现 Cd8 +效应 T 细胞是心肌细胞损伤的关键介质。这些细胞释放细胞毒性分子,特别是 IFN-γ,它会调节Spi1的表达,而 Spi1 是一种与加剧心肌细胞死亡和促进疾病进展有关的因素。针对 IFN-γ/ Spi1轴的治疗干预措施在 FM 模型中表现出显著疗效。值得注意的是,静脉注射免疫球蛋白 (IVIG) 治疗降低了死亡率、抑制了病毒增殖并减轻了 FM 的炎症过度状态。IVIG 疗法还下调了 IFN-γ 和Spi1 的表达,凸显了其免疫调节和治疗潜力。
+ + + + +



 English
English


