文献解读|Gut(23.0):多项研究中的肠-肝-脂肪轴多组学揭示了肠道微生物群和抗病毒反应与全身葡萄糖代谢之间的一致联系
✦ +
+
论文ID
原名:Multiomics of the intestine-liver-adipose axis in multiple studies unveils a consistent link of the gut microbiota and the antiviral response with systemic glucose metabolism
译名:多项研究中的肠-肝-脂肪轴多组学揭示了肠道微生物群和抗病毒反应与全身葡萄糖代谢之间的一致联系
期刊:Gut
影响因子:23.0
发表时间:2025.01.17
DOI号:10.1136/gutjnl-2024-332602
背 景
肥胖与多种代谢变化有关,特别是胰岛素抵抗和 2 型糖尿病 (T2D)。近年来,人们认识到微生物群在确定肥胖、2 型糖尿病和代谢综合征倾向方面具有强大的系统性影响。在实验模型中,肠道微生物群会增加肠道通透性,有利于微生物群衍生的脂多糖 (LPS) 易位到血液中。这会导致代谢性内毒血症,从而引发肥胖和胰岛素抵抗。虽然一些研究探索了肠道微生物群与人类胰岛素敏感性之间的联系,但大多数研究都使用了单组学方法,重点关注单个组织,并且通常仅限于单个人类群体。目前缺乏对肠道微生物群、肠道、脂肪组织和肝脏之间影响全身胰岛素作用的复杂相互作用的整体理解。先前研究的局限性强调需要采取更全面、更综合的方法来掌握这些相互作用的复杂性。
实验设计
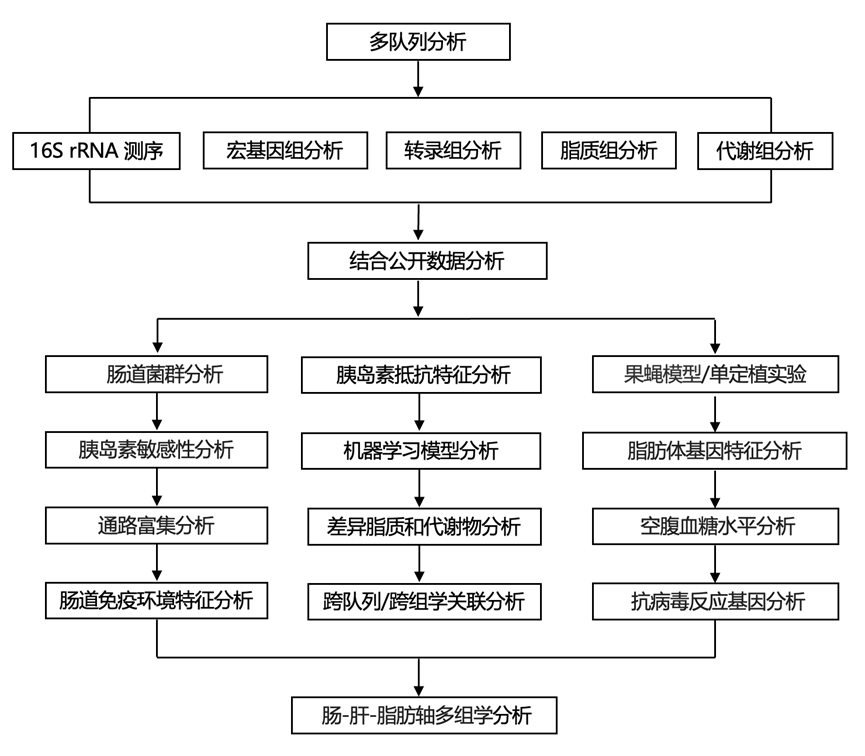
结 果
01
变形菌和丹毒丝菌科物种与胰岛素敏感性呈负相关
很少有研究使用高胰岛素-正常血糖钳 (hyperinsulinaemic-euglycaemic clamp) 技术来研究肠道菌群与胰岛素敏感性之间的关系。重要的是,所有这些研究都使用 16S rRNA 测序来评估微生物组成,这并未提供物种水平或微生物功能的微生物组成信息,也没有考虑到宏基因组学数据集的组成性质。为了克服这些局限性,研究团队通过宏基因组学技术分析了三项独立研究(ADIPOINST,n=15;IRONMET,n=121 和 FLORINASH,n=67)的粪便微生物群。他们在对数尺度上应用了线性回归模型,使用偏差校正的微生物组组成分析(ANCOM-BC)调整了年龄、性别和身体质量指数(BMI)。在三项独立研究中,发现丹毒丝菌科和变形菌门的几种属和种与胰岛素敏感性呈一致的负相关(图 1a-e),特别是肠杆菌。他们进一步使用16S rRNA 测序技术分析粪便样本,在 FLOROMIDIA 队列中具有高胰岛素-正常血糖钳的一组患者(n=24)上验证了这些结果:变形菌门的脱硫弧菌属与胰岛素敏感性呈强烈的负相关。
相反,胰岛素敏感性与双歧杆菌和普氏菌属的微生物物种呈正相关。在 ADIPOINST 和 FLORINASH 队列中,他们还发现Blautia和Faecalibacterium属的产生短链脂肪酸 (SCFA) 的物种与胰岛素敏感性呈正相关(图 1d-e)。最近的研究还证明了肠道菌群在调节胰岛素敏感性中的因果作用。来自瘦捐赠者的粪便微生物移植 (FMT) 已证明可以增强外周胰岛素敏感性,而来自代谢综合征捐赠者的 FMT 则具有相反的效果。从瘦男性捐赠者到肥胖男性受试者的 FMT 增加了产生 SCFA 的细菌,如假长双歧杆菌,同时降低了大肠杆菌的水平。此外,脱硫弧菌属的含量增加。预测胰岛素敏感性会下降≥10%,而预测普雷沃氏菌则不会增加。同样,对于肥胖的男性患者,使用万古霉素治疗会降低外周胰岛素敏感性,增加革兰氏阴性细菌,主要是变形菌。在患有2型糖尿病的患者中也观察到了变形菌水平升高。相反,其他研究发现肥胖个体在接受万古霉素治疗后,变形菌增加与胰岛素敏感性之间没有明确的联系,并且在某些情况下,变形菌减少与胰岛素敏感性或代谢结果改善有关,例如胃绕道手术后或在 Toll 样受体 2 基因敲除小鼠中。
众所周知,药物会影响肠道菌群。因此,为了排除药物对当前关联的混杂影响,他们进行了额外的分析,控制高血压和血脂异常药物以及质子泵抑制剂的用量,质子泵抑制剂是本研究中的主要药物。此外,虽然ADIPOINST 和 IRONMET 研究不包括患有 2 型糖尿病 (HbA1c <6.5% 和空腹血糖 <126 mg/dL)的患者,但 FLORINASH 队列中有 9 名患者 (13%) 患有 2 型糖尿病。为了进一步消除糖尿病的混杂影响,他们控制了 FLORINASH 队列中 2 型糖尿病存在的分析。值得注意的是,在控制了这些额外的协变量之后,不仅大多数关联仍然显著,而且变形菌门的属也表现出与胰岛素敏感性最显著的关联。
先前的研究忽视了微生物功能分析,而由于微生物功能冗余,功能分析对于准确捕捉宿主-微生物组相互作用至关重要。因此,他们接下来在三项研究中基于京都基因与基因组百科全书 (KEGG) 直系同源物进行了功能分析,并使用与胰岛素敏感性相关的微生物基因进行了通路富集分析。在 ADIPOINST、IRONMET 和 FLORINASH 研究中,他们发现参与能量代谢的通路始终过度表达,例如三羧酸循环、氧化磷酸化、糖酵解/糖异生、丙酮酸代谢和戊糖磷酸途径(图1g-i)。值得注意的是,IRONMET 和 FLORINASH 的研究都显示出与硫辛酸和组氨酸代谢的密切相关性。研究表明,α-硫辛酸可增加 2 型糖尿病患者的胰岛素敏感性(用高胰岛素-正常血糖钳测量)。基于KEGG 模块的功能分析发现,组氨酸降解是最重要的通路之一。值得注意的是,咪唑丙酸酯(一种微生物产生的组氨酸代谢物)在糖尿病前期和糖尿病患者中升高,并会损害胰岛素信号传导。
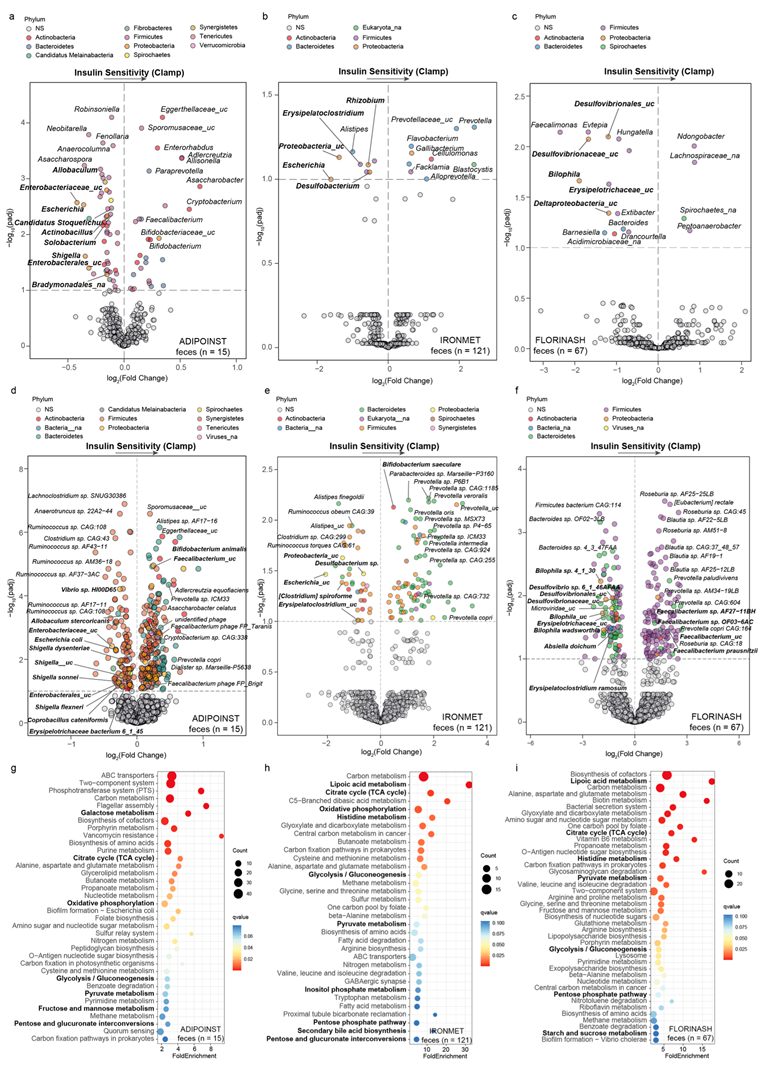
图1. 不同研究中粪便微生物群组成和功能与高胰岛素-正常血糖调控之间的关联。
(a-f) ADIPOINST、IRONMET和 FLORINASH 研究中与胰岛素敏感性(高胰岛素-正常血糖钳)相关的差异微生物属和种的火山图。(g-i) KEGG 通路过度表达分析的点图。
02
T 细胞相关空肠转录组特征与全身胰岛素敏感性呈正相关
最近的证据表明,肠道是肥胖相关胰岛素抵抗的关键组织,它通过破坏肠道通透性和增强对 LPS 等微生物产物的吸收来引起肠道微生物引起的炎症。大部分脂质和糖的消化发生在空肠,受胰岛素调节。然而,人们对空肠转录组与胰岛素敏感性的关系知之甚少。考虑到这一点,他们对来自 ADIPOINST 队列 (n=26) 的空肠样本进行了转录组分析(RNA-seq),并应用了根据年龄、BMI 和性别调整的稳健线性回归模型,以确定与高胰岛素-正常血糖钳夹相关的空肠转录组特征(图2a)。通路过度表达分析强调,大多数上调基因在 CD4 和 CD8 辅助 T 细胞受体信号传导 (TCR) 和分化(Th1 和 Th2)、先天免疫、炎症反应调节、RHO GTPase 循环和肠道上皮完整性维持中发挥关键作用(图 2b-c)。参与补体级联的CR2和编码嗜酸性粒细胞特异性趋化因子的CCL11是影响最大的两个空肠基因。这些发现表明,随着胰岛素敏感性的增加,肠道免疫力和完整性得到保持。
由于 TCR 信号通路与空肠胰岛素敏感性的关联性最强,他们试图分析另一个独立队列(SIMMUNIDIA,n=42)回肠中的 T 细胞含量。回肠 T 细胞的数量和比例与空腹血糖和 HbA1c 呈负相关(图 2d-g)。在解释这些结果时,重要的是要考虑到回肠的免疫微环境与空肠略有不同。总体而言,这些发现表明 T 细胞的存在似乎在小肠中发挥保护作用。同样,Th2 细胞的频率也与小鼠和人类其他组织(如内镜下脂肪组织)中的胰岛素抵抗呈负相关。
肠道微生物群及其衍生的代谢物是肠道屏障破坏和局部免疫反应的关键,从而导致炎症和代谢疾病。然而,只有有限数量的研究描述了小肠微生物群的组成,关于其与肥胖和胰岛素抵抗的关系的证据甚至很少。因此,他们使用 16S rRNA 基因测序分析了 SIMMUNIDIA 队列 (n=42) 中的回肠粘膜微生物群,并确定了与 HbA1c 相关的细菌属作为胰岛素抵抗的间接标志物(图 2h)。与粪便结果一致,变形菌门的细菌属(大肠杆菌、志贺氏菌和肠杆菌)与胰岛素抵抗相关(图 2h),与 T 细胞总数呈负相关(图 2i),而双歧杆菌属和产 SCFA 的属(如粪杆菌)呈负相关。高脂饮食 (HFD) 导致回肠微生物群发生改变,通过减少产生白细胞介素 (IL)-17 的 CD4 T 细胞 (Th17) 的数量来损害小肠的免疫系统,并在小鼠中诱发 2 型糖尿病。
接下来,他们对 ADIPOINST 队列 (n=26) 中的空肠脂质组和代谢组进行了分析,以阐明与胰岛素敏感性相关的小肠生化途径。他们应用了基于随机森林的变量选择机器学习算法来识别可预测高胰岛素-正常血糖钳夹的脂质和代谢物。脱氧胆酸 (DCA)是一种微生物衍生的次级胆汁酸,已确定为与胰岛素敏感性呈负相关的最重要代谢物(图 2j)。缬氨酸和异亮氨酸也与胰岛素敏感性呈强烈的负相关,而牛磺酸则呈正相关。
始终如一,空肠中的 DCA 水平与粪便中促炎细菌种类(如Gammaproteobacteria(阴沟肠杆菌、大肠杆菌和柠檬酸杆菌)的存在呈正相关,而与双歧杆菌和粪杆菌属的种类呈负相关。代谢综合征供体的 FMT 导致粪便中 DCA 和其他次级胆汁酸的水平升高,同时降低接受者的胰岛素敏感性。已知DCA会诱发肠道炎症,破坏上皮屏障并增加肠道通透性。肠道 DCA水平升高与 HFD 和西方饮食以及主要产生 DCA 的梭菌属的丰富度增加有关,从而促进结肠炎症。DCA 的血浆水平与胰岛素抵抗有关,并且在 2 型糖尿病患者中显著升高。
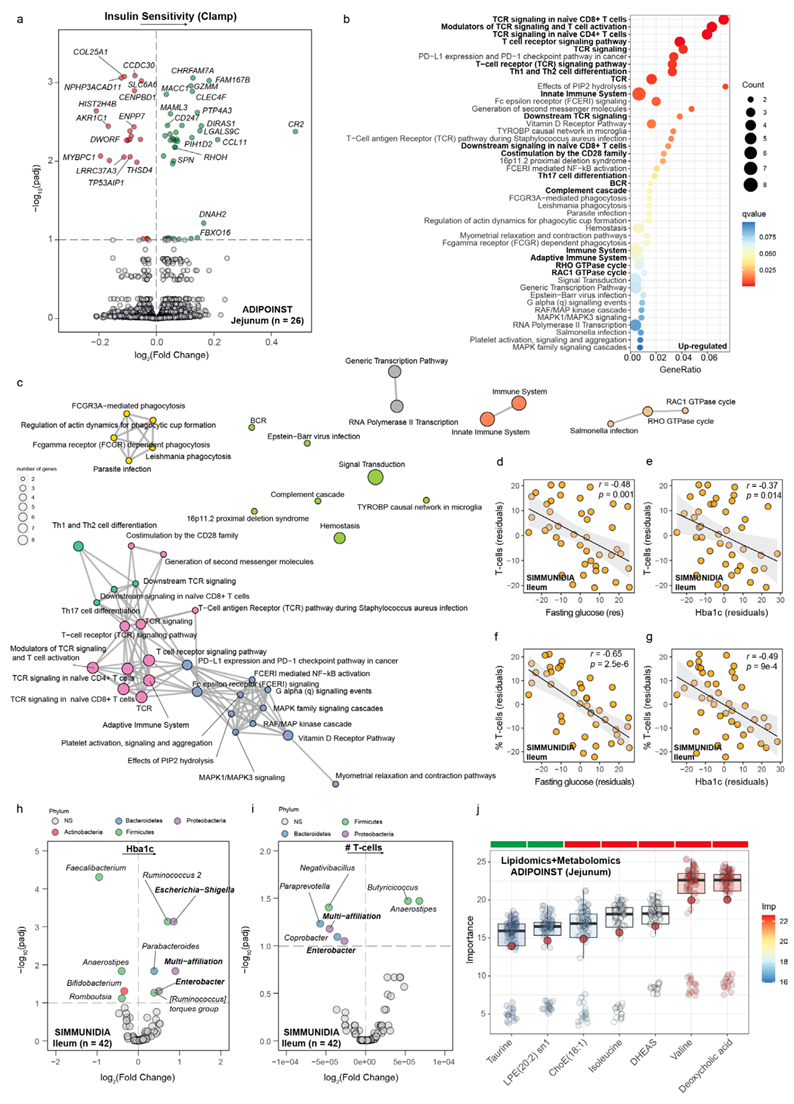
图2. 小肠中胰岛素敏感性和抵抗性的跨队列和跨组学关联。
(a) 通过 limma-voom 分析确定的与 ADIPOINST 队列患者空肠胰岛素敏感性(高胰岛素-正常血糖钳)相关的差异表达基因的火山图。(b) 通过通路过度表达分析确定的与空肠胰岛素敏感性显著相关的通路点图。(c) 使用富集图将过度表达分析结果映射为通路功能网络。(d-g) 空腹血糖或糖化血红蛋白水平与 SIMMUNIDIA 队列患者回肠中 T 细胞数量或 T 细胞百分比之间的部分 Spearman 等级相关性(根据年龄、性别和 BMI 调整)的散点图。(h-i) 使用 ANCOM-BC 确定的与糖化血红蛋白相关的差异微生物属的火山图SIMMUNDIA 队列回肠中 T 细胞的数量。(j) ADIPOINST 队列空肠中与胰岛素敏感性相关的代谢物/脂质的标准化变量重要性度量的箱线图。
03
结肠中的变形菌和 T 细胞相关转录组特征也与胰岛素敏感性有关
他们还在 FLOROMIDIA 队列中进行了结肠转录组学分析,以确定与胰岛素敏感性相关的基因(图 3a)。与在空肠中的发现一致,涉及 CD4/CD8 辅助 T 细胞谱系特化和 Th17 型免疫反应的通路发生富集(图 3b)。他们发现胰岛素敏感性与白细胞介素 17 受体 E (IL17RE)和白细胞介素 6 受体(IL6R) 呈正相关,但与 IL-23 亚基 α (IL23A) 呈负相关(图 3a-c)。同样,SIMMUNIDIA 队列中的空腹血糖水平与 IL-17 受体 B (IL17RB) 和肿瘤坏死因子受体 (CD40)的表达相关(图3d)。然后,他们使用 16S rRNA 基因测序分析了 SIMMUNIDIA 队列(n=55)中的结肠微生物群。与回肠的结果一致,他们发现变形菌门的属(大肠杆菌、志贺氏菌和γ‐变形菌)与用 HbA1c 评估的胰岛素抵抗呈正相关,与结肠中的 T 细胞数量呈负相关,而粪杆菌属与之呈负相关(图3e-f)。
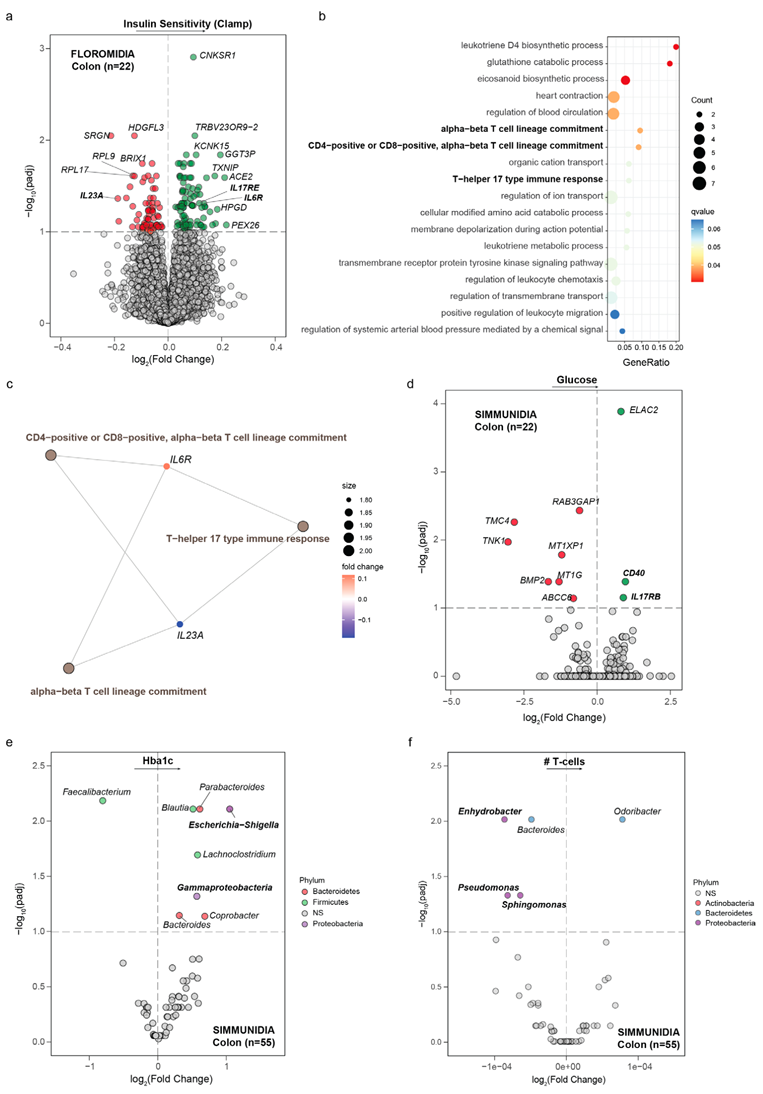
图3. 结肠中胰岛素敏感性和抵抗力的跨队列和跨组学关联。
(a) 通过控制年龄、性别和 BMI 的 limma-voom 分析确定了 FLOROMIDIA 队列患者结肠中与胰岛素敏感性相关的差异表达基因的火山图。(b) GO分析。(c) 基因概念网络描绘了与参与 Th17 免疫反应和 CD4+ 或 CD8+、α-β T 细胞谱系特化的胰岛素敏感性相关的重要基因之间的联系。(d) 通过控制年龄、性别和 BMI 的 limma-voom 分析确定的与 SIMMUNIDIA 队列患者结肠空腹血糖水平相关的差异表达基因的火山图。(e-f) 使用 ANCOM-BC 确定的与 HbA1c 相关的差异微生物属的火山图和 SIMMUNDIA 队列 (n=55) 结肠中的 T 细胞数量。
04
参与 T 细胞和 Rho GTPase 信号传导的脂肪组织特征与全身胰岛素敏感性和抵抗性相关
脂肪组织的慢性炎症已成为肥胖相关胰岛素抵抗的标志。因此,他们对 ADIPOMIT 队列 (n=740) 中肥胖和非肥胖患者的皮下脂肪组织 (SAT) 进行了 RNA-seq。在拟合控制年龄、BMI 和性别的稳健线性回归模型后,他们确定了几个与 HbA1c 相关的基因(图 4a)。富集分析强调,与 HbA1c 负相关的基因参与了包括胰岛素信号传导、胰岛素抵抗、IRS 激活或瘦素信号传导在内的通路,而与 HbA1c 正相关的基因主要参与 TCR 信号传导、免疫系统和 Rho GTPases 的信号传导(图 4b-c),这与在空肠和结肠中的发现一致。然而,虽然肠道中与这些通路相关的基因表达水平较高似乎与更高的胰岛素敏感性有关,但在脂肪组织中,这似乎与胰岛素抵抗增加有关。这种差异可能表明发育阶段不同和/或对环境刺激的反应不同步。在肠道中,更高的胰岛素敏感性可能与更强的免疫反应相对应,这表明适当的肠道免疫反应可能预防肠道菌群失调引起的胰岛素抵抗。相反,在脂肪组织中,免疫反应增强可能表明胰岛素抵抗相关的脂肪组织功能障碍。脂肪组织中这种反应的慢性激活可能会造成损害。
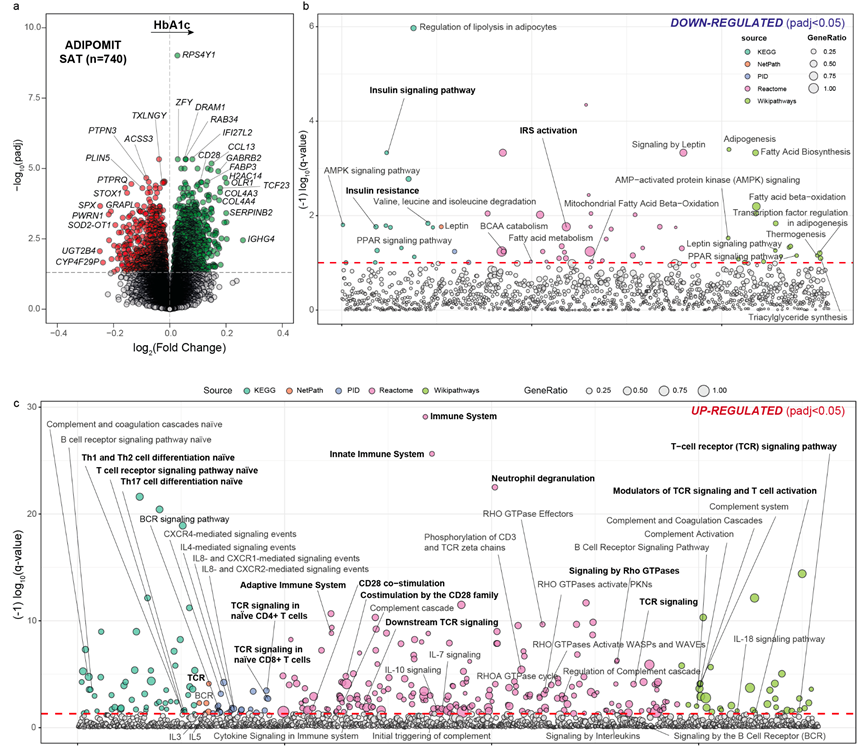
图4. 与 HbA1c 相关的 SAT 转录组特征。
(a) SAT 中与 HbA1c 相关的差异表达基因的火山图。(b) 与空肠胰岛素敏感性显著相关的通路曼哈顿图。(c) 将显著下调的基因和显著上调的基因映射到不同数据库中。
他们接下来对来自 ADIPOINST 队列 (n=29) 的患者的内脏脂肪组织(VAT)进行了RNA-seq。在应用调整了年龄、BMI 和性别的稳健线性回归模型后,他们发现了大量与胰岛素敏感性相关的VAT基因(图 5a)。值得注意的是,基于与胰岛素敏感性负相关的基因的通路富集分析揭示了与先天免疫的关联,特别是 TCR 信号通路的过度表达;Rho GTPases 的信号传导;IL4、IL8、IL3、IL-18、IL2 介导的信号传导事件和预期的代谢通路,如瘦素、脂联素、胰高血糖素和磷脂酰肌醇 3-激酶 (PI3K)/蛋白激酶 B 信号传导(图 5b)。
单组学分析仅提供有关一层生物调节的信息。因此,他们整合了 ADIPOINST 队列中与胰岛素敏感性相关的宏基因组学、代谢组学和转录组学(空肠和 VAT)概况,以获得与胰岛素敏感性相关的肠道微生物组-宿主相互作用机制的整体图景。
聚类 1 与胰岛素敏感性以及空肠代谢物和脂质[DCA、缬氨酸、异亮氨酸、脱氢表雄酮硫酸盐 (DHEAS)]、变形菌门的微生物属(大肠杆菌、志贺氏菌和军团菌)和丹毒丝菌科 (Allobaculum和Solobacterium)以及空肠和内脏脂肪组织的转录组特征呈强烈的负相关 (图5c)。值得注意的是,该聚类与聚类 2 呈强烈的负相关,代谢物(牛磺酸)、微生物属 (Faecalibacterium)、空肠和内脏脂肪组织基因与胰岛素敏感性呈强烈的正相关。
为了探索两个聚类的基因在胰岛素敏感性方面的作用,他们进行了基因本体-生物过程 (GO-BP) 和通路富集分析。聚类2 中空肠基因的最显著 BP(与胰岛素敏感性正相关)涉及淋巴细胞迁移和免疫系统调节(图 5d)。一致地,该聚类中最重要的空肠通路包括 TCR 信号传导和 T 细胞活化的调节剂、补体级联、先天免疫系统和 Rho GTPase 循环(图 5e),而最重要的 VAT 通路参与调节胰岛素样生长因子 (IGF) 的转运和 IGFBP 的吸收。
此外,超分子纤维组织(CCL1、CHRFAM7A 、 CYFIP2和RHOH)和肌动蛋白细胞骨架组织(CCL11和RHOH)是聚类2 中过度表达的 GO-BP 之一。脂肪细胞和肌肉细胞中的肌动蛋白分解已证明可以抑制胰岛素诱导的事件,例如葡萄糖转运蛋白募集到细胞表面和增强葡萄糖转运;肌动蛋白对于胰岛素刺激的葡萄糖转运蛋白 GLUT4 易位必不可少。血浆CCL11与脂肪变性严重程度呈正相关,喂食高脂肪、高热量饮食的CCL11 基因敲除小鼠可改善胰岛素敏感性。此外,RHOH是 T 细胞发育和正常功能的关键因素。
值得注意的是,与聚类1(与胰岛素敏感性呈负相关)最密切相关的 VAT 中的 GO-BP 和通路再次包含肌动蛋白细胞骨架组织和调节,以及胰岛素信号传导(图 5f-g)同样,空肠中这些聚类的过度代表的 BP 还包括肌肉骨骼运动和超分子纤维组织(图 5h)。
最后,为了评估粪便变形菌与胰岛素敏感性之间的负相关性是否会转化为脂肪组织,他们对 IRONMET 队列 (n=12) 中的一组患者的 VAT 进行了 16S rRNA 测序,发现VAT 中的变形菌门属(慢生根瘤菌和莫拉氏菌科)与胰岛素敏感性呈负相关(图 5i)。
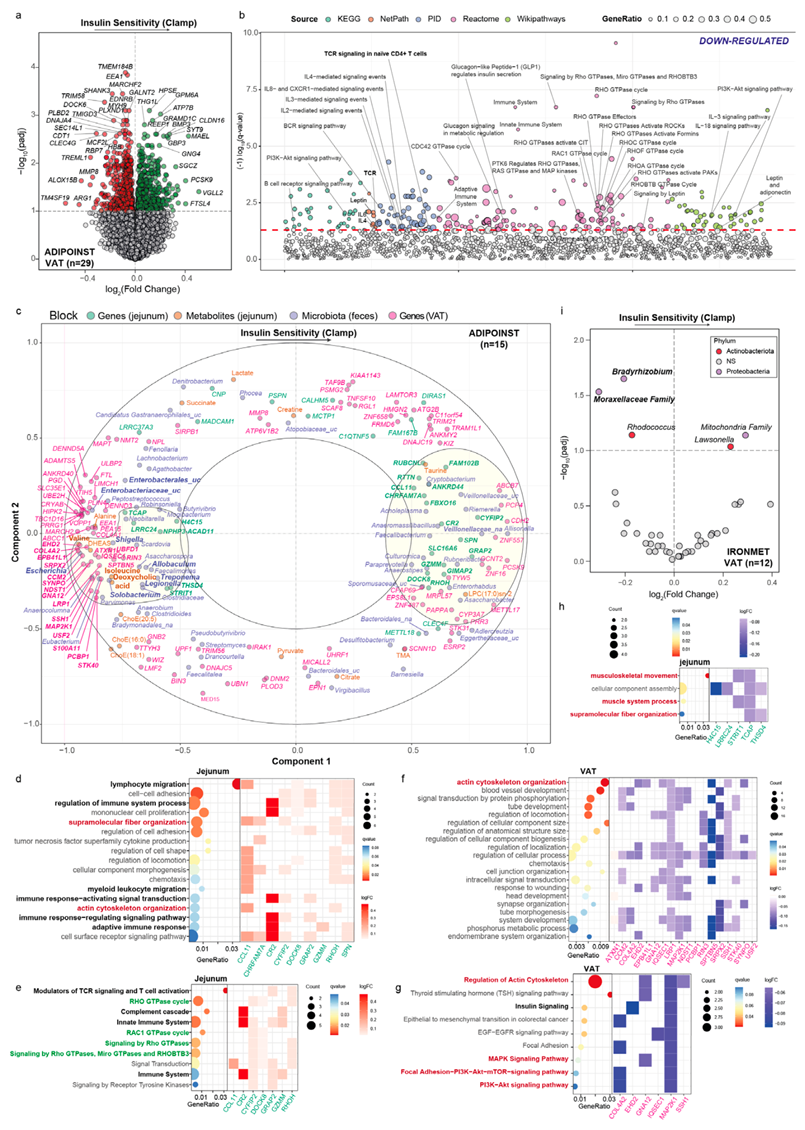
图5. VAT 转录组特征与 ADIPOINST 队列中的胰岛素敏感性以及跨组学和跨组织整合相关。
(a) 差异表达基因的火山图。(b) 通过通路过度表达分析确定的与 VAT 中的胰岛素敏感性显著相关通路。(c) 使用多块稀疏 PLS 模型整合 ADIPOINST 队列中与胰岛素敏感性相关的空肠和 VAT 基因、空肠代谢物和粪便微生物种类的相关圆图。(d-g)通路分析。(h) 与胰岛素敏感性强烈负相关的空肠基因的点图。(i) 使用 ANCOM-BC 确定的 IRONMET VAT中与胰岛素敏感性相关的差异微生物属的火山图。
05
组学和多组织整合数据分析
肝脏在调节葡萄糖和胰岛素方面起着核心作用。因此,他们接下来分析了 FLORINASH 队列 (n=80) 中肥胖患者的肝脏转录组。在拟合调整年龄、BMI 和性别的稳健线性回归模型后,确定了 1356 个与高胰岛素-正常血糖钳制相关的基因(图 6a)。与在空肠和 VAT 中的发现一致,这些基因参与了 TCR 信号传导、补体系统、Ras 和 Rap1 GTPase 信号传导以及细胞因子-细胞因子受体相互作用(图 6b)。他们还分析了其中一部分患者的肝脏脂质组,发现几种溶血磷脂酰胆碱和溶血磷脂酰乙醇胺与胰岛素敏感性有关(图 6c)。重要的是,他们再次发现 DCA 与胰岛素敏感性呈负相关(图 6c)。他们还分析了 FLORINASH 研究中来自西班牙(n=17)和意大利(n=20)的一部分参与者的肝脏微生物群。与之前在粪便、回肠、空肠和结肠中的结果一致,他们发现在控制年龄、BMI、性别、血脂异常和高血压药物和糖尿病后,肝脏中来自变形菌门的属与胰岛素敏感性表现出最强和/或最显著的负相关性在西班牙(图 6d)和意大利队列中。基于MB-sPLS的多组学整合分析,对粪便微生物群、肝脏脂质和与胰岛素敏感性相关的基因(仅使用L1正则化筛选出50个最相关的特征)进行了研究,揭示了一个高度互相关联的特征,涉及来自变形菌门(Proteobacteria)的多个菌属(如Deltaproteobacteria_uc、Desulfovibrionaceae_uc、Bilophila和Desulfovibrionales_uc)以及丹毒丝菌科(Erysipelotrichaceae)家族的成员。此外,还涉及初级胆汁酸(如牛磺胆酸,taurocholic acid)和次级胆汁酸(如脱氧胆酸,DCA),以及一个与胰岛素敏感性呈负相关的转录组特征(图 6e)。
与之前在空肠和内脏脂肪组织中的研究结果一致,对该转录组进行通路富集分析发现,Rap1信号通路、白细胞跨内皮迁移、肌动蛋白细胞骨架的调节、趋化因子信号通路、免疫系统、免疫系统中的细胞因子信号传导和胰岛素的分泌等都存在过度表达(图6f-g)。同样,GO-BP分析突出显示了主要涉及淋巴细胞活化、白细胞细胞间粘附、白细胞迁移调节和T细胞活化的通路的富集。
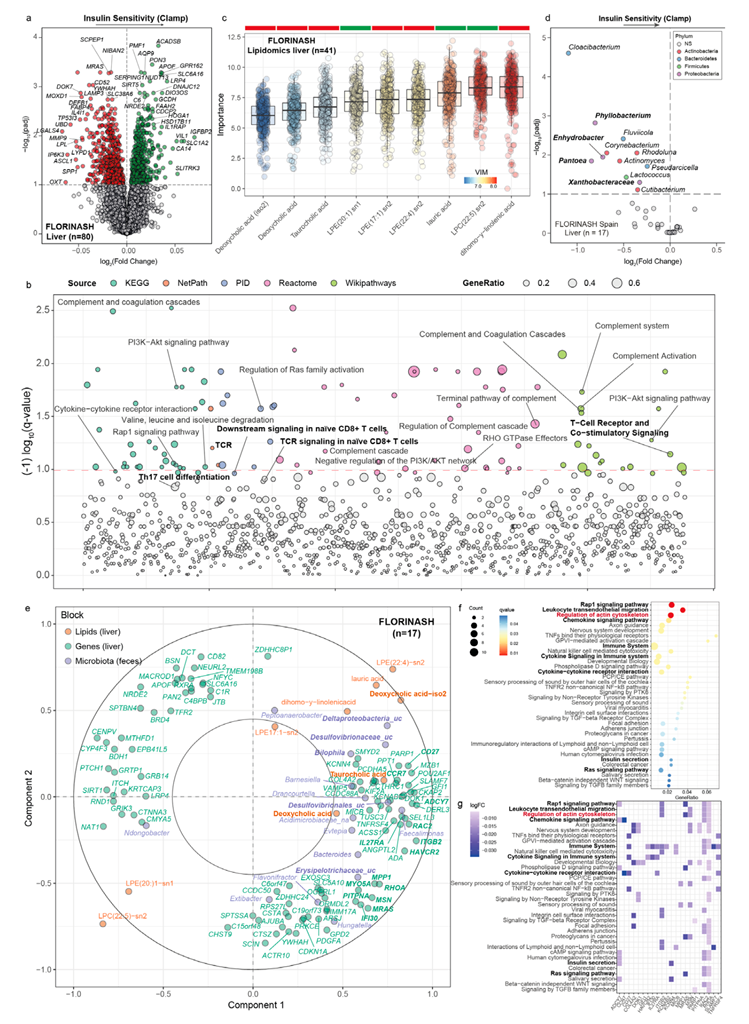
图6. 与 FLORINASH 队列中的胰岛素敏感性和跨组学及跨组织整合相关的肝脏转录组特征。
(a) 差异表达基因的火山图。(b) 通过通路过度表达分析确定的与肝脏胰岛素敏感性显著相关的通路的曼哈顿图。(c) 与 FLORINASH 队列肝脏中胰岛素敏感性相关的脂质的标准化变量重要性度量的箱线图。(d) 差异微生物属的火山图。(e) 整合 FLORINASH 队列中与胰岛素敏感性相关的肝脏脂质、肝脏基因和粪便微生物种类的相关圆图。(f-g) 显著富集通路的点图和参与这些通路的基因热图。
06
HFD 和与阴沟肠杆菌的单一关联会诱导果蝇肠道和脂肪体中与胰岛素抵抗相关的转录变化
为了进一步探索与胰岛素敏感性相关的多器官转录变化,他们使用了模型生物果蝇。为了模拟果蝇的胰岛素抵抗,他们给果蝇施用高脂饮食,导致其出现类似肥胖的表型,包括循环葡萄糖水平升高和胰岛素样抵抗。为了进一步评估变形菌在胰岛素抵抗中的作用,他们选择阴沟肠杆菌在果蝇中进行单定植实验,因为它既是果蝇变形菌门的共生菌,又与人类和动物模型中肥胖相关表型有关联,因此作为果蝇单定植实验的细菌(图 7a)。他们描述了聚类 2 中确定的参与免疫系统调节的空肠基因的果蝇直系同源物CR2 (hig)、DOCK8 (Zir)、GRAP2 (drk)、CYFIP2 (Cyflip)、SPN (Deaf) 和RHOH (Rac1)(图 5d),并通过 qRT-PCR 评估了在用标准饮食 (SD) 或 HFD 喂养的果蝇肠道中的相对基因表达,这些饮食是在无菌条件下饲养的,或与E. cloacae单相关。HFD 喂养的果蝇表现出hig、Rac1、Cyflip和Deaf表达显著下降,这与在人类中的发现一致,因为这些基因与空肠的胰岛素敏感性呈正相关(图 7b-g)。类似地,SD 喂养的果蝇与E. cloacae单一关联表现出肠道中hig、Rac1表达显著降低和Deaf倾向(图 7b-g)。这些发现共同表明 HFD 和与E. cloacae的单一关联都会导致肠道基因表达模式的改变。
接下来,他们在果蝇脂肪体(相当于人类的脂肪组织)中进行了基因表达分析。他们评估了 Cluster 1 基因Past1、ssh、siz、cta、Dsor1和Col4a1的表达,它们分别对应于EHD2、SSH1、IQSEC1、GNA12、MAP2K1和COL4A2的人类同源物(图 5f-g)。与 SD 喂养的果蝇相比,HFD 喂养的果蝇的Col4a1、siz和Past1表达显著增加(图 7h-m)。在人类中,这些基因与 VAT 的胰岛素敏感性呈负相关(图 5f-g)。与E. cloacae的单一关联不会影响所选基因的 FB 表达。
果蝇没有相当于肝脏的器官;其功能由脂肪体承担。因此,他们评估了脂肪体基因表达vib、Moe、Ac76E和mys(图 7n-q),它们是PITPNA、MSN、ADCY7和ITGB2的果蝇直系同源物,它们均与肝脏转录组学中的高胰岛素-正常血糖钳相关(图 6g)。与E. cloacae单相关的 HFD 喂养的果蝇在 FB 中表现出vib表达显著增加(图7n)。值得注意的是,他们观察到PITPNA(其相应的人类直系同源物)是胰岛素抵抗相关的基因之一(图 6E)。此外,MSN的果蝇直系同源物Moe与人类肝脏的胰岛素敏感性呈负相关,在 HFD 喂养的果蝇中表现出显著的上调(图 7o)。
最后,为了研究变形菌在胰岛素抵抗中的作用并验证模型,他们评估了dilp2(果蝇胰岛素样肽 2)的表达,它是人类胰岛素的果蝇直系同源物之一。他们观察到与 SD 喂养的果蝇相比,HFD 喂养的果蝇中dilp2的表达增加,类似于之前描述的胰岛素抵抗。果蝇与E. cloacae的单一关联进一步提高了 SD 喂养的果蝇的dilp2表达水平,表明这种细菌也会加剧果蝇的胰岛素抵抗(图 7r)。此外,与无菌果蝇相比,与E. cloacae单一定殖的果蝇相比,羟基苯丙酮酸脱氢酶 (Hpd)的表达显著降低(图 7s)。Hpd表达受转录因子 dFOXO 调控,该因子在胰岛素反应中在 PI3K 下游发生激活。在胰岛素抵抗的情况下,dFOXO 信号及其下游基因的表达会减少(图 7u)。最后,当受到葡萄糖耐受性挑战时,由E. cloacae单一定植的幼虫清除血淋巴中的葡萄糖的效率不如不育幼虫。摄入葡萄糖溶液 90 分钟后,由E. cloacae定植的幼虫血淋巴中的葡萄糖含量明显较高(图 7t图)。鉴于果蝇幼虫主要使用海藻糖作为循环糖,除了葡萄糖之外,他们还检测了循环海藻糖的含量。研究结果表明,与不育幼虫相比,由E. cloacae单一定植的幼虫血淋巴中的海藻糖和葡萄糖含量始终较高。这些结果与在人类肠道、内脏脂肪组织和肝脏中观察到的转录变化一致,与胰岛素敏感性相关,并进一步支持了变形菌在肠道中加剧胰岛素抵抗病理生理的作用。
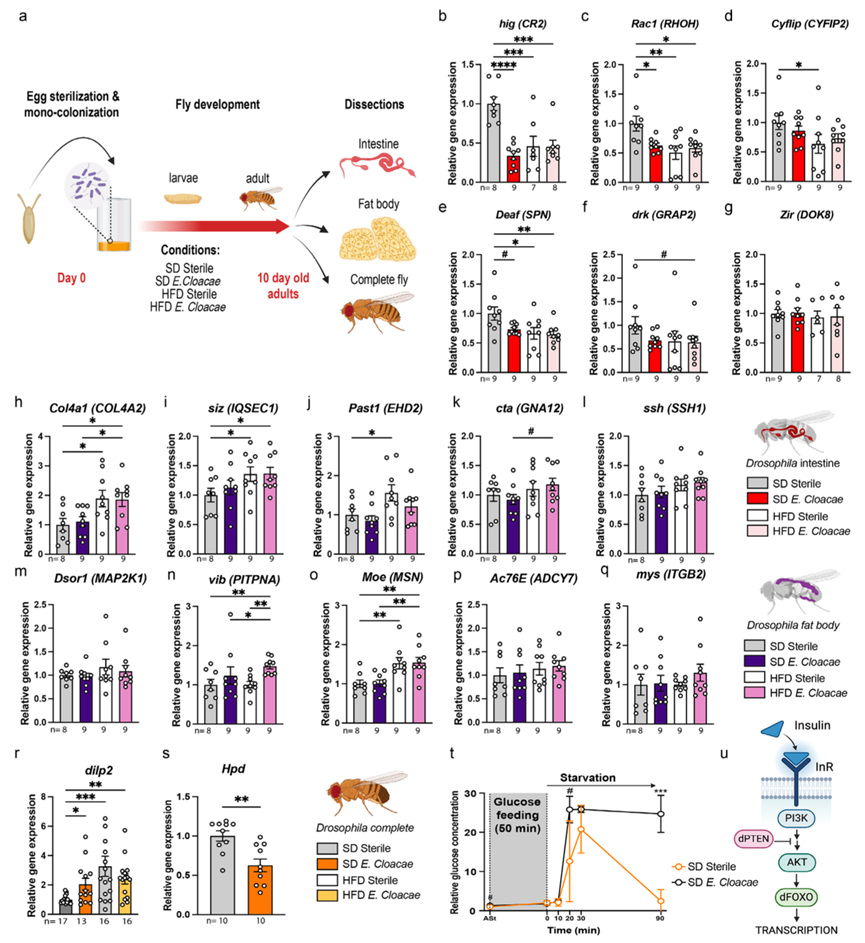
图7. 阴沟肠杆菌单一关联和 HFD 补充会导致果蝇肠道和脂肪体中胰岛素敏感性相关基因直系同源物的转录变化。
(a)实验方案。(b-s)不同基因的相对表达。(t) 在 0、10、20、30 和 90 分钟后喂食葡萄糖后幼虫血淋巴的葡萄糖清除率。(u) 果蝇中 FOXO 通过胰岛素信号激活的示意图。
07
空腹血糖水平与抗病毒反应基因有关
胰岛素敏感性和血糖状态与特定微生物群和 T 细胞数量以及不同组织中的信号传导之间存在一致的关联。鉴于 T 细胞在应对病毒感染中的重要性,以及观察到胰岛素敏感性与病毒感染(如 Epstein-Barr 病毒感染、病毒性心肌炎和人类巨细胞病毒感染)之间存在有趣的关联(图 2b,图 6f),他们还分析了空腹血糖与空肠、回肠、内脏脂肪组织和肝脏转录组的关联(图 8a-c、g)。令人惊讶的是,GP-BP 分析显示,对病毒的防御反应(图 8d-h)和病毒转录(图 8e-h)是空肠和回肠中出现最多的通路,还强调了 I 型干扰素 (IFN) 的产生和响应病毒的细胞质模式识别受体通路(图 8d)。结肠和 VAT 中的 KEGG 过度表达分析发现病毒蛋白与细胞因子和细胞因子受体的相互作用显著富集(图 8f-h),以及病毒感染,包括丙型肝炎、甲型流感和巨细胞病毒感染,这些都与患上糖尿病前期和糖尿病的风险增加有关。空肠中的通路过度表达分析还强调了 IFN 信号传导、IFN 刺激基因的抗病毒机制和少聚腺苷酸合成酶抗病毒反应的富集,而 II 型 IFN 信号传导在结肠中也过度表达(图 8h)。最近的一项研究还发现,葡萄糖代谢下调促进了视黄酸诱导基因 I 样受体 (RLR) 诱导的 I 型 IFN 产生,同时病毒复制减少,并发现乳酸脱氢酶和/或糖酵解升高是病毒通过抑制 RLR 触发的 I 型 IFN 产生来逃避宿主防御的潜在机制。I 型 IFN 在保护细胞免受病毒病原体侵害方面起着至关重要的作用。对380多种人类 IFN 刺激基因的筛选发现了八种广泛作用的效应物,包括 IRF7 和 IFIH1,他们还发现它们与回肠中的葡萄糖水平有关(图 8h)。在空肠中鉴定的基因包括OASL、参与靶向抗病毒特异性的基因和众所周知的抗病毒效应物,例如EIF2AK2或 IFN 诱导的基因OAS1、OAS2和OAS3,它们在先天细胞抗病毒反应中发挥关键作用,并且最近确定与 COVID-19 引起的危重疾病有关。
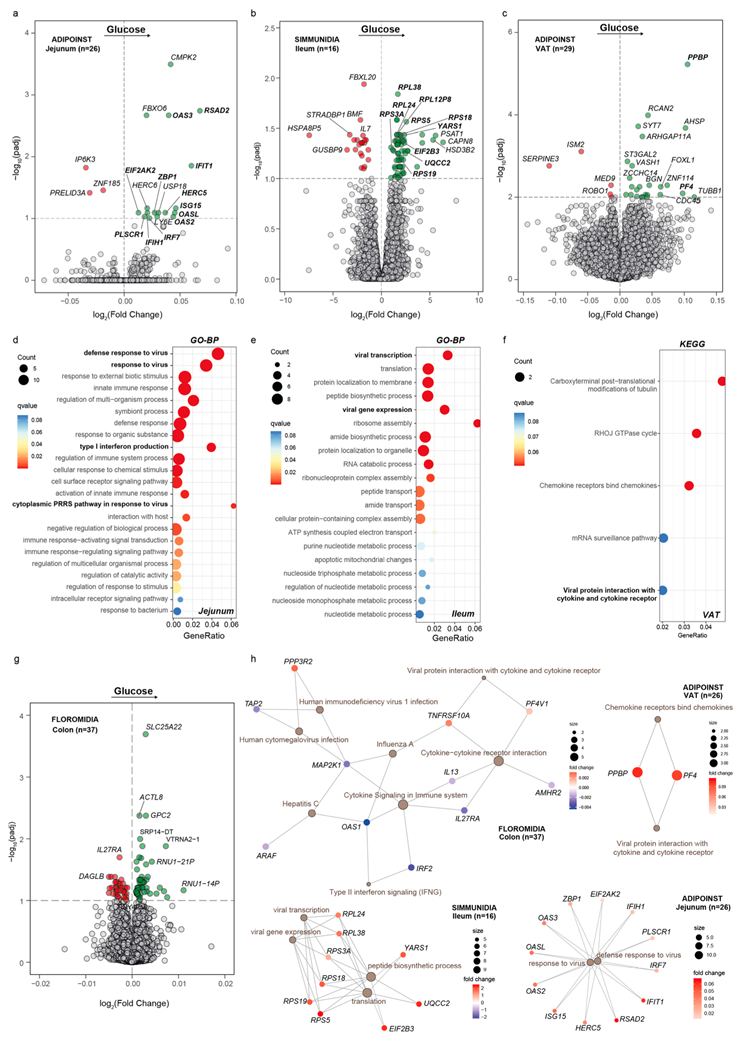
图8. 跨队列和跨组织转录组与空腹血糖水平的关联。
(a, b, c, g) 差异表达基因的火山图。(d-f)通路分析。(h) 基因概念网络描绘了与空腹血糖水平相关的重要基因与参与空肠、回肠、内脏脂肪组织和结肠抗病毒反应途径的联系。
+ + + + + + + + + + +
结 论
四项研究(ADIPOINST,n=15;IRONMET,n=121;FLORINASH,n=67 和 FLOROMIDIA,n=24)表明,变形菌门的几种属和种与胰岛素敏感性始终呈负相关。空肠、回肠和结肠的转录组分析显示,T 细胞相关特征与胰岛素敏感性呈正相关。回肠和结肠中的变形菌与 HbA1c 呈正相关,但与 T 细胞数量呈负相关。空肠脱氧胆酸与胰岛素敏感性呈负相关。皮下脂肪组织 (ADIPOMIT,n=740) 和内脏脂肪组织 (VAT) (ADIPOINST,n=29) 的转录组显示,T 细胞相关特征分别与 HbA1c 和胰岛素敏感性相关。VAT 变形菌与胰岛素敏感性呈负相关。 ADIPOINST 和 FLORINASH 研究中的多组学和多组织数据整合将粪便变形菌与空肠和肝脏脱氧胆酸以及与肌动蛋白细胞骨架、胰岛素和 T 细胞信号传导有关的空肠、VAT 和肝脏转录组特征联系起来。空腹血糖与干扰素诱导基因和肠道和 VAT 中的抗病毒反应始终相关。对果蝇的研究证实了这些与人类胰岛素敏感性相关的变化。
+ + + + +



 English
English


