文献解读|Cancer Cell(48.8):食管癌变的单细胞多阶段空间进化图
✦ +
+
论文ID
原名:Single-cell multi-stage spatial evolutional map of esophageal carcinogenesis
译名:食管癌变的单细胞多阶段空间进化图
期刊:Cancer Cell
影响因子:48.8
发表时间:2025.03.10
DOI号:10.1016/j.ccell.2025.02.009
背 景
了解致癌背后的复杂过程对于探索肿瘤演变和确定早期干预的目标至关重要。基因组学和单细胞转录组学的最新进展揭示了突变(TP53、NOTCH1等)在肿瘤细胞中的重要作用以及上皮和基质细胞群之间的复杂相互作用在驱动癌症发展和进展中的重要性。然而,其中许多研究缺乏空间分辨率,限制了了解癌细胞进化的分子机制和细胞间相互作用的能力。为了克服这个问题,需要进行高分辨率空间转录组分析来系统地绘制出致癌过程中细胞状态的空间动态。Xenium In Situ和 TF-seqFISH 平台已成为两种开创性的高通量检测方法,用于在大量连续样本中对数百到数千个 RNA 靶标进行亚细胞定位。它们能够以前所未有的单细胞分辨率对细胞结构和功能进行详细的可视化和空间分析,因此成为研究肿瘤空间进化的理想工具。
实验设计
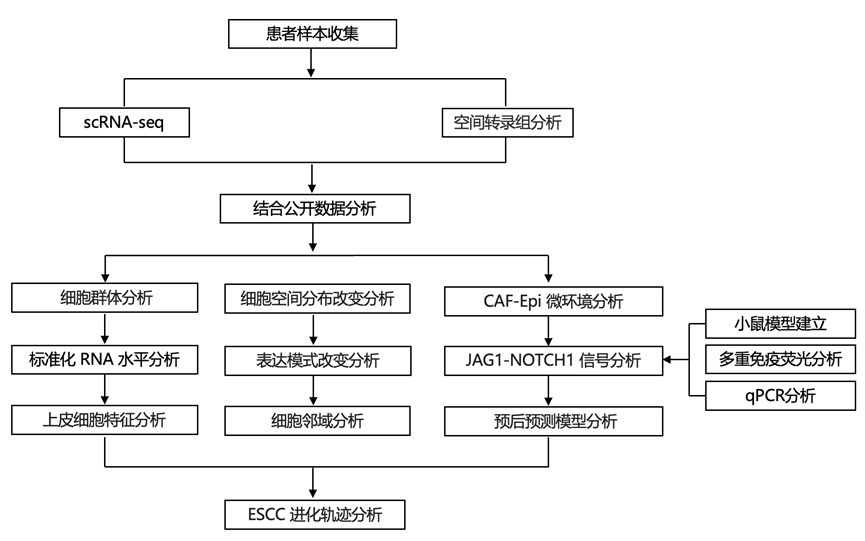
结 果
01
多阶段空间转录组分析揭示 ESCC 发育中的细胞编排
在本研究中,研究团队对代表食管鳞状细胞癌 (ESCC)发展多个阶段的 43 名患者的总共 127 个视场 (FOV) 进行了空间转录组分析,包括 45 个正常食管上皮 (NOR)、25 个低级别上皮内瘤变(LGIN)、21 个高级别上皮内瘤变(HGIN)和 36 个ESCC FOV(图 1 A)。他们从 6 名患者的完整食管组织中获得了 71 个 FOV(包括 24 个 NOR、15 个 LGIN、16 个 HGIN 和 16 个 ESCC),每个 FOV 涵盖多个病理阶段,以便对疾病进展过程中的细胞进化进行连续评估。为了确保本研究结果不受个别患者的影响,他们还分析了其他 37 名患者的 56 个 FOV(包括 21 个 NOR、10 个 LGIN、5 个 HGIN 和 20 个 ESCC)。使用 10× Genomics 的 Xenium In Situ平台进行空间转录组学分析,对 6442006 个细胞的 300 个基因进行了单细胞分辨率分析(图 1 A-C)。他们还将 TF-seqFISH 平台应用于另外两张包含 NOR、LGIN 和 HGIN 的组织切片,以验证和扩展对 21999 个细胞进行 Xenium In Situ空间转录组分析的结果,该分析检测了 Xenium In Situ确定的通路中的 1471 个基因。此外,他们整合了来自 143 个多阶段样本的单细胞转录组分析(scRNA-seq)数据,总共涵盖 385151 个细胞。这种综合方法能够在整个 ESCC 发展过程中详细研究细胞状态和细胞间相互作用。
每个 FOV 均包含上皮细胞、基质细胞和免疫细胞的异质混合物(图 1 D)。他们分析了每个 FOV 内每种细胞类型的密度,以评估 ESCC 发展过程中细胞结构的改变(图 1 E)。与 NOR相比,LGIN和 HGIN的 T 细胞密度显著增加。这表明在这些癌前病变阶段免疫反应发生激活。然而,与 HGIN 相比,ESCC 阶段的 T 细胞密度显著降低,表明在 ESCC 微环境中免疫状态从激活转向抑制。此外,与 NOR相比, HGIN和 ESCC阶段的髓系细胞密度升高,这表明髓系亚型具有肿瘤前分化。
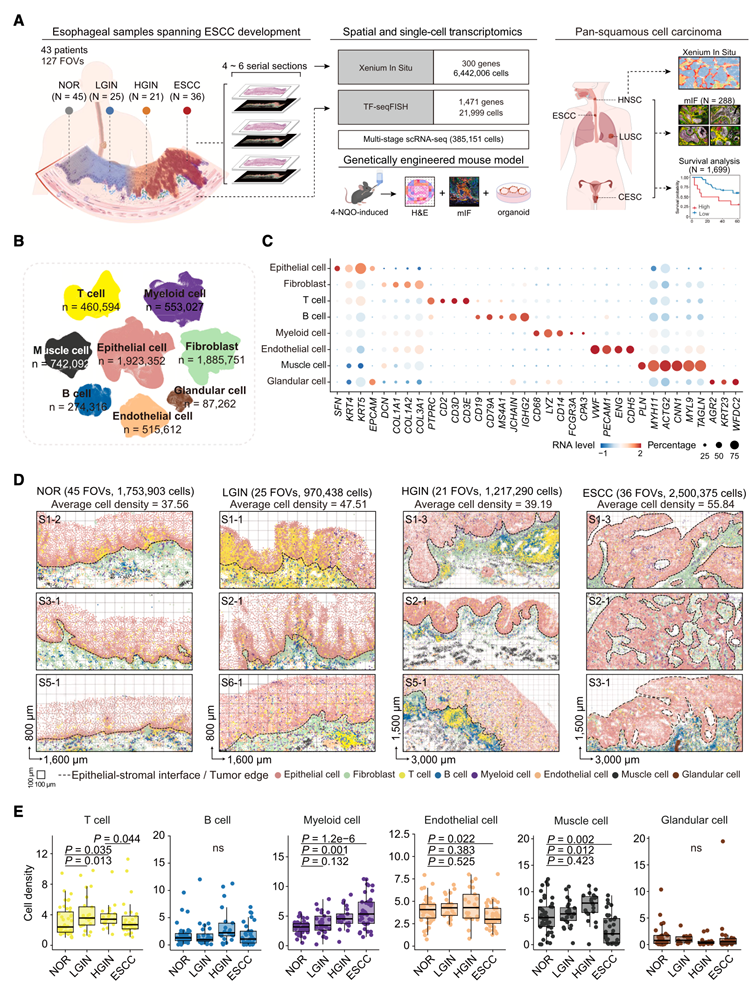
图1. 单细胞空间转录组分析揭示食管癌变过程中的细胞群动态。
(A) 本研究ESCC的时空转录组学分析示意图。(B) UMAP图显示了ESCC肿瘤发生过程中样本中的细胞群。(C) 点图显示不同细胞群中标记基因的标准化RNA水平。(D) 代表性FOV的空间转录组图谱。(E) 箱形图显示不同细胞群的平均密度。
02
增殖性和侵袭性上皮亚群的扩增推动了 ESCC 的发展
为了绘制肿瘤发生过程中上皮细胞的进化过程,他们在 ESCC 发展中的多个阶段中描述了 4 个主要亚群,共 1923352 个上皮细胞(图 2 A)。每个上皮细胞亚群都表现出不同的表达谱,并使用来自多阶段样本的 scRNA-seq 数据进一步验证了这些表达谱(图 2 B)。在 NOR 阶段,复层鳞状上皮完整,具有连续的基底膜,三个上皮细胞亚群位于其上方(图 2 C)。基底细胞的特点是与去分化相关的表达程序(例如ITGA6、NOTCH1和COL17A1)。增殖细胞(n = 126560)以与细胞周期(例如MYC、JAG1和TOP2A)、炎症(例如STAT1、STAT3和HIF1A)和DNA修复(例如DDB2、OGG1和RPA3)相关的上调通路为标志(图2B)。在NOR阶段,对上皮层再生至关重要的基底细胞和增殖细胞主要位于上皮-基质界面附近(图2C),分别占上皮厚度的6.2%和7.2%。分化细胞具有参与粘膜防御的表达程序(例如S100A8、ANXA1和TRIM29),形成保护屏障,防止外部机械和化学损伤。这些细胞分散在整个上皮层(图 2 C),平均占总上皮体积的 86.7%。
在 LGIN 阶段,增殖细胞从 NOR 时的 7.2% 增至 22.2%,同时伴有循环、炎症和 DNA 修复程序与 NOR 相比显著上调(图 2 D)。相反,分化上皮细胞的平均比例厚度从 NOR 阶段的 86.7% 降低至 60.1%。粘膜防御程序的表达水平也低于 NOR 阶段,尽管差异无统计学意义(图 2 D)。这些变化表明 LGIN 进展的特征是增殖细胞亚群向食管腔显著扩张,从而压迫分化细胞区。
在 HGIN中,增殖性和侵袭性上皮细胞迁移到其原生区域之外,占据了上皮景观,取代了基底细胞并压缩了分化细胞域(图 2C)。侵袭性细胞从增殖细胞中出现是一个引人注目的事件。这些细胞表现出上皮-间质转化(EMT)(例如MMP2、MMP11和CXCL12)、致癌转录因子(TF)(例如SOX2、TP63和TP73)、血管生成(例如SPP1、VEGFA和VEGFC)和去分化基因的表达显著升高(图 2B)。增殖细胞和侵袭细胞的扩张表现为 HGIN 期的平均细胞比例分别为 37.3% 和 18.5%,且参与 EMT、致癌 TF和血管生成的基因表达水平更高(图 2 D)。然而,在这种癌前病变中,分化细胞的平均比例厚度从 LGIN 期的 60.1% 降至 34.9%,与 NOR 相比,粘膜防御程序表达显著减少(图 2 D)。此外,在 16 个 FOV 中的 4 个中,上皮细胞渗透到上皮-基质界面形成侵袭性前沿,但是其他区域仍然保持完整的界面(图 2 C)。在 HGIN 阶段,侵袭性前沿由比其他区域高得多的侵袭性细胞组成,这表明侵袭性细胞可能在破坏上皮-基质界面方面发挥作用。
在 ESCC 期,他们发现基底-基质界面完全中断,侵袭性细胞亚群的比例从 HGIN 时的 18.5% 显著增加至 79.3%。侵袭性细胞位于肿瘤边缘,完全侵入基质区域(图 2 C)。ESCC 期中 EMT、血管生成和去分化相关基因的表达水平明显高于 HGIN(图 2 D)。通过对额外的人体组织样本进行免疫荧光染色进一步证实了这些侵袭性特征。此外,分化细胞主要位于肿瘤核心(图 2 C),其比例从 HGIN 期的 29.4% 显著下降至 ESCC 时的 4.8%。总之,这些结果表明,获得性侵袭性和去分化可能驱使转化上皮细胞从 LGIN 的局部扩张转变为 HGIN 和 ESCC 阶段的基质区域侵袭。
此外,在 HGIN 阶段靠近上皮-基质边界的上皮细胞和 ESCC 阶段靠近肿瘤边缘的上皮细胞中,去分化、循环、EMT 和致癌 TF 的趋势显著增加(图 2 E)。体外侵袭试验表明,与 NOR 类器官相比,HGIN 和 ESCC 类器官的侵袭能力显著增加,而 NOR 和 LGIN 类器官的侵袭能力无显著差异。与侵袭能力一致,HGIN 和 ESCC 类器官的侵袭性细胞标志物水平显著增加,包括EMT 通路中的 Mmp2和Mmp11、致癌 TF Nfe2l2、Sox2和Trp63、血管生成Vegfa和Vegfc以及去分化基因Notch1和Col17a1,这些结果进一步强调了恶性上皮细胞在获得侵袭性和去分化以驱动 ESCC 进展方面的演变。
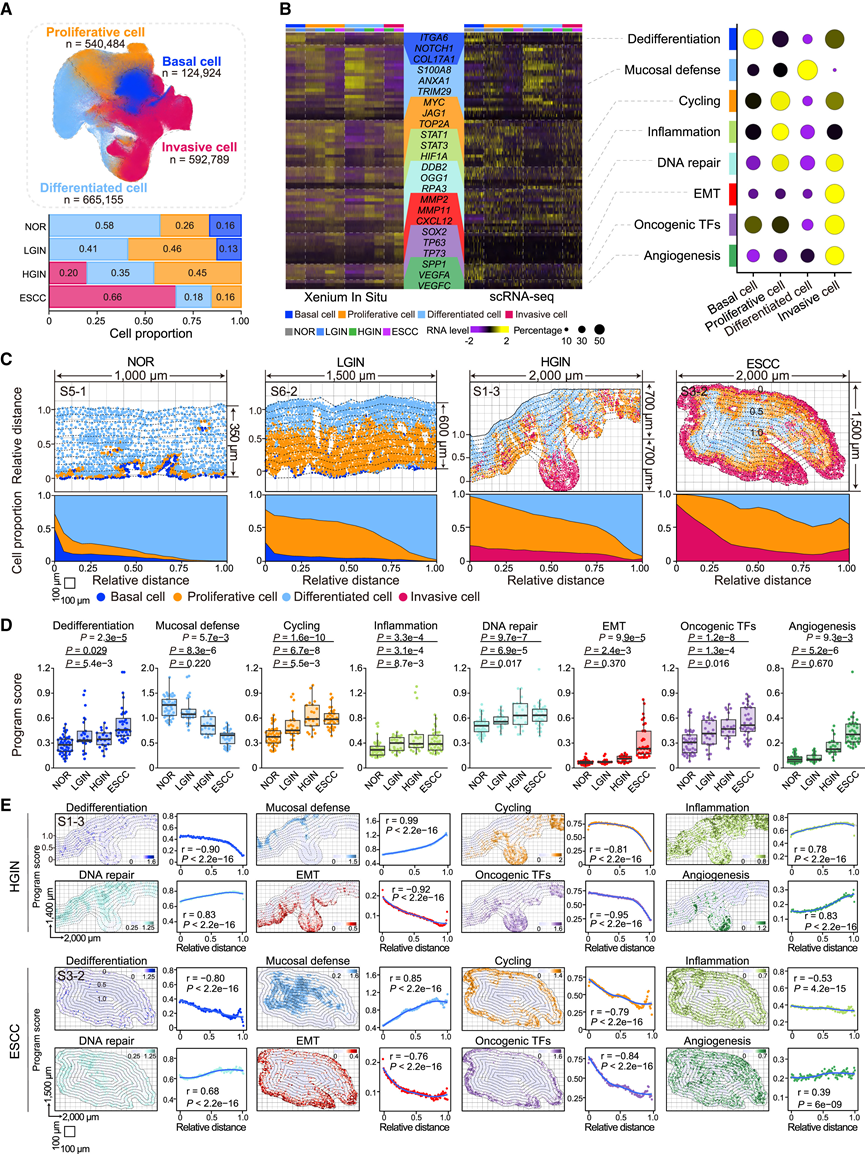
图2. ESCC 发展过程中上皮细胞的形态和转录进化。
(A) UMAP 图显示上皮细胞亚群(上)及其在 ESCC 发展不同阶段的比例(下)。(B) 热图显示不同阶段不同上皮细胞亚群中基因的标准化 RNA 水平(左),气泡图显示不同上皮细胞亚群中每个程序的标准化 RNA 水平(右)。(C) 上皮结构的空间图,包括上皮细胞的相对距离和上皮的厚度(上)以及不同阶段每个上皮细胞亚群的相对距离的核密度图(下)。(D) 箱线图显示了不同阶段每个 FOV 中八个程序的表达分数。(E) 表达评分与 HGIN 上皮-基质界面相对距离(上)和 ESCC 肿瘤边缘相对距离(下)的相关性分析。
03
上皮侵袭性和去分化是 ESCC 进展的指标
通过使用 TF-seqFISH 检测,他们发现可以一致地识别出 4 个上皮细胞亚群的空间分布和表达模式改变(图 3 A-B)。然后,他们根据已识别的上皮亚群进化模式开发了独立的上皮侵袭性和去分化评分。在scRNA-seq 数据中,随着疾病进展到 HGIN 和 ESCC 阶段,侵袭性和去分化评分均显著增加(图 3 C)。增殖和侵袭性细胞扩增推动了这一趋势,其中两者都显示出最高的上皮侵袭性评分,而侵袭性细胞表现出最高的去分化评分(图 3 D)。值得注意的是,虽然 NOR/LGIN 期增殖细胞的去分化评分低于基底细胞,但它们接近 HGIN和 ESCC 时的基底细胞值,支持去分化水平是关键进展标志的观点(图3E)。进一步证实,在NOR 和 LGIN 期,具有相对较高的侵袭性和去分化评分的上皮细胞局限于基底层和增殖区,但在 HGIN 和 ESCC 期,则扩展到整个病变区域(图3F)。因此,上皮细胞的中位侵袭性评分从 NOR 期的 0.46 分别增加到 LGIN、HGIN 和 ESCC 的 0.60、0.67 和 0.69(图 3 G)。同时,在整个 ESCC 发展过程中,中位去分化评分也在上升(图 3G)。总的来说,这些发现表明,食管上皮从分化状态向去分化和侵袭性更强的状态的转变是 ESCC 进展的一个关键指标。
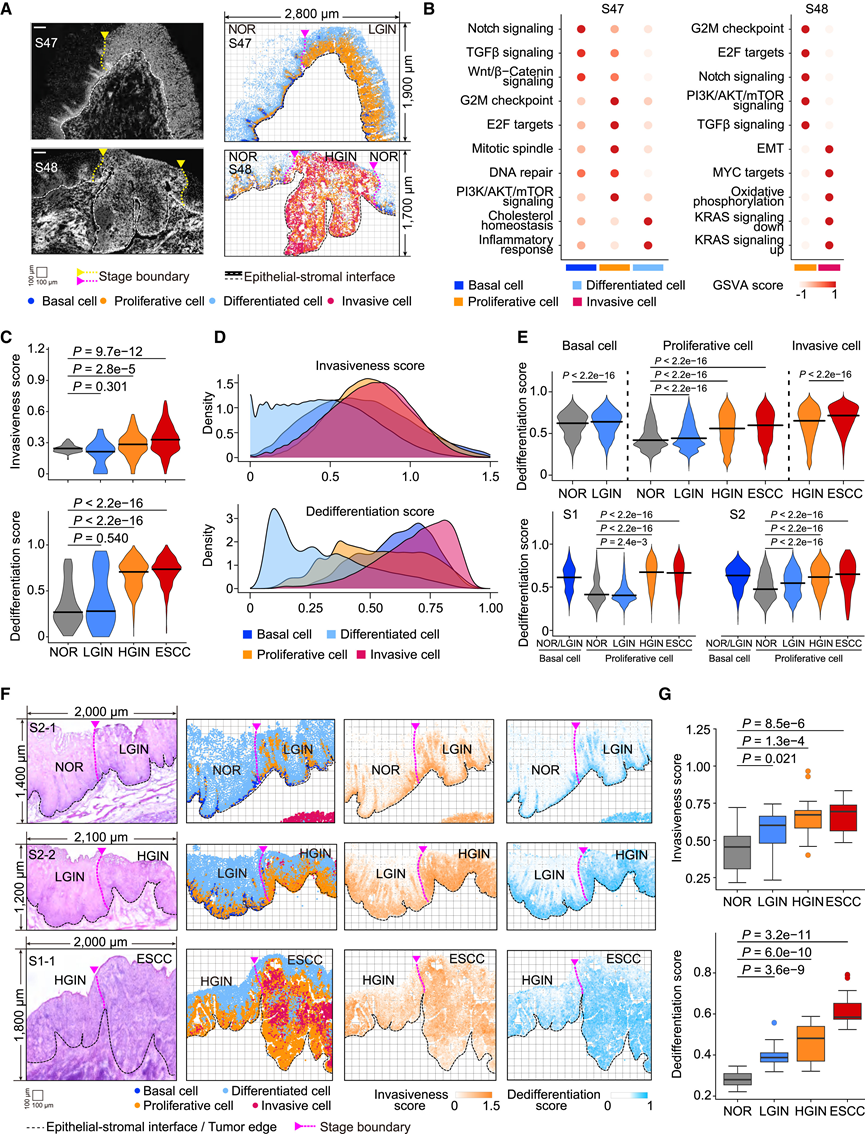
图3. 增殖分化细胞向去分化细胞的转变标志着 ESCC 的进展。
(A) 使用 TF-seqFISH 平台检查的两个组织切片(S47 和 S48)的 DAPI 图像(左) 和空间图(右)。(B) 点图显示不同上皮细胞亚群中通路的基因集富集分析 (GSVA) 的 Z 分数。(C) 小提琴图显示 scRNA- seq 数据中 NOR、LGIN、HGIN和 ESCC阶段的上皮侵袭性评分(上)和去分化 评分表达(下图)。(D) 核密度图显示Xenium In Situ数据中不同阶段不同上皮细胞亚群的上皮侵袭性评分(上)和去分化评分(下)。(E) 小提琴图显示所有患者在相应疾病阶段的基底细胞、增殖细胞和侵袭细胞的去分化评分(上)。2 名不同患者的增殖细胞和基底细胞的模式(下)。(F) 代表性上皮结构的H&E 染色图像(左)和空间图(右)。(G) 箱线图显示NOR、LGIN、HGIN和 ESCC阶段的上皮侵袭性(上)和去分化评分(下)。
04
HGIN 阶段的侵袭性上皮细胞和附近的 CAF 形成 CAF-Epi 微环境
然后,他们使用标记基因PI16、DPT、DCN和癌症相关成纤维细胞 (CAF)(使用标记基因FAP、MMP1、MMP11和POSTN)在整个疾病过程中量化了正常成纤维细胞 (NF) 的密度(图 4 A)。NF 密度在 LGIN、HGIN 和 ESCC 样本中保持稳定,分布广泛,在肌肉层中丰富。CAF 密度在 NOR(0.12)和 LGIN(0.15)中较低,但在 HGIN(0.65)中激增,并在 ESCC 中占主导地位(图 4 B)。此外,ESCC样本中CAF 与上皮细胞的平均距离(27.3 μm)明显远于 HGIN(20.3 μm)(图 4 C),这表明 ESCC 期扩增的侵袭性上皮细胞可能在 NF 转化为 CAF 的过程中发挥更远和更广泛的作用。 然后,他们以单细胞分辨率检测了上皮细胞和成纤维细胞之间的空间细胞间相互作用(图 4 D)。他们比较了距离上皮细胞每 10 μm 处总成纤维细胞中的 CAF 比例,并发现当与上皮细胞的距离从 91-100 μm 缩小到 1-10 μm 时,CAF 的比例显著增加(图 4 E)。此外,使用 scRNA-seq 数据进行的细胞间通讯分析显示,侵袭性上皮细胞与 CAF 之间的相互作用明显强于分化细胞之间的相互作用。这些结果表明,在 HGIN 中出现的侵袭性上皮细胞已经能够激活 NF转化为CAF。
然后,他们在整个 ESCC 发展过程中对细胞群进行了细胞邻域分析。结果揭示了一个由 CAF 和侵袭性上皮细胞组成的独特细胞区室,他们将其称为 CAF-Epi (CAF 和上皮细胞)微环境(图 4 F-I)。该微环境位于 HGIN 的侵袭前沿和 ESCC 的肿瘤边缘(图4 G),与 HGIN 相比,在 ESCC 中观察到的比例明显更高(图 4 I)。值得注意的是,与微环境外部的 CAF 相比,微环境内的 CAF 表现出更高的活化状态,以FAP、MMP11和POSTN的显著上调为标志。此外,他们还从头颈部鳞状细胞癌 (HNSC) 样本中获得了 Xenium In Situ数据,在肿瘤中发现了多个 CAF-Epi 微环境(图 4 J)。这些结果表明 CAF-Epi 生态位的形成可能是 SCC 进展的一个关键特征。
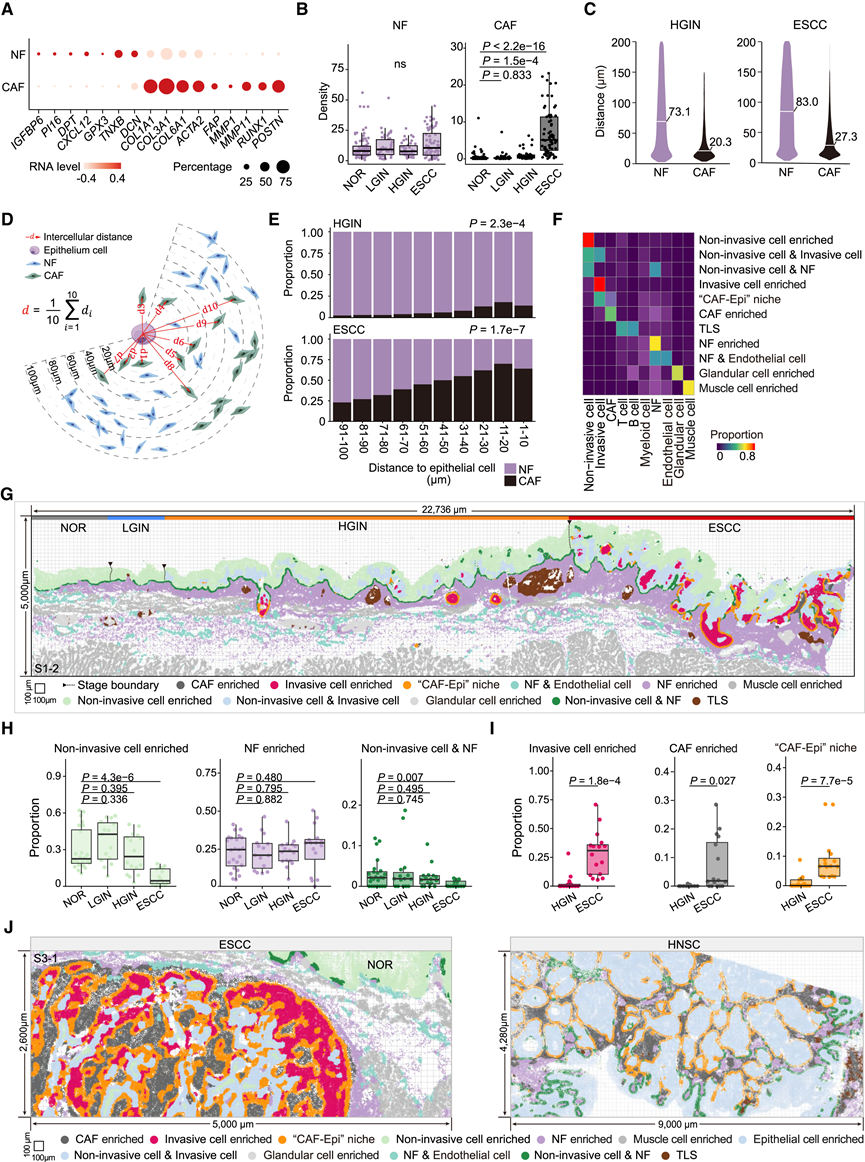
图4. HGIN 和 ESCC 阶段侵袭性上皮细胞和附近 CAF 形成的 CAF-Epi 微环境。
(A) 点图显示 NF 和 CAF 中标记基因的标准化 RNA 水平。(B) 箱线图显示不同阶段每个 FOV 中的 NF 和 CAF 的平均密度。(C) 小提琴图显示 HGIN 和 ESCC 阶段 NF 或 CAF 到上皮细胞的距离。(D) 图表显示成纤维细胞和上皮细胞的空间接近度的定量。(E) 堆积条形图显示在 HGIN(16 FOV)和 ESCC(16 FOV)阶段按距离组在空间区域内识别的 NF 和 CAF 的比例。(F) 热图显示 11 个细胞邻域聚类中 10 种细胞类型的比例。(G) 代表性载玻片(S1-2)中11种细胞邻域分布的空间图。(H-I) 箱线图显示不同阶段每个 FOV 中每个细胞邻域聚类的比例。(J) ESCC和HNSC中代表性CAF-Epi微环境的空间图。
05
侵袭性上皮细胞通过 JAG1-NOTCH1 信号传导驱动 CAF-Epi 微环境形成
他们研究了侵袭性细胞和 CAF之间的相互作用如何促进 CAF-Epi 生态位的形成。在靠近侵袭性细胞的 NF 中观察到CAF 活化标志物(即FAP、MMP1、MMP11和POSTN)的表达水平呈上升趋势,这表明 NF 越靠近侵袭性细胞,它们就越有可能激活成 CAF。此外,随着侵袭性上皮细胞与 CAF的空间距离在 ESCC 阶段从 150 μm 减少到 1μm,侵袭性上皮细胞中的循环和去分化程序逐渐上调,其中包括两个关键基因,JAG1和NOTCH1。永生化食管鳞状细胞系 (Het1A) 或细胞系 (KYSE510) 与 CAF共培养,与 NF共培养相比,其增殖率显著增加,NOTCH1、MYC、AURKA、SPP1、SOX2和TP63的表达水平也增加。另一方面,与 Het1A 细胞共培养的 CAF相比,与 KYSE510 细胞共培养的 CAF表现出明显更高的增殖率、迁移能力和 CAF 活化标志物(FAP、VIM 和 αSMA)的蛋白表达。这些结果表明,侵袭性上皮细胞和 CAF 的空间共定位在促进和维持 CAF-Epi 生态位的形成中起着关键作用。他们检测了上皮 JAG1-NOTCH1 信号在 ESCC 发展过程中对募集和激活 CAF 的影响。多重免疫荧光分析表明,在 ESCC 发展过程中,JAG1 水平增加,其评分与 ESCC 癌巢或与基质接壤的上皮层中的 CAF 标记物 αSMA和 FAP呈正相关,与 Xenium In Situ数据一致(图 5 A)。他们对用致癌物 4-硝基喹啉 1-氧化物 (4-NQO) 处理的小鼠食管进行了scRNA-seq,该致癌物可诱发多阶段 ESCC 病变,也表明在 ESCC 发展过程中,JAG1 表达和 CAF 评分(Acta2、Mmp11和Cthrc1)存在相关性和上升趋势(图 5B-C)。此外,来自人类食管组织的空间转录组数据表明,在整个 ESCC 进展过程中,上皮细胞附近的 CAF 评分空间升高(图 5D)。因此,他们将 ESCC 细胞与从人食管组织中提取的 NF 共培养,结果表明,与JAG1过表达的 ESCC 细胞共培养的 NF 表现出比与对照 ESCC 细胞共培养的 NF 明显更高的迁移能力,而当 NF 与JAG1沉默的 ESCC 细胞 共培养时则出现相反的结果。有趣的是,当在JAG1过表达的 ESCC 细胞中敲低CXCL1或CXCL8时,共培养的 NF 的迁移能力不再增加。与对照组相比,在与JAG1过表达 ESCC 细胞共培养的 NF 中,CAF 活化标志物(胶原蛋白 I、FAP、αSMA 和 IL6)升高,但在与JAG1沉默的 ESCC 细胞共培养的 NF 中,CAF 活化标志物(胶原蛋白 I、FAP、αSMA 和 IL6)没有变化。总之,这些结果表明,上皮细胞中升高的 JAG1-NOTCH1 信号在募集和激活 CAF 中起着重要作用。
他们建立了食管上皮特异性Notch1基因敲除小鼠,并将其暴露于 4-NQO 以诱导多阶段 ESCC 病变。他们将小鼠食管组织的 H&E 染色切片进行分区,并将其细分为 100 μm x 100μm 的区域,以定量评估每只小鼠中各种病变的比例(图5E)。小鼠中的Notch1缺失导致 ESCC 病变患病率显著降低,其中Notch1⁻/⁻小鼠显示的侵袭性区域最少(图5 F)。多重免疫荧光证实上皮Notch1信号传导促进 CAF 活化,因为JAG1和NICD1水平随着疾病进展而逐渐增加并与 CAF 标志物(FAP和αSMA)(图5G-H)呈正相关。他们还在 4-NQO 诱导的Notch1条件性敲除小鼠中建立了源自 ESCC 的类器官,多重免疫荧光和 qPCR 分析显示Notch1+/−和Notch1−/−小鼠的 Cxcl1 水平显著低于Notch1+/+小鼠。总之,这些发现强烈表明 CAF-Epi 微环境的形成驱动 ESCC 进展,而 JAG1-NOTCH1 信号抑制阻止了其发展。
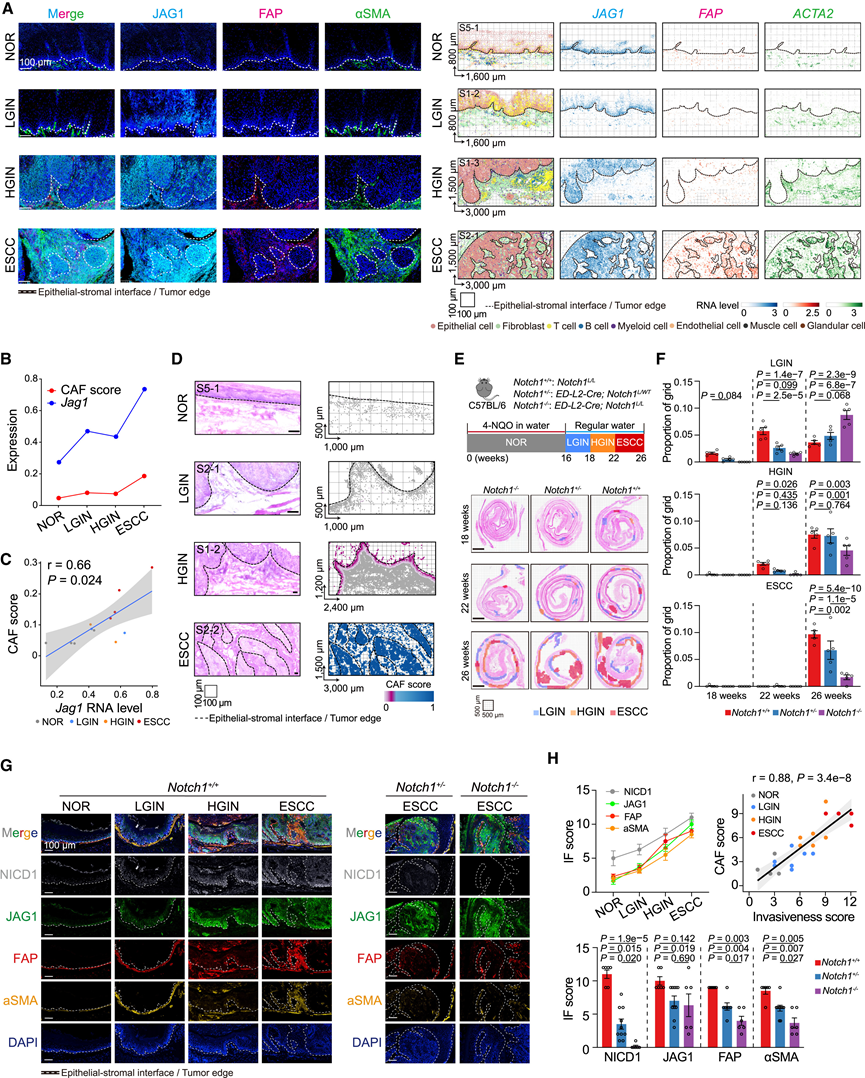
图5. JAG1-NOTCH1 信号促进癌症相关成纤维细胞募集和激活。
(A) 不同阶段的 JAG1 和 CAF 激活标记物 FAP 和 αSMA 的多重免疫荧光分析(左)和空间转录组图(右)。(B) 线图显示了NOR、LGIN、HGIN和ESCC阶段的Jag1 RNA 水平和 CAF 评分趋势。(C) 来自小鼠 scRNA-seq 数据的Jag1水平与 CAF 评分的 Spearman 相关性。(D) 代表性 NOR、LGIN、HGIN 和 ESCC 区域的空间图。(E) 食管上皮特异性Notch1条件性敲除的基因工程小鼠中食管癌前病变和 ESCC 的诱发图表(上)和 H&E 图像(下)。(F) 条形图显示 LGIN、HGIN 和 ESCC 的网格比例(按基因型划分)。(G) 在不同阶段的小鼠食管样本中对 NICD、JAG1 和 CAF 激活标志物 FAP 和 αSMA 进行多重免疫荧光分析。(H) 免疫荧光 (IF) 评分以及增殖和 CAF 评分的 Spearman 相关性。
06
CAF-Epi 微环境在肿瘤区域形成免疫隔离微环境
为了阐明 CAF-Epi 微环境形成的免疫学后果,他们系统地分析了 ESCC 进展过程中上皮和基质区域中免疫细胞的空间分布(图6A-C)。在上皮-基质界面上方的上皮区域中,他们观察到从 NOR 到 LGIN 阶段,单核细胞、树突状细胞以及 CD8+和CD4+幼稚/记忆 T 细胞的密度略有增加(图 6 A-C)。在基质区,免疫细胞密度没有显著变化,而三级淋巴结构 (TLS) 的比例从 NOR 阶段的 12/45 (26.7%) FOV 增加到 LGIN 阶段的 9/25 (36.0%) FOV。这些结果表明,在 NOR 和 LGIN 阶段存在旨在抵御 ESCC 进展的主动免疫反应。
在 HGIN 期上皮区,CD4+调节性 T 细胞 (Treg) 的密度与 NOR 相比显著升高,增殖评分显著增加(通过平均MKI67、AURKA、CCDN1和CCNA2的表达水平)(图 6 A-C)。相反,与 NOR 相比,HGIN 期 CD8+幼稚/记忆性 T 细胞密度降低(图 6 A-C)。此外,HGIN 时上皮区域中促肿瘤的SPP1 +巨噬细胞密度增加,而 NOR 期仅为 0.02,同时增殖评分也显著增加(图 6 A-C)。HGIN 期基质区域中 TLS 存在的比例增加,而 LGIN 期仅为 36.0%,NOR 期仅为 26.7%。这些发现表明,虽然免疫反应在 HGIN 阶段处于活跃状态,但在晚期癌前阶段,上皮区域内可能开始向免疫抑制转变,同时巨噬细胞也开始向肿瘤方向分化。
在 ESCC样本中,观察到免疫细胞分布的更剧烈变化。与 NOR 相比,ESCC 阶段肿瘤区域的 CD4+和CD8+幼稚/记忆 T 细胞以及树突状细胞的密度显著降低(图6 A-C)。此外,与 NOR 相比,ESCC 肿瘤区域的CD8+ Tex 密度显著升高,增殖评分显著增加(图6A-C)。此外,ESCC 期肿瘤区域内SPP1+巨噬细胞的密度显著增加至 0.65,而 NOR 期仅为 0.02,同时增殖评分也显著升高(图 6A-C)。这些发现表明在晚期 ESCC 期建立了免疫抑制和耗竭的微环境,并伴有肿瘤区域巨噬细胞的促肿瘤分化。
然后,他们研究了免疫变化是否与 CAF-Epi 微环境的形成有关。细胞邻域分析显示,在 ESCC 期,SPP1+巨噬细胞和 CAF-Epi 微环境在肿瘤区域内存在显著的空间共定位。此外,使用scRNA-seq数据进行细胞间通讯分析显示,与 NF 和 SPP1+巨噬细胞相比,CAF和SPP1+巨噬细胞之间极化或粘附相关的配体-受体对增强,包括之前已知的 RARRES2-CMKLR1。这些结果表明,CAF-Epi 微环境的形成可能促进SPP1+巨噬细胞在从 HGIN 到 ESCC 阶段的转变过程中分化。
此外,细胞密度分析显示在 HGIN 和 ESCC 中上皮-基质界面周围富集了 CAF-Epi 微环境和SPP1+巨噬细胞,且ESCC 中的CAF 和SPP1+巨噬细胞密度更高(图 6B-C)。在 HGIN 中,上皮区域内以及距上皮-基质界面 100 μm 以内的 CD4+和CD8+T 细胞密度(CD4+Treg除外)明显低于 100 μm 以外的基质区域(图 6B)。而在 ESCC 中,在肿瘤区域内发现了一个免疫空洞区,该免疫空洞区延伸到肿瘤边界外 250 μm(图 6B)。这些空间分布表明肿瘤边缘的 CAF-Epi 微环境可能形成屏障,削弱免疫细胞在肿瘤防御中的功能。因此,他们研究了这种屏障是否是由 CAF-Epi 微环境形成引起的 ECM 重塑引起的。在肿瘤边缘的 CAF-Epi 微环境周围有高细胞外基质(ECM)评分(通过计算COL1A1、COL1A2和COL3A1表达的平均数)(图 6D)。在基质区域,到随着距离肿瘤边缘从 0 到 250 μm 的增加,ECM 评分呈显著下降趋势(图 6D)。在上皮区域,随着距离肿瘤边缘从 0 到 50μm 的增加,也观察到了类似的下降趋势(图 6D)。这些结果表明在肿瘤边缘的 CAF-Epi 微环境周围形成了致密的纤维化 ECM。他们还利用多重免疫荧光分析其他 ESCC 样本中的上皮细胞 (EPCAM)、CAF(FAP 和 αSMA)和 ECM(I 型胶原和 III 型胶原)的标记基因,证实了这种 ECM 重塑(图 6 E)。此外,他们还发现了类似的 CAF-Epi 微环境,它在 HNSC 中诱导了 ECM 重塑(图6F-G),这表明该微环境通过跨多个 SCC 的 ECM 重塑促进了免疫隔离微环境的建立。
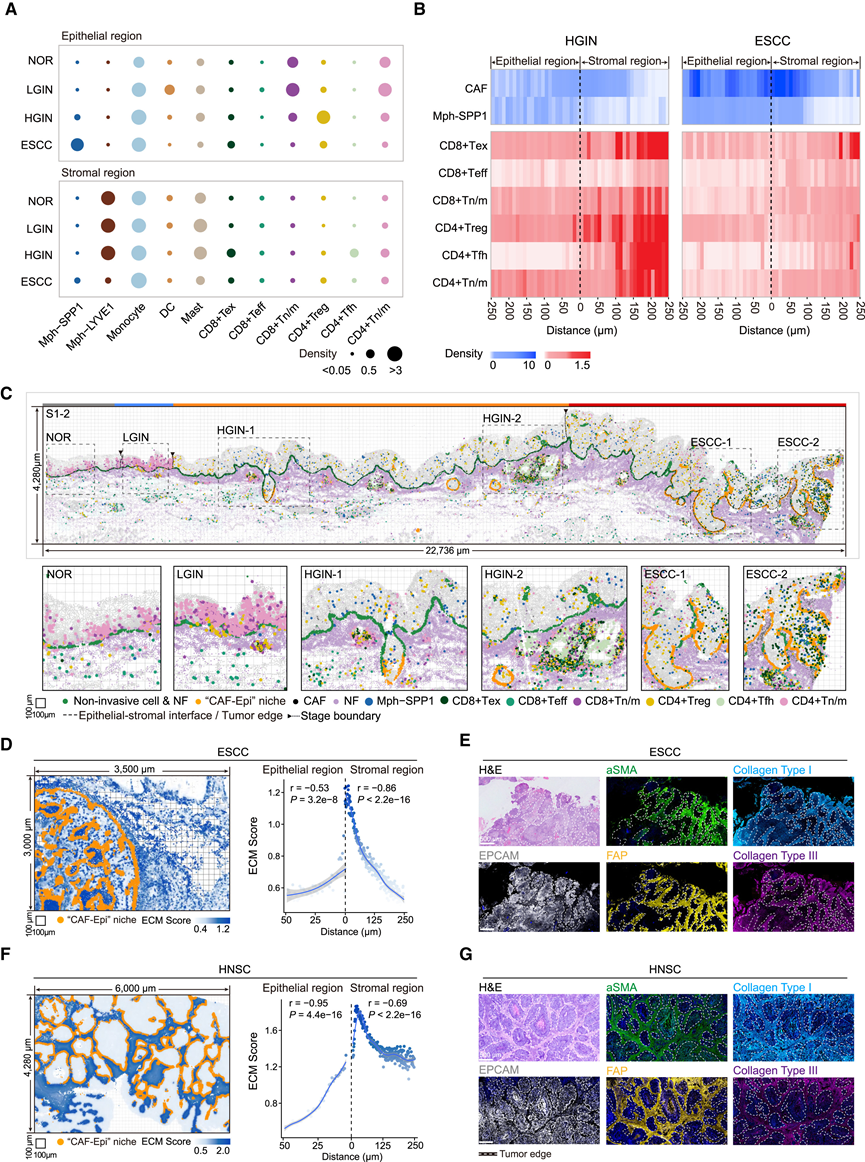
图6. CAF-Epi 微环境的形成在肿瘤区域建立了免疫隔离微环境。
(A) 点图显示不同阶段每个 FOV 中上皮(上)和基质(下)区域中免疫细胞亚型的平均密度。(B) 热图显示距离上皮-基质界面 (HGIN) 或肿瘤边缘 (ESCC) 不同距离的 CAF和SPP1+ 巨噬细胞(上)CD8+和 CD4 + T 细胞(下)的平均密度。(C) CAF-Epi 生态位和不同类型免疫细胞的代表性分布的空间图。(D, F) ESCC和HNSC样本中 ECM 评分与肿瘤边缘距离的相关性分析。(E, G) ESCC和 HNSC样本中 EPCAM、CAF 活化标志物 αSMA 和 FAP 以及 ECM 成分 I 型胶原蛋白和 III 型胶原蛋白的 H&E 染色和多重免疫荧光图像。
07
ESCC 和其他 SCC 中上皮和微环境重塑评分的临床潜力
然后,他们系统地评估了 CAF-Epi 微环境形成在 ESCC 发展中的临床意义。通过检测FAP、MMP1、MMP11、POSTN、COL1A1、COL1A2和COL3A1的平均表达水平制定了 CAF 评分,并利用外部蛋白质组学数据集测试了其独立和与已建立的上皮侵袭性评分相结合对 ESCC 进展的预测价值(图 7 A)。NOR 的上皮侵袭性评分为 0.70,HGIN和 ESCC(图 7 B)的评分显著增加。NOR和 LGIN的 CAF评分分别为 1.09 和 1.12。与 NOR 相比,该评分在 HGIN 中显著增加至 1.31,在 ESCC 中进一步增加至 1.62(图 7B)。值得注意的是,结合上皮侵袭性和 CAF 评分的综合 CAF-Epi 生态位评分显示出从 NOR(0.85)到 HGIN和 ESCC(图 7B)的增加趋势。此外,他们发现 JAG1 的表达水平与 CAF 评分之间存在显著相关性,证实 CAF 激活是由 JAG1-NOTCH1 信号驱动的。利用其他队列中的多重免疫荧光分析,他们确认了ESCC、HNSC、肺鳞状细胞癌 (LUSC) 和宫颈鳞状细胞癌 (CESC)样本中存在 CAF-Epi 微环境的形成(图 7 C)。总之,这些结果表明与 CAF-Epi 微环境形成相关的基因可作为多种 SCC 进展的重要指标。
接下来,他们研究了 CAF-Epi 微环境形成及其诱导的 SCC 免疫微环境重塑的预后潜力。通过最小绝对收缩和选择算子 (LASSO) Cox 回归,在 179 名 ESCC 患者(发现队列)中使用 36 个预后细胞相关基因构建了一个预后预测模型,确定了一个与 ESCC 预后密切相关的 26 个基因的“CAF-Epi-Immune”评分(图 7 D)。该评分的预后效用在 137 名 ESCC 患者的独立队列(验证队列)中得到证实,其中评分越高,总体生存率越差(图 7 D)。将发现队列和验证队列结合起来,在 316 名 ESCC 患者中也观察到了类似的趋势(图 7 D),并且与早期阶段(I 和 II)相比,较高的评分与晚期肿瘤淋巴结转移 (TNM) 分期(III 和 IV)相关(图 7 E)。与单独的上皮侵袭性评分(0.747)或 CAF 评分(0.720)相比,CAF-Epi-Immune 评分在 ESCC 患者预后预测中显示出更高的曲线下面积 (AUC, 0.786)。虽然该评分显示出比 TNM 更高的 AUC,但在对数似然比检验中它并没有提供超出 TNM 的额外预后价值,表明它主要表示 ESCC 进展。他们还评估了该评分在 Cancer Genome Atlas (TCGA) 数据库中其他 SCC 的预后价值,包括 HNSC、LUSC和 CESC。结果表明,在 HNSC、LUSC和 CESC(图7F)中,较高的评分与较差的预后显著相关。在对 1699 个 SCC 样本的全面分析中,他们发现了较高分数与不良预后风险增加之间的显著相关性(图7G)。这些发现强调了 CAF-Epi 微环境在泛 SCC 中形成的潜在预后意义。
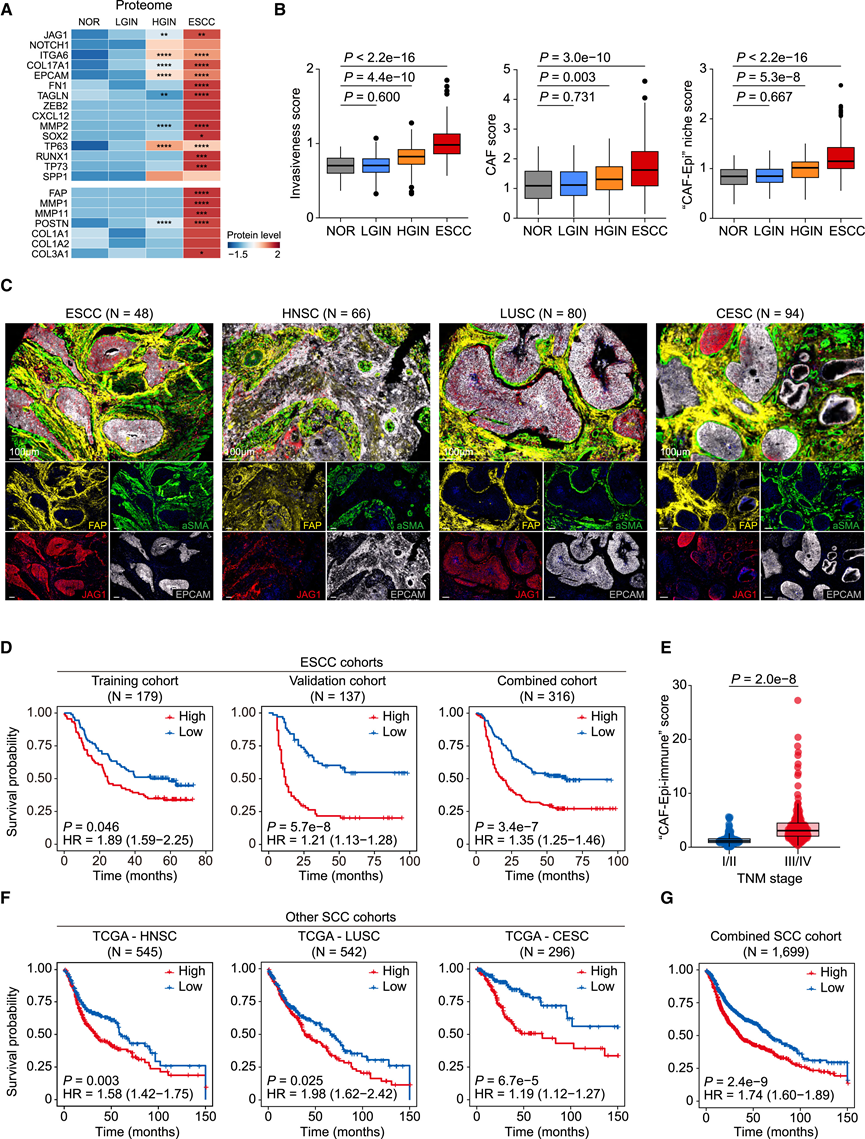
图7. 上皮侵袭性和 CAF 评分与 ESCC 进展和全 SCC 预后相关。
(A-B) 热图显示与侵袭性细胞和 CAF相关的基因的蛋白质表达水平,箱线图显示生态位评分。(C) ESCC、HNSC、LUSC 和 CESC 样本中 CAF(FAP 和 αSMA)和侵袭性上皮细胞(JAG1 和 EPCAM)标志基因的多重免疫荧光。(D) Kaplan-Meier 曲线。(E) ESCC 联合队列中 ESCC 患者的风险评分按 TNM 分期分层。(F-G) Kaplan-Meier 曲线显示 TCGA 数据库中 SCC 患者的总体生存率。
+ + + + + + + + + + +
结 论
本研究展示了单细胞分辨率的空间转录组图,涵盖了来自 43 名患者的 127 个多阶段视野,以绘制人类食管鳞状细胞癌 (ESCC) 的进化轨迹。通过分析 640 万个细胞,发现 ESCC 进展是由获得去分化和侵袭性特征的增殖性上皮细胞亚群驱动的。在晚期癌前阶段,这些细胞破坏上皮-基质界面并通过 JAG1-NOTCH1 信号传导招募正常成纤维细胞,将它们转化为CAF。这种相互作用导致在肿瘤边缘形成“CAF-Epi”生态位,保护肿瘤免受免疫监视。 CAF-Epi 微环境形成是 ESCC 和其他鳞状细胞癌进展及患者预后的关键指标。
+ + + + +



 English
English


