文献解读|Cell(45.5):膳食异生物质的微生物转化塑造肠道微生物组组成
✦ +
+
论文ID
原名:Microbial transformation of dietary xenobiotics shapes gut microbiome composition
译名:膳食异生物质的微生物转化塑造肠道微生物组组成
期刊:Cell
影响因子:45.5
发表时间:2024.10.31
DOI号:10.1016/j.cell.2024.08.038
背 景
人体微生物群对健康有着广泛的影响。每个个体都承载着数万亿的共生微生物,这些微生物在人与人之间差异很大,它们编码的基因总数是人类基因组的150多倍。这些细菌的遗传和代谢能力为维持健康状态提供了必要的功能,而微生物群失调可能导致心血管疾病、炎症性肠病、2型糖尿病、肥胖和癌症等疾病。然而,除了少数例外,人们对微生物群促进健康的机制知之甚少
实验设计
结 果
01
生成生长影响和膳食异种代谢的图谱
从水果和蔬菜等食物中摄取的许多膳食异生物质(“母体”化合物)主要以糖苷酯的形式存在,其中骨架用亲水性糖(如葡萄糖、鼠李糖和芦丁糖)或酸(如奎宁酸和没食子酸)修饰。其他母体化合物仅作为未修饰的骨架存在。为了了解这些膳食异生物质的微生物代谢如何导致对饮食的不同反应,研究团队首先探索了来自相关健康供体的29个人类群落(微生物组变异[MV]收集)代谢22种代表性化合物的能力(图1A)。这组化合物包括来自13种不同种类的膳食异生物质的母体糖苷和酯类及其未修饰衍生物,以及未修饰的母体化合物,包括从普通食物(如水果和蔬菜)中摄入的高剂量化合物,以及作为膳食补充剂或传统药物摄入的与结构相关的化合物。每种化合物与人体样本在厌氧条件下在培养基中培养,培养基在很大程度上重现了人类肠道中的微生物组组成;48 h后用液相色谱-质谱法测定化合物代谢。
他们观察到不同群落对不同化合物的代谢存在广泛的个体间差异,并建立了三种一致的模式。首先,具有糖苷键的亲本蛋白(例如多甙和橙皮苷)和酯键很容易受到大多数菌群切割,而它们未修饰的形式(例如,白藜芦醇和橙皮苷)只由部分菌群代谢(图1A)。其次,不同的群落对同一母体化合物产生不同的代谢物,包括去糖基化、开环、双键还原、去甲基化和去羟基化的产物。最后,与未修饰的多酚相比,修饰了甲氧基的多酚由较少的群落代谢(例如柚皮苷与橙皮苷)(图1A)。肠道微生物组个体成员代谢甲氧基化和非甲氧基化糖苷化合物的能力与群落范围内的测量结果一致,例如,肠道微生物组的常见成员(拟杆菌和双歧杆菌)会使许多这些化合物去糖基化,而不太常见的分类群(例如醋酸菌)可能通过Wood-Ljungdahl途径从甲氧基化的多酚中去除甲氧基。
人类肠道群落和个体物种对膳食异生物质的这些代谢转化包括产生或消除具有抗菌作用的化合物(在这里,毒性是指抗菌活性)。为了确定膳食化合物的微生物代谢是否会改变外生物的毒性,他们首先扩大了膳食外生物的收集范围,包括了37种结构类别的161种化合物(图1B)。这个扩大的收集包括亲本化合物(糖苷、酯或未修饰的亲本)、未修饰的衍生物(糖苷或酯水解产物),以及进一步下游的微生物代谢物(如酚酸),使他们能够评估亲本化合物及其微生物代谢物之间的毒性差异。
在含有 161 种化合物的膳食异生物质库中,他们对 26 种细菌进行生长测量,结果表明,超过一半的化合物(86/161)对任何物种都没有强烈的抑制作用(生长率 <50%),只有9%抑制了超过一半的测试物种的生长,这表明在测试的浓度下,一般的抗菌作用并不常见。然而,他们发现了一组化合物(32%)在 200 μM 时可使至少 2 种物种的生长降低至少 50%(图 1C-D)。这些化合物对易感指示物种产生 50% 生长抑制率(IC 50)的浓度范围为 50 至 250 μM;对于超过一半的测试化合物,这些 IC 50值低于预测的结肠浓度。化合物毒性显示出门水平的模式:变形菌对几乎所有抑制大多数其他门的化合物都有抗性,而一些化合物对特定门有优先毒性。变形菌的抗性可能是由于外膜的不透性和外排所致,因为高透性的大肠杆菌 ΔbamB ΔtolC突变体对大量化合物表现出敏感性(图 1 C)。重要的是,母体化合物和它们各自的微生物代谢物的毒性各不相同;在多种情况下,糖苷是无毒的,而相应的非糖基化形式会抑制细菌生长。在某些情况下,代表这些有毒糖苷配基的下游代谢物(还原形式)的化合物也不会抑制细菌生长。

图1. 膳食异生物质由肠道微生物群落以不同的方式代谢。
(A)通过 LC-MS 检测与每个群落孵育后 10-20 μM 的每种化合物的水平。(B) 161 种膳食异生物质库中所代表的化合物类别。(C) 26 种肠道共生菌在库中每种膳食异生物质(200 μM)存在下的生长情况。(D) 每种膳食异生物质抑制的物种数量直方图。
02
膳食异生物质重塑肠道微生物群落的组成
鉴于膳食异生物质或其微生物代谢物抑制单个物种生长的能力广泛且多变,他们接下来确定这些化合物是否会重塑微生物群落的组成。为此,他们将 161 种化合物库中的 140 种膳食异生物质(由于化合物可用性原因,排除了 21 种)引入到四个不同微生物群落的厌氧培养中:图 1 A 中测试的集合中的三个群落(MV20、MV27 和 MV29),以及一个由 38 个成员定义的群落,其中包括主要人类肠道门的代表以及已知会代谢常见膳食异生物质的物种(图 2 A)。
使用 16S rRNA测序测量的群落组成,他们评估了样本之间的 β 多样性(图 2 B)。用相同化合物处理的同一群落的独立重复表现出较低的 β 多样性(图 2 C)。为了定量膳食异生物质对群落组成的影响,他们检测了生长的群落与 DMSO 对照之间的 β 多样性。MV27 的整体 β 多样性得分高于其他群落(图 2 D),表明它更容易受到破坏;该群落还表现出低 α 多样性(Shannon 熵)和更高的梭菌相对丰度。他们确定了显著重塑群落的化合物(图 2 D)。总共有 25/140 种化合物(19%)导致至少一个群落发生显著重塑(图 2 D),其中 10 种化合物破坏了所有四个群落(“泛破坏性化合物”)(图 2 E)。这些泛破坏性化合物引起的变化与来自不同捐赠者的群落之间的差异(群落间 β 多样性)相当(图 2 E),表明这种重塑程度与微生物组功能有关。与 DMSO 对照相比,存在泛破坏性化合物的情况下这些群落的最终密度(OD 600)也降低了,表明绝对细菌丰度降低了。值得注意的是,泛破坏性化合物在纯培养中也对肠道共生体有毒性(图 2 E)。事实上,当考虑所有化合物时,纯培养中对单个物种的平均毒性与 β-多样性与 DMSO显著相关,表明化合物毒性是这些条件下群落重塑的主要预测因素(图 2 F)。

图2. 膳食异生物质对人类肠道微生物群落的重塑。
(A) 实验设计。(B-F) β 多样性分析。
03
相互作用分析
接下来,他们评估了群落中单个分类群对每种膳食异生物质的反应的相对丰度变化。某些化合物,包括泛破坏性化合物,改变了群落中相同细菌类别的相对丰度(图 3A)。此外,这些化合物引起的群落组成变化与对单个物种的测量毒性一致:抗性分类群(例如,Gammaproteobacteria)的相对丰度增加,而易感分类群减少(图 3A)。值得注意的是,当细菌总量发生变化时,相对丰度测量并不总是反映绝对丰度的变化。
然而,对于大多数膳食异生物质而言,四个群落之间的分类单元相对丰度变化并不相同,也无法根据化合物对单一栽培中相关分类单元的毒性进行预测(图 3B)。此外,许多仅引起整体组成细微变化的化合物(与 DMSO 相比β 多样性较低)仍然显示出多个分类单元相对丰度的显著变化。为了更仔细地分析单个物种对膳食异生物质的敏感性与其在群落中的相对丰度之间的关系,他们绘制了单一栽培中用给定化合物处理的特定菌株的生长情况(图 1C),并分析用相同化合物处理的 38 个成员的定义群落中相同菌株的相对丰度的关系(图 3C)。在此图中,大多数点沿每个轴呈正态分布,因为大多数化合物在单一栽培中无毒,也不会对群落组成产生影响。此外,一些在单一栽培中有毒的化合物会导致易感分类单元可预测的减少。落在这些预期区域之外的点代表了新出现的相互作用:当一种化合物降低了某个群落中某个物种的相对丰度,但对单一培养中的该物种几乎没有或根本没有活性时,就会发生交叉敏感化;而当一种化合物对单一培养中的某个物种表现出显著的毒性,但不会降低该物种在群落环境中的相对丰度时,就会发生交叉保护。
为了探究化合物代谢与新出现的相互作用之间的关系,他们使用 LC-MS 技术测量了与 38 个成员群落孵育后每种化合物的水平。根据单一培养中的毒性可预测地消耗群落中的分类群的化合物,包括 10 种泛破坏性化合物中的 8 种,通常不会由38 个成员群落代谢(图 3D)。相比之下,大多数涉及交叉保护或交叉致敏相互作用的化合物都由 38 个成员群落大量代谢,剩余的母体化合物不到 25%(图 3D)。这些结果表明,膳食异生物质的代谢可能与观察到的新出现的相互作用有关。值得注意的是,这种趋势也有例外,因此也可能出现与代谢无关的其他机制。
总之,这些结果说明了直观的原理,即抑制细菌生长的化合物会导致群落重塑,其重塑基于其毒性范围,正如十种泛破坏性化合物所表明的那样。然而,在许多情况下,饮食中的膳食异生物质对特定群落的影响并不是那么容易预测的,从而揭示了突发的相互作用。

图3. 膳食异生物质与群落组成之间的预测和出现的相互作用。
(A-B) 对于每种膳食异生物质,将每个群落中细菌类别的相对丰度差异倍数与化合物对该类别中代表性物种的平均毒性进行比较。(C-D) 38 个成员的特定群落和单一培养条件下的 26 个物种对 140 种膳食异生物质的反应。
04
对膳食异生物质进行不同程度的毒化或解毒
他们假设:膳食异生物质的微生物代谢变化可能通过改变化合物毒性产生交叉致敏和交叉保护等新特性(图 4 A)。为了创建膳食异生物质毒性如何通过群落代谢改变的详细图谱,他们从 161 个化合物库中选择了 94 种膳食异生物质,将这些化合物中的每一种与上面使用的四个微生物群落(MV20、MV27、MV29 和 38 个成员定义的群落) 一起孵育,从每次孵育中生成小分子提取物,并检测这些提取物抑制七种代表性肠道共生菌生长的能力(图 4 B)。在没有添加膳食异生物质的情况下从这四个群落中制备的提取物对七种指示物种无毒(图 4 C)。
对于 11/94 种化合物(“有毒化合物”),至少一种指示物种的生长受到与至少一种群落孵育后制备的提取物的抑制,表明可能产生有毒代谢物(图 4 C)。此组中的几种化合物(例如槲皮素、虎杖苷、白皮杉醇和川陈皮素)也表现出群落特异性重塑活性,其方式无法通过它们对纯培养中单个物种生长的影响来预测,提示群落特异性的新兴相互作用(图 3 B)。当将这 11 种化合物与 MV 收集的 29 个人类微生物群落一起孵育时(图 1 A),这些孵育中的提取物产生了群落和化合物特异性的抑制指示物种生长的能力(图 4 D)。
这些有毒化合物中有五种(橙皮苷、柚皮芦丁、槲皮苷、甜菊苷和虎杖苷)是糖苷,其糖苷配基形式表现出毒性,但其下游代谢物无毒(图 4 A)。几乎所有 29 个人类群落都将这些糖苷去糖基化为有毒的糖苷配基,但随后在某些群落中以不同的方式代谢为无毒的下游代谢物,而在其他群落中则没有。与 29 个群落一起孵育的化合物提取物中的糖苷配基丰度与指示物种的生长抑制之间的相关性表明这些糖苷配基是造成观察到的毒性的原因(图 4 E)。群落 MV20 对糖苷白藜芦醇的毒性就是一个例子:他们将白藜芦醇与 MV20 一起孵育,使用活性引导纯化分离孵育过程中产生的毒性因子,并使用 LC-MS 将该因子鉴定为白藜芦醇糖苷配基白藜芦醇。一些化合物可能还会诱导群落产生不相关的代谢物,从而增加或减少指示物种的生长。例如,这可以解释以下观察结果:虽然这些提取物中的甜菊醇含量相似,但从不同群落与甜菊苷孵育中制备的提取物对B. ovatus生长的影响却不同(图 4 E)。
对于某些糖基化母体化合物,其糖苷形式具有毒性,尽管母体化合物消失,但将母体化合物与 MV20、MV27、MV29 或 38 个成员定义的群落一起孵育后制备的提取物不会抑制指示物种的生长。将其中三种糖苷(根皮苷、木犀草苷和杨梅苷)与完整的 29 个细菌群落一起孵育,在所有情况下均未发现毒性,LC-MS 显示预测的毒性糖苷均匀地代谢为无毒的下游代谢物(图 4 F)。一致地,虽然这些化合物的糖苷形式具有毒性,但直接将其添加到测试的群落中不会导致群落重塑(图 3 B)。与这些普遍解毒的化合物相比,甲氧基化化合物(例如橙皮素、香叶木素和橘皮素)由较小群体转化为下游代谢物,因此其毒性作用的变化性更大(图 4 D)。因此,对于这些糖苷,毒性糖苷配基的代谢程度决定了是否会积累有毒或无毒代谢物。

图4. 肠道微生物组对膳食异生物质的毒性和解毒作用。
(A) 微生物组介导的膳食异生物质的毒性和解毒模型。(B) 实验流程。(C-D) 对于所测试的 94 种膳食异生物质中,由化合物与至少一种群落孵育制备的提取物抑制了至少一种指示物种的生长。(E) 指示物种的标准化生长与毒性糖苷配基检测之间的关系。(F) 与 29 个细菌群落一起孵育不会导致中毒的化合物示例。
05
膳食异生物质代谢预测体外群落重塑
他们选择了三种膳食异生物质(虎杖苷、橙皮苷和甜菊苷)来测试这些假设的机制(图5)。之所以选择这些化合物,是因为(1)它们在体外和与人类群落一起定植的无菌小鼠中均由人类群落不同程度地代谢(图1 A);(2)它们通过产生同源糖苷而导致群落代谢中毒(图4 D-E);(3)它们通常是可食用的(葡萄或作为补充剂的虎杖苷,柑橘类水果中的橙皮苷,以及作为无热量甜味剂的甜菊苷),并且与人类健康有关;以及(4)通常食用的剂量产生的结肠浓度与群落重塑相关(200 μM),例如虎杖苷、橙皮苷和甜菊苷的糖苷配基形式对易感类群的最低抑菌浓度 (MIC) 约为 125-250 μM,而用相应剂量管饲的小鼠的结肠内容物中则超过了这一浓度。
为了从机制上检验这些假设的群落重塑机制,他们确定了能够代谢虎杖苷、橙皮苷或甜菊苷的物种,构建了包含这些物种的 8-10 个成员的特定群落,并在引入每个母体糖苷、糖苷配基和下游代谢物后测量了群落重塑。他们首先研究了虎杖苷,一种 3-糖基化的二苯乙烯 (IC50> 1000μM),它去糖基化后形成糖苷配基白藜芦醇 (IC 50 ≥ 125 μM);随后还原产生二氢白藜芦醇 (IC 50> 1000 μM)(图 5 A)。虽然许多物种能够将白藜芦醇苷去糖基化为白藜芦醇,但他们收集的只有两个物种(Eggerthella lenta DSM 2243 和Adlercreutzia equolifaciens DSM 19450;均属于放线菌门、Coriobacteriia 纲)将白藜芦醇还原为二氢白藜芦醇。在缺乏E. lenta或A. equolifaciens的 9 成员群落中,添加白藜芦醇苷会导致交叉致敏:白藜芦醇积累,而Bacteroides thetaiotaomicron的相对丰度显著降低(图 5 B),与其对白藜芦醇而非白藜芦醇的敏感性一致。向该群落中直接添加白藜芦醇会以类似的方式调节群落组成(图 5 B)。向群落中添加E. lenta产生了交叉保护作用:当施用虎杖苷时,二氢白藜芦醇代替白藜芦醇积累,而B. thetaiotaomicron在群落中保持稳定(图 5 B)。
他们研究了橙皮苷,它是一种 IC 50> 1000 μM 的 7-O-芸香糖苷。橙皮苷去糖基化形成糖苷配基橙皮素,它是一种 4′-甲氧基化黄烷酮,IC 50 ≥ 125 μM(图 5 C)。橙皮素随后代谢为酚酸[例如 3-(4-甲氧基-3-羟基苯基)丙酸 (MHPPA);IC 50> 1000 μM)]。在测试的 30 个物种中,只有Ruminococcus gnavus ATCC 29149 将橙皮苷代谢为橙皮素;与之前的报道一致, E. ramulus DSM 16296 将橙皮苷或橙皮素转化为MHPPA。在缺乏R. gnavus或E. ramulus 的9 成员群落中,糖苷橙皮苷不会发生代谢,对群落组成影响较小,而糖苷配基橙皮素导致B. thetaiotaomicron和B. ovatus的消耗(图 5 D)。向该群落中添加R. gnavus或E. ramulus分别导致对橙皮苷的交叉致敏或对橙皮素的交叉保护,这与每个群落中通过该途径的代谢物积累一致(图 5 D)。在这些化合物存在的情况下, E. ramulus的相对丰度也会增加,这与其对橙皮苷/橙皮素的利用以及在食用富含黄酮类化合物饮食的人类受试者中的扩增相一致。
之后,他们又研究了甜菊苷 (IC 50> 1000 μM),它由三个葡萄糖部分组成,装饰着甜菊醇糖苷核心 (IC 50 ≥ 250 μM)(图 5 E)。他们鉴定了能够裂解甜菊苷中每个糖苷键的物种,最终产生甜菊醇,而甜菊醇不会进一步降解(图 5 E)。Blautia producta DSM 3507 能够将甜菊苷完全代谢为甜菊醇,并且将它纳入一个确定的群落中会导致B. thetaiotaomicron对甜菊苷产生交叉敏感(图 5 F)。直接添加糖苷配基甜菊醇同样会耗尽B. thetaiotaomicron的相对丰度,这与预期的B. producta无关(图 5 F)。
他们接下来测试了通过膳食异生物质代谢的交叉致敏和交叉保护是否也可以预测复杂的、未分馏的人类肠道微生物群落的重塑。他们在体外用白藜芦醇、白藜芦醇或 DMSO处理来自 MV 收集的人类肠道群落(图 1 A) ,并检测化合物代谢和群落组成。在用虎杖苷孵化的群落中,与 DMSO 相比,白藜芦醇暴露与 β 多样性显著相关(图 5 G)。虎杖苷诱导的成分变化与直接添加白藜芦醇引起的变化相似,表现为低 β 多样性和这些处理之间细菌类群相对丰度变化显著相关(图 5 G)。此外,将交叉保护菌株E. lenta添加到以白藜芦醇解毒缓慢为特征的群落或非代谢的 38 成员确定群落中,可减少和虎杖苷和白藜芦醇对群落的破坏(图 5 H)。这个由 38 个成员组成的定义群落表现出可预测的新兴相互作用:例如,在没有E. lenta的情况下,B. ovatus对白藜芦醇产生交叉敏感,而在有E. lenta的情况下,B. ovatus 则对白藜芦醇产生交叉保护。他们还观察到在没有E. lenta的情况下的交叉保护相互作用,这表明除了解毒之外,还有其他机制有待阐明。总之,这些结果提供了体外证据,表明交叉敏感和交叉保护是膳食异生物质重塑微生物群落的主要机制之一。

图5. 微生物代谢将群落重塑与膳食异生物质毒性联系起来。
(A-F) 白藜芦醇苷、橙皮苷和甜菊苷在体外重塑 8-10 个成员的定义群落。(G)β-多样性与白藜芦醇暴露之间的相关性。(H) 添加E. lenta可调节响应虎杖苷或白藜芦醇的群落重塑。
06
Coriobacteriia中白藜芦醇还原酶的鉴定
他们试图了解与饮食中的膳食异生物质中毒和/或解毒有关的基因和酶。与肠道微生物群对膳食异生物质进行的许多代谢转化一样,负责白藜芦醇代谢的具体酶尚不清楚。在存在白藜芦醇的情况下生长的E. lenta产生的无细胞裂解物可以降低白藜芦醇,但在没有白藜芦醇的情况下则不会降低白藜芦醇(图 6 A),这表明负责的基因可能受到转录调控。因此,他们对E. lenta进行了转录组分析 (RNA-seq),以识别白藜芦醇上调的基因。只有 26 个基因显著上调,包括 2 个操纵子(图 6 B)。两个基因上调超过 100 倍,且具有注释功能,可能与电子转移有关:Elen_288,注释为富马酸还原酶,以及Elen_1284,注释为黄素蛋白家族蛋白。
他们利用 CRISPR 61从E. lenta中敲除了Elen_288或包括Elen_1284在内的三基因操纵子。敲除Elen_288但不敲除Elen_1283-5会消除E. lenta中的白藜芦醇还原(图 6 C)。在非代谢性Gordonibacter urolithinfaciens中异源表达Elen_288 可赋予白藜芦醇还原酶活性。因此,Elen_288 对于白藜芦醇还原是必要且充分的(图 6 C)。
Elen_288 是一种预测的 TAT 分泌黄烯基化脂蛋白,之前已在单核细胞增生李斯特菌和小肠球菌中发现同源物。该蛋白质家族参与细胞外电子传递,以减少支持无氧呼吸的末端电子受体。之前已发现的 Elen_288 同源物可还原富马酸或尿苷酸,它们在目标双键两侧的结构均不同于白藜芦醇。RefSeq的 BLASTP 分析在Gordonibacter中发现了 Elen_288 同源物,但在其他细菌类别中未发现。与表型证据一致,代谢物种A. equolifaciens DSM 19450 编码一个相近的同源物(Aequ_2118,氨基酸同一性为 76.3%),而非代谢物种Gordonibacter pamelaeae、G. urolithinfaciens和Slackia isoflavoniconvertens仅编码远亲同源物(氨基酸同一性 <42%)(图 6 C)。使用此数据支持 70% 作为预测白藜芦醇还原酶活性的氨基酸同一性截止值,他们绘制了 96 个 Coriobacteriial 基因组中 Elen_288 同源物的存在情况(图 6 D)。他们发现该基因主要局限于Eggerthella、Adlercreutzia和Raoultibacter spp.,而在E. lenta菌株中高度保守。
使用针对Eggerthella、Adlercreutzia或Raoultibacter中白藜芦醇还原酶同源物保守区域的引物,他们在体外培养后测量了 MV 人类群落收集中的基因丰度。E. lenta物种丰度与白藜芦醇还原酶基因丰度密切相关,与其在该物种中的高度保守性一致(图6E)。此外,Eggerthella白藜芦醇还原酶基因丰度与群落白藜芦醇还原率显著相关(图 6F)。Adlercreutzia和Raoultibacter白藜芦醇还原酶基因丰度低于检测限,与这些物种在这些体外条件下的低丰度一致。
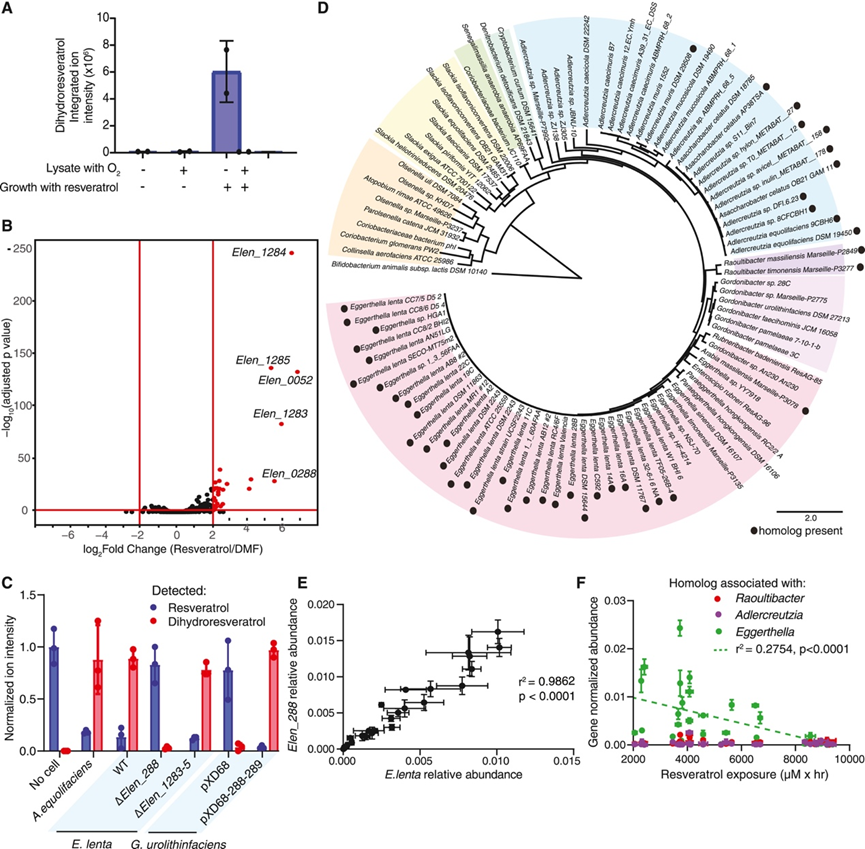
图6. Coriobacteriia中白藜芦醇还原酶的鉴定。
(A) 检测100 μM 白藜芦醇的情况下生长的E. lenta产生的无细胞裂解物将白藜芦醇还原为二氢白藜芦醇的能力。(B) 火山图显示在 100 μM 白藜芦醇或载体(二甲基甲酰胺 [DMF])存在下生长的E. lenta的差异转录本丰度。(C) 通过体外培养和 LC-MS测量各种物种或菌株将白藜芦醇代谢为二氢白藜芦醇的能力。(D) 96 种红蝽杆菌菌株的系统发育树,其中存在Elen_288同源物。(E) 使用基因和物种特异性引物通过 qPCR 测定体外生长的 29 个 MV 群落中Elen_288的丰度和E. lenta的丰度之间的相关性。(F) 不同属(Eggerthella、Adlercreutzia和Raoultibacter)相关的白藜芦醇还原酶同源物的丰度与体外培养的 29 个 MV 群落的白藜芦醇代谢速率之间的相关性。
07
膳食异生物质代谢可预测体内群落重塑
最后,他们检测膳食异生物质群落重塑模型是否适用于哺乳动物肠道环境。以虎杖苷为重点,他们首先将9元多门群落定植于无菌小鼠,分别在有或没有E. lenta的情况下进行,如先前体外表征的那样(图5B)。他们在对照窗口(PBS管饲)和治疗窗口(虎杖苷管饲)期间监测了粪便样本中的微生物组成(图7A)。在治疗窗口期间,粪便白藜芦醇水平约为200μM,与预测的人类结肠浓度一致(图7B)。与E. lenta在肠道中减少白藜芦醇一致,在群落中加入E. lenta会显著改变局部和全身对虎杖苷及其代谢物的暴露:粪便白藜芦醇水平显著降低,而粪便二氢白藜芦醇显著升高(图7B)。此外,在群落中加入E. lenta会显著降低白藜芦醇及其宿主介导的(葡萄糖醛酸化和硫酸化)代谢物的血清水平,并显著升高宿主介导的二氢白藜芦醇代谢物的血清水平。在对照窗口期间,含有和不含E. lenta的群落组成保持稳定,而缺乏E. lenta 的群落则在虎杖苷处理窗口期间每天都会出现紊乱。在紊乱期间,大肠杆菌(对白藜芦醇的生长抑制具有抗性)在虎杖苷处理后,其相对丰度和绝对丰度(以菌落形成单位 [CFU] 衡量)每天增加 3 到 4 倍,并在第二天早上白藜芦醇通过肠道后恢复到基线水平(图 7 C)。与E. lenta将白藜芦醇解毒为二氢白藜芦醇的能力一致,添加E. lenta可保护群落(包括大肠杆菌)免受白藜芦醇苷的破坏(图 7 C)。
定植于不同人类群落的小鼠的粪便白藜芦醇浓度相差超过 160 倍(9-1500 μM)(图 7 D),这突显了在食用相同量的母体化合物后,膳食异生物质代谢物浓度的广泛、微生物组依赖性变化。在这种体内环境中,Eggerthella和Raoultibacter白藜芦醇还原酶同源物的丰度与白藜芦醇治疗后的白藜芦醇水平不相关,而这些群落中Adlercreutzia白藜芦醇还原酶同源物Aequ_2118的丰度可以有力地预测这些动物中白藜芦醇代谢为白藜芦醇的程度(图 7 D)。Adlercreutzia在测试的体外条件下生长不良,再加上基因调控的可能差异,可能是造成这种差异的原因。这些观察结果表明,基因丰度等分子标记可以成为预测人类样本表型的重要工具。
他们在体内测试了虎杖苷是否会导致复杂人类群落的群落重塑。使用与定义的群落类似的实验方案(图7 A),在小鼠中定殖了两个不同的群落,这两个群落表现出不同的白藜芦醇减少水平:MV20,其特征是小鼠服用虎杖苷后Aequ_2118水平高而白藜芦醇积累很少,而 MV18,其特征是小鼠服用虎杖苷后Aequ_2118水平低而粪便白藜芦醇水平高(图7 D)。通过对照(PBS)和治疗(虎杖苷)阶段每天的初始条件(0 小时)和处理时间点(6 和 9 小时)之间的 β 多样性来评估群落破坏情况(β 多样性与 0 小时),揭示了由Aequ_2118基因水平和虎杖苷代谢预测的不同群落反应。具体而言,与MV20(图7E)和PBS对照期(图7F)相比, MV18群落(low Aequ_2118 ,high白藜芦醇)在白藜芦醇处理期间受到破坏,而与PBS处理相比,MV20群落(high Aequ _ 2118,low白藜芦醇)在白藜芦醇处理期间没有受到显著破坏(图7F)。通过在属和种水平上检查分类单元丰度,他们发现在MV18定植小鼠中,拟杆菌属(例如,B. uniformis)耗竭,而Aestuariispira属(例如,A. insulae)在白藜芦醇处理期间扩增(图7G)。这些观察结果与这些分类单元对白藜芦醇生长抑制的预测敏感性一致。此外,虽然B. uniformis也存在于定植于 MV20 群落的小鼠中,但在虎杖苷处理期间,其在该群落中的丰度没有发生变化(图 7 G)。事实上,在 MV20 定植小鼠中,没有物种在虎杖苷处理期间与对照处理期间丰度有显著差异。总之,这些体外和体内研究证明了特定白藜芦醇还原酶家族的个体间差异如何解释特定或复杂群落对膳食异生物质虎杖苷的反应。
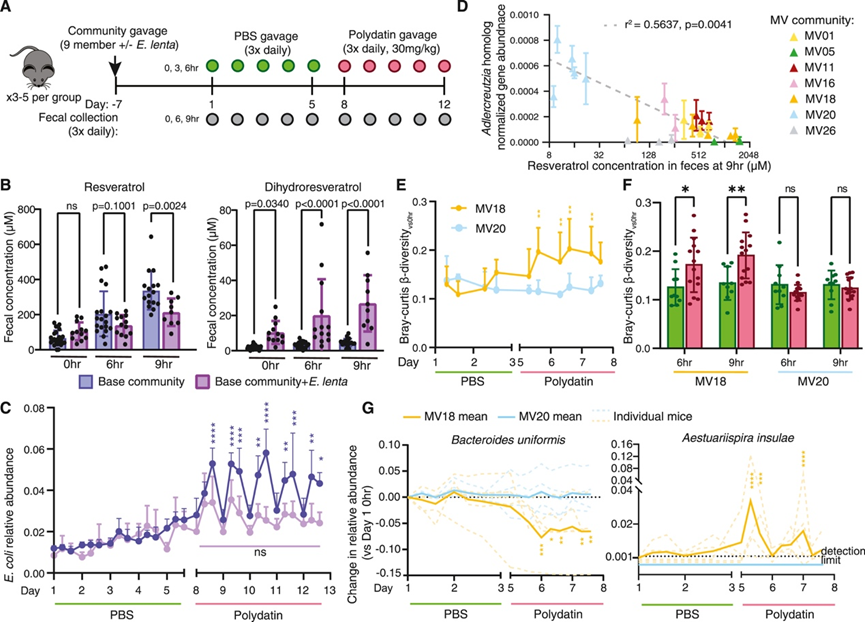
图7. 肠道微生物对白藜芦醇的代谢决定了白藜芦醇在体内对群落的重塑。
(A-C) 在无菌小鼠中,白藜芦醇苷重塑了细菌群落。(D) 白藜芦醇还原酶基因丰度与白藜芦醇代谢之间的关系。(E-G) 虎杖苷对 MV18 或 MV20 定植的离菌小鼠微生物组的影响。
+ + + + + + + + + + +
结 论
本项研究绘制了约 150 种小分子膳食异生物质与肠道微生物之间的相互作用,包括这些化合物对群落组成的影响、人类肠道微生物对膳食异生物质的代谢活动以及这些特征的个体间差异。微生物代谢可以毒化和解毒这些化合物,产生新兴的相互作用,解释膳食异生物质对群落特定重塑的影响。本项研究确定了负责解毒一种膳食异生物质白藜芦醇的基因和酶,并证明这种酶有助于白藜芦醇对群落重塑的个体间差异。总之,这些结果系统地绘制了膳食异生物质与肠道微生物之间的相互作用,并将毒化和解毒与微生物群对饮食反应的个体差异联系起来。
+ + + + +



 English
English


