文献解读|Cell Host Microbe(20.6):抗生素引起的肠道微生物群扰动会改变对狂犬病疫苗的免疫反应
✦ +
+
论文ID
原名:Antibiotic-induced gut microbiome perturbation alters the immune responses to the rabies vaccine
译名:抗生素引起的肠道微生物群扰动会改变对狂犬病疫苗的免疫反应
期刊:Cell Host & Microbe
影响因子:20.6
发表时间:2025.04.15
DOI号:10.1016/j.chom.2025.03.015
背 景
目前,疫苗接种每年可挽救350万至500万人的生命,使其成为医学史上最伟大的成就之一。然而,疫苗接种引起的免疫反应在个体之间以及全球不同人群之间可能存在很大差异。了解这种差异的根本原因对于改善全球健康至关重要。虽然包括宿主遗传和环境影响在内的许多因素都可能导致这些差异,但新兴证据强调了肠道微生物群在塑造免疫系统对疫苗的反应方面发挥的重要作用。目前的大部分证据来自小鼠研究,关于微生物组对人体免疫力影响的直接证据有限。然而,最近针对接受广谱抗生素治疗的人群的研究提供了确凿证据,并更清晰地揭示了肠道细菌如何影响人类的疫苗反应。
实验设计
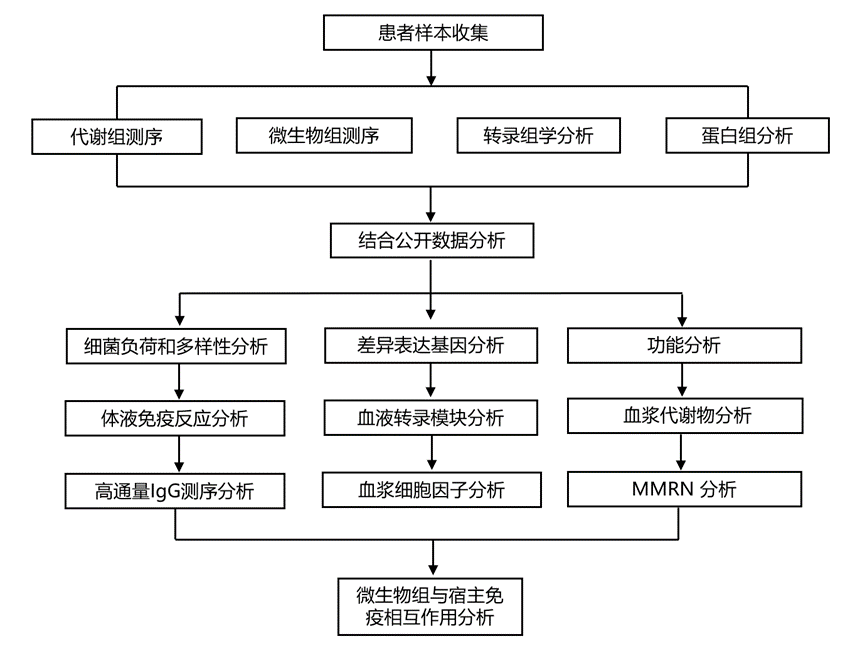
结 果
01
抗生素的使用导致肠道微生物群的细菌负荷和多样性降低
本研究共纳入18名参与者入组,在第0天和第28天接受两剂狂犬病疫苗接种(图1 A)。9名参与者随机分配,从第-3天开始接受为期5天的抗生素治疗(指定为Abx组,颜色:红色),其余参与者作为对照组(指定为No-Abx组,颜色:蓝色)。
为了广泛消耗宿主微生物群,研究团队使用了广谱抗生素方案,包括万古霉素、甲硝唑和新霉素。首先,他们检测了血浆中的抗生素代谢物。由于全身吸收不良,万古霉素和新霉素在血浆中检测不到。一名参与者未检测到甲硝唑,因此排除在后续分析之外,以提高研究质量和研究组依从性的清晰度。然后,他们评估了抗生素的使用如何影响肠道微生物群。在接种疫苗当天,观察到接受抗生素的参与者每克粪便中的细菌细胞数量减少了 100 倍以上(图 1 B)。在第 1 天,即抗生素治疗的最后一天,接受抗生素治疗的组的总细菌含量降至最低点。然后,在接下来的几天里慢慢恢复到基线水平,并在第 7 至 30 天之间达到基线水平(图 1 B)。正如预期的那样,对照组的细菌负荷没有发生显著变化。
肠道细菌的消耗也导致共生细菌组成相对丰度发生显著变化(图 1 C)。在第 0、1 和 3 天,低丰度分类单元肠杆菌科和链球菌科在接受抗生素治疗的参与者的肠道菌群中占主导地位,这与之前的研究结果一致。到第 7 天,8 名参与者中有 7 名的肠杆菌科丰度仍然很高,在接下来的 180 天内,最常见细菌成分的丰度恢复到抗生素治疗前的水平(图 1 C)。
优势物种和稀有物种都对共生多样性有所贡献。为了评估多样性的变化,他们分析了群落丰富度(观察到的物种或操作分类单位)和香农指数(用于表示 alpha 多样性)以及布雷-柯蒂斯差异性(用于表示 beta 多样性)。对稀有物种变化敏感的观察到的物种和香农指数都在抗生素治疗的最后一天达到最低点,并且显著低于对照组参与者(图 1D)。这些变化持续长达 90 天和长达 180 天,表明细菌物种,尤其是稀有物种,在抗生素治疗后很长时间内仍然不存在于肠道中(图 1D)。他们进一步使用主坐标分析 (PCoA) 可视化了个体微生物群落之间的布雷-柯蒂斯差异。Abx 组和非 Abx 组的微生物群落在第 0 天(接种疫苗当天和抗生素治疗的第四天)出现分化,在第 1 天达到峰值,并在接下来的 6 个月内逐渐趋同(图 1 E),这与 alpha 多样性指标和之前的研究一致。
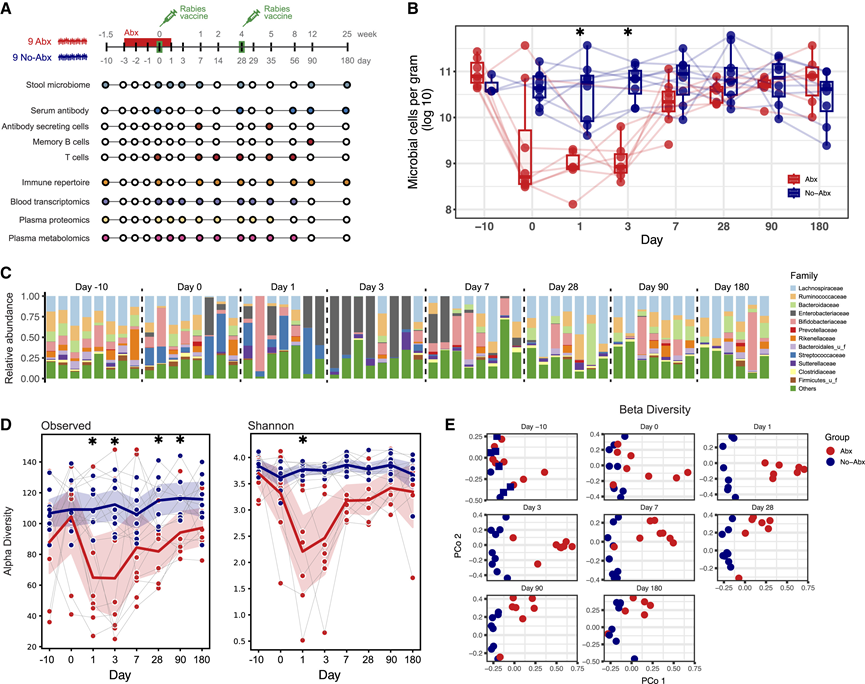
图1. 抗生素治疗可降低肠道微生物组的细菌数量和多样性。
(A)研究设计概述及方法。(B) 每克粪便的绝对微生物细胞计数。(C) 抗生素治疗组中细菌家族的相对丰度随时间的变化。(D) 多样性指数。(E) β多样性估计值。
02
抗生素的使用会削弱狂犬病疫苗的体液免疫反应
接下来,他们探究了肠道菌群显著且持久的变化如何影响狂犬病疫苗的抗体反应。之前的研究表明,抗生素导致的肠道菌群耗竭对流感疫苗抗体反应的影响很大程度上取决于先前存在的免疫力。本研究的参与者之前未接触过狂犬病疫苗或感染,这使他们能够评估抗生素对疫苗接种后原发免疫反应的影响。
在基线时,所有参与者均未感染过狂犬病,但在初次接种疫苗后产生了狂犬病特异性免疫球蛋白 G (IgG) 抗体,并且在二次免疫后这些抗体水平进一步升高(图 2 A)。值得注意的是,抗生素治疗显著降低了初次狂犬病特异性 IgG 反应(p < 0.01),与第 28 天的对照组相比降低了约 5.9 倍。这种抗体反应降低在第二次免疫后仍然持续存在,并且最多持续 180 天(图 2 A)。他们通过快速荧光灶抑制试验 (RFFIT) 检测了狂犬病毒中和抗体。值得注意的是,狂犬病特异性总 IgG 滴度与中和抗体密切相关(图 2 B)。根据世界卫生组织的指导方针将保护性血清转化定义为每毫升 0.5 国际单位 (IU/mL),并发现 Abx 组中更多的参与者在第 28 天和第 180 天表现出非保护性中和抗体水平(图 2C),这表明总 IgG 反应受损导致中和抗体水平降低。接下来,他们确定了每次免疫后新鲜分离的外周血单核细胞 (PBMC) 中狂犬病特异性浆母细胞的频率。在对照组中,第一剂疫苗在第 7 天未引发可检测到的浆母细胞反应(图 2D),这与研究结果一致,表明灭活狂犬病疫苗的免疫原性较弱,并且在初次接种后第 7 天的初次免疫反应中浆母细胞反应通常较低。然而,第二剂导致浆母细胞反应显著增加。令人惊讶的是,在接受抗生素的参与者中,这种浆母细胞反应受到严重抑制(图 2D)。他们还检测了狂犬病特异性记忆B细胞反应。第90天,Abx组和No-Abx组狂犬病特异性记忆B细胞的频率没有显著差异。
高通量免疫球蛋白基因 ( Ig ) 测序可以分析 Ig 库,捕捉克隆进化的特征,例如感染或疫苗接种后体液反应中的 SHM 和类别转换重组。他们通过免疫球蛋白测序评估了狂犬病疫苗接种前后免疫球蛋白库的动力学。如预期的那样,类别转换的免疫球蛋白同型(IGHG1、IGHG2、IGHG3、IGHA1和IGHA2)表现出的 SHM 远高于未转换的免疫球蛋白同型 (IGHM 和IGHD),分别反映成熟和幼稚的 B 细胞表型(图 2 E)。他们检测到的IGHE和IGHG4基因不足,因为它们在免疫球蛋白库中的比例很低。与抗生素组相比,对照组中低突变类型转换的IGHG克隆出现率更高(图 2 E)。值得注意的是,在第 28 天和第 35 天,抗生素治疗个体中免疫球蛋白重链可变区 (IGHV) 基因中含有低和无 SHM(<1%)的 IgG B 细胞受体同种型(IGHG1、IGHG2和IGHG3)的比例明显低于对照组,这表明受到刺激并转换为这些同种型的幼稚 B 细胞克隆更少(图 2 F)。有趣的是,抗生素组似乎有更多高突变的IGHM和IGHD克隆(图 2 E)。他们进一步通过 ELISA 检测了狂犬病 IgM 抗体,发现接受抗生素治疗的受试者在第 28、35 和 56 天的 IgM 水平出现统计学上不显著的升高。两组中IGHA区室的免疫球蛋白库变化均较小,低突变IGHA克隆的出现情况相似(图 2 E)。

图2. 接受或未接受抗生素治疗的成人对狂犬病疫苗的体液反应。
(A) 用 ELISA 法测定血浆中狂犬病特异性 IgG 的滴度。(B) 总 IgG 与中和抗体之间的 Pearson 相关性。(C) 饼图显示各组第28天和第180天的保护率。(D) 每次疫苗接种后第7天,每百万PBMC中狂犬病特异性IgG分泌细胞的数量。(E) 接受或未接受抗生素治疗的代表性参与者的免疫球蛋白库。(F) 各时间点各亚型未突变(<1% SHM)B 细胞谱系的比例,按抗生素治疗状态分组。
03
抗生素给药调节对狂犬病初次疫苗接种的血液转录反应
为了确定抗生素对转录反应的大小和动力学的影响,他们对接种疫苗前后收集的血液样本进行了转录组分析 (RNA-seq)(图 3 A)。首先确定了每组中指定日期的差异表达基因 (DEG),相对于参与者在抗生素治疗和接种疫苗之前的自身基线时间点。在第 1、14 和 29 天(第二次接种疫苗后 1 天)出现了三个转录反应峰。这些反应分别对应于初次接种疫苗后的先天反应和 T 细胞反应以及二次接种疫苗后的先天反应(图 3 B)。接受和未接受抗生素治疗的参与者的 DEG 大小和动力学相似(图 3 B)。
为了探索抗生素治疗是否会在狂犬病疫苗接种反应中诱导独特的转录特征,他们使用先前描述的计算方法计算了相对于初次接种后第 0 天和二次接种后第 28 天的归一化富集得分 (NES),从而确定了差异表达的血液转录模块 (BTM)。与干扰素(IFN)/抗病毒感应相关的模块在两组中均在初次和二次接种后 1 天发生显著高表达(图3C),但这些反应迅速减弱。值得注意的是,与抗原呈递、炎症/TLR/趋化因子、单核细胞和树突状细胞 (DC) 活化相关的模块在初次接种后发生激活。有趣的是,与炎症/TLR/趋化因子和单核细胞相关的模块(图3C)在第 3 天在 Abx 组中仍然上调。到第 7 天,所有参与者都出现了与细胞周期相关的特征,表明适应性免疫反应的开始(图 3C)。在初次接种疫苗后的第 7 天和第 14 天,Abx 组和对照组的 T 细胞增殖和活化相关 BTM 的诱导存在差异(图 3C)。有趣的是,先天免疫特征在疫苗接种 2 周后仍然突出,并且在接受抗生素治疗的个体中,一些 T 细胞活化模块在第 14 天发生选择性激活(图 3C)。巧合的是,在接受抗生素治疗的参与者中,“先天”模块(例如 IFN/抗病毒感应 BTM 亚组中的 CXCL-10 基因相关 M75)的第二轮激活重新出现,并在第 14 天优先富集(图 3C)。
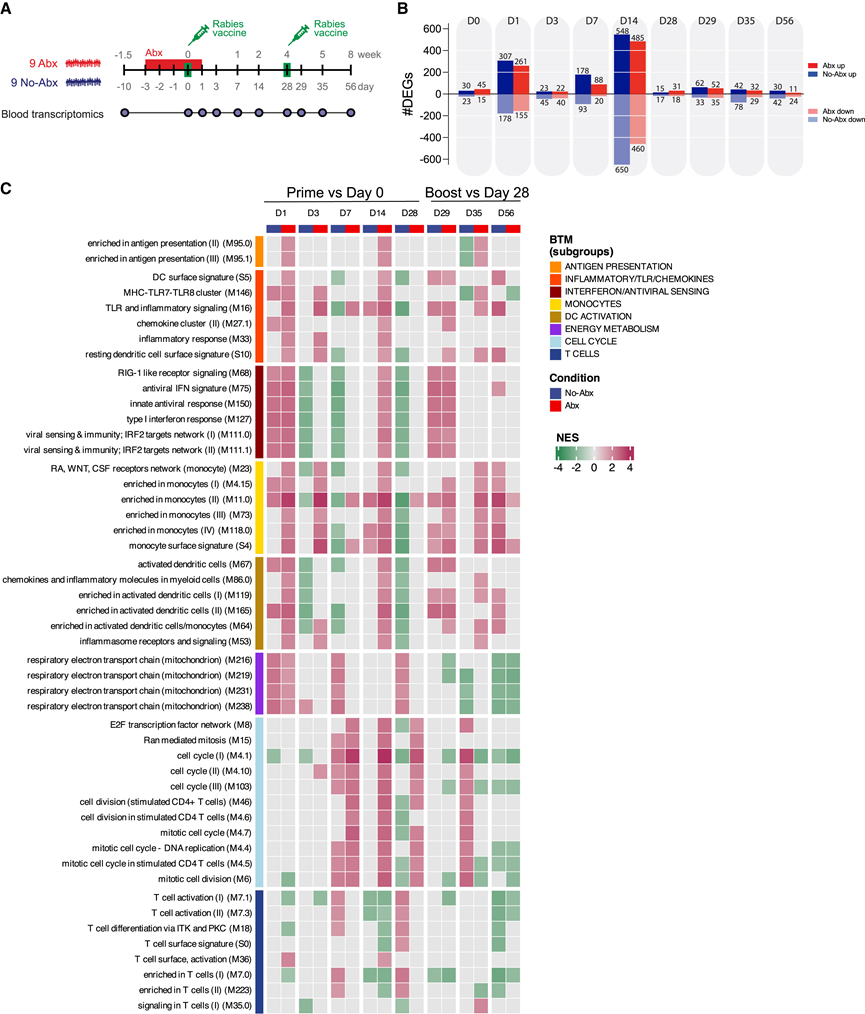
图3. 接受或未接受抗生素治疗的成年人对狂犬病疫苗的血液转录反应。
(A) 实验布局概览。(B) 对于筛选时间点(第-10 天)的第 0、1、3、7、14、28、29、35 和 56 天的DEG 数量。(C) 对照组和抗生素治疗组受试者的血液转录模块 (BTM) 显著富集。
04
抗生素治疗导致狂犬病疫苗特异性 Th1/cTfh 比例失衡
T 细胞应答,尤其是 T 辅助细胞 1 (Th1) 应答,对于狂犬病毒的保护性免疫至关重要。他们接下来收集了来自所有参与者的 158 份纵向血浆样本,进行了蛋白质组学和离体功能分析来(图 4 A)。在第 1 天和第29 天的初次和二次狂犬病疫苗接种后,CXC 基序趋化因子配体 10 (CXCL-10) 和 IFN-γ 的血浆循环水平均显著增加(图 4 B)。值得注意的是,IFN-γ 的上调在第 29 天显著增强,这与最近对其他病毒疫苗的发现一致。进一步分析发现,与对照组相比,抗生素治疗组参与者在第14天时IFN-γ和CXCL-9(调节Th1极化和活化的关键趋化因子和细胞因子)的差异倍数相对于第-10天时显著升高(图4 C),而CXCL-10则没有显著差异(图S4 C)。这一观察结果与转录反应的动力学一致,强烈提示抗生素治疗组对狂犬病疫苗接种的反应偏向Th1。
Th1 细胞促进细胞介导的局部炎症或感染应答,而 Tfh 细胞是体液免疫应答的关键调节者。Tfh 细胞和 Th1 细胞拥有共同的前体阶段。然而,Tfh 细胞和 Th1 细胞的分化路径有所重叠,CD4+ T 细胞会选择其中一种命运,而牺牲另一种。他们假设,抗生素治疗组受试者 Th1 细胞应答的上调与 Tfh 细胞频率的降低会处于一种平衡状态。为了验证这一点,他们用疫苗对 PBMC进行体外刺激,并结合细胞因子胞内染色 (ICS) 检测和活化诱导标志物 (AIM) 检测来测量 Tfh 和 Th1 细胞应答。通过检测CD40L + CD4 + T 细胞分泌的白细胞介素2 (IL-2)、IFN-γ、肿瘤坏死因子 α (TNF-α)、IL-4 和 IL-21 以及 OX40 + CD137 + CD4 + T 细胞、OX40 + CD40L + CD4 + T 细胞和 CXCR5 + OX40 + CD40L + CD4 + T 细胞的频率来评估狂犬病特异性CD4 + T细胞反应。值得注意的是,在初次接种疫苗后第 14 天,接受抗生素治疗的参与者中狂犬病特异性 IFN-γ 分泌 CD4 + T 细胞的频率明显较高(图 4 D)。然而,IL-2、TNF-α、IL-4 和 IL-21 分泌 CD4 + T 细胞的频率和动力学与对照参与者相当。值得注意的是,对照组参与者的狂犬病特异性T滤泡细胞 (cTfh) 频率略高,而抗生素治疗组参与者的狂犬病特异性IFN-γ分泌CD4 + T细胞与狂犬病特异性cTfh细胞的比例较高(图4 E)。事实上,他们观察到第28天的IgG滴度与第14天的Th1/cTfh比例之间存在很强的相关性(图4 F)。这支持了以下假设:抗生素治疗组对狂犬病疫苗接种的T细胞应答偏向Th1表型。这些发现表明,抗生素治疗后早期先天激活和炎症的调节会导致平衡偏向Th1细胞生成,并降低Tfh应答,从而导致对初次疫苗接种的抗体应答减弱。
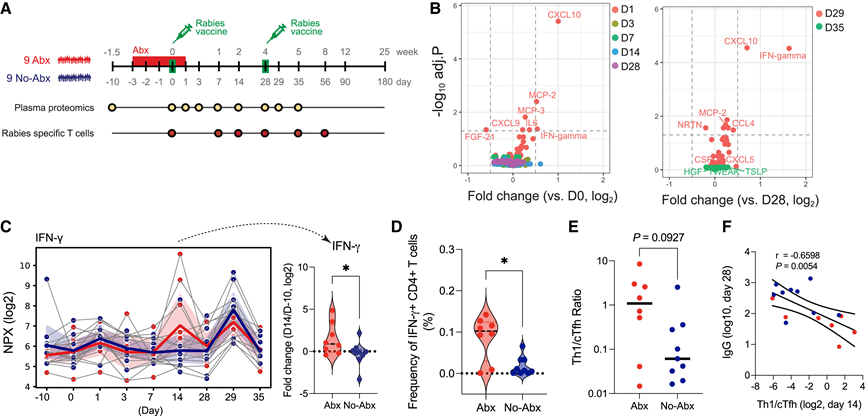
图4. 接受或未接受抗生素治疗的成年人对狂犬病疫苗接种的血液细胞因子和 T 细胞反应。
(A) 实验布局概览。(B) 火山图显示初次和二次疫苗接种后显著表达的血浆细胞因子。(C) 用 Olink 测量血浆 IFN-γ 水平。(D) 第14天采集的血液样本中,在狂犬病病毒刺激下,分泌IFN-γ的CD4 + T细胞占总CD4+ T细胞的比例。(E) 第14天采集的血液样本中,狂犬病特异性IFN-γ分泌CD4 + T细胞与狂犬病特异性循环Tfh细胞的比例。(F) 图(E)中Th1/cTfh比值与接种后第28天ELISA测定的IgG滴度倒数的散点图。
05
抗生素的使用会改变血液代谢
代谢是调节免疫细胞功能的核心过程,而疫苗接种已证明可以调节循环代谢物的水平。他们对在第 -10、0、1、3、7、14、28、29、35 和 56 天收集的 176 个血浆样本进行了代谢组分析(图5 A)。总的来说,在这个队列的所有血浆样本中鉴定了 1186 种代谢物,这些代谢物可分为与氨基酸代谢相关的类别(17.37%)、碳水化合物(1.94%)、辅因子和维生素(3.04%)、能量(1.01%)、脂质(34.82%)、核苷酸(2.70%)、肽(2.45%)、外来化合物(16.19%)和其他部分表征(1.77%)和未知分子(18.72%)(图 5 A)。在抗生素治疗组的血浆样本中检测到了甲硝唑,其浓度在第0天和第1天达到峰值,并在第7天发生清除(图5B)。研究人员观察到参与者之间甲硝唑浓度和动力学的差异,这反映了人体代谢的异质性,并部分解释了抗生素导致的肠道菌群耗竭的差异(图5B)。正如预期的那样,由于全身吸收率低,万古霉素和新霉素在血液中未检测到。
单独接种狂犬病疫苗对血浆中代谢物的量级没有显著影响,这由差异丰度随时间的边际变化所证明(图 5C)。有趣的是,抗生素治疗加上初次接种疫苗对代谢物差异丰度的量级和动力学都有显著影响(图 5C)。他们对两组从 -10 天到 14 天的差异丰度代谢物峰的差异倍数值(p < 0.01)进行了轨迹主成分分析 (PCA),发现接受抗生素治疗的参与者相对于对照组表现出显著改变的代谢轨迹(图 5D)。
为了进一步了解亚途径和超途径水平的代谢组变化,他们基于代谢物的特征注释表进行了富集分析,确定了与氨基酸、辅因子和维生素、脂质、能量、碳水化合物、核苷酸、肽、外来化合物和其他尚未完全表征的特征相关的代谢通路。氨基酸和脂质超途径受抗生素治疗的影响最大。在抗生素治疗后的前 2 周内,与脂肪酸代谢相关的酰基肉碱化合物增加,而酰基胆碱化合物减少(图 5 E)。例如,3-甲基戊二酰肉碱(3MG)(一种酰基肉碱化合物,已报道为线粒体功能障碍的生物标志物)的血浆浓度在抗生素治疗组较高。他们还观察到抗生素治疗后与色氨酸代谢和次级胆汁酸代谢相关的代谢通路减少(图 5 E)。
使用液相色谱-质谱 (LC-MS),他们证实了次级胆汁酸,特别是脱氧胆酸 (DCA)、甘氨脱氧胆酸 (GDCA)、石胆酸 (LCA) 和甘氨石胆酸 (GLCA),在接种疫苗后第一周内降低(图 5 F),而初级胆汁酸不受影响(图 5 G)。次级胆汁酸水平降低通过 TGR5-cAMP-PKA 轴和通过调节 Th17 和调节性 T (Treg) 细胞的平衡导致炎症水平增加。与此一致,他们观察到接受抗生素治疗的个体 PBMCs 中 Th17 细胞的频率更高。总之,这些数据表明抗生素治疗扰乱了血液代谢组,特别是氨基酸和脂质代谢。

图5. 接受或未接受抗生素治疗的成年人对狂犬病疫苗接种的血液代谢反应。
(A) 实验布局概述和整个研究过程中测量的血浆中代谢物的组成。(B) 抗生素治疗组所有参与者的甲硝唑动力学。(C) 血浆中差异代谢物的数量。(D) 代谢轨迹表示 研究过程中所有差异特征代谢物丰度的变化,并投射到主成分空间。(E) 代谢物特征的通路富集分析。(F) 相对于筛选时间点(第 -10 天),第 0-7 天各组所有参与者中每种次级胆汁酸的平均差异倍数。(G) 相对于筛选时间点(第 -10 天),第 0-7 天各组所有参与者中每种初级胆汁酸的平均差异倍数。
06
MMRN 分析揭示了控制微生物组与宿主免疫相互作用的调控中心
为了进一步探索抗生素驱动的肠道微生物组变化与血液转录组和代谢组之间的关系,并研究这些变化如何影响疫苗接种后的免疫反应,他们构建了多尺度、多因素响应网络 (MMRN) 分析,将每个细菌群落中第 0 天与筛选变化之间的关联可视化(图 6 A)。除其他联系外,还观察到含有激活蛋白 1 (AP-1) 和核受体超家族 4A (NR4A) 信号转录模块的基因群落 GN9 与含有许多次级胆汁酸的代谢群落 MT9 之间的关联,这与之前的观察结果一致。
为了研究在接受抗生素治疗的参与者中观察到的狂犬病疫苗接种后 T 细胞反应偏差和抗体产生受损的潜在分子机制,他们接下来通过将所有特征与第 0 天与筛选时的细菌负荷变化、第 14 天 Th1/cTfh 比率和第 28 天抗狂犬病 IgG 滴度相关联来“分析”该网络,并进行富集测试以识别富含与细菌负荷和/或免疫读数高度相关的特征的群落。有趣的是,含有许多炎症信号和 DC 激活模块的 GN3(图 6B)与 Th1/cTfh 比率表现出最强的关联(图 6A),这表明抗生素治疗引起的炎症状态可能使疫苗诱导的 T 细胞启动过程向 Th1 表型转化,导致生发中心的 T 细胞辅助(例如 Tfh)无效以及抗体反应受损。然而,这并不排除肠道菌群可能通过其他免疫途径调节抗体反应,而这些通路与GN3和Th1偏向无关。与GN3相关的群落包括代谢物群落MT4和MT1,它们含有许多脂质分子,尤其是脂肪酸(图6C),已知这些分子在炎症信号传导中发挥重要作用。
GN10 是少数几个特征显著富集的群落之一,这些特征与 Th1/cTfh 比率呈正相关,而与抗体反应呈负相关,GN10 由参与能量代谢的转录模块组成,包括电子传递链和核苷酸合成,以及细胞分裂过程(图 6B)。该群落还与几个代谢物群落密切相关,包括含有多种氨基酸及其衍生物的 MT0(图 6C)和含脂质的群落 MT4,这两个群落都与抗生素驱动的整体细菌负荷变化显著相关。这些发现提出了这样一种可能性,即 T 细胞极化失调和随后的抗体反应受损也可能部分是免疫细胞代谢改变的结果,可能在抗原呈递细胞内或 T 细胞本身内,这是由于关键微生物组调节的代谢物的可用性发生变化造成的。
就观察到的表型的潜在微生物驱动因素而言,细菌群落 BC8 不仅与炎症/DC 激活模块 GN3 表现出显著关联,而且与 D14 Th1/cTfh 比率和 D28 抗体反应也表现出显著关联。BC8 以芽孢杆菌为主(图 6 D),包括多种链球菌。研究表明,几种链球菌菌株在与人类树突状细胞 (DC) 一起培养时可诱导强效 IL-12 反应,IL-12 是 Th1 极化的关键介质。链球菌科在抗生素治疗后相对丰度增加(图 1 C),因此它们的存在可能导致先天细胞反应发生改变,并随后引发 T 细胞启动。

图6.多尺度、多因素响应网络。
(A) MMRN 中第 0 天与筛选连接的子网络可视化,包含与不同生物学测量相关的节点。(B) 转录组群落 GN3 和 GN10 内的 BTM 亚群分布(%)。(C) 代谢组群落 MT1、MT4 和 MT0 内的代谢超路径分布(%)。(D) 微生物群落内的类别分布 BC8 (%)。
+ + + + + + + + + + +
结 论
本研究采用系统生物学方法分析了抗生素给药对人类狂犬病疫苗初次和继发性免疫应答的影响。抗生素给药降低了肠道细菌负荷,并导致共生菌多样性的长期降低。这种改变与狂犬病特异性体液应答降低有关。多组学分析显示,抗生素给药诱导了 (1) 疫苗接种后早期促炎特征增强,(2) 疫苗特异性辅助性 T 细胞 1 (Th1) 和滤泡辅助性 T 细胞应答的平衡向 Th1 表型转变,以及 (3) 代谢物的显著变化,尤其是血液中的次级胆汁酸。通过整合多组学数据集,本研究生成了一个多尺度、多响应网络,揭示了关键的调控节点,包括微生物群、次级胆汁酸和体液免疫。
+ + + + +



 English
English


