文献解读|Nature(50.5):空间蛋白质组学发现 JAKi 可治疗致命皮肤病
✦ +
+
论文ID
原名:Spatial proteomics identifies JAKi as treatment for a lethal skin disease
译名:空间蛋白质组学发现 JAKi 可治疗致命皮肤病
期刊:Nature
影响因子:50.5
发表时间:2024.10.16
DOI号:10.1038/s41586-024-08061-0
背 景
中毒性表皮坏死松解症(TEN) 是一种由常用药物引发的致命药物性皮肤反应,是一个新出现的公共卫生问题。患有 TEN的患者会因角质形成细胞死亡而出现严重且突然的表皮脱落。尽管已经提出了导致角质形成细胞死亡的分子机制,但主要驱动因素仍然未知,而且目前尚无针对 TEN 的有效治疗方法。
实验设计
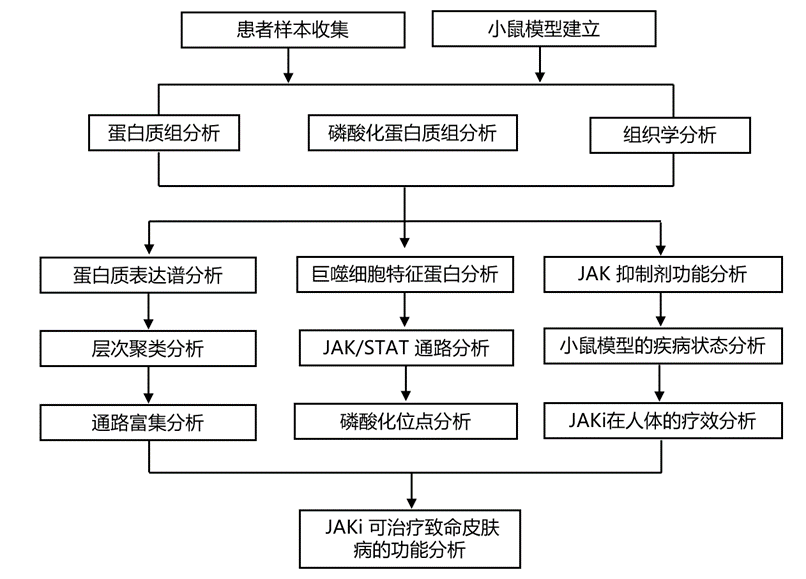
结 果
01
病变角质形成细胞的蛋白质组分析
研究团队对轻度(MPR)和重度(TEN 或 DRESS)皮肤药物不良反应 (CADR) 患者以及健康个体的一组回顾性病变 FFPE 皮肤活检样本进行了深度视觉蛋白质组学( DVP)分析(图1a)。他们对福尔马林固定石蜡包埋 (FFPE)组织切片进行 CD45 +免疫细胞和全细胞角蛋白角质形成细胞染色,然后进行基于机器学习的细胞分割。对于每个个体,在肽提取和获取质谱数据之前,对每种细胞类型的轮廓进行激光显微切割并分别组合以保持患者和细胞类型的特异性(图1a)。这在所有参与者的每种细胞类型中鉴定出约 5000 种独特蛋白质,角质形成细胞和免疫细胞具有不同的特征。
为了确定疾病和细胞类型特异性的分子机制,他们首先分析了 CADR 中病变角质形成细胞的蛋白质表达谱(图1b)。角质形成细胞蛋白质组根据药物反应类型聚类,主成分 1(PC1)将 TEN 与其他 CADR 和健康个体区分开来(图1c)。PC1 与参与钙稳态和细胞应激反应的蛋白质(HSPA5、TMCO1 和 ATP2A2)(图1d)密切相关。值得注意的是,STAT3 是分离的主要驱动因素,以及主要的干扰素特征(图1d-e)。与健康个体的细胞相比,差异表达蛋白质(DEP)的数量随着 CADR 的严重程度而增加。DRESS 角质形成细胞表达的主要组织相容性复合体 I 类蛋白 TAP1、TAP2、TAPBP 和 HLA-A 的量是正常人的两倍多,表明角质形成细胞积极参与罪犯药物相关抗原呈递。在 TEN 患者角质形成细胞中,许多受显著调节的蛋白质都参与了抗菌反应,例如溶菌酶和丛集素(图1f)。WARS1 是最强的上调蛋白质之一,受炎症信号(尤其是 IFNγ 28)强烈诱导,与 TEN 无关。TEN 角质形成细胞中的超氧化物歧化酶 1(SOD1)水平降低了一半,这可能会加剧氧化应激级联反应,而已知氧化应激级联会上调角质形成细胞的 Fas 配体表达,Fas 配体是一种关键的细胞溶解分子,参与 TEN 中的角质形成细胞凋亡和表皮脱离。
为了识别与特定 CADR 独特相关的角质形成细胞蛋白质特征,他们检测了 DEP 的层次聚类,结果显示 TEN 在三个不同的蛋白质聚类中明显分离(图1g)。TEN 聚类 1 富含参与调节补体活化和血液凝固的通路(图1h)。因此,几乎所有补体因子在 TEN 的角质形成细胞中都独特地上调,它们的存在可能反映了 TEN 中角质形成细胞死亡的程度(图1i)。因此,来自 DRESS 和 TEN 的角质形成细胞蛋白质组揭示了不同的疾病相关蛋白质表达特征。
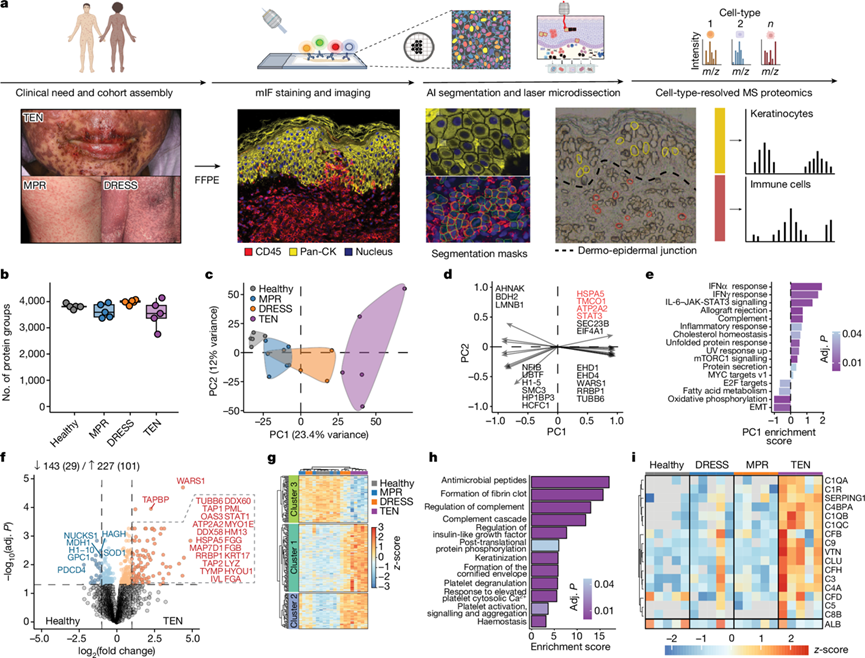
图1. 皮肤药物反应中角质形成细胞的 DVP 工作流程和细胞类型特异性蛋白质组。
(a)上:蛋白质组工作流程。下:每个步骤的代表性图像。(b) 不同队列中角质形成细胞中鉴定出的蛋白质数量。(c) 主成分分析。(d) PC1–PC2 分离的主要驱动因素。(e) PC1 的基因集富集分析(GSEA)。(f) TEN和健康角质形成细胞中蛋白质的差异表达。(g) 通过 ANOVA 对显著蛋白质进行层次聚类。(h) ANOVA 聚类 1 的过度表达分析。(i) 指示条件下补体因子的半监督热图。
02
病变免疫细胞的蛋白质组
不同 CADR 之间的皮肤免疫细胞浸润模式有显著差异。为了了解免疫细胞中潜在的分子差异,他们评估了它们的蛋白质组(图S2a-l)。按疾病表型将它们聚类,但与角质形成细胞相反,PC1 将 DRESS 与其他 CADR 区分开来(图2a,图S2m)。它与 E2F 和 MYC 的靶标显著相关,表明处于高度增殖状态(图S2o)。PC1 和 PC3 共同揭示了 DRESS 和 TEN 独有的特征。在 DRESS 中,多种病毒通路发生富集,与其发病机制中的病毒再激活一致(图2b)。相比之下,TEN 具有以 STAT1 为主要驱动因素的显性干扰素特征(图2b,图S2n)。与健康免疫细胞相比,DRESS中差异表达蛋白( DEP) 数量最多,其次是 TEN 和 MPR(图2c-e,图S2p)。很少有蛋白质是特定 CADR 亚群所特有的。其中一种蛋白质是组蛋白甲基化酶 EZH2,它仅在 DRESS 患者的免疫细胞中可检测到(图2f,图S2r-s)。在与特定 CADR 相关的蛋白质中,颗粒酶 B 是 TEN 中细胞毒性的关键介质,然而,在无细胞毒性的DRESS中,其含量相似(图2f)。
对所有队列中免疫细胞中的 DEP 进行无监督层次聚类分析,显示出三个不同的蛋白质聚类(图2g)。聚类 2 主要代表 DRESS,与DNA 复制过程有关,突显了该疾病中浸润免疫细胞的增殖性质(图S2t)。其最突出的通路(响应复制压力而激活 ATR)主要由 DNA 复制因子 RFC 和 MCM 主导,这与 DRESS 32的病毒发病机制之间存在潜在联系(图S2u)。值得注意的是,聚类1 包含主要与 I 型和 II 型干扰素信号传导相关的蛋白质(图2h)。这些蛋白在 TEN 中明显过表达,但在 MPR 和 DRESS 中表达仅略有增加(图2g)。
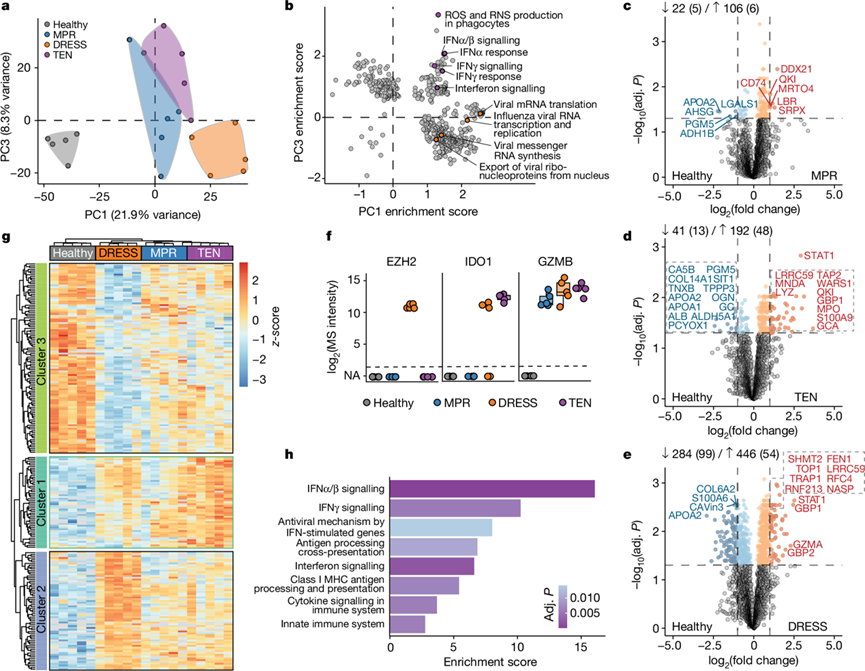
图2. 病变免疫细胞的细胞类型特异性蛋白质组。
(a) 主成分分析。(b) PC1和 PC3 中存在的基因集富集得分的散点图。(c-e) 健康细胞与 MPR、TEN 或 DRESS免疫细胞之间的 DEP。 (f) 在不同队列中具有不同强度的选定蛋白质。(g) 通过方差分析对显著蛋白质进行层次聚类。(h) ANOVA 聚类 1 的过度表达分析 (Reactome),按富集分数排序。

图S2. 角质形成细胞和免疫细胞蛋白质组。
(a-c) 角化细胞蛋白质组的中位蛋白质强度、每个蛋白质的数据完整性和每个队列的变异系数(CV)。 (d) MPR/DRESS/TEN患者与健康人角质形成细胞差异表达蛋白(DEP)的数量。(e) DRESS与健康人角质形成细胞中的DEP。(f-g) 方差分析聚类2和聚类3的过度代表性分析,按富集分数排序。(h) 免疫细胞中补体因子的半监督热图。(i) 在不同人群的免疫细胞中发现的蛋白质数量。(j-l) 免疫细胞蛋白质组的中位蛋白质强度、每个蛋白质的数据完整性和每个队列的CV。(m-o) 主成分分析,对免疫细胞的 PC1/3有贡献的前 20 种蛋白质和 PC1 基因集富集分析(MSigDB Hallmark),按富集分数排序。(p) 与健康相比,所示条件下的 DEP 。(q) 特定于每种所示条件的唯一识别蛋白质的翻转图。(r) 散点图显示了 DRESS 的 PBMC 淋巴细胞聚类变化和患病样本与健康样本的细胞表达比率。(s) 皮肤组织切片中 EZH2、CD45 和泛细胞角蛋白染色的代表性组织学图。(t-u) 按富集分数和“响应复制压力而激活 ATR” 的富集蛋白的半监督热图排序。
03
TEN 中巨噬细胞显著参与病变过程
他们利用带有参考通道的多路复用数据独立采集 (mDIA) 工作流程和用于 DVP 工作流程的新型 Astral 质量分析仪进行进一步的研究,着重对 TEN 和 SJS-TEN 重叠患者皮肤中浸润的 CD163+ 巨噬细胞、CD4+ T 辅助细胞和 CD8+ 细胞毒性 T 细胞进行蛋白质组学研究(图3a-c)。巨噬细胞中与干扰素途径相关的蛋白质表达最高,这可能反映了 IFNγ 受体的更高表达(图3d)。尤其是干扰素信号传导介质STAT1的含量在巨噬细胞中始终高于来自同一个体的CD4 +和CD8 + T细胞(图3e)。与细胞毒性T细胞相比,巨噬细胞表现出髓系特异性谱系标志物(MNDA和MRC1)和干扰素驱动蛋白(STAT1和GBP5)的显著富集(图3f)。接下来,他们研究了同一活检样本中每种类型和患者仅 20 个细胞的脱落(水疱顶)和附着(水疱侧)角质形成细胞之间的空间差异(图3g-h)。在三个不同的聚类中,最大的聚类包含补体系统和炎症(图3i)。这些蛋白质在 TEN 的附着和脱落角质形成细胞中均上调,表明驱动 TEN 的炎症通路在水疱皮肤附近的角质形成细胞中已经活跃。几种蛋白质从健康角质形成细胞到附着角质形成细胞再到脱落角质形成细胞呈线性关系。附着角质形成细胞和脱落角质形成细胞之间的蛋白质组学差异很细微,但足以根据空间位置将它们与健康角质形成细胞区分开来(图3j)。这种分离再次由补体和炎症级联蛋白(包括 MX1、C3、KRT6 和 KRT16 等)(图3k-m)驱动。此外,五种蛋白质与附着细胞和分离细胞相关,可能代表分离前的早期蛋白质组学变化(图3k-m)。
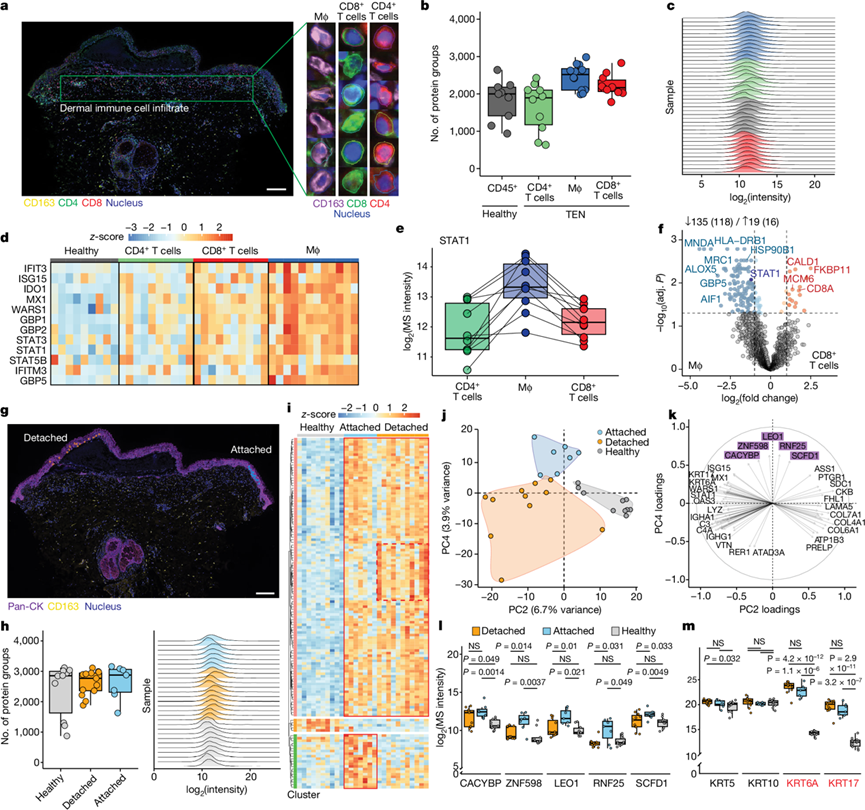
图3. TEN 中免疫细胞亚型的空间蛋白质组学分析。
(a) 左:TEN 的免疫荧光图像,其中有分割的 CD163+巨噬细胞、CD4 +和 CD8 + T 细胞。右:代表性单细胞图像和分割轮廓。(b-c) 所有样本中已识别蛋白质的数量及其强度。 (d) 按细胞类型分组的样本中干扰素途径蛋白的热图。(e) 不同免疫细胞亚型的 STAT1 强度值。(f) 所示细胞类型之间的 DEP。(g) TEN 样本的免疫荧光。(h) 角质形成细胞中鉴定出的蛋白质数量(左)和样本间的强度分布(右)。(i) 通过 ANOVA 对显著蛋白质进行半监督层次聚类。(j-k) 主成分分析和 PC2 和 PC4 的主要驱动因素。(l-m) 在分离细胞和附着细胞之间以及在不同队列之间变化的感兴趣的蛋白质。
04
JAK/STAT 通路在 TEN 中高度活跃
严重炎症性疾病的特征是细胞串扰和反馈回路发生改变,从而加剧免疫反应;他们使用细胞类型分辨的蛋白质组对此进行了研究(图S3a-c)。与健康对照组相比,TEN 的角质形成细胞和免疫细胞中有六种重要蛋白质(WARS1、STAT1、S100A9、LYZ、GBP1 和 APOL2)上调至少四倍(图4a)。DRESS 只有一种(STAT1),而 MPR 没有这样的重叠蛋白质(图S3c)。值得注意的是,所有这六种蛋白质都位于干扰素通路中,负责信号转导(通过STAT1)或由其触发。干扰素通过 JAK/STAT 通路发出信号;因此,他们检测了该通路中的分子(图4b)。STAT1 和 STAT3在免疫细胞和角质形成细胞中均上调,而 STAT2 仅在角质形成细胞中上调,STAT5 在免疫细胞中上调。大多数干扰素刺激基因 (ISG) 产物要么强烈上调,如 GBP1 增加了 9 倍,要么仅在 TEN 中可检测到,例如 GBP5。
细胞因子激活JAK/STAT通路;为了研究该通路的激活,他们在扩大的 CADR 患者队列中利用了靶向转录组学(图S5a-c)。在已知通过JAK/STAT 通路发出信号的细胞因子编码基因中,IFNG(编码 IFNγ)表达在 TEN 中上调最明显,超过了已知与TEN 有关的基因如TNF 41的上调(图4c)。虽然靶向转录组学无法区分不同的 CADR,但对JAK 和 STAT 的特定检测证实了这些分子在 TEN 和 SJS-TEN 重叠中广泛上调(图4d,图S5d-i)。基于抗体的 FFPE 组织切片中 STAT1 的可视化进一步证实,它在 TEN 中的角质形成细胞和其他细胞类型的细胞中显著上调并定位到细胞核中(图4e,图S3d)。值得注意的是,TEN 免疫细胞中单细胞核 STAT1 上调的程度与 DRESS 相似,在 DRESS 中,虽然它们的组织病理学、临床表现和疾病过程不同,但使用 JAKi 的治疗干预已证明是成功的。STAT1 的这种上调表明严重的 CADR 具有共同的炎症通路,可能是由 T 细胞活化驱动的。为了进一步在信号水平上验证 TEN 中的 STAT1 活化,他们评估了 STAT1 的磷酸化状态。组织学分析显示,TEN 患者的皮肤浸润免疫细胞和角质形成细胞中 STAT1 磷酸化程度很高(图4f)。他们利用整体磷酸化蛋白质组分析扩展了这一观察结果,检测了一组独立的 TEN 患者中超过 16000 个 I 类磷酸化位点(图S6a-g)。总之,这些结果表明,JAK/STAT 通路的激活是 TEN 的关键驱动因素。

图S3.相互作用分析。
(a) 蛋白质按脱落角质形成细胞(上图)和健康角质形成细胞(下图)中最高 MS 强度值的顺序显示。(b) Circos 图用于可视化角质形成细胞 (CK) 和免疫细胞 (CD45) 在皮肤药物反应 (MPR、DRESS、TEN) 中的配体-受体相互作用。 (c) 与健康相比,DRESS(左)或 MPR(右)的角质形成细胞(x 轴)和免疫细胞(y 轴)中的DEP。 (d) 每个细胞的核 Stat1 强度。
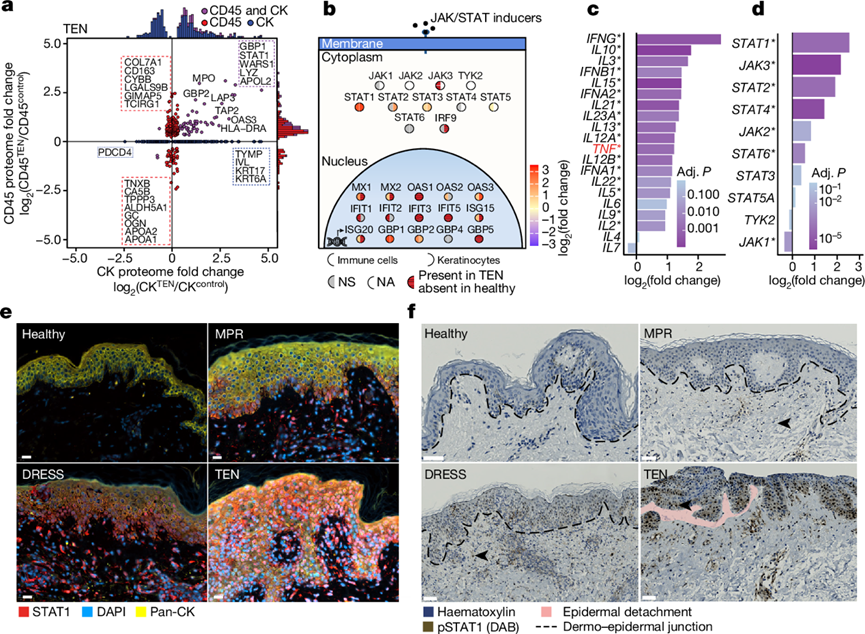
图4. JAK/STAT 通路在 TEN 中发生激活。
(a) TEN 患者与健康参与者相比的角质形成细胞 (CK) 和免疫 (CD45) 细胞中的 DEP。(b) 免疫细胞和角质形成细胞中的 JAK/STAT 通路蛋白。(c-d) 选定的细胞因子和 JAK/STAT 通路成分的 mRNA 转录本表达存在差异。 (e-f) 不同队列组织切片中STAT1 和全细胞角蛋白以及磷酸化 STAT1 (pSTAT1)染色的代表性图像。

图S5. 组织切片的靶向转录组学分析。
(a)实验示意图。(b-c) 通过靶向转录组学检测到的已鉴定转录本的文恩图,以及使用角化细胞或免疫细胞的DVP鉴定的蛋白质。(d) ANOVA 显著蛋白质的层次聚类。(e-f) 对所有队列中大量组织切片的转录本进行主成分分析 (PCA)。(g) 差异表达转录本。(h-i) 与健康相比,所有条件下差异调节转录本的Upset图。TEN中唯一调节的转录本在火山图中以颜色标记,随后进行了过度代表性分析。
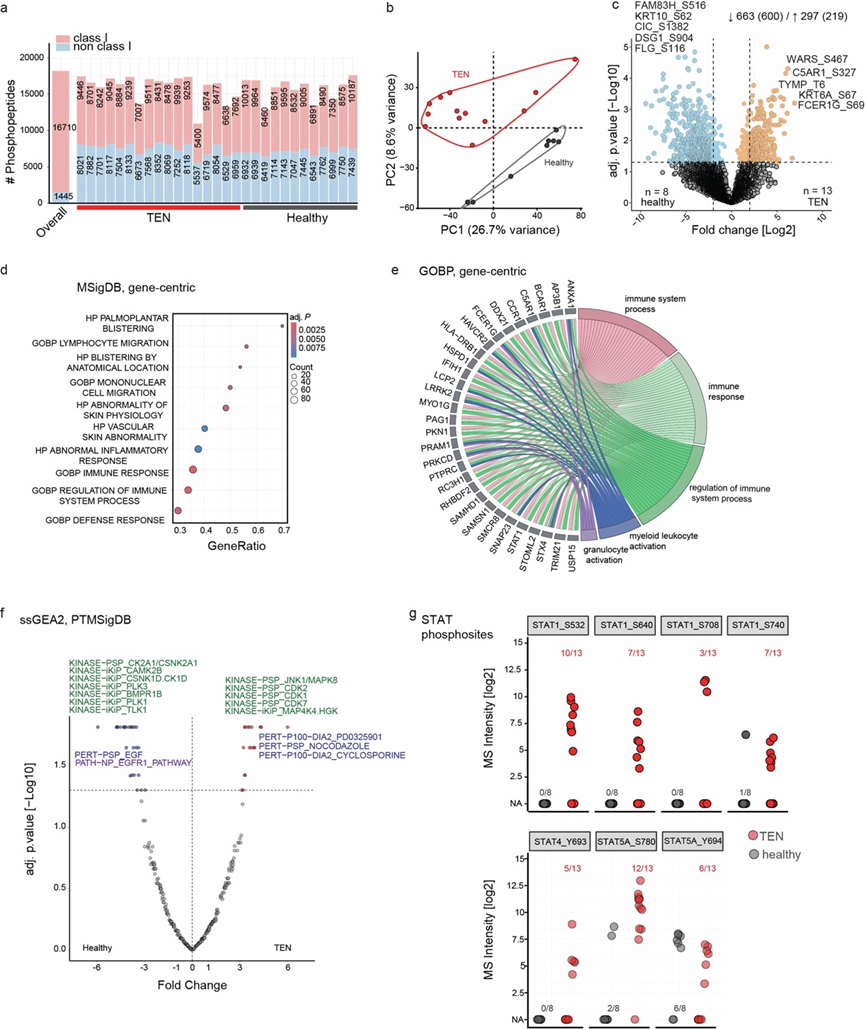
图S6. TEN 的磷酸化蛋白质组学分析。
(a) 每个样本和总体中在 TEN 和健康样本中鉴定出的 I 类磷酸位点。(b) 主成分分析 (PCA)。(c) TEN 和健康之间差异调节的磷酸位点。(d-e)富集分析。(f) TEN中上调磷酸位点的位点特异性富集分析 (ssGEA2,PTMSigDB)。(g) 健康和对照样本中已鉴定的 STAT1/4/5 磷酸位点的数量。
05
靶向 TEN 模型中的 JAK/STAT
为了研究实验结果的临床意义,他们开发了一种新的体外模型来真实地探究皮肤药物反应(图5a)。在这种自体共培养模型中,活化的外周血单核细胞 (PBMC) 在 72 小时内有效杀死角质形成细胞,而这种效应由泛 JAK 抑制(JAKi)剂托法替尼(Tofacitinib)以剂量依赖性方式抑制(图5b)。
他们接下来评估了口服 JAKi 在已建立的 TEN 小鼠模型中的疗效。皮下注射凋亡抑制剂 (IAP)蛋白的小分子拮抗剂[第二种线粒体衍生的胱天蛋白酶激活剂 (smac) 模拟物]可诱发类似 TEN 的皮肤炎症、表皮脱离和 TEN 的组织学特征(图5c-f)。口服泛 JAK 抑制剂托法替尼或 JAK1 和 JAK2 抑制剂巴瑞替尼成功降低了治疗第 1 天和第3 天的疾病严重程度(图5d)。与人类 TEN 相似,可检测到皮肤磷酸化 STAT1 信号的强烈增加,而在 JAKi 治疗后显著降低(图5e)。同样,平均真皮厚度恢复到正常水平(图5f)。此外,JAKi 减少角质形成细胞死亡(TUNEL + cleaved caspase-3 +细胞)并减少免疫细胞浸润(CD45 +细胞)(图5e)。值得注意的是,JAKi 治疗小鼠的表皮恢复加快,表现为快速的临床恢复和基底层角质形成细胞中增殖标志物 Ki67 的表达上调。这表明 JAKi 治疗不会对 TEN 背景下的伤口愈合产生有害影响。
由于 JAK1 是干扰素信号传导的主要介质,他们检测了仅抑制 JAK1 是否足以治疗该疾病。事实上,使用 JAK1 抑制剂 abrocitinib 或 upadacitinib 治疗可显著降低疾病严重程度(图5g)。他们还探索了一种在疾病诱导后施用 JAKi 的治疗模型(图5h)。这同样显著降低了临床严重程度、病变大小和恢复时间(图5h-j)。
他们进一步在已建立的 TEN 人源化小鼠模型中测试了巴瑞替尼的疗效,将来自 TEN 幸存者的 PBMC 静脉注射到免疫缺陷小鼠体内(图5k)。在每天口服致病药物22后的第 14 天出现了严重的眼结膜炎和结膜上皮细胞死亡,类似 TEN (图5l-n)。与载体治疗(对照)相比,巴瑞替尼治疗显著减少了眼结膜炎和结膜上皮细胞死亡(图5l-n)。总之,体外和体内数据清楚地证明了 JAKi 在 TEN 临床前模型中的疗效。
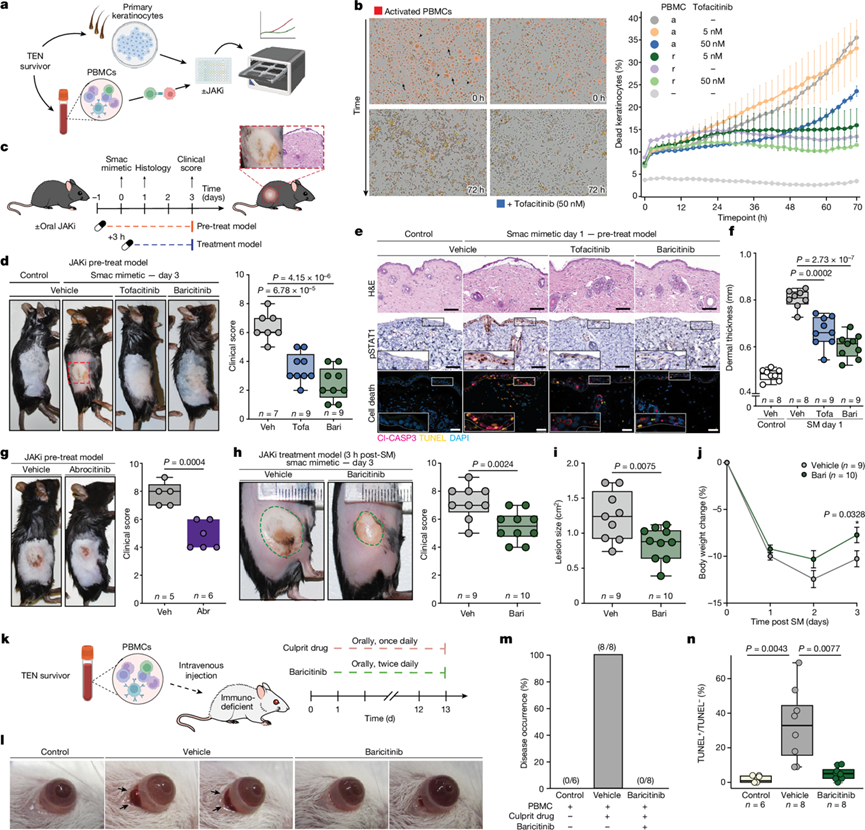
图5. JAK/STAT 抑制可降低体外和体内 TEN 的严重程度。
(a-b) 活细胞成像测定示意图,50 nM 托法替尼以测量随时间的细胞毒性(b)。(c) smac 类似物诱导的 TEN 模型中口服 JAKi 治疗示意图。(d-j) 临床评估、组织学结果、真皮厚度、病变大小和体重变化。(k) TEN 人源化小鼠模型中口服 JAKi 治疗示意图。(l-n)联合药物治疗结果。
06
JAKi 治疗可缓解 TEN
他们按照说明书用 JAKi 治疗了 7 名患有 TEN 或 SJS-TEN 重叠的患者。其中一名患者是 59 岁的男性,他正在接受卡铂、依托泊苷和 PD1 拮抗剂 serplulimab 治疗小细胞肺癌(图6)。在第三个周期的癌症治疗后,他出现了 TEN,表皮脱离影响了 35% 的体表面积,疾病严重程度评分 (SCORTEN) 为 4,预计死亡率为 58.3%。虽然接受了高剂量静脉注射甲基强的松龙,但表皮脱离仍旧进展,促使他们开始使用阿布替尼进行 JAK1 抑制剂救援疗法,该疗法最近获批用于治疗特应性皮炎。疾病在 2 天内停止进展,4 天内可见上皮化,16 天后达到近乎完整的上皮化(95%),之后患者完全康复出院。所有七名接受 JAKi 治疗的患者在第 30 天均存活,且无副作用。值得注意的是,所有七名接受 JAKi 治疗后,皮肤磷酸化 STAT1 水平均显著降低。这些临床数据显示 JAK1 或泛 JAK 抑制在治疗 TEN 方面具有潜力。

图6. 与癌症治疗相关的TEN (SCORTEN 4)患者的病程。
+ + + + + + + + + + +
结 论
本项研究利用了深度可视化蛋白质组学技术,分析了三种严重程度不同的皮肤药物反应的福尔马林固定、石蜡包埋的存档皮肤组织活检样本,并定量了角质形成细胞和皮肤浸润免疫细胞中的 5000 多种蛋白质。结果显示,TEN 患者的免疫细胞和角质形成细胞区室中 I 型和 II 型干扰素特征显著丰富,以及磷酸化 STAT1 激活。体外靶向抑制泛 JAK 抑制剂托法替尼可降低角质形成细胞定向细胞毒性。体内口服托法替尼、巴瑞替尼或 JAK1 特异性抑制剂阿布替尼或乌帕替尼可改善两种不同 TEN 小鼠模型的临床和组织学疾病严重程度。至关重要的是,在七名 TEN 患者中,使用JAKi 治疗是安全的,并且与快速皮肤上皮化和恢复有关。这项研究揭示了 JAK/STAT 和干扰素信号通路是 TEN 的主要致病驱动因素,并展示了靶向 JAKi 作为治愈疗法的潜力。
+ + + + +



 English
English


