文章解读|Nat Commun(14.7):具有放射状胶质细胞特征的人类 iPSC 衍生神经干细胞在小鼠体内表现出长期安全性
✦ +
+
论文ID
原名:Human iPSC-derived neural stem cells displaying radial glia signature exhibit long-term safety in mice
译名:具有放射状胶质细胞特征的人类 iPSC 衍生神经干细胞在小鼠体内表现出长期安全性
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.01
DOI号:10.1038/s41467-024-53613-7
背 景
神经干细胞 (NSC) 是用于神经退行性疾病细胞疗法的有前途的先进治疗药物。NSC 植入并存于脑血管周围干细胞微环境,迁移至病变区域,通过减少炎症和增强内源性修复机制发挥神经保护和免疫调节功能。最近的证据表明,神经退行性疾病与神经炎症和多细胞功能障碍有关。人类诱导多能干细胞衍生的神经干/祖细胞 (hiPSC-NSC) 有望用于治疗神经退行性疾病和脱髓鞘疾病。然而,对其身份和安全性的全面研究仍然有限。
实验设计
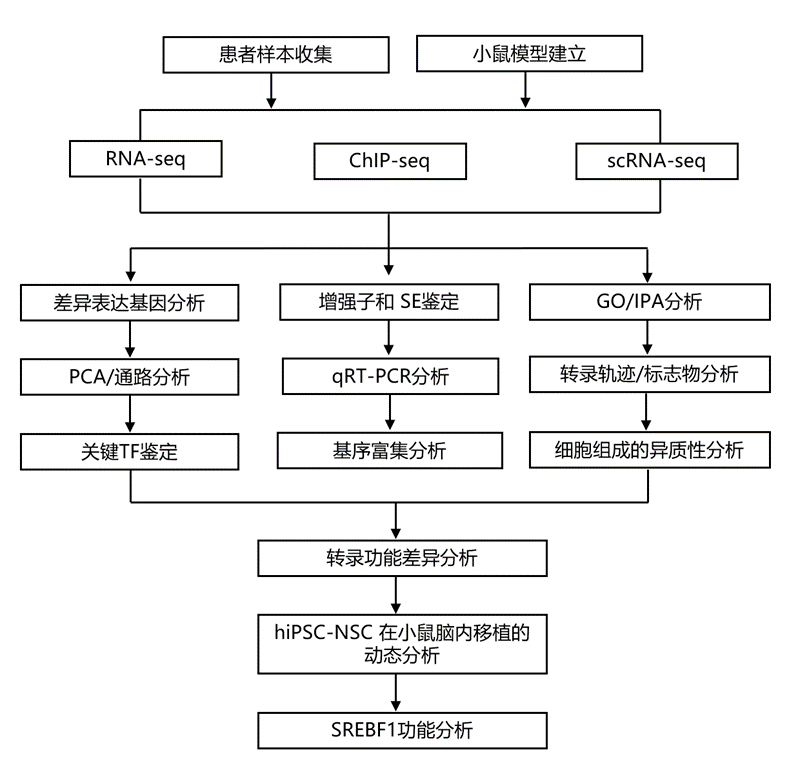
结 果
01
hiPSC-NSC 表现出放射状胶质细胞样转录谱
为了揭示 hiPSC 向 NSC 分化背后的转录动力学,研究团队对四个 hiPSC-NSC 系及其亲本 hiPSC 克隆进行了转录组分析(RNA-seq)。RNA-seq 数据集的分析确定了 hiPSC-NSC 和 hiPSC 样本之间 6030 个差异表达基因(DEG)(图 1A)。欧几里得距离图和 PCA 分析突出显示样本根据其来源分为三个聚类,供体相关差异最小。与亲本 hiPSC相比,hiPSC-NSC 与人类胎儿NSC (hfNSC)的分组更紧密,表明 hiPSC 在神经特化后整体获得了类似 NSC 的转录景观(图 1B)。对 hiPSC-NSC 与 hiPSC的GO分析确定了涉及中枢神经系统 (CNS) 发育、神经发生和神经元功能的生物过程和通路,包括神经特化/神经发生的主要调节因子(PAX6、NEUROD1、POU3F2、FOXN4、MEIS1、FOXA1)和编码电压门控离子通道亚基的基因(图 1C-D)。同时,调节细胞周期、胚胎发育和组织形态发生的进程和通路在 hiPSC-NSC 中下调(图 1C),多能性网络(如POU5F1、NANOG、MYC)、中胚层[如Brachyury (T)、GSC] 和内胚层标记(如EOMES、SOX17、AFP)以及参与胚胎发育的基因(包括TBX和HOX基因)也表现出强烈下调(图 1D)。值得注意的是,用于检测残留 iPSC 污染物的多能特异性标记基因(VRTN、ZSCAN10、LINC00678、L1TD1和ESRG) 在神经特化时也强烈下调(图 1A)。
为了更好地分析 hiPSC-NSC 的成熟阶段,他们将RNA-seq 数据集与来自人类胚胎干细胞 (ESC)的 NE 细胞和RG 的公开转录数据进行了比较。对样本间欧几里得距离的无监督分析发现了 hiPSC-NSC 与中晚期 RG (MRG、LRG) 的转录谱之间更高的相似性。相反,处于分化最早步骤的细胞,即 NE 细胞和早期 RG (ERG),分开聚集(图 1E)。在 hiPSC-NSC 中,功能性调节 ESC 神经定型后期阶段的核心和共同结合因子的表达水平在 MRG 和 LRG 之间的中间水平表达,具有高度样本间变异性,这表明 hiPSC-NSC 包含处于不同成熟阶段的异质 RG 群体。事实上,与显示出更高胶质生成潜力的完全成熟的 ESC 衍生的 LRG 相比,hiPSC-NSC 表现出胶质生成基因(OLIG2、NFIA 和 NFIB)和调节胶质生成的生物过程的下调以及神经生成因子(NEUROD4、NEUROG2)的上调。
另一方面,对 hiPSC 分化过程中显著下调的转录因子(TF) 的 GO 分析揭示了其在多能性网络控制、胚胎发育以及心脏和神经嵴分化中的作用。通过对上游调节剂的 IPA 证实了这些发现,确定了主多能性调节因子(NANOG、POU5F1)下游通路的下调,以及参与间质-上皮转化(TFAP2C) 、非 CNS 细胞生成 (HNF1B)和细胞增殖(CCN1D、E2F 蛋白)的 TF,包括 Myc 通路。hiPSC-NSC 中 MXD1 下游通路的激活可能抑制 MYC 通路并促进细胞生长停滞和分化。值得注意的是,MXD1 对 MYC 的抑制作用可能发生在 hiPSC 神经外胚层定型的初始阶段,因为在 hiPSC 分化的最早时间点, MYC 的下调与MXD1的上调同时发生。
总体而言,这些 RNA-seq数据的比较分析表明,hiPSC 到 NSC 的转变涉及最初上调驱动神经定型的 TF,随后激活调节新生成的 hiPSC-NSC 中 NSC 维持和多能性的通路。人类 iPSC-NSC 下调了与 hiPSC 多能性和向非神经细胞谱系定型相关的转录网络,获得了类似 RG 的转录景观。
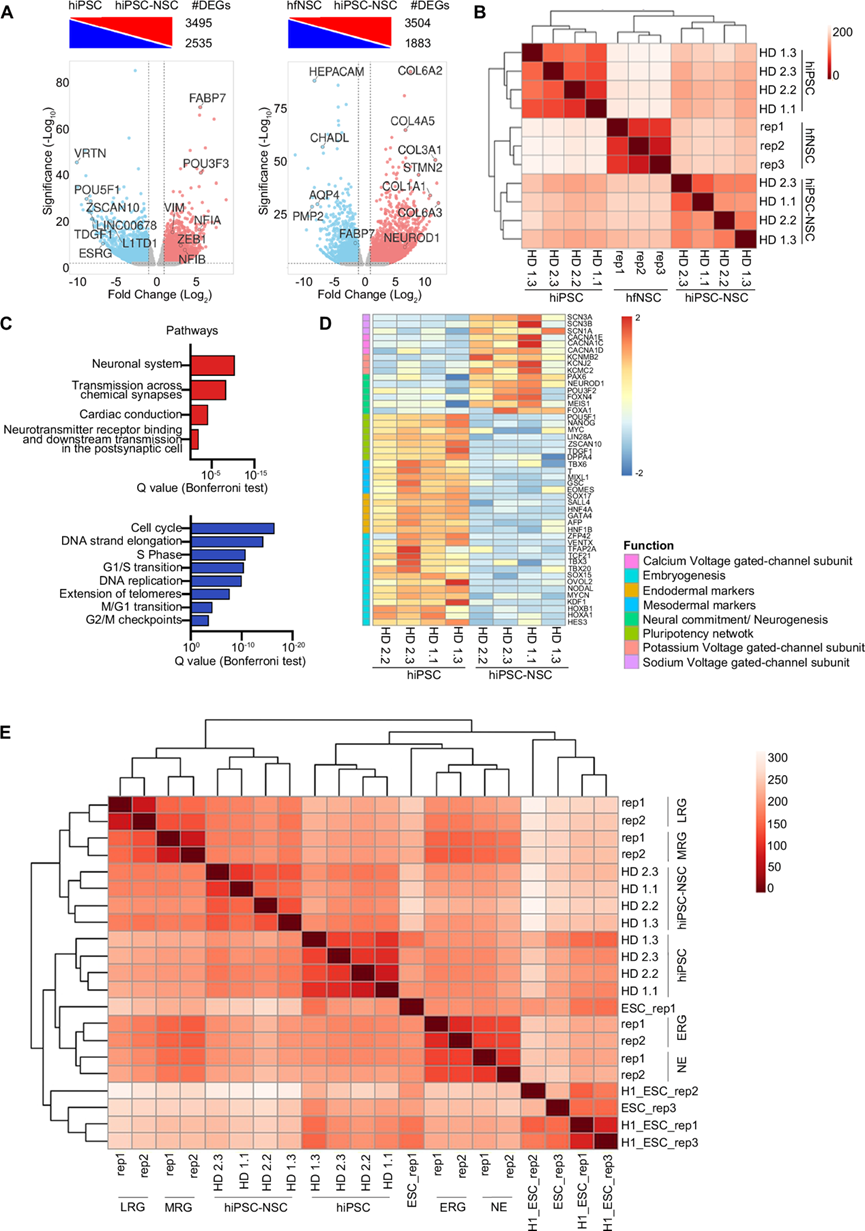
图1. hiPSC 在神经定型过程中获得放射状胶质细胞相关的转录特征。
(A) 差异表达基因(DEG)。(B) 比较 hiPSC、hiPSC-NSC和 hfNSC的 RNA-seq 样本之间的样本间距离热图。(C) hiPSC-NSC vs. hiPSC 中上调或下调的通路的条形图。(D) 热图显示 hiPSC 和 hiPSC-NSC 中涉及多能性、胚胎发生、中胚层和内胚层分化、神经特化和突触信号传导的基因的表达水平。(E)样本间距离热图。
02
增强子和超级增强子是 hiPSC 向 NSC 转变的主要驱动力
接下来,他们使用染色质免疫沉淀和测序 (ChIP-seq) 来进一步表征 hiPSC 到 NSC 的转变和 NSC 身份,重点检测富含组蛋白标记 H3K27ac(一种与转录激活相关的表观遗传标记)的基因组区域。通过 qPCR 针对 hiPSC 和 NSC 标记的细胞特异性调控区域验证每个样本的免疫沉淀 (IP)结果(图S4A)。在 hiPSC、hiPSC-NSC 和 hfNSC 中鉴定了相似数量的 H3K27ac+启动子。相反,增强子和超增强子 (SE) 的数量更加多变(图S4B)。与整体表达水平相比,靠近增强子和 SE 并可能与其接触的基因总体上具有更高的表达水平(图S4C)。值得注意的是,他们观察到 hiPSC 标记物(POU5F1、LIN28A)和 NSC 基因(PAX6、POU3F2)调控区域中细胞特异性差异 H3K27ac 富集(图S4D)。通过证明目标细胞群中靠近细胞特异性增强子和 SE 的基因的整体表达水平高于其他细胞群中的表达水平,验证了选定区域的细胞特异性(图S4E)。
当比较 ChIP-seq数据集时,观察到增强子和 SE 在 hiPSC 到 NSC 的转变过程中发生了显著变化,而大多数已鉴定的 H3K27ac +启动子在两个细胞群中的活性较高(图 2A)。这些发现表明这些调控区域在驱动多能细胞的神经特化方面发挥着重要作用。事实上,通过整合 ChIP-seq 和 RNA-seq 数据集并进行 GO 和 IPA 分析,注意到 hiPSC-NSC 特异性增强子和 SE 与参与神经发生(包括 EHMT1 、CTNNB1、NF-κB1和TEAD2)、突触组织、神经传递和神经胶质生成(图 2B,图S4F)。事实上,这些增强子在参与神经特征化(MEIS1、NEUROD1)、RG维持和多能性(SOX6、RFX2、OLIG2)的TF的共识结合位点中富集(图 2C)。细胞特异性SE可能与参与胆碱能和血清素能神经元特征化的基因接触(图 2B)。
同时,hiPSC 特异性增强子和 SE 接近并可能接触参与胚胎发生、多能性网络和 MYC 通路的基因(图 2B)。TF 结合位点(图 2C)和 IPA 分析(图S4F)表明,hiPSC 特异性增强子和 SE 调节多能性基因(NANOG、 POU5F1、MYC)以及参与细胞周期(E2F1、MYBL2)、非神经组织特化(MYOCD;GATA4)、DNA 损伤反应(NER、BER、ATM信号)和组织特异性癌症的 TF。

图S4. ChIP-seq分析。
(A) 对含有多能性(LIN28)和NSC(PPAP2b)标记的基因组区域的H3K27ac+免疫沉淀染色质进行代表性的qRT-PCR。(B) 条形图显示了每个细胞群体中与启动子、增强子和se相对应的H3K27ac+的数量。(C) 表达水平方框图(Reads Per Kilobase Million;RPKM)中接近细胞特异性增强子和SE的基因与各细胞群体中基因总表达水平的比较。(D) 在hiPSC、hiPSC-NSC和hfNSC中,H3K27ac+在多能基因(POU5F1、LIN28A)和NSC(PAX6、POU3F2)基因上达到峰值。(E) 在hiPSC和hiPSC-nsc ChIP-seq数据集的比较中检测到的hiPSC和hiPSC-nsc特异性增强子和se的接近基因的表达水平的箱线图。(F) 条形图显示了hipsc或hiPSC-NSC中接近细胞特异性增强子和SE的上调和下调基因的IPA分析。
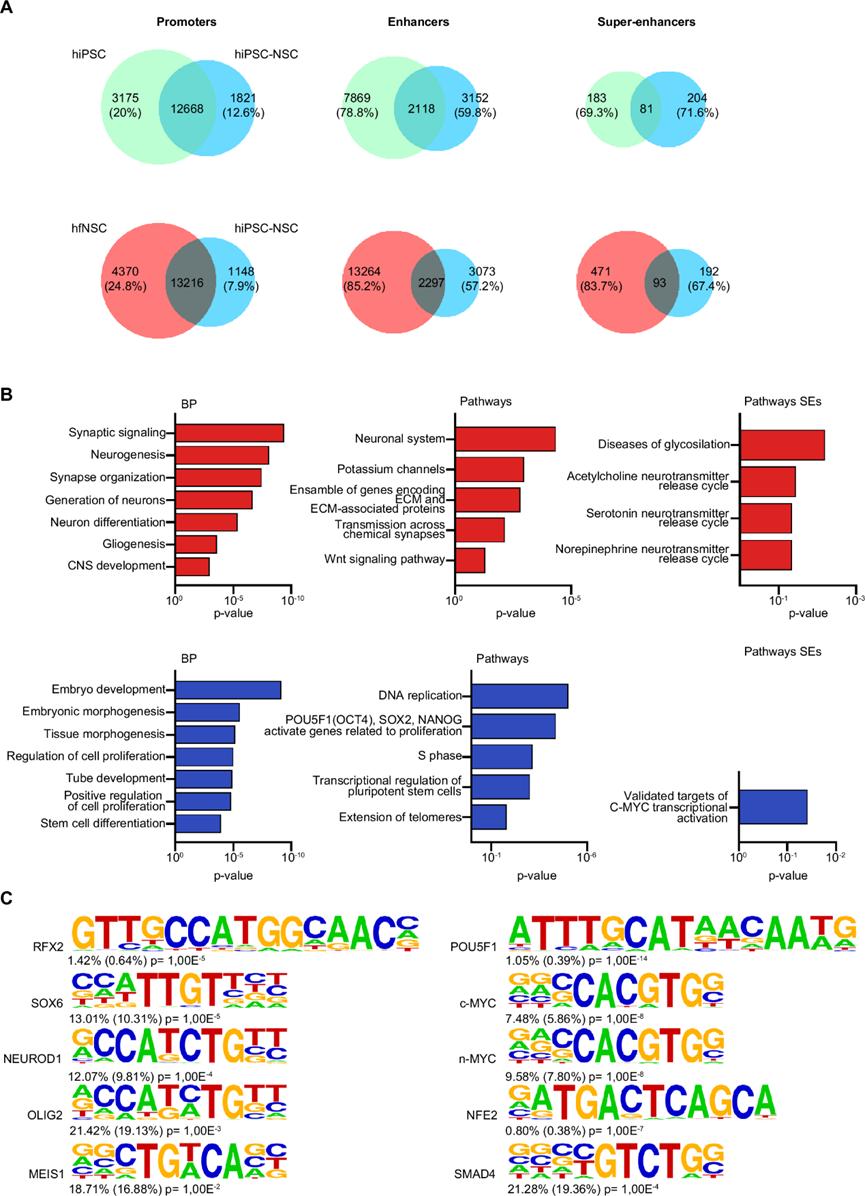
图2. H3K27Ac+调节区域驱动 hiPSC 到 hiPSC-NSC 的转变。
(A) 维恩图显示了hiPSC 与 hiPSC-NSC 以及 hfNSC 与 hiPSC-NSC 中细胞特异性和共享的 H3K27ac +启动子、增强子和超级增强子 (SE) 的数量。(B) 富集分析。(C) 在 hiPSC-NSC 特异性(左)和 hiPSC 特异性增强子(右)中检测到的假定转录因子结合位点 (TFBS) 的 HOMER 分析。
03
hiPSC-NSC 和 hfNSC 包括处于不同成熟阶段的 RG
为了更好地突出 hiPSC-NSC 和 hfNSC 之间的相似点和不同点,他们比较了它们的转录和表观遗传图谱(RNA-seq 和 ChIP-seq 数据集)。两种 NSC 群体都具有共同的 H3K27ac +启动子(图 2A)和与细胞周期和代谢以及 NGF 和 CXCR4 信号传导相关的通路,参与 NSC 的存活和迁移。与 hfNSC 相比,hiPSC-NSC 中增强子和 SE 的激活程度不同(图 2A),并且检测到了涉及细胞外基质组织的转录本和基因的上调(图 3A-B)。相反,以漂浮神经球形式生长的 hfNSC 上调了细胞间粘附过程和涉及糖胺聚糖和硫酸软骨素的通路,这些通路是神经源性微环境的信号分子(图 3A-B)。这些结果突出了培养条件对这些细胞整体转录和表观遗传特征的影响。
此外,hiPSC-NSC 的特点是:调节脑发育(ARNT2、OTX2、POU3F2)、NE到 RG 转换(NOTCH3、LMX1a)、腹侧神经祖细胞的模式改变(HOXA9、LMX1a、LMX1b、OTX2)和 NSC 的静止/维持(FOXO1、KLF4)的下游TF 通路活化程度更高(图 3B)。参与 WNT/β-catenin(例如CTNNB1、LEF1)和 Hedgehog(例如GLI1)通路以及 BMP 和 SMAD 信号传导(SMAD4、SMAD3、SOX11)的蛋白质和 TF 表达增加可能与 hiPSC-NSC 产生神经元的倾向有关(图 3A-C)。另一方面,细胞特异性增强子/SE 和调节神经胶质生成的基因(包括 SOX3 和 PRMD8 下游通路)在hfNSC中表达更高(图 3A-C)。值得注意的是,调节驱动胚胎和非中枢神经系统发育的基因的增强子的残留激活(图 3B)与多能干细胞向神经谱系分化过程中通常激活的通路有关。
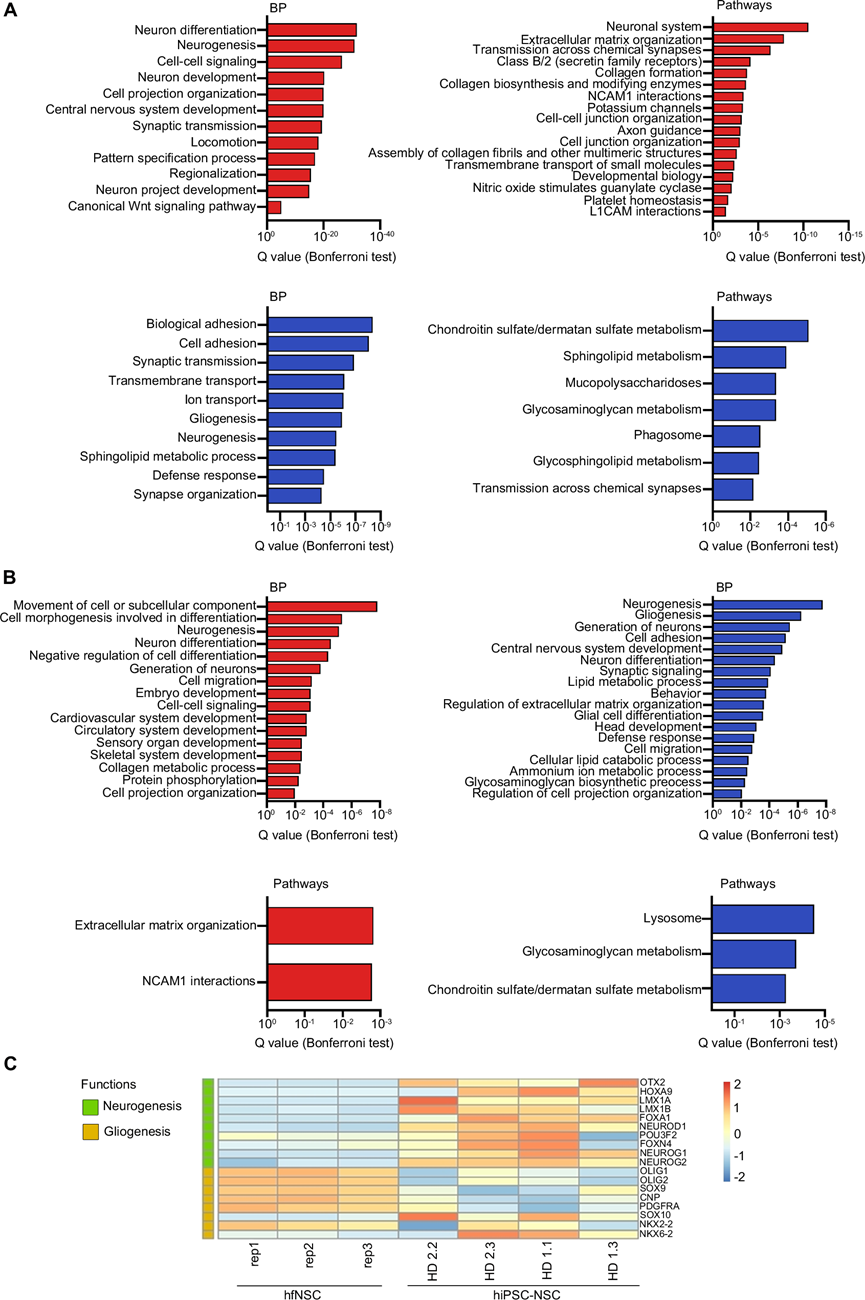
图3. 转录和表观遗传分析揭示 hiPSC-NSC 和 hfNSC 分化潜力的差异。
(A-B)富集分析。(C) 热图显示 hiPSC-NSC 与 hfNSC 中神经源性和胶质源性基因的表达水平。
04
hiPSC-NSC 细胞组成的异质性反映了 RG 成熟的不同阶段
均匀流形近似和投影 (UMAP) 表示揭示了 hiPSC-NSC 和 hfNSC 样本内的样本内异质性(图 4A),从而注释了 12 个以不同的转录组谱为特征的聚类(图 4B)。UMAP 聚类的伪时间分析确定了一条轨迹,描述了从未成熟到成熟 RG 的逐渐转变以及获得神经元祖细胞样特征的过程(图 4C)。事实上,聚类 1(PAX6high/OTX2lowRG)中 PAX6 和 ERG 标记物的表达高于聚类2(PAX6low/OTX2 high RG),后者仍然保持了 MRG 的转录特征(图 4D-E)。此外,聚类2 显示出更高的 N-糖生物合成激活度,这与 NSC 中的神经发生/星形发生转换有关,而糖酵解通常在神经干细胞中激活,为维持干性提供能量(图 4F)。沿着拟时间轨迹,由 hiPSC-NSC 和 hfNSC 混合组成的聚类3 ( SLC1A3 high RG ) 以 LRG 标记物高表达、cAMP 和钙信号激活以及与少突胶质细胞发生相关的PPAR 通路和胆固醇代谢的正向调节(图 4D-F)。聚类5(GBX2 high RG)可能代表逐渐获得神经元祖细胞表型的 RG,聚类7(神经元前体)中已知神经元前体标志物的表达更高(图 4D-E)。聚类7 的特征是激活调节 RAS 和 ERBB 信号传导的通路,这些通路涉及神经元祖细胞的增殖、存活、分化和迁移,轴突引导、突触小泡以及谷氨酸能和 GABA 能突触(图 4F)。此外,聚类7 中的细胞具有与人类胎儿脑的神经元细胞相似的转录谱。值得注意的是,聚类4(循环SLC1A3+ RG)和聚类 6(循环GBX2 high RG)分别显示出与聚类 3和聚类 5 类似的转录谱,且细胞周期基因的激活程度更高(图 4E-F)。此外,他们还确定了一个主要由表达典型 LRG 基因的 hfNSC 组成的聚类(聚类11)。
他们在富含 hiPSC-NSC 的聚类 8(TNF 和 Hedgehog 反应性胶质祖细胞亚群,胶质祖细胞 1)和聚类9(以 PI3K-AKT 和鞘脂信号传导激活为特征,胶质祖细胞 2)中检测到 ESC 衍生胶质祖细胞标志物的表达较高(图 4D-F)。少突胶质祖细胞标志物在聚类10中上调,聚类 10 主要由 hfNSC 组成(图 4D-E)。值得注意的是,更多定向的神经元(聚类 5、6 和 7)和少突胶质细胞(聚类10) 亚群的特点是激活氧化磷酸化通路,这有利于更有效地产生能量以(图 4F)。他们定义了转录特征(图 4D)和膜结合标记以识别不同成熟阶段的 hiPSC 衍生的 RG 和定向的神经元和神经胶质祖细胞。通过 hiPSC-NSC 中的免疫荧光分析在蛋白质水平上验证了富含 ERG(PAX6、ACKR3)、GBX2 high RG (GBX2)、神经胶质祖细胞 (LOXL2) 和神经元祖细胞 (L1CAM) 的基因的表达。有趣的是,在人类胎儿脑的 RG 和神经胶质/神经元祖细胞亚群中检测到了识别 hiPSC-NSC/hfNSC 衍生的成熟 RG(聚类 3-6 和 11)和定向祖细胞(聚类7、10)的前 50 个基因。重要的是,他们没有在 hiPSC 衍生的亚群中检测到OCT4+细胞,并且仅检测到中胚层/内胚层标志物或涉及 hiPSC/ESC 多能性的基因的低表达(例如CNMD 、DPPA4 和 L1TD1 )(图4D)。在 scRNA-seq 分析中,他们观察到 hiPSC-NSC RG 亚群组成的样本间差异。特别是,与 HD1.1 和 HD2.3 样本相比,HD1.3 hiPSC-NSC 表现出不同的细胞分布(图 4A)。
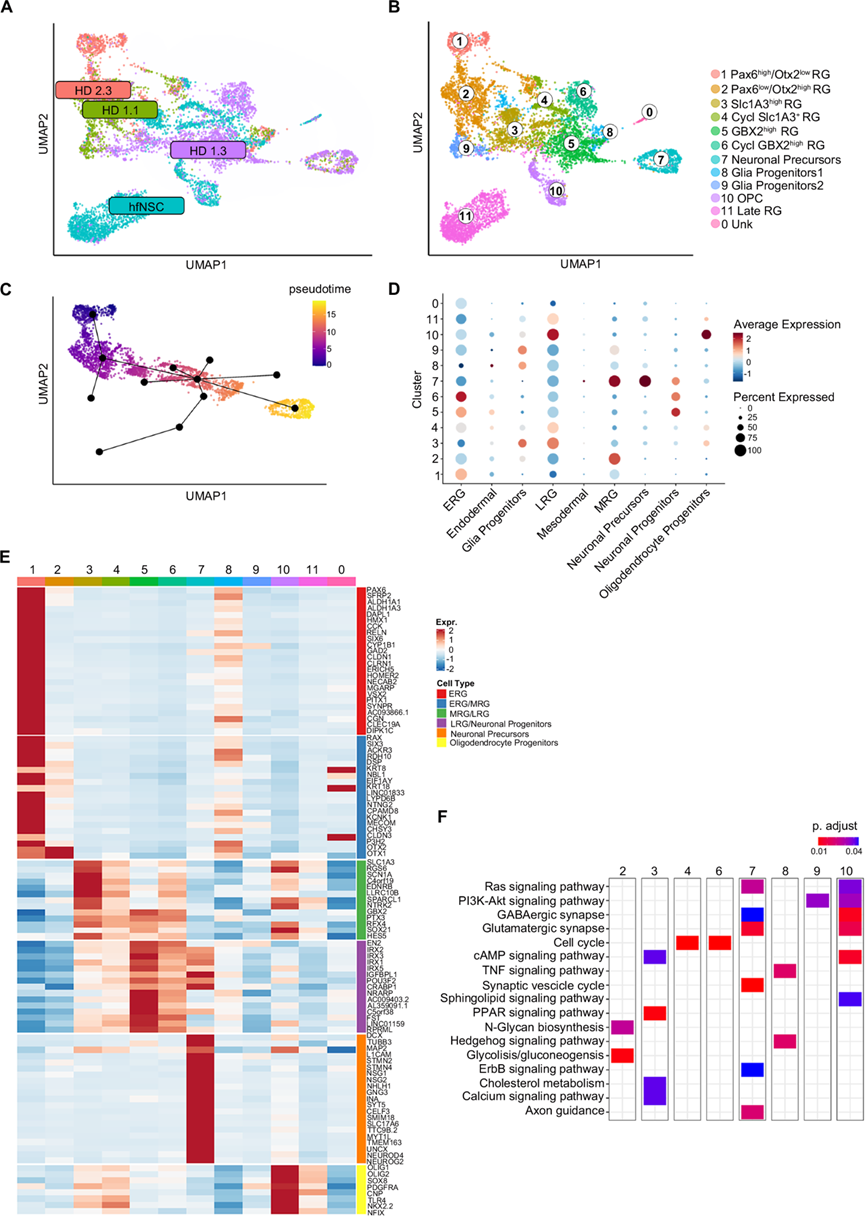
图4. hiPSC-NSC 细胞组成的异质性反映了 RG 成熟的不同阶段。
(A) UMAP图显示三个 hiPSC-NSC 克隆 [HD 1.1(p2,绿点)、HD 1.3(p1,紫点)和 HD 2.3(p2,红点)] 和 hfNSC(p19,蓝点)的分布(约 1000-3000 个细胞/样本)。(B) UMAP图显示 scRNA-seq 分析中确定的不同聚类。(C) 伪时间分析显示转录轨迹。(D) 点图显示基于公开数据集的每个聚类的特征注释。(E) 热图比较 scRNA-seq 聚类之间特征特异性标记的表达水平。(F) 热图显示在 scRNA-seq 聚类中富集的选定通路。
05
hiPSC-NSC 在转录上与胶质母细胞瘤干细胞存在差异
对 hiPSC-NSC 和 hfNSC 的 RNA-seq 和 ChIP-seq 数据集的比较分析表明,hiPSC-NSC 中可能激活了促癌 TF下游的通路。由于胶质母细胞瘤 (GBM) 中的癌症干细胞与 NSC具有共同的特征和生态位,他们研究了 hiPSC-NSC 和 hfNSC 与原代胶质母细胞瘤干细胞 (GSC) 的转录相似性/差异。
样本之间的欧几里得距离表明这三个细胞群聚类不同,hiPSC-NSC 和 GSC(G523NS)的转录谱相似度较低(图 5A)。RNA-seq数据集的监督分析在 hiPSC-NSC 与 GSC 样本中鉴定出 8471 个 DEG(图 5B),与两种神经细胞群的比较相比,转录多样性程度更高(图 1A)。值得注意的是,在 hfNSC 与 GSC 中检测到了 6626 个 DEG(图 5B),进一步表明临床相关的 hfNSC 细胞群中发生肿瘤的倾向较低。在 hiPSC-NSC 中检测到的大多数潜在致癌 TF,以及驱动 GBM 重编程和 GSC 生长发育的关键 TF 和信号分子,在 hiPSC-NSC 中的表达水平明显低于GSC(图 5C)。
与 GSC 相比,NSC 群体中下调的生物过程和 GO 分析表明,GSCs(胶质瘤干细胞)研究显示,具有肿瘤形成能力的干细胞表现出以下基因的高表达:驱动细胞周期的基因(包括 MYC 和 E2F 转录因子)、依赖氧化磷酸化的 ATP 合成(通常在癌细胞中检测到)、硒蛋白的合成(例如 GPX1 和 GPX4)(这些蛋白在胶质母细胞瘤中的氧化应激调节中起关键作用)、L13a 介导的铁蓝蛋白 (ceruloplasmin) 沉默作用(而铁蓝蛋白是铁代谢的重要调节因子,其表达水平与放疗对胶质母细胞瘤细胞的疗效呈正相关)(图 5C-E)。相反,hiPSC-NSC 和 hfNSC 均上调了与胶原组织有关的生物过程和通路,这似乎与 GBM 患者的更长的中位生存期呈正相关,并且与神经发生或突触传递有关,这反映了这些细胞群相对于 GSC 的多能性(图 5D-E)。
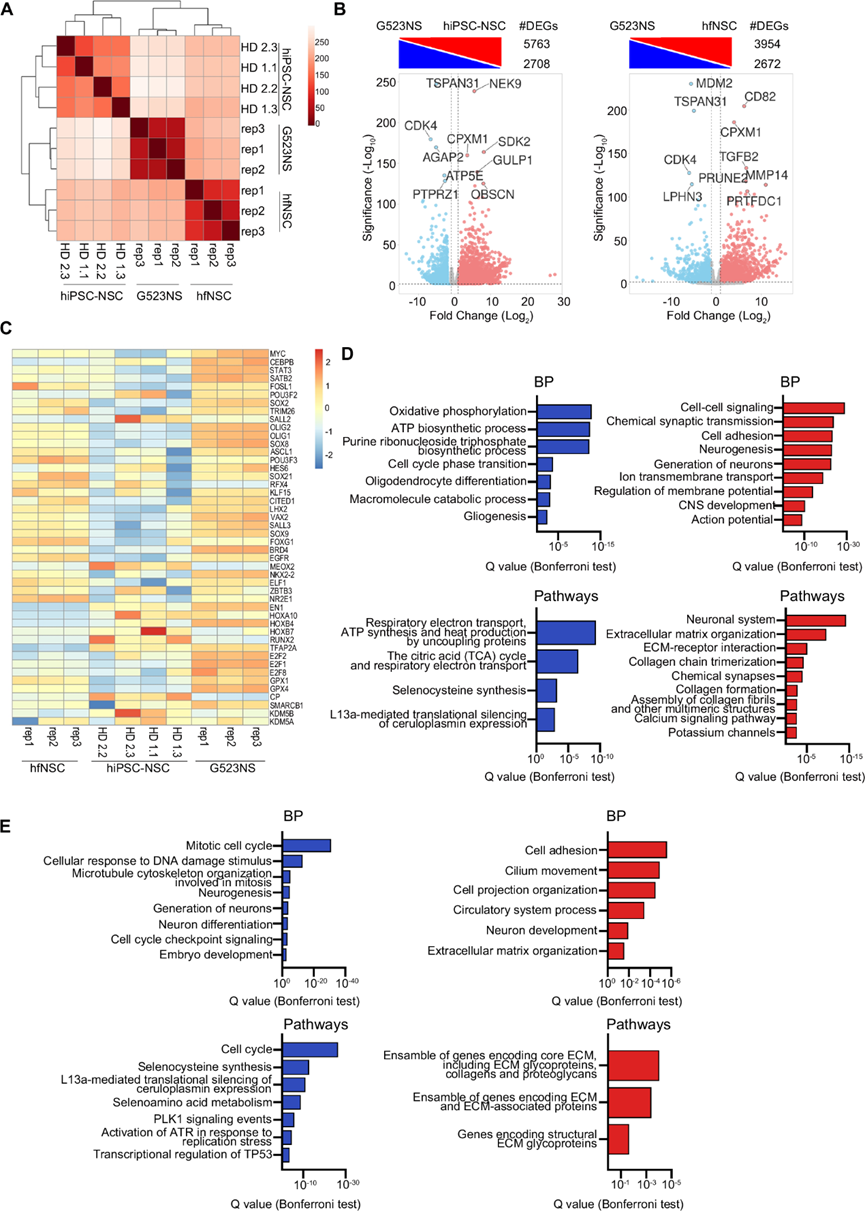
图5. hiPSC-NSC 和 hfNSC 在转录上与胶质母细胞瘤干细胞存在差异。
(A) hiPSC-NSC vs. hfNSC vs. 胶质母细胞瘤干细胞 (GSC;细胞系 G523NS) 的样本间距离热图。(B) DEG分析。(C) 热图显示 hiPSC-NSC、hfNSC 和 GSC 样本中潜在 GSC 标记物、促癌转录因子和信号分子的表达水平。(D-E)GO富集分析。
06
hiPSC-NSC 在小鼠脑内移植后可安全、稳定、长期植入
为了评估这些细胞在体内的安全性和功能性,他们将 hiPSC-NSC 移植到免疫缺陷(Rag2 −/− /γ-chain −/−)新生小鼠体内[双侧脑室内 (ICV) 注射;200000 个细胞/脑],并在移植后 10 个月对接受治疗的动物进行分析。他们采用免疫荧光分析,使用人类特异性抗体(hNuclei 和 STEM121)和细胞谱系特异性标记物来评估细胞植入和分布以及植入脑组织的移植细胞的表型。
他们检测到了可变但稳健的人类细胞植入(图 6A-B)。hiPSC-NSC 很好地整合到白质和灰质区域,包括嗅球、纹状体、小脑、脑桥、延髓和颈部脊髓(图 6A-D),表明从注射部位广泛向喙-尾方向迁移。在移植了所有 hiPSC-NSC 克隆的小鼠中,表达增殖标志物 Ki67 的人类细胞百分比较低(4.4 ± 1.0%)。有趣的是,Ki67+人类细胞优先位于脑室下区 (SVZ) 神经源性生态位内或附近(图 6C)。 NESTIN+人类细胞在 SVZ 和其他脑区的存在证实了植入的 hiPSC-NSC 保留了未成熟表型的长期持续性(图 6D-E)。在非 SVZ 脑区和脊髓中检测到的大多数人类细胞表达星形胶质细胞(S100β)和少突胶质细胞(谷胱甘肽 S-转移酶 π,GSTπ)的标志物(图 6D-E)。
移植的人类细胞群中存在≅ 50% 和≅ 80% 的 S100β +细胞和 GSTπ +细胞,这表明这两种标志物可能在神经胶质细胞亚群中共同表达。为了验证这一假设,他们检测了表达 SOX10 的细胞的存在,SOX10 是由 NSC 表达的 TF,也是少突胶质细胞特化的主要 TF,其表达也与星形胶质细胞分化方面的一定程度的可塑性有关。双重免疫荧光分析显示,大多数 S100β +和 GSTπ +细胞共同表达 SOX10,这表明它们可能代表了一群定向神经胶质祖细胞。在移植动物的灰质和白质区域检测到 平均 40% S100β + /SOX10 -星形胶质细胞和 25% GSTπ + /Sox10 -少突胶质细胞,hiPSC-NSC 衍生的少突胶质细胞在胼胝体和皮质中的分布较高。他们发现少量人类衍生的 β-tubulin III +神经元(2-20%),主要位于靠近注射部位(SVZ 和纹状体)的区域(图 6D-E)。为了进一步探索移植后 hiPSC-NSC 分化的动态,他们在双侧 ICV 注射 hiPSC-NSC(200000 个细胞/脑)后对免疫缺陷小鼠进行了全面的时间过程评估。他们比较了移植后 1.5 个月、3 个月和 10 个月时显示神经元(β-微管蛋白 III +)、星形胶质细胞(S100β +)和少突胶质细胞(GSTπ +)标记物的移植细胞的百分比。免疫荧光分析显示 β-微管蛋白III +神经元的百分比随时间显著下降,而 S100β+星形胶质细胞的百分比则逐渐增加。同时,GSTπ +少突胶质细胞和 NESTIN + NSC的百分比随时间保持不变(图 6F)。
值得注意的是,在移植后 10 个月,他们没有检测到任何表达多能性标志物(NANOG 和 OCT4)的人类细胞或任何 hiPSC-NSC 移植小鼠大脑中异常增殖或肿瘤形成的迹象。

图6. hiPSC-NSC 在新生小鼠脑内移植后的长期植入。
(A) 基于免疫荧光图像生成的脑矢状切片代表性掩模,显示移植 10 个月后植入的 HD 2.2 hiPSC-NSC 的分布情况。(B) 条形图显示移植小鼠脑中植入的 hiPSC-NSC 的百分比。(C) 条形图显示在整个大脑 (TOT) 和选定区域 (CTX) 中检测到的Ki67 +人类细胞的百分比。(D) 免疫荧光分析。(E) 条形图报告了移植细胞(hNuclei +或 STEM121 +)在整个大脑和选定区域中表达细胞特异性标志物的量化。(F) 堆积条形图显示移植后 1.5 个月、3 个月和 10 个月时移植大脑中表达细胞特异性标志物(NESTIN、GSTπ、β-tubulin III 和 S100β)的移植人类细胞(hNuclei +、hMito+或 STEM121+)的相对组成。
07
SREBF1 参与星形胶质细胞分化的调节
他们通过共递送核糖核蛋白 Cas9 和靶向SREBF1基因外显子 5 的 sgRNA 来生成 SREBP1 缺陷型 hiPSC 系。在大量 hiPSC 中实现了 89% 的编辑效率(Synthego ICE 分析),导致 bHLH DNA 结合域(外显子 5)内 134 bp 的缺失。通过亚克隆 Cas9/sgRNA 处理的 hiPSC,他们分离出三个克隆,在其中观察到了截短的未成熟(iSREBP1)和成熟(mSREBP1)蛋白的产生,其 SRE 结合活性降低(图 7A-B)。RNA-seq数据显示,在 SREBP1 缺陷型和 Cas9仅处理的 hiPSC中,转录谱和多能性标志物的表达相似(图 7C-D),但涉及固醇/脂质转运(例如APOC1 、APOE、SIRT1、CLU、PCSK9)和基因表达调控(例如SOX2、PHOX2A、BCL11B、NFATC2、RUNX1、HOXA1、FOXP1、SMAD3)的已知SREBP1靶基因表达发生改变。
SREBP1 缺陷的 hiPSC 分化导致 NSC/祖细胞标记物(图 7D)和涉及神经系统发育、轴突引导和突触传递的通路上调。事实上,hiPSC 分化产生的细胞具有转录组谱,如 ESC 衍生的 MRG 和 LRG,无论是在 SREBP1 缺陷样本中还是在对照样本中(图 7E)。值得注意的是,SREBP1 缺陷会影响 hiPSC-NSC 中涉及脂质代谢(例如EPAS1、DDIT3、TRIB3、GADD45A/B、CAV1、ARX)和转录调控(例如ETS1、FOXA1、ATF3、NFATC2)的SREBP1 靶基因的表达,而不会影响这些细胞群的存活和增殖(图 7F-G)。
为了研究 SREBP1 缺乏对 hiPSC-NSC 多能性的影响,他们使用优化的方案将 hiPSC-NSC 分化为混合神经元/神经胶质细胞群。仅用 Cas9 处理的细胞的分化导致与星形胶质细胞特化相关的通路上调(例如粘着斑、整合素-受体相互作用、ECM 组织、脂肪生成),而在 14 天分化期间,SREBP1 缺乏的细胞中神经元相关通路发生激活。事实上,SREBP1 缺乏的神经元/神经胶质细胞培养物的特点是神经元基因(DCX、β-微管蛋白 III、MAP-2)和相关通路(例如神经元分化和突触传递)的上调。同时,分化 7 天和 14 天后,与对照细胞相比,星形胶质细胞标志物 (GFAP、S100β、ALDH1L1) 的表达显著降低。转录组数据表明,SREBP1 缺陷的 hiPSC-NSC 的细胞组成与对照不同。免疫荧光分析证实了这一假设,结果显示,与对照相比(分化第 7 天和第 14 天),SREBP1 缺陷的 hiPSC-NSC 分化的神经元/神经胶质细胞培养物中 MAP2 +神经元的百分比相似, 但 S100β +和 GFAP +星形胶质细胞的百分比较少(图7H-I)。
为了评估 SREBP1 缺乏对 hiPSC-NSC 体内分化的影响,他们在免疫缺陷幼崽的侧脑室双侧移植了 SREBP1 缺乏的 hiPSC-NSC,使用仅用 Cas9 处理的细胞作为对照。然后他们在移植后 6 周分析了移植细胞的分化,因为在这个早期时间点预计会有相当大比例的神经元和神经胶质细胞。使用人类特异性抗体(hNuclei、STEM121、hMito)和细胞谱系特异性标记物进行的双重免疫荧光分析显示,SREBP1 缺乏会特异性地损害 hiPSC-NSC 的星形胶质细胞分化。移植了 SREBP1 缺陷细胞的动物表现出 S100β +星形胶质细胞的百分比降低,与对照细胞处理的小鼠相比,GSTπ +少突胶质细胞和 β-微管蛋白 III +神经元的百分比没有显著差异(图7J)。这些发现强调了SREBF1在星形胶质细胞分化同时维持其他神经细胞类型的生成中发挥的关键作用。
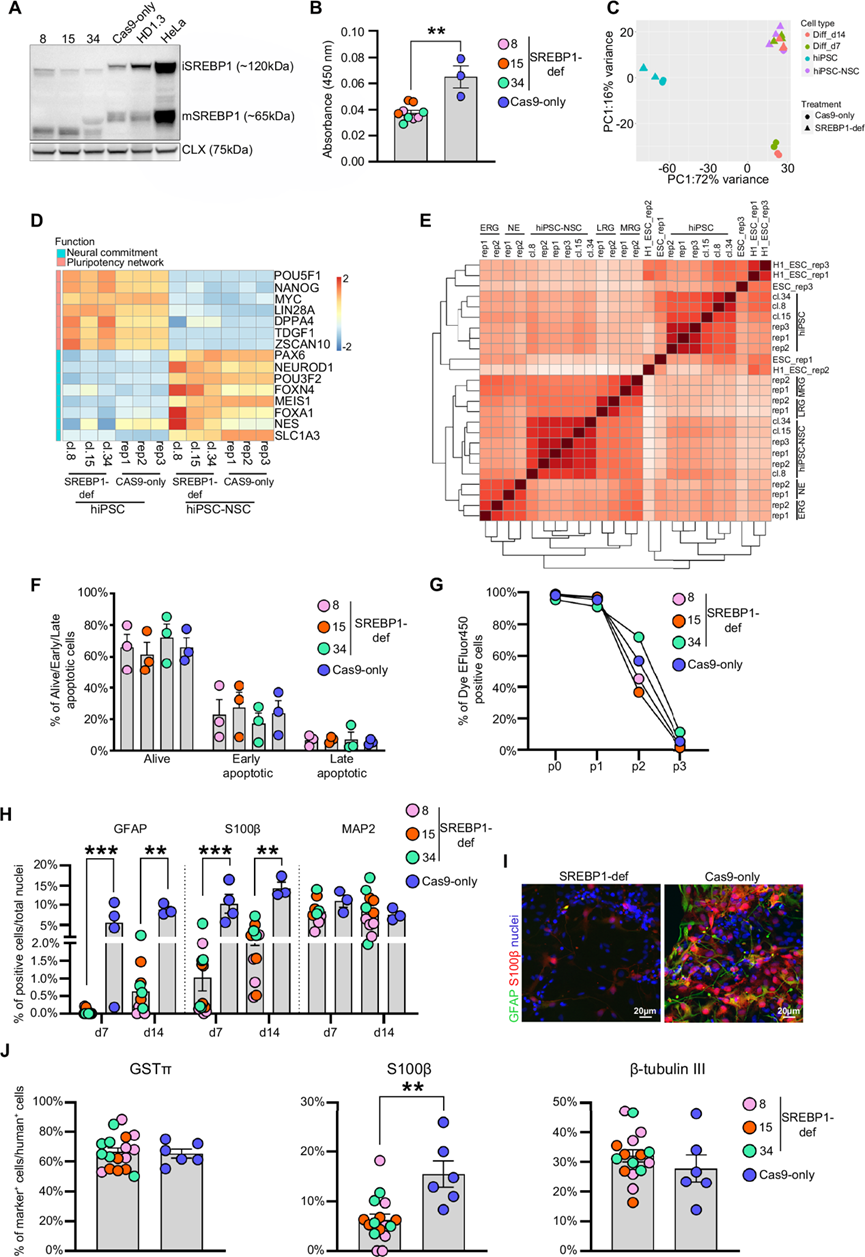
图7. SREBF1在 hiPSC-NSC 的星形胶质细胞分化中的作用。
(A) 免疫印迹分析。(B) 在 SREBP1 缺陷型(SREBP1-def)和仅 Cas9 处理的 hiPSC 中评估 SREBP1 活性。(C) 在 SREBP1 缺陷和 Cas9 仅处理的 hiPSC、hiPSC-NSC 和分化培养物(分化第 7 天和第 14 天)中收集的 RNA-seq 数据的 PCA 图。(D) 热图显示 SREBP1 缺陷和 Cas9 仅处理的 hiPSC 和 hiPSC-NSC 中多能性和神经特化的主要调节因子的表达水平。(E) 样本间距离热图。(F) Annexin V/7-AAD FACS分析用于评估srebp1缺陷和cas9缺失的hiPSC-NSC中活细胞和凋亡细胞的百分比。(G) 缺乏srebp1和仅cas9的hiPSC-NSC的FACS细胞增殖试验。(H) 表达星形胶质细胞(GFAP 和 S100β)和神经元(MAP2)标志物的细胞的定量。(I)代表性免疫荧光图像。(J) 特异性标记物(S100β:星形胶质细胞、GSTπ:少突胶质细胞、β-微管蛋白 III:神经元)的变化。
+ + + + + + + + + + +
结 论
本项研究证明 hiPSC-NSC 采用放射状胶质细胞相关特征,与hfNSC共有关键的表观遗传和转录特征,同时表现出与胶质母细胞瘤干细胞不同的特征。小鼠的长期移植研究表明 hiPSC-NSC 植入稳健而稳定,主要分化为胶质细胞,没有肿瘤形成的证据。此外,本研究还确定了SREBF1是 hiPSC-NSC 中星形胶质细胞分化的调节因子。
+ + + + +



 English
English


