文献解读|Genome Biol(10.4):多组学揭示了乳酸化驱动的调节机制促进口腔鳞状细胞癌的肿瘤进展
✦ +
+
论文ID
原名:Multi-omics reveals lactylation-driven regulatory mechanisms promoting tumor progression in oral squamous cell carcinoma
译名:多组学揭示了乳酸化驱动的调节机制促进口腔鳞状细胞癌的肿瘤进展
期刊:Genome Biology
影响因子:10.4
发表时间:2024.10.15
DOI号:10.1186/s13059-024-03383-8
背 景
口腔鳞状细胞癌 (OSCC) 是一种源自口腔黏膜鳞状上皮细胞的恶性肿瘤,约占全球所有口腔癌病例的 90%。OSCC 的发病机制复杂,涉及遗传和环境因素的相互关联。已清楚的是,OSCC 起源于口腔黏膜鳞状上皮的逐渐恶性转化,最终导致癌症发展。口腔白斑 (OLK) 是口腔黏膜中最常见的潜在恶性病变。然而,驱动 OLK 发展为 OSCC 的机制仍然不太清楚。OSCC 的治疗策略包括手术切除、放疗和化疗,其中手术切除是主要干预措施。通常,手术会结合放疗和化疗,以降低复发和转移风险。研究口腔癌中驱动肿瘤发生的蛋白质表达模式对于制定有效的预防和治疗策略至关重要。此类研究将使患者能够根据个人情况制定个性化治疗方案。
实验设计
结 果
01
OSCC 进展过程中蛋白质整体乳酸化的改变
免疫组织化学染色显示,与正常邻近组织 (NAT) 相比,OSCC 组织中的乳酸化水平显著升高。OSCC 的恶性程度与乳酸化程度之间存在直接相关性;随着恶性程度的增加,乳酸化水平也上升(图 1 a)。使用苏木精和伊红染色确定 OSCC 组织和 NAT 的类型,确保准确的组织分类。免疫印迹分析检测了 OSCC 组织和 NAT 中的乳酸化水平,显示肿瘤组织中的乳酸化显著增加(图 1 b)。为了鉴定 OSCC 组织和 NAT 之间乳酸化水平显著不同的蛋白质,研究团队进行了蛋白质组和乳酸组分析。样品质量评估表明,肿瘤组织存在很大的异质性,不同样本组间差异显著(图 1 c)。样品分布图表明样品质量很高(图1 d)。基于每组内重复样品定量值的相对标准偏差 (RSD) 表明组内定量重现性一致(图 1 e)。样品酶消化后进行产品检测显示,大多数肽片段带有 2-3 个电荷,肽片段长度为 7-20 个氨基酸,与蛋白质组学质量控制中的典型结果一致(图1f)。综合分析鉴定出了 1033 种蛋白质上的 2765 个乳酸化位点,表明 OSCC 中广泛存在乳酸化(图 1 g)。检测这些修饰位点的基序特征,分析所有已识别修饰位点上游和下游的肽序列(10 个氨基酸),揭示了修饰位点附近氨基酸频率的变化(图 1 h)。
对所有具有有效定量数据的乳酸化位点进行差异分析,筛选标准为P值 < 0.05,显著上调定义为差异倍数(FC)超过 1.5,显著下调定义为FC小于 1/1.5。共鉴定出 329 种蛋白质上的 642 个乳酸化位点,其中 554 个位点乳酸化增加,88 个位点乳酸化减少(图 1 i)。这一发现符合预期,因为肿瘤组织中存在Warburg效应,导致乳酸与正常组织相比积聚。蛋白质表达和乳酸化水平的差异分析结果以火山图的形式可视化(图 1 j-k)。相应的定量数据以热图形式呈现(图 1 l-m),显示与 NAT 相比,OSCC 中的蛋白质表达水平既有上调也有下调,且乳酸化水平明显普遍上调。
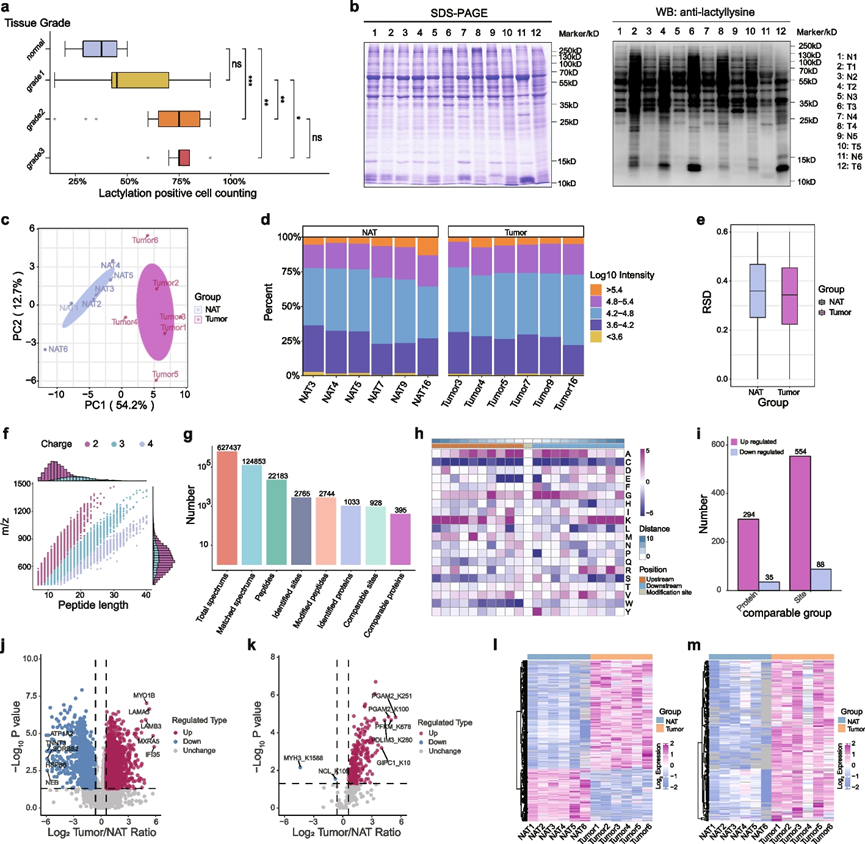
图1. 口腔鳞状细胞癌(OSCC)的乳酸化水平明显高于正常邻近组织(NAT)。
(a) 不同OSCC等级之间的乳酸化水平。(b) Western blot分析测定了OSCC和邻近正常组织的乳酸化水平。 (c) PCA分析。(d) 样本分布图说明了组内和组间数据的分散情况,横轴表示样本名称,纵轴表示百分比。(e) 基于每组内重复样本相对定量值的相对标准偏差(RSD)的箱线图。(f) 评估了消化蛋白质样品的肽长度和电荷分布。(g) 已识别的乳酸化位点和数据库检索后过滤的总蛋白质的摘要。(h) 所有已鉴定的赖氨酸乳酸化 (KLA) 蛋白的基序分析。(i) 条形图显示数据处理和阈值选择后差异蛋白和修饰位点的统计数据。(j-k) 火山图显示差异蛋白和乳酸化位点。(l-m) 热图显示不同样本中多个差异蛋白和乳酸化位点的相对表达水平。
02
乳酸化对口腔鳞状细胞癌生物学功能及相关信号通路的影响
为了全面阐明乳酸化在 OSCC 中的作用,他们研究了乳酸化所控制的分子机制。对蛋白质组学和乳酸化组学分析中的上调和下调数据集进行了功能富集和通路分析。结果表明,蛋白质组学功能主要涉及基因表达和细胞功能,例如基因表达的负调控、基因表达的正调控、细胞迁移、生物过程的调控和细胞过程的调控(图 2a)。相反,乳酸组富集主要包括细胞代谢,例如葡萄糖代谢过程、糖异生和烟酰胺腺嘌呤二核苷酸 (NAD+) 代谢过程。此外,乳酸化显著影响信号通路和细胞活动,包括 G 蛋白偶联受体信号通路、信号转导、细胞表面受体信号通路、细胞生长调节和细胞发育(图 2b)。为了确定不同FC的蛋白质之间的功能差异,这些蛋白质根据其FC分为四组,标记为Q1至Q4(图 2 c)。对每组进行GO分析和KEGG富集分析(图 2 d)。结果显示,除了影响代谢活性外,这些蛋白质还影响mRNA活性、蛋白质定位、信号转导和其他过程。
在通路富集方面,蛋白质组学和乳酸组学之间存在显著差异。与蛋白质组学富集结果不同,乳酸化富集结果显示甘氨酸、丝氨酸和苏氨酸代谢、Hippo 信号通路、T 辅助细胞 17 (Th17) 细胞分化、白细胞介素 17 (IL-17) 信号通路、糖酵解/糖异生和丝裂原活化蛋白激酶 (MAPK) 信号通路等通路的排名较高。这些通路主要集中在乳酸化修饰增强的区域(图 2 e-f)。关于差异结果,乳酸化修饰结果中高Q4 的比例与其他组相比显示出显著更大的幅度(图 2 g)。富集分析还强调了与肿瘤相关的功能和通路(图 2 h)。这表明,在 OSCC 的发生和发展过程中,乳酸化增加可能在这些通路中发挥关键的调节作用。

图2. 蛋白质组和乳酸组富集分析。
(a) 蛋白质组内差异蛋白的生物功能富集。(b)KEGG通路富集分析。(c)将差异表达蛋白分为四类。(d) 蛋白质的生物功能和 KEGG 富集结果。(e) 乳酸组内差异蛋白的生物功能富集。(f) 乳酸组内差异蛋白的 KEGG 通路富集。(g) 将差异表达位点分为四组。(h) 显示不同变化位点的生物学功能和KEGG富集结果。
03
乳酸化相关的表观遗传调控
为了全面阐明乳酸化在 OSCC 中的潜在生物学功能,他们研究了其上游调节作用。首先,OSCC 细胞系 CAL27 暴露于 10 mM 乳酸中 24 小时,导致治疗后乳酸化水平升高。随后,治疗组和对照组样品均使用泛抗乳酸化修饰抗体进行 CUT&TAG-seq,以及 ATAC-seq 和 RNA-seq 分析。这种方法为了解乳酸化相关的表观遗传调控、染色质可及性的变化以及高乳酸条件下基因表达的变化提供了见解。与对照组相比,乳酸处理组的 CUT&TAG-seq 和 ATAC-seq 结果显示,转录起始位点 (TSS) 附近的峰聚集,表明乳酸增强了转录过程。对 CUT&TAG-seq 和 ATAC-seq 数据进行单独的差异分析显示,差异识别的峰主要集中在启动子和远端基因间区域,表明乳酸化对转录调控有显著影响。差异 CUT&TAG-seq 结果的功能富集和 KEGG 通路分析进一步深入了解了受乳酸化相关组蛋白影响的功能和信号通路。富集的峰,无论是乳酸处理后上调还是下调,主要与细胞内代谢活性以及生物合成和基因表达等过程有关。通路富集分析表明,乳酸化相关组蛋白不仅显著影响代谢相关信号通路,而且显著影响磷脂酰肌醇-3-激酶/蛋白激酶B (PI3K/AKT)、缺氧诱导因子-1 (HIF-1) 和癌症相关信号通路。
为了阐明与乳酸化相关的表观遗传调控和染色质可及性相关的基因,他们对未处理对照组的 CUT&TAG-seq 和 ATAC-seq 数据进行了综合分析。位于 TSS 上游和下游 3 kb 范围内的峰定义为基因转录所必需的。三个数据集之间的重叠峰是相同的,维恩图可视化了这种重叠(图 3a)。交集显示 14518 个峰,其中乳酸化与染色质可及性呈正相关。仅在 TSS 和 CUT&TAG-seq 数据中出现但在 ATAC-seq 数据中不存在的峰(2390 个峰)与乳酸化呈负相关。仅存在于 ATAC-seq 数据中的 TSS 附近的峰总计 18164 个,表明染色质可及性与乳酸化无关,可能受到乙酰化等其他表观遗传机制的影响。这些峰用基因信息进行了注释。对乳酸处理样本的类似联合分析显示,乳酸化驱动的染色质可及性增加,同时其他染色质可及性机制上调(图 3b)。分析 CUT&TAG-seq 和 ATAC-seq 数据表明,乳酸处理不仅增加了乳酸化,还增强了染色质可及性(图 3c)。先前的报告表明,乳酸处理也可能提高乙酰化水平,可能有助于提高染色质可及性。
为了进一步研究与乳酸化和染色质可及性相关的基因所控制的下游功能,他们将上述正相关和负相关峰注释为基因。随后,根据这些基因在染色质中的富集强度进行单样本基因集富集分析 (ssGSEA),从而确定它们的潜在功能和相关信号通路(图 3d)。鉴于 CUT&TAG-seq 和 ATAC-seq 中正相关基因的数量明显多于负相关基因,并且考虑到乳酸化在促进 OSCC 发展中的肿瘤进展方面可能发挥主要作用,特别关注了由乳酸化驱动的癌基因表现出染色质可及性增加的机制。分析了 CUT&TAG-seq 和 ATAC-seq 样本中得分升高的正相关基因的富集通路。检索了这些通路中富集的乳酸化驱动基因,并与 CUT&TAG-seq、ATAC-seq 和随后的 RNA-seq 分析的差异结果相交叉。使用翻转图可视化结果(图 3 e),揭示了 217 个表达增加的乳酸化驱动基因,表明 OSCC 中存在受乳酸化影响的潜在致癌基因组。
对上述基因进行了实验验证。采用泛乳酸化抗体对 OSCC 组织和 NAT 进行染色质免疫沉淀-定量聚合酶链式反应 (ChIP-qPCR),以验证乳酸化驱动基因的转录状态(图 3f)。结果显示,与 NAT 样本相比,肿瘤组织中CASP3和TPR启动子近端的乳酸化修饰增加,这与测序结果一致。同时,预测了乳酸化驱动基因表达的基序序列信息。对从 OSCC 组织和配对 NAT 中提取的 RNA 进行 RT-qPCR,以验证选定的潜在致癌基因的转录改变(图 3g)。结果表明,与 NAT 相比,OSCC 中的CASP3、HSP90AA1、HSP90B1、TPR、RAS和CCND1显著上调,这与之前的分析一致。这表明这些关键基因可能受到乳酸化的影响,导致其表达上调。

图3. 乳酸化驱动的致癌基因集表达。
(a) 热图描述了口腔鳞状细胞癌 (OSCC) 细胞系 CAL27 在乳酸治疗前后乳酸化相关基因表达和染色质可及性的变化。(b) 乳酸化驱动基因表达水平与染色质可及性的相关性分析。(c) 暴露于高乳酸浓度的CAL27细胞中乳酸化驱动基因和染色质可及性的变化。(d) 通过单样本基因集富集分析(ssGSEA)分析乳酸化驱动基因和基因集与染色质可及性的正相关和负相关。(e) 通过靶向下切割和标签测序(CUT&TAG-seq)、转座酶可及染色质高通量测序(ATAC-seq)和RNA测序(RNA-seq)确定的与染色质可及性和差异表达基因正相关的乳糖化驱动基因集的交集分析。(f) 通过染色质免疫沉淀-定量聚合酶链式反应 (ChIP-qPCR) 验证 OSCC 组织中CASP3和TPR启动子区域乳酸化富集增加, 并预测可能受乳酸化影响的启动子序列。(g) 通过逆转录定量聚合酶链反应 (RT-qPCR)验证OSCC 组织中 CASP3、HSP90AA1、HSP90B1、TPR、RAS和CCND1的表达升高。
04
DHX9-146Kla 可能逆转 DHX9 对 OSCC 的抑制作用
已鉴定的 217 个乳酸化驱动的潜在致癌基因在口腔癌发生过程中表现出上调表达,可能与染色质结构开放有关,表明染色质解旋酶在口腔癌进展中起着关键作用。在口腔癌的致癌过程中,特定的解旋酶可能促进染色质开放,从而增强许多基因的表达。
在之前的工作中,人们开发了一种口腔癌致癌性的诊断模型,其中dexh-box解旋酶9(DHX9)已确定为一个关键成分。DHX9是一种多功能核蛋白,显著参与 RNA 加工、转录和翻译。对 DHX9 和致癌基因的蛋白质间相互作用网络分析显示,它与HIF-1A、TPR、MDM2和BRCA1等蛋白质直接相互作用,下游分子包括CASP3、KRAS、MAPK1、HSP90AA1和PIK3CA。测序结果表明,与 NAT 相比,OSCC 中DHX9的乳酸化水平显著增加。对DHX9蛋白质结构的进一步分析确定了赖氨酸 146 处的潜在乳酸化修饰位点(图 4 a)。
通过逆转录定量聚合酶链反应 (RT-qPCR) 和免疫印迹分析验证了 LEUK1(口腔白斑细胞系)和 CAL27(口腔腺鳞癌细胞系)细胞中 DHX9 的过度表达(图 4 b-c)。通过细胞计数试剂盒-8 (CCK8) 检测评估的细胞增殖表明,DHX9在两种细胞类型中过度表达均显著抑制,克隆形成检测证实了这一点(图 4 d-e)。使用划痕愈合和 Transwell 检测分析了 过度表达的DHX9对细胞迁移和侵袭的影响(图4 f-g),结果显示DHX9可有效抑制这些能力。为了验证这些结论,使用两种不同的载体在 LEUK1 和 CAL27 细胞中敲低DHX9,证实了敲低效率(图 4 h-i)。随后的CCK8和克隆形成实验表明, DHX9敲低后细胞增殖明显增加(图 4j-k),而划痕愈合(图 4l)和Transwell实验(图 4m)显示细胞迁移和侵袭增强。这些结果表明DHX9对OSCC的发生和发展具有抑制作用。

图4. DHX9 抑制 OSCC 的发生和进展。
(a) DHX9的蛋白质结构和潜在的乳酸化修饰位点。(b-c) 逆转录定量聚合酶链反应 (RT-qPCR)和免疫印迹分析 LEUK1 和 CAL27 细胞中 DHX9 过表达的表达。(d) 细胞增殖能力的变化。(e) 克隆形成试验以评估菌落形成能力的改变。(f) 检测细胞迁移能力的变化。(g) Transwell试验研究细胞迁移和侵袭能力的变化。(h-i) 分析 LEUK1 和 CAL27 细胞中下调的DHX9表达。(j) CCK8试验评估细胞增殖的变化。(k) 克隆形成试验评估菌落形成能力的改变。(l) 细胞迁移能力的变化。(m) Transwell实验检测量细胞迁移和侵袭能力的变化。
05
DHX9-146Kla功能分析
蛋白质组乳酸化测序数据确定了DHX9的 146 个赖氨酸残基处的乳酸化。为了研究DHX9乳酸化的功能影响,他们引入了 K146R(精氨酸)突变来抑制乳酸化,并引入了 K146T(苏氨酸)突变来模拟乳酸化。使用慢病毒,分别用对照质粒、野生型过表达质粒和两个突变质粒感染 LEUK1 和 CAL27 细胞。Co-IP 和免疫印迹分析证实了 K146R 突变体中的乳酸化水平降低,而 K146T 突变体中的乳酸化水平升高(图 5a)。CCK8 检测显示,与对照组相比, 野生型和突变型DHX9均抑制细胞生长,其中 K146T 突变体表现出的抑制作用弱于 K146R 突变体,尤其是在 CAL27 OSCC 细胞系中(图5b)。这些结果表明乳酸化的DHX9可能显著促进 OSCC 的发生。克隆实验进一步证明,抑制DHX9乳酸化会强烈抑制细胞增殖,而模拟乳酸化突变会逆转这种影响(图 5c)。最后,划痕愈合和 Transwell 检测表明,在过表达期间阻断DHX9乳酸化会显著抑制细胞迁移和侵袭,而模拟乳酸化会逆转这种抑制(图 5d -f)。他们还进行了 qPCR 检测,以评估CAL27 细胞系中CASP3、RAS、MAPK1、HSP90AA1和PIK3CA的表达水平。结果显示,在过表达DHX9乳酸化抑制载体(K146R 突变体)的细胞中,这些基因明显下调。相反,在含有乳酸化载体(K146T 突变体)的细胞中观察到基因表达明显上调。这些发现进一步证实了DHX9乳酸化在调节口腔癌细胞内这些致癌基因表达方面的关键作用。
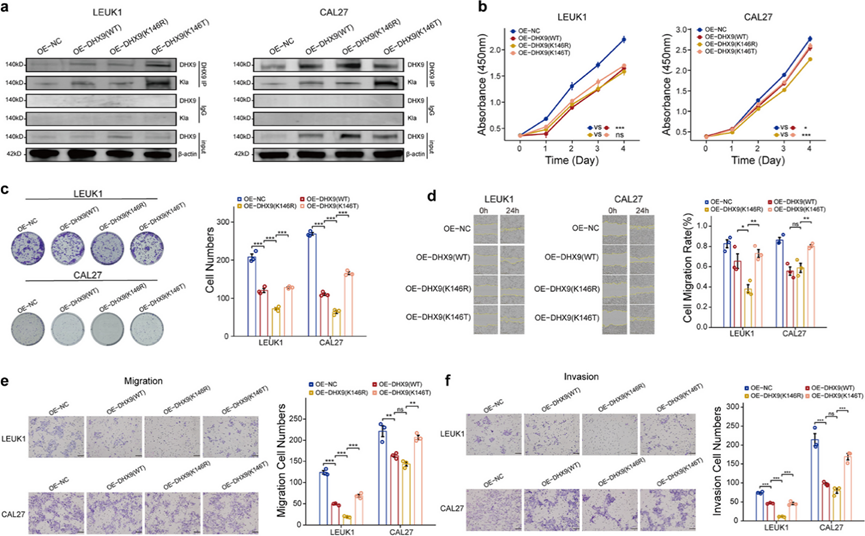
图5. DHX9-146Kla 逆转 DHX9 对 OSCC 的抑制作用。
(a) DHX9 表达和乳酸化水平。(b) DHX9乳酸化对细胞增殖能力的影响。(c) 克隆形成试验测量了DHX9乳酸化对菌落形成能力的影响。(d) DHX9乳酸化对细胞迁移能力的影响。(e-f) Transwell 实验确定了DHX9乳酸化对细胞迁移和侵袭能力的影响。
+ + + + + + + + + + +
结 论
本研究进行了全面的全蛋白质组、高通量乳酸组分析,以阐明与 OSCC 发展相关的乳酸化特征。利用一种综合方法,结合靶标下的切割和可及染色质的标记分析与高通量测序和 多组学分析(CUT&TAG-seq、ATAC-seq 和 RNA-seq),揭示了受乳酸化影响的 OSCC 进展的潜在调控网络。本项研究还表明,DHX9的 K146 位点的乳酸化修饰减轻了其对 OSCC 的抑制作用,促进了 OSCC 的发病和进展。此外,还提供了对乳酸化整体调控作用的初步见解,包括调节致癌基因表达和翻译后修饰 (PTM)。这些发现为未来的科学研究和临床应用奠定了基础。
+ + + + +



 English
English


