文献解读|Science(44.7):哺乳动物衰老过程中细胞群体动态的全景
✦ +
+
论文ID
原名:A panoramic view of cell population dynamics in mammalian aging
译名:哺乳动物衰老过程中细胞群体动态的全景
期刊:Science
影响因子:44.7
发表时间:2024.11.28
DOI号:10.1126/science.adn3949
背 景
“链条的强度取决于其最薄弱的环节”这句格言非常适用于衰老过程。在不同器官的多样化细胞景观中,某些细胞类型的状态或群体会随着年龄的增长而发生重大变化。这些变化不仅影响生物体的整体功能,而且在与年龄相关的疾病的发生中起着关键作用。因此,对这些脆弱的细胞类型进行分类对于了解与衰老相关的病理的细胞基础和确定缓解与衰老相关的失调细胞群体变化的潜在干预措施至关重要。
实验设计
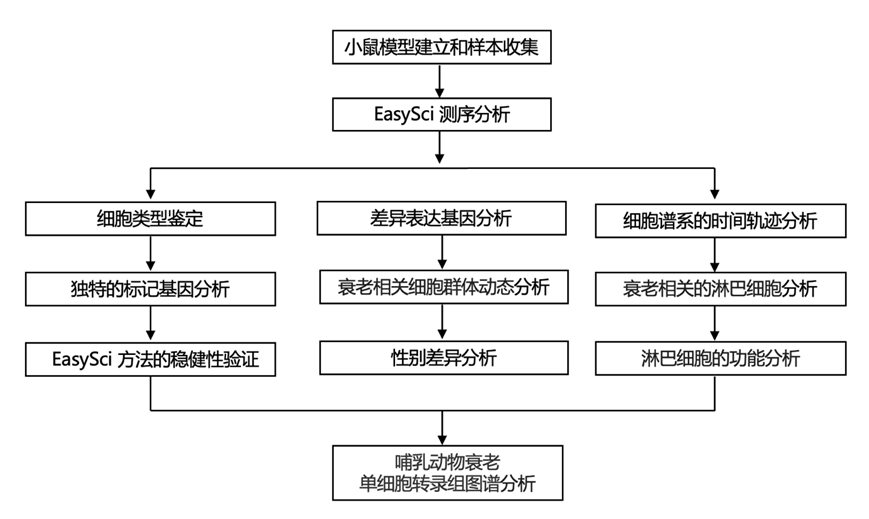
结 果
01
使用EasySci绘制生物体衰老的细胞图谱
研究团队开发了一种高通量单细胞组合(single-cell combinatorial indexing)测序技术 (EasySci),用于生物体规模的细胞群分析。EasySci具有全基因覆盖、高可扩展性和低成本的特点,单次就可以对超过 2000 万个细胞进行分析。他们广泛优化了细胞裂解条件,从不同哺乳动物器官的冷冻组织中提取高质量细胞核,有效减少了通常与传统组织消化和细胞分离方法相关的批次效应。通过索引逆转录、索引连接和索引扩增对提取的细胞核进行分选和条形码标记(图 1A),产生超过 2000 亿个原始读数。过滤掉低质量细胞和双联体后,恢复了 21786931 个单核基因表达谱。平均每个细胞检测到 1613 个独特转录本(唯一分子标识符:UMI),平均每个器官恢复 1562909 个细胞(最多:来自肾脏的 3767262 个细胞;最少:来自肌肉的 696410 个细胞)(图 1B)。值得注意的是,本研究数据集中检测到的每个细胞核的转录本数量低于Tabula Muris Senis (TMS)(中位数为 5930 UMI),这可能是由于测序深度和检测类型的差异造成的。
为了识别不同器官之间的异质性细胞状态,他们采用了与之前工作类似的两步法,首先对每个器官或组织的基因表达谱进行降维和聚类分析。除了之前在脑中鉴定出的 31 种细胞类型之外,他们还在 13 个不同的器官或组织中鉴定了 239 种器官特异性的主要细胞类型(图 1C)。每种主要细胞类型均在多次重复中鉴定,中位数为 15922 个细胞,范围从肾脏近端小管细胞的 2465275 个细胞到肌肉中成骨细胞的 6 个细胞。平均而言,每种主要细胞类型鉴定出 56 个独特的标记基因。标记基因的定义是:排名靠前和第二名的细胞类型之间的表达至少有 5 倍的差异,并且在目标细胞类型中每百万 (TPM) 的最低表达量为 50 个转录本。这些细胞类型的身份通过已发表的单细胞数据集中的细胞类型特异性基因标记物确认,并通过与已发表的小鼠细胞图谱的整合分析进行验证。值得注意的是,本研究平台的可扩展性有效地将批次效应降至最低,这种效应通常在传统的联盟级研究中整合多个实验室生成的单细胞数据集时出现。例如,来自不同个体的相同细胞类型(例如II 型肌核)在 UMAP 空间中表现出一致的聚类模式,无需批次校正。进一步的验证结合了来自不同器官/组织的所有细胞,证实了来自不同器官/组织的同一谱系(例如免疫或内皮谱系)的细胞也一致地聚集(图 1C),证明了本研究方法对批次效应的稳健性。
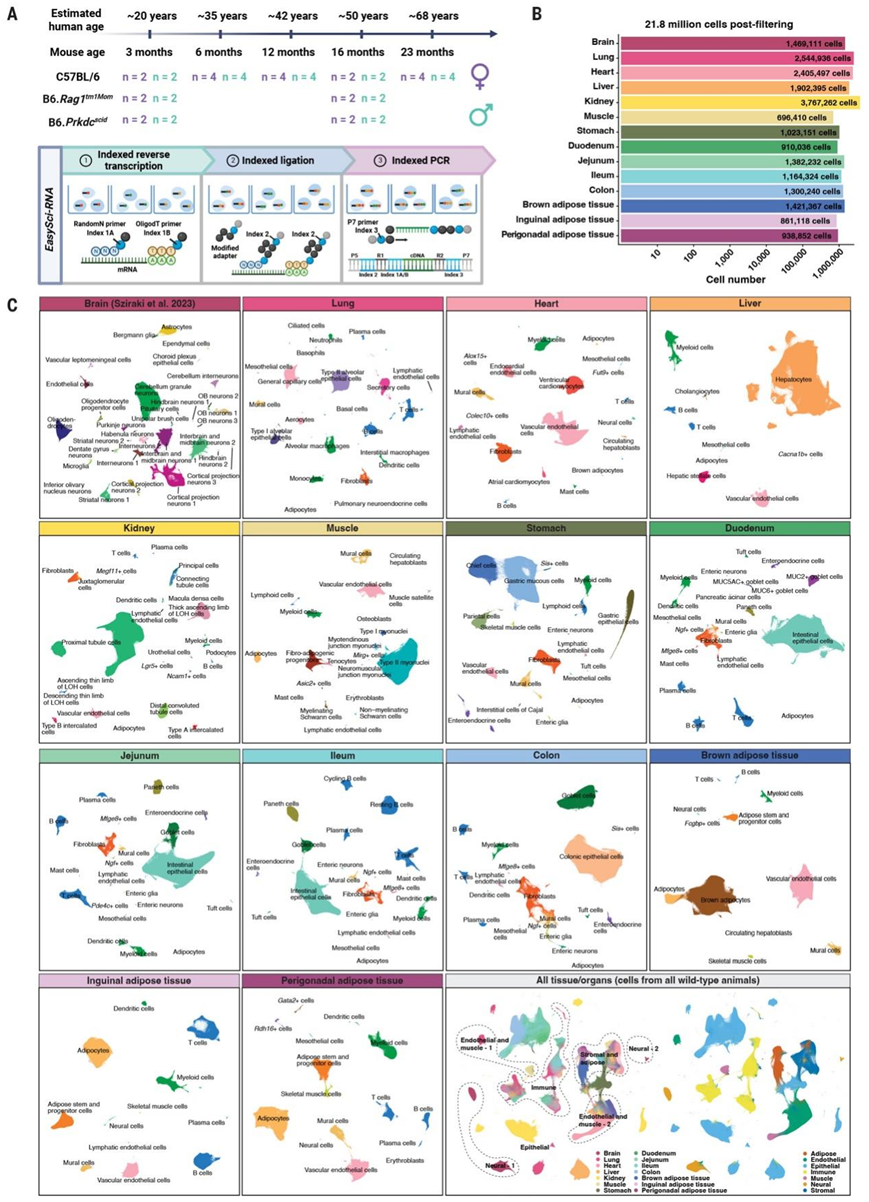
图1. 哺乳动物器官的实验设计和主要细胞类型注释概述。
(A)上:样本采集过程示意图,详细说明了研究中使用的各种年龄、性别和基因型(包括野生型和免疫缺陷小鼠)。下:流程图说明通过EasySci进行组合索引的scRNA-seq实验程序。(B) 对数比例尺条形图描绘了质量过滤后从每个器官或组织中分析出的高质量细胞数量。(C) UMAP 图显示每个器官/组织的细胞异质性,细胞按已识别的主要细胞类型用颜色编码。
02
与衰老相关的基因特征和细胞群体动态改变
为了全面了解衰老相关的基因特征和群体动态,他们首先对来自不同器官的 239 种主要细胞类型进行了差异表达基因 (DEG) 分析,并确定了随着衰老而上调或下调的细胞类型特异性基因。B 细胞和 T 细胞等免疫细胞显示出大量的 DEG,表明它们对衰老的脆弱性增加。十多种细胞类型共有的上调衰老相关基因主要参与免疫反应(例如B2M、C3、C7、C4b、Trim30a)、应激反应(例如Cdk8、Prkn、Mid1、Marcf3)以及 DNA 修复和染色质重塑(例如Hdac9、Runx2、Lrmda)。相反,下调基因在与昼夜节律调节有关的通路中富集,例如Arntl和Npas2。这种模式凸显了衰老组织中昼夜节律动态的改变,这与先前的研究一致,表明衰老过程中循环激素的节律性丧失。
为了研究与衰老相关的细胞群体动态,他们定量了不同年龄组的单个重复中主要细胞类型和亚聚类中细胞类型特异性比例,然后进行差异丰度分析,控制性别和每个重复的细胞数量。他们发现 23 种主要细胞类型和 374 个亚聚类在两个年龄段都发生了显著的群体变化:(图 2A)。除了少数可能与性别特异性细胞状态相对应的异常值外,这些变化在两种性别中均有观察到(图 2B-E)。令人欣慰的是,大多数主要细胞类型和亚聚类在两个间隔内都表现出强劲而一致的变化,在后续的分析中将其称为“衰老相关细胞群体”。此外,他们检测了每个与衰老相关的细胞群的标记基因的特异性,以确保所选的标记与已识别的亚聚类具有统计学意义和生物学相关性。

图2. 识别与衰老相关的跨器官/组织细胞群体转移。
(A) 点图说明 6 至 23 个月大之间细胞类型特异性分数变化。(B-E) 相关散点图比较雌性和雄性小鼠在两个年龄段中主要细胞类型和亚群的分数变化。
03
衰老相关细胞群分析
这些与衰老相关的细胞群在不同生命阶段表现出独特的动态模式(图 3A)。例如,多个器官中免疫细胞(包括淋巴细胞和髓细胞)显著的与年龄相关的扩增,这与先前研究的结果一致。某些与年龄相关的细胞类型在群体动态方面也表现出性别差异。例如,虽然男性和女性在衰老过程中骨骼肌中的Mirg+ 细胞都会减少,但女性的减少更为明显,可能是因为她们在年轻时的基线水平较高(图 3B)。这些细胞对应于肌肉肌核群体的一个罕见子集,其标志是几种 lncRNA(Meg3、Rian、GM37899和Mirg)的表达升高,它们均源自Dlk1 - Dio3基因座,包含哺乳动物中最大的 miRNA 超聚类(图3C-D),观察到的下降可以归因于与衰老相关的Dlk1-Dio3基因座的miRNA的下调,这些基因座对于线粒体的生物合成和活性氧化物质的保护至关重要,这表明细胞对衰老引起的压力的恢复能力下降。
为了更深入地研究整个生命周期中细胞群体的演变情况,他们接下来根据五个年龄阶段的细胞群体动态对所有与年龄相关的细胞亚群进行了聚类。这些亚群中有相当一部分在整个生命过程中经历了一致的变化。具体来说,他们确定了 174 个扩增的亚群、56 个耗竭的亚群和 50 个具有瞬时动态的亚群(图 3E)。利用本研究的多时间点数据集,辨别出不同细胞状态在细胞谱系和器官中变化的不同速度(图 3F-G)。为了进一步研究这些与衰老相关的细胞群体及其独特的分子标记,他们整合了来自持续扩张或消耗的亚群的所有细胞,以进行聚类和降维(图 3H)。
最初的两种细胞群动态模式主要表明细胞丢失(图 3I)。第一种动态模式持续 3 至 6 个月,其特点是BAT 中Gmpr + 活化的棕色脂肪细胞和肌肉中Bmpr1b+ Dkk2+ 肌腱细胞的减少(图 3K)。随后的模式从 6 个月延续到 12 个月,值得注意的是各个器官中 CD4+ 幼稚 T 细胞和Dlc1+ Spock1+ 肠道巨噬细胞的显著减少。作为肌肉退化的连续体,他们发现了肌肉中Flt1+ Shank3+ 肌腱细胞的减少和 gWAT 中Ttn+Neb+ 壁细胞的减少。在 gWAT 中的Akap13 +脂肪细胞中进一步观察到与年龄相关的脂肪减少。此外,这一时期的特点是多个器官的功能性上皮细胞减少,包括来自肌肉和结肠的Mirg+细胞、Cybrd1+胃粘液细胞,以及肾脏中的一系列上皮细胞(例如Zfp207 + 连接小管细胞、Sgcd + B 型插入细胞、Rbfox1+亨利环细胞的降支细肢、Opcml+足细胞和Tspan18 +主细胞)(图 3L)。
接下来的两种细胞群动态模式以细胞扩增为特征,主要是免疫细胞(图 3J)。第三个变化从 12 个月开始,主要表现为大多数 T 细胞亚型(例如 CD8+ Gzmk + 细胞毒性 T 细胞和 γδ T 细胞)、IgM+ 浆细胞、Tbx21+ 衰老相关 B 细胞以及来自髓系的各种细胞亚型[例如Blnk + Ccr5 + 肺泡巨噬细胞、Cxcr1+ Fstl1 + 肺泡巨噬细胞、Ccr7 + 迁移性树突状细胞、Col14a1+ 来自肾脏的巨噬细胞、Colq+来自肠道的巨噬细胞、Mcpt1+ Mcpt2 + 粘膜肥大细胞]的扩增性生长。此外,Pcdh15+ 肺成纤维细胞、Cyp7b1+ 肺淋巴内皮细胞、Col2a1+ 神经肌肉接头肌核、Cdc14a+ 肌腱接头肌核和肾脏中的某些上皮细胞(例如Dock10+ 近端小管细胞、Sntg1+ LOH 细胞的粗升支、Slco1a5+ 尿路上皮细胞、Fgf14+ 足细胞、Itga8+ 肾小球旁细胞和Nlgn1+远曲小管细胞)也显著激增(图 3M)。从 16 个月开始的后期扩张模式以免疫群体的大量扩增为特征,例如Pstpip2 + 衰老相关 B 细胞和单核细胞(图 3N)。
综上所述,这些连续的衰老群体动态描绘出一条轨迹,其中细胞耗竭先于扩增,时间重叠最小,表明在不同生命阶段控制细胞群体动态的不同机制。从 3 到 12 个月,主要在脂肪、肌肉和上皮细胞系等细胞谱系中观察到下降。相比之下,在生命后期,即 12 到 23 个月,各种免疫细胞的数量会大幅连续增加。这一进展与最近的研究一致,该研究记录了整个衰老过程中分子谱的连续变化,从而反映了不同生命阶段内部细胞群的非线性变化。
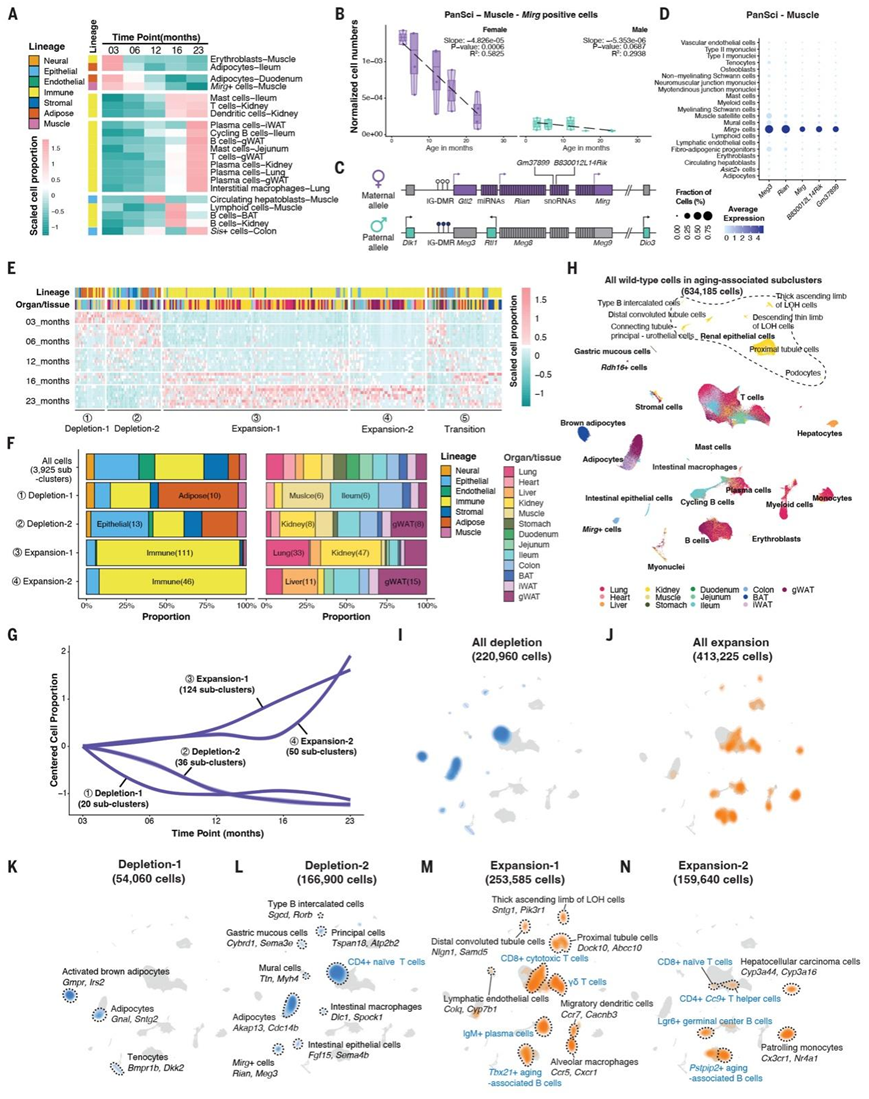
图3. 衰老相关细胞群的时间动态、组织分布和分子特征。
(A) 热图显示了五个生命阶段中与衰老相关的主要细胞类型的分数变化。(B) 箱线图描绘了不同年龄段雌性(左)和雄性(右)小鼠肌肉组织中标准化Mirg + 细胞计数的分数变化。(C) Dlk1-Dio3 基因座示意图,突出显示Mirg+ 细胞标记基因。(D) 点图显示PanSci肌肉数据集中的标记基因表达。(E) 热图显示指定年龄组内每个重复的衰老相关亚聚类的缩放比例。(F)堆叠条形图表示每个动态变化中不同谱系和器官/组织的衰老相关亚群的比例。(G)线图显示每个衰老动态中标准化的细胞比例变化,其中 Loess 回归线以初始年龄点为中心。(H)来自衰老相关亚群的 634185 个野生型细胞的 UMAP 可视化,按器官/组织着色。(I-N)密度图显示与衰老相关的亚聚类的分布。
04
淋巴细胞群的衰老相关动态
本研究泛器官数据集为系统探索广泛分布的细胞类型(特别是免疫细胞)中器官特异性衰老变化提供了独特的机会。为了研究 T 细胞和先天淋巴细胞 (ILC) 的衰老相关改变,他们首先分离了代表所有器官中这些细胞群的 957975 个细胞进行聚类和降维(图 4A)。总共回收了 18 个细胞聚类,每个细胞聚类都有高度细胞类型特异性的基因标记(图 4B)。虽然大多数细胞聚类广泛分布于各个器官,但一些免疫细胞表现出器官特异性定位(图 4C)。例如,表达穿孔素和颗粒酶的细胞毒性自然杀伤细胞主要存在于肺和白色脂肪组织中,而 2 型 ILC 则富集于包括肺在内的屏障组织和胃肠道的多个区域。作为性激素调节的关键免疫反应者,2 型 ILC 也富含于性腺周围的白色脂肪组织中。3 型 ILC 是粘膜免疫的中枢调节者,主要在肠道中检测到。
在研究 T 细胞亚群的衰老相关动态时,几乎所有随年龄增长而减少的 T 细胞聚类都可以追溯到 CD4+ 幼稚 T 细胞(图 4D)。这种趋势在不同器官中是一致的,与之前的报告一致(图 4E)。相反,与衰老相关的 T 细胞扩增跨越各种不同的细胞状态,包括 CD4+ T 滤泡辅助细胞(Dgki + Hs6st3 +)、CD4+ T 辅助细胞(Ccr9 + Cd6 +)、CD8+ Gzmk + 细胞毒性 T 细胞、CD8+ Pde2a+ Ly6c2+ T 细胞和 γδ T 细胞(图 4D)。虽然之前的研究中没有很好地表征 CD8+ Pde2a+ Ly6c2+ T 细胞,但其与年龄相关的扩增与骨髓和脾脏中 Ly6C 表达免疫细胞与年龄相关的激增的观察结果相一致。这种增加可能归因于这样一种现象,即增殖的幼稚 CD8+ T 细胞在没有特定抗原识别的情况下,作为对与年龄相关的炎症的全身免疫反应的一部分,采用 Ly6C 表达状态。此外,他们观察到 CD8+ Gzmk + 细胞毒性 T 细胞在各个器官中广泛扩增(图 4E),这与之前的研究一致,即老年小鼠中参与组织重塑的促炎分子(如颗粒酶 K)的与年龄相关的产生以及老年人血液中表达 GZMK 的 CD8+ T 细胞的丰富度更高。虽然这种 CD8+ Gzmk + T 细胞亚群的扩增发生在不同位置(例如肾脏、肺和脂肪组织),但其在肠道中的存在很少,肠道以 CD8+ Gzmb+ T 细胞亚群为主,表明肠道老化中存在独特的免疫环境。
通过分析 1072614 个全器官 B 细胞和浆细胞,他们检测到了 9 个不同的细胞聚类,每个细胞聚类都有独特的基因标记和器官特异性分布(图 4F-H)。IgA+ 浆细胞主要存在于消化系统中(图 4H),这与它们在产生免疫球蛋白 A 中的关键作用相一致,免疫球蛋白 A 是粘膜上皮抵御病原体和毒素的主要防御手段。在Fcgbp和ceacam1高表达的记忆 B 细胞亚群和表达Lgr6和Mid1的生发中心 B 细胞中也观察到了类似的器官特异性分布(图 4H)。IgGFc 结合蛋白(Fcgbp)是肠道内壁粘膜免疫的基础。相反,其他 B 细胞和 IgM+浆细胞分散在多个器官中,例如肺和脂肪组织(图 4H)。
与年龄相关的 T 细胞扩增同时,各种 B 细胞亚群在衰老过程中也显著扩增(图 4I)。与 B 细胞衰老的经典标志一致,他们鉴定出Zbtb32和Apoe表达增加的衰老相关 B 细胞 (ABC) ,它们在肺和脂肪组织中富集。通过整合来自多个器官的 B 细胞,他们发现了两种具有独特分子特征的不同 ABC 亚型。第一种亚型以Tbx21表达增加为特征,类似于先前报道的与小鼠狼疮样自身免疫相关的 B 细胞亚群。第二种与年龄相关的 B 细胞亚群显示Pstpip2表达升高,这是一种与巨噬细胞活化、中性粒细胞迁移和自身炎症疾病有关的因素(图 4J)。有趣的是,与年龄相关的 B 细胞亚型(例如,Pstpip2+ ABC)的扩增以性别特异性的方式发生,在女性个体中观察到更明显的增加。
同时,他们检测到与年龄相关的 IgM+ 浆细胞扩增(图 4J),以Xbp1、Dgkg和Igbm表达为标志。该亚型广泛存在于老年小鼠组织中,包括肝脏和脂肪组织(图 4H)。鉴于 IgM 是感染后产生的初始抗体,这表明衰老过程中的免疫反应特异性较低,与衰老相关的低度炎症相一致。此外,老年回肠的独特之处在于Mki67+ Mybl1+ 生发中心 B 细胞明显增加。肠道中不同 B 细胞和 T 细胞亚型与年龄相关的增殖凸显了其与其他实体非淋巴组织相比的差异化衰老过程,这可能是由于胃肠道固有层内不同的免疫环境造成的。他们进一步深入研究了这些扩增的 B 细胞群背后的分子程序。虽然细胞特征和起源器官各异,但它们具有相同的基因标记,如Sox5和Cdk14(图4K),均参与细胞周期和增殖,表明它们在驱动塑造免疫衰老的重塑过程中发挥着关键作用。
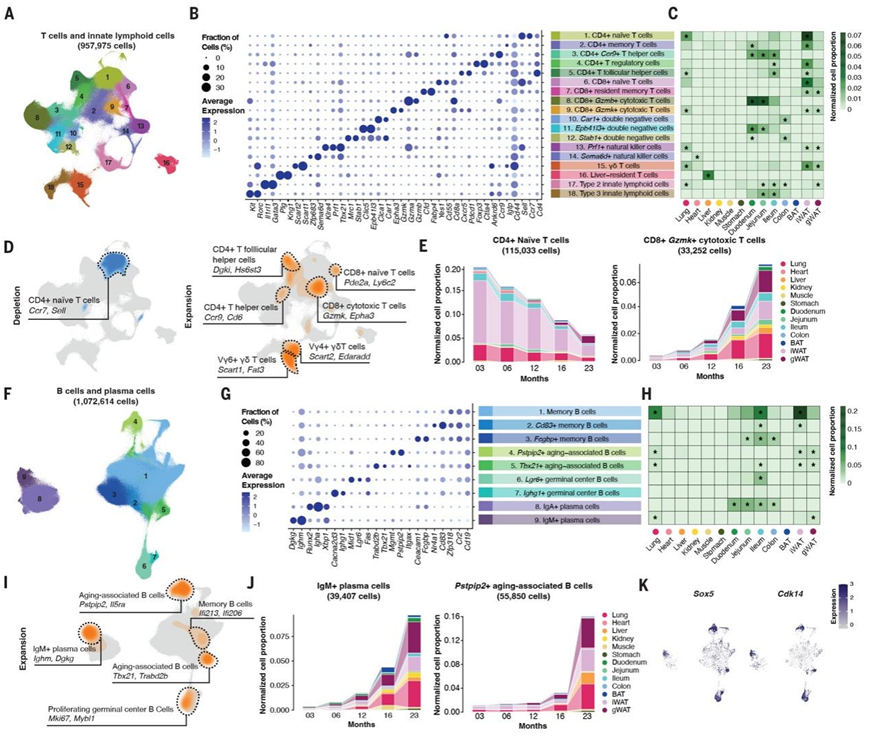
图4. 识别跨器官/组织与衰老相关的淋巴细胞。
(A) UMAP 可视化了各个器官/组织中的 957975 个 T 细胞和先天淋巴细胞 (ILC),并按聚类ID 着色。(B) 点图显示了 T 细胞和 ILC 亚型的标记基因表达。(C) 热图显示每个 T 细胞和 ILC 亚型在不同器官/组织中的归一化和缩放分布。(D) 密度图突出显示了衰老过程中显著减少(左)和扩增(右)的 T 细胞和 ILC 亚聚类的分布,以及它们各自的标记基因。 (E) 堆叠条形图描绘了野生型细胞中每个器官/组织内CD4+ 幼稚 T 细胞(左)和 CD8+ Gzmk + 细胞毒性 T 细胞(右)的比例,按器官和年龄组标准化。(F) UMAP 可视化器官/组织中的 1072614 个 B 细胞和浆细胞,根据聚类 ID 着色。(G) 点图显示 B 细胞和浆细胞亚型的标记基因表达,颜色表示平均表达,点大小反映细胞表达百分比。(H) 热图说明器官/组织中每个 B 细胞和浆细胞亚型的标准化和缩放分布。所有五个年龄组的汇总细胞数量在每个组织内进行标准化,然后计算为组织间的比例。星号标记相对于其余组织在给定组织中的显著富集。(I) 密度图显示与衰老相关的 B 细胞和浆细胞亚聚类的分布,随着衰老而显著扩增,并用不同的标记基因注释。(J) 堆积条形图显示每个野生型器官/组织中 IgM+浆细胞(左)和Petpip2 +衰老相关 B 细胞(右)的扩增。(K) UMAP 可视化显示Sox5和Cdk14在扩增的 B 细胞和浆细胞群中广泛表达。
05
淋巴细胞缺乏对调节衰老过程的影响
为了了解淋巴细胞对衰老过程中细胞群动态的影响,他们采用了一种“敲减”方法,使用两种特定的免疫缺陷基因型靶向哺乳动物体内的淋巴细胞:B6.129S7-Rag1tm1Mom/J 和 B6.Cg-Prkdcscid /SzJ。这些模型因缺乏功能性或成熟的淋巴细胞而受到认可。为了验证这些模型中的淋巴细胞缺陷,他们将两种突变体的主要细胞群与年龄匹配的野生型对照(3 个月大)进行了比较。正如预期的那样,减少的细胞群主要是淋巴细胞,包括各个器官中的 B 细胞、T 细胞和浆细胞(图 5A)。
除淋巴细胞外,他们还观察到两种免疫缺陷突变模型中肠道特异性Mfge8+ 滤泡树突状细胞 (FDC) 明显减少。这种下降趋势在各个解剖部位(即十二指肠和空肠)和各个年龄阶段都一致(图 5B)。FDC 因其在 B 细胞活化和抗体成熟中的关键作用而受到认可,是肠道初级滤泡和生发中心趋化因子Cxc13的主要产生者。这种趋化因子与 B 细胞特异性受体Cxcr5协同作用(图 5C),在滤泡内的 B 细胞定位中起着至关重要的作用,并且对于确定包括淋巴结和派尔集合淋巴结在内的次级淋巴组织结构至关重要。在缺乏成熟淋巴细胞的免疫缺陷模型中观察到 FDC 的减少,这表明 FDC 和成熟 B 细胞之间存在交叉依赖关系,其中淋巴细胞衍生的信号支持 FDC 的维持,反过来,FDC 维持肠基质内 B 细胞的存活和成熟。
接下来,他们根据两种免疫缺陷模型中的细胞动态对衰老相关细胞亚型进行了聚类(图 5D),重点关注在两种突变体中检测到并显示出一致改变的亚型。有趣的是,15 种与年龄相关的耗竭亚型和 33 种与年龄相关的扩增亚型在野生型和突变型模型中都表现出一致的模式,这表明它们的群体变化不是由淋巴细胞的参与直接引起的(图 5E-F)。代表性例子包括与衰老相关的Tspan18+ 肾脏主细胞的耗竭(图 5,I 和 J,以及图 S38A)、Pcdh15 + 肺成纤维细胞的扩增(图 5K-L)以及Nlgn1 + 肾脏连接小管 (CNT) 细胞(图 5M-N)。对这些细胞进行分子分析有助于深入了解衰老相关的器官功能障碍。例如,衰老耗竭的肾脏主细胞对应于一组祖细胞[例如Dach1、Tfap2b、Tspan18](图 5I),并显示出对钙稳态至关重要的基因表达升高[例如Cacnb4、Atp2b2]。这表明它们易受钙诱导的细胞应激影响,可能使它们易受与年龄相关的损伤和耗竭,这些结果强调了衰老过程中细胞变化的复杂相互作用,并提出了淋巴细胞直接相互作用以外的机制。
相比之下,其他与衰老相关的亚型在野生型和突变体之间呈现出不同的群体动态,表明存在免疫依赖性调节(图 5D)。这些亚型中有相当一部分(138 个中的 128 个)是淋巴细胞,受突变体中淋巴细胞耗竭的影响(图 5G-H)。例如,年轻突变体中的幼稚 T 细胞发生耗竭,表明存在发育缺陷。此外,正如预期的那样,大多数成熟淋巴细胞的扩增在老年突变体中是不存在的。他们观察到在两个突变体中都显示出改变的动态的几个非淋巴细胞细胞群。一个值得注意的获救的细胞类型特异性扩增是Slco1a5 + 肾尿路上皮亚型(即尿路上皮细胞-14),其特征是表明免疫刺激的基因表达富集(例如Csf2rb)(图 5O-P)。同样,两种突变体中Colq+ 肺间质巨噬细胞的独特亚型(即间质巨噬细胞-3)的扩增均停止(图 5Q-R)。这种巨噬细胞亚型的特征是与淋巴细胞相互作用相关的基因(例如Cxcl13、Cxcl10),阐明了淋巴细胞在驱动其在衰老过程中扩增的关键作用。这些观察结果强调了淋巴细胞在调节这些细胞群动态方面的关键性作用。
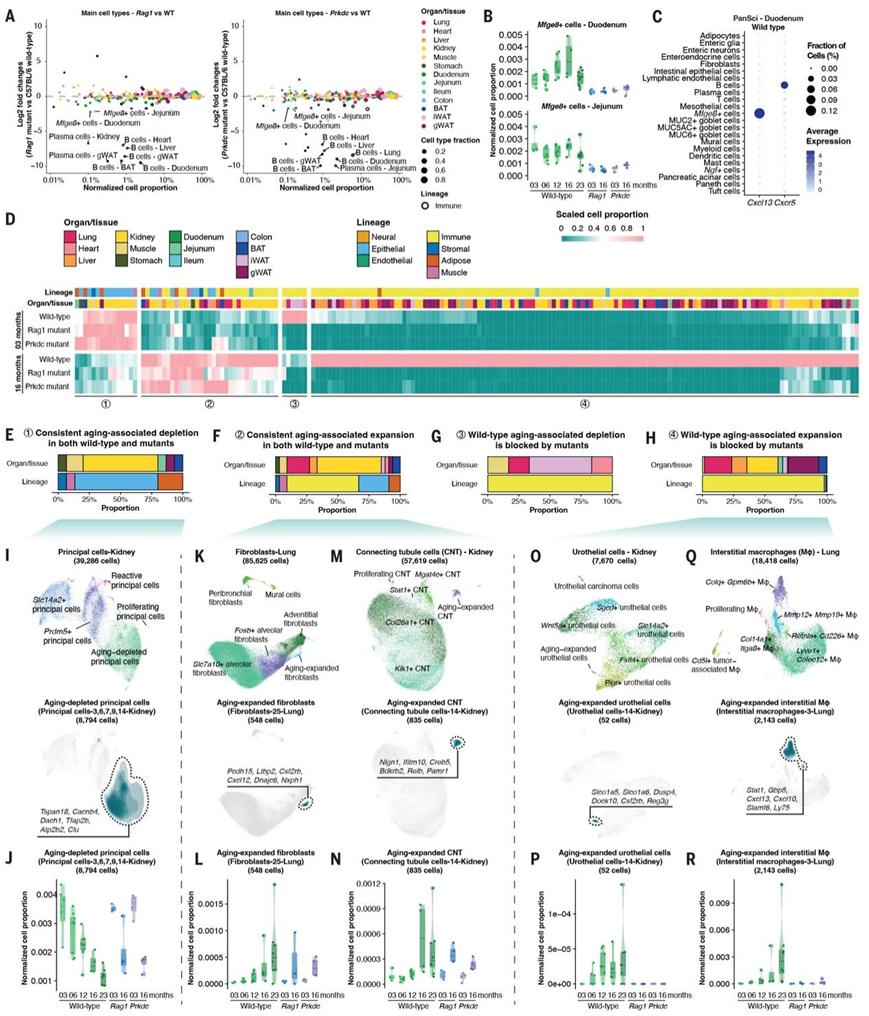
图5. 表征衰老过程中淋巴细胞依赖性细胞群的动态。
(A) 散点图比较 C57BL/6 野生型小鼠与Rag1(左)或Prkdc(右)突变体之间主要细胞类型的比例变化。免疫细胞谱系以黑色圆圈突出显示,并标记了显著变化。(B) 箱线图说明野生型和突变型小鼠在生命阶段中十二指肠(上)和空肠(下)中 Mfge8+细胞的比例变化。(C) 点图展示PanSci十二指肠数据集中Cxcl13及其受体Cxcr5的表达,按平均基因表达着色,并按表达这些标志物的细胞百分比调整大小。 (D) 热图可视化了C57BL/6 野生型和免疫缺陷突变体中 3 至 16 个月之间与衰老相关的亚聚类(如图 3所示)的分数变化,其中层次聚类揭示了四种不同的动态模式。(E-H) 堆叠条形图显示了每种动态模式中来自不同谱系和器官/组织的与衰老相关的亚聚类的比例。(I-J)肾脏主细胞案例研究:39286 个肾脏主细胞的 UMAP 可视化和密度图描绘了衰老耗尽的主细胞的分布和标记基因;箱线图详细显示了野生型和突变型小鼠在不同生命阶段中衰老耗尽的主细胞的群体变化。(K-L) 肺成纤维细胞案例研究:85625 个肺成纤维细胞的 UMAP 可视化和密度图描绘了老化扩增的肺成纤维细胞的分布和标记基因;箱线图详细列出了野生型和突变型小鼠在不同生命阶段中老化扩增的肺成纤维细胞的群体变化。(M-N) 肾连接小管细胞案例研究:57619 个肾连接小管细胞 (CNT) 的 UMAP 可视化和密度图显示老化扩增的 CNT 的分布和标记基因;箱线图详细列出了野生型和突变型小鼠在不同生命阶段中老化扩增的 CNT 的群体变化。(O-P) 肾脏尿路上皮细胞案例研究:7670 个肾脏尿路上皮细胞的 UMAP 可视化和密度图显示老化扩增的尿路上皮细胞的分布和标记基因;箱线图详细表示野生型和突变型小鼠在不同生命阶段老化扩增的尿路上皮细胞的群体变化。(Q-R) 肺间质巨噬细胞案例研究:18418 个肺间质巨噬细胞的 UMAP 可视化 [(Q),上] 和密度图显示老化扩增的间质巨噬细胞的分布和标记基因;箱线图详细表示野生型和突变型小鼠在不同生命阶段老化扩增的间质巨噬细胞的群体变化。
+ + + + + + + + + + +
结 论
本项研究分析了来自 623 个小鼠组织的不同生命阶段、性别和基因型的 2000 多万个细胞。这个全面的数据集揭示了 3000 多种独特的细胞状态和 200 多种与衰老相关的细胞群。该全景分析揭示了生命周期进展过程中器官、谱系和性别特异性的细胞动态变化。此外,本研究确定了与衰老相关的免疫细胞群的系统性和器官特异性改变,并进一步探讨了免疫系统对衰老的调节作用,还确定了淋巴细胞依赖性的特定年龄相关细胞群扩增。“细胞组学”策略增进了对细胞衰老的理解,为探索衰老和衰老相关疾病中复杂的细胞调控网络奠定了基础。
+ + + + +



 English
English


