文献解读|Cell Metab(27.7):肠道微生物群落和代谢物之间的相互作用调节泛癌免疫治疗反应
✦ +
+
论文ID
原名:Interplay between gut microbial communities and metabolites modulates pan-cancer immunotherapy responses
译名:肠道微生物群落和代谢物之间的相互作用调节泛癌免疫治疗反应
期刊:Cell Metabolism
影响因子:27.7
发表时间:2025.02.04
DOI号:10.1016/j.cmet.2024.12.013
背 景
癌症免疫疗法通过利用免疫系统的力量,在癌症治疗中具有巨大前景。采用了各种策略,包括针对特定蛋白质的抗体,例如细胞毒性 T 淋巴细胞蛋白 4 (CTLA-4)、程序性细胞死亡蛋白 1 (PD-1) 和程序性死亡配体 1 (PD-L1),这些蛋白质都称为免疫检查点。虽然免疫检查点阻断 (ICB) 疗法,尤其是抗 PD-1 和抗 CTLA-4 等联合疗法,已显示出明显的抗肿瘤作用,但只有一小部分患者(不同癌症类型中约 20%-40%)表现出显著的反应。必须加强对预测 ICB 疗法临床益处的因素的理解。这种理解可以改进对可能产生积极反应的适当肿瘤类型和患者群体的选择。此外,它可以阐明新型免疫治疗方法背后的机制,并有助于决定使用单一药物疗法还是使用越来越多可用的各种组合疗法。尽管一些生物标志物(如肿瘤突变负荷、错配修复缺陷和 PD-L1 表达)显示出预测价值,但其预测能力有限。因此,寻找高预测性生物标志物来确定临床益处仍然具有挑战性。
实验设计
结 果
01
与抗 PD-1/PD-L1 治疗反应相关的独特微生物和代谢特征
为了探索影响免疫治疗临床结果的微生物因素,研究团队在附属机构中确定了患有各种癌症的合格患者。根据实体肿瘤反应评估标准 1.1 (RECIST 1.1) 分析患者对抗 PD-1/PD-L1 治疗的反应。本研究包括两个内部队列:队列 1 ( n = 165) 和队列 2 ( n = 138)。在两个队列中,分别约有 45% 和 38% 的患者(队列 1,n = 75;队列 2,n = 53)对抗 PD-1/PD-L1 治疗表现出积极反应。在两个队列中,应答者(Rs)与无应答者 (NR) 或最佳总体反应 (BOR)组在年龄、性别、体质指数 (BMI)、抗生素使用情况、癌症类型和既往化疗方面无统计学显著差异。在基线时从这些患者中获取粪便样本,尽可能对每个样本进行宏基因组测序和靶向代谢组学分析。除了本研究的内部队列外,他们还整合了其他四个样本量相对较大的抗 PD-1/PD-L1 队列的数据进行全面分析(图 1)。
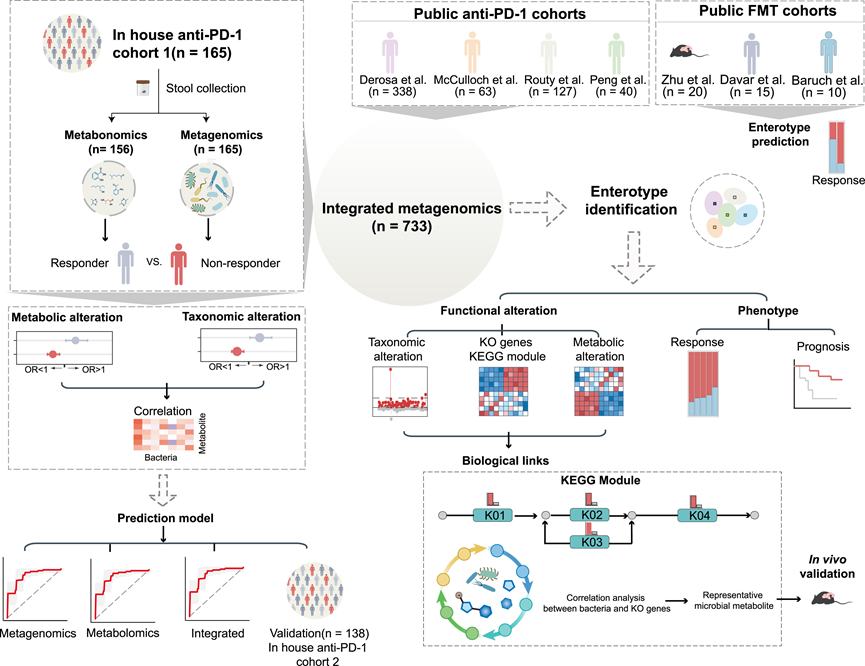
图1. 本研究概述。
为了确定与抗 PD-1/PD-L1 疗法反应性相关的关键微生物和代谢特征,他们对队列 1 中的基线样本进行了广泛的多组学分析。首先,他们评估了潜在临床混杂因素对反应结果的影响,发现这些因素与物种组成没有显著关联(图 S1 A)。此外,他们观察到 R 和 NR 之间或 BOR 组之间的无进展生存期(PFS)存在显著差异(图S1B-C)。随后,他们进行了宏基因组测序检测了肠道微生物群落,发现 R 和 NR 在物种水平上的 β 多样性存在统计差异(图 2 A-B)。这种差异表明与反应相关的一定程度的组成变化,这一结论通过使用多变量逻辑回归进行差异丰度分析得到支持,该分析考虑了门和物种水平的临床因素。
在属的水平上,他们发现 11 个属与反应呈正相关,例如Butyricicoccus、Adlercreutzia、Allisonella、Candidatus和Clostridiales,而 7 个属与反应呈负相关,包括Klebsiella和Erysipelatoclostridium(图 S1 D)。在物种水平上进一步探索发现,74 种细菌与反应相关,其中 20 种可能有助于促进反应,主要为Adlercreutzia equolifaciens、Allisonella histaminiformans、Eubacterium ramulus、Holdemania filiformis、Blautia obeum/wexlerae、Faecalibacterium prausnitzii和Bacteroides massiliensis。相反,在与反应呈负相关的物种中,他们发现了两种属于克雷伯氏菌属的物种,包括肺炎克雷伯氏菌和密歇根克雷伯氏菌/产酸克雷伯氏菌(图 2C,图S1E)。
值得注意的是,其中一些细菌此前已与临床反应有关。例如,大量的Faecalibacterium prausnitzii与黑色素瘤对抗 CTLA-4/PD- 1疗法的良好反应有关。此外,在多个队列中,PFS 较长的患者在接受免疫治疗后,其基线丰度较高的Allisonella histaminiformans。1Adlercreutzia equolifaciens是一种在对药物有反应的黑色素瘤患者中富集的细菌,它能产生雌马酚,已知雌马酚能激活 T 细胞受体 (TCR) 并刺激雌激素受体 β 磷酸酪氨酸转换,从而增强抗 PD-1 疗法的有效性。此外,他们还发现Eubacterium ramulus和Blautia obeum/wexlerae在对药物有反应的黑色素瘤患者中富集,并且与更长的生存期有关。相反,他们也注意到与先前研究的差异,例如肺炎克雷伯菌,在先前的研究中,它在黑色素瘤 R 中占主导地位,但与本研究队列中的反应呈负相关。虽然存在这些差异,但本研究结果发现了可能与临床反应相关的潜在候选者。
考虑到代谢物作为连接宿主和肠道菌群的介质发挥着至关重要的作用,他们旨在研究基线抗 PD-1/PD-L1 治疗前 Rs 和 NR 之间粪便代谢物的差异。对整体代谢概况的分析突出了这两组之间的明显差异(图 2D)。随后的统计比较确定了与反应相关的特定代谢物(图 2E),揭示了 16 种代谢物与反应正相关,例如 D-核糖、黄素腺嘌呤二核苷酸 (FAD)、3-氨基-4-羟基苯甲酸酯和蛋氨酸亚砜亚胺,而五种代谢物,包括戊二酰肉碱、4-乙酰氨基丁酸、麦芽三糖、嘌呤和 PAGln,与治疗呈负相关。
此外,他们考虑了抗生素使用对这些改变的细菌和代谢物的影响,进行了偏相关分析,结果显示,Rs 升高的细菌与代谢物之间普遍呈正相关,而 NR 富集的细菌与 Rs 富集的代谢物之间呈负相关(图 2 F)。值得注意的是,蛋氨酸亚砜亚胺与真杆菌呈正相关,而真杆菌也与维生素 B2 呈正相关。有趣的是,研究发现,维生素 B2 的微生物合成途径产生的代谢物可刺激肠道和呼吸道中粘膜结合 T 细胞活化,促进组织修复反应,并有助于维持上皮屏障完整性。NR相关代谢物戊二酰肉碱与 NR 相关细菌链球菌种(如S. timonensis、S. gordonii和S. dysgalactiae)呈正相关。在 PAGln 和克雷伯氏菌种(包括肺炎克雷伯氏菌和密歇根克雷伯氏菌/产酸克雷伯氏菌)之间可以观察到类似的趋势。这些关联表明,肠道微生物组介导的免疫疗法增强反应可能依赖于细菌群落或其共同代谢物的共同作用,而不是单个细菌或代谢物的孤立作用。
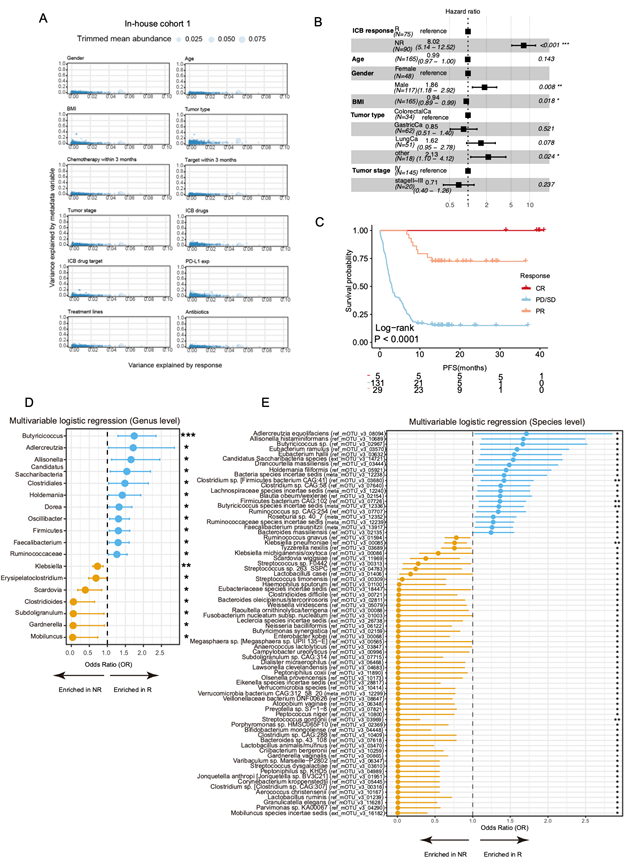
图S1. 队列1中应答者和无应答者之间肠道微生物组的变化。
(A)人口统计。(B) 调整年龄、性别、BMI、肿瘤类型和肿瘤分期等临床因素后,Cox多因素回归分析显示内部队列1的ICB疗效结果。(C)生存分析。(D-E) 森林图显示反应者和非反应者之间差异富集的细菌属和物种。
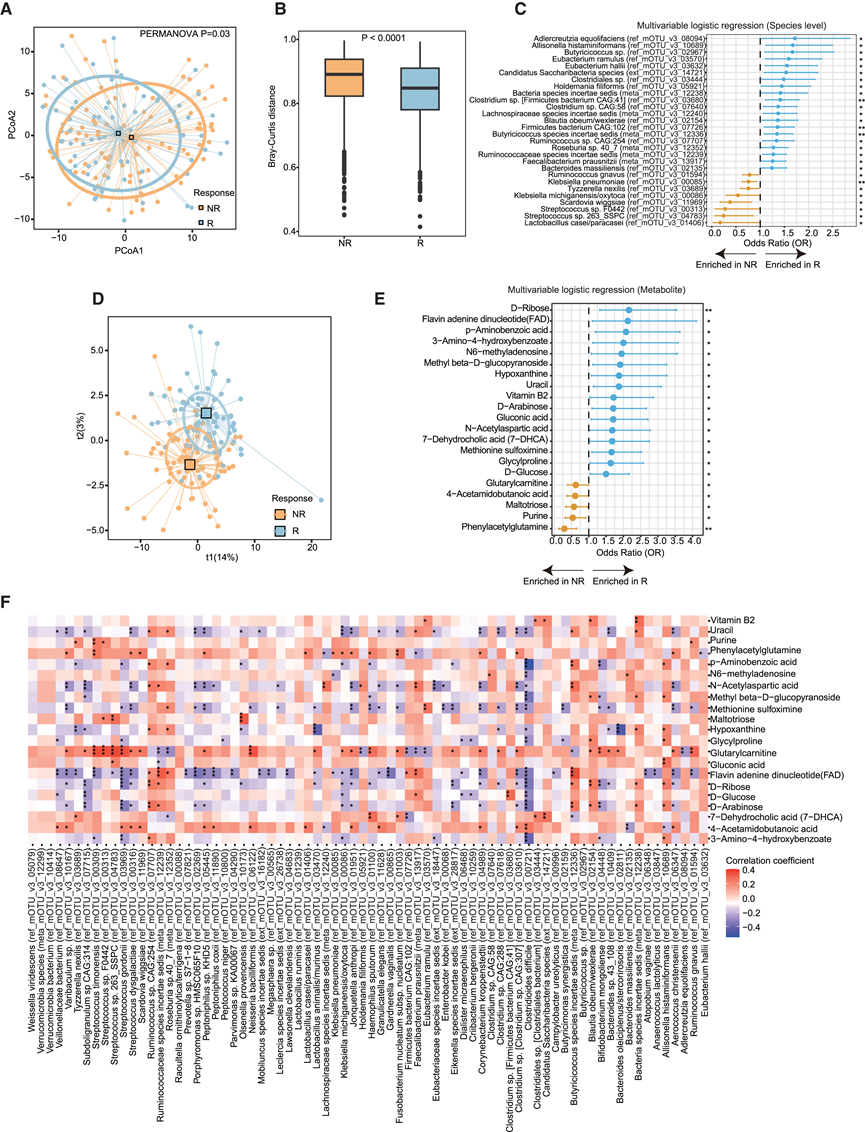
图2. 队列 1 中 Rs 和 NRs 肠道微生物组和代谢物的变化。
(A) PCoA 图显示 R 和 NR 之间的 beta 多样性差异。(B) 箱线图比较 R 和 NR 之间的 Bray-Curtis 距离的差异。(C) 森林图显示 R 和 NR 之间细菌种类的差异。(D) 正交投影至潜在结构判别分析(OPLS-DA)得分图,显示 R 和 NR 之间的整体代谢组学概况。(E) 森林图显示 R 和 NR 之间差异富集的细菌代谢物。(F) 热图显示了考虑抗生素使用后改变的细菌和代谢物之间的偏相关性。
02
多组学特征预测抗 PD-1/PD-L1 治疗反应
之前,多项研究尝试开发基于微生物组的模型来预测 ICB 反应,但结果并不令人满意。然而,之前的研究表明,整合真菌和细菌数据可显著提高预测准确性。在本研究中,他们旨在评估与单独使用细菌相比,整合细菌和代谢组学数据是否可以进一步提高预测性能。为此,他们将四组已发表的抗 PD-1 治疗数据与本研究内部的 1 组数据相结合,共得到 733 个样本(图 3 A)。
首先,他们进行了差异分析,以鉴定整个综合队列中 Rs 和 NRs 之间具有统计差异的物种。随后,基于差异丰度物种构建了分层的 10 倍交叉验证随机森林 (RF) 模型。为了改进这些模型并选择最重要的特征,他们应用了迭代特征消除 (IFE) 步骤。最后,使用这组最佳核心特征开发了一个稳健的 RF 模型(图 3 A)。核心细菌特征集包含 17 个分类单元,由 IFE 从差异丰度物种库(视为生物标志物) 中选择出来,实现响应预测的曲线下面积 (AUC) 为 0.79(图 3 B)。具体而言,在核心特征中,11 个物种表现出 Rs 富集,而 6 个物种的 NR 富集增加。值得注意的是,Blautia obeum/wexlerae和Eubacterium ramulus是排名靠前的生物标志物,其次是Lactobacillus mucosae、Firmicutes bacterium CAG:114、Butyricicoccus sp.、Roseburia intestinalis、Actinomyces sp. ICM47、Bacteroides intestinalis、Actinomyces sp. oral taxon 448、Lactonifactor longoviformis和Clostridium sp. CAG:58,在 Rs 中显示出增加的丰度。相比之下,在 NR 中富集的排名最高的生物标志物是Hungatella hathewayi,其次是Ruthenibacterium lactatiformans、Klebsiella pneumoniae、Streptococcus anginosus、Coprobacterium cateniformis和Provencibacterium massiliense。为了评估在个别研究中确定的核心特征的普遍性和稳健性,他们进行了逐项研究的转移验证和留一数据集 (LODO) 验证,并进一步在内部队列 2 中进行了独立验证,其中 R 与 NR 或 BOR 组之间存在显著的生存差异,AUC 达到 0.78(图 3 C),表明其具有稳健的预测性能。
随后,他们试图研究基于粪便代谢物的模型是否能有效预测患者的反应,采用与细菌分析相同的策略,将其应用于队列 1 中鉴定的差异代谢物(图 2 E)。这种方法选出了一组具有最高预测能力的核心代谢物(图 3 D)。值得注意的是,7-脱氢胆酸 (7-DHCA) 成为排名第一的生物标志物,其次是麦芽三糖、维生素 B2、N-乙酰天冬氨酸、N6-甲基腺苷、葡萄糖酸、甲基 β-D-葡萄吡喃苷、蛋氨酸亚砜亚胺和 D-核糖。训练队列在区分 R 和 NR 时显示 AUC 为 0.80(图 3 E)。令人鼓舞的是,他们在队列 2 中验证了预测模型,实现了 0.79 的 AUC(图 3 F)。
此外,他们评估了结合细菌和代谢物的综合模型是否可以提高预测能力。采用类似的方法,确定了一组由 12 种细菌和 3 种代谢物组成的 15 个核心特征(图 3G)。该综合模型在队列 1 中显示出更高的 AUC 0.87,并在队列 2 中得到独立验证,AUC 为 0.88(图3H-I),这些发现强调了细菌和粪便代谢物在预测免疫疗法反应方面的潜在贡献。
除了评估临床反应外,患者生存时间也是评估免疫疗法益处的关键因素。因此,他们比较了基于细菌 RF 模型的预测 R 和 NR 之间的生存差异。正如预期的那样,核心细菌组对患者预后表现出很高的预测价值。细菌模型预测的 R 显示出比预测的 NR 更长的生存期,这由 Derosa 等人和 McCulloch 等人队列中的总生存期 (OS) 以及 McCulloch 等人和内部队列中的 PFS 证明(图 3 J)。
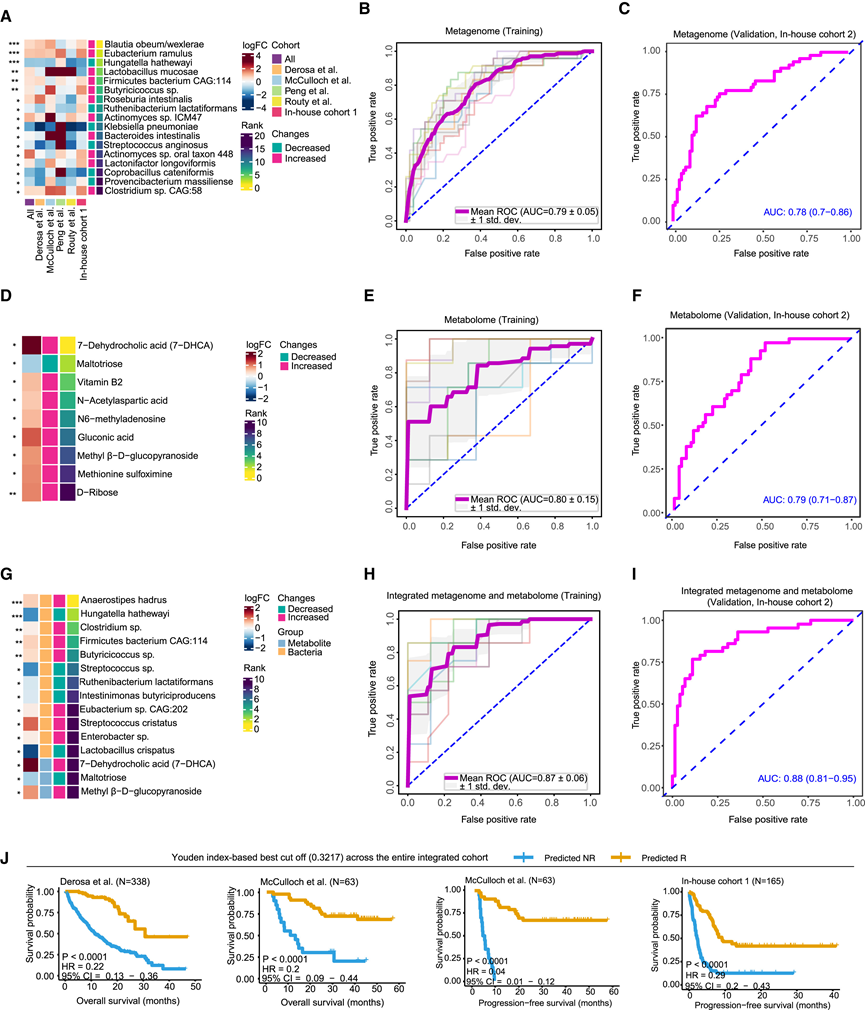
图3. 预测模型的核心特征与准确率。
(A,D,G) 热图显示考虑 R 与 NR 宏基因组学、代谢组学以及组合宏基因组学和代谢组学的核心特征。(B,E,H) ROC 曲线显示利用宏基因组学、代谢组学和综合宏基因组学和代谢组学的特征构建的用于响应预测的优化模型的 AUC。(C,F,I) ROC 曲线显示了第 2 组宏基因组学、代谢组学以及综合宏基因组学和代谢组学的预测性能。(J)生存分析。
03
肠道类型与抗 PD-1/PD-L1 治疗的反应和预后相关
人类肠道微生物群由多样、独特的生态群落组成,这些群落具有弹性,但会受到饮食、药物和生活方式选择等因素的改变。他们之前已确定了两种与患者年龄和对 ICB 的反应相关的肠型。最近的研究强调了基于细菌的预测模型在接受相同 ICB 治疗方案的队列中的稳健性,强调了在免疫治疗相关研究中考虑治疗方案的重要性,包括预测模型、潜在机制和肠型。McCulloch 等人确定了与黑色素瘤患者对抗 PD-1 治疗反应相关的肠型。然而,由于样本量有限,只确定了两种粗略的肠型。鉴于最近在健康人群中发现了更多独特的肠型(n = 5),他们试图确定在接受抗 PD-1 治疗的患者中是否存在潜在的相似肠型。为此,他们使用先前在细菌肠型发现中描述的围绕 medoid (PAM) 聚类方法进行聚类。分析显示,总共 733 个样本形成 5 个不同的聚类(即肠型),其 alpha 多样性(Shannon)存在显著差异(图4 A-B)。随后的差异分析揭示了这五种肠型中特定属的丰度存在差异:瘤胃球菌(肠型 1,E_Rumin)、大肠杆菌(肠型 2,E_Esch)、拟杆菌(肠型 3,E_Bact)、梭菌(肠型 4,E_Clos)和普雷沃氏菌(肠型 5,E_Prev)(图 4 C)。此外,物种水平的差异分析确定了每种肠型中的优势细菌。肠型 1 (E_Rumin) 富含瘤胃球菌(R. bromii和R. bicirculans)、Anaerostipes hadrus、Blautia obeum/wexlerae、Akkermansia muciniphila和Faecalibacterium prausnitzii等菌种(图 4D)。肠型 2 (E_Esch) 富含大肠杆菌,以及Alistipes finegoldii/onderdonkii和克雷伯氏菌属(K. pneumoniae、K. michiganensis/oxytoca)(图 4E)。肠型 3 (E_Bact) 主要富含拟杆菌属(B. dorei/vulgatus、B. uniformis、B. sartorii、B. thetaiotaomicron、B. caecimuris、B. fragilis)、Parabacteroides distasonis和Roseburia hominis(图 4 F)。肠型 4(E_Clos)以各种梭菌属和古菌Methanobrevibacter smithii为特征,而肠型 5(E_Prev)以普雷沃氏菌属为主,特别是Prevotella copri(图4G-H)。
鉴于 McCulloch 等人之前已确定了两种与黑色素瘤患者抗 PD-1 疗法临床反应相关的肠型,并提出它们在分布上存在地理差异,他们研究了研究中获得的五种肠型在国家和队列中的分布情况。有趣的是,当与抗 PD-1 疗法相关的表型相关联时,他们发现 E_Rumin 和 E_Bact 是两种 Rs 比例较高的肠型,并且与其他肠型相比,这些肠型的患者的 PFS 也明显更长(图 4 I-K)。
这些发现验证了鉴定接受抗 PD-1 治疗的患者的肠型的重要性,这表明患者固有的肠型不受 FMT 等干预措施的影响,但可能会影响他们对该治疗的反应。之前的证据表明,特定肠型衍生的 FMT 可以通过改变肠道微生物群和肿瘤微环境来增强抗 PD-1 治疗的疗效他们利用已建立的肿瘤小鼠队列,将它们分成接受来自不同供体的粪便菌群移植(FMT)的组。利用基于肠道微生物组组成的 PAM 分类器,他们为每只小鼠分配了肠型(图 4 L)。鉴于 E_ Eumin 和 E_Bact 肠型具有较高的缓解率和延长的 PFS,通过将样本归类为 E_Eumin/E_Bact 或 E_Others 来简化分析。值得注意的是,预测为 E_Eumin/E_Bact 的小鼠中很大一部分属于对抗 PD-1 疗法表现出高度敏感性的组(图 4 L)。为了在临床环境中验证这些结果,他们收集了两组黑色素瘤队列的数据,其中抗 PD-1 难治性患者在接受抗PD-1 治疗之前接受了 Rs 的 FMT。预测为 E_Eumin/E_Bact 的患者与预测为 E_Others 的患者相比表现出明显更高的缓解率(图 4 L)。
综上所述,这些发现表明,无论其自然状态如何或通过 FMT 进行的任何修改,肠型都有望成为对抗 PD-1 疗法反应性的指标。重要的是,对于表现出对抗 PD-1 疗法耐药性的患者,FMT 是一种有效的策略,可以将其肠道微生物组重塑为更易于接受抗 PD-1 的肠型(例如 E_Eumin/E_Bact),从而有可能恢复其对这种治疗的反应性。
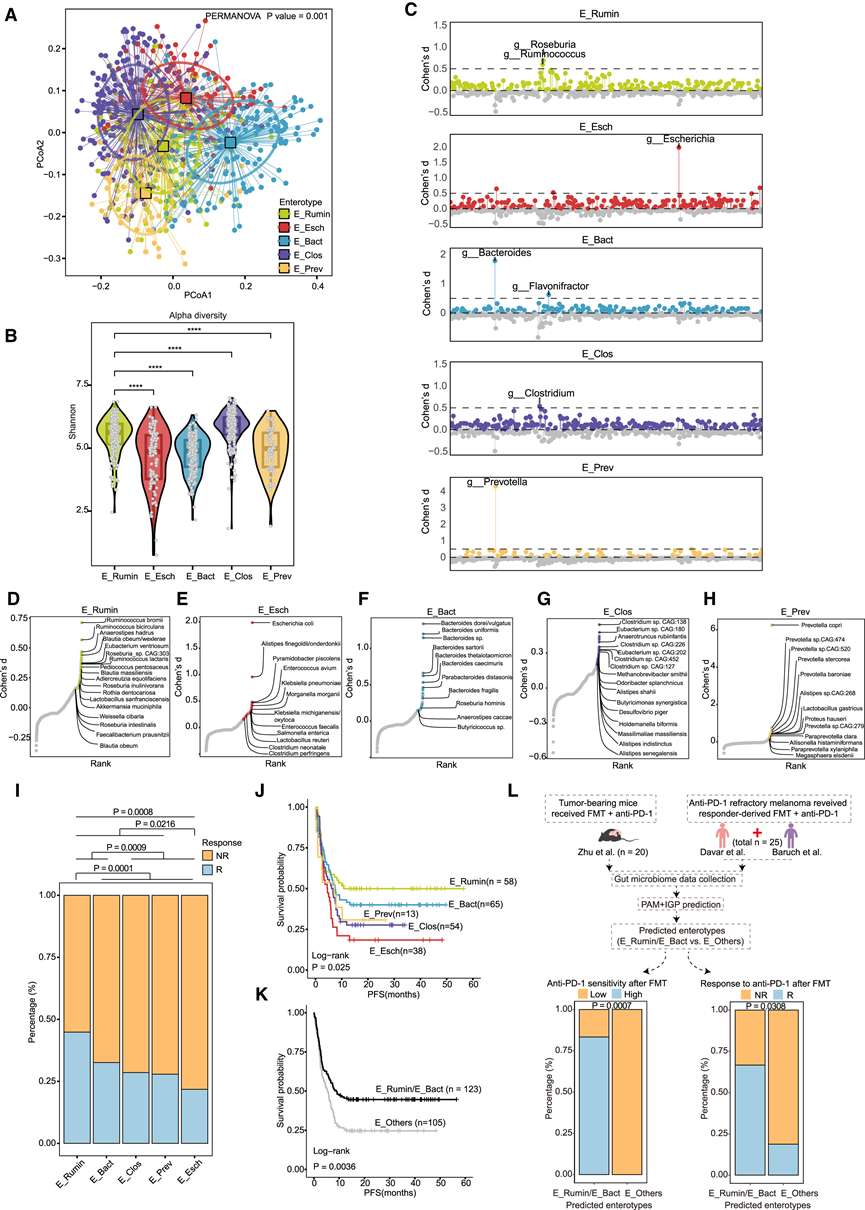
图4. 通过整合宏基因组学数据进行肠型鉴定。
(A) PCoA 图显示五种肠型之间的 β 多样性差异。(B) 肠型间 alpha 多样性 (Shannon) 的小提琴图。(C) 针状图显示每种肠型中占主导地位的属以及 Cohen's d 统计量。(D-H) 散点图显示每种肠型中物种水平的富集细菌。(I) 堆积图显示了R和 NR 在各种肠型中的分布偏好。(J-K)生存分析。(L) 接受 FMT 的小鼠和黑色素瘤患者的肠型预测。
04
不同肠型的微生物功能模块和代谢模式
为了研究不同肠型中微生物群落变化的功能意义,他们利用 KEGG 直系同源物 (KO) 谱对KEGG中的功能模块进行了注释。随后,通过与其他肠型进行比较,确定了每种肠型的差异富集模块(图 5 A)。他们发现 E_Rumin 富含氨酰 tRNA、苏氨酸、三酰甘油和海藻糖的生物合成以及硫酸盐、生物素和极性氨基酸的运输;E_Bact 富含四氢叶酸、泛酸、吡哆醛和异亮氨酸的生物合成以及组氨酸和亮氨酸的降解以及葡萄糖醛酸和糖醛酸代谢; E_Clos以产甲烷作用及古菌相关的RNA聚合酶、DNA聚合酶II复合物、外泌体为主;E_Esch富集腐胺、谷胱甘肽、牛磺酸等多种化学物质的运输过程以及酸、药物耐受性和抗菌肽抗性等;E_Prev富集多种复合物相关模块,以Skp1-Cullin-F-box(SCF)相关复合物为代表,并与E3泛素连接酶连接,表明E_Prev中蛋白质降解过程高度活跃。
为了阐明肠型与宿主代谢之间的潜在联系,他们比较了内部队列 1 中肠型之间的独特代谢模式(图 5B)。E_Rumin 表现出较高的苯胺-2-磺酸盐、天冬酰胺、牛磺酸和核苷酸或其类似物浓度,包括胞苷、鸟嘌呤、尿苷和脱氧胞苷。值得注意的是,天冬酰胺可通过改善淋巴细胞特异性蛋白酪氨酸激酶信号传导来激活 CD8+ T 细胞并增强抗肿瘤反应。此外,牛磺酸在调节肠道菌群方面发挥作用,并对肠道稳态的恢复产生积极影响。牛磺酸已证实可通过刺激磷脂酶 C γ1 介导的钙和丝裂原活化蛋白激酶 (MAPK) 信号传导来增强 T 细胞增殖并增强抗 PD-1 疗法的抗肿瘤功效。此外,E_Prev 显示纤维二糖、S-腺苷甲硫氨酸和肌肽浓度增加。而 E_Esch 显示出更高的 PAGln 和 4-乙酰氨基丁酸浓度。肠型 E_Esch 和 E_Prev 均表现出更高水平的 γ-氨基丁酸 (GABA) 和嘌呤。GABA 通过诱导 M2 巨噬细胞极化并通过 β-catenin 信号传导抑制 CD8+ T 细胞的浸润来促进肿瘤生长。苯乙酰谷氨酰胺 (PAGln)是一种肠道微生物组衍生的代谢物,与致命前列腺癌和心血管疾病的风险增加有关。有趣的是,富含 E_Esch 的肺炎克雷伯菌已证明能以 proA 基因非依赖的方式产生 PAGln。此外,E_Bact 富含核糖酸和草酸。E_Clos 表现出较高浓度的各种有机酸及其衍生物,如脯氨酸和氨基己二酸,以及胆汁酸异石胆酸 (isoLCA)。值得注意的是,isoLCA 已证明能抑制 T 辅助 (Th)17 细胞的分化,并通过产生线粒体活性氧来增加 Treg 细胞的分化。
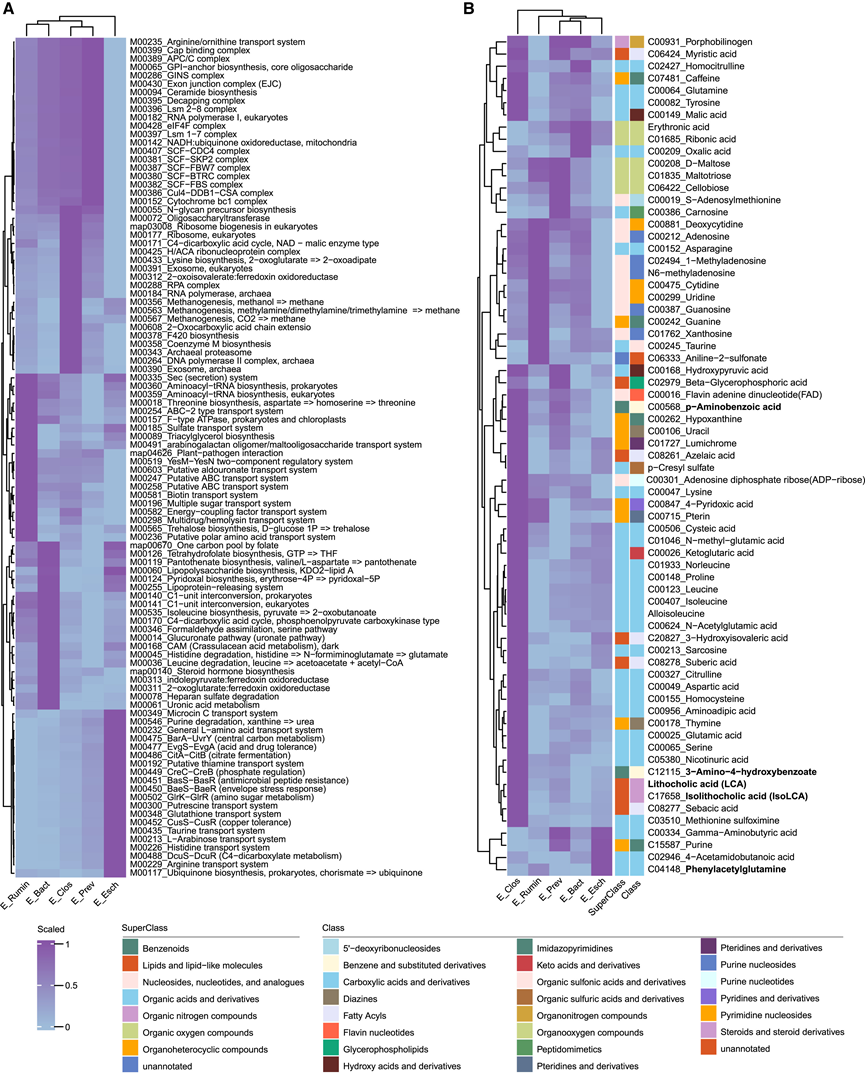
图5. 不同肠型的功能和代谢改变。
(A) 热图显示每种肠型中前 20 个显著富集的 KEGG 模块。(B) 热图显示与肠型显著相关的代谢物。
05
肠型间微生物组-代谢物相互作用的生物学关系
他们假设肠道细菌可以产生或代谢影响患者生物过程的化合物,从而导致免疫微环境的变化和对抗 PD-1 疗法的不同反应。通常,微生物组和代谢物之间的生物学联系是由编码催化代谢物反应的酶的特定基因以及相应途径(即 KEGG 模块)的改变所介导的。这可能有助于解释相应肠型中特定代谢物的富集。为了探索每种肠型内的潜在联系,他们进一步确定了每种肠型与其他肠型相比独有的差异 KO 基因,使用每种肠型中差异富集的代谢物作为线索,手动筛选出这些代谢物所涉及的显著增加的 KEGG 模块。随后,确定了属于这些 KEGG 模块的上调 KO 基因。这种方法能够构建微生物组和代谢物之间的潜在生物学联系,这些联系由 KO 基因和相关途径介导。
他们注意到丙氨酸、天冬氨酸、谷氨酸代谢(map00250)和组氨酸代谢(map00340)在 E_Rumin 中高度活跃,从而导致天冬酰胺的产生(图 6 A)。除了这些途径之外,他们还鉴定出 11 个在 E_Rumin 中显著升高的 KO 基因,由 9 种细菌编码。重要的是,这些细菌中的大多数也在 E_Rumin 中显著富集,包括Adlercreutzia equolifaciens、Anaerostipes hadrus、Faecalibacterium prausnitzii、Roseburia intestinalis、Ruminococcus bromii和Ruminococcus lactaris(图 6 A)。类似地,发现苯丙氨酸代谢(map00360)、谷氨酸代谢(map00250)和 GABA 支路(M00027)在 E_Esch 中发生激活,表明该肠型中 PAGln 和 GABA 的产生(图 6 B)。总共 7 个 KO 基因参与了 PAGln 的产生,主要由 E_Esch 中富集的 5 种细菌贡献,包括大肠杆菌、克雷伯氏菌(肺炎克雷伯氏菌、产酸克雷伯氏菌)、粪肠球菌和摩根氏菌。有趣的是,他们观察到 E_Clos 中与产甲烷相关的途径上调,包括 M00356 和 M00567,同时与这些过程相关的 14 个 KO 基因增加。值得注意的是,E_Clos 中主要由一种古菌Methanobrevibacter smithii主导,这在很大程度上导致了这些 KO 基因的上调(图 6 C)。此外,他们还发现 E_Clos 中的 FAD 有所增加,可能是由核黄素代谢过程 (map00740) 介导的,其中有 7 个 KO 基因上调。这些 KO 基因也来自富含 E_Clos 的细菌,例如Methanobrevibacter smithii和Odoribacter splanchnicus。这些结果阐明了个体肠型中归因于其优势细菌和潜在衍生代谢物的代谢表型。
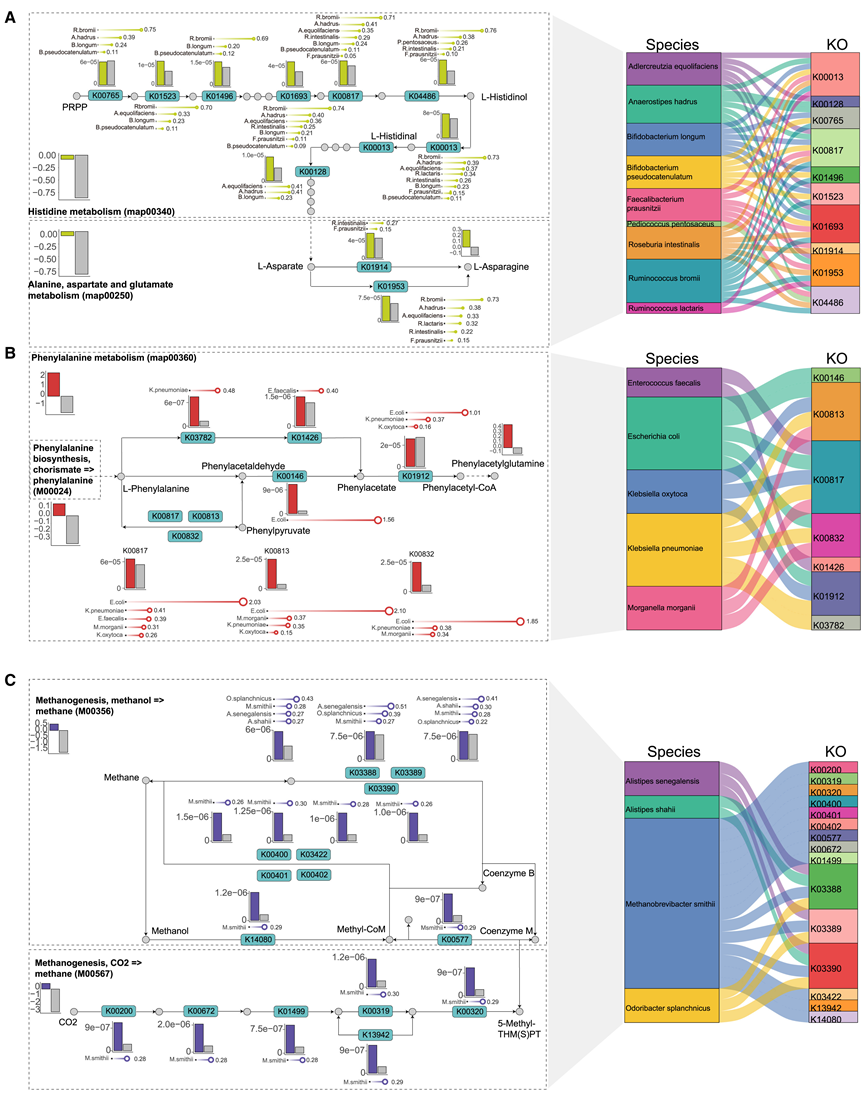
图6. 个体肠型中微生物组-代谢物的生物学联系。
(A-C) 左:参与从 KEGG 通路图修改而来的通路模块的代表性 KO 基因。右:桑基图显示了左图显示的携带 KO 基因的特定细菌。
06
PAGln 对抗 PD-1 疗法的减毒作用的体内验证
在与肠型相关的代谢物中,他们注意到代谢物 PAGln 不仅在 E_Esch 肠型中富集,而且与反应呈负相关。Nemet 等人的研究表明,在人类和小鼠中,PAGln 和苯乙酰甘氨酸 (PAGly) 都是通过与微生物 porA 基因有关的超生物途径在体内产生的,其中饮食中的苯丙氨酸由肠道微生物转化为苯乙酸 (PAA),与谷氨酰胺(主要在人类中)或甘氨酸 (主要在啮齿动物中)发生结合反应,分别产生 PAGln 和 PAGly。此外,除了porA 之外,另外两种微生物酶也参与了 PAA 的形成,即苯丙酮酸:铁氧还蛋白氧化还原酶 (PPFOR) 和苯丙酮酸脱羧酶 (PPDC)。
鉴于 PAGln 已证明能促进血小板反应性和血栓形成潜力,从而增加动脉粥样硬化心血管疾病的风险,而没有研究将 PAGln 与 ICB 反应联系起来,他们试图检测 PAGln 是否可以降低体内抗 PD-1 疗法的效果。C57BL /6 小鼠(6-8 周)植入 MC38 细胞并接受抗 PD-1 治疗,同时不注射 PAGln(图 7 A)。结果显示,与对照组相比,用 PAGln 治疗的小鼠的肿瘤生长显著增加(肿瘤体积和重量)(图 7 B-C)。此外,PAGln 减弱了抗 PD-1 对肿瘤生长的抑制作用(图 7 B-C)。质谱分析证实了在用 PAGln 治疗的小鼠血清中检测到并积累了 PAGln(图 7 D)。为了表征这些小鼠的免疫变化,他们进行了单细胞转录组分析 (scRNA-seq),重点关注肿瘤组织中的 CD45+细胞。鉴于 T 淋巴细胞是免疫治疗的关键靶点,并在调节抗肿瘤免疫中发挥重要作用,他们专门分析了 T 细胞的变化,与仅抗 PD-1 组相比,PAGln +抗 PD-1 组小鼠的有效 CD8 + T 细胞比例较低,而耗竭 CD8 + T 细胞比例较高(图7E-H)。进一步的差异基因表达分析表明,抗 PD-1 组的 T 细胞对免疫刺激的反应性高于抗 PD-1+ PAGln 组,干扰素 (IFN)-γ 和肿瘤坏死因子 α (TNF-α) 信号通路的上调证明了这一点(图 7 I)。流式细胞还显示 CD45 + CD3 + T 细胞的绝对数量没有统计学差异,而PAGln 加抗 PD-1 组中 IFN-γ 或 TNF-α 标记的细胞毒性 CD8+ T 细胞浸润减少(图7J-M)。总之,这些结果表明 PAGln 可能通过负向调节 T 细胞反应来降低抗 PD-1 治疗的疗效,细胞毒性CD8+ T细胞的减少表明了这一点,证明 PAGln 显著抑制炎症细胞因子(IFN-γ、白细胞介素 [IL]-6 和 TNF-α)的产生,抑制炎症蛋白(核因子 κB [NF-κB] 和诱导型一氧化氮合酶 [iNOS])的表达,并通过抑制 T 细胞活化和 Toll 样受体 4 信号传导具有抗炎活性。
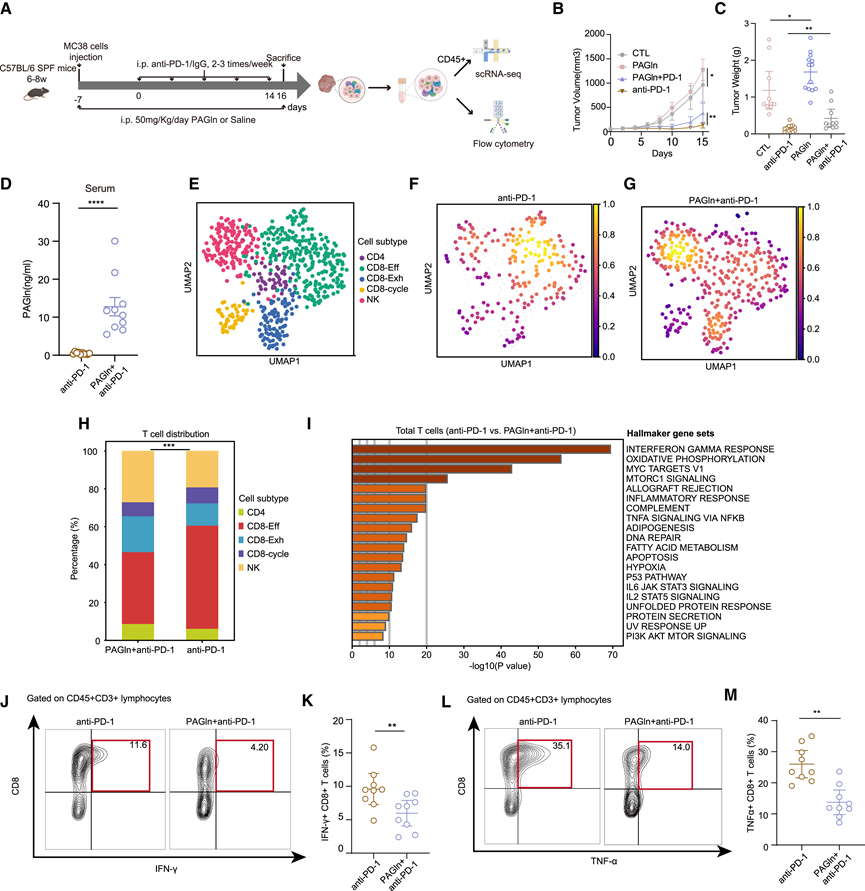
图7. PAGln体内实验验证。
(A) 体内实验的工作流程。(B) MC38 肿瘤的生长动力学。(C) 比较四组肿瘤体积的散点图。(D) 散点图显示接受或未接受 PAGln 治疗的抗 PD-1 组血清中 PAGln 的浓度。(E-G)UMAP可视化。(H) 堆积图显示抗 PD-1 和抗 PD-1 加 PAGln 组之间的 T/NK 细胞分布。(I) 条形图显示使用抗 PD-1 组中显著上调的基因进行基因集富集分析的结果。(J,L) CD8+T 细胞流式细胞分析代表图。(K,M) 散点图比较抗 PD-1 组和抗 PD-1+ PAGln 组之间IFN-γ + CD8 + T 细胞 (K) 和 TNF-α + CD8 + T 细胞的差异。
+ + + + + + + + + + +
结 论
本项研究对 165 名接受抗程序性细胞死亡蛋白 1 (PD-1)/程序性死亡配体 1 (PD-L1) 治疗的患者的粪便微生物群和代谢组进行了多组学分析,确定了与治疗反应相关的微生物和代谢实体。整合来自四个公共宏基因组数据集的数据,揭示了跨队列微生物和代谢特征,并在独立队列中进行了验证,结合这些特征的综合预测模型表现出稳健的性能。值得注意的是,本研究表征了五种与反应相关的肠型,每种都与特定的细菌类群和代谢物有关。其中,代谢物苯乙酰谷氨酰胺 (PAGln) 与反应呈负相关,并显示可减弱体内抗 PD-1 疗效。本研究揭示了肠道微生物组、肠道代谢组和免疫治疗反应之间的相互作用,并确定了改善治疗结果的潜在生物标志物。
+ + + + +



 English
English


