文献解读|Cancer Cell(48.8):综合空间分析揭示肿瘤异质性和免疫克隆生态位与小细胞肺癌临床结果的关系
✦ +
+
论文ID
原名:Integrative spatial analysis reveals tumor heterogeneity and immune colony niche related to clinical outcomes in small cell lung cancer
译名:综合空间分析揭示肿瘤异质性和免疫克隆生态位与小细胞肺癌临床结果的关系
期刊:Cancer Cell
影响因子:48.8
发表时间:2025.02.20
DOI号:10.1016/j.ccell.2025.01.012
背 景
小细胞肺癌 (SCLC) 是一种侵袭性恶性肿瘤,其特征是快速生长、早期播散和通常较差的长期预后。虽然最初对铂类化疗有反应,但它会迅速产生耐药性和疾病进展。免疫疗法最近为 SCLC 治疗带来了潜在突破,但仅在选定的患者群体中观察到生存获益。与其他癌症[如非小细胞肺癌 (NSCLC)和乳腺癌]的生物标志物导向个性化治疗策略不同, 最近的进展揭示了SCLC的分子异质性,但肿瘤免疫微环境中的空间组织和细胞相互作用仍有待阐明。
实验设计
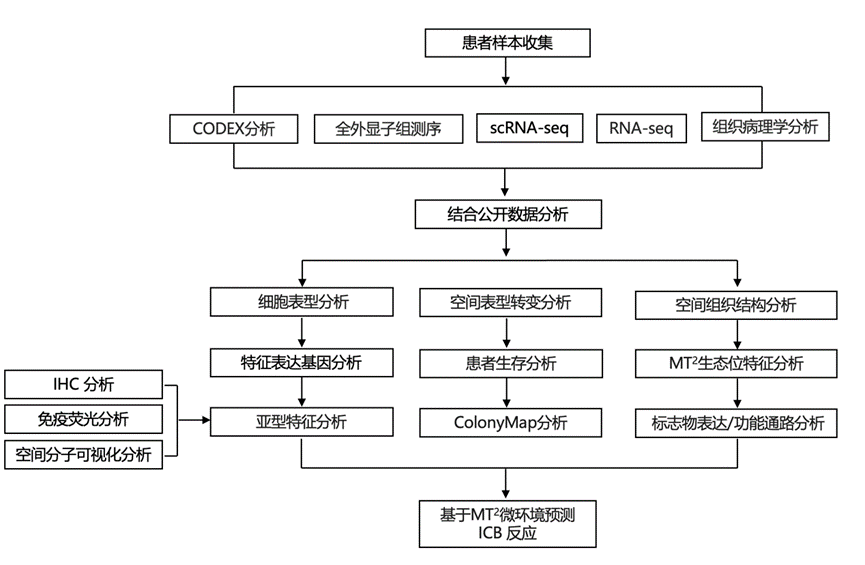
结 果
01
SCLC 的空间分辨单细胞表型图谱
为了全面分析 SCLC 的细胞组成、空间组织和分子异质性,研究团队构建了代表所有临床病理特征的原发性 SCLC 肿瘤多组学图谱(复旦大学 [FU]-SCLC 队列),该图谱来自 HLTMA 队列。在本研究中,系统性治疗前的肿瘤组织用于全外显子组测序 (WES)、 转录组分析 (RNA-seq) 和索引联合检测 (CODEX),并使用空间分子成像仪 (SMI) CosMx 和免疫组织化学 (IHC) 染色验证(图 1 A)。CODEX 设计了一个 35-重抗体组合,可同时定量蛋白质,包括分子亚型转录因子(TF),以确定 SCLC 异质性;肿瘤微环境 (TME) 的上皮、间质、免疫和内皮谱系标志物;以及细胞功能状态或正在进行临床药物试验的靶点(图1B)。他们从129个肿瘤样本和16对相邻正常组织中获取了 267 张高维组织病理学图像(图 1C)。总共检测到了9337647个细胞,并使用监督谱系分配方法根据典型标志物对细胞表型进行分类(图1D-E)。在肿瘤细胞 (TC) 和免疫细胞中均表达的标志物已准确注释,例如,双阴性 T(dnT)定义为 CD3+ CD4− CD8− CD56− T 细胞。自然杀伤 T 细胞 (NKT) 定义为 CD3+ CD4 − CD8 − CD56+ T 细胞,CD3− CD56 +细胞标注为自然杀伤 (NK) 细胞。具体而言,检测到具有共表达两种或多种阳性 TF 标志物的表型的多阳性肿瘤细胞(MPTC)(图 1 E)。与 TME 细胞表型相比,肿瘤组成在各个核心之间的保守性更好,但也存在例外。例如,YAP1+TC相对较弱,可能是由于YAP1在肿瘤和间叶组织之间的非特异性表达模式。而CD68+巨噬细胞在同一肿瘤的不同核心之间具有良好的保守性,表明其具有较强的肿瘤浸润能力。
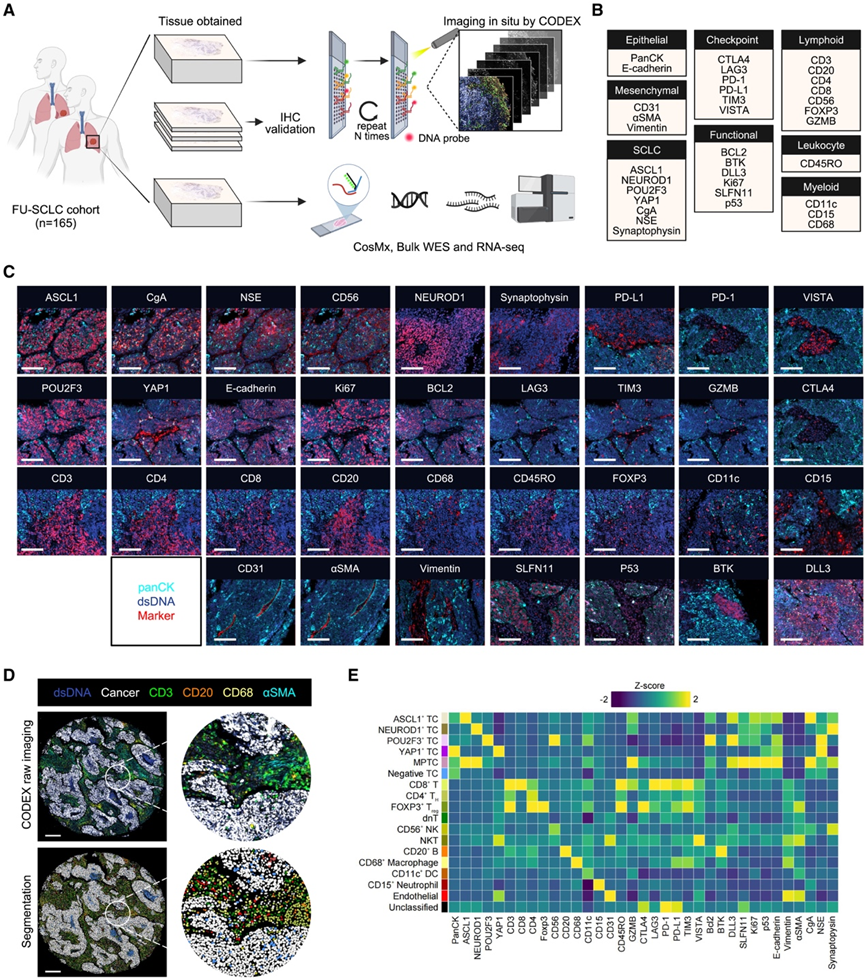
图1. FU -SCLC 队列中的 CODEX 和多组学工作流程。
(A)多组学实验示意图。(B) CODEX 面板中使用的标记,按目标细胞类型或蛋白质类别分组。(C) CODEX 图像数据的代表性示例。(D) 一个肿瘤核心的代表性 CODEX 图像,其中有癌症和免疫细胞谱系标记的六色叠加,以及相应的细胞分割掩模图,通过叠加在掩模上的颜色显示细胞身份。(E) 热图显示 CODEX 识别的细胞表型中所有标记物的平均表达。
02
SCLC的肿瘤异质性
最近对 FFPE 组织切片进行 IHC 的研究表明,在同一 SCLC 肿瘤样本中可能同时表达两种或多种 TF 标志物。值得在单细胞水平上进一步探索分子和 TME 异质性的细节。他们分析了各种 TC 和免疫细胞的细胞比例。ASCL1+ TC 占所有 TC 的 50% 以上,而巨噬细胞是免疫细胞中含量最多的。令人惊讶的是,超过 10% 的 TC(916348 个细胞)鉴定为 MPTC(图 2 A-B)。通过免疫组织化学(IHC)(图 2 B)、单细胞转录组分析(scRNA-seq)技术在连续切片上进行验证,并证实了 MPTC 的存在。在这些 MPTC 中,ASCL1 和 NEUROD1 共表达最为普遍,其次是 ASCL1+ YAP1+和 NEUROD1 + YAP1 +细胞,少部分表现出 ASCL1+ NEUROD1 + YAP1 +表型。POU2F3 表达与 ASCL1 和 NEUROD1 几乎互斥,而 YAP1 显示出更普遍的表达模式(图 1 E)。最近的研究阐明了 SCLC 中从 ASCL1 到 NEUROD1 再到 YAP1 的表型神经内分泌 (NE) 去分化轨迹。相反, POU2F3+细胞来自独特的簇细胞谱系,证实了本研究结果。在分析每个核心时,他们采用了类似于肺腺癌病理亚型的策略,即选择 5% 作为最低阈值,并将主要分子亚型定义为比例最高的表型。在相应的表型类别中分别计数 MPTC。例如,如果患者含有 60% ASCL1+ TC和 20% 混合 ASCL1+ NEUROD1+ TC,则将其归类为 SCLC-A 主要亚型,同时也注释为 ASCL1+/NEUROD1 +混合亚型。在本研究中,超过 40% 的 SCLC-A 核心含有 MPTC,这表明肿瘤内存在显著的分子异质性(图 2C)。相关性分析显示,ASCL1+ TC 的比例与 NEUROD1+/YAP1+ TC的比例呈显著负相关。结合RNA-seq数据观察到,与SCLC-A为主的亚型相比,SCLC-N/Y亚型中NE分化相关基因的表达降低,而非NE分化相关基因的表达则呈现相反趋势。这表明,这种亚型划分策略可能表征了SCLC的去分化过程。值得注意的是,一个肿瘤显示出三种亚型表型:NEUROD1+、YAP1 +和 POU2F3 +,这是一种罕见的情况,值得进一步研究此类肿瘤的细胞起源和进化轨迹。
接下来,他们对肺癌肿瘤免疫微环境 (TIME) 的细胞景观进行了探究。首先对 16 个肿瘤和配对的邻近正常组织进行分析。与邻近正常组织相比,肿瘤中除 CD56+ NK 细胞外,大多数免疫细胞类型的比例并未增加,支持 SCLC 的“冷” TIME 特征。在亚型中,SCLC-Y具有最高的免疫浸润(25.2%)(图 2 D-E),这种优势主要是由髓系区室中的移位(特别是巨噬细胞)驱动的,SCLC-Y 与其他亚型之间的平均频率有显著差异(图 2 E)。有趣的是,虽然 SCLC 中 Treg细胞的频率总体较低,但FOXP3+ Treg细胞聚类的频率仅在 SCLC-P 亚型中显著较高(图 2 E)。相应地,SCLC-P亚型患者的预后明显差于其他亚型,而SCLC-Y与本研究数据集中的最佳生存相关。为了验证SCLC-Y亚型的免疫浸润水平,在bulk RNA-seq数据中进一步鉴定出4个聚类。在聚类1中可以观察到单个SCLC-Y肿瘤,并结合SCLC-P。排除SCLC-P肿瘤后,聚类1与其他聚类相比显示出升高的免疫特征评分。SCLC-Neg 肿瘤的免疫浸润水平相对较高(图 2 E),仅次于 SCLC-Y 肿瘤。这些四阴性 TC 主要表现为坏死和病理性萎缩,可能由免疫系统抑制或清除。不同亚型计数的免疫学或患者生存期差异较小(图 2 E)。
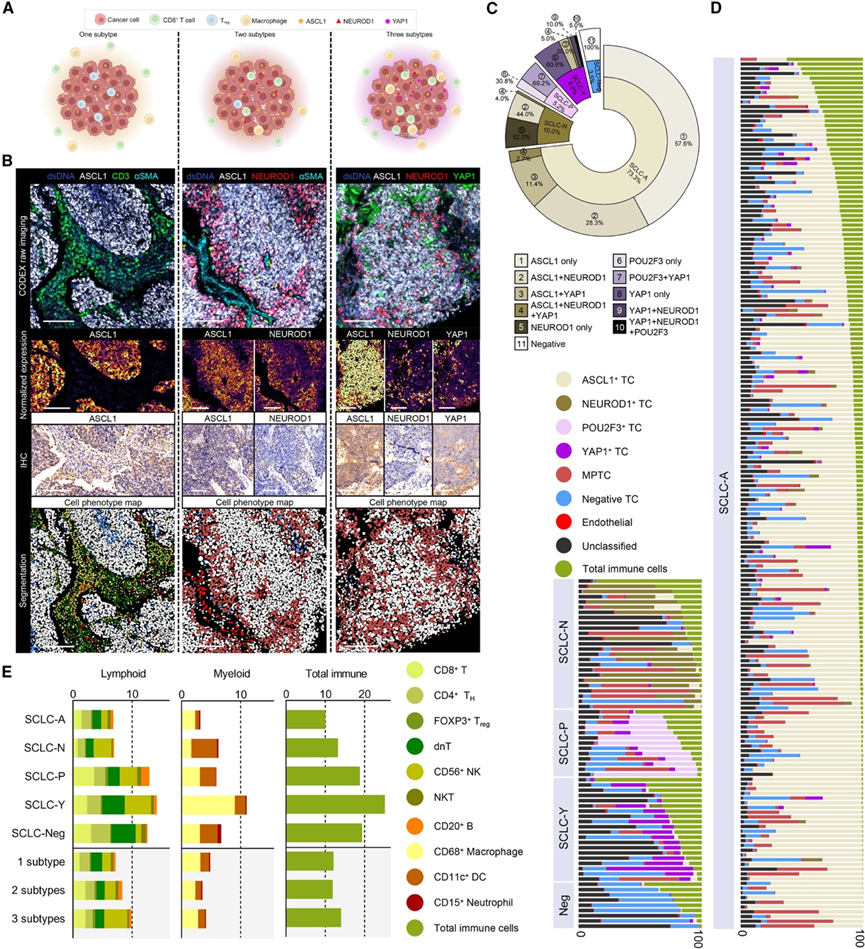
图2. CODEX 分析的 SCLC 肿瘤异质性层。
(A) 示意图,说明单个肿瘤内的共表达模式。(B) 代表性 CODEX 图像。(C) 环形图表示每个核心中 SCLC 主要亚型的百分比(环形图内部),以及所有五个组中各种 TF 表达组合的百分比(环形图外部)。(D) 瀑布图描绘了核心层面上六种肿瘤细胞表型和每种 SCLC 主要亚型中总免疫细胞浸润的分布。(E) 堆叠条形图,表示所示免疫细胞表型占所有细胞的百分比,根据 SCLC 主要亚型(上图)和亚型计数(下图),均在核心水平。
03
细胞邻域(CN)标记空间表型转变和生存结果
接下来,他们探讨了 CN 在肿瘤内的组织方式以及不同 SCLC 亚型之间的 TIME。应用典型方法建立了 20 个 CN 聚类,这些聚类重现了新的和已知的 TIME 架构(图 3 A-B),包括全免疫 (CN1)、巨噬细胞富集 (CN12)、血管 (CN5) 等。值得注意的是,该 CN 分析根据每个 TC 的空间关系和比例进一步对局部肿瘤巢进行分层,包括几个 MPTC 富集的邻域(CN2、CN9、CN13 和 CN14)。为了确定与生存相关的 CN,使用 CN 比例作为变量进行了调整 TNM 分期的多元 Cox 回归分析,将肿瘤分期视为重要的预后因素。在所有患者中,邻域比例与 OS 无关。当仅限于SCLC-A为主的亚型时,CN7(YAP1+ TC富集)、CN9(MPTC富集)和CN10(NEUROD1+ TC富集)与预后较差显著相关,而CN17(ASCL1+ TC富集)与生存率提高相关(图3 B)。这表明,在ASCL1+为主的肿瘤中,其他亚型的出现预示着不良预后。在其他主要亚型中未观察到类似的趋势。
实际上,多项研究已揭示了 SCLC 中 TF 的共表达。在四个 MPTC 富集区域内,CN9 是唯一与预后相关的结构。因此,他们采用 Voronoi 图模拟 CN 的空间分布并将其可视化(图 3 C)。Voronoi 图与原始 CODEX 荧光模式高度吻合。在混合型 SCLC-A 肿瘤中,他们观察到多个 MPTC 富集区域呈同心环状排列,CN9 位于中心,周围是 CN2 和 CN13,形成“虫蚀”状(图 3 C)。CN9 区域与非 ASCL1 标志物的表达相对应。对每个 CN 进行了出现顺序和伪时间轨迹分析,结果表明 CN3 的伪时间出现时间早于 CN9(图 3 D-E)。
然后,他们在所有 MPTC 中执行了t分布随机邻域嵌入 ( t -SNE)算法分析,并观察到几种功能标志物[例如 Ki67 和 Schlafen 11 (SLFN11)]的不同表达分布。与很少表达波形蛋白[上皮-间质转化 (EMT) 标志物]的 CN3 相比,CN9 中波形蛋白+ TC 的比例大幅升高(图 3F)。CN9 中 TC 的增殖比例 (Ki67 + ) 也相对高于 CN3。这些发现表明 TC 在去分化过程中具有较高的增殖和转移潜力,部分解释了其与不良预后的关系(图 3B)。考虑到波形蛋白也可以表征去分化程度,他们分析了 CN10 并观察到与 CN3 和 CN9 相比波形蛋白表达增加(图 3 F)。此外,CN9 和 CN10 中 SLFN11+ TC 的比例显著升高(图3 F-G)。SLFN11 是一种 DNA/RNA 解旋酶,可使癌细胞对 DNA 损伤剂敏感,并且还确定为聚 ADP-核糖聚合酶抑制剂 (PARPi) 的关键预测因子。先前的报道证实了 SLFN11 在 SCLC-A 肿瘤中的双峰表达模式。本研究结果表明 SLFN11 的表达可能伴随 SCLC 中的去分化轨迹。从体细胞突变和拷贝数变异(CNV)的角度探讨了CN与基因组改变之间的关系(图3H)。他们首先对同一肿瘤内每个核心的目标CN比例进行平均,然后将这些平均值与遗传事件相关联。CN3与体细胞突变的相关性较低,但富含BRCA2和B2M缺失,后者可能介导肿瘤免疫逃逸和免疫检查点阻断(ICB)耐药性。而CN9含有最多的RBBP6突变,据报道该突变可诱导EMT过程并促进肿瘤转移。CREBBP改变是NEUROD1 + TC富集邻域(CN10)中的最高命中率,可能与化疗后的SCLC复发有关。此外,发现EYA2突变与CN11(一个SCLC-P亚型富集聚类)相关(图3H)。EYA2之前已确定为一种关键调节因子,可提高 MYC 表达并介导 TC 中的免疫逃避,与SCLC -P 亚型中的高 Treg频率相呼应。
简而言之,这些结果提示,在SCLC-A肿瘤中,存在一个特殊的MPTC富集区域(CN9),其特征是高转移潜能、SLFN11高表达,且与不良预后相关。这种结构可能与特定的体细胞变异相关,例如RBBP6,它又称为p53负调控因子。而CN9结构与SCLC中p53和RBBP6变异之间的具体关系值得进一步研究。
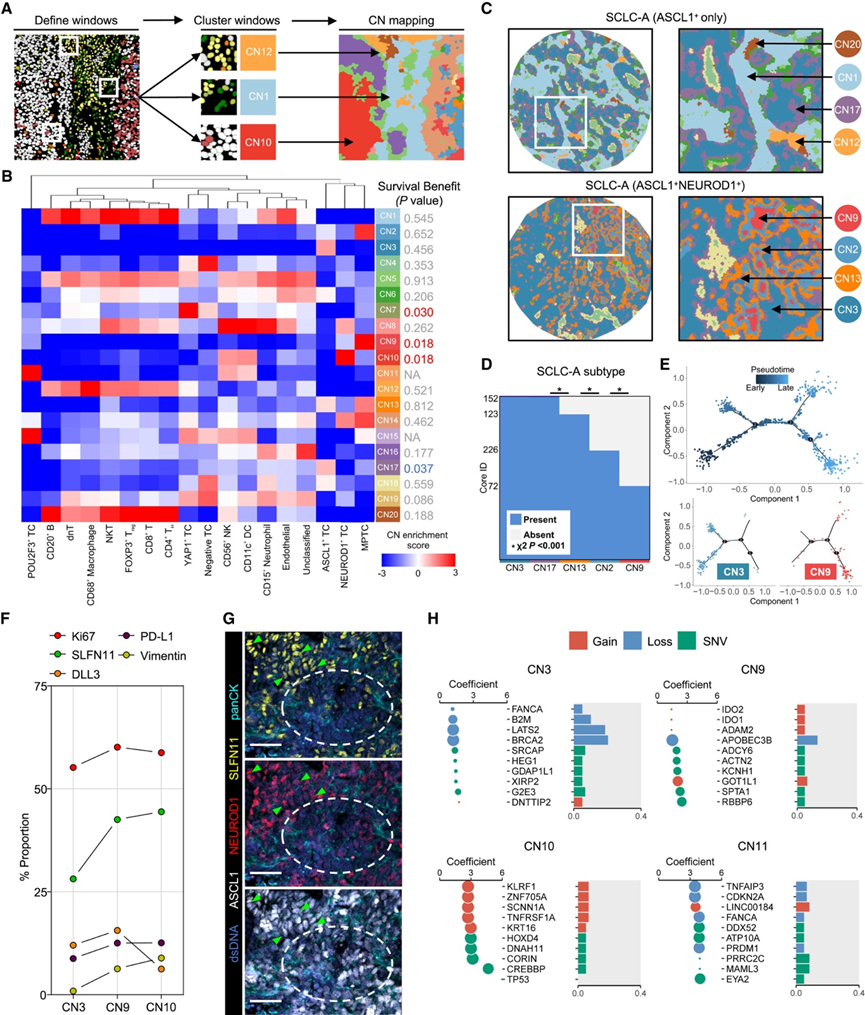
图3. CN 标记的空间表型转变和生存结果。
(A) 示意图描绘了细胞邻域(CN)分配的工作流程。(B) 跨 CN 表示的细胞组成热图。(C) CN 代表性 Voronoi 图。(D) 核心层面上 SCLC-A 主要亚型中五种 CN 的存在与否。(E) Monocle 2 使用 (D) 中的五个 CN 的频率作为变量绘制的伪时间轨迹(上图)。图中标示的 CN3 和 CN9 的位置投射到伪时间空间上(下图)。(F) 功能标志物表达比较。(G) ASCL1+ NEUROD1+ SCLC 的代表性 CODEX 图像叠加,显示 MPTC 中 SLFN11 表达较高。(H) CN3 和 CN9 中富集最多的五种体细胞突变或拷贝数畸变。
04
SCLC 的空间分析
CN 分析提供了一种有效的策略来描述每个细胞周围局部微环境中的细胞组成。空间上,聚集或分散状态下的同一种细胞类型可能在组织内表现出不同的生理功能。他们将这些聚集的均质细胞定义为细胞克隆,以便从细胞群体的角度更好地研究空间相互作用。据此,开发了空间集落检测算法 ColonyMap 来分析 CODEX 和 SMI CosMx 数据。首先使用图像分割和轮廓识别算法描绘出每个克隆及其边界(图4 A)。然后,将不同克隆的重叠区域确定为克隆-克隆相互作用 (CCI) 区域,并进一步分析。
与苏木精和伊红 (H&E) 和 CODEX 图像相比,ColonyMap 准确地检测到了肿瘤和免疫边界(图 4B)。还成功描绘了三级淋巴结构 (TLS) 样结构和血管(图 4B)。将 ColonyMap 与常用的人工神经网络多层感知器 (ANN-MLP) 模型进一步比较,表明了 ColonyMap 的可靠性。从 CODEX 数据中检测到了 17 种克隆类型。为了分析各种克隆的空间分布,引入了 Clark-Evans 指数来评估它们在每位患者中的聚集程度。Clark-Evans 指数通常用于生态学中,以定量给定区域内生物实体的空间聚集/分散程度。将指数和克隆面积的分布绘制成核心的核密度估计 (KDE) 图,免疫细胞克隆往往聚集得比 TC 克隆更小。
他们首先探究了每个克隆中的免疫检查点和功能标志物状态(图 4C)。DLL3 和 Bcl2 主要在 ASCL1+ TC 中表达,而 SLFN11 在 NEUROD1+ TC 和 MPTC中高度表达,这与 CN 的结果一致。有趣的是,SLFN11 也在各种免疫细胞中表达,例如 CD8+ T 细胞,这在单细胞数据中得到了证实(图 4D)。据报道,SLFN11 是一种模式识别受体,可以显著调节微环境的免疫特性。通路富集分析表明,TC 中的高 SLFN11 激活了 MYC 和 JAK-STAT 等信号通路以及检查点(图 4E)。此外,生存分析显示,T 细胞中较高的 SLFN11 可预测较差的预后,优于免疫检查点的预测结果。
随后,他们研究了不同SCLC亚型之间的克隆相互作用,将不同克隆类型之间的CCI分为六类:免疫-免疫、免疫-肿瘤、免疫-血管、肿瘤-肿瘤、肿瘤-血管和无相互作用(图4 F)。SCLC-A和混合型SCLC-A表现出比其他类型更多的肿瘤-肿瘤CCI,表明其肿瘤内多样性和空间复杂性更高。而免疫-免疫CCI在SCLC-Y中更常见,这与较高的免疫浸润性相符(图4 F)。令人惊讶的是,他们发现ASCL1阳性肿瘤克隆主要位于血管旁(图4 G),并且ASCL1阳性克隆内的EC比例最高(图4 H)。更重要的是,在所有 SCLC 患者中,ASCL1+肿瘤与 EC 克隆之间较低的 CCI 比例与更好的无复发生存期 (RFS)和 OS显著相关(图 4 I)。据报道,肿瘤-血管相互作用增强与患者生存期缩短相关,因为新生血管可以为肿瘤生长提供必需的营养物质,同时也可作为远处播散和转移性病变形成的通道。
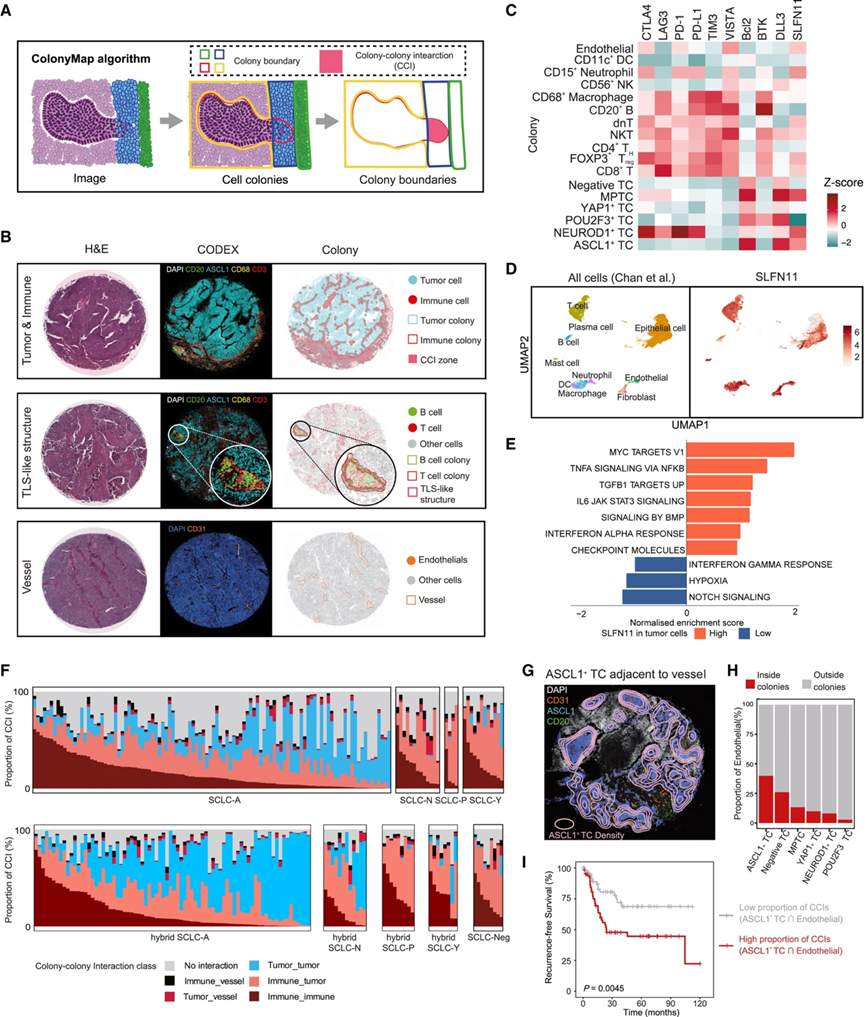
图4. ColonyMap检测到 SCLC 的空间克隆。
(A) ColonyMap算法示意图。(B) ColonyMap 检测到的肿瘤和免疫边界、TLS 样结构和血管。(C) 17 个细胞群落中的几个免疫检查点和功能标志物表达的热图。(D) 所有细胞亚群的 UMAP以及 SLFN11 基因的标准化表达。(E) 应用与 SCLC 神经内分泌去分化、干扰素反应和免疫检查点相对应的基因特征进行成对的基因集分析。(F) 瀑布图描绘了六个 CCI 类别在每个单一和混合 SCLC 主要亚型中的分布。(G) ASCL1+肿瘤克隆可视化,位于血管附近。(H) 每种 TC 克隆内部或外部的 EC 比例。(I) 无复发生存率 Kaplan-Meier 曲线。
05
CCI 分析确定了有利于生存的生态位
免疫-免疫相互作用在TIME中起着至关重要的作用,然而SCLC中的免疫相互作用尚未从空间单细胞角度系统地研究。他们进一步关注免疫-免疫CCI,特别是与临床结果相关的。首先,分析了前五种相互作用的免疫CCI克隆类型(图5A)。T细胞与其他免疫细胞表现出广泛的相互作用。在T细胞和巨噬细胞之间观察到的CCI面积最丰富。值得注意的是,DC和T细胞之间的CCI很少检测到,部分原因是DC的丰度低(图2)。
接下来,根据详细的 10 种免疫细胞类型重新分析免疫 CCI。巨噬细胞总体上与 T 细胞表现出丰富的相互作用(图 5B)。为了验证这是否普遍存在于各个核心中,他们用不同颜色绘制了核心的比例,以指示每个核心内详细 CCI 的流行水平(图5B)。结果表明,巨噬细胞相关的 CCI 确实在大多数核心中普遍存在(该 CCI 的比例 >20%)。上述结果表明巨噬细胞和 T 细胞在 SCLC 的 TIME 中起着重要作用。
他们进一步探讨了患者层面的CCI,与长期生存率相关。与免疫相关的 CN 相反,各种 CCI 显示出与预后的显著相关性。为了确定潜在的关键参与者,扫描了所有二元 CCI,包括 6 个 TC、10 个免疫细胞和 EC。如果它们可以显著区分患者预后,则选择它们,并用于构建预后相关的 CCI 网络,同时考虑 CCI 面积和比例(图 5C)。在这个网络中,可以清楚地注意到一个预后有利的克隆子网络,它由巨噬细胞、NKT、CD8+ T 和 Treg细胞组成。由于 Treg细胞的比例低(<占总细胞的 1%),他们最终将重点放在由巨噬细胞、自然杀伤 T 细胞(NKT)和 CD8+ T组成(以下简称 MT2)的免疫生态位上。令人惊讶的是,研究发现,生态位面积高的患者与良好的长期生存率显著相关(图 5D)。高/低免疫浸润水平无法区分患者预后。然而,无论整体免疫浸润如何,MT2面积似乎都是一个独立的预后因素(图 5E)。有趣的是,MT2生态位倾向于聚集在肿瘤克隆的边界,这种现象在 MT2生态位富集的核心中尤为明显(图5 F)。相应地,据报道,MT2富集的患者的 OS为 40 至 120 个月(图 5 F)。MT2缺乏患者的相应 OS为 6 至 9 个月(图 5 F)。
基于 CosMx 图像的ColonyMap 检测的 MT2生态位证实了其在 SCLC 中的预后价值。CosMx 数据使研究团队能够探索 MT2生态位内的详细细胞亚群和功能状态,并且他们采用了巨噬细胞亚群的共识模型,将巨噬细胞分为增殖性(Prolif-Macro)、脂质相关/促纤维化(LA/profibrotic-Macro)和 M1 样炎症/干扰素引发(Inflam/IFN-Macro)亚群(图 5 G)。LA/profibrotic-Macro具有免疫抑制和促纤维化作用,具有特发性肺纤维化 (IPF) 相关的促纤维化特征(图5H)。MT2内部和外部的巨噬细胞和 T 细胞亚型比例无显著差异,但功能状态明显不同。MT2内的巨噬细胞表现出低脂质合成、低缺氧和高抗原呈递能力 (APC)(图 5I)。此外,MT2内的耗竭 T 细胞指数显著降低(图5J)。MT2内的巨噬细胞显著富集参与 T 细胞活化和细胞毒作用的信号通路(图5K)。
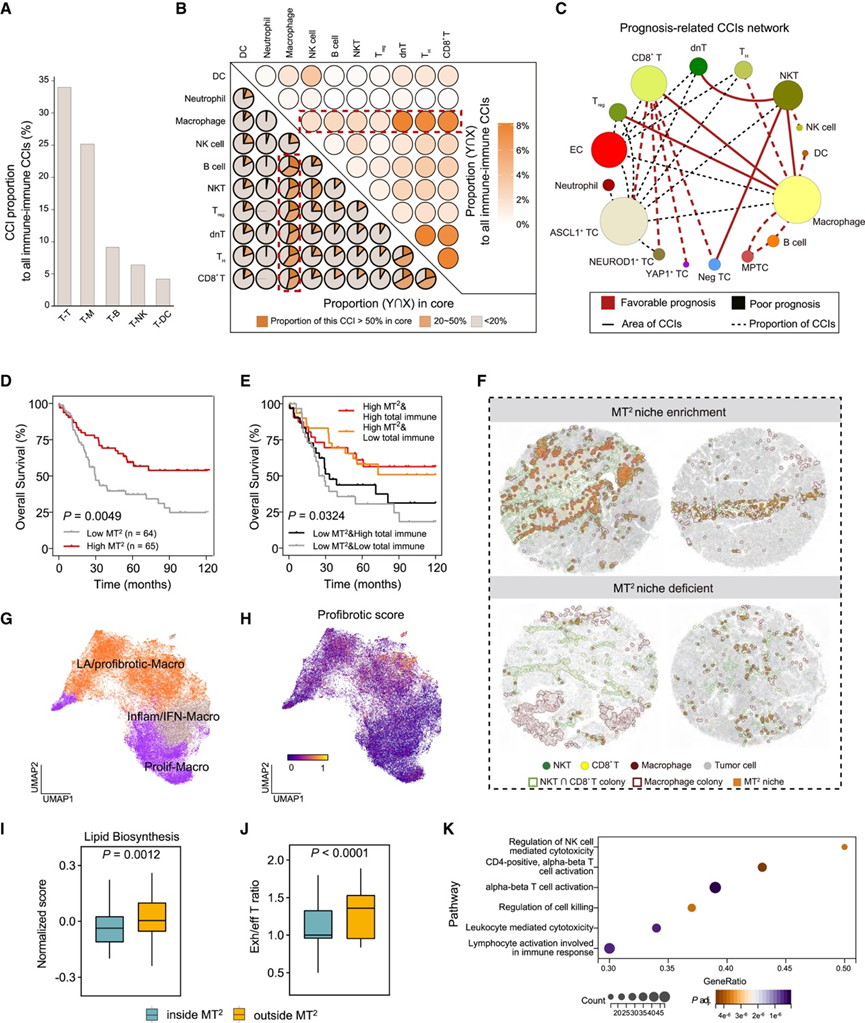
图5. CCI 分析确定了有利于生存的 MT2生态位。
(A) T 细胞相关 CCI 的面积与所有免疫-免疫 CCI 的面积之比。(B) 免疫 CCI 中的详细细胞类型。(C) 预后相关 CCI 网络。(D-E) 根据 MT2生态位的丰富度以及 MT2生态位与总免疫浸润的组合绘制的 Kaplan-Meier 曲线。(F) 典型 MT2生态位富集/缺乏核心的代表性掩模图像。(G) CosMx 测序数据中注释的 SCLC 巨噬细胞亚群的 UMAP 可视化。(H) SCLC 巨噬细胞的 UMAP 显示促纤维化相关基因特征评分。(I-J) MT2生态位内外巨噬细胞脂质生物合成的标准化途径富集分数和耗竭 T 细胞与有效 T 细胞的比例。(K)通路分析。
06
基于M1样巨噬细胞的MT2生态位预测ICB反应
他们收集了一个独立队列,其中 23 例患有广泛期 SCLC (ES-SCLC) 并接受抗 PD-L1 免疫治疗(阿特珠单抗或度伐利尤单抗)的患者。在 ICB 治疗前通过组织活检获取样本,他们对肿瘤切片进行多重免疫荧光 (mIF) 和 CosMx 以进行空间映射和克隆分析(图 6 A)。患者可分层为持久临床获益 (DCB) 组和无持久临床获益 (NDB) 组,由医生进行临床评估。并且还选择了治疗后的长期生存率进行 ICB 疗效评估。最长随访时间为 33.93 个月。ICB 治疗后,8 名患者达到 DCB,15 名患者达到 NDB。
他们采用了包括 CD86 在内的六种免疫细胞谱系标记来区分 mIF 测试中的 M1 样炎症巨噬细胞。结果显示在 mIF 图像上成功识别出不同的细胞克隆和 MT2生态位,证明了 ColonyMap 方法的稳健性(图 6B)。DCB组和 NDB 组之间的免疫细胞克隆和MT2面积比例均无显著差异(图 6C)。然而,当将患者进一步分层为高和低 M1-MT2组(由 M1 样 CD86+巨噬细胞、CD8+ T 细胞和 NKT 细胞组成)时,高M1-MT2组的 DCB 患者数量高于低 M1-MT2组(图 6D)。重要的是,预后分析显示高 M1-MT2比例与免疫治疗后生存期延长显著相关(图 6E)。
根据 ES-SCLC 队列的 CosMx 数据,MT2的细胞组成与免疫治疗的疗效相关(图 6 F)。在MT2生态位内,DCB 组的 M1 样 Inflam/IFN-Macro 比例明显高于 NDB 组,验证了免疫荧光的结果。然而,NDB 组的 Prolif-Macro 和耗竭的 CD8+ T 细胞明显增加。这可能与 SLFN11 高表达有关(图 6 G)。最后,他们分析了上述特征以及之前报道的与 ICB 反应相关的 ASCL1+YAP1+免疫“热”TC,发现MT2内的 Inflam/IFN-Macro 比例和 Prolif-Macro 中的 SLFN11 表达对预测临床疗效具有很高的准确度(图 6 H)。
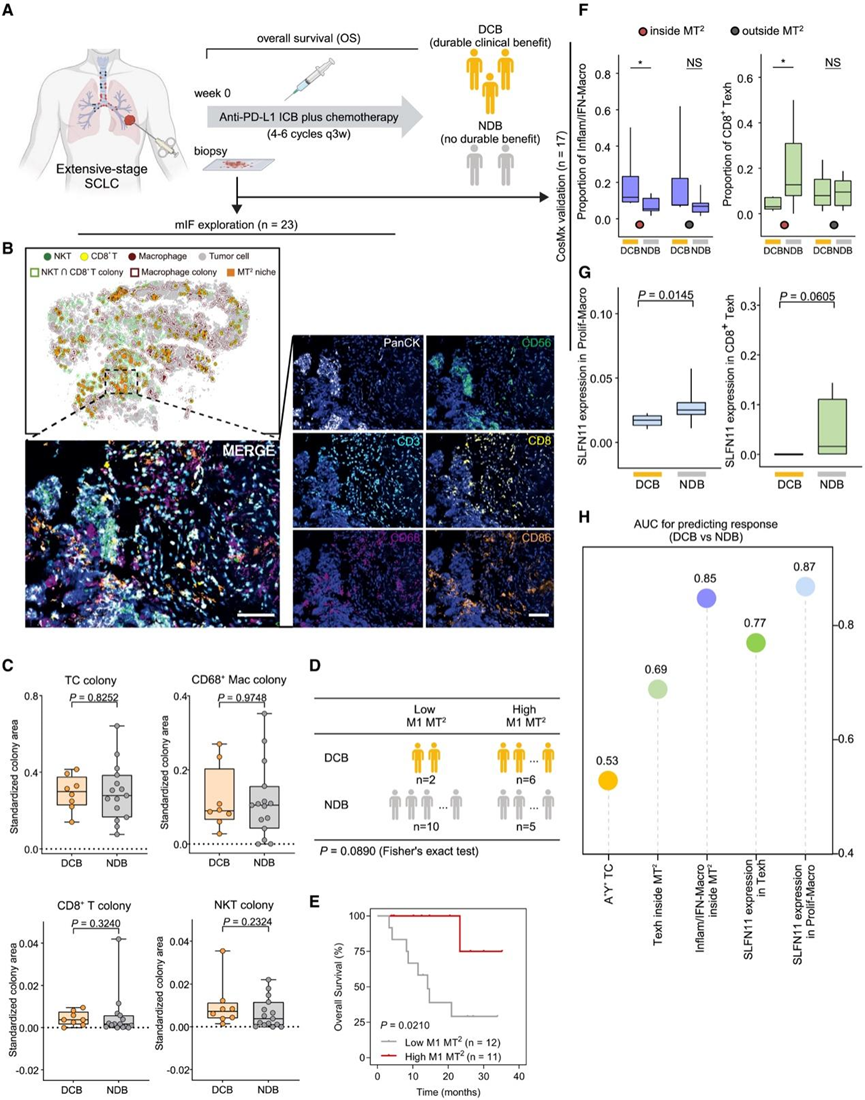
图6. 基于 M1 样巨噬细胞的 MT2生态位预测 ICB 反应。
(A-B) 收集接受抗 PD-L1 免疫治疗的广泛期 SCLC (ES-SCLC) 患者和基于多重免疫荧光 (mIF) 图像的克隆检测。(C) DCB 和 NDB 患者的 TC 和免疫细胞克隆面积比较。(D) DCB 和 NDB 患者在低 M1 MT2 丰度组和高 M1 MT2丰度组之间的分布。(E) 总体生存率 Kaplan-Meier 曲线。(F-H)在 17 名有可用样本的 ES-SCLC 患者中识别MT2生态位。
+ + + + + + + + + + +
结 论
本研究采用CODEX和多组学技术来分析165 名 SCLC 患者的空间景观,涵盖超过 930 万个细胞。整合 CODEX 和基因组数据揭示了 ASCL1+ (SCLC-A) 亚型内的多阳性肿瘤细胞邻域,其特征是高 SLFN11 表达并与不良预后相关。本研究进一步开发了一种细胞集落检测算法 (ColonyMap),并揭示了一个空间组装的免疫生态位,由抗肿瘤巨噬细胞、CD8+ T 细胞和自然杀伤 T 细胞 (MT2) 组成,这与较高的生存率高度相关,并预测独立队列中免疫治疗反应的改善。这项研究是研究 SCLC 空间异质性的宝贵资源,并为潜在的患者分层和个性化治疗提供了见解。
+ + + + +



 English
English


