文献解读|Nat Cancer(23.5):空间单细胞蛋白质景观揭示vimentinhigh巨噬细胞在肝细胞癌微环境中具有免疫抑制作用
✦ +
+
论文ID
原名:Spatial single-cell protein landscape reveals vimentinhigh macrophages as immune-suppressive in the microenvironment of hepatocellular carcinoma
译名:空间单细胞蛋白质景观揭示vimentinhigh巨噬细胞在肝细胞癌微环境中具有免疫抑制作用
期刊:Nature Cancer
影响因子:23.5
发表时间:2024. 09.26
DOI号:10.1038/s43018-024-00824-y
背 景
肝癌是癌症相关死亡的第三大原因。肝细胞癌 (HCC) 是最常见的原发性肝癌类型,是全球严重的健康问题,死亡率不断上升。HCC中肿瘤微环境(TME)在空间单细胞分辨率上的异质性尚不清楚。
实验设计

结 果
01
肝细胞癌的空间单细胞表型图谱
为了全面定量HCC的空间异质性,研究团队应用索引联合检测 (CODEX)技术,设计了一个由 36 种抗体组成的 CODEX 面板来可视化 401 个 HCC 样本(图1a),同时检测 HCC 的临床特征、免疫细胞标志物[(CD4 和 CD8+ T 细胞、Treg细胞、巨噬细胞、B 细胞和抗原呈递细胞)、内皮细胞、成纤维细胞、淋巴管内皮细胞和胆道细胞、细胞状态(例如,增殖和生长、上皮-间质转化、缺氧、凋亡和能量感应)](图1b)。在细胞分割和测量标志物表达强度后,将样品以 3:1 的比例随机分成发现组和验证组,然后进行独立处理和分析。
经过质量控制后,他们在发现队列中总共鉴定出3231437个细胞,包括9种细胞类型和67种细胞表型(图1b-c)。用Voronoi图显示典型的细胞分割和身份以及相应的标记(图1d)。
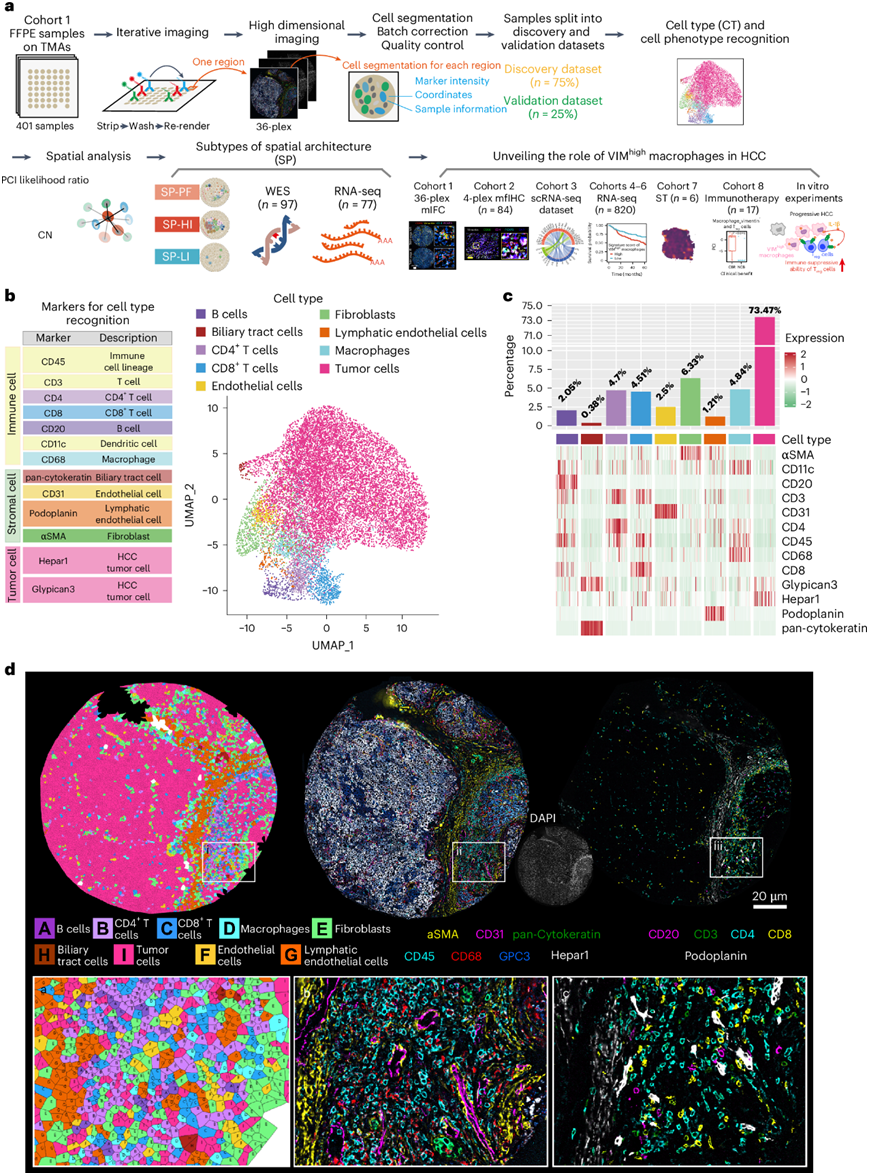
图1. 研究设计和细胞类型及表型定义。
(a) 实验示意图。(b) 根据左侧列出的标记物定义的细胞类型对子采样单细胞进行均匀流形近似和投影 (UMAP)。(c) 热图显示每种细胞类型的z分数平均标记物表达水平。(d) Voronoi 图描绘的 TMA5_8_reg043 代表性区域。
接下来,采用结合成对细胞-细胞相互作用 (PCI) 似然比和细胞邻域 (CN) 计算的空间信息分析来探究空间特征(图2a)。CN反映了基于窗口的区域细胞构成,而 PCI 侧重于两种细胞类型或表型之间的空间相互作用(图2b)。大多数以基质细胞为主的 CN 聚集在一起并呈现正相关(突出显示的区域 1)或位于同一窗口中(基于细胞类型的 CN 20/15/39/21/14/27/18)。有趣的是,具有相似状态或激活信号的不同细胞类型,例如 c-Myc+细胞(突出显示区域 2,基于细胞表型的 CN3)、Ki-67+ 细胞(突出显示区域 3,基于细胞表型的 CN30/35)、HIF1α+细胞(突出显示区域 4,基于细胞表型的 CN29)、HLA-DR+细胞(突出显示区域 5)和 CD44+细胞(突出显示区域 6,基于细胞表型的 CN9/28)倾向于在空间上聚集并且彼此呈正相关(图2b),这表明那些共有信号的细胞可能在 TME 重塑和肿瘤恶性程度中发挥重要作用。
值得注意的是,他们发现总体 CD4+ T 细胞百分比并不能对 HCC 患者的无复发生存期 (RFS) 和总生存期 (OS) 进行分层,而基于细胞类型的 CN2 中的特定 CD4+ T 细胞富集能预测不良预后,这表明具有不同空间位置的CD4+ T细胞可能在HCC进展中具有不同的作用。此外,单变量 Cox 回归分析确定了一种未表征的表型,即巨噬细胞_VIM +细胞,其在所有特征中具有最高的复发风险比 (HR),表明在 HCC 进展中起着关键作用(图2c)。值得注意的是,空间分析结果产生了有关肿瘤发生的精确信息。虽然 CD8+ T 细胞和肿瘤细胞百分比均不影响 RFS,但它们之间更大的空间相互作用改善了预后,这表明免疫浸润的物理距离很近对于预后至关重要(图2c)。
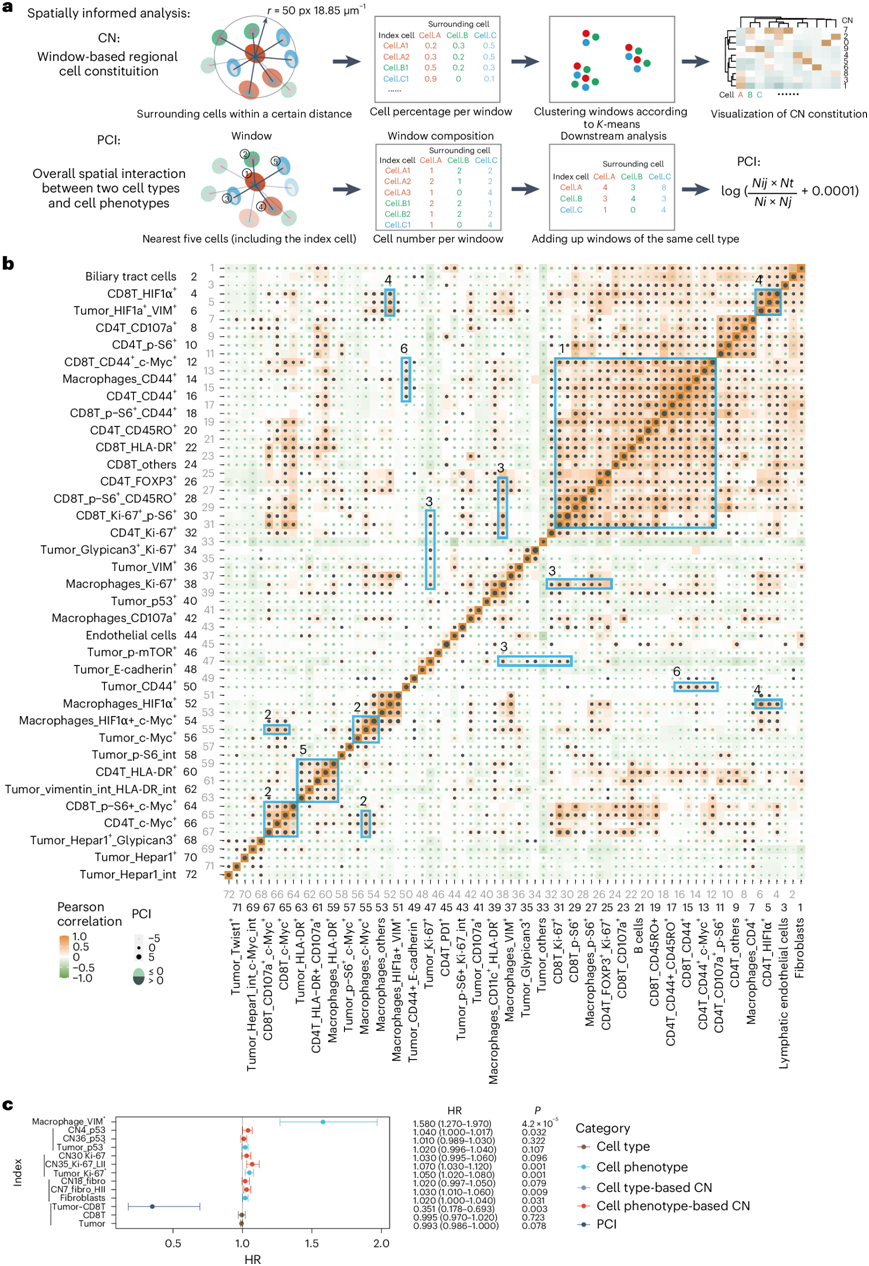
图2. HCC 的空间单细胞表型图谱。
(a) PCI 似然比和定义 CN 的计算示意图。(b) 所有区域的72种细胞类型或表型之间的成对相关性和 PCI。(c) 发现队列中指示特征的 HR 。
02
空间模式分层 HCC 患者的预后
研究团队试图探究基于功能生态位的聚类是否可以更好地解释肿瘤间异质性并分层预后。首先,他们在基于细胞类型的 CN 上尝试了这种方法,并确定了三个主要聚类,即高、中、低肿瘤纯度水平,这些聚类不能用于分层预后。接下来,基于细胞表型的 CN 上的层次聚类确定了 14 种肿瘤模式(图3a)。肿瘤模式 TP-p53 与显著更高的复发风险相关(图3b),并且与所有其他患者相比具有不同的临床结果(RFS 和 OS)(图3c)。值得注意的是,在 TP-p53 样本中观察到 p53 蛋白的显性核定位。考虑到肝细胞癌中 p53 的突变和失活频率较高,这表明细胞核中异常 p53 的积累可能导致肝细胞癌的进展。
两个具有相似组成但空间位置不同的微环境可能具有不同的特征(图2c)。例如,单变量 Cox 回归分析显示,CN4_p53 细胞 具有显著较高的复发风险,但 Tumor_p53+和 CN36_p53细胞则没有(图2c)。通过分析空间 Voronoi 图,他们观察到 CN36_p53 位于中心,由 CN4_p53 包围(图3d)。在 TP-c-Myc、TP-E-cadherin 和 TP-CD107a 中也发现了类似的环状分布(图3d)。对于 TP-p-mTOR、TP-Hepar1 或 TP-p-S6,具有两个 CN 的 CN 彼此之间以及与其他 CN 之间更加交织在一起,呈现出马赛克状分布(图3d)。有趣的是,与环状分布中位于中心的相应 CN 相比, Tumor_Ki-67+细胞在位于外围的 CN 中明显更富集(图3d-e)。由于具有外围模式的 CN 与基质和免疫 CN 更加相邻,表明基质和免疫细胞与肿瘤细胞之间的空间相互作用可能促进肿瘤细胞的增殖。此外,具有马赛克状分布的CN倾向于富集代谢相关信号(p-mTOR、p-S6、Hepar1),而具有环状分布的CN倾向于主要富集增殖相关分子(p53、c-Myc、CD107a),这表明具有多样化信号的肿瘤可能具有不同的生长模式和空间组织。

图3. HCC 样本中的肿瘤模式定义。
(a) 热图显示基于细胞表型的CN的层次聚类和基于细胞表型的CN的z得分百分比。(b) 肿瘤模式的HR。(c) 生存曲线。(d) 不同肿瘤模式中指示基于细胞表型的CN的Voronoi图。(e) 箱线图显示指示基于细胞表型的CN中Tumor_Ki-67 +细胞的特定百分比。
03
HCC 中具有不同预后的空间模式
他们假设:通过聚类稳健的 CN,可以识别出对 HCC 预后进行分层的普遍空间模式 (SP)。对选定的 15 个共同的 CN 进行聚类,确定了五种空间信息模式:(1) SP-HI:高水平免疫和基质浸润微环境,尤其是 B 型显性 CN (CN39、CN15);(2) SP-LI:低水平免疫和基质浸润微环境;(3) SP-Endo:高水平内皮细胞,相对低水平免疫和基质浸润微环境;(4) SP-TIM:更高水平的肿瘤-免疫-混合微环境;(5) SP-PF:富集增殖细胞主导的微环境和低水平免疫和基质细胞(图4a)。临床发现,SP-HI和SP-PF在肝硬化HCC中富集较多,SP-Endo和SP_LI在有包膜的HCC中富集较少,SP_LI富集较多,胆管血栓仅见于SP-HI标本,这些SP呈现多种细胞类型组成群的混合(图4b)。
这五种 SP 在 RFS 和 OS 方面均表现出对患者的明显预后分层(图4c)。值得注意的是,这些 SP 的预后价值超过了细胞类型构成组、肿瘤纯度水平和肿瘤类型(图3b)。这五种 SP 的预后分层仍然分别适用于肿瘤、淋巴结、转移 (TNM) III 和 IV 期以及 TNM I 和 II 期样本,这表明 SP 可以作为独立于传统肿瘤分期系统的可靠预后标记物。单因素Cox回归分析显示SP-PF和SP-HI与复发风险增加相关,而SP-LI与复发风险降低相关(图4d)。结合TP-p53和临床病理特征的多因素Cox回归分析表明,SP-PF、SP-HI和TP-p53是肿瘤复发的独立因素(图4e)。基于细胞表型的CN与SP-PF、SP-HI和SP-LI细胞类型的Voronoi图以及原始成像结果显示,SP-LI和SP-PF具有相似的细胞类型组成,但CN构成不同(图4f)。
他们计算了不同 SP 中所有细胞类型和表型之间的 Pearson 相关性。两种细胞类型表型之间的成对细胞相关性越显著,表明这两种细胞类型之间的通讯越多。结果显示,在 SP-PF、SP-HI 和 SP-LI 中,B 细胞、CD4+ T 细胞、CD8+ T 细胞和巨噬细胞之间的通讯极其多样化(图4g)。在 SP-PF 和 SP-LI 中,活化(CD8T_HLA-DR+)和记忆(CD8T_CD45RO+)表型与记忆 CD4T_CD45RO+表型显著相关,但在 SP-HI 中无此相关性。由于有效的细胞介导免疫需要 CD4+和 CD8+ T 细胞之间的密切合作,上述观察结果表明,SP-HI 中可能存在低效的抗肿瘤免疫。SP-PF 而非 SP-LI 显示出 CD8+和 CD4+T 细胞与巨噬细胞表型之间的通讯丰富。HCC中的肿瘤相关巨噬细胞主要通过抑制 CD4+和CD8+T细胞的抗肿瘤功能以及促进 Treg细胞的抑制功能来显示关键的促肿瘤活性。事实上,增殖的 Treg细胞与 SP-PF 中的五种巨噬细胞表型呈正相关,但与 SP-LI 中的两种巨噬细胞表型呈正相关,这表明涉及巨噬细胞和 T 细胞的更具抑制性的 TIME 可能是 SP-PF 病例中侵袭性行为的原因。此外,SP-LI 显示出 B 细胞和 T 细胞增殖、活化和记忆表型之间的相关性显著增强,表明 SP-LI 中存在有效的体液免疫反应。

图4. HCC 中具有不同预后的 SP。
(a) 热图显示基于指示细胞表型的 CN 的z分数百分比的聚类。(b) 桑基图显示 SP 与细胞类型构成之间的关系。(c) SP 的 Kaplan-Meier 生存曲线。(d) SP 的 HR。(e) RFS 的多变量分析。(f) 不同 SP 中所示基于细胞表型的 CN和细胞类型的代表性 Voronoi 图。(g) 所有具有不同 SP 的样本中细胞类型和表型之间的Pearson相关性。
04
SP 的空间、基因组和分子特征
他们将发现队列分成训练集(80%)和测试集(20%),以训练针对特定 SP 的分类器。保留的测试集中 SP-PF、SP-HI 和 SP-LI 模型的曲线下面积分别为 90.4%、92.8% 和 85.7%(图5a)。这些分类器应用于验证队列,分别预测 SP-PF、SP-HI 和 SP-LI。相应基质显性 CN 的构成与其各自的特征相当(图5b)。他们进一步将这些分类器应用于发现队列和验证队列的所有样本,发现预测的 SP 在 RFS和 OS方面存在显著差异 (图5c)。
为了确定某个空间模式的判别特征,他们根据基尼重要性(Gini importance)对分类器的前 30 个特征进行排序,并分析它们的富集水平(图5d)。进一步分别在 SP-PF、SP-HI 和 SP-LI 中确定了具有预后意义的特征(仅限训练分类器的特征)(图5e)。所代表的特征在图形中进行了总结(图5f)。SP-PF 分类器的前 30 个特征中有很多关于成纤维细胞与 CD8+T 细胞、CD4+ T 细胞、巨噬细胞和肿瘤细胞表型相互作用的特征(图5d)。成纤维细胞在 SP-PF 中复发的风险最高(图5e),表明成纤维细胞可能导致 SP-PF 病例的进展。 SP-HI 中CD4 + T、B 和 CD8 + T 细胞、淋巴管内皮细胞和巨噬细胞富集度较高,肿瘤细胞富集度较低(图5d)。CD8T_HLA-DR(一种活化表型)和 CD8 + T 细胞都是 SP-HI 中 HCC 复发的保护因素(图5e)。
在SP-LI病例中,Ki-67+细胞富集较少(图5d)。内皮细胞富集较少和肿瘤细胞富集较多是SP-LI的鉴别性特征(图5d),这表明SP-LI中可能存在缺氧微环境。由于CD8T_HIF1α+是SP-LI复发的关键风险因素(图5e),这表明缺氧可能是促进SP-LI进展的关键因素。出乎意料的是,CD8 + T细胞的数量与SP-LI复发风险的增加有关(图5e)。有趣的是,在具有预后意义的特征中,大多数成纤维细胞 PCI 特征与 SP-PF 复发风险高(7/8)相关,但与 SP-HI 复发风险低(4/4)相关,这验证了相同细胞类型或表型可能在不同的 SP 中具有不同作用。
他们对发现队列中的 SP-HI、SP-LI 和 SP-PF 样本进行了全外显子组测序 (WES) 和转录组分析(RNA-seq)(图S7a)。TP53突变在三种 SP 中没有表现出偏好,而CTNNB1突变在 SP - LI 中显著富集(图5g)。据报道,具有 CTNNB1 突变的 HCC表现出免疫“沙漠”表型,这与 SP-LI 2的特征一致。
使用estimateR、MCP-counter和CIBERSORT对转录组数据进行反卷积分析,结果与SP各自的特点比较一致:(1)SP-LI和SP-PF中的肿瘤细胞含量明显较高,而SP-HI中的免疫细胞和基质细胞含量最高(图S7b);(2)SP-HI中许多免疫细胞类型(例如T细胞、B细胞、单核细胞和巨噬细胞)的浸润增强(图S7c);(3)SP-LI中成纤维细胞的浸润最低(图S7c)。有趣的是,虽然免疫细胞的绝对浸润水平在SP之间存在显著差异,但三种SP之间的免疫细胞构成相似(图S7d)。分析了三种SP中的富集通路和差异表达基因(DEG)(图S7e-f):SP-HI富集了与炎症反应相关的项目和编码免疫球蛋白的基因;SP-LI富集了与代谢相关的通路和基因;SP-PF富集了上皮-间质转化(EMT)通路和KRAS信号通路,并且具有更高的CCNE1,FGF9,AFP和EPCAM的表达水平,表明SP-PF的侵袭性表型。
最后,他们将 SP 与之前报道的 HCC 分子分类(图S7g)进行了比较。令人信服的是,结果显示免疫类在SP-HI中富集,非免疫、S3 和 CTNNB1 类在 SP-LI 中富集,增殖类在 SP-PF 中富集。他们发现 SP-HI 还富集了增殖相关类(S1 和增殖),而 SP-PF 没有优先富集 S1、S2 和 S3 类。
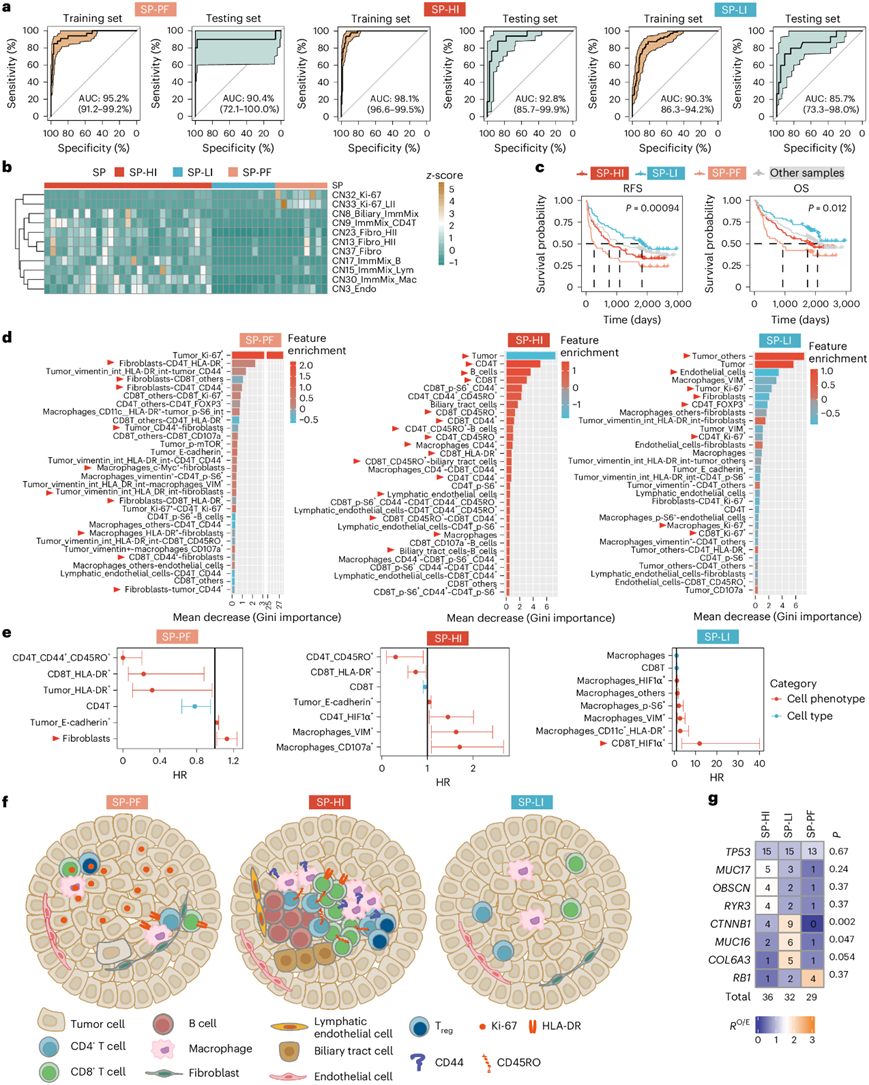
图5. SP 的判别特征。
(a) 训练和测试集中 SP-PF、SP-HI 和 SP-LI 分类器的准确度。 (b) 热图显示验证队列中指示细胞表型的 CN 的z分数百分比。(c) Kaplan-Meier 生存曲线。(d) 条形图显示指示分类器中前 30 个特征的基尼重要性(Gini Importance)。(e) 发现队列中指示特征的 HR。(f) SP-PF、SP-HI 和 SP-LI 的代表性空间图形。(g) 根据三个 SP 的 RO/E 分数显示基因组突变丰度的热图。
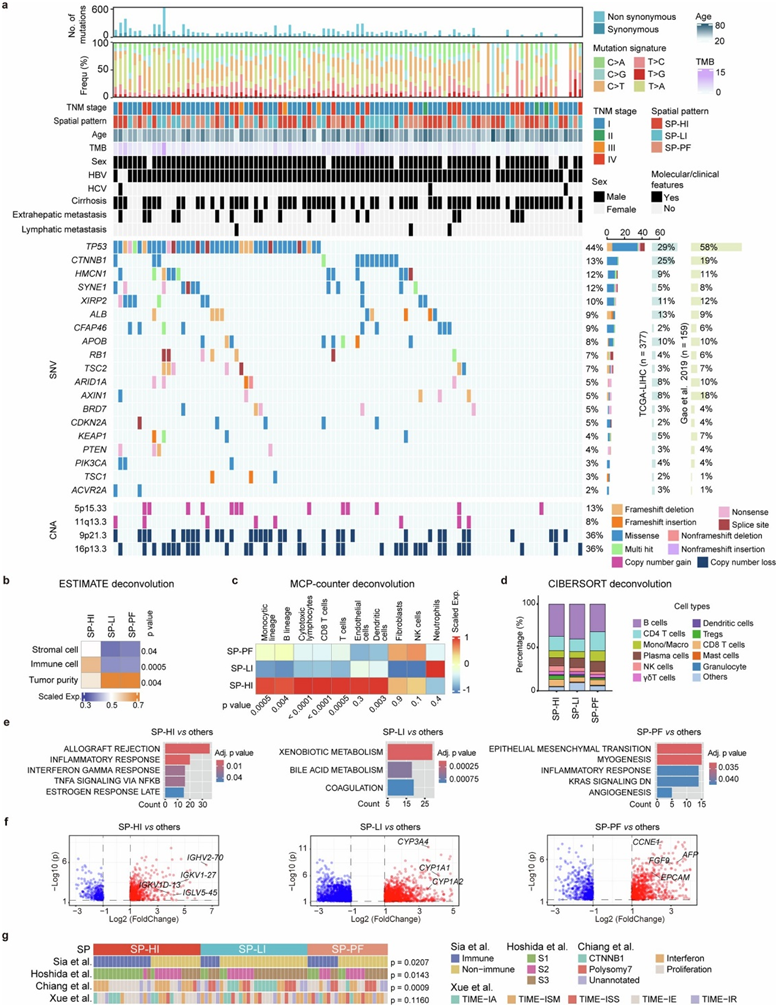
图S7. SP-HI、SP-LI 和 SP-PF 的基因组图谱和分子特征。
(a) 97 名 HCC 患者的基因特征和相关临床病理特征。(b) 热图使用 ESTIMATE 反卷积方法显示基质细胞、免疫细胞和肿瘤纯度的 z 分数估计分数。(c) 热图显示了 SP-HI、SP-LI 和 SP-PF 中不同免疫和基质细胞群的 z 分数丰度。(d) 条形图显示 SP-HI、SP-LI 和 SP-PF 中免疫细胞群的构成。(e) SP-HI相对于其他(左)、SP-LI相对于其他(中)和 SP-PF相对于其他(右)中显著上调的 DEG 的 Hallmark 通路富集。(f) 火山图显示 SP-HI 相对于其他(左)、SP-LI 相对于其他(中)和 SP-PF 相对于其他(右)中代表性上调的DEG。(g) 每个样本的预测分子亚类。
05
巨噬细胞_VIM +细胞在肝细胞癌中的进展作用
他们进一步观察到,巨噬细胞_VIM +细胞百分比较高与预后不良相关(图6a)。结合TNM III 期和 IV 期(图6b)和肝外转移性 HCC (EHM)(图6b)中巨噬细胞_VIM +细胞富集的数据,巨噬细胞_VIM +细胞可能是促进 HCC 进展的关键因素。
利用空间信息特征,他们发现巨噬细胞和 CD4 + T 细胞表型是与巨噬细胞_VIM +空间共现的主要表型(图6c)。PCI 大于零的特征经过单变量 Cox 回归分析,其中巨噬细胞_VIM +和 CD4T_FOXP3+细胞之间的 PCI 显示最高 HR(图6d)。巨噬细胞_VIM +和 CD4T_FOXP3 +细胞之间的相互作用与不良预后(RFS 和 OS)相关(图6e)。TNM III 期和 IV 期巨噬细胞_VIM +和 CD4T_FOXP3 +细胞之间的 PCI 明显高于 TNM I 期和 II 期,患有 EHM 的 HCC 也明显高于没有 EHM 的 HCC(图6f)。与各自的对照相比,在 TNM III 期和 IV 期以及 EHM 型肝癌中,巨噬细胞_VIM +和 CD4T_FOXP3 +细胞之间的距离明显缩短(图6g-h)。他们发现了TNM III 期和 IV 期中巨噬细胞_VIM + 和 CD4T_FOXP3+ 细胞的共定位(图6i)。总之,这表明巨噬细胞_VIM+细胞及其与 Treg细胞的相互作用在肝癌发展中起着促进作用。

图6. 巨噬细胞_VIM +和Treg细胞共现与肿瘤恶性行为相关。
(a) Kaplan-Meier 生存曲线。(b) 箱线图显示不同组样品中巨噬细胞_VIM+细胞的百分比。(c) 细胞相互作用表型。(d) 细胞表型之间的 PCI HR。(e) Kaplan-Meier 生存曲线。(f) T reg和 macrophage_VIM +细胞之间的 PCI 密度图。(g-h) Treg和 macrophage_VIM+细胞之间的距离差异。(i) TNM 阶段 IVB 和 IB 区域的代表性图像。
06
肝细胞癌中 VIMhigh巨噬细胞与 Treg细胞同时出现
他们使用多重荧光免疫组织化学 (mfIHC)验证了VIMhigh巨噬细胞和 T reg细胞的空间共定位确实与独立 HCC 队列(队列 2)中的 HCC 进展相关(图7a-b)。然后,他们结合已发布的 HCC scRNA-seq 数据集(队列 3)进一步分析。在CODEX 队列中,巨噬细胞_VIM +细胞约占总巨噬细胞的 10%。因此,他们将VIM表达排名前 10% 的巨噬细胞归类为 VIMhigh巨噬细胞,其他归类为 VIMlow巨噬细胞。VIMhigh巨噬细胞主要存在于聚类1 和 6 中(图7c)。DEG 富集分析表明炎症相关通路在VIMhigh巨噬细胞中高度富集(图7d)。由于VIMhigh巨噬细胞并不局限于一个聚类,而是扩散到几个聚类中,这表明VIMhigh巨噬细胞可能是高度炎症巨噬细胞的混合物。
为了用独立的数据集验证VIMhigh巨噬细胞在 HCC 中的作用,他们使用VIMhigh巨噬细胞中上调最多的 50 个基因定义了一个基因特征。三个独立的 HCC 队列(队列 4-6)显示,较高的VIMhigh巨噬细胞特征评分与 HCC 预后较差相关(图7e)。VIMhigh巨噬细胞和 Treg细胞的特征评分之间存在显著的正相关性(图7f)。
为了进一步证实VIMhigh巨噬细胞和 Treg细胞的空间共定位,对五个已发表的 ST 数据集和本研究中的一个 ST 数据集进行了分析,如下所示(队列 7):(1)VIMhigh巨噬细胞和 T reg细胞的特征分数的共定位;(2)VIMhigh巨噬细胞和 T reg特征分数之间的相关性;(3)VIMhigh巨噬细胞和 T reg共定位点的通路富集分析(图7g-r)。综上所述,在所有共定位聚类中均发现 VIMhigh巨噬细胞和 T reg细胞呈显著正相关。在所有样本中,均在共定位聚类中发现了 EMT 富集。EMT 是肿瘤细胞的转移前过程。这些结果进一步证实了VIMhigh巨噬细胞和 T reg细胞的共定位,并表明这种共定位可能有助于 HCC 的进展。
此外,与无临床获益 (NCB) 病例相比,在具有临床获益反应 (CBR) 的病例中,巨噬细胞_VIM+和 T reg细胞之间的 PCI明显更高(图7s-t)。综上所述,VIMhigh巨噬细胞和 Treg细胞之间的空间相互作用有利于肿瘤进展和免疫逃逸。
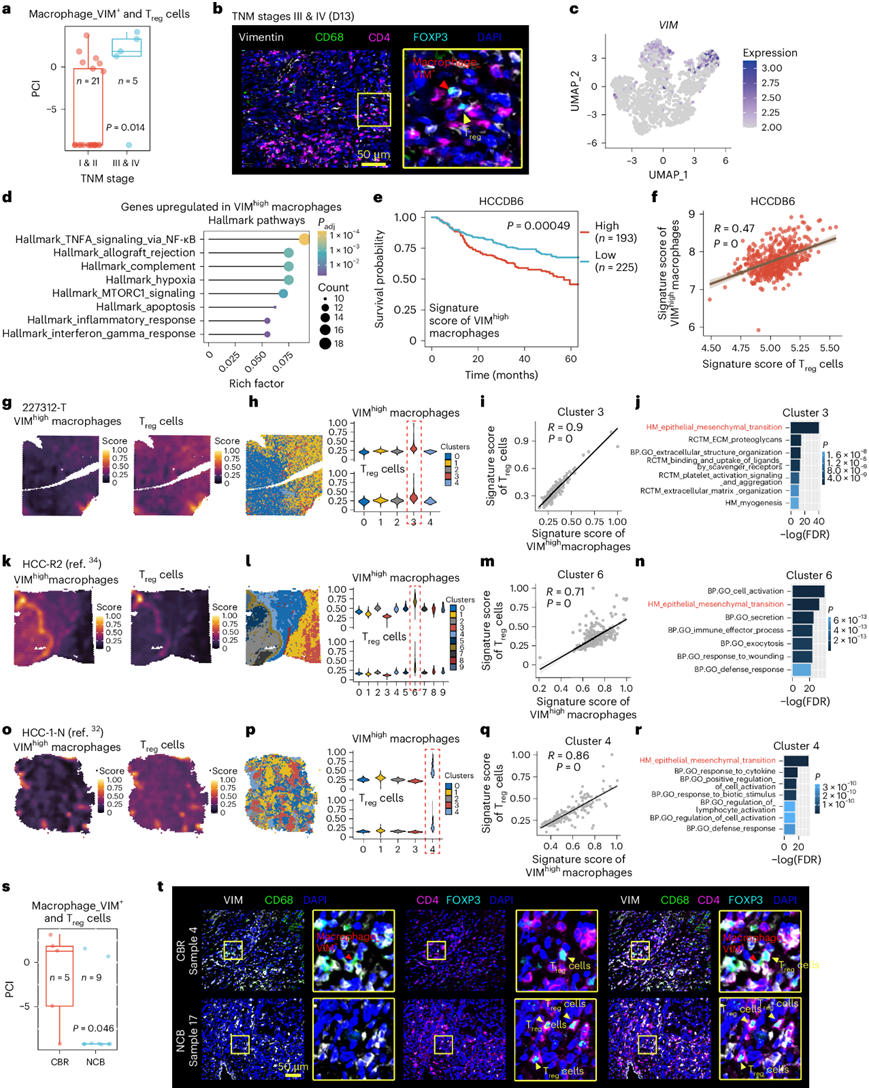
图7. 巨噬细胞_VIM+和 Treg细胞的共存有利于 HCC 的免疫治疗。
(a) Treg和巨噬细胞_VIM+细胞之间的 PCI 箱线图。 (b) TNM III 期和 IV 期T reg和巨噬细胞_VIM +细胞之间相互作用的代表性图像。(c) 巨噬细胞亚群中VIM表达水平的 UMAP 图。(d) 标志通路富集分析。(e) 生存曲线。(f) HCCDB6中所示特征分数之间的双侧 Pearson 相关性 。(g,k,o) 所示特征分数的空间特征图。(h,l,p) ST点的无偏聚类(左)和小提琴图显示聚类中所示特征分数。(i,m,q) 双侧Spearman相关性。(j,n,r) 基因集富集分析(GSEA)。(s)T reg与 macrophage_VIM +细胞之间的 PCI 箱线图。(t) 代表性免疫染色。
07
VIMhigh巨噬细胞通过白细胞介素-1β增强 Treg细胞抑制
接下来,他们进行了NicheNet 分析,发现了潜在的配体-受体对(图8a-b)。T reg细胞中靶基因的富集分析显示“细胞对白细胞介素 1 (IL-1) 的反应”和“对干扰素-γ (IFNγ) 的反应”的富集(图8c),这表明VIMhigh巨噬细胞可能通过白细胞介素 1β (IL-1β) 和 IFNγ 调节 T reg细胞,与 VIM低巨噬细胞相比,这两者在VIMhigh巨噬细胞中均显著上调(图8d)。
他们验证了IL-1β和VIM在直接来自临床HCC肿瘤组织的巨噬细胞(图8e)以及在由THP1和U937分化的巨噬细胞中共表达(图8f-g)。他们在 THP1、U937 和人单核细胞衍生的巨噬细胞 (hMDM) 中成功分化为 M0、M1 和 M2 巨噬细胞。在 hMDM、THP1 和 U937 的 M1 状态下证实了 IL-1β mRNA 和分泌水平的上调(图8h-j)。与 hMDM 和 THP1 的 M0 和 M2 巨噬细胞相比,M1 巨噬细胞中 VIM 的 mRNA 水平升高(图8h-i)。在促炎信号刺激后,活化的巨噬细胞可以分泌 VIM。与 THP1 的 M0 和 M2 巨噬细胞相比,M1 巨噬细胞中 VIM 的分泌增加(图8k)。
有趣的是,与 U937 的 M2 巨噬细胞相比,M1 中 VIM 的 mRNA 水平没有显著变化(图8j);在 M0、M1 和 M2 U937 细胞的上清液中可以检测到少量分泌的 VIM(图8k)。外源性VIM过表达上调了 THP1 衍生的巨噬细胞中 IL-1β 的分泌,但没有上调 U937 衍生的巨噬细胞中 IL-1β 的分泌(图8l)。在 THP 细胞中发现VIM过表达后 VIM 分泌增加,但在 U937 细胞中没有发现(图8m)。用来自 THP1-VIM OE静息细胞而非 U937-VIM OE细胞的条件培养基 (CM) 处理 THP1 衍生的巨噬细胞可显著增加 IL-1β 的分泌。重组VIM 蛋白处理成功上调了 THP1 和 U937 衍生巨噬细胞中 IL-1β 的分泌(图8n)。总之,这些数据表明细胞外 VIM 可以上调巨噬细胞中 IL-1β 的分泌。
接下来,他们试图验证VIMhigh巨噬细胞是否可以通过 IL-1β调节 Treg细胞的抑制功能。由于 M1 状态的 THP1 衍生巨噬细胞具有高VIM和IL1B表达,他们将其视为VIMhigh巨噬细胞的模型。使用直接从外周血单核细胞(PBMC)分离的Treg细胞和从 CD4 + T 细胞分化的 Treg细胞。与来自 THP1 细胞的 M0 巨噬细胞(M0-CM)的 CM 相比,来自 THP1 细胞的 M1 巨噬细胞(M1-CM)的 CM 显著增加了 T reg的 IL-10 的 mRNA 和分泌水平,这可以通过抗 IL-1β 中和抗体逆转(图8o)。此外,与 M0-CM 相比,用 M1-CM刺激 Treg细胞更能有效抑制 CD4 +应答 T (Tresp) 细胞的增殖,而使用抗 IL-1β 中和抗体也可以逆转这一现象(图8p)。这些体外实验表明,VIMhigh巨噬细胞可以通过 IL-1β 促进 Treg细胞的抑制能力(图8q)。

图8. VIMhigh巨噬细胞通过 IL-1β促进 T reg细胞的免疫抑制能力。
(a-c) NicheNet 分析。(d) 小提琴图显示 VIMhigh和 VIMlow巨噬细胞中IL1B的表达水平。 (e) 流式细胞分析。(f-g) 流式细胞分析。(h-j) IL1B 的 mRNA 水平(左) 、IL-1β 的分泌水平( 中)和VIM 的mRNA水平。(k) VIM 的分泌水平。(l) IL-1β分泌水平。(m) VIM分泌水平。(n) 重组人VIM处理后M0巨噬细胞中VIM分泌水平的变化。(o) Treg细胞中的 mRNA 水平和 IL-10 分泌水平。(p) Treg体外抑制试验。(q) 图形说明 VIMhigh巨噬细胞-IL-1β-Treg细胞调节轴在促进 HCC 进展中的作用。
+ + + + + + + + + + +
结 论
通过解析肝癌的空间肿瘤生态系统,本项研究确定了具有不同预后和基因组和分子特征的空间模式,并揭示了VIMhigh巨噬细胞的进展作用。对八个独立队列的整合分析表明,VIMhigh巨噬细胞和Treg细胞的空间共存促进了肿瘤进展并有利于免疫治疗。功能研究进一步表明,VIMhigh巨噬细胞通过增加白细胞介素-1β 的分泌来增强调节性 T 细胞的免疫抑制活性。本项研究揭示了VIMhigh巨噬细胞在 HCC 进展过程中的关键作用,这对于个性化的癌症预防和药物发现具有潜力,并强调了解决癌症治疗的空间信息特征的必要性。
+ + + + +



 English
English


