文献解读|Bone Res(12.7):肠道微生物代谢物靶向成纤维细胞样滑膜细胞中的 HDAC3-FOXK1-干扰素轴以改善类风湿性关节炎
✦ +
+
论文ID
原名:Gut microbial metabolite targets HDAC3-FOXK1-interferon axis in fibroblast-like synoviocytes to ameliorate rheumatoid arthritis
译名:肠道微生物代谢物靶向成纤维细胞样滑膜细胞中的 HDAC3-FOXK1-干扰素轴以改善类风湿性关节炎
期刊:Bone Research
影响因子:12.7
发表时间:2024.05.23
DOI号:10.1038/s41413-024-00336-6
背 景
类风湿性关节炎 (RA) 是一种自身免疫性疾病。早期研究认为肠道菌群是环境获得的,与 RA 易感性有关。然而,越来越多的证据表明,遗传因素也会影响肠道菌群。已知一些近交系实验室小鼠品系对胶原诱导性关节炎 (CIA) 高度敏感,而其他品系对 CIA 具有抗性。
实验设计
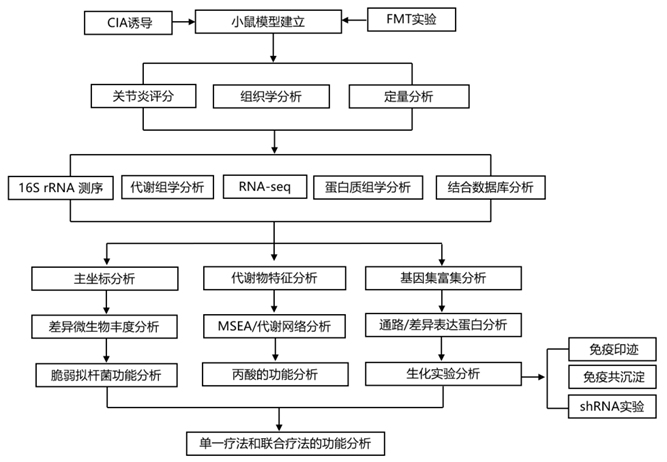
结 果
01
C57BL/6J 小鼠的粪便微生物群赋予 DBA/1J 小鼠对 CIA 的抵抗力
研究团队进行了 CIA 诱导,以确认饲养环境中 C57BL/6J 小鼠和 DBA/1J 小鼠对 CIA 的不同易感性。为了检测 C57BL/6J 小鼠是否具有抗关节炎的肠道菌群,他们收集了未免疫的 C57BL/6J 小鼠和 DBA/1J 小鼠的粪便样本,并在 CIA 发作前对 DBA/1J 小鼠进行了粪便菌群移植 (FMT) 实验(图1a)。与接受供体 DBA/1J 小鼠粪便混合物的小鼠相比,接受供体 C57BL/6J 小鼠粪便混合物的 DBA/1J 小鼠的关节炎评分较低(图1b)。显微CT 、苏木精和伊红 (H&E) 和番红 O 和固绿 (SafO-FG) 染色的组织学分析显示,接受供体 C57BL/6J 小鼠粪便混合物的 DBA/1J 小鼠的骨质侵蚀、滑膜炎症和软骨侵蚀减轻(图1c-d)。骨表面与骨体积比 (BS/BV)、骨质侵蚀、滑膜炎症和软骨侵蚀的定量一致表明,供体 C57BL/6J 小鼠和受体 DBA/1J 小鼠之间的 FMT 赋予了对 CIA 的抗性(图1e)。
他们使用未免疫的DBA/1J小鼠和C57BL/6J小鼠的粪便样本进行了高通量16S rRNA基因测序分析。通过基于未加权UniFrac距离的主坐标分析(PCoA)分析了微生物群落的β多样性。DBA/1J和C57BL/6J小鼠之间的微生物组成有明显的分离(图1f)。DBA/1J和C57BL/6J小鼠品系之间的肠道菌群组成存在统计学上的显著差异(图1g)。热图分析显示在DBA/1J小鼠和C57BL/6J小鼠中共检测到91个细菌操作分类单元(OUT)(图1h)。火山图显示了两种小鼠品系在属水平上的差异丰度OTU,其中拟杆菌属是C57BL/6J小鼠中富集最多的属(图1i)。然后,进行线性判别分析(LDA)效应尺寸分析,显示在C57BL/6J小鼠中有5个分类单元以LDA得分> 3的方式富集,其中也包括拟杆菌属(图1j)。他们还使用已建立CIA的DBA/1J和C57BL/6J小鼠的粪便样本进行了16S rRNA基因测序(图S2A),观察到两种小鼠品系之间肠道菌群组成的差异(图S2B-C)。C57BL/6J小鼠中拟杆菌属的相对丰度也高于DBA/1J小鼠(图S2D)。他们在未免疫的DBA/1J小鼠和C57BL/6J小鼠中对不同微生物进行了分析,验证了脆弱拟杆菌、B. eggerthii和B.stercoris在C57BL/6J小鼠粪便样本中的富集程度明显高于其他微生物(图1k)。先前的研究报道,经B. eggerthii灌胃的小鼠可能发生更严重的结肠炎,而B. stercoris与患结直肠癌的风险较高有关。因此,他们将重点研究脆弱拟杆菌。C57BL/6J小鼠粪便中脆弱拟杆菌的丰度也高于已建立CIA的DBA/1J小鼠(图S2E)。此外,他们还比较了GMrepo数据库中RA患者和健康对照(HC)的粪便中拟杆菌和脆弱拟杆菌的丰度,发现RA患者的拟杆菌和脆弱拟杆菌水平低于HC(图1l-m),这些结果提示脆弱拟杆菌可能与关节炎抵抗有关。
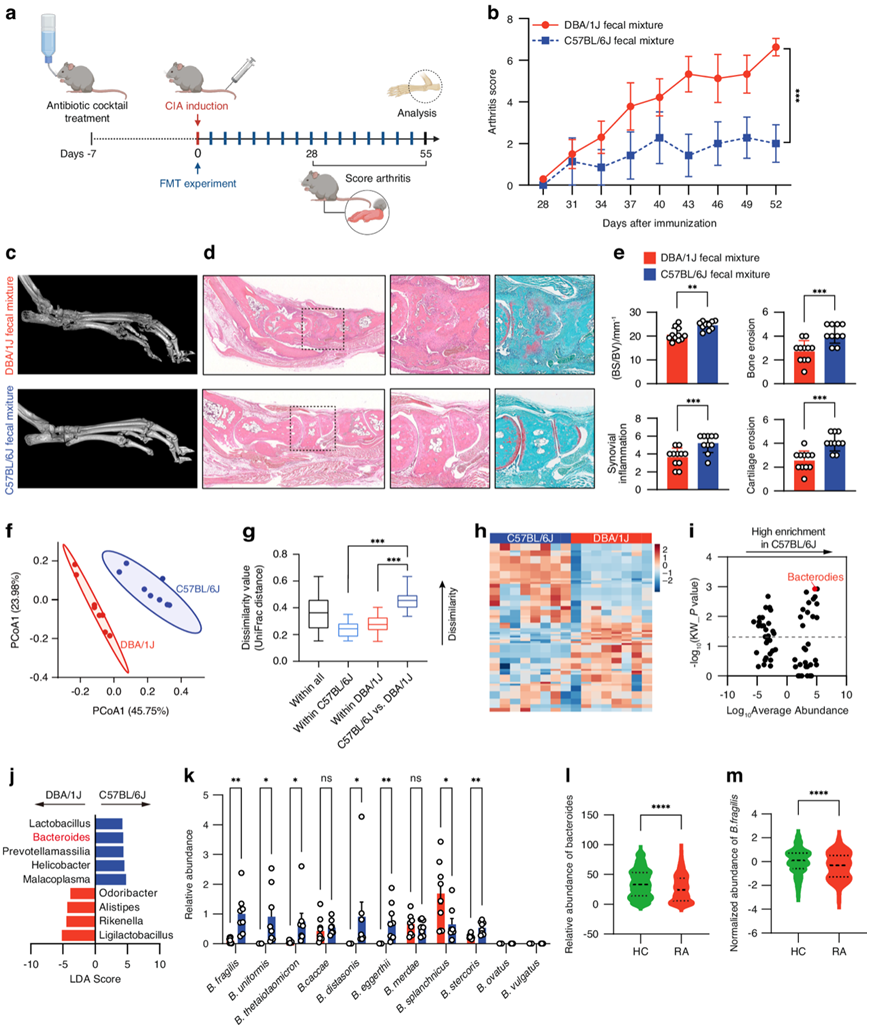
图1. 供体 C57BL/6J 小鼠和受体 DBA/1J 小鼠的粪便微生物群移植和肠道微生物群的差异组成。
(a) 小鼠中的粪便微生物群移植 (FMT) 的图示。(b) 评估FMT后小鼠的关节炎评分。(c) FMT后小鼠的代表性显微 CT 图像。(d) H&E 和 SafO-FG 染色图像。(e)分析骨表面与骨体积的比率 (BS/BV),定量H&E 染色切片上的滑膜炎症和骨侵蚀,以及 SafO-FG 染色切片上的软骨侵蚀。(f) 主坐标分析 (PCoA) 图。(g) 箱线图显示样本内和样本间的未加权 UniFrac 距离。(h) 小鼠的细菌操作分类单元 (OTU) 丰度热图。(i) 火山图显示未免疫的 C57BL/6J 小鼠在属级别上的微生物 OTU 的差异丰度分布。(j) 差异微生物丰度。(k) 相对丰度分析。 (l) 粪便中拟杆菌的相对丰度 。(m) 粪便中脆弱拟杆菌的标准化丰度。
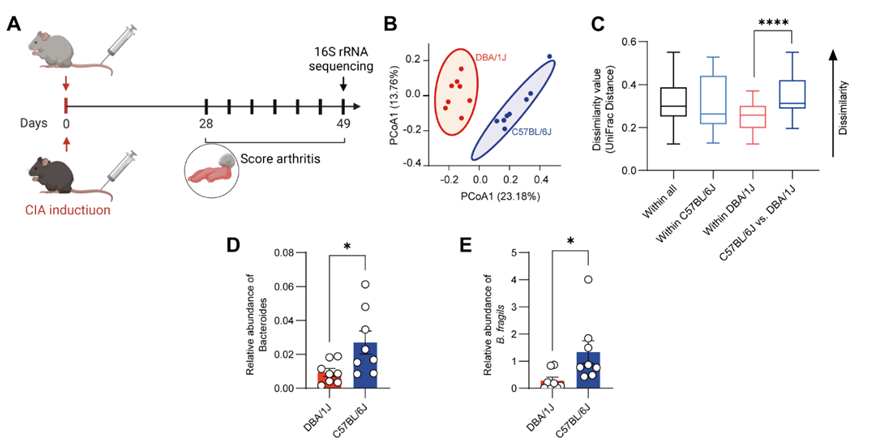
图S2. 小鼠肠道菌群组成的差异。
(a) 16S rRNA测序流程图。 (b) 16S rRNA基因测序数据的PCoA图描绘了C57BL/6J小鼠和DBA/1J小鼠之间微生物组成的差异。(c) 箱线图显示样本内部和样本之间未加权的UniFrac距离。(d) 通过16S rRNA测序检测已建立CIA的C57BL/6和DBA/1J小鼠粪便中拟杆菌的相对丰度。(e) 采用实时荧光定量PCR检测C57BL/6和DBA/1J小鼠粪便中脆弱拟杆菌的相对丰度。
02
移植脆弱拟杆菌可改善 DBA/1J 小鼠的关节炎
他们评估了脆弱拟杆菌移植对CIA的保护潜力。在CIA发病前,DBA/1J小鼠口服脆弱拟杆菌或培养基(对照)(图2a),给药后证实了脆弱拟杆菌的定殖效果(图2b)。与对照组相比,脆弱拟杆菌移植显著降低了DBA/1J小鼠的血清IgG和关节炎评分(图2c-d)。显微ct和组织学检查显示,脆弱拟杆菌可改善DBA/1J小鼠的骨侵蚀、滑膜炎症和软骨侵蚀(图2e-f)。BS/BV、骨侵蚀、滑膜炎症和软骨侵蚀的定量证实了脆弱拟杆菌对DBA/1J小鼠关节炎的保护作用(图2g)。此外,他们还评估了脆弱拟杆菌移植对已建立CIA的DBA/1J小鼠的治疗潜力。II型胶原免疫后,表现出关节炎症状的DBA/1J小鼠口服脆弱拟杆菌或培养基(对照)(图2h)。他们观察到脆弱拟杆菌在CIA小鼠体内的有效定植(图2i)。移植脆弱拟杆菌导致血清IgG和关节炎评分降低(图2j-k),并抑制CIA小鼠的骨侵蚀、滑膜炎症和软骨侵蚀(图2l-n)。这些结果表明脆弱拟杆菌可能是一种有益的肠道细菌,可以预防关节炎的发生和发展。
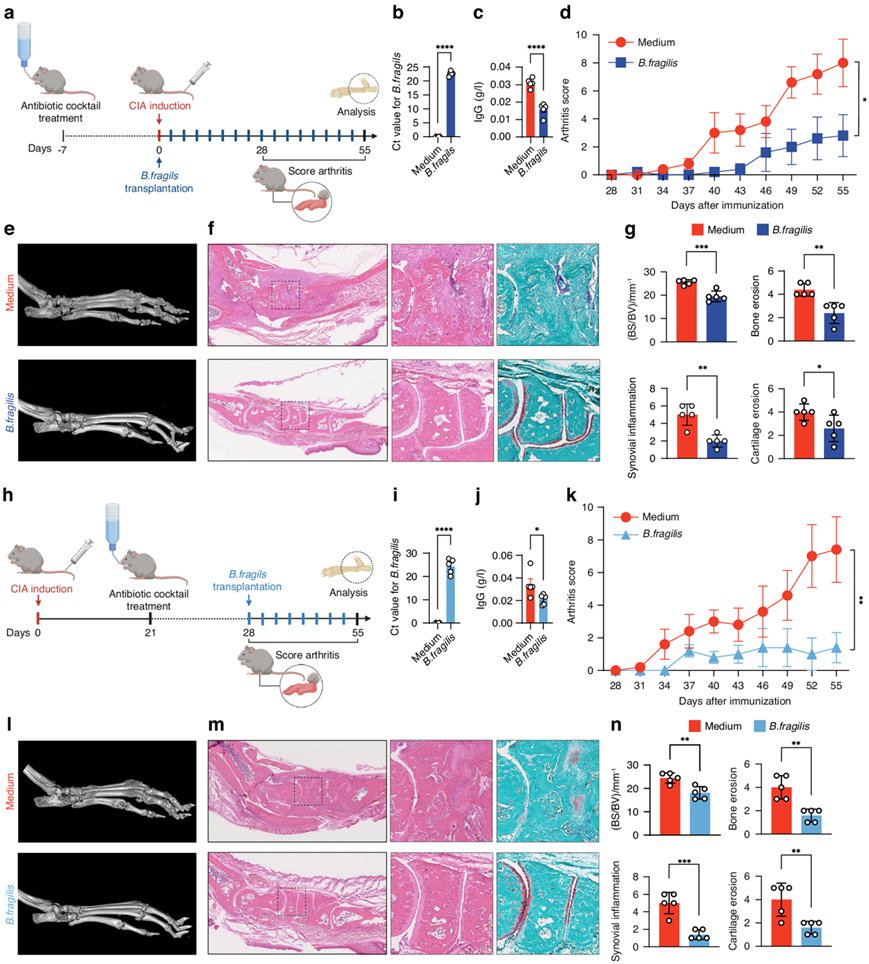
图2.移植脆弱拟杆菌对DBA/1J小鼠关节炎发展的影响。
(a)实验流程图。(b) 实时 PCR 检测脆弱拟杆菌移植一周后 DBA/1J 小鼠中脆弱拟杆菌的定植效果。(c)小鼠血清 IgG 水平。 (d) 小鼠的关节炎评分。(e) 代表性显微 CT图像。(f) H&E 和 SafO-FG 染色图像。(g) 检测BS/BV,定量 H&E 染色切片上的滑膜炎症和骨侵蚀,以及 SafO-FG 染色切片上的软骨侵蚀。(h) 实验流程图。(i) 小鼠中脆弱拟杆菌的定植效果。(j) 小鼠血清IgG 水平。 (k) 小鼠的关节炎评分。(l) 代表性显微 CT 图像。(m) H&E 和 SafO-FG 染色图像。(n) 检测BS/BV,定量 H&E 染色切片上的滑膜炎症和骨侵蚀,以及 SafO-FG 染色切片上的软骨侵蚀。
03
脆弱拟杆菌衍生的丙酸参与抵抗关节炎
拟杆菌通过发酵膳食多糖产生各种短链脂肪酸。利用Picrust2软件和MetaCyc数据库,他们对与SCFA代谢相关的功能谱进行了基于16S rRNA基因测序的预测。与DBA/1J小鼠相比,C57BL/6J小鼠的糖酵解、淀粉降解、丙酮酸发酵成丙酸和蔗糖降解等与SCFA产生相关的代谢通路富集更为显著(图3a)。与DBA/1J小鼠相比,C57BL/6J小鼠具有更高水平的丙酸、丁酸和戊酸,而乙酸和异丁酸含量则较低(图3b)。由于脆弱拟杆菌是C57BL/6J小鼠中优势物种,且脆弱拟杆菌移植可改善DBA/1J小鼠的关节炎,因此他们检测了脆弱拟杆菌发酵培养基中的丙酸、丁酸和戊酸含量,发现脆弱拟杆菌产生的丙酸多于丁酸和戊酸(图3c),这表明脆弱拟杆菌产生的丙酸可能与抗关节炎有关。
他们还收集了RA和HC个体的血浆样本并进行非靶向代谢组学分析(图3d)。代谢组学总离子色谱图云图、三维主成分分析(3D-PCA)得分图和正交偏最小二乘判别分析(OPLS-DA)得分图显示,RA与HC个体具有不同的代谢物谱(图3e-g)。RA患者和HC个体之间存在多种显著变化的代谢物。代谢物集富集分析(MSEA)显示,与HC个体相比,RA患者的SCFA相关代谢通路,例如TCA循环、丙酮酸代谢以及淀粉和蔗糖代谢均显著下调(图3h)。结合生化通路和化学关系的代谢网络表明,HC个体的TCA循环、丙酮酸代谢、淀粉和蔗糖代谢显著富集(图3i)。此外,他们使用靶向代谢组学检测了血浆样本中的丙酸水平,发现RA患者血浆中的丙酸水平低于HC个体(图3j)。这些结果提示,RA患者SCFA相关代谢通路异常,导致丙酸生成减少,丧失对关节炎的抵抗力。
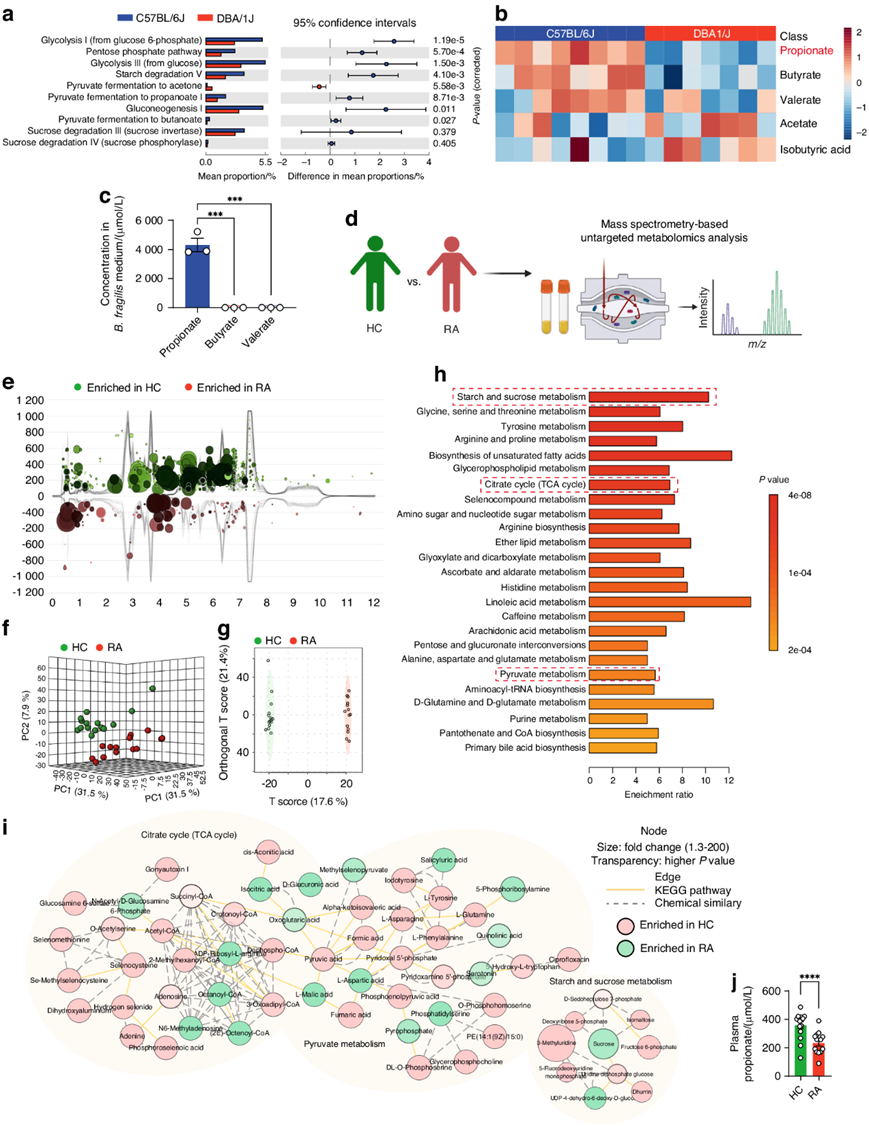
图3. 肠道微生物功能概况预测及人血浆代谢组学分析。
(a) 16S rRNA 基因测序数据预测功能概况。(b) 热图显示通过气相色谱-质谱 (GC-MS) 检测到的粪便短链脂肪酸 (SCFA) 的相对水平。(c) 通过 GC-MS 检测到的脆弱拟杆菌发酵培养基中的丙酸、丁酸和戊酸水平。(d) 非靶向血浆代谢组学分析示意图。(e) 血浆中显著代谢物特征的代谢组总离子色谱云图。 (f) 代谢特征的三维主成分分析 (3D-PCA) 得分图。(g) 血浆代谢特征的正交偏最小二乘判别分析 (OPLS-DA) 得分图。(h) 代谢物集富集分析 (MSEA)。(i) 生化通路和化学关系的代谢网络。(j) 血浆丙酸水平。
04
丙酸盐体外抑制 RA-FLS 的病理表型
在RA的发展过程中,成纤维细胞样滑膜细胞 (FLS)获得一系列肿瘤样表型,包括超增殖能力,增强迁移和侵袭能力以及促进细胞凋亡的抵抗。此外,RA-FLS产生炎症介质,如IL-6、IL-1β、TNF-α和MMP。他们研究了丙酸是否对RA-FLS的生存能力有影响,RA-FLS的特征是纤维母细胞生物标志物THY1和vimentin阳性表达,巨噬细胞标志物CD68缺失。CCK-8和克隆形成实验显示丙酸在体外以浓度依赖的方式降低RA-FLS的增殖(图4a-b)。他们还研究了丙酸盐对RA-FLS其他侵袭性表型的影响。Transwell实验表明,丙酸处理的RA-FLS比用载体处理的细胞更能抑制细胞的迁移和侵袭(图4c)。伤口愈合实验证实丙酸治疗后RA-FLS的迁移受到抑制(图4d)。流式细胞分析显示丙酸促进了RA-FLS的凋亡(图4e)。炎症相关基因(MYD88、NF-κ b、ICAM、PTPN2和TLR3)、趋化因子和炎症因子(CXCL11、TNFα、CCL2、IL-6和CXCL8)以及迁移和侵袭相关基因(MMP13、PDGFR和MMP1)的mRNA表达量在丙酸处理的RA-FLS中低于载体处理的RA-FLS(图4f-h)。
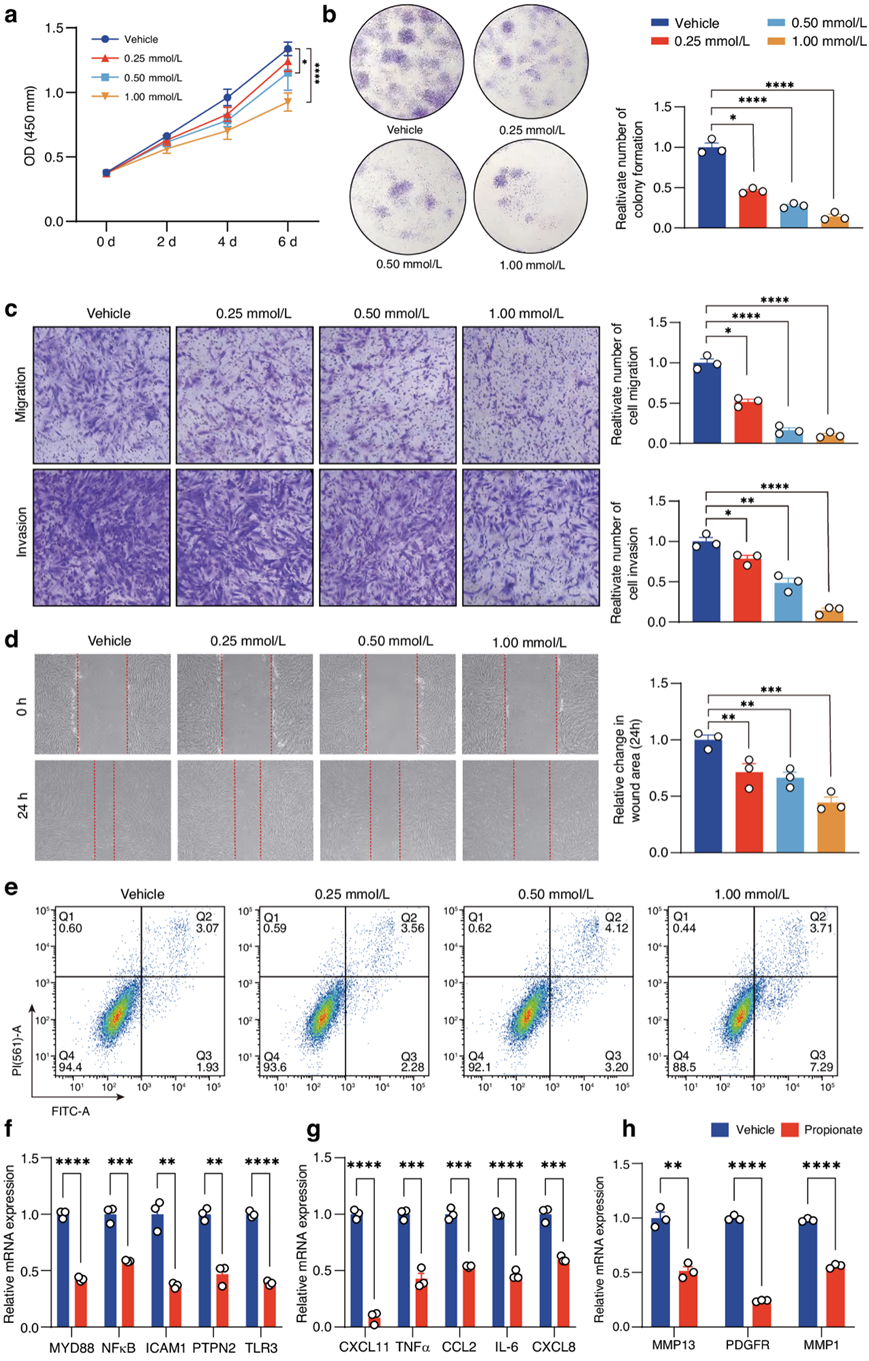
图4. 丙酸对体外 RA-FLS 肿瘤样表型的影响。
(a) RA-FLS 的活力。(b) RA-FLS 的克隆形成。(c) Transwell分析。(d) 伤口愈合试验结果。(e) 细胞凋亡分析。 (f-h) 炎症相关基因、趋化因子和炎症细胞因子以及迁移和侵袭相关基因的相对 mRNA 表达。
05
丙酸破坏HDAC3-FOXK1相互作用,降低FOXK1蛋白稳定性
为了探索丙酸抑制RA-FLS病理表型的机制,他们对丙酸或载体处理的RA-FLS进行了转录组分析(RNA-seq)(图5a)。热图分析显示,丙酸处理的RA-FLS和载体处理的RA-FLS之间存在许多差异表达基因(DEG)(图5b)。基因集富集分析(GSEA)显示,在丙酸处理后,涉及RA-FLS免疫和肿瘤样转化的通路,例如干扰素反应、通过NF-κB的TNF信号传导、炎症反应、KRAS信号传导、上皮间质转化和白细胞介素(IL6和IL2)显著下调(图5c)。他们还对用丙酸或载体处理后的RA-FLS进行了蛋白质组学分析(图5d)。在丙酸盐处理的RA-FLS和溶剂处理的RA-FLS之间检测到了差异表达的蛋白质(图5e)。蛋白质组学数据的功能富集分析表明,在丙酸盐处理的RA-FLS中,干扰素反应、适应性免疫系统和白细胞介素等信号通路下调(图5f)。他们还根据RNA-seq和蛋白质组学数据进行了Venn分析,以显示丙酸盐处理的RA-FLS中下调的蛋白质编码基因(图5g)。重叠的蛋白质编码基因主要参与干扰素通路(图5h),暗示丙酸盐主要阻断干扰素通路来抑制RA-FLS的病理表型。
为了探究丙酸如何调控RA-FLS中的干扰素通路,他们分析了蛋白质组学分析确定的两组之间干扰素通路中所有差异表达蛋白(图5i)。他们注意到,在RA-FLS中,丙酸在蛋白质水平上下调FOXK1,但在mRNA水平上没有下调(图5i-j)。FOXK1基因敲低抑制了RA-FLS中干扰素通路基因、炎症相关基因、趋化因子和炎症细胞因子以及迁移和侵袭相关基因的表达(图5k-o)。丙酸盐是表观遗传调节剂HDAC3的抑制剂。为了测试FOXK1是否是ra-fls中HDAC3的新底物,他们进行了共免疫沉淀实验,结果显示FOXK1与HDAC3相互作用(图5p)。他们使用丙酸盐或另一种hdac抑制剂曲古司汀A (TSA)来控制HDAC3活性。TSA以浓度依赖的方式增加了RA-FLS中FOXK1的乙酰化(图5q),降低了FOXK1和干扰素信号传导关键介质(STAT1和STAT2)的蛋白水平。tsa诱导的FOXK1降解可以由溶酶体抑制剂Bafilomycin A1 (BafA1)而不是由蛋白酶体抑制剂MG132逆转(图5r),这表明HDAC3和FOXK1之间的相互作用是保护FOXK1免受溶酶体系统介导的降解以维持干扰素信号传导所必需的。丙酸破坏了 RA-FLS 中 FOXK1 和 HDAC3 之间的相互作用(图5s)。丙酸处理后,RA-FLS 中 FOXK1 的赖氨酸乙酰化水平升高(图5t)。丙酸以浓度依赖性方式降低 FOXK1、STAT1 和 STAT2 的蛋白水平(图5u)。除了抑制 HDAC 之外,SCFA 还通过 G 蛋白偶联受体 (GPCR) 诱导的信号传导发挥作用。他们检测了ra-fls中GPR41、GPR43和HDAC3的水平。RA-FLS中GPR41和GPR43均未表达,但HDAC3表达水平较高。
综上所述,他们认为在病理条件下,HDAC3与FOXK1相互作用,使FOXK1去乙酰化,通过抑制其溶酶体降解提高FOXK1蛋白稳定性,导致干扰素信号传导增强,激活RA-FLS,而丙酸破坏HDAC3-FOXK1相互作用,降低FOXK1蛋白稳定性,导致干扰素信号传导阻断,使RA-FLS失活(图5v)。
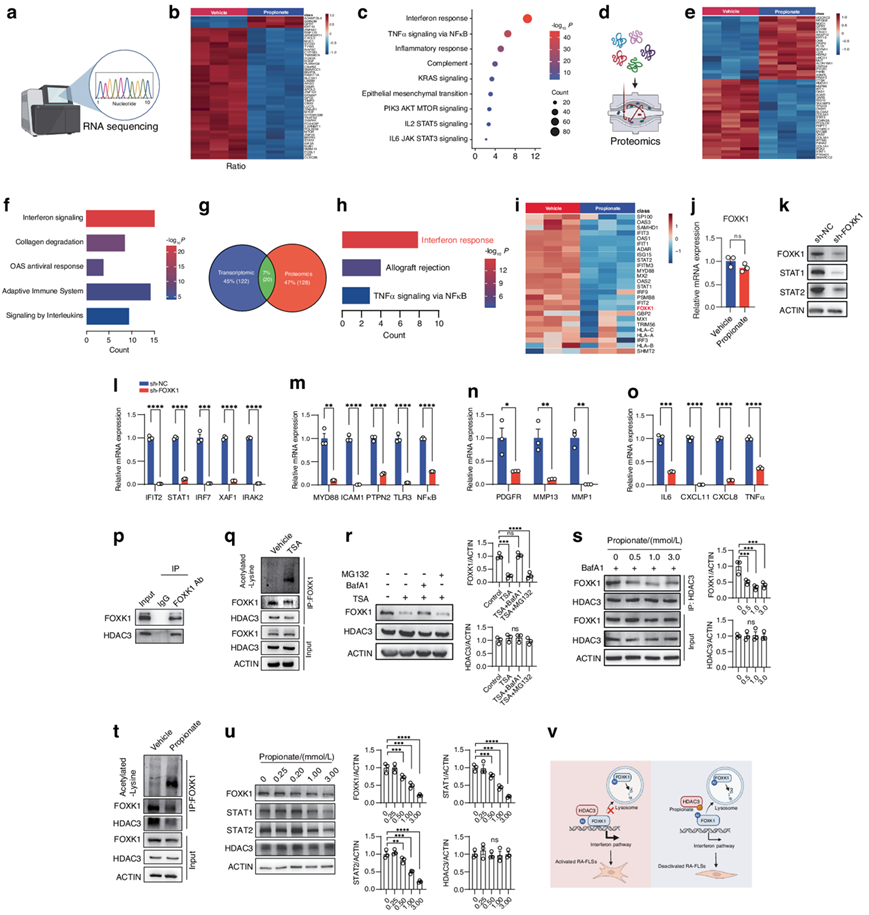
图5. 用丙酸处理后 RA-FLS 的转录组学和蛋白质组学分析。
(a) RNA-seq图示。(b) 差异表达基因的热图。(c) 基因集富集分析 (GSEA) 。(d) 蛋白质组学分析图示。(e) 差异表达蛋白质的热图。(f) 蛋白质组学数据的功能富集分析。(g) 维恩图显示用丙酸盐处理后,RA-FLS 中转录组(蓝色)和蛋白质组(红色)之间下调的蛋白质编码基因的重叠(绿色)。(h) 丙酸盐下调的 RA-FLS 中重叠蛋白质编码基因的功能富集分析。(i) 热图显示用载体 (PBS) 或丙酸盐处理后,RA-FLS 中参与干扰素通路的差异表达蛋白质。(j) 相对 mRNA 表达分析。(k) FOXK1、STAT1 和 STAT2 的蛋白质水平分析。(l-o) 干扰素通路相关基因、炎症反应基因、趋化因子和炎性细胞因子以及迁移和侵袭相关基因的相对 mRNA 表达。(p) 免疫共沉淀分析。(q) 赖氨酸乙酰化水平。(r) HDAC3 的蛋白质表达。(s) HDAC3 和 FOXK1 之间的相互作用。(t) 赖氨酸乙酰化水平。(u) FOXK1、STAT1、STAT2 和 HDAC3 的蛋白质表达。(v) 丙酸盐在 RA-FLS 中的作用机制的示意图。

图S6. 丙酸处理后RA-FLS的转录组学分析。
(A-F)不同信号通路的GSEA分析结果。
06
丙酸单一疗法或其与抗 TNF 药物的组合可减轻 CIA 小鼠的关节炎
他们研究了丙酸盐或其与生物抗肿瘤坏死因子依那西普(etanercept)联合治疗CIA的DBA/1J小鼠关节炎的潜力。CIA小鼠分别进行丙酸盐、依那西普或丙酸盐与依那西普的组合给药(图6a)。治疗后,关节炎评分显示,与对照组相比,丙酸显著阻碍了CIA的进展(图6b)。Micro-CT 分析表明,用丙酸盐治疗的 CIA 小鼠的骨质侵蚀比用载体治疗的小鼠减少(图6c-d)。H&E 和 SafO-FG 染色的组织学分析表明,丙酸盐显著抑制了滑膜增生、骨质侵蚀和软骨破坏(图6e)。踝关节 BS/BV 测量和滑膜评分、骨侵蚀和软骨侵蚀在 H&E 和 SafO-FG 染色切片上的定量分析一致证明丙酸盐对 CIA 小鼠具有良好的治疗效果(图6e-f)。免疫荧光染色显示丙酸盐显著降低 CIA 小鼠滑膜组织中 FOXK1、STAT1、STAT2、IL-6、IL-1β 和 MMP3 的表达(图6g-h)。此外,他们评估了丙酸盐联合用药对 CIA 小鼠的治疗效果。与依那西普单药治疗相比,丙酸盐与依那西普联合用药更显著地缓解了 CIA (图6b-h)。此外,他们还检测了丙酸盐单药治疗和丙酸盐与依那西普联合治疗的肝毒性。血液生化检测显示,用丙酸盐或丙酸盐与依那西普联合治疗的CIA小鼠的肝功能参数包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB)和总蛋白(TP)没有明显变化。
他们还检测了丁酸单一疗法或与抗 TNF 依那西普联合治疗 CIA 小鼠关节炎的效果(图6a)。关节炎评分显示,与载体相比,丁酸可减轻 CIA(图6b)。显微CT 分析表明,用丁酸治疗的 CIA 小鼠骨质侵蚀减少(图6c)。组织学分析表明,丁酸显著抑制滑膜增生、骨质侵蚀和软骨破坏(图6d)。与依那西普单一疗法相比,丁酸与依那西普联合治疗在缓解 CIA 方面表现出协同作用(图6b-f)。血液生化检测显示,丁酸盐单药治疗或与依那西普联合治疗的CIA小鼠未出现明显的肝毒性。此外,他们比较了丁酸盐和丙酸盐的治疗效果。在CIA小鼠中,丁酸盐单药治疗或与依那西普联合治疗后,减轻关节炎的效果不如丙酸盐(图6b-f)。
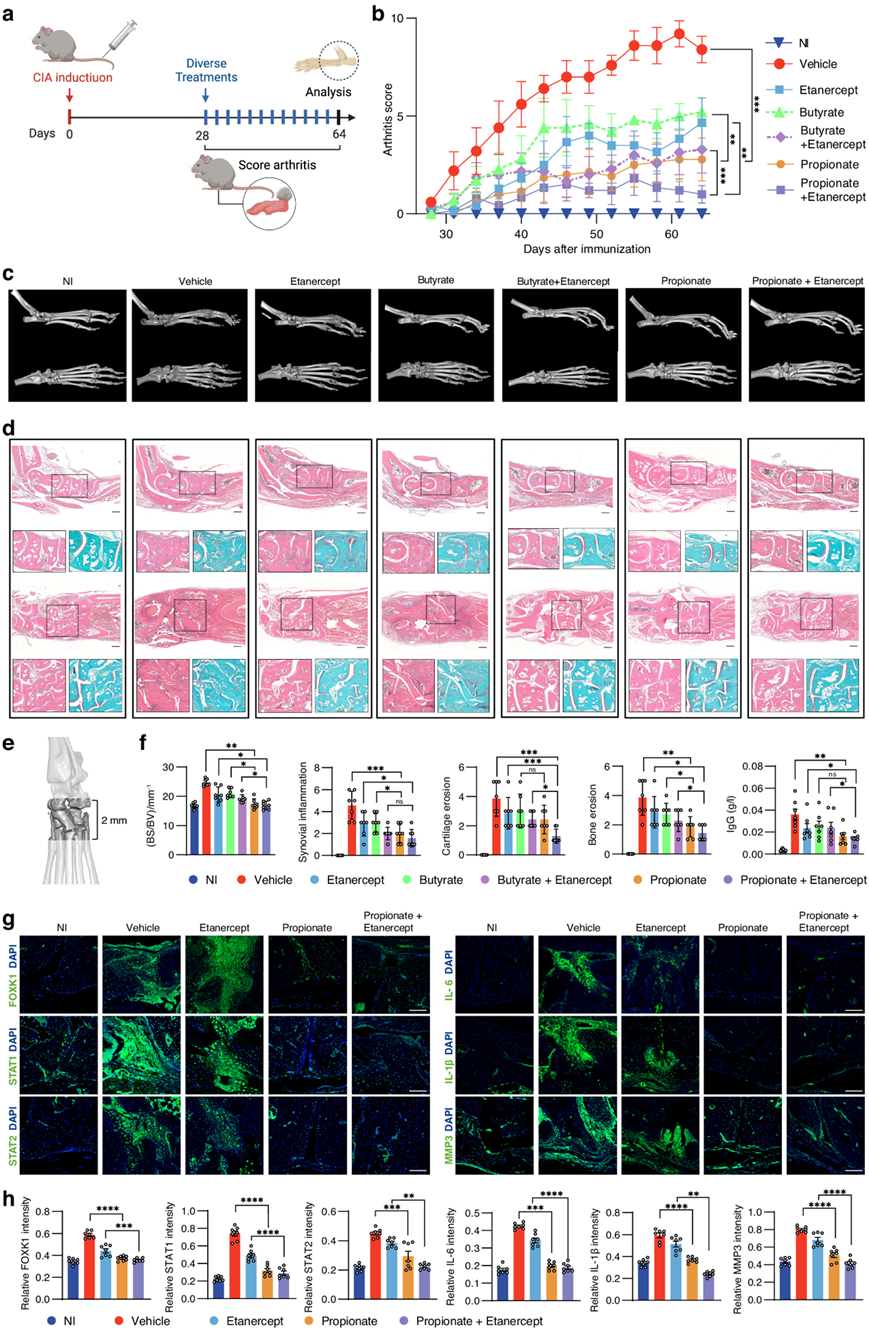
图6. 丙酸盐对 CIA 小鼠的治疗效果。
(a) CIA 小鼠实验设计流程图。(b) 小鼠的关节炎评分。(c) 代表性显微CT 图像。(d) H&E 和 SafO-FG 染色图像。(e) 通过显微CT 测量 BS/BV 的爪子区域。(f) 检测BS/BV,并在 H&E 染色切片上量化滑膜炎症和骨侵蚀,以及在 SafO-FG 染色切片上量化软骨侵蚀。(g) 免疫荧光染色。(h) 荧光强度的定量分析。
+ + + + + + + + + + +
结 论
将 CIA 抗性的 C57BL/6J 小鼠的粪便菌群移植到 CIA 易感的 DBA/1J 小鼠中,可使 DBA/1J 小鼠产生 CIA 抗性。C57BL/6J 小鼠和健康人类个体比 DBA/1J 小鼠和 RA 患者富含脆弱拟杆菌。移植脆弱拟杆菌可预防 DBA/1J 小鼠患上 CIA。脆弱拟杆菌主要产生丙酸,C57BL/6J 小鼠和健康人类个体的丙酸水平较高。类风湿性关节炎中的成纤维细胞样滑膜细胞 (FLS) 激活,发生肿瘤样转化。丙酸盐破坏 HDAC3-FOXK1 相互作用,从而增加 FOXK1 的乙酰化,导致 FOXK1 稳定性降低、干扰素信号传导受阻和 RA-FLS 失活。用丙酸盐治疗 CIA 小鼠,结果显示丙酸盐可减轻 CIA。此外,丙酸盐与抗 TNF 依那西普的组合可协同缓解 CIA。这些结果表明脆弱拟杆菌或丙酸盐可能是当前疗法的替代或补充方法。
+ + + + +



 English
English


