文献解读|Nat Genet(30.8):小鼠肝脏稳态和再生的时空图谱
✦ +
+
论文ID
原名:A spatiotemporal atlas of mouse liver homeostasis and regeneration
译名:小鼠肝脏稳态和再生的时空图谱
期刊:Nature Genetics
影响因子:30.8
发表时间:2024.04.16
DOI号:10.1038/s41588-024-01709-7
背 景
显微镜下,肝叶包含重复单位或小叶,包括围绕中央静脉和几个外周门节点(包括静脉、小动脉和胆管)呈放射状组织的同心实质肝细胞层。这种表面上的简单性背后隐藏着巨大的功能复杂性。人们对哺乳动物肝细胞在组织稳态和扰动过程中协调反应的机制了解甚少,这成为理解许多疾病的主要障碍。
实验设计

结 果
01
小鼠肝脏的时空图谱
为了以高分辨率、高灵敏度和全叶尺度解剖肝脏稳态和再生的时空动态,研究团队将时空增强分辨率组学测序 (Stereo-seq) 技术应用于部分(2/3)肝切除(PHx)小鼠模型。他们从第0天(D0)、启动期(8 h)、增殖期[1-3天(D1、D2、D3)]和终止期[第7天(D7) ]收集30个全肝切片。他们还分析了公开报道的非实质细胞(npc)单细胞转录组分析(scRNA-seq)数据集,以生成包含51275个细胞的更广泛的稳态肝细胞矩阵,捕获了所有主要的肝驻留细胞类型,然后可以映射到Stereo-seq玻片上(图1a)。门静脉周围标志物E-cadherin的免疫荧光检测与Stereo-seq定义的门静脉周围肝细胞相关性良好(图1a)。为了研究稳态肝脏的门中转录梯度,他们使用了一种基于肝细胞标志基因的算法,该算法具有明确的分区模式,将区域均匀划分为九个分区层(1 和 2 个中央区、3-6 个中部区域和 7-9 个门管区),且典型肝细胞标记物的分布与公开的数据相符合(图1b-c)。
他们使用Kruskal-Wallis检验对稳态Stereo-seq切片中的分区层显示非随机空间分布的所有基因进行了筛选。这一检验共识别出8127个基因,他们从中选择了在稳态肝细胞矩阵中特异表达的基因。这样筛选得到2456个基因,其中大约一半(52.1%)与之前一项研究中基于scRNA-seq的分区重建结果重叠(图1d-e)。在新发现的分区基因中,他们观察到乙型肝炎病毒结合受体Slc10a1 (NTCP)在中央周围富集,这与人类对乙型肝炎病毒的中央周围易感性相关,而未折叠的蛋白反应调节剂Xbp1在门静脉周围富集(图1f)。此外,他们检测到T3甲状腺激素受体Thrb的中区富集。T3在这个区域有更强的有丝分裂活性。Thrb的单分子荧光原位杂交(smFISH)和NTCP的免疫荧光证实了这些结果(图1g)。同样,EGFR配体Fgl1 (hepassocin)也在中层中富集。在这方面,稳态肝细胞增殖主要是中区性的。所有肝细胞分区基因的功能分析鉴定了已知和未知的分区通路(图1h-i)。例如,他们在中央周围区观察到自噬,LC3和LAMP2的免疫荧光证实了这一点(图1j)。然后,他们通过将SCENIC应用于Stereo-seq载玻片,研究了控制肝细胞身份的基因调控网络(grn)。这鉴定出307个调控,其中172个在肝细胞中(图1k-l)。
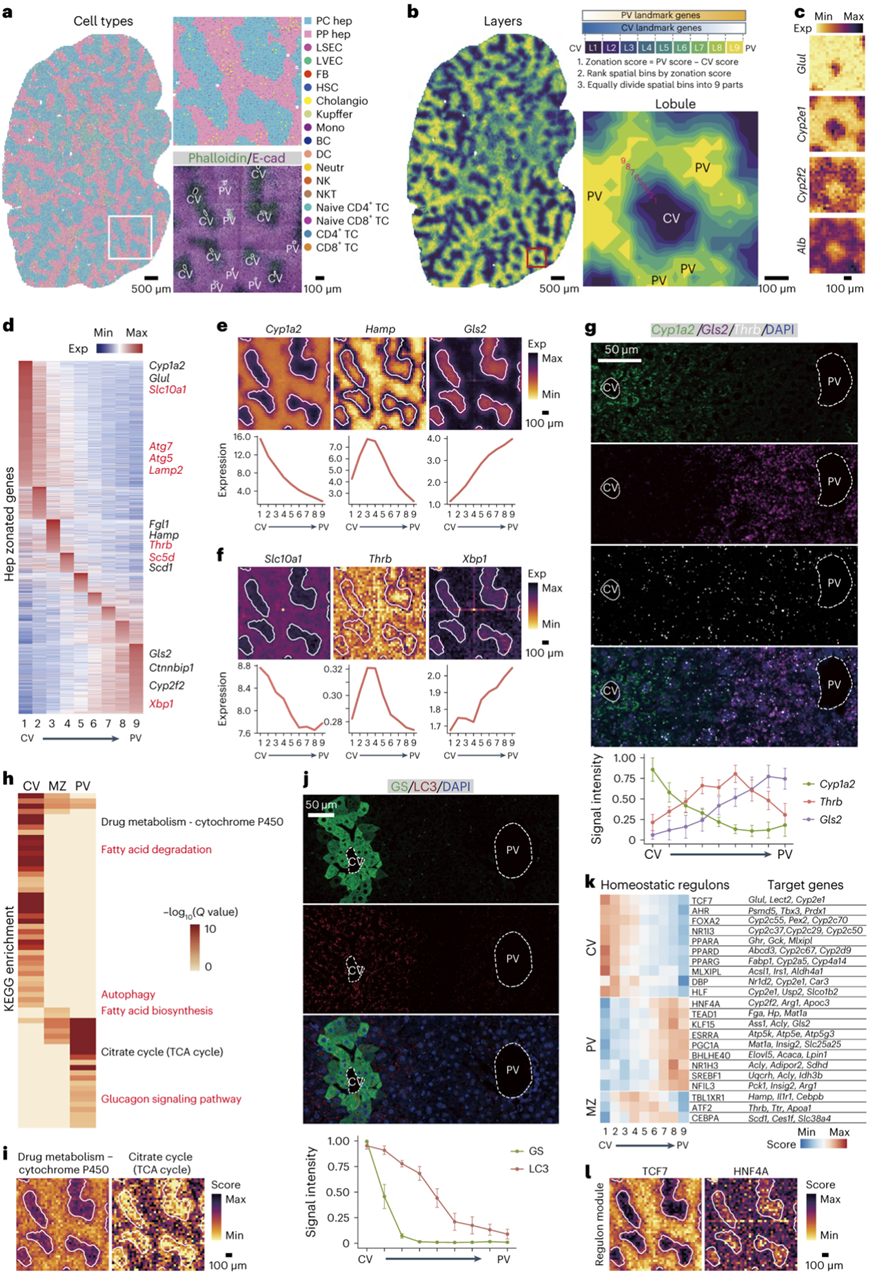
图1. Stereo-seq 在全叶范围内描绘了稳态肝脏。
(a) 左:通过 RCTD 反卷积的细胞类型分布的空间可视化(D0-DY1 部分)。右上角:所示区域的放大图。右下:相邻切片的鬼笔环肽和 E-钙粘蛋白 (E-cad) 的代表性免疫荧光染色。(b) 左,分区层的空间可视化(D0-DY1 部分)。右上,计算分区层的方案。右下角,所示区域的放大图。(c) 典型中心周围和门静脉周围基因的空间可视化。(d) 生物重复中所有稳态切片中每个分区层 2456 个肝细胞分区基因的平均表达。(e-f) 上:已知的和新鉴定的分区基因的估算表达的空间可视化(D0-DY1 部分)。下:所有稳态部分的每个分区层中的平均表达水平。(g) 稳态肝脏中Cyp1a2、Gls2和Thrb的代表性 smFISH 图像以及平均信号强度。(h) 肝细胞分区基因的KEGG富集。(i) 指定分区路径的模块得分的空间可视化(D0-DY1 部分)。(j) 上:来自稳态肝脏中 GS 和 LC3 免疫荧光染色的代表性图像。下:平均信号强度。(k) 每个分区层的平均调节子活性(D0-DY1 部分)。(l) 指定调节子的活性得分的空间可视化(D0-DY1部分)。
02
稳态 NPC 和非区域化结构中的区域化基因
接下来,他们将重点研究肝窦内皮细胞(LSEC)和造血干细胞的分区基因。他们从稳态肝细胞基质中提取了lsEc特异性和肝星状细胞(hsc)特异性基因,并将它们与整体分区基因列表重叠。LSEC和hsc的分区基因分别为636个和1158个。在LSEC基因中,有132个与配对细胞测序描述的区分结构重叠,包括中心周Wnt2、门脉周围Dll4和中区Lyve1(图2a-c)。在未知基因中,他们注意到血管生成素受体Tie2 (Tek)和转录因子Gata4,它们都在中央周围区域调节Wnt细胞因子的表达。功能分析发现中枢周围区neuropilin与VEGF和VEGFR通路的相互作用和门静脉周围区Notch信号通路的调控等分区通路(图2a-e)。
对HSC分区基因的分析显示,54个基因与先前研究中发现的基因重叠,包括中心周围Rspo3和门静脉周围Ngfr,以及1104个未知基因。功能分析还发现了分区信号通路,如中央心周BMP信号通路和Wnt信号通路,而与细胞基质粘附和趋化性相关的基因则在周围富集。虽然大多数BMP信号成分在中心周围富集,但Bmp4在中部区域减少,他们通过smFISH验证了这一点(图2k)。BMP4是一种通过ALK3 (Bmpr1a)作用的肝细胞增殖旁分泌抑制因子。
为了探索与肝分区无关的空间依赖性基因表达模式,他们应用了Hotspot分析。除了预期的分区模块外,他们还在动物中发现了富含IFNγ反应基因(Rsad2)的非分区稀疏点样结构(图2l-m)。这些“免疫斑点”的大小(直径约80 ~ 200 μm)表明存在多种细胞类型。免疫荧光在不同的稳态肝脏重复中鉴定出分散的免疫细胞灶(图2o)。
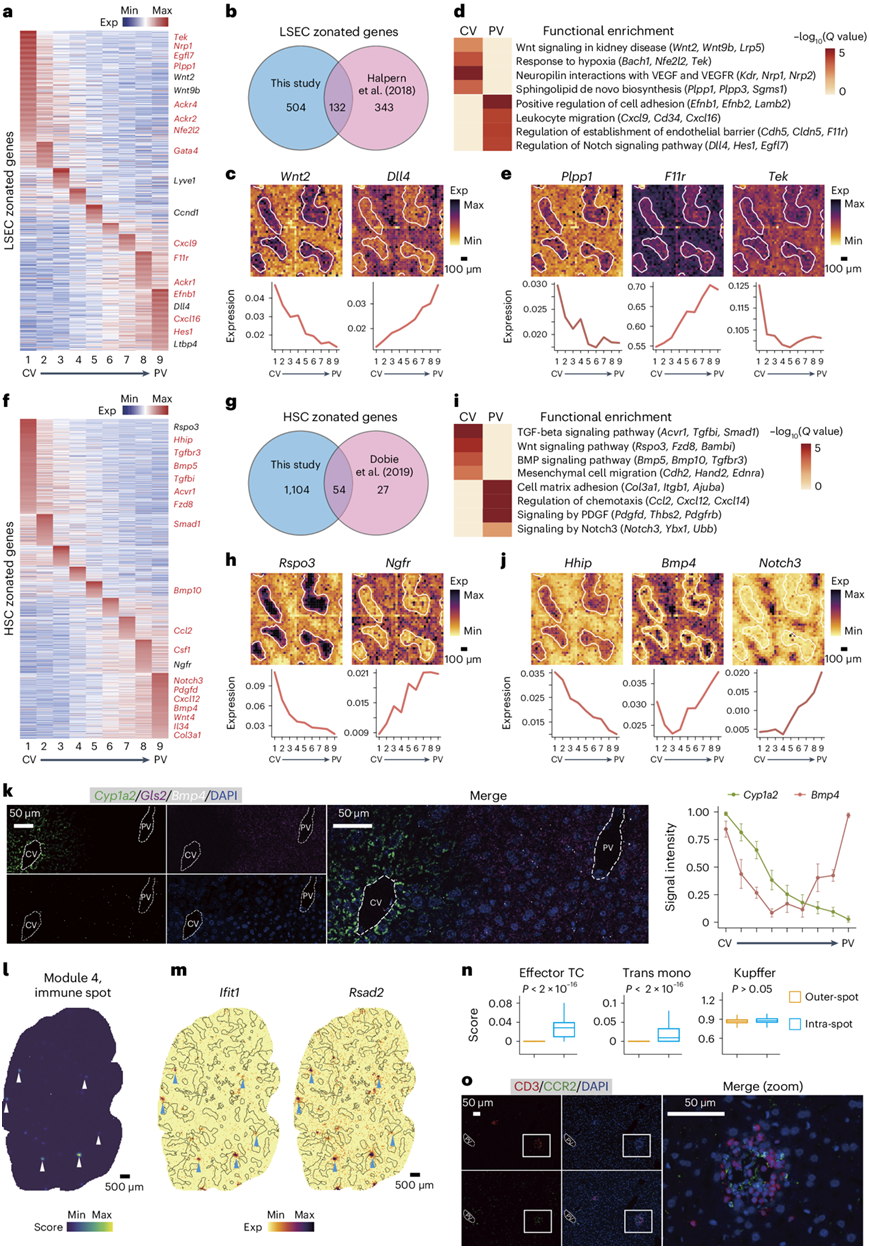
图2. Stereo-seq 分析 NPC 分布和分区模式。
(a,f) 跨生物重复的所有稳态切片中每个分区层的636 LSEC 和1158 HSC 分区基因的平均表达。 (b,g) 维恩图比较本研究中鉴定的 LSEC 分区基因与配对细胞测序鉴定的基因,以及本研究鉴定的 HSC 分区基因与 HSC scRNA-seq 研究鉴定的基因。(c,e,g,j) 上:已知的和新发现的LSEC分区基因,以及已知的和新发现的HSC分区基因(D0-DY1)的表达水平的空间可视化。下:所有稳态部分中每个分区层的平均表达水平。(d,i) 中央周围和门静脉周围 LSEC或 HSC 分区基因的功能富集结果。(k) 左:稳态肝脏中Cyp1a2、Gls2和Bmp4表达的代表性 smFISH 图像。右:平均信号强度。 (l) 免疫点(模块4)基因的模块得分的空间可视化(D0-DY1部分)。(m) 免疫点基因的空间可视化(D0-DY1 部分)。(n) 指定细胞类型在免疫点内部或外部的分布。(o) CD3(T 细胞)和 CCR2(单核细胞)免疫荧光染色的代表性图像。
03
动态平衡中的分区细胞-细胞通信网络
他们观察到已知的Wnt相关的中央静脉周围和Notch相关的门静脉周围的相互作用(图3a-b)。在未知的分区相互作用中,他们检测到涉及门静脉周围非经典Wnt因子WNT4和WNT5B的相互作用,还检测到Egfl7在中央静脉周围的LSECs中与Notch1的相互作用。鉴于Notch的抑制促进Wnt因子的分泌,他们猜测Egfl7调节Wnt信号。Bmp10和Acvrl1(ALK1)在库普弗细胞中的相互作用在中区区域富集。BMP10–ALK1促进库普弗细胞的自我更新。Bmp4与Bmpr1a的相互作用在中央周层和门静脉周围层富集。Fgfr1 /2/21和Fgfr1之间的相互作用在门静脉周围肝细胞中富集程度更高(图3a-c)。smFISH证实了Fgfr1和Wnt4在门静脉周围的富集(图3d)。
门静脉周围的免疫细胞极化建立了宿主对肠道细菌的屏障。有趣的是,他们不仅发现了涉及趋化活性的新相互作用,而且还发现了多种趋化因子与LSEC和hsc中表达的非典型趋化因子受体的相互作用(图3a-e)。其中包括Ackr1的中区和门静脉周围富集,以及趋化因子清除因子Ackr2和Ackr4的中心周围富集。通过smFISH证实Ackr4在中心周围的分布(图3f)。
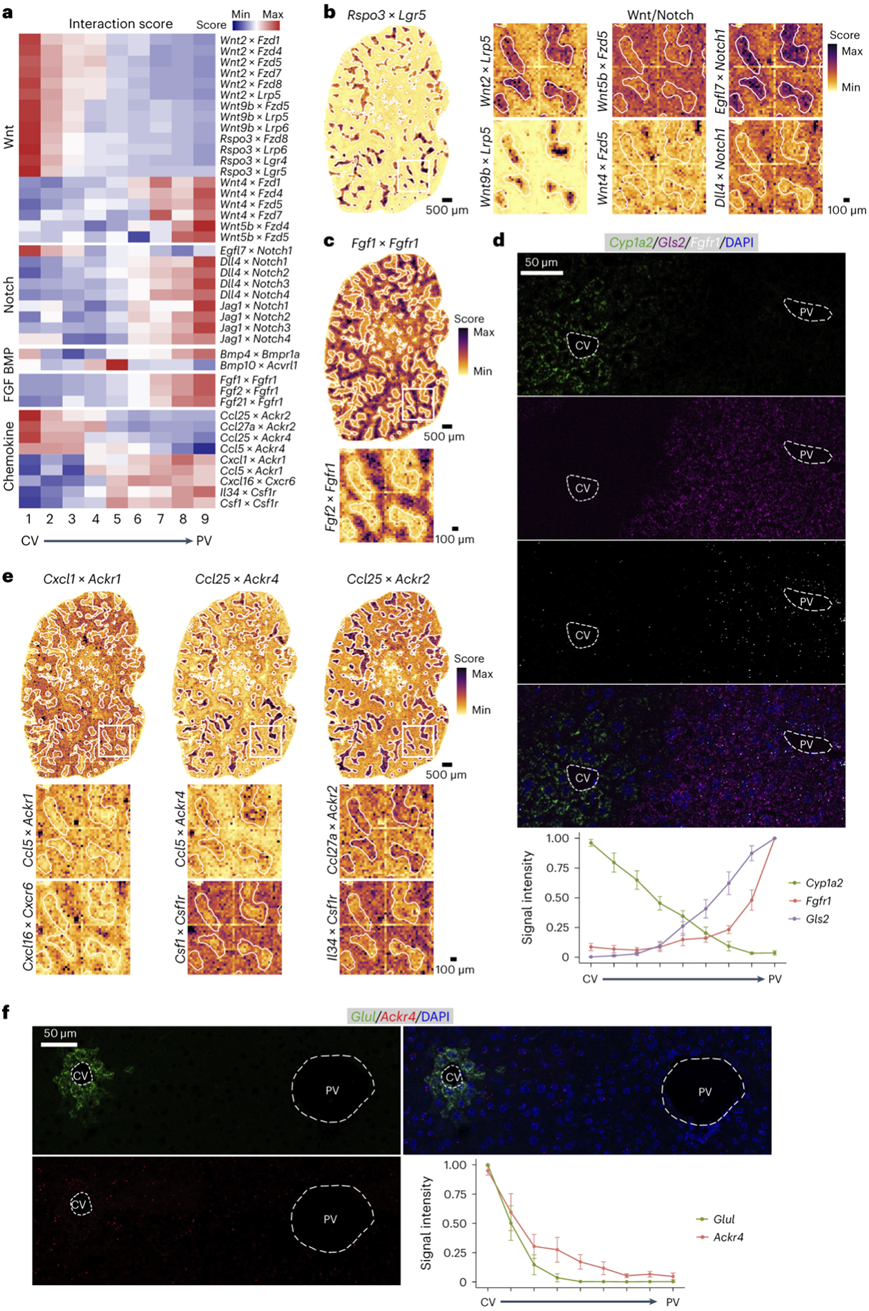
图3. Stereo-seq 剖析了稳态肝脏的细胞间通信网络。
(a) 跨生物复制的所有稳态部分中选定的配体-受体相互作用的每个分区层中的平均相互作用得分。(b) 左:Rspo3 × Lgr5的估算相互作用得分的空间可视化(D0-DY1 部分)。右:指定区域中指定 Wnt/Notch 信号相互作用的估算相互作用得分的空间可视化。 (c) 上:Fgf1 × Fgfr1的估算相互作用得分的空间可视化(D0-DY1 部分)。下:所示区域中Fgf2 × Fgfr1的估算相互作用得分的空间可视化。 (d) 上:稳态肝脏中Cyp1a2、Gls2和Fgfr1的代表性 smFISH 图像。下:平均信号强度。(e) 上:Cxcl1 × Ackr1、Ccl25 × Ackr4和Ccl25 × Ackr2的估算相互作用得分的空间可视化(D0-DY1 部分)。下:指定区域中指定趋化因子-受体相互作用的估算相互作用得分的空间可视化。 (f) 上:稳态肝脏中Glul和Ackr4的代表性 smFISH 图像。下:平均信号强度。
04
再生过程中细胞增殖动力学
接下来,他们使用scRNA-seq数据集分析细胞增殖。泛循环标志物Mki67在D1的肝细胞群中表达,在D2显著升高(占所有肝细胞的35.2%,占所有细胞的32.5%),然后下降。LSEC的增殖在D2出现,在D3达到高峰,在免疫细胞中观察到低水平增殖(图4a-b)。在检测Stereo-seq切片中的增殖情况之前,他们检测了层分布在整个再生过程中是否保持稳定。使用相同的算法来研究稳态,验证了在PHx后极化分区模式的维持(图4c-d)。通常用于确定区域边界的特异性基因(Cdh1)改变了表达水平和区域分布,但总体上静脉-中央静脉梯度保持不变(图4e)。对伪整体值进行的主成分分析证实了层的维持(图4f)。
他们将Mki67数据映射到Stereo-seq图谱上(图4g)。D2时,Mki67信号在中区区域较强,但中央静脉周围和门静脉周围区域也显示出相当高的水平(图4h)。然后,他们通过评估一组相关基因来分析细胞周期阶段的动力学(图4i-j)。在D1时,中区层的S期得分较高,随后在D2时总体上升到更高水平,但在中央静脉周围层达到峰值。G2/M期得分在D2时在中区层达到峰值,这些结果表明增殖始于中区层。他们在不同视野的单个切片中检测到S期和G2/M期得分的分布相似。通过将Stereo-seq数据划分为100层以提高细节水平显示,在D2时,最边缘的中央静脉周围和门静脉周围的增殖减少。先前的研究提出,在最内层中央静脉周围肝细胞区域的增殖率明显低于其他区域。
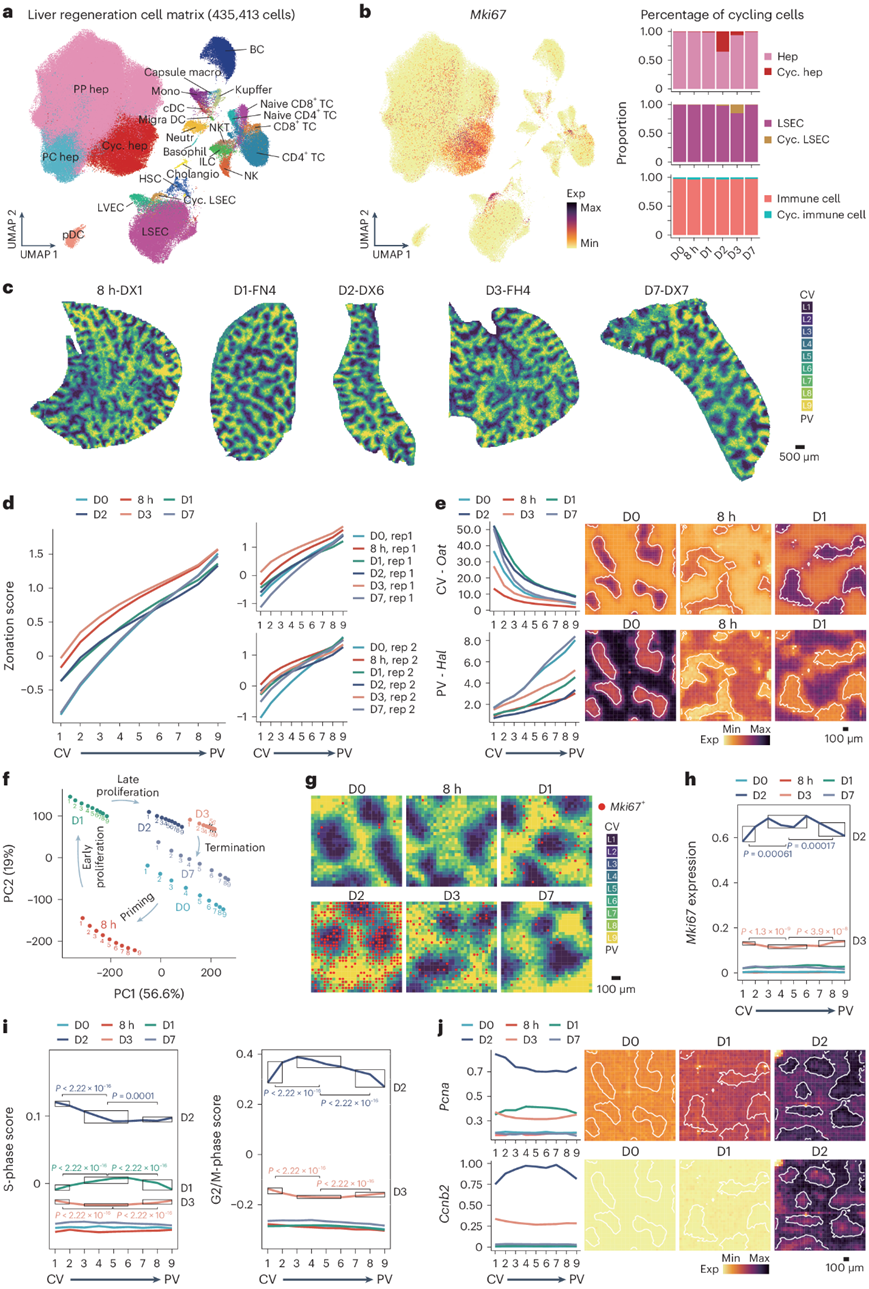
图4. 识别再生肝脏中肝细胞增殖的时空动力学。
(a) 来自肝再生细胞基质的 435413 个单细胞的均匀流形近似和投影 (UMAP) 图。(b) 左:肝再生细胞基质中Mki67表达的 UMAP 可视化。右:循环肝细胞(上)、LSEC(中)和免疫细胞(下)的百分比。(c) 分区层的空间可视化(第 8 h-DX1、D1-FN4、D2-DX6、D3-FH4 和 D7-DX7 部分)。(d) 左:所有再生部分中每个分区层的平均分区得分。右:再生肝脏不同生物复制切片的平均分区得分。 (e) 左:所有再生部分中每个分区层的代表性标志基因的平均表达水平。右:相应基因的估算表达水平的空间可视化(D0-DY1、8 h-DX1、D1-FN4 部分)。(f) 来自所有再生部分的每个分区层的伪体数据的主成分分析。(g) Mki67 + bin在每个时间点的空间可视化。(h) 所有再生部分中每个分区层的Mki67平均表达水平。(i) 所有再生部分中每个分区层的S 期(左)和 G2/M 期(右)基因的平均模块得分。 (j) 左:所有再生切片中每个分区层的S 期基因Pcna和 G2/M 期基因Ccnb2的平均表达水平。右:相应基因的估算表达水平的空间可视化(D0-DY1、D1-FN4、D2-DX6 部分)。
05
再生过程中的分区转录组反应
他们研究了PHx后细胞特异性转录组反应的图谱,首先集中在肝细胞上。对肝再生细胞矩阵的分析鉴定了4310个高变基因,其中92.8%具有分区特征,将这些基因分为七个聚类(图5a)。功能富集分析显示了两次主要的代谢基因调节波动(图5b-c)。第一次波动是与身体稳态相关的基因减少,从8小时开始,部分恢复从D3到D7(聚类1)。第二次波动的基因与能量生产有关(聚类2和聚类3);这些基因在8小时部分减少,并从D1开始激活,包括中央静脉周围的脂肪酸β-氧化、门静脉周围的糖异生和线粒体电子传递链。当将特定的KEGG代谢功能分组为分数映射到Stereo-seq切片上时,也观察到了类似的结果。D1时脂质代谢基因的上调与在肝再生过程中脂质作为主要能量来源一致。他们还注意到与脂质摄取相关的基因(Cd36)增加,具有广泛的分区分布,但主要在D1和D2时在中央静脉周围占主导地位。
其他增加的基因聚类包括起始(聚类4和聚类5)、早期增殖(聚类6)和晚期增殖(聚类7)基因(图5a–e)。起始基因在8小时增加,大多是短暂的并且分布广泛,与炎症或氧化应激有关。作为炎症反应的一部分,NF-κB信号和IL6信号相关基因分别在中央静脉周围和门静脉周围区域更强烈地激活。祖细胞标记基因Sox9在8小时在中区区域短暂增加,表明部分去分化。早期增殖基因包括多个Wnt信号调节因子。众所周知的Wnt/β-连环蛋白拮抗剂Znrf3和Rnf43以及胞外Wnt因子去酰化酶Notum,所有这些都是Wnt的靶基因,都增加了,且遵循类似于Wnt信号的分区模式。另有两个Wnt/β-连环蛋白抑制因子Tcf7l1(TCF3)和Ctnnbip1在门静脉周围增加。这些结果表明,存在复杂的负反馈回路控制Wnt介导的肝细胞增殖。此外,他们注意到核糖体基因在D1时在中区层更明显地增加。Rpl10a和Rpl24对肝再生是必需的。晚期增殖基因主要与有丝分裂有关。
为了揭示NPC的分区反应,他们使用相同的肝细胞分析流程对LSEC和HSC高变基因进行了分组,观察到其中许多基因也具有分区特征(图5f)。对于LSEC来说,在8小时发生抑制的基因(聚类1)大多与适应性免疫反应和趋化作用相关,具有不同的分区偏好(图5f-i),这可能有助于防止过度的免疫细胞激活。增加的基因分为两组,一组从8小时到D7持续激活(聚类2),另一组在8小时短暂激活(聚类3)。前者包含与中央静脉周围区域的Wnt信号(Wnt2)和中区及门静脉周围区域的EGFR信号(Hbegf)相关的基因。后者包含与中央静脉周围的剪切应力(Klf2)和eNOS激活相关的基因。这个结果表明,中央静脉周围的LSEC对由于门静脉血流量增加而导致的较高剪切应力更敏感。有趣的是,KLF2在发育中的心脏中诱导内皮细胞分泌Wnt因子。此外,他们观察到与有丝分裂相关的通路(聚类4)在D3富集,这与LSEC增殖的高峰一致。对于HSC来说,受到抑制的基因(聚类1)与ECM相关的通路相关。同样,IFNγ反应基因在再生过程中减少,与免疫斑点的减少相关。在8小时或D2增加的基因(聚类2和聚类3)包含以中区为主的MET/PI3K/AKT信号(Hgf);HSC通过分泌HGF调节肝再生。
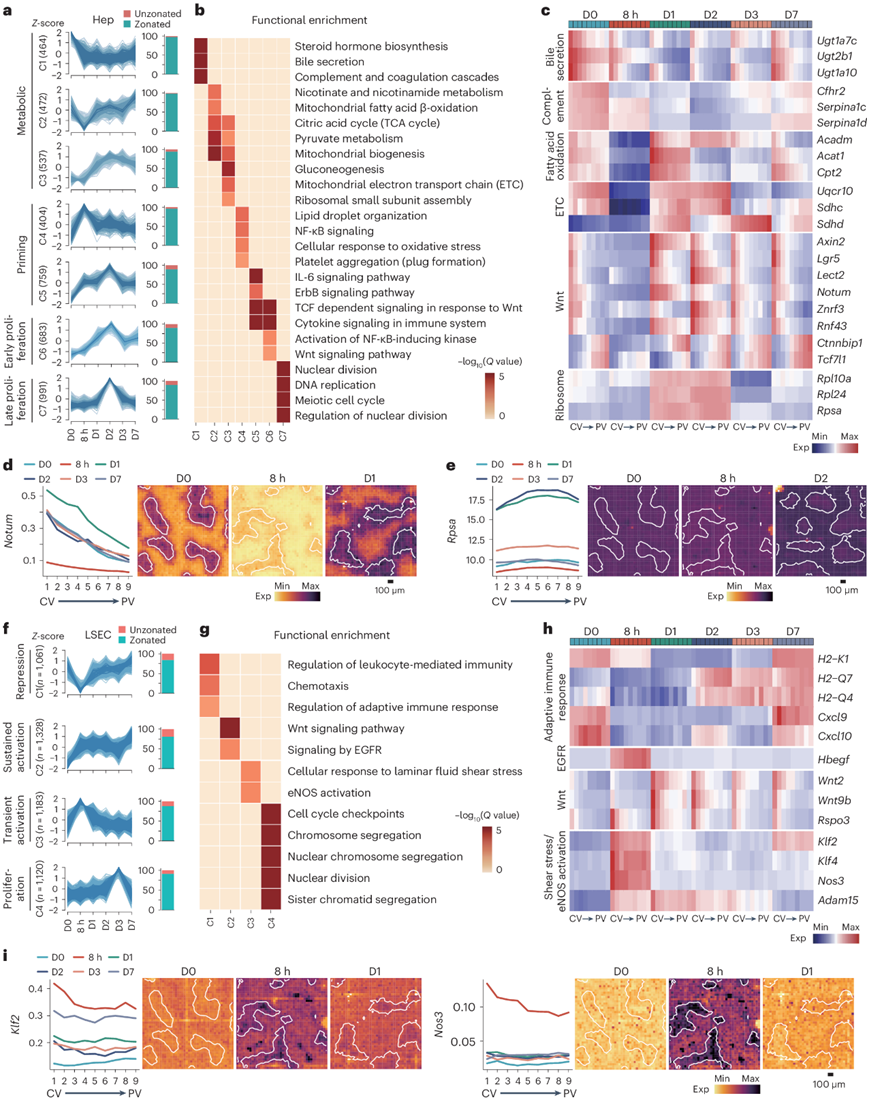
图5. 分析了再生肝脏的时空反应。
(a,f) 左:肝再生细胞基质的伪块数据的模糊聚类分析,显示肝细胞中不同时间点上有 4310 个高变基因,LSEC 中不同时间点上有 4692 个高变基因。右:每个基因组中区域基因的百分比。(b,g) 肝细胞和 LSEC中每个高变基因组的功能富集。(c,h)选定肝细胞高变基因和 LSEC 高变基因的平均表达。 (d,e,i) 左:所有再生切片中每个分区层中所示肝细胞高变基因[包括Notum、Rpsa 和 LSEC 高变基因(Klf2和Nos3)]的平均表达。右:所示时间点相应基因估算表达水平的空间可视化。
06
再生过程中细胞-细胞相互作用的动力学
为了研究细胞间通讯的时空动态,他们计算了不同时间点的配体-受体相互作用得分,这产生了1487个相互作用,其中75%具有分区特征(图6a)。他们在肝再生细胞矩阵中映射了配体和受体的表达(图6b),观察到在8小时增加的相互作用主要与免疫细胞相关。
他们研究了一组与肝细胞增殖相关的已知和未知配体-受体对的分区分布(图6c-d)。由肝窦内皮细胞(LSEC)和肝星状细胞(HSC)通过其相应受体介导的Wnt2、Wnt9b和Rspo3的中心区相互作用增强,作用范围扩大至门静脉周围区域。这在D1时更加明显,但在整个再生过程中仍高于稳态水平,这与Wnt/β-catenin靶基因持续激活直到D7相一致。非经典的Wnt4和Wnt5a与它们的受体的相互作用主要在D1时增加,分别在门静脉周围和中央静脉周围占主导地位。其他相互作用涉及有丝分裂信号通路的成分,如IL6、EGF、FGF、HGF和Hedgehog,以及抗有丝分裂信号,如BMP-BMPR1A轴、activin和IL1。有丝分裂信号通路主要在中区和门静脉周围区域激活。他们通过smFISH验证了Fgfr1的诱导。在肝细胞中,HGF信号涉及HGF的ECM存储和通过纤溶酶原激活因子Tp(Plat)和Upa(Plau)激活。在8小时,Plat在中区区域增加,而纤溶酶原激活因子抑制因子Serpine1和Serpine2以及HGFR拮抗剂Tac1在中央静脉周围和中区区域增加。此外,他们检测到中央静脉周围增强的拮抗Ihh-Hhip信号。在抑制再生的相互作用中,他们注意到从8小时到D3的Bmp2–Bmpr1a在中央静脉周围增加,而Inhba–/Inhbc–/Inhbe–Acvr2a/Acvr2b和Il1a/b–Il1rap相互作用在8小时总体减少,并在D7时在中央静脉周围或门静脉周围区域恢复。
他们还检测了LSEC的输入信号(图6c-d),发现Mif和Cxcl12(编码SDF-1)与Ackr3(编码CXCR7)在整个小叶中的相互作用增强,但在中央静脉周围区域更为明显。通过smFISH验证了在PHx后8小时内,Ackr3在内皮细胞中在中央静脉周围的表达(图6e)。此外,观察到Dll4-Notch的相互作用在8小时减少,并从D3开始稳步恢复,而Egfl7-Notch1在D2增加,尤其是在中央静脉周围和中区区域。同样,D1起,肝细胞表达的Lect2与血管生成素受体Tie1的相互作用增加,以中央静脉周围为主。LECT2阻止TIE1的磷酸化及其与TIE2的后续二聚化,而TIE2已知在其他环境中诱导Wnt因子的分泌。他们在D3和D7检测到增强的血管生成相互作用(Angpt2/4-Tek,Vegfa/c-Kdr),以门静脉周围为主,与LSEC增殖高峰相关(图4b)。Angpt2在PHx后的肝再生晚期促进血管生成。作为免疫分区的一部分,他们注意到大多数趋化因子相关的相互作用在再生过程中减少,但在终止阶段恢复(图6c)。
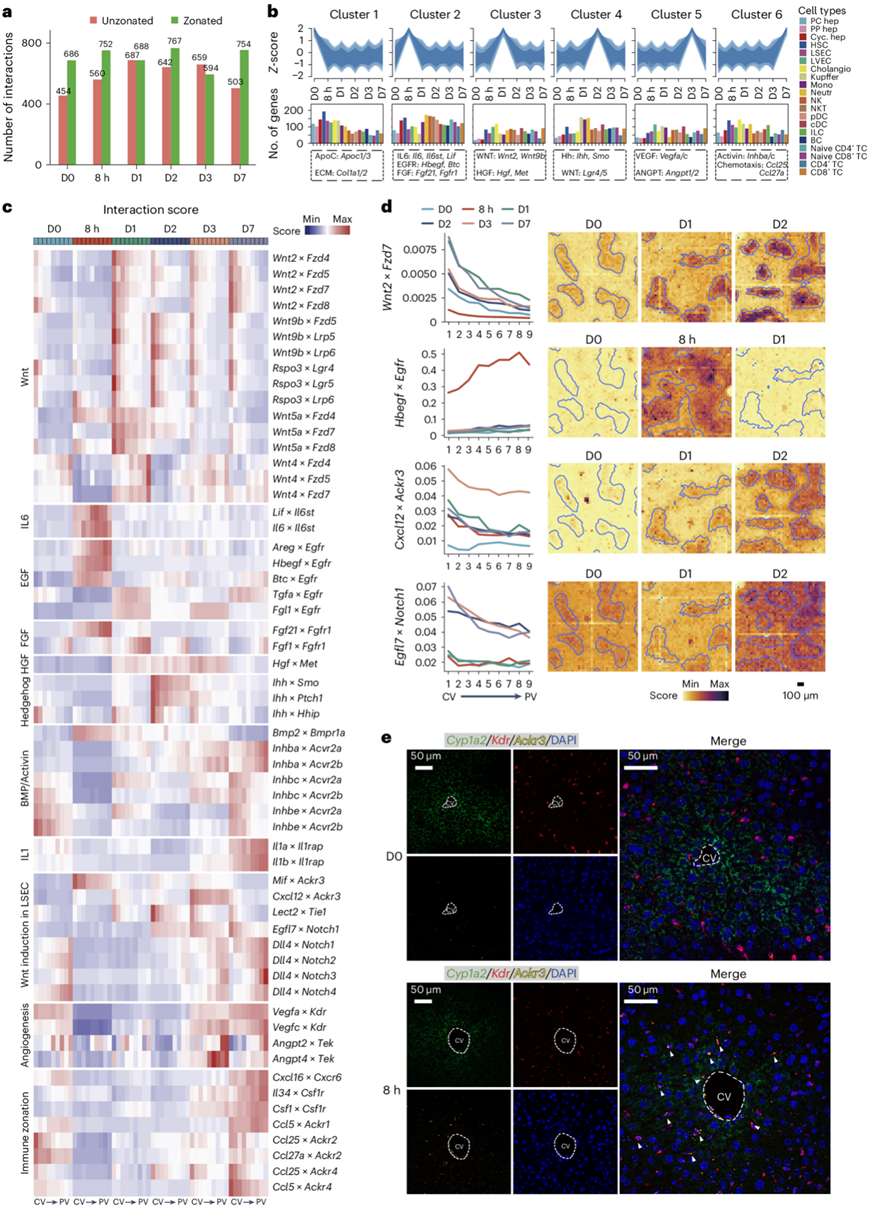
图6. 再生肝脏中细胞间通讯网络的动态。
(a) 条形图显示在所有再生部分中识别的相互作用的数量。(b) 肝再生细胞基质的模糊聚类分析以及每个细胞表达的肝再生细胞基质中相应基因组的配体或受体的数量。(c) 所有再生部分中每个分区层的指定配体-受体相互作用的平均相互作用得分。(d) 左,所有再生部分中每个分区层的平均相互作用得分。右:指定时间点相应交互的估算交互得分的空间可视化。(e) 来自稳态肝脏(上)或 PHx 后 8 小时(下)切片中Cyp1a2、Kdr(LSEC 标记)和Ackr3的代表性 smFISH 图像。
07
再生过程中的时空grn
接下来他们研究了控制再生的GRN,观察到8小时时伴随转录变化的调节子的显著变化(图7a)。在8小时下调的调控子中(图7a),他们检测到中区的CEBPA,这与之前的报告一致,以及几个代谢调控子(HLF)。同时,与上皮-间质转化相关的调控子,如SOX5、ZEB1和RREB1发生激活,这与肝再生开始时的部分去分化相一致。至于8小时上调的调控子,虽然大多数是短暂的,但有些延续到D3。如预期的那样,它们包括参与修复性炎症反应的转录因子(EGR1、JUN)以及其他如TBL1XR1。这些调控子在所有区域都有富集,有些情况下略偏向门静脉周围。在D1和D2,Wnt相关的调控子在整个小叶中上调,以中央静脉周围为主。在D2时,几乎所有富集的调控子都与有丝分裂有关。在D7时,代谢调控子恢复到接近稳态水平,支持下调的肝功能包括代谢的逐步恢复。
他们重点研究了TBL1XR1。Stereo-seq、scRNA-seq和免疫荧光证实了其在肝细胞中的激活(图7c)。对体外培养的小鼠肝细胞的scRNA-seq数据集进行分析显示,Tbl1xr1受TNFα诱导。支持这一结果的是,在进行PHx之前中和TNFα,阻止了8小时时TBL1XR1的诱导(图7d-e)。
他们使用特异性靶向肝细胞的腺相关病毒(AAV)进行体内shRNA敲低Tbl1xr1。在感染4周后,他们进行了PHx,并在D2提取肝脏。免疫荧光和RT-qPCR显示,与对照组相比,Tbl1xr1的敲低效率较高,同时细胞周期相关基因减少,细胞周期依赖性激酶抑制剂Cdkn1a(p21)诱导(图7f-g)。通过免疫荧光评估的Ki67+肝细胞比例在Tbl1xr1敲低组(20.9%)低于对照组(38.9%)(图7h-i)。然而,敲低Tbl1xr1后,肝细胞体积增大,总肝脏质量适度增加,表明存在代偿性肥大(图7h)。这一表型在D7时仍然存在,但程度较轻。
转录组分析(RNA-seq)表明,敲低Tbl1xr1不仅导致细胞周期基因减少,还损害了脂肪酸β-氧化(图7j-k)。此外,油红染色显示在PHx后D2时,敲低Tbl1xr1后脂滴减少。有趣的是,他们还观察到在Tbl1xr1敲低的肝脏中Wnt通路基因减少(图7j)。鉴于Wnt信号调节肝脏脂肪酸β-氧化,这一结果表明敲低Tbl1xr1会导致异常的能量生产。TBL1XR1与β-catenin相互作用,通过去除NCoR共抑制复合物,在结直肠癌中激活促癌生长相关基因。他们重新分析了之前的染色质免疫沉淀测序(ChIP-seq)数据集。稳态肝脏中的NCoR结合位点在Apc−/−肝脏中与β-连环蛋白效应子T细胞因子4(TCF4)共同结合,而在PHx后40小时,这些位点的组蛋白H3赖氨酸27乙酰化(H3K27ac)水平增加。这些位点包括多个因敲低Tbl1xr1而下调的与细胞周期、Wnt信号和脂肪酸β-氧化相关的基因(图7l-n)。这些结果提出了一种模型,即TBL1XR1和β-连环蛋白在关键位点的协同结合,通过去除NCoR共抑制复合物并促进组蛋白乙酰化,促进肝细胞增殖程序的激活。
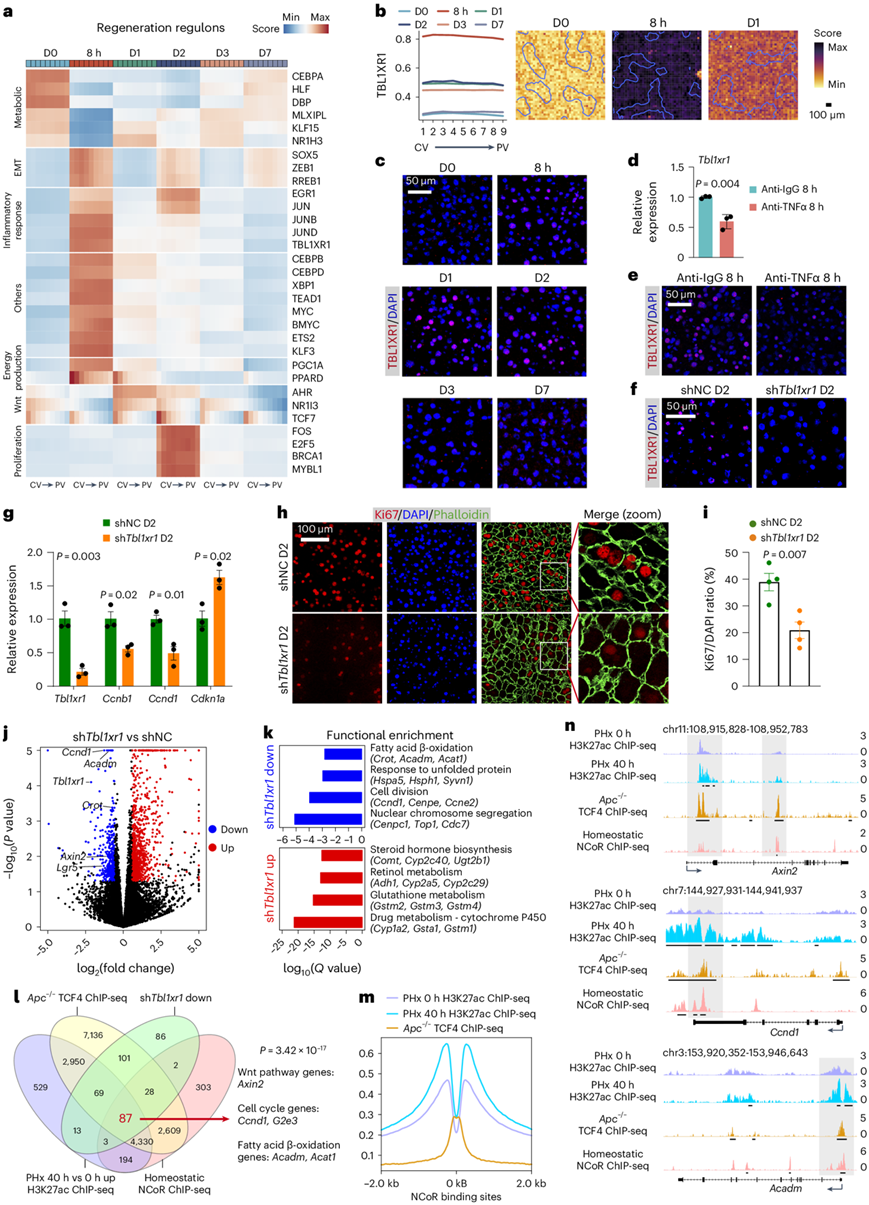
图7. 空间分辨的 GRN 确定 TBL1XR1 是肝再生的关键调节因子。
(a) 每个分区层的平均调节子活性(D0-DY1、8h-DX1、D1-FN4、D2-DX6、D3-FH6 和 D7-DX7 部分)。(b) 每个分区层的平均活性(左)和 TBL1XR1 调节子在指定时间点的空间可视化(右)。(c) 再生肝脏TBL1XR1免疫荧光染色的代表性图像。(d) 抗TNFα或对照治疗后PHx后8小时对Tbl1xr1进行RT-qPCR。(e-f)免疫荧光染色的代表性图像。 (g) 在 PHx 后 D2 时对Tbl1xr1和细胞周期相关基因进行 RT-qPCR 。(h) 免疫荧光染色分析。(i) 对照肝脏和Tbl1xr1敲低肝脏中 PHx 后 D2 时 Ki67 +细胞核与所有细胞核的比率。(j) 火山图显示在 PHx 后 D2 时 比较对照和Tbl1xr1敲低肝脏的DEG。(k) 已确定的 DEG 的功能富集。(l) 四向维恩图显示指定数据集中基因的重叠。 (m) TCF4 和 H3K27ac ChIP-seq 在 NCoR 结合位点的堆积密度图。(n) TCF4、NCoR 和 H3K27ac ChIP-seq 在指定位点的基因组浏览器视图。
+ + + + + + + + + + +
结 论
本项研究将Stereo-seq与 scRNA-seq相结合,以生成小鼠肝脏稳态和全叶再生的高清时空图谱,综合研究详细分析了控制肝细胞功能的分子梯度,系统地定义了基因网络如何通过细胞间通讯进行动态调节以促进再生。在其他重要调节因子中,发现转录辅因子 TBL1XR1 是一种调节因子,它将炎症与 Wnt/β-catenin 信号联系起来,以促进肝细胞增殖。
+ + + + +



 English
English


