文献解读|Cell Rep Med(11.7):脊索瘤的临床蛋白质组学分类及精准治疗策略
✦ +
+
论文ID
原名:Clinical-proteomic classification and precision treatment strategy of chordoma
译名:脊索瘤的临床蛋白质组学分类及精准治疗策略
期刊:Cell Reports Medicine
影响因子:11.7
发表时间:2024.10.04
DOI号:10.1016/j.xcrm.2024.101757
背 景
脊索瘤是一种罕见的异质性间叶性恶性肿瘤,具有独特的临床和生物学行为。到目前为止,其全面的临床分子特征和准确的分子分类仍然不清楚。
实验设计
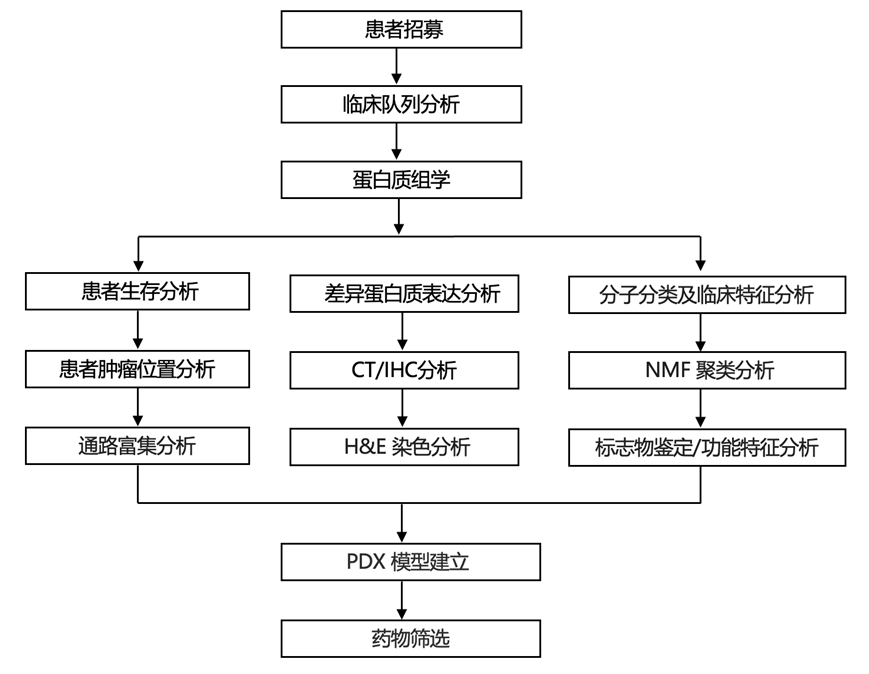
结 果
01
脊索瘤的临床蛋白质组学分析
研究团队建立了一个由 102 名患者组成的中国脊索瘤大规模临床蛋白质组学队列(图1A)。脊索瘤队列包括 68 名男性和 34 名女性,中位年龄为 57.5 岁(范围:15-84 岁)。一般身体状况通过卡氏体能状态 (KPS) 进行评估,大多数患者的 KPS 相对较好(中位数为 80)。在该队列中,骶尾骨 (76.47%) 是最常见的肿瘤部位,普通脊索瘤 (92.16%) 在所有病理亚型中占主导地位。所有脊索瘤组织均通过手术获得,包括整块肿瘤切除术、分块肿瘤切除术和次全肿瘤切除术。中位生存期为 43个月,其中 63 名患者(61.76%)出现脊索瘤复发,16 名患者(15.69%)出现远处转移。最终,共有 37 名(36.27%)患者在随访期间死亡,其中 35 名死于癌症。 2 年无进展生存率 (PFS)、总生存率 (OS) 和癌症特异性生存率 (CSS) 分别为 49.4%、90.2% 和 92.0%,而 5 年 PFS、OS 和 CSS 率分别为 9.2%、55.4% 和 56.5%(图1B-D)。
利用Swissprot 数据库,共鉴定出 79062 个肽。其中,他们随后进一步鉴定和定量了 9014 种蛋白质,错误发现率小于 1%(图 S1 A-B)。总体缺失率为 17.51%,表明缺失数据率在这种类型的蛋白质组学分析的可接受范围内。每个样本中鉴定出的蛋白质数量各不相同,鉴定数量高,批次差异低(图 S1 C-D)。对于随机选择的组织样本(SP15、SP21 和 SA74)的三个技术重复,它们的相关系数分别为 0.942、0.966 和 0.989(图 S1 E)。
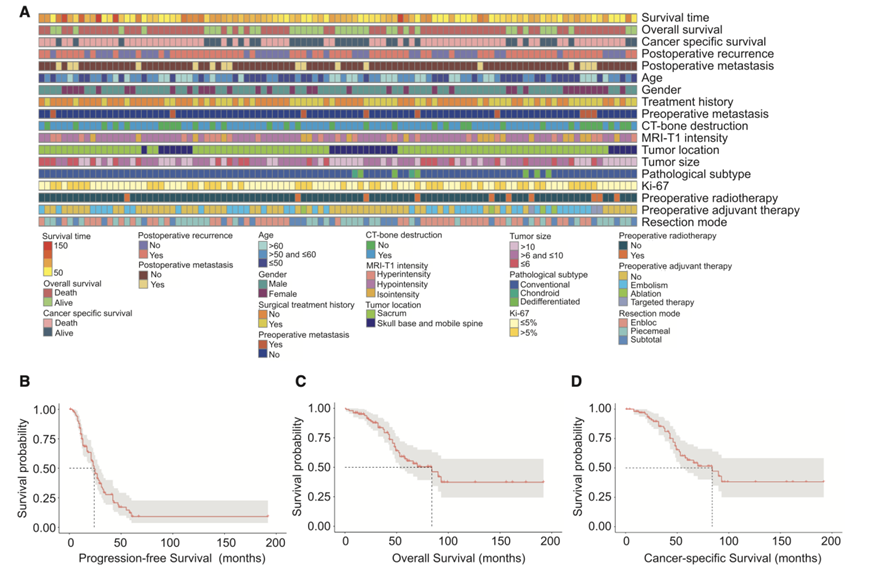
图1. 脊索瘤的临床蛋白质组学分析。
(A) 构建的脊索瘤队列的临床数据热图。(B-D) 脊索瘤患者的 PFS、OS和 CSS的 Kaplan-Meier 曲线。
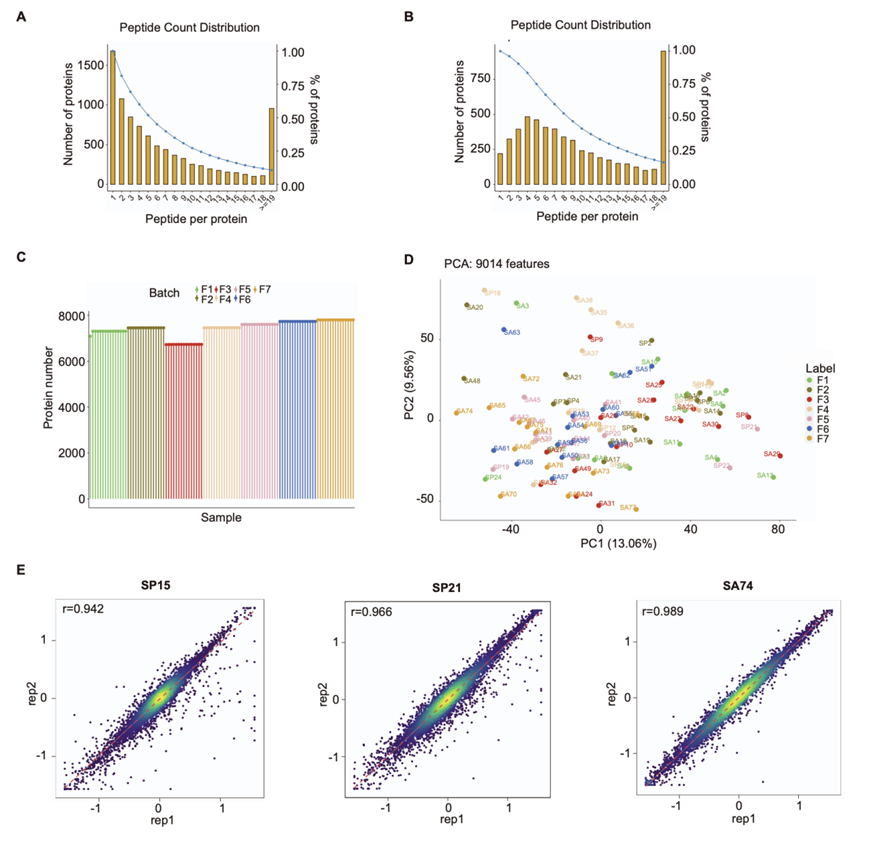
图S1. 脊索瘤的蛋白质组学分析。
(A-B) 所有鉴定蛋白的肽计数分布。(C) 7批样品中每个样品的蛋白质含量。(D) PCA检验不同TMT批次标记的样品之间批次效应的散点图。(E) 蛋白丰度的Pearson相关性。
脊索瘤起源于未分化的脊索残余,因此主要影响融合的脊柱节段。然而,根据美国的一项基于人群的研究,脊索瘤在骶骨、颅底和活动脊柱中的分布几乎相等。在本研究中,大多数脊索瘤位于骶骨,其余分布在颅底和活动脊柱。虽然两组的预后没有显著差异(图 S2 A-B),但脊索瘤具有不同的临床表现和预后,具体取决于解剖位置。因此,他们探索了两个解剖组之间的蛋白质组学多样性。颅底和移动脊柱脊索瘤与MYH2、MYL11和 ATP2A1 高度相关,而 DPEP1、FBN3 和 PDXK 在骶骨脊索瘤中过表达(图S2C)。GO分析显示,颅底脊索瘤和活动脊柱脊索瘤的生物学过程(BP)与干细胞和中胚层细胞的命运、免疫细胞(中性粒细胞和巨噬细胞)的调节和骨矿化相关。此外,信号转导通路(CAMP和TGF-β信号通路)、氧稳态和T细胞调节在骶骨脊索瘤中显著富集(图 S2 D)。通过 Reactome富集分析,与癌症免疫治疗相关的通路和 RIPK1 介导的调节坏死通路参与了骶骨脊索瘤发展;Rho GTPases 和 DNA 修复通路与颅底和活动性脊髓脊索瘤有关(图S2E-H)。

图S2. 基于肿瘤定位的脊索瘤临床-蛋白质组学分析。
(A-B)生存分析。(C) 骶骨脊索瘤与颅底/活动脊柱之间DEP的火山图。(D) 基于GO数据集BP的GSVA分析。(E-H) GSEA富集分析。
02
脊索瘤的影像学-蛋白质组学分析
计算机断层扫描 (CT) 和磁共振成像 (MRI) 是诊断骨肿瘤经常使用的成像方式。前者有利于显示骨结构,而后者用于正确描述肿块,确定其与脊髓、血管和多个内脏器官的关系。在 CT 扫描中,脊索瘤通常是溶骨性病变,而硬化性脊索瘤是一种特殊的罕见模式(图2A)。在本项研究中,71 名患者(69.61%)发现破坏性病变,其余 31 名患者(30.39%)没有出现骨破坏。通过 Kaplan-Meier 生存分析,CT 中的骨破坏与脊索瘤患者的预后没有显著相关性。由于 CT 表现不同,它们的生物学特征可能不同。对于差异表达蛋白 (DEP),SAA1、RETN 和 MME 在溶骨性脊索瘤中高表达,他们进一步验证了 RETN 的高水平(图 2 B-C)。
溶骨性脊索瘤的BP与 ECM-细胞信号传导、破骨细胞分化和 NOTCH 信号通路有关。无骨破坏的脊索瘤与干细胞和中胚层细胞特化指定以及成骨细胞调节(WNT 信号通路、成骨细胞增殖和骨成熟)有关。同样,Reactome 和 WP 富集分析表明,ECM 的降解和整合素细胞表面相互作用与溶骨性脊索瘤高度相关。在非骨破坏性脊索瘤中发现了与骨桥蛋白信号传导和氧化应激诱导的衰老相关的通路(图 2 D-E)。
在 MRI 上,肿块呈小叶状,在 T2 加权图像上通常呈现高信号,在 T1 加权图像上呈现差分信号。至于 T1 加权 MRI 上的低信号和等信号,它们的强度相对均匀。对于 T1 加权 MRI 上的高信号,强度可能不均匀(图 2 F)。在本研究中,发现64 名和 17 名患者出现低信号和中等信号,而 21 名 (20.59%) 患者为不均匀高信号,这是一种不良预后预测因素(图2G)。等/低信号的 T1 加权脊索瘤与 AHNAK2 和 PPTC7 高度相关。他们随后确定了 AHNAK2 的表达,并在 T1 加权 MRI 上呈低/中等信号的脊索瘤中发现其过度表达(图 2 H-I)。
关于 GO 分析的 BP,异质性高信号的脊索瘤与干细胞和中胚层细胞命运决定、免疫细胞(中性粒细胞和巨噬细胞)调节以及成骨细胞调节(WNT 信号通路、成骨细胞增殖和骨矿化)有关。通过功能富集分析,与 mTORC1 信号和 ECM 受体相互作用相关的通路与异质性高信号的脊索瘤有关,而 G2/M DNA 损伤检查点和 TP53 相关细胞周期基因与中等/低信号的脊索瘤有关(图 2 J-K)。
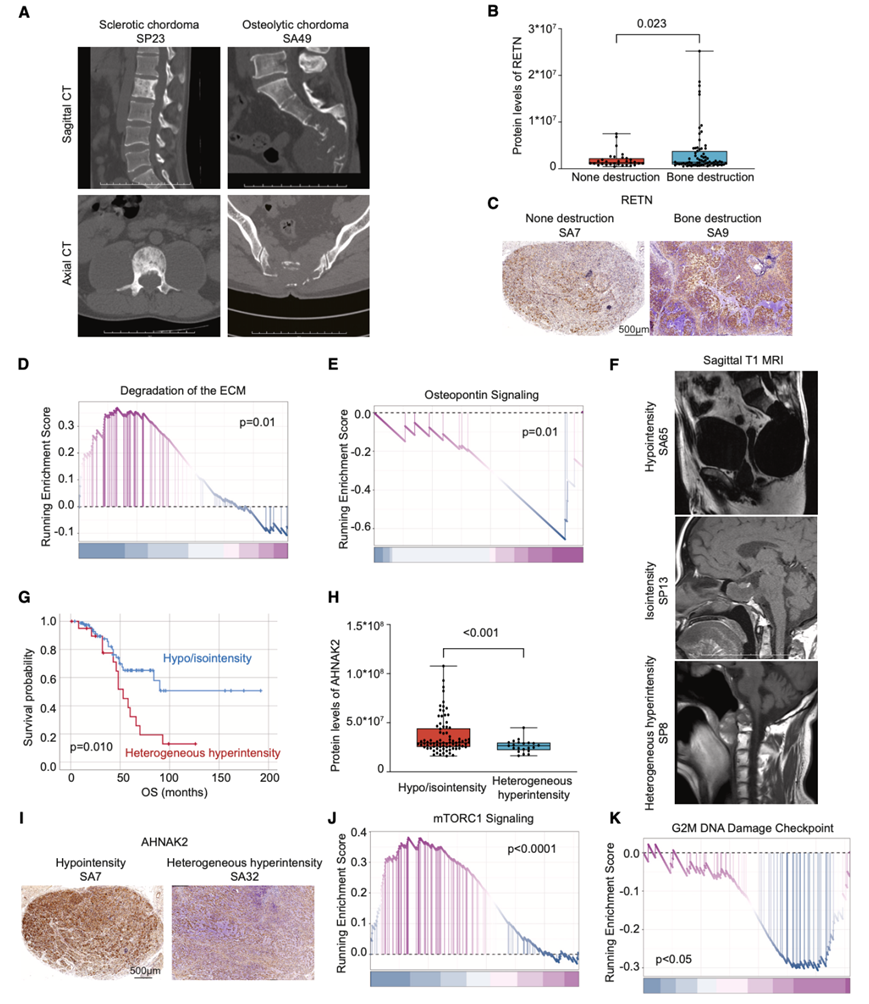
图2. 脊索瘤的影像学-蛋白质组学分析。
(A) 硬化性和溶骨性脊索瘤的代表性 CT 。(B-C) 脊索瘤中 RETN 的蛋白质水平和代表性免疫组织化学(IHC)图像。(D-E) GSEA 富集分析揭示了 ECM 降解和骨桥蛋白信号传导的差异。 (F) 脊索瘤的 MRI 代表性 T1 加权图像(低信号、等信号、不均匀高信号)。(G) 低/中等信号和异质性高信号之间 OS 的 Kaplan-Meier 曲线。(H-I) AHNAK2 的蛋白质水平和代表性 IHC 图像。(J-K) GSEA 富集分析揭示了 mTORC1 信号传导和 G2/M DNA 损伤检查点的差异。
03
脊索瘤的组织病理学-蛋白质组学分析
脊索瘤以前分为三种组织病理学模式:常规、软骨样和去分化亚型。在 2020 年 WHO 分类中,增加了一种新的但罕见的亚型(低分化脊索瘤),软骨样脊索瘤是常规脊索瘤的一种变体。因此,他们将常规和软骨样脊索瘤合并为一个亚型,以便与去分化亚型进行比较(图 3 A)。在本研究中,去分化脊索瘤与 OS 预后不良显著相关(图 3 B),但与 PFS 无关。相比之下,常规脊索瘤过度表达 SFRP4、NDUFS2 和 NDUFS3,而去分化脊索瘤与 POLR3C、PRPF3 和 WDR43 高度相关。接下来,他们验证了传统脊索瘤中 NDUFS3 的高水平(图 3C-D)。
在生物功能差异方面,普通脊索瘤与神经调节(突触小泡对接聚集、神经递质受体转运)及免疫细胞[自然杀伤(NK)细胞]和非肿瘤细胞(成肌细胞)调节有关,去分化脊索瘤主要与线粒体活动有关,普通脊索瘤保留了脊索的胚胎发育特征(图3E-F)。
Ki-67是评估恶性程度的重要肿瘤增殖标志物。在本研究中,39名患者(38.24%)的Ki-67水平高于5%,而63名患者(61.76%)的恶性程度较低(Ki-67≤5%)。低度恶性脊索瘤过表达ADGRB3、CILP2和CAVIN3,而PRPF4主要与高Ki-67水平的脊索瘤有关。此外,在高Ki-67水平的脊索瘤中也发现PRPF4的高表达(图3H-I)。
高度恶性脊索瘤与 UTP/GTP 生物合成过程、骨微环境 (BM)细胞(破骨细胞和成骨细胞)调节和 MET 有关,而低度恶性脊索瘤与凋亡细胞、免疫细胞(CD8+ T 细胞、髓系祖细胞和中性粒细胞)调节和骨矿化有关。接下来,他们进行了 Reactome 富集分析,并注意到癌症中的 DNA 复制和 EGFR 信号传导与高度恶性脊索瘤有关,在低度恶性脊索瘤中发现了与 ECM 降解和胶原蛋白降解相关的通路富集(图 3 J-K)。
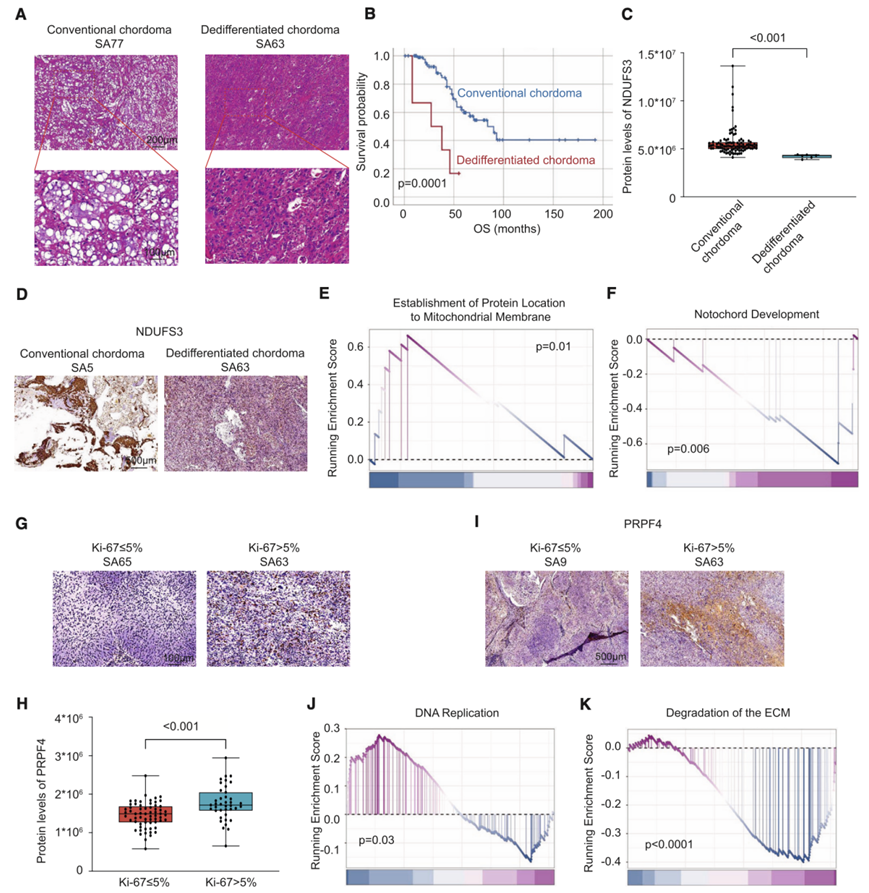
图3. 脊索瘤的组织病理学-蛋白质组学分析。
(A) 传统和去分化脊索瘤的代表性 H&E 染色。(B) 传统与去分化脊索瘤之间 OS 的 Kaplan-Meier 曲线。(C-D) NDUFS3 的蛋白质水平和代表性 IHC 图像。(E-F) GSEA 富集分析显示,蛋白质定位到线粒体膜和脊索发育存在差异。(G) Ki-67 > 5% 和≤ 5% 的代表性 IHC 图像。(H-I) Ki-67 > 5% 或≤ 5% 的脊索瘤中 PRPF4 的蛋白质水平和代表性 IHC 图像。(J-K) GSEA 富集分析显示,DNA 复制和 ECM 降解存在统计差异。
04
基于蛋白质组学分析的脊索瘤分子分类及其临床特征
在定量蛋白质组数据的非负矩阵分解 (NMF) 聚类中,计算了共表型相关系数。经过综合考虑,最终认为 k = 3 是最佳的聚类分离数。将三个不同的蛋白质组亚组指定为聚类 1、聚类 2和聚类 3。当 k = 3 时,共识矩阵热图显示出明显而尖锐的边界,表明聚类稳定且稳健(图 4 A)。为了验证聚类分配,他们进行了 t-SNE可视化分析,注意到亚型指定和 t-SNE 分布模式之间基本一致(图 4 B)。
接下来,他们试图确定蛋白质组脊索瘤亚型的临床相关性。根据 Kaplan-Meier 生存分析,确定了三个聚类的 OS 和 CSS。聚类 1、2 和 3 的平均 OS 分别为 145.7、55.1和 97.3个月(图 4 C)。由于两例死于其他原因(SA14 和 SP1)的患者均属于聚类 1,因此聚类 1 的平均 CSS 为 157.6个月,聚类 2/3 的平均 CSS 与其平均 OS 一致。对于蛋白质组聚类的预后价值,他们进行了多变量分析,结果显示聚类、切除方式和远处转移是预后因素(图 4 D)。接下来,他们试图消除混杂因素的干扰,排除接受肿瘤次全切除术的患者和有远处转移的患者,剩下 74 例患者参与分析。在该队列中,所有死亡均由癌症引起,在最后一组中观察到显著的预后差异(图 4 E),其中聚类 1 的预后最良好,而聚类2 中患者的 OS/CSS 最短。
在临床特征(患者性别、年龄、KPS 和远处转移)、肿瘤特征(病理分级、肿瘤大小、Ki-67)和切除方式方面,三个聚类之间没有显著差异。与聚类1 和聚类2 相比,聚类3 中发现了更多的骶骨脊索瘤(87.8%),而在这个聚类中发现较少的移动性脊柱瘤(12.2%)(图 4 F)。在聚类1 中,原发性脊索瘤(76.9%)和 T1 加权 MRI 低信号的脊索瘤(76.9%)发现率很高(图 4 G-H)。
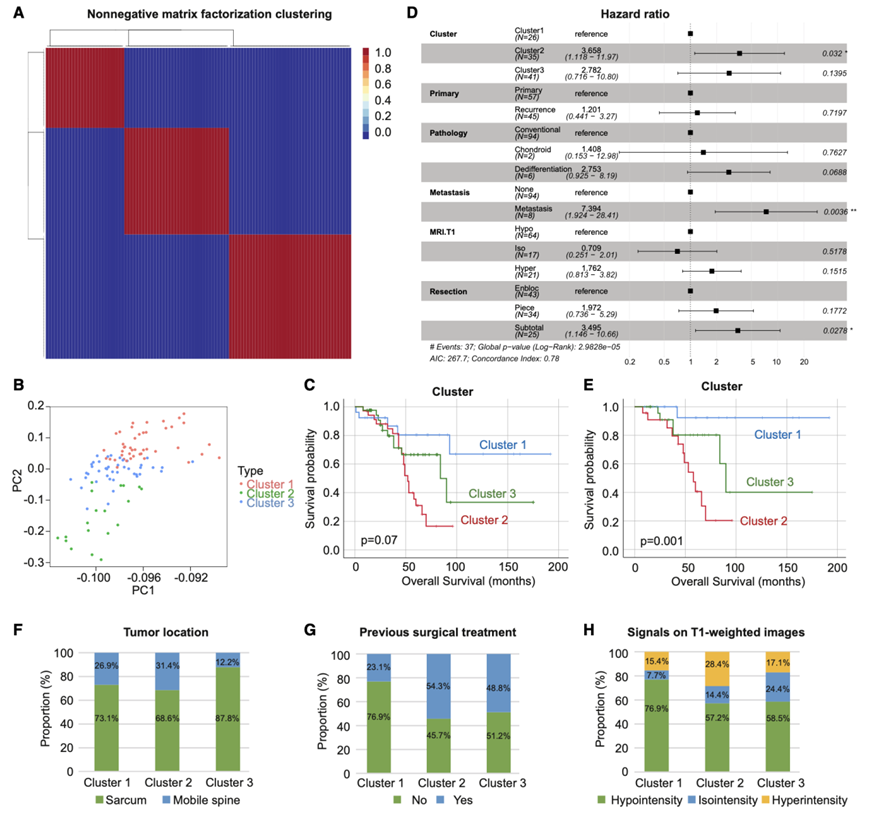
图4. 根据蛋白质组学分析对脊索瘤进行分子分类及其临床特征。
(A) 使用蛋白质组学数据进行 NMF 聚类来识别分子亚型。 (B) PCA 图显示了已识别的三个聚类中脊索瘤样本的 t-SNE 分布。(C) 所有脊索瘤患者中已确定的三个聚类的 OS 的 Kaplan-Meier 曲线。(D) 队列中脊索瘤患者 OS 的多元 Cox 回归分析森林图。(E) 未发生远处转移且未进行次全切除的患者中,确定的三个聚类的 OS 的 Kaplan-Meier 曲线。
05
分子亚型的生物学特征
聚类1 的 DEP 富含 BM 细胞(破骨细胞、成骨细胞、肥大细胞、中性粒细胞、NK 细胞、巨噬细胞、T 细胞和 B 细胞)的特征,而聚类 2 则观察到间充质细胞和线粒体 OXPHOS。聚类3 的特征是上皮特征[间充质-上皮转化 (MET)、上皮细胞增殖]、ECM 分解和对酪氨酸激酶 (PDGF) 的通路富集(图 S9 A)。因此,他们将脊索瘤分为三种分子亚型:BM 显性、间充质衍生和 MET 介导(图 5 A)。
为了进一步验证每种亚型的组织病理学特征,他们采用了组织学染色和生物信息学分析。多色免疫荧光和免疫组织化学显示在 BM 显性亚型中大量鉴定出 CD8 + T 细胞、CD14 +单核细胞/巨噬细胞、TRAP +破骨细胞和 SP7 +成骨细胞,而泛细胞角蛋白在 MET 介导的脊索瘤中高度表达(图5B)。对于肿瘤特征,他们研究了肿瘤纯度以及基质和免疫特征。根据脊索瘤亚型的蛋白质组学数据,MET 介导的亚型表现出最高的肿瘤纯度和最低的基质评分,而 BM 显性亚型的免疫评分明显高于其他亚型。
在 BM 显性亚型中,他们发现了免疫微环境标志物(CD3G、CD8A、MZB1、CD14、CD16a、CD16b、CD47 和 CXCL13)和骨特异性微环境标志物(SEMA7A、MMP9、OSCAR 和 CA2)的过度表达,以及更高丰度的免疫细胞(CD8 + T 细胞和单核细胞)浸润(图 5C-D)。对于间充质来源的脊索瘤,他们定量了 Mito 蛋白以及线粒体呼吸复合体 I-V的表达并确定了它们的高水平(图 5E-F)。
此外,他们研究了先前报道的三种亚型脊索瘤突变基因。脊索瘤标记物(TBXT、CDKN2A、LYST 和 ACAN)在 MET 介导的亚型中显著富集(图 5G),而染色质建模基因(PBRM1、SETD2 和 ARID1A)在间充质衍生的亚型中高度表达,其中 SETD2 存在统计学差异。
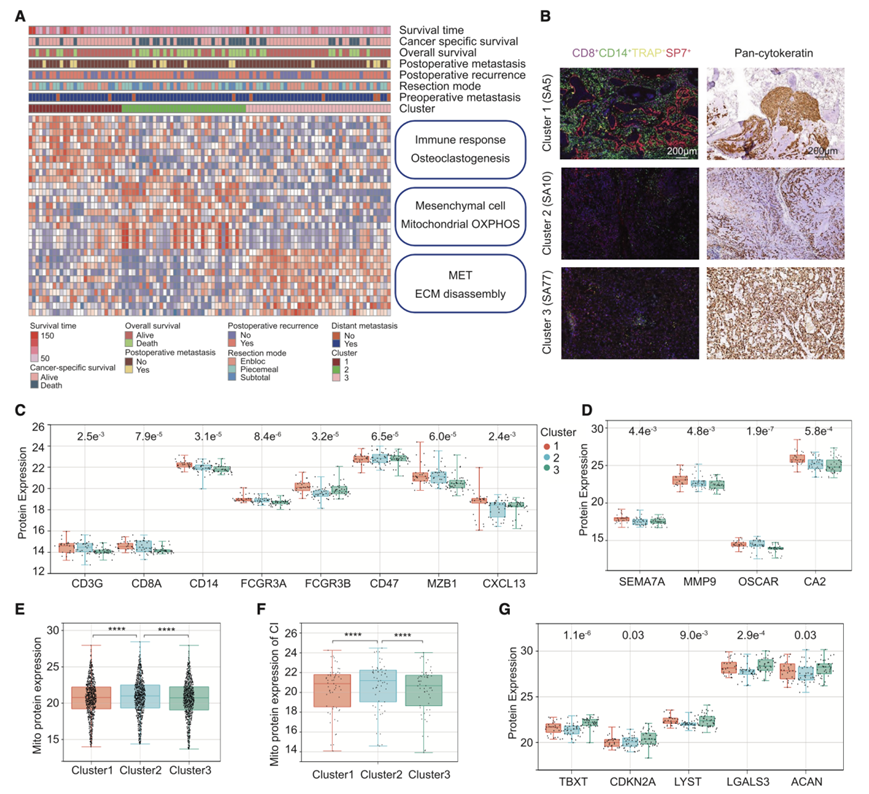
图5. 分子亚型生物学特征。
(A) 基于已识别的三个聚类中的 DEP 功能富集分析的 NMF 聚类。 (B) 脊索瘤亚型中 CD8、CD14、SP7、TRAP 的代表性多色 IF。(C-D) 已鉴定的三个聚类中关键免疫微环境标志物和骨微环境标志物的蛋白质表达。(E-F) 脊索瘤亚型中的 Mito 蛋白表达和 CI 的 Mito 蛋白表达。(G) 已鉴定的三个聚类中先前报道的脊索瘤突变基因的蛋白质表达。
06
脊索瘤亚型的精准治疗策略
利用生物学特征信息,他们针对每种脊索瘤亚型提出了针对性的治疗策略。在脊索瘤细胞系中,由于缺乏TME细胞,没有一个归类为BM显性亚型。同时,将CH22和JHC7鉴定为间充质衍生脊索瘤;MUG-CHOR1、U-CH2和UM-CHOR1是MET介导的亚型(图6A)。
鉴于 BM 显性亚型的特点是免疫和破骨细胞活化,针对此亚型优化了破骨细胞靶向性,并选择了 RANKL 单克隆抗体地诺单抗(denosumab)。在细胞功能实验中,地诺单抗对 CH22 和 U-CH2 未表现出抑制作用。为了确定 BM 内的抗肿瘤作用并模拟体内条件,他们建立了患者衍生的异种移植 (PDX) 模型。结果显示,地诺单抗抑制了 SA47(BM 显性亚型)皮下 PDX 中的肿瘤进展,而体重没有明显下降(图 6 B)。总体而言,这些数据表明地诺单抗靶向破骨细胞生成,并对 BM 显性亚型的脊索瘤致瘤性表现出明显的抑制作用。
由于间充质来源的脊索瘤以线粒体 OXPHOS 为特征,因此OXPHOS 可能是潜在的治疗靶点。S-Gboxin 是 Gboxin 的功能类似物,可作为 OXPHOS 抑制剂。在细胞功能实验中,S-Gboxin 对 CH22 的 IC50 为 3.37 μM(图 6 C)。通过 MTT 和克隆形成试验,S-Gboxin 在 1 μM 剂量下以时间依赖性方式降低了 CH22 细胞增殖和克隆形成(图 6 D-E)。同时,S-Gboxin 还导致 CH22 细胞的 ATP5A1(线粒体 ATP 合酶亚基)表达和氧消耗率大幅降低(图 6 F)。他们在脊索瘤PDX和细胞来源的异种移植(CDX)模型中研究了S-Gboxin的体内抑制作用。在SA20(间充质来源亚型)的皮下PDX中,S-Gboxin抑制了脊索瘤的发展,而体重没有明显下降(图6G)。与PBS组(对照)[平均肿瘤体积(TV):1.72cm3]相比, S-Gboxin组的TV(平均TV:0.74cm3)在治疗结束时显著减小,而裸鼠体重无明显下降(图6H)。总之,S-Gboxin 是间充质脊索瘤的候选治疗选择。
由于 MET 介导的脊索瘤与 RTK 激活高度相关,安罗替尼(anlotinib)[一种口服多种 RTK(针对 FGFR、VEGFR 和 PDGFR)的小分子抑制剂]可作为候选药物。根据体外功能实验,安罗替尼抑制 U-CH2 细胞生长,IC50 值为 0.7324 μM(图 6 I)。因此,安罗替尼在 MTT 和克隆形成试验中发挥了抑制作用。它在 0.5 μM 浓度下以时间依赖性方式抑制细胞增殖(图 6 J-K)。在 SA50(MET 介导亚型)的 PDX 中,安罗替尼(6 mg/kg)以时间依赖性方式抑制脊索瘤形成,且体重没有明显下降(图 6 L)。在具有 U-CH2 的胫骨异种移植模型中,安罗替尼以剂量依赖性方式逆转脊索瘤发展,且体重没有降低(图 6 M)。总之,安罗替尼为 MET 介导亚型脊索瘤提供了一种潜在的治疗方式。
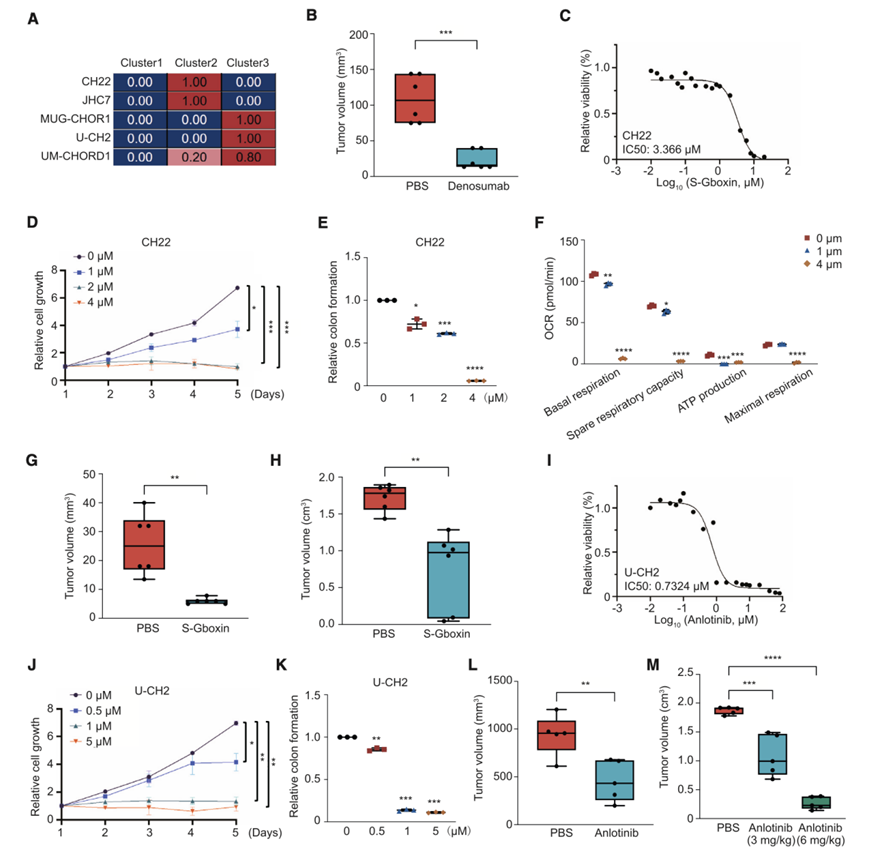
图6. 脊索瘤亚型精准治疗策略。
(A) 脊索瘤细胞系与已识别的三个聚类之间的相关性。(B) 地诺单抗和 PBS 处理的 PDX 模型的肿瘤体积。(C) S-Gboxin对CH22细胞的IC50。(D) 细胞增殖分析。(E)克隆形成分析。(F) 细胞耗氧率(OCR)分析。(G-H) 肿瘤体积分析。(I) 安罗替尼对U-CH2细胞的IC50。(J) 细胞增殖分析。(K) 克隆形成分析。(L-M) 肿瘤体积分析。
+ + + + + + + + + + +
结 论
本研究招募了 102 例脊索瘤患者,并描述了他们的临床、影像学和组织病理学特征。通过蛋白质组学分析和非负矩阵分解聚类,本研究将脊索瘤分为三种分子亚型:骨微环境显性、间叶衍生和间叶-上皮转化介导模式。这三种亚型表现出不同的临床预后和不同的生物学属性,即破骨细胞生成和免疫原性、氧化磷酸化和受体酪氨酸激酶活化,提示分别采用地诺单抗、S-Gboxin 和安罗替尼的靶向治疗策略。值得注意的是,这些方法在体外和体内对每种亚型都显示出积极的治疗结果。总之,这项工作揭示了脊索瘤的临床蛋白质组学特征,并根据分子分类为脊索瘤提供了候选的精准治疗策略,强调了其临床应用的潜力。
+ + + + +



 English
English


