文献解读|Nat Commun(14.3):上皮性卵巢癌的蛋白质组学图谱
✦ +
+
论文ID
原名:Proteomic landscape of epithelial ovarian cancer
译名:上皮性卵巢癌的蛋白质组学图谱
期刊:Nature Communications
影响因子:14.3
发表时间:2024.07.31
DOI号:10.1038/s41467-024-50786-z
背 景
卵巢癌 (OC) 是全球影响女性生殖系统的最致命癌症之一。其高死亡率主要是因为早期难以检测、组织间和组织内的异质性、高复发率和有效的治疗方法有限。上皮性卵巢癌 (EOC) 是最常见的组织学类型,由于肿瘤位于腹腔内并且缺乏特定的早期症状,通常在晚期才诊断出来。EOC 可细分为五种组织学亚型,即高级别浆液性 OC (HGSOC)、低级别浆液性 OC (LGSOC)、透明细胞 OC (CCOC)、子宫内膜样 OC (EMOC) 和粘液性 OC (MCOC)。每种亚型都表现出不同的临床特征、组织型特异性祖细胞和分子改变。
实验设计
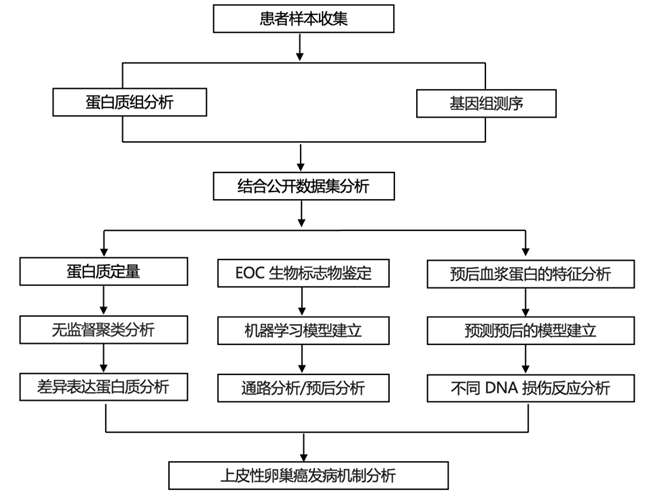
结 果
01
中国 EOC 的蛋白质组学概况
研究团队从三个中国队列中收集了 753 例手术切除的 EOC 组织,即接受减瘤手术的原发性队列(PDS-EOC5)、接受新辅助化疗的原发性队列(NACT-EOC)和复发性队列(RLP-EOC)(图 1A)。PDS-EOC包括5种组织学亚型,即高级别浆液性(HGSOC)、低级别浆液性(LGSOC)、透明细胞性(CCOC)、子宫内膜样(EMOC)和黏液性(MCOC) EOC,而其他2个队列的样本几乎全部为HGSOC,他们定量了10527个蛋白质(图1A)。与非癌组织相比,癌组织中发现的蛋白质数量明显更多(图1B)。值得注意的是,对整体蛋白质组的无监督聚类很好地分离了正常组织和癌组织(图1C)。
他们在血液样本中也可以检测到一组蛋白质,其表达水平与组织活检中的肿瘤恶性程度相关。这些蛋白质可以作为可行的生物标志物,以非侵入性的方式区分良性和恶性状态,从而增强癌症的诊断能力。他们确定了8个蛋白聚类,它们随着恶性程度的增加而持续上调(图1D)。此外,与正常组织相比,原发性癌中有 2551 种蛋白显著上调(图1E)。这些恶性肿瘤相关蛋白主要富集于能量代谢和肿瘤坏死因子(TNF)相关通路。
接下来,他们重点研究了这些恶性肿瘤相关蛋白中的组织渗漏蛋白(tissue-leakage proteins)。在 2551 个上调蛋白中,有43 个是分泌蛋白。此外,他们鉴定出了碳水化合物抗原 125 (CA125),这是用于监测化疗反应的 EOC 生物标志物(图 1E)。
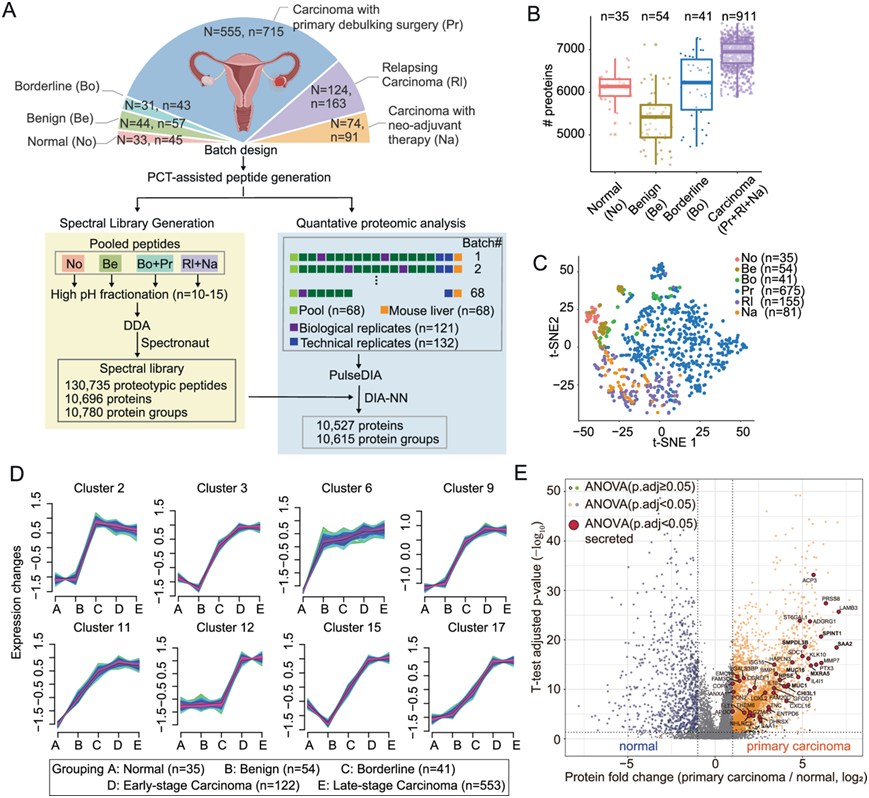
图1. 中国EOC的蛋白质组学分析。
(A)实验流程。(B)四组的蛋白质数量。(C) 无监督聚类分析。(D) 根据恶性程度的增加而上升的趋势选择了八个聚类。(E) 火山图表示PDS-EOC队列癌样本与正常组织之间的差异表达蛋白(DEP)。
02
EOC 组织和血浆样本中的恶性肿瘤相关蛋白
接下来,他们收集了PDS-EOC 队列中 168 份患者的血浆样本,并对其进行了蛋白质组学分析(图 2A)。与非癌症个体相比,其中八种分泌候选物在 HGSOC 患者血浆中上调(图 2 A-C)。这些候选蛋白包括 CA125(又称 MUC16)、粘蛋白-1(MUC1)、kunitz 型蛋白酶抑制因子 1(SPINT1)、血清淀粉样蛋白 A-2(SAA2)、几丁质酶-3 样蛋白 1(CHI3L1)、基质重塑相关蛋白 5(MXRA5)和肝素酶(HPSE)。公开数据显示,所有这些蛋白在卵巢癌患者的临床标本中(相对于非癌对照)过表达。值得注意的是,酸性鞘磷脂酶样磷酸二酯酶3b (SMPDL3B)在HGSOC组显著上调(图2B-C)。SMPDL3B是一种参与细胞膜脂质调节的酶,也是巨噬细胞toll样受体信号转导的负性调节因子。在局限性前列腺癌中,SMPDL3B高表达与迁移障碍和良好预后相关。
为了鉴别卵巢癌和非癌(non-carcinoma),他们构建了15个机器学习模型。这些模型是使用上述8种经过验证的蛋白质及其不同的组合,应用随机森林算法开发的。优先考虑了一个8个特征的分类器,检测到的 MUC16/CA125 的重要性低于其他七种蛋白质(图2D-F)。
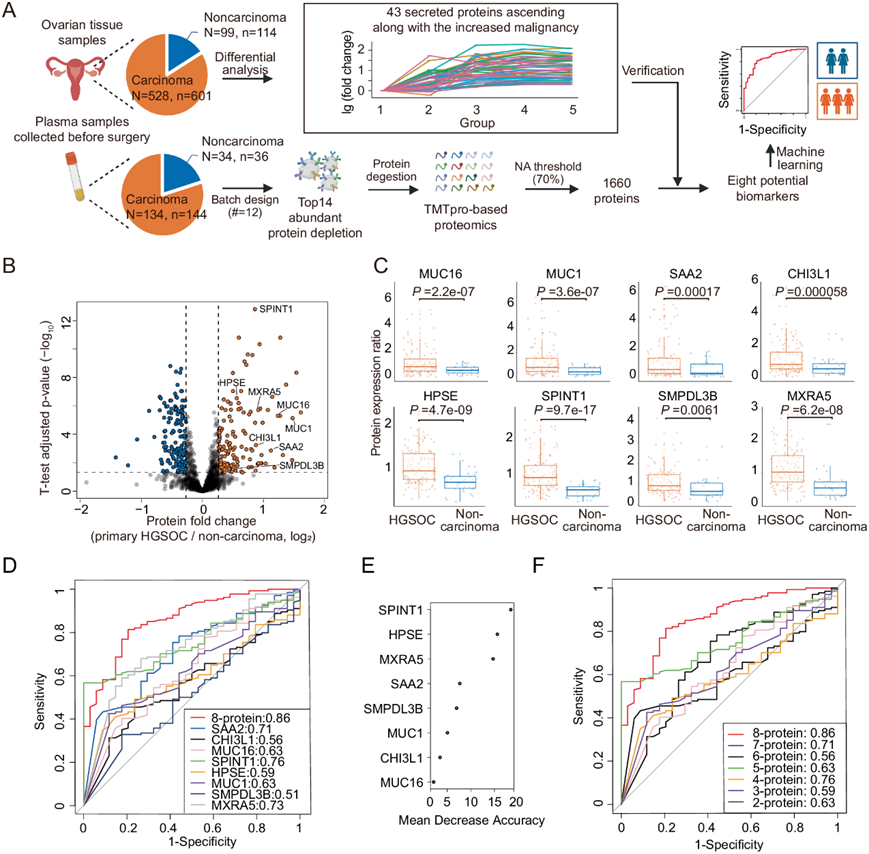
图2. 血浆样本中 EOC 潜在蛋白质生物标志物的验证。
(A) 对血浆样本进行蛋白质组学分析,并验证血浆样本中随着卵巢组织恶性程度的增加而上调的潜在蛋白质生物标志物。(B) 对原发性 HGSOC 和非癌症组血浆样本的 DEP进行分析。(C) 蛋白表达验证。(D) 使用每个特征和八特征模型进行五倍交叉验证的总 AUC。(E) 构建八特征模型时,五倍交叉验证中平均减少准确度的平均值。(F) 使用按重要性排序选择的两到八个特征进行五倍交叉验证的总 AUC。
03
中国 EOC 五种组织学亚型的蛋白质组学特征
EOC 的五种组织学亚型具有不同的风险因素、细胞来源、遗传特征、临床特征和治疗方法。与其他组织学亚型相比,HGSOC 的淋巴转移、晚期和化疗耐药发生率明显较高(图3A)。为了系统地研究 PDS 队列中 5 种组织型的蛋白质组学特征,他们在每种组织型与正常卵巢组织样本之间鉴定了总共 4313 个差异表达蛋白 (DEP),其中 2709 个在 5 种组织型之间表现出显著失调。通过无监督聚类,他们发现聚类 4 中 CCOC 特异性上调蛋白在中性粒细胞脱颗粒、补体和凝血级联和多种代谢通路中富集(图 3A)。由于卵巢癌透明细胞组织学亚型(CCOC)和肾癌(CCRC)之间的基因组具有相似性,目前已批准用于CCRC的抗血管生成药物已在多项临床试验中用于CCOC(NCT00979992、NCT02315430和NCT01914510),但显示出有限的益处。有趣的是,CCOC特异性蛋白模式揭示了在聚类4中上调的蛋白酶抑制因子,如ITIH1、ITIH3和SERPINA1,以及在聚类2中下调的VEGF相关促血管生成蛋白,如SMAD1和ARHGEF40。
本项研究表明,对 PDS 队列中的五种组织型进行系统分析可以提供更全面的差异生物标志物信息。例如,早期研究报告聚合免疫球蛋白受体 (PIGR) 是 EMOC 的诊断标志物,将其纳入标准临床标志物组(WT1 和 TP53)可提高 HGSOC 和 EMOC之间的诊断潜力。然而,在本项研究中,与正常组相比,PIGR 不仅在 EMOC 中显著上调,而且在 HGSOC、CCOC 和 MCOC 组中也发生显著上调。虽然 HGSOC 中的差异倍数 (FC) 远小于 EMOC,但 CCOC和 MCOC中的FC大于 EMOC的FC(图 3C)。因此,由于 PIGR 缺乏特异性,因此未将其纳入组织型特异性 DEP 列表。在膜联蛋白 A4 (ANXA4)和细胞视黄酸结合蛋白 2 (CRABP2) 中也发现了类似的偏差(图 3C),这表明这些生物标志物候选物可能不适合直接区分 PDS-EOC 的五种组织型。
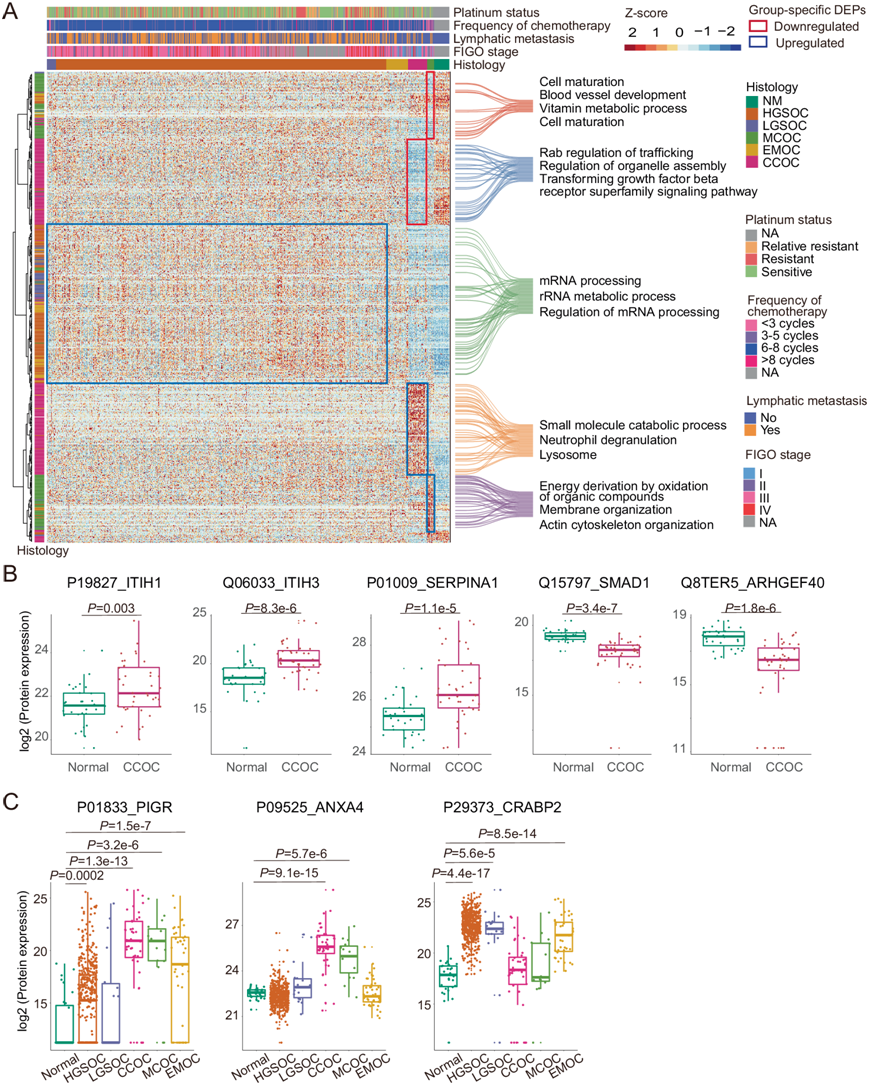
图3. PDS-EOC 群体中的组织型特异性蛋白质及其功能。
(A) 热图可视化了正常和五种原发性 EOC 组织型中 606 种组织型特异性蛋白的表达。(B) 对正常和 CCOC组之间参与血管生成蛋白质的差异表达进行分析。(C) PDS-EOC队列中正常组和5种组织类型的蛋白表达分析。
04
鉴定与晚期 HGSOC 预后相关的蛋白质
超过 80% 的晚期卵巢癌女性会出现复发,不幸的是,大多数复发病例无法治愈。他们分别从 PDS-EOC、RLP-EOC 和 NACT-EOC 队列中的晚期 HGSOC 组织中鉴定了 572、346 和 486 种与 RFS 相关的潜在预后蛋白(图4A)。值得注意的是,大多数这些潜在的预后蛋白都是队列特异性的(图 4A),突出了原发性癌、复发性癌和 NACT 癌切除后宿主反应不同。在 PDS-EOC 队列中,血小板反应蛋白-1(TSP1)对血管生成的抑制在预后良好的患者中发生特异性激活(图 4B)。
在NACT-HS队列中,他们观察到剪接体循环在预后不良的患者中发生特异性激活(图 4 B-C)。PD-1 / PD-L1癌症免疫治疗通路在原发性和NACT预后良好的患者中均受到抑制(图 4 B-C),表明PD-L1 / PD-1阻断对这些患者具有生存益处。在RLP-HGSOC队列中,他们发现生长激素信号、促红细胞生成素信号通路、ERBB4信号和自噬在预后不良的患者中受到特异性抑制(图 4B)。肌醇磷酸化合物和D-肌醇-5-磷酸代谢超通路在RLP-HGSOC队列预后不良的患者中受到抑制,但在PDS-HGSOC队列中发生激活(图 4B-D),表明肌醇化合物在原发性和复发性患者中的抗癌活性不同。磷酸肌醇磷脂酶C (PLC) 是磷酸肌醇(PI)循环中的一类代谢酶家族,可催化两种细胞内第二信使DAG和InsP3的生成。据报道,这些信使会影响主要的致癌信号通路,包括 PI3K/Akt/mTOR 和蛋白激酶 C 信号,进而调节癌细胞的运动、分裂和死亡。在本项研究中,PIK3R3、PLCB1 和 PLCB4 升高与原发性 HS 的不良预后相关,而复发性 HGSOC 中 PIK3R4 和 PLCG2 上调与良好预后相关(图 4 C-E),突出了复杂的生物学。
为了研究PDS-HGSOC队列血浆中的预后蛋白,他们对血浆蛋白质组进行了单变量Cox回归分析,发现124种不良预后蛋白和73种良好预后蛋白。这些不良预后蛋白主要参与炎症反应和细胞外基质等通路,而良好预后蛋白在适应性免疫系统中富集(图 4F)。α-1-抗胰蛋白酶(SERPINA1)、血小板衍生的生长因子亚基A(PDGFA)和凝溶胶蛋白(GSN)最重要的危险因子(图 4G)。SERPINA1 是一种具有抗炎和组织保护特性的蛋白酶抑制因子,在复发和无反应的卵巢癌患者中均升高。
他们在 PDS-HGSOC 队列的组织和血浆样本中发现了 17 种具有潜在预后的蛋白质(图4H)。其中,14 种是独立的预后蛋白,主要参与免疫反应和细胞外基质组织(图 4H)。蛋白酶体亚基 β9 型(PSMB9)是免疫蛋白酶体的催化亚基,在血浆和组织样本中都是一个独立的危险因子(图 4H)。在血浆和组织样本中,富含亮氨酸α2糖蛋白(LRG1)是一个独立的预后不良蛋白(图4H)。LRG1是致病性血管生成的调节因子,可诱导上皮-间充质转化(EMT),从而导致癌细胞的迁移。因此,LRG1 的高表达可能促进血管生成和 EMT,从而增强转移和提前复发。
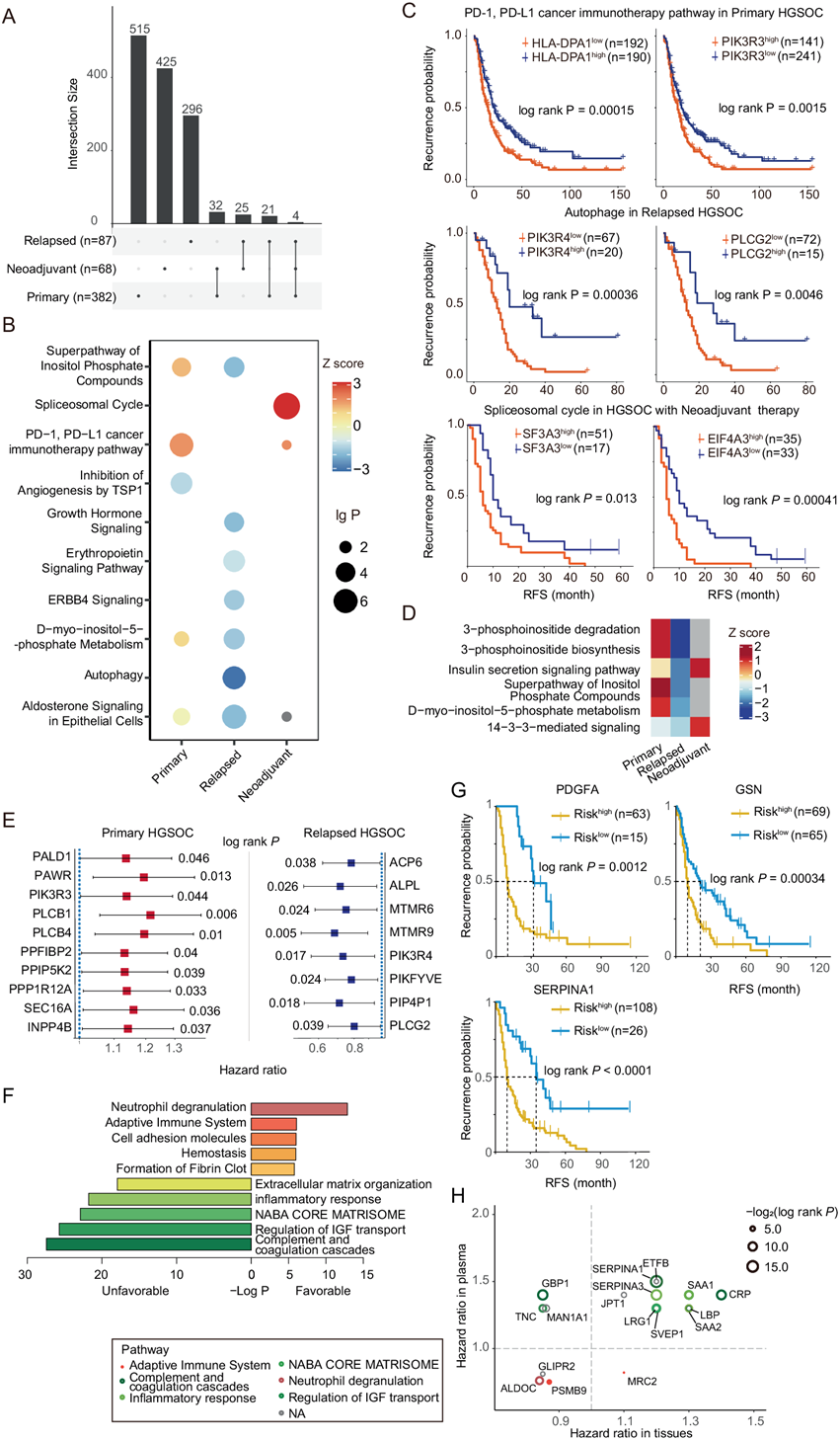
图4. 来自三个 HGSOC 队列的组织和血浆样本的预后分析。
(A) UpSet图显示 PDS-HGSOC、RLP- HGSOC 和 NACT- HGSOC 队列中晚期癌样本组织预后蛋白的交集。(B) 通过IPA 对三个队列中组织预后蛋白的通路富集进行分析。(C) 通过每个队列中代表性通路中预后蛋白的表达来区分预后差异。(D) 热图表示不同队列中在预后中起相反作用的通路。(E) PDS-HGSOC和 RLP-HGSOC队列之间肌醇化合物代谢关键蛋白质的风险比 。(F) 使用Metascape 富集的血浆预后蛋白通路。(G) Kaplan-Meier 图表示血浆样本中三种不依赖临床因素的蛋白质的预后意义。(H)组织和血浆样本中的预后蛋白。
05
用于预后预测的蛋白质分类器模型
为了验证组织和血浆样本中的预后蛋白,他们采用了靶向蛋白质组学方法,并证实了 38 种组织蛋白和 34 种血浆蛋白与预后相关(图 5A)。在外部验证队列中,当纳入组织或血浆蛋白特征时,组织模型B和血浆模型C均能有效预测晚期原发性HGSOC患者的1年复发。外部验证队列包括了从发现组和测试组不同时期收集的临床样本(图5B-E)。CPTAC 队列也作为外部验证集,以验证组织模型 B 在中国患者队列之外的适用性。由于 CPTAC 队列中缺少两个临床因素和 AGRE5 蛋白表达数据,他们调整了模型,保留了其余 11 个蛋白特征的原始参数,用于预测一年复发率,调整后的模型在 CPTAC 队列中表现出良好的预测能力(图5F)。
在组织模型B中,鉴定了多种蛋白鉴定是卵巢癌的诊断生物标志物,如α2-巨球蛋白(A2MG)、血清淀粉样蛋白A-1 (SAA1)和转甲状腺素蛋白(TTHY)。其他与化疗耐药和转移相关的蛋白包括粘附G蛋白偶联受体E5 (AGRE5)、14-3-3sigma蛋白 (1433S)、过量位点蛋白4 (SURF4)和线粒体质子/钙交换蛋白(LETM1)(图5B)。值得注意的是,组织模型 B 中的蛋白酶体亚基 β 型 6 (PSMB6) 也纳入使用拷贝数变异反式影响蛋白的预后模型,而等分支酶结构域含蛋白 2 (ISOC2) 在 CPTAC 数据集中鉴定为预后蛋白。
在血浆模型C中,补体系统包括备蛋白(PROP)、C4b结合蛋白α链(C4BPA)和补体成分C8 (CO8G) 三种蛋白(图 5D),与卵巢癌细胞增殖和耐药性有关,且与患者预后不良有关。此外,凝血因子XIII A链(F13A)和α-1-抗胰蛋白酶(A1AT) 参与凝血过程(图 5D),其具有诊断和预后的潜力。
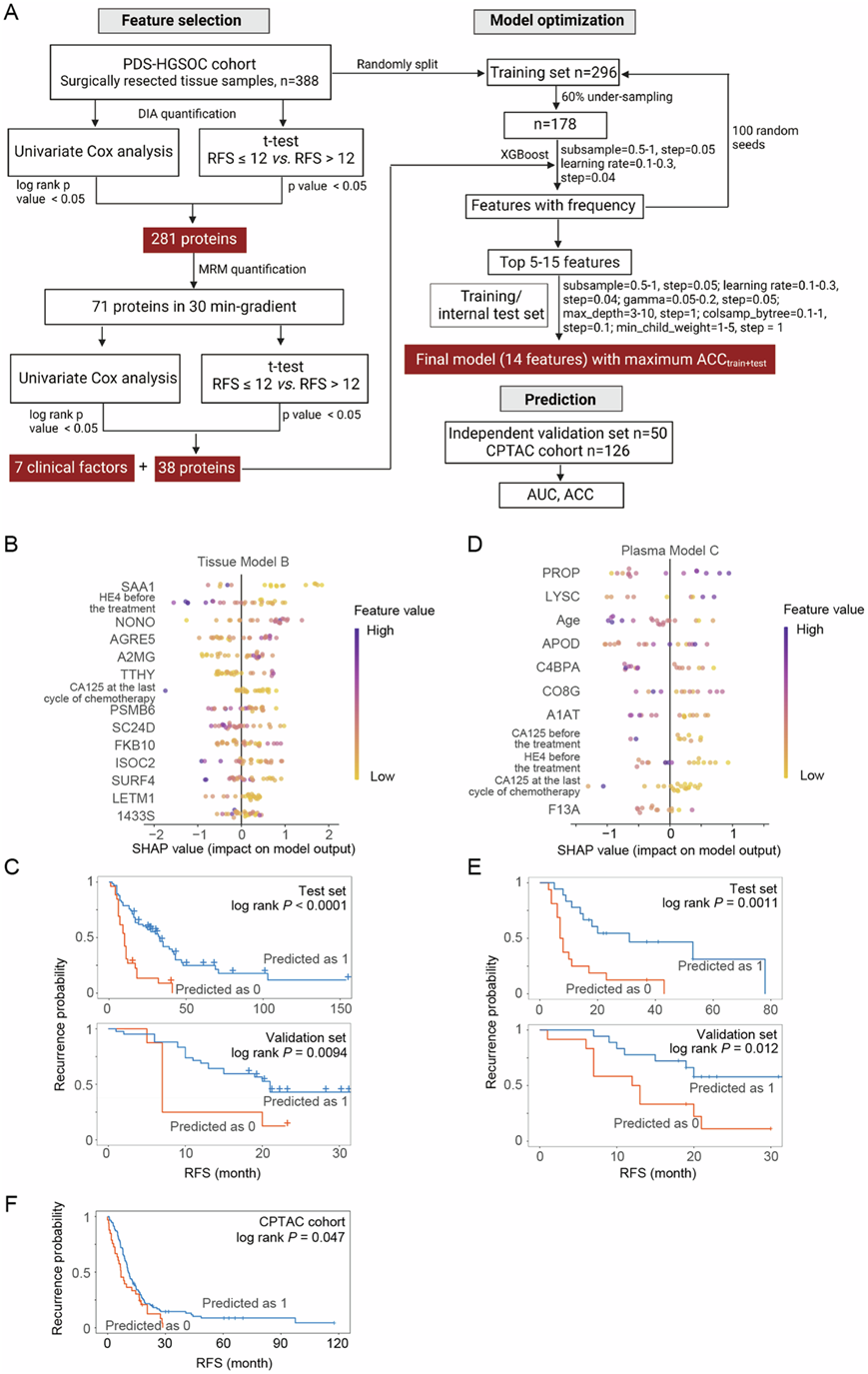
图5. 预测原发性 HGSOC 患者一年复发的预后模型。
(A) 基于组织蛋白质组数据的机器学习模型的工作流程。(B) 12 种组织蛋白和两种临床因素对组织模型 B 输出(output)的影响。(C) 组织模型 B 在内部测试集和外部验证集中预测组的 Kaplan-Meier 图。(D) 7种血浆蛋白和四种临床因素对血浆模型 C 输出的影响。(E) 血浆模型 C 在内部测试集和外部验证集中预测组的 Kaplan-Meier 图。(F) 分类器预测组的 Kaplan-Meier 图。
06
分析HGSOC 中的不同 DNA 损伤反应
为了比较 PDS 和 RLPS HGSOC 患者之间化学耐药的潜在驱动因素,他们对四组患者(即原发敏感组、原发耐药组、复发敏感组和复发耐药组)的 295 个基因组进行了靶向基因组测序(图6A)。TP53是最常见的突变,发生在 PDS 和 RLPS 队列中约 85% 的患者中(图 6A)。他们专注于同源重组修复 (HRR) 途径,因为HRR已确定是 HGSOC 中 PARP 抑制的靶点。他们在56.20%的初发患者和53.39%的复发患者中发现了14个HRR基因的生殖细胞系或体细胞突变(图6A)。原发敏感组中的 HRR 基因突变明显高于原发耐药组。然而,在两个复发组(复发敏感组和复发耐药组)中没有观察到差异(图 6A)。
为了表征 HRR 通路突变对原发性 HGSOC 患者化学敏感性的影响,他们比较了具有 HRR 突变的化学敏感性 HGSOC 患者和没有任何 HRR 突变的化学抗性患者的蛋白质组数据。在具有 HRR 突变的化学敏感性 HGSOC 患者中鉴定了 53 种上调蛋白质和 206 种下调蛋白质(图 6B)。
他们在复发队列中根据化疗反应分层确定了 DEP。仅发现 11 个 DEP 在原发队列和复发队列之间重叠(图 6C)。值得注意的是,复发化学敏感患者中 DNA 修复相关蛋白质上调(图 6D-E)。这与具有 HRR 突变的原发性化学敏感患者形成对比,在这些患者中这些蛋白质下调(图 6E)。这些结果表明复发队列的化学敏感性可能不是主要由 HRR 相关过程驱动的。此外,复发性化学敏感患者中总共 163 种上调蛋白质也在组蛋白修饰和适应性免疫通路中富集,而 193 种下调蛋白质参与先天免疫、伤口愈合和 VEGF 相关信号。
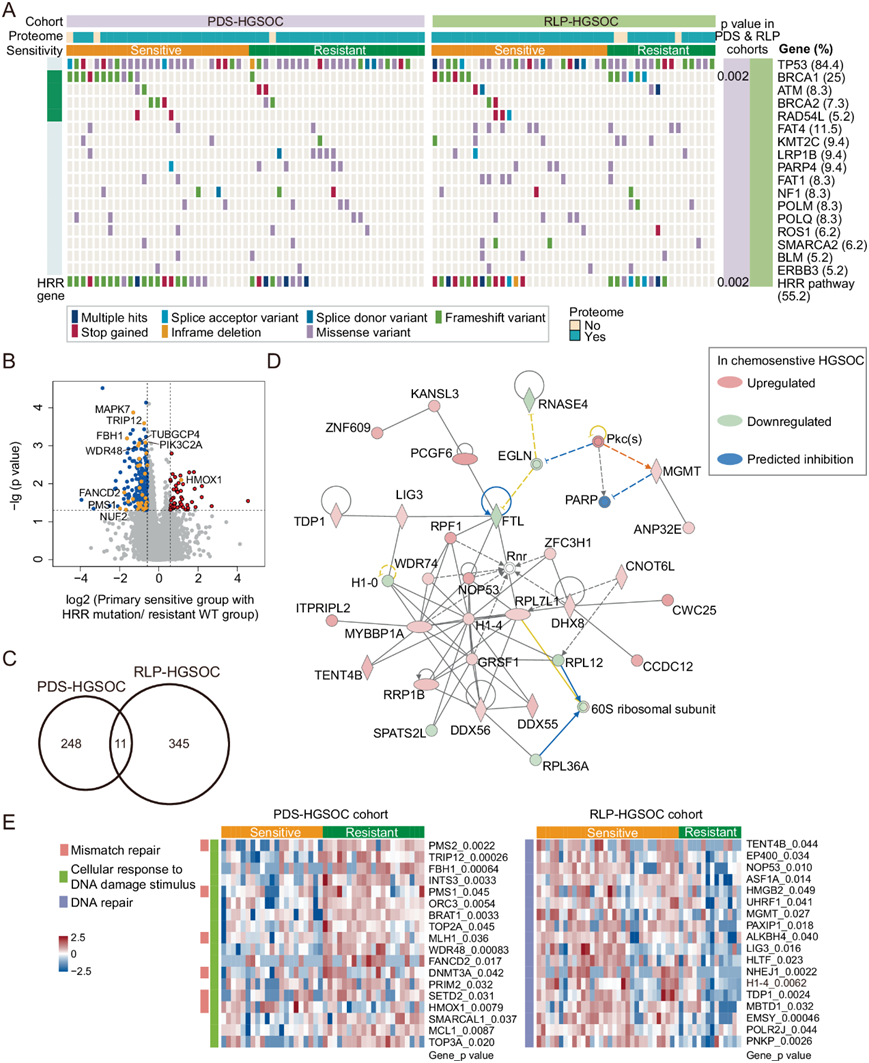
图6. 基因组测序和蛋白质组的整合分析。
(A) 53 名原发性 HGSOC(PDS-HGSOC)患者和 43 名复发性 HGSOC(RLP-HGSOC)患者的 295 个基因组的遗传变异。(B)具有 HRR 突变的化学敏感 HGSOC 患者与没有任何 HRR 突变的化学耐药患者的蛋白质组比较。(C) 原发性和复发性 HGSOC 队列之间化学耐药相关 DEP 的重叠关系。(D) 复发性 HGSOC 队列化学耐药组和化学敏感组之间使用 DEP 的最富集网络。(E) 原发性和复发性患者化学敏感组和化学耐药组之间 DNA 损伤修复相关 DEP 的表达。
+ + + + + + + + + + +
结 论
本项研究对来自 813 名具有不同组织类型和治疗方案的患者的卵巢组织和血浆样本进行了全面的蛋白质组学分析,在组织样本中鉴定出与肿瘤恶性程度相关的八种蛋白质,进一步验证了这些蛋白质是血浆中潜在的循环生物标志物。针对 12 种组织蛋白和 7 种血液蛋白开发了靶向蛋白质组学检测方法,并构建了机器学习模型来预测一年的复发率,并在独立队列中进行了验证。这些发现有助于了解 EOC 的发病机制,并为早期检测和监测疾病提供了潜在的生物标志物。
+ + + + +



 English
English


