文献解读|Cell Stem Cell(19.):灵长类星形胶质细胞的分子特征揭示了促进人类大脑进化的途径和调节变化
✦ +
+
论文ID
原名:Molecular signature of primate astrocytes reveals pathways and regulatory changes contributing to human brain evolution
译名:灵长类星形胶质细胞的分子特征揭示了促进人类大脑进化的途径和调节变化
期刊:Cell Stem Cell
影响因子:19.8
发表时间:2025.02.04
DOI号:10.1016/j.stem.2024.12.011
背 景
在动物进化过程中,星形胶质细胞发生了巨大的变化。与啮齿动物相比,灵长类动物的星形胶质细胞的尺寸和复杂性显著增加;与迄今为止研究的猴子和猿类相比,人类的星形胶质细胞的尺寸和复杂性也显著增加。对成年人类和非人类灵长类动物(NHP) 死后大脑的单细胞转录组分析表明,与神经元相比,星形胶质细胞的转录组重塑更为显著。然而,人类和NHP星形胶质细胞中基因表达变化与星形胶质细胞形态和功能的进化调控之间的潜在联系尚不清楚。同样,灵长类动物胎儿星形胶质细胞转录组的变化也尚未确定。
实验设计
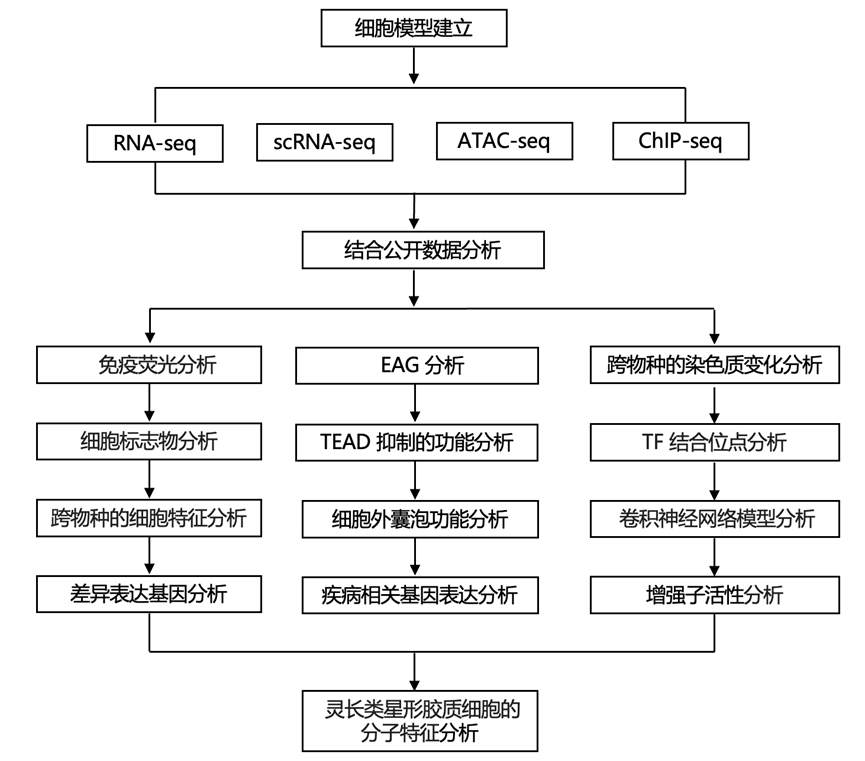
结 果
01
星形胶质细胞进化的显著特征分析
研究团队利用完善的程序获取皮质神经祖细胞 (iNP) 和广泛使用的方法从一组灵长类动物 iPS 细胞系中生成星形胶质细胞 (iAstrocytes)(图1 A)。iAstrocytes 表达典型的星形胶质细胞标志物(图 1 B-C),包括钙结合蛋白 S100B、神经胶质纤维酸性蛋白 (GFAP) 和兴奋性氨基酸转运蛋白/谷氨酸转运蛋白溶质载体家族 1 成员 3 (EAAT1/SLC1A3)。同样,iAstrocytes 从细胞外环境吸收谷氨酸(图 1 D),并通过产生钙 (Ca2+) 信号对细胞外 ATP 作出反应。在大脑中,星形胶质细胞会对各种线索作出反应并分泌促炎因子,这可能会导致神经元死亡。为了确保iAstrocytes的稳定状态,他们评估了促炎因子的产生。iAstrocytes 不会产生白细胞介素(IL-6 和 IL-8)或趋化因子(CCL2、CXCL1)。然而,当暴露于肿瘤坏死因子 (TNF)、白细胞介素 1-alpha (IL-1α) 和补体分子 C1q 的混合物时,它们会这样做,这些混合物通常用于在体外引发星形胶质细胞活化。
通过转录组分析 (RNA-seq) 确定了全面的星形胶质细胞标志物 (GO:0048708) 的表达。他们采用了完善的计算策略,并将双端RNA-seq 读段与基于最近的人类、黑猩猩和恒河猴组装构建的共识基因组进行比对。所有灵长类动物 iAstrocyte 的星形胶质细胞基因表达模式与体外培养的人类原代胎儿星形胶质细胞以及先前从一组不同的雌性 iPS 细胞系中获得的细胞非常相似(图 1 C)。此外,转录组分析确保了 iAstrocyte 制备的可重复性和稳健性。所有 iAstrocyte 都显示出分化评分 (DS),表明胎儿星形胶质细胞身份,证明人类、黑猩猩和恒河猴 iAstrocyte 的分化状态相当(图 1 E)。这些数据验证了 iNP 细胞已成功转化为功能性胎儿星形胶质细胞。
在成人大脑中,人类星形胶质细胞比啮齿动物和恒河猴的细胞具有更复杂的形态和更大的尺寸。他们发现人类 iAstrocytes 的细胞表面积明显大于黑猩猩和恒河猴的细胞(图 1 F-G)。相反,他们发现三个物种中巢蛋白阳性 iNP 细胞的表面积没有显著差异。值得注意的是,除了表面积较大之外,人类 iAstrocytes 还比 NHP 细胞拥有更多的初级分支(图 1 F-I)。人类 iAstrocytes 的尺寸和复杂性增加反映了体内现象,其中人类星形胶质细胞比小鼠和恒河猴星形胶质细胞大。同样,这些数据表明进化过程中增强的星形胶质细胞复杂性的遗传编码。因此,iAstrocytes 可用作体外模型,用于探究星形胶质细胞生物学进化变化背后的调控机制。
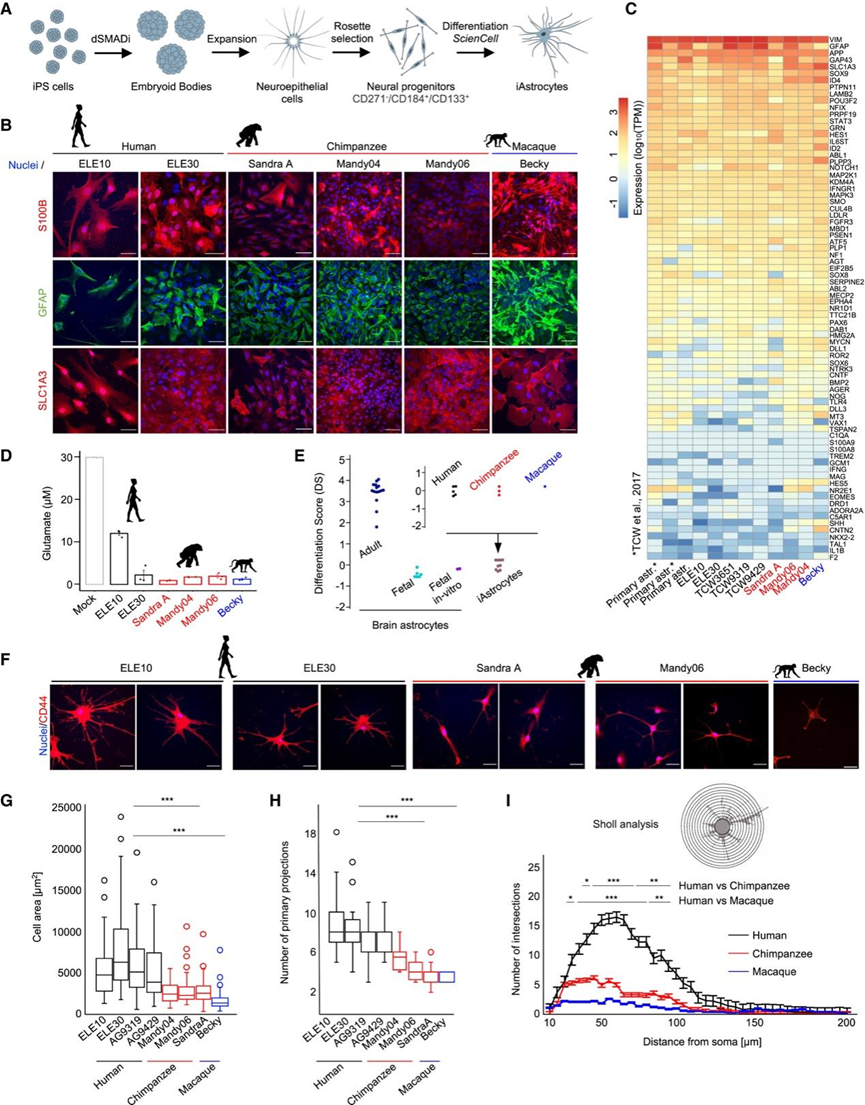
图1. 灵长类动物 iAstrocytes 重现了胎儿大脑星形胶质细胞的进化特征。
(A)实验设计。(B) 表达 S100B(红色)、GFAP(绿色)、SLC1A3(红色)的 iAstrocytes 代表性免疫荧光图像。(C) 体外培养的人胎儿脑衍生星形胶质细胞和 iAstrocytes 中的星形胶质细胞标志物的 RNA-seq(TPM,每百万转录本)表达水平热图。(D) 体外培养的人胎儿脑衍生星形胶质细胞和 iAstrocytes 中的星形胶质细胞标志物的 RNA-seq(TPM,每百万转录本)表达水平热图。(E) 显示不同细胞系和物种的细胞成熟程度相似。(F) 人类 iAstrocytes 的形态比 NHP 同类细胞更复杂。(G) 来自不同供体的 iAstrocytes 的总细胞面积。(H) 来自不同供体的 iAstrocytes 的总细胞面积。(I) iAstrocytes 的 Sholl 分析。
02
星形胶质细胞进化过程中基因表达的变化
在人与恒河猴之间的差异表达基因(DEG)明显多于人与黑猩猩之间的DEG(图 2 A)。他们对两次比较中受影响的基因的转录变化进行了大致一致的评分,这与之前的报告一致。绝大多数DEG 在 iAstrocytes 和纯化的星形胶质细胞中均有强烈表达(图 2 B)。正如预期的那样,他们观察到了转录调控,而不是进化过程中基因表达的剧烈变化。蛋白质编码基因的表达水平变化小于非编码基因座,这与蛋白质编码基因表达的更强的进化约束相一致。他们在将人类与每个 NHP iAstrocytes 进行比较时,确定了 493 个上调和 373 个下调的进化影响基因 (EAG)(图 2 C)。
目前尚不清楚哪些基因在进化过程中调节星形胶质细胞大小和复杂性的增加。他们发现了几个与细胞骨架调节相关的上调 EAG 的例子。值得注意的是,TEA 结构域转录因子 (TF) 3 (TEAD3) 的表达是在人类 iAstrocytes 中进化获得的,TEA 结构域转录因子 (TF) 3 (TEAD3) 是控制细胞和器官大小的 Hippo 通路的直接靶标之一(图 2 D)。
对五种灵长类动物颞中回 (MTG) 星形胶质细胞进行的单细胞转录组分析(scRNA-seq)表明,与 NHP 星形胶质细胞相比,人类的TEAD3转录激活(图 2 E)。因此,人类星形胶质细胞中TEAD3表达的上调在成人大脑中得以维持。此外,他们和已发表的成人大脑皮层的转录组数据均表明,人类样本的TEAD3基因活性明显高于 NHP 皮层 (图2F-G)。
目前尚不清楚 Hippo 通路是否与细胞大小的进化变化有关。虽然TEAD 的抑制对所有 iAstrocyte 系中的细胞存活率没有影响,但 TEAD 的抑制导致人类 iAstrocyte 的细胞大小(约 40%)和主要分支数量显著减少(图2H-J)。接下来,为了测试TEAD3的转录上调是否有助于人类谱系中星形胶质细胞形态的扩张,他们将 iAstrocyte 暴露于 DC-TEAD3in03(一种 TEAD3 活性的选择性抑制剂)。阻断 TEAD3 导致人类 iAstrocyte 的面积和复杂性降低(图2J-L)。令人惊讶的是,NHP iAstrocytes 对 TEAD3 抑制具有免疫力,并且在抑制剂处理后形态尺寸没有发生显著变化(图 2 M)。因此,TEAD3 有助于调节人类 iAstrocyte 的形态。由于 TEAD3 的蛋白质序列在人类和 NHP 之间高度保守,他们推测 TEAD3 的转录上调可能有助于增加星形胶质细胞在进化中的复杂性。
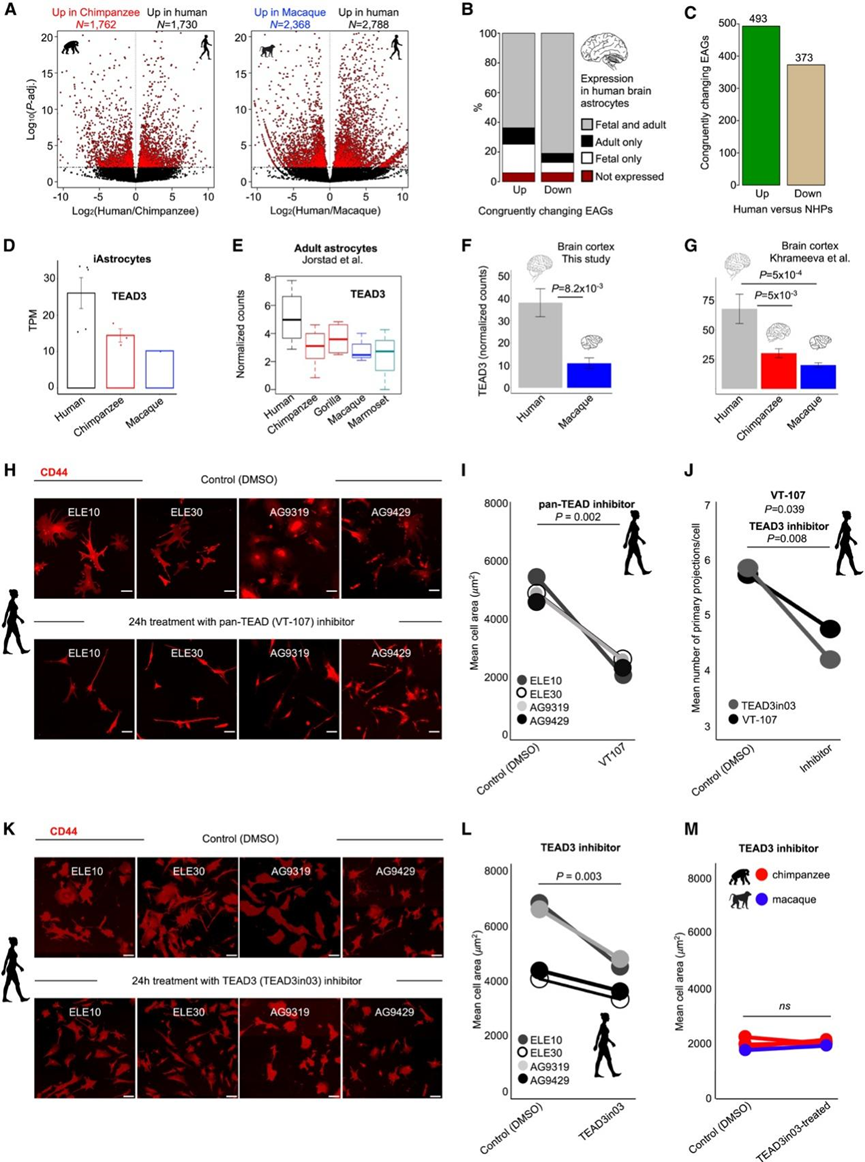
图2. 灵长类星形胶质细胞进化过程中基因表达的进化变化。
(A) 差异表达基因 (DEG) 的火山图。(B) 在急性纯化的胎儿和成人脑星形胶质细胞中表达中确定的基因座。(C) 人类与 NHP iAstrocyte 中鉴定的 EAG 的最终数量。(D) TEAD3 在灵长类动物星形胶质细胞中的表达。(E) TEAD3 在人类、黑猩猩、大猩猩、猕猴和狨猴成年颞中回皮质大脑星形胶质细胞中的表达。(F) TEAD3 在人类、黑猩猩、大猩猩、猕猴和狨猴成年颞中回皮质大脑星形胶质细胞中的表达。(G) TEAD3 在人类、黑猩猩和猕猴脑皮质组织中的表达。(H) TEAD3 在人类、黑猩猩和猕猴脑皮质组织中的表达。(I) 泛 TEAD 抑制对人类 iAstrocyte 形态的影响。(J) 泛 TEAD 抑制对人类 iAstrocyte 形态的影响。(K) 使用 TEAD3in03进行特定的 TEAD3 抑制会导致人类 iAstrocyte 形态发生变化。(L) TEAD3 抑制会减少人类 iAstrocyte 面积。(M) TEAD3 抑制对 NHP iAstrocyte 形态没有影响。
03
细胞外囊泡(EV)相关基因表达的进化增益
他们发现在上调的 EAG 中与代谢相关的基因显著过度表达,包括线粒体核糖体蛋白 S7 (MRPS7)、线粒体编码的 ATP 合酶 6/8,以及与脂质信号传导有关的因子(磷脂酶 C delta 3— PLCD3、磷脂酶 D 家族成员 3— PLD3和磷脂剪切酶 3—PLSCR3),这与人类大脑代谢消耗的增加相一致。因此,胎儿星形胶质细胞的进化涉及调节能量产生和消耗的基因表达的增加。
令人惊讶的是,493 个上调的 EAG 中有 49 个(10%)与细胞外外泌体(ExEg)有关(图 3 A),例如 EPH 受体 B4 (EPHB4)(神经元投射的正调节因子),以及血小板反应蛋白4(THBS4)。与 NHP 成体 MTG 星形胶质细胞相比,EPHB4在人类中发生激活。血小板反应蛋白是调节突触形成的分泌性糖蛋白,而 THBS4 是该家族中相对了解较少的成员。先前的报告显示,与黑猩猩和猕猴大脑相比,人类大脑中 THBS4 蛋白的表达增加。
ExEg 类别中的基因包括与外泌体生物学有关的基因座——外泌体是影响神经系统稳态和病理的细胞外囊泡 (EV)。为了确定三种灵长类动物的 iAstrocyte 之间的外泌体分泌是否存在差异,他们从 iAstrocyte 培养基中分离出分泌的颗粒,并使用纳米粒子跟踪分析( NTA) 对其进行了表征。这些颗粒对外脂膜 (CellMask) 和四跨膜蛋白(CD63、CD9、CD81)呈阳性,证实了它们的身份。人类 iAstrocyte 比 NHP iAstrocyte 产生的 EV 多(图3B-D)。因此,人类星形胶质细胞的进化表现为 EV 产量的增强。
为了更好地了解增强的 EV 产生在进化中的可能功能,他们将恒河猴 iAstrocyte 暴露于人类 iAstrocyte EV,恒河猴 iAstrocyte 的表面积增加了约 30%(图3E-F),并且恒河猴细胞呈现出清晰突起的倾向性增加(图3G-H)。为了确保这些形态变化不是由 EV 处理后假定的反应状态诱导引起的,他们评估了用人类 iAstrocyte EV处理的恒河猴 iAstrocyte 中的炎性细胞因子(IL-6、IL-8)和趋化因子(CCL2、CXCL10)的水平。人类 EV的给药不会改变这些药物的产生。总之,EV的剂量,以及它们携带的物质,都会影响星形胶质细胞的形态。因此,细胞外环境组成的变化可能是大脑进化的一个重要方面,并且可能对细胞形态的调节有影响。
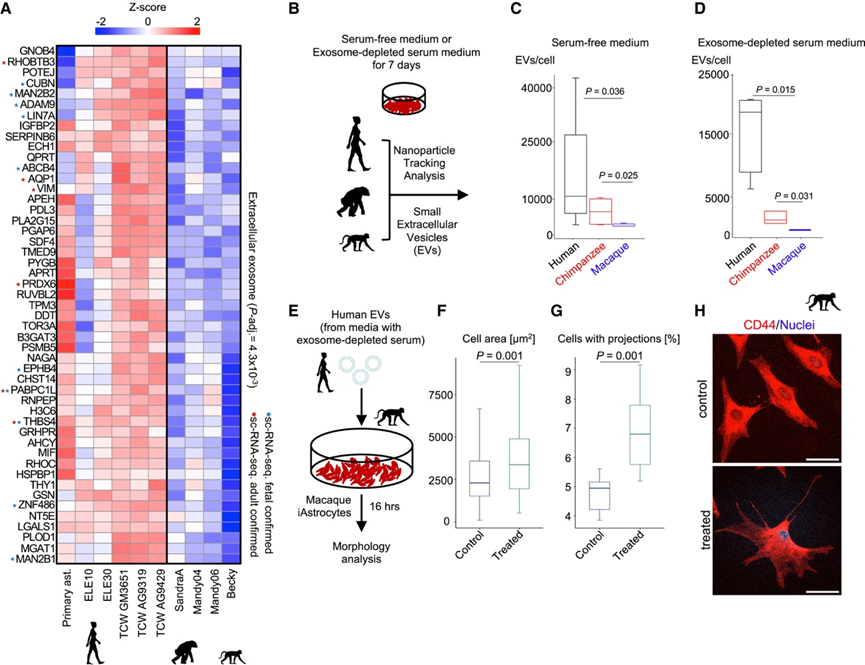
图3. 细胞外囊泡相关基因的进化表达增益。
(A) 与 iAstrocytes 和胎儿脑星形胶质细胞中的细胞外泌体相关的 EAG 缩放表达热图。(B) 分析 iAstrocytes 产生的细胞外囊泡 (EV) 的实验策略。(C) 用 NTA 量化每个 iAstrocyte 中的 EV 数量。(D) 在含有 2% 外泌体耗尽血清的培养基中培养的每个 iAstrocyte 中的 EV 数量。(E) 使用人类 EVs 治疗猕猴 iAstrocyte 的实验设计。(F) 两次重复中,猕猴 iAstrocyte 暴露于来自两种不同 iAstrocyte 系的人类 EV 后的细胞面积。(G) 猕猴 iAstrocyte 细胞在暴露于人类 EV后出现初级突起。(H) 用人类 EV 处理的 CD44 阳性恒河猴 iAstrocyte 的示例性免疫荧光染色。
04
与神经系统疾病相关的基因在人类星形胶质细胞中下调
患上特定神经系统疾病的倾向可能是大脑进化的必然结果。因此,他们试图确定星形胶质细胞基因表达的进化变化与人类疾病之间的关系。他们整合了最新的脑部疾病相关基因数据库 (BrainBase)。EAG 与总共 23 种疾病有关,包括阿尔茨海默病、自闭症谱系障碍和多发性硬化症(图 4 A)。观察到的与疾病相关的 EAG 总数与预期值相符(图4A)。然而,在与疾病相关的 EAG 中,下调基因的表达量增加了 2.5 倍。他们使用 DisGeNET 和 PsyGeNET 数据库证实了这一发现。因此,在人类星形胶质细胞进化过程中,与神经系统疾病相关的基因下调的频率高于上调的频率。
值得注意的是,BrainBase 中所有与智力障碍 (ID) 相关的 EAG 都属于转录下调组(图 4 A)。虽然在人类细胞中只有 1 个 ID 相关基因发生激活,但 36 个 ID 相关基因位点在人类 iAstrocytes 中下调的 EAG 之中(图 4B)。为了测试 ID 与基因表达的进化改变之间的联系是否在成人大脑样本中类似,他们纳入了15 个来自人类和 NHP 额叶皮质的 RNA-seq 文库。与 NHP 样本相比,成年人脑中 36 个 ID 相关基因总体下调,而人类样本中与细胞外外泌体相关的基因座总体发生激活(图 4 C)。同样,对人类和恒河猴成年大脑皮质灰质的免疫印迹分析显示,人类样本中两个选定的 ID 相关基因 CTCF 和 KMT2E 的蛋白质水平显著下降,进一步证实了RNA-seq结果,并表明人脑中这些 ID 相关因子普遍下调(图 4 D)。虽然来自皮质组织的结果显示了与大脑中 CTCF 和 KMT2E 表达调节相关的广泛影响,但还需要进一步测试来解决星形胶质细胞中 CTCF 和 KMT2E 表达的细胞类型特异性调节。
他们接下来探讨了ID相关基因的进化下调在成年颞中回(MTG)星形胶质细胞中是否也具有显著性。MTG是一个涉及多感官输入整合和语言理解的皮层区域。此外,他们还研究了前额叶背外侧皮层(DLPF)和额叶皮层的星形胶质细胞,其中DLPF对高阶认知能力至关重要(图4E)。在考虑至少由两个独立数据集验证的组合列表时,与NHP(非人灵长类)成年大脑星形胶质细胞相比,ID相关基因在人类中更频繁地下调而非激活(图4E)。他们发现 10 个上调基因和 23 个下调基因与 ID 相关,表明在人类表达水平低于 NHP 星形胶质细胞的 EAG 列表中,ID 相关基因位点的过度表达率为 3.4 倍。
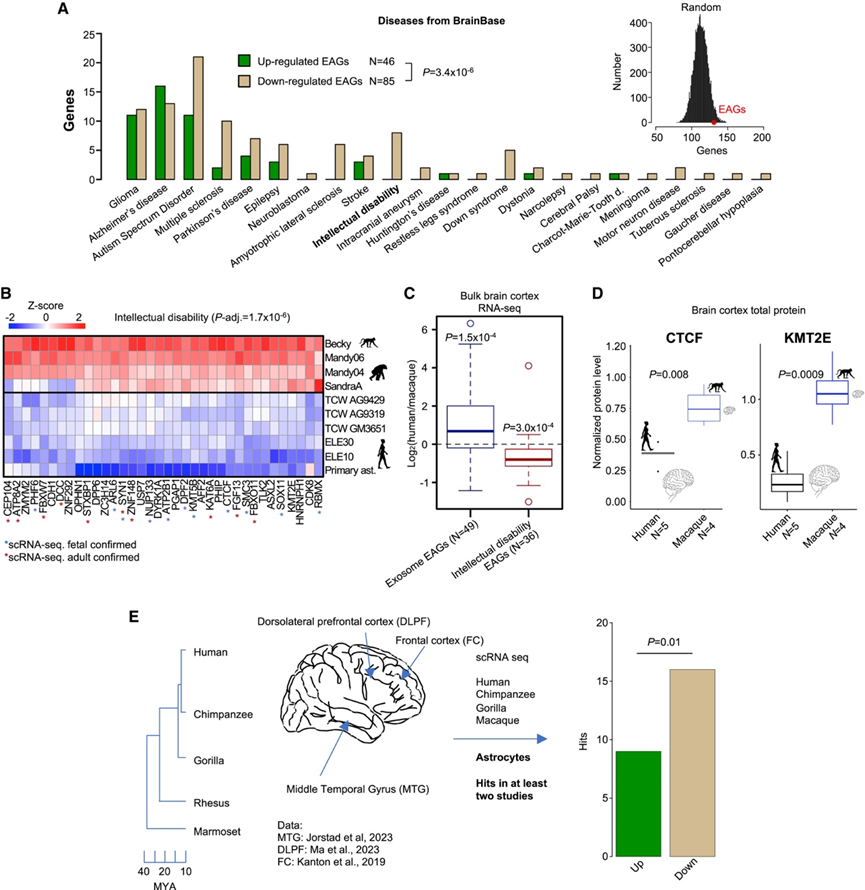
图4. 与神经系统疾病相关的基因在人类大脑进化过程中经常发生转录下调。
(A) 下调的 EAG 比激活的 EAG 与脑部疾病的关联性更高。(B) iAstrocytes 和胎儿星形胶质细胞中与 ID 相关的下调 EAG 的表达热图。(C) 与猕猴大脑皮层相比,外泌体相关基因在人类中表现出普遍的转录上调。(D) 与猕猴大脑皮层组织相比,人类 ID 相关基因 CTCF 和 KMT2E(分别为左和右)的蛋白质水平降低。(E) 在人类成人星形胶质细胞中,ID 相关基因下调的频率高于上调。
05
星形胶质细胞中的转录变化随着增强子元素数量的净增加而变化
转录调控系统的变异可能驱动新性状的获得,分析不同物种染色质可及性的差异有助于揭示进化过程中基因表达改变的机制。他们采用了基于染色质可及性测序(ATAC-seq)和染色质免疫沉淀-测序(ChIP-seq)的方法来确定顺式调控元件(CRE)开放性和活性的进化变化(活性启动子:H3K4me3+ /H3K27ac+;活性增强子:H3K4me3− /H3K27ac+)。ATAC-seq 数据的主成分分析 (PCA) 揭示了不同物种的调控组紧密聚集,验证了模拟灵长类星形胶质细胞进化过程中染色质变化的能力(图 5 A)。正如预期的那样,人类与黑猩猩以及人类与恒河猴 iAstrocytes 之间基因间 ATAC-seq 区域开放性的变化与基因活性变化的相关性较低。
他们确定了差异开放区域(DOR)(图 5 B),并观察到灵长类动物进化过程中 DOR 处染色质开放性的逐步变化。与远端调控元件在引发基因表达进化变化中的重要作用一致,大多数DOR 位于启动子之外,他们确定了 9343个人类和 2351个NHP 特异性增强子。在人类谱系中激活的 9343 个增强子中,只有 1443 个(15%)可与上调的 EAG 相关联(“链接”组)图 5C-D),而几乎两倍以上的元件(2681,29%)位于灵长类动物 iAstrocytes 中没有差异基因表达的区域(“未链接”组)(图 5C-D)。链接和未链接的增强子均位于任何注释启动子的 500 kb 范围内。与基因激活相关的元素比与人类谱系中的差异基因表达无关的元素具有稍微更多的开放性和中等水平的 H3K27ac。然而,这些差异相对较小,因此不能解释两组元素之间观察到的功能差异。事实上,在人类细胞中,类似比例的链接和未链接元素与 H3K27ac 峰重叠,并且两组 NHP iAstrocytes 中都基本缺乏 H3K27ac。因此,除了 H3K27ac 水平之外,其他因素也影响了链接和未链接增强子之间的活性差异。
为了解决单个 TF 对关联和非关联增强子活性调节的贡献,他们比较了位于两类增强子中的 TF 识别位点的跨物种改变频率。虽然对于绝大多数因子,两组增强子的TF结合位点(TFBS)序列变化频率相似(图 5 F),但有一组独特的 TF 在嵌入与上调 EAG 关联的增强子中时在进化中变化更频繁(蓝色)(图 5 F)。考虑 TAD 注释而不是基因组距离的类似分析证实了这些结果。令人惊讶的是,在与进化基因上调相关的增强子中,89 个变化更频繁的基序中有 77 个(图 5 F)对应于最近描述的Stripe(条纹) TF 的同源位点,包括 MAZ、SP1-4、PATZ1(图 5 F)。这些广泛表达的 TF 有利于其他转录调节因子的结合,并起到确保组织特异性TF与染色质的正确相互作用动力学的作用。在与上调的 EAG 相关的 1443 个增强子中,超过 77%(1118)与本次比较中确定的至少一个条纹 TF 的基序的进化改变相交。条纹 TF 识别的基序的进化变化大体上导致人类基因组中TFBS的增加(图 5G)。与此观察结果一致,比较人类和黑猩猩版本的条纹 TF 同源基序,在与上调 EAG 相关的人类特异性增强子中,他们发现人类谱系中的条纹TF显著增加。因此,条纹 TF 同源位点 DNA 序列的进化变化导致这些 TF 在人类特异性增强子处的结合增加。
为了解决以条纹 TF 基序变化为特征的增强子的贡献,他们分析了它们与 EAG 的关系频率。值得注意的是,几乎所有上调的 EAG 都可能与至少一个显示条纹 TFBS 变化的增强子有关(图5H),这进一步支持了条纹 TFBS 的变化导致增强子活性的物种间差异的观点。总之,条纹 TF 的 DNA 基序变化与进化中与转录激活相关的增强子分离。
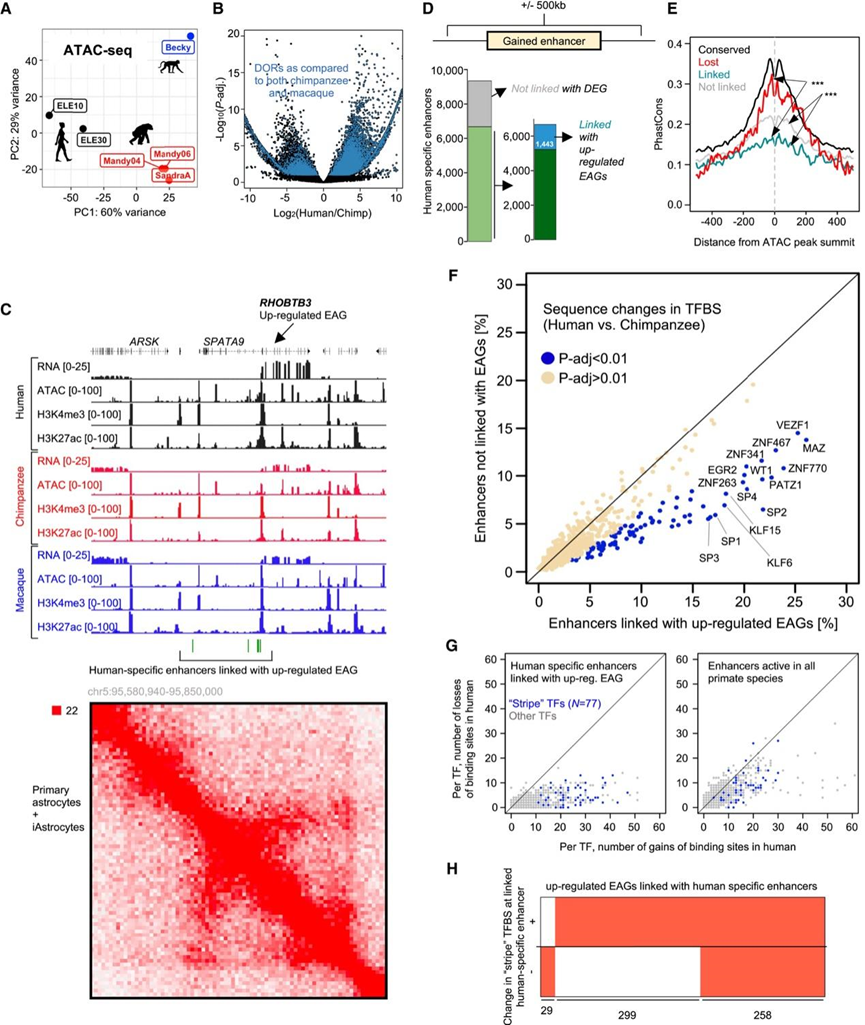
图5. 与基因激活相关的增强子处Stripe转录因子结合位点的增加。
(A) 主成分分析 (PCA) 揭示了人类、黑猩猩和恒河猴 iAstrocyte 染色质开放性图谱按物种的聚类情况。(B) 灵长类动物 iAstrocytes 的差异开放性。(C) 编码上调 EAG RHOBTB3 基因座的基因表达、染色质活性和结构。(D) 人类 iAstrocytes 中获得的大多数增强子可以与进化过程中表达变化的基因相关联。(E) 在常见、丢失和获得的 ATAC 峰顶周围的基因组间隔中的 PhastCons 得分。(F) 在预测的 TF 结合位点 (TFBS) 中发生变化的元素的每个 TF 频率在人类特异性链接和不链接增强子之间有所不同。(G) 连接增强子的 DNA 序列的进化变化导致 TFBS 的增加而不是减少。(H) 大多数上调的 EAG 位于人类谱系中获得的增强子的 500 kb 范围内,该增强子的特点是 (F) 中鉴定的 77 个TF 之一的基序发生了进化变化。
06
深度学习模拟增强子序列进化变化的功能影响
最近,深度学习方法已用于预测 DNA 序列的进化变化对增强子活性的贡献。因此,为了评估77种条纹 TF 识别的基序的人类-黑猩猩序列变化对增强子活性的影响,他们采用了基于 Basset 架构的卷积神经网络 (CNN)。他们使用人类 iAstrocyte 调节组对其进行了训练,这使其能够达到 90% 的预测能力(图 6 A)。正如预期的那样,获得开放性的人类增强子序列比黑猩猩增强子序列产生更高的 CNN 响应。当增强子失去开放性时,情况正好相反(图 6 B),这突出了CNN 检测序列进化差异对增强子活性影响的能力。至关重要的是,恢复与基因上调相关的增强子中黑猩猩版本的条纹 TF 基序会导致这些元素的 CNN 预测活性显著丧失(图 6B)。这些数据与以下观点相一致:条纹 TF 结合位点的进化增益使增强子更加活跃(图 6C)。
总之,与基因表达增益相关的增强子具有广泛激活条纹TF识别的基序的特征,表明这些广泛表达的因子在塑造增强子活性并从而在进化中影响基因表达方面发挥着潜在作用(图6C)。
图6. 卷积神经网络预测转录因子在增强子转录激活潜能进化增益中的作用。
(A) 卷积神经网络(CNN)对来自 36 名患者的胶质瘤样本中的 16 万个调控序列进行了训练。(B) 人类 TF 结合的基序赋予所连接增强子的调节元件潜能,高于黑猩猩 TF 识别序列。(C) Stripe TF 结合位点的出现有助于增强子的转录激活潜力的进化增益。
+ + + + + + + + + + +
结 论
本研究获得了人类、黑猩猩和猕猴诱导多能干细胞衍生的iAstrocytes。人类 iAstrocytes 比非人类灵长类动物 iAstrocytes 更大、更复杂。本研究确定了导致人类星形胶质细胞增加的新位点。与长距离细胞间信号传导有关的基因和通路在人类 iAstrocytes 中激活,并参与控制 iAstrocyte 的复杂性。人类 iAstrocytes 中下调的基因通常与神经系统疾病有关,在成人大脑样本中下调的基因减少。通过调控组分析和机器学习,本研究发现增强子的功能激活与以前未受到重视的“条纹”转录因子结合位点的普遍增加相吻合。总之,本研究揭示了灵长类星形胶质细胞进化的转录组特征和驱动获得增强子调控潜力的机制。
+ + + + +



 English
English


