文献解读|Nature(48.5):肥胖和减肥中脂肪微环境的选择性重塑
✦ +
+
论文ID
原名:Selective remodelling of the adipose niche in obesity and weight loss
译名:肥胖和减肥中脂肪微环境的选择性重塑
期刊:Nature
影响因子:48.5
发表时间:2025.07.09
DOI号:10.1038/s41586-025-09233-2
背 景
肥胖影响着全球超过 10 亿人,脂肪组织 (AT)质量增加是肥胖的典型特征,也是 2 型糖尿病、心血管疾病、某些癌症和早期死亡的主要危险因素之一。通过减肥 (WL) 减少 AT 质量可显著改善肥胖引起的合并症,并可降低死亡率,了解这些截然不同的临床效应背后的生物学原理,对于改善治疗方案和健康结果至关重要。
实验设计
结 果
01
绘制 AT 重塑动态图
为了更好地了解肥胖 AT 功能障碍及其在 WL 后的逆转,研究团队对 WL 手术前后极度肥胖男性和女性和健康瘦对照者的约 100000 个细胞进行了单细胞核转录组分析(snRNA-seq)(图1a)。WL 显著改善了代谢参数,但是没有达到基线(图1b)。他们专注于腹部皮下 AT,因为它对中心肥胖的贡献以及相对于其他皮下 AT 库的不良代谢影响。本研究的结果与来自已发表的最大的人类皮下脂肪图谱的另外 50,000 个细胞(细胞核)整合,以改进细胞注释,空间转录组学分析能够在健康和功能失调的 AT 的组织层次结构中定位和情境化细胞表型(图1a)。这捕获了人类体重增加和 WL 中皮下 AT 生态位的细胞、结构和功能动态的丰富表示。组织范围的聚类和成分分析表明,肥胖 AT 中存在广泛的免疫细胞(主要是巨噬细胞,也有淋巴细胞)浸润(图1c-e)。肥胖 AT 还表现出成熟脂肪细胞的缺陷,表明细胞死亡增加和/或无法补充成熟脂肪细胞,WL 减轻了这些通常有害的影响。
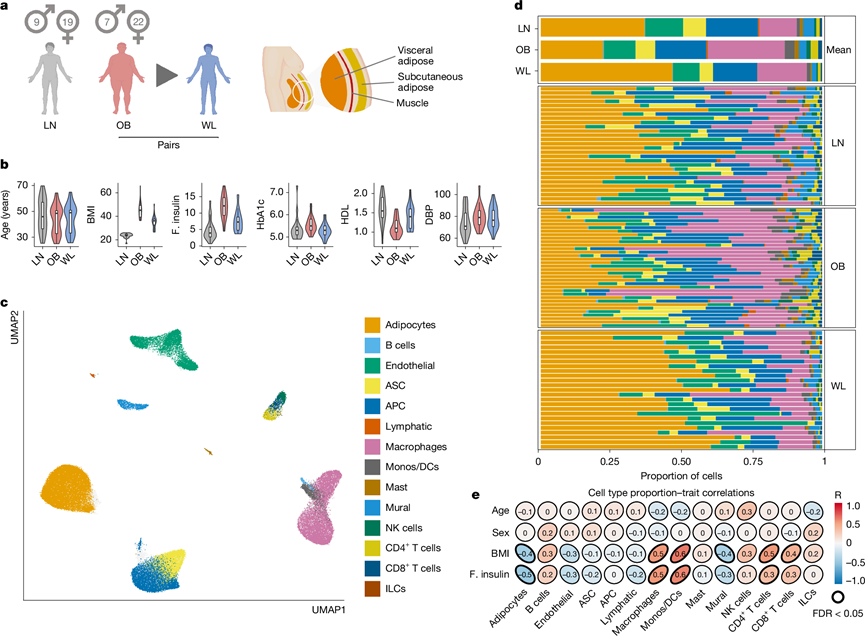
图1. 瘦弱、肥胖和 WL 状态下人类 AT 的单细胞图谱。
(a) 主要研究队列的图形表示(左)和AT解剖位置(右)。(b) 主要队列的临床特征。(c) 145452 个人类 AT 细胞。(d) 合并队列中的细胞类型比例。(e) 细胞类型与临床特征之间的相关性。
02
持续的巨噬细胞活化
免疫细胞浸润是肥胖 AT的一个特征,但 WL 对炎症重塑的影响尚不清楚,有研究表明其具有相反的抗炎和促炎作用。他们将髓系细胞聚类为 AT 巨噬细胞、单核细胞和树突状细胞(MYE1–10)的异质亚类(图2a)。
AT 巨噬细胞的增加(平均从 14% 增加到 31%)主要包括表达溶酶体、脂质代谢和代谢活化标志物(CD9、TREM2、LPL和LIPA)的脂质相关巨噬细胞(LAM)(成熟 MYE2 和未成熟 MYE3)(图2a-b)。表达VCAN 的经典单核细胞(MYE5)也有所增加,表明从血液中进行组成性运输。可视化和标记基因模式支持从单核细胞到未成熟再到成熟 LAM 的分化连续体(图2a)。比例分析显示,表达稳态标志物(LYVE1、FOLR2和MRC1)的组织驻留巨噬细胞(MYE1 和 TRM)比例较低。邻域图证实,这代表了相对(而非绝对)的TRM减少。增殖性巨噬细胞表达MCP-1(CCL2)、TRM和LAM标记物,支持人类肥胖症中两个细胞群的低水平MCP-1依赖性扩增。
为了客观地理解巨噬细胞代谢重编程,他们利用基因表达系统地模拟代谢通量。这揭示了肥胖巨噬细胞独有的整体激活状态,涵盖已知和未曾认识的代谢变化(图2e)。具体而言,他们发现向高糖酵解(促炎)、高呼吸(抗炎)特征的转变与肥胖小鼠的细胞外通量分析一致,戊糖磷酸途径和 TCA 循环的相应变化,胆固醇、脂质和脂肪酸合成以及氧化途径的普遍激活;细胞运输的强制性上调(图2e-f)。以脂肪酸为例,通量建模揭示了脂肪酸去饱和(FADS1和SCD)和线粒体β-氧化的显著激活(图2e-f),这与缓冲和利用潜在有毒的微环境脂肪酸获取能量相一致。整体生物活性在LAM中最高,但不限于LAM,这表明肥胖AT中不同类型的髓系细胞经历了广泛的代谢启动。实验能量分析证实了LAM的基础活性和糖酵解能力高于TRM(图2g)。
WL 导致各个亚类的髓系细胞数量显著减少(平均从 31% 减少到 18%)。比例和密度分析表明,肥胖和 WL 之间的髓系细胞分数没有差异(图2a),原位验证了这一点。然而,WL 确实使 LAM 向炎症较少的亚型转变(图2c),这表明虽然 WL 范围很广,但肥胖诱导的髓系细胞状态仍然存在。代谢通量分析证实,整体代谢活化并没有随着 WL 完全逆转(图2e),但 WL 确实显著降低了脂肪酸合成和氧化的某些方面(主要是去饱和酶和酰基辅酶 A 合成酶)(图2e-f),在时间上将这些途径与微环境脂质可用性联系起来。相比之下,糖酵解、呼吸能力和戊糖磷酸途径通量增加(图2e-f),这意味着随着脂肪酸水平降低,需要从其他来源获取能量。差异表达分析表明炎症小体、促炎细胞因子和趋化性基因普遍减少(图2f)。网络分析表明特定转录因子(TF)参与了 TRM 和 LAM 的规范化,并揭示了强化以下发现的模式:WL 改善了炎症和稳态网络,但没有改善 LAM 转录重编程(图2h)。总之,这些结果表明肥胖 AT 中存在复杂的激活反应,主要由单核细胞募集和持续的代谢重编程主导。
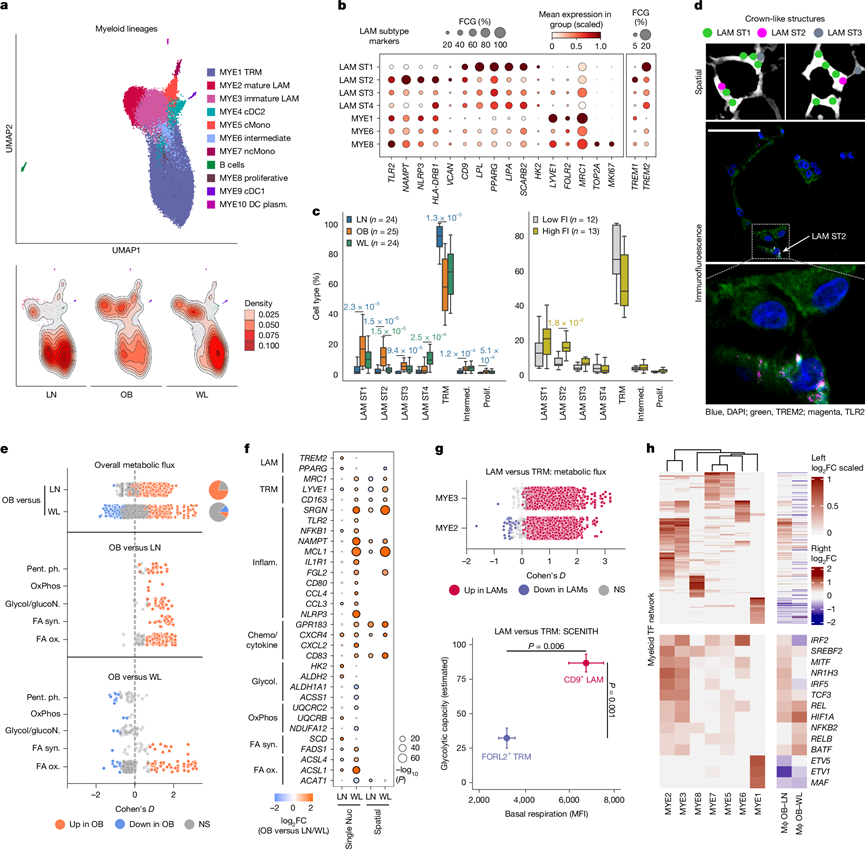
图2. 肥胖和 WL 中的免疫细胞浸润、激活和重编程。
(a)UMAP可视化。(b) 相对于主要巨噬细胞类别的 LAM 亚型 (ST) 标记基因。(c) LAM 亚型比例。(d) CellTypist 在 CLS 的空间数据集中预测了 LAM 亚型(上)。CLS 下的 TREM2(泛 LAM 标记)和 TLR2(ST2 标记)的免疫组织化学(下)。(e) 基于代谢通量的分析显示肥胖 (OB)与瘦 (LN)和 WL 巨噬细胞相比的整体(上)和通路特异性(下)代谢活化。(f) LN–OB 和 OB–WL 比较中巨噬细胞中差异表达的基因。(g) 基于 代谢通量的分析显示 LAM 与 TRM 相比的整体代谢活化。(h) 差异基因调控网络。
03
增强脂肪细胞代谢灵活性
成熟脂肪细胞在肥胖和 WL 中会发生深刻的表型变化,通过扩张和收缩来适应不断变化的能量需求。这如何影响它们的分子特征和不同的代谢功能尚不清楚。亚聚类显示 8 个成熟脂肪细胞亚群(AD1–AD8)(图3a),两种亚型表现出“应激”(AD3,JUN / NFKBIZ -hi)和“纤维化”(AD6,NOX4 / LOX -hi)特征。应激和纤维化的脂肪细胞随着肥胖而增加,表明组织微环境具有选择性脆弱性和致病性(图3b)。另一个具有脂质生物合成特征的亚群(AD5,PNPLA3/MOGAT1 -hi)在肥胖中意外减少(图3b)。WL导致应激脂肪细胞显著减少(平均从55%降至14%),纤维化数量减少,脂质生物合成细胞相对增加(图3b)。米色脂肪细胞稀少(AD8,GATM -hi,1%),且在不同条件下保持不变。
基于表达的代谢通量分析发现,与瘦脂肪细胞相比,肥胖脂肪细胞的脂肪酸和支链氨基酸 (BCAA) 分解存在显著缺陷,这与之前的研究结果相符,共同表明代谢活性受损(图3c)。相比之下,WL 导致脂肪细胞代谢通量显著增加(图3c),可能反映了负能量平衡。
意外的合成代谢活性促使他们研究甘油三酯动员(这是对热量限制的生理反应)是否会引发脂质循环(重复降解和再合成)。为了验证通量模型,他们比较了不同组之间重要底物途径的酶活性评分和途径限制酶(图3d-e)。肥胖脂肪细胞的代谢活性(评分和酶)持续较低,再次表明代谢缺乏灵活性。WL 系统地增加了相反的脂质生物合成和分解途径(图3d)。与此一致,他们发现连续循环步骤中典型酶发生了显著变化(图3e),包括DGAT2,它编码一种酰基转移酶,可催化甘油三酯合成并介导体外脂质循环。因为酶表达是催化能力的关键决定因素,这表明 WL 可能启动甘油三酯循环,这是一个高度生物能量过程,具有重要的脂质多样化、毒性脂肪酸猝灭代谢益处。WL 还逆转了 BCAA 分解代谢的缺陷(途径通量和典型酶)(图3c-e),其预测的后果是全身 BCAA 清除和改善胰岛素敏感性。脂质循环是PNPLA3 -hi 脂肪细胞(AD5)的特征,而应激(AD3)脂肪细胞的特点是代谢周转率较低(图3f)。WL 这些典型的分解代谢和以前未认识的合成代谢作用表明,底物动员参与细胞自主循环途径,这可能是代谢稳态广泛改善的基础。
为了了解哪些 TF 明确负责 WL 诱导的代谢活化,他们进行了仅限于代谢途径基因的网络分析,MLXILP和SREBF1在甘油三酯合成中排名很高。其他值得注意的发现是与氧化还原生物学和 BCAA 分解代谢相关的 TF。许多主要的 TF与人类代谢疾病全基因组关联研究 (GWAS) 基因座重叠,从而暗示特定 TF 及其各自的代谢途径与病理生理和治疗反应有因果关系。
差异表达分析发现,改变的生物力学是脂肪细胞应激和代谢功能障碍的潜在驱动因素,而 WL 可以缓解这种现象。具体而言,肥胖增加了关键细胞骨架张力、机械转导、细胞外基质 (ECM) 形成和纤维化基因(ACTA2、LOX、LOXL2和VGLL3)的表达,而 WL降低了这些基因的表达,他们在无偏通路分析和原位分析中验证了这些影响(图3g)。生物力学基因在应激和纤维化的 AD3 和 AD6 细胞中富集(图3g)。因此,他们评估了脂肪细胞肥大和机械应变是否会引发这些适应不良的变化,以及 WL 期间脂肪细胞收缩是否会逆转这些变化。如预期的那样,肥胖时脂肪细胞大小增加,而 WL 时脂肪细胞大小减小(图3h)。尽管样本内存在异质性,脂肪细胞大小与机械敏感、应激和纤维化基因表达呈正相关,与稳态基因表达呈负相关(图3g-h)。相关性水平表明,这可能是引发组织应激和纤维化的几个因素之一,也可能是退化周期中的驱动事件。
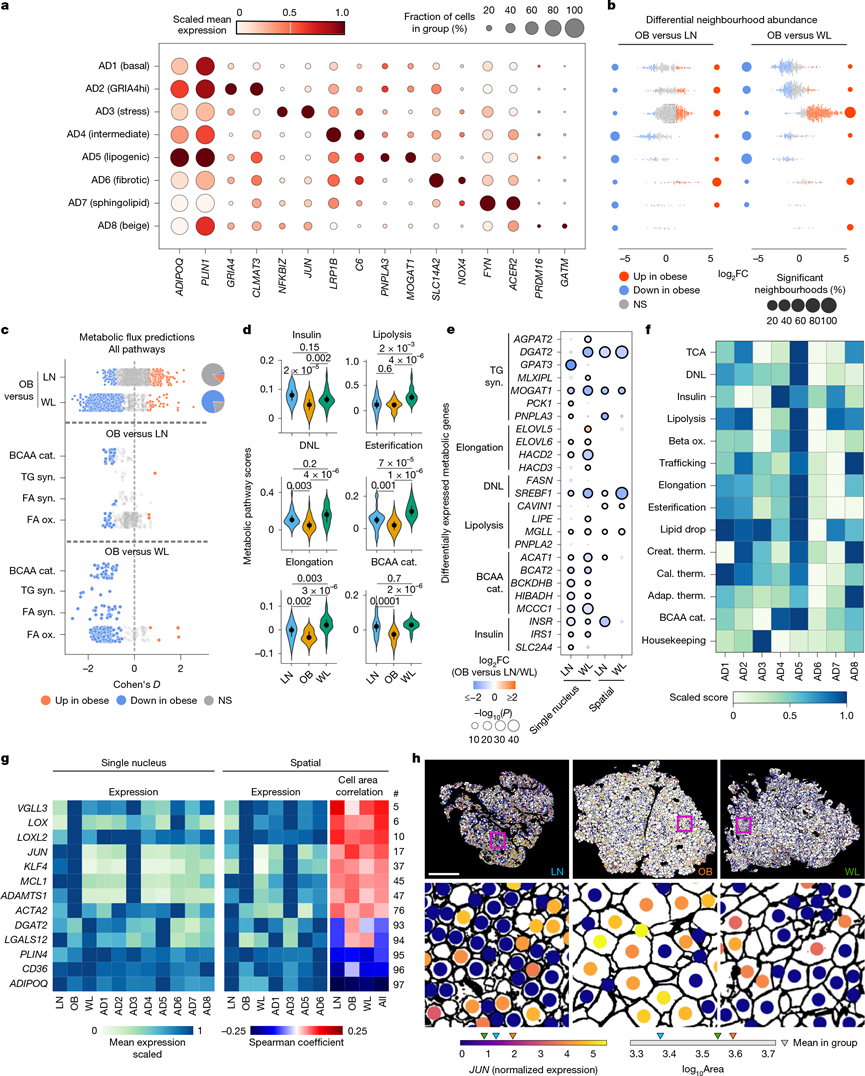
图3. 肥胖和 WL 中脂肪细胞和分子谱的动态调控。
(a) 成熟脂肪细胞亚群的标记基因表达。(b) 蜂群图显示脂肪细胞亚群中 LN–OB 和 OB–WL 比较中邻域丰度的变化。(c) 与 LN 和 WL 脂肪细胞相比,OB 中的代谢通量分析。(d) 检测单个脂肪细胞主要代谢途径总体活性的分数。(e) OB 与 LN 和 WL 脂肪细胞相比,脂质和 BCAA 代谢通路中酶基因的差异表达。(f) 脂肪细胞亚群代谢通路的总体活性。(g) 不同条件和脂肪细胞亚群中机械敏感、应激、纤维化和稳态基因的平均表达。(h) 代表性空间切片显示不同条件下脂肪细胞大小(WGA 分割)和JUN(应激标记)表达的变化。
04
逆转多细胞应激
脂肪细胞祖细胞(APC)可再生成熟脂肪细胞并维持组织基质,这些关键的稳态功能在肥胖症中可能会受损。APC 聚类为:“多能” DPP4-CD55- hi 祖细胞(ASC/APC1);表达典型分化基因的“定向”前脂肪细胞(APC2 和 APC3);脂肪生成调节细胞(APC4、KCNIP -hi 和CD142 / F3 -hi);以及促纤维化前体细胞(APC5、ADAM12 -hi 和POSTN -hi)。APC3 表现出与成熟脂肪细胞类似的应激特性,以及NOCT的更高表达(图4a),NOCT 是前脂肪细胞定向的潜在限制性调控因子。为了支持这一点,APC2 在局部亚区域内选择性地表达晚期脂肪细胞成熟基因。应激和促纤维化细胞数量再次反映了肥胖,并随着 WL 而显著减少(图4b)。两个群体均具有较高的缺氧诱导因子 1A(HIF1A)表达(图4a),这促进了小鼠的纤维化并抑制了脂肪生成(通过 PPARG 磷酸化)。相应地,WL 下调了缺氧、促纤维化(TGFβ)和抗脂肪生成(WNT)基因。因此,WL 可以减轻某些人类 APC 亚群中缺氧诱导的分化能力受损和促纤维化信号传导。
血管网络的协调生长对于健康的AT扩张至关重要。血管细胞亚聚类重现了在其他组织类型中观察到的内皮(动脉、毛细血管和静脉)和壁(平滑肌和周细胞)分区与成熟脂肪细胞和APC一样,毛细血管内皮细胞和壁细胞各自显示出“基础”和“应激”特征(图4a),并且随着脂肪沉积而相互变化。应激内皮细胞过表达APOLD1和SNAI1(图4a),突显了潜在的病理性新血管形成和内皮-间质转化。应激壁细胞富含ADAMTS1(图4a),ADAMTS1是一种抗血管生成蛋白,与周细胞脱离、纤维化转变和毛细血管稀疏相关。在不同的单核和空间数据集中,WL显著降低了应激血管细胞含量和标志物(图4c),暗示着这种病理转变的逆转。
所有应激细胞状态都会上调一个共同的基因特征(188 个基因)。多细胞应激虽然在肥胖中最高,但它是瘦组织的一个特征,并且会随着年龄和代谢功能障碍而增加(图4c)。基因和通路分析揭示了多细胞应激的假定介质(缺氧、机械和氧化应激、Gp130 介导的细胞因子、DNA 损伤和细胞周期停滞)。体外诱导 DNA 损伤(使用依托泊苷)重现了体内对应激标志蛋白的影响并削弱了 ASPC 分化能力。WL 导致多细胞应激基因显著减少,总体强调了多细胞应激通路在组织损伤和修复中的重要性。
他们利用空间数据集研究组织中应激细胞的方向和影响。为了确定与应激信号最相关的细胞,他们定量了低应力和高应力区域的细胞组成(50 µm 区间)(图4d)。应激细胞状态通常富集在高应力分区中,而应激毛细血管 (EC2) 则遍布整个组织。他们还发现应激区域与免疫细胞(TRM 和 NK 细胞除外)之间存在密切关联,并且与动脉内皮细胞 (EC4)存在意外的联系(图4d)。
虽然这种方法将单个细胞状态定位到应激分区,但它并未解决微环境区室中细胞的非随机分组问题。为了评估这一点,他们使用了空间分辨的邻近富集方法(300 µm 以内,以捕获脂肪细胞)来根据细胞状态邻域搜索组织微环境。这确定了五个不同的细胞群落,称为动脉微环境、静脉微环境、脂肪细胞微环境、干细胞微环境和应激微环境(图4d-e)。没有一种细胞类型是微环境独有的,这表明这些模式反映了组织的等级。干细胞微环境富含多能 ASC/APC1 和稳态 TRM。应激微环境富含 AD3、APC3、LAM、其他先天性(cMono 和 cDC2)和适应性(T 细胞)免疫细胞,表明这些状态与应激诱导和/或反应有关。动脉内皮细胞形成了自身的微环境,并与应激前体细胞(APC3)和应激壁细胞(Mu4)结合。直接细胞间共定位揭示了免疫细胞与大静脉血管和LAM的接近性,这可能反映了外渗和向CLS的迁移。
组织分区的识别使他们能够研究微环境内部和微环境之间的信号传导模式。空间数据集中的配体-受体推断分析揭示了一个复杂的通讯网络。脂肪因子和神经营养因子在脂肪细胞微环境(ADIPOQ、LEP和NRXN3)中富集。典型的 WNT 和 ECM 成分(FN1、胶原蛋白和层粘连蛋白)是干细胞微环境的主要成分。应激微环境和动脉微环境富含促炎趋化细胞因子(CXCL2、CCL2和IL6)以及推定的应激线索(TGFB1、AREG、NAMPT和THBS1),其中一些因子相互重叠(图4f)。在更大的单核数据集中,并行的细胞间通讯分析将不同的微环境信号与源细胞、靶细胞以及疾病病理生物学联系起来(图4g-h)。例如,THBS1(应激 AD3)、ADGRE5(泛免疫)和NAMPT(多细胞)是胰岛素抵抗、免疫糖酵解代谢和炎症的突发触发因素,它们在肥胖中均发生扩增,而 WL 则将其逆转(图4h)。这表明,应激微环境具有高浓度的与病理和修复性组织重塑有关的信号。
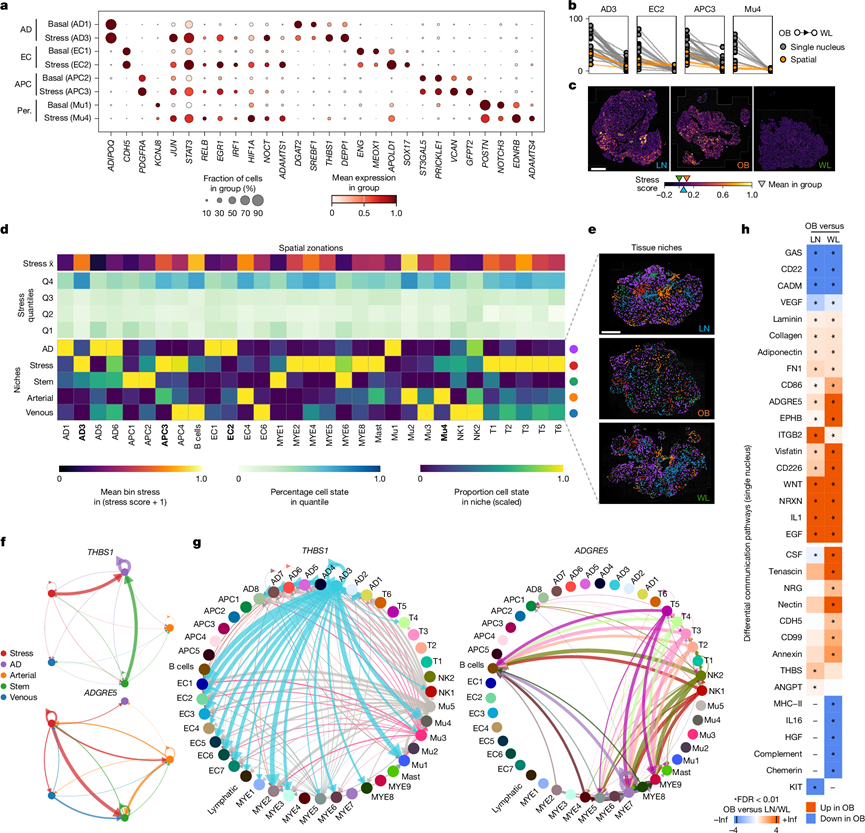
图4. 应激细胞形成空间生态位并丰富与应激相关的信号通路。
(a) 成熟脂肪细胞 (AD)、前体细胞 (APC)、内皮细胞 (EC) 和壁周细胞 (Per.) 的基础和应激亚群中的标志物基因表达谱。(b) OB 和随后的 WL 中应激细胞比例的成对变化。(c) 代表性 LN、OB 和 WL 空间组织切片中的组织范围应激分数。(d) 空间分区。上图:平均细胞状态应激分数。中图:所有条件下每个细胞状态 (Q1 低应激,Q4 高应激) 中应激分位数的细胞百分比。下图:组织微环境的细胞状态组成,表示为每个细胞状态的比例百分比。(e) 代表性组织切片中的空间微环境。(f) 空间生态位之间估算的 CellChat 通信。(g) 细胞状态之间的 CellChat 通信。(h) OB-LN 和 OB-WL 比较中具有显著差异相互作用的配体-受体通路。
05
抑制衰老
用于定义 AT 重塑途径的差异表达分析表明,WL 广泛逆转了肥胖对基因调控的影响。许多与 WL 相关的最强转录变化在细胞类型之间是保守的,这表明这些基因及其潜在途径可能代表重要的 WL 机制。在多种细胞类型中因 WL 改变的基因表现出系统性下调。下调的基因归类为 AT 功能障碍的标志性途径:炎症(TNFA和IFNG);缺氧;纤维化;免疫细胞募集和激活;以及氧化应激。 WL 还导致细胞周期停滞基因的下调,共同表明细胞衰老的逆转可能是 WL 对炎症和代谢产生有益作用的基础。
为了验证这一点,他们检测并证实了多种衰老特征的抑制(图5a)。在多种细胞类型中,WL 导致CDKN1A (p21) 的下调,而 CDKN1A 是衰老中的主要细胞周期抑制因子之一,并且导致受 p21 抑制的细胞周期进程基因的上调。相应地,WL 显著降低了主要衰老标志物和无偏衰老评分的表达(图5a)。具有衰老细胞转录特征的 p21 阳性细胞在应激的脂肪细胞、前体细胞和血管细胞状态下最为普遍,这表明共同的应激特征反映了脆弱性和向衰老的转变。瘦 AT 也含有大量(数量明显较少)的 p21 阳性细胞(图5b)。相比之下,WL 几乎完全从组织中消除了 p21 阳性细胞(图5b),他们利用空间转录组学和蛋白质定量原位验证了这一结果(图5c)。衰老的抑制反映了脂肪细胞生物能量学的增强,表明这些效应可能是机制耦合的。因此,他们确定人类 WL 具有先前未描述过的强效抗衰老作用。
组织范围的基因调控网络分析揭示了应激衰老细胞中紧密保守的转录联系,这种联系在肥胖时增加,在 WL 时减少(图5d)。已鉴定的 TF 分为几类(图5e):AP-1 超家族,可启动衰老基因组;标志信号依赖性 TF,可激活炎症和衰老相关分泌表型(SASP);Krüppel 样 TF,与细胞周期停滞有关;控制纤毛发生的 TF(RFX2/RFX3),它是假定的衰老调节因子;由DNA 损伤和氧化应激诱导的孤儿核受体 TF,关键的衰老触发因素;以及之前未与衰老相关的多个候选TF。单个TF表现出自调节作用,并共有多个靶基因(图5e),包括CDKN1A,这表明这些TF可能协同作用,增强细胞应激、衰老、SASP释放、炎症和组织损伤的退化循环,该转录级联反应可由WL抑制。
由于其在强化衰老方面的重要性,他们试图通过系统地比较分泌蛋白在应激和基础细胞状态下的表达来进一步定义 AT SASP 的特征。这揭示了衰老、组织损伤和代谢功能障碍的各种介质的变化,包括与多细胞应激以及微环境内和微环境间通讯有关的信号肽(AREG、ADAMTS1、OSMR、IL6ST 和 CXCL2)。假定的 SASP 成分系统地在原位复制并定位到应激和动脉微环境(图5f)。衰老细胞强烈上调 NAMPT,它是SASP 的细胞内驱动因素(通过 NAD 挽救途径中的酶活性)和细胞外脂肪细胞因子(内脂素),具有多效性、环境依赖性、主要具有促炎作用(图5a)。NAMPT表达同样在肥胖巨噬细胞和炎症 LAM 中富集(图2b-f),这与其在炎症小体活化和免疫募集中的作用一致。组织水平蛋白质分析证实,肥胖中 NAMPT 丰度增加,而 WL 时 NAMPT 丰度显著降低,共同强调 NAMPT 可能是 AT SASP 的驱动因素。
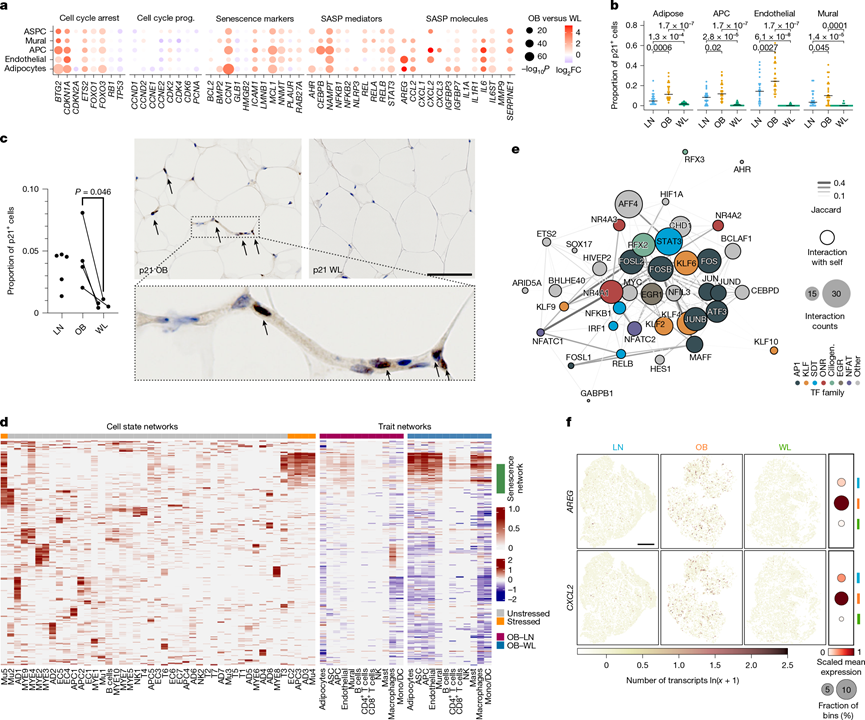
图5. WL 有效逆转衰老及其介质。
(a) 不同易损细胞类型在WL中细胞周期和衰老标志基因表达的差异。(b) 单细胞核数据集中不同条件下每个样本中p21 (0–1) 阳性细胞的平均比例。(c) 免疫组织化学分析。(d) 每种细胞状态下的差异基因调控网络。(e) 在应激细胞状态下保守的 TF 网络。(f) 每种条件下代表性空间组织切片中 SASP 成分、 AREG和CXCL2 的组织范围表达。
+ + + + + + + + + + +
结 论
本研究报告了一个空间分辨的多组学图谱(包含来自 70 人的 171247 个细胞),研究了在肥胖和治疗性减重过程中重塑人类 AT 以及代谢健康的细胞类型、分子事件和调控因素。本研究发现代谢细胞、前体细胞和血管细胞对衰老存在选择性易感性,并揭示减重可以有效逆转衰老,定义了可能驱动衰老、组织损伤和代谢功能障碍退化循环的基因调控机制和组织信号。本研究发现减重可以减少脂肪细胞肥大和生物力学约束途径,激活整体代谢通量和生物能量底物循环,从而可能介导代谢健康的系统性改善。在免疫系统中,本研究证明减重可抑制肥胖诱导的巨噬细胞浸润,但并不能完全逆转其活化,从而使这些细胞处于触发潜在体重反弹并加剧代谢功能障碍的准备状态。总而言之,这项互补的单细胞核和空间数据集为肥胖AT功能障碍的根本原因及其通过减重逆转提供了前所未有的见解,是机制和治疗探索的关键资源。
+ + + + +



 English
English


