文献解读|Sci Immunol(24.8):对肿瘤浸润淋巴细胞过继治疗的反应与黑色素瘤中预先存在的 CD8 + T 骨髓细胞网络有关
✦ +
+
论文ID
原名:Response to tumor-infiltrating lymphocyte adoptive therapy is associated with preexisting CD8+ T-myeloid cell networks in melanoma
译名:对肿瘤浸润淋巴细胞过继治疗的反应与黑色素瘤中预先存在的 CD8 + T 骨髓细胞网络有关
期刊:Science Immunology
影响因子:24.8
发表时间:2024.02.02
DOI号:10.1126/sciimmunol.adg7995
背 景
使用体外扩增的自体肿瘤浸润淋巴细胞(TIL)的过继细胞疗法(ACT)是一种有效的癌症治疗方法,多项临床研究在转移性黑色素瘤患者中观察到客观缓解,并且在这些患者中优于免疫检查点阻断(ICB)治疗。TIL-ACT在其他上皮癌中也有临床缓解的报道。然而,由于尚不清楚的原因,TIL-ACT的益处并不能扩展到所有接受治疗的患者。
实验设计
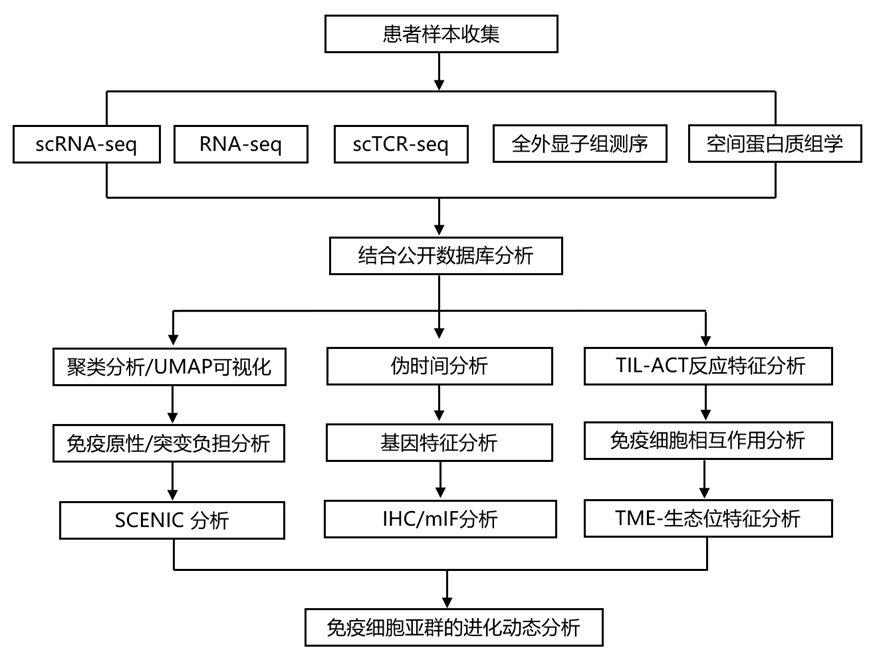
结 果
01
接受 TIL-ACT 患者的稳态黑色素瘤微环境
研究团队对 2018 年 3 月至 2020 年 12 月期间参加 1 期临床研究 (NCT03475134) 的 15 名转移性黑色素瘤患者进行了分析,这些患者在 ICB 治疗进展后接受了 TIL-ACT(图1A)。他们在6例患者中观察到客观缓解[46%,分类为缓解(Rs): 2例患者持续完全缓解(CR),4例患者部分缓解(PR)]。非Rs (NRs)包括4例疾病进展(PD)患者和3例疾病稳定(SD)患者(图1B)。13例患者中,中位无进展生存期(PFS)为5.6个月,中位随访时间为45.4个月;中位总生存期(OS)为8.8个月(图1C)。2例CR患者接受单一ICB治疗,而4例PR(短暂性Rs)和7例NRs患者中的6例在入组前接受双重ICB治疗。
为了了解这些肿瘤的基线细胞形态,他们通过scRNA-seq检测了来自10例患者的12个手术样本(6个Rs和4个NRs)。他们发现细胞分布在21个主要聚类中,包括T细胞、B细胞、髓样细胞以及其他基质细胞和血管内皮细胞(图1D)。利用TCGA(癌症基因组图谱),他们构建了黑色素瘤细胞特异性基因标签评分,并鉴定了59958个肿瘤细胞。来自不同患者的肿瘤细胞单独聚集,具有较高的患者特异性(图1D)。他们发现基于临床反应的恶性细胞和免疫细胞比例没有差异。虽然NRs有降低总TIL的趋势,但这具有较高的患者间变异性(图1E)。
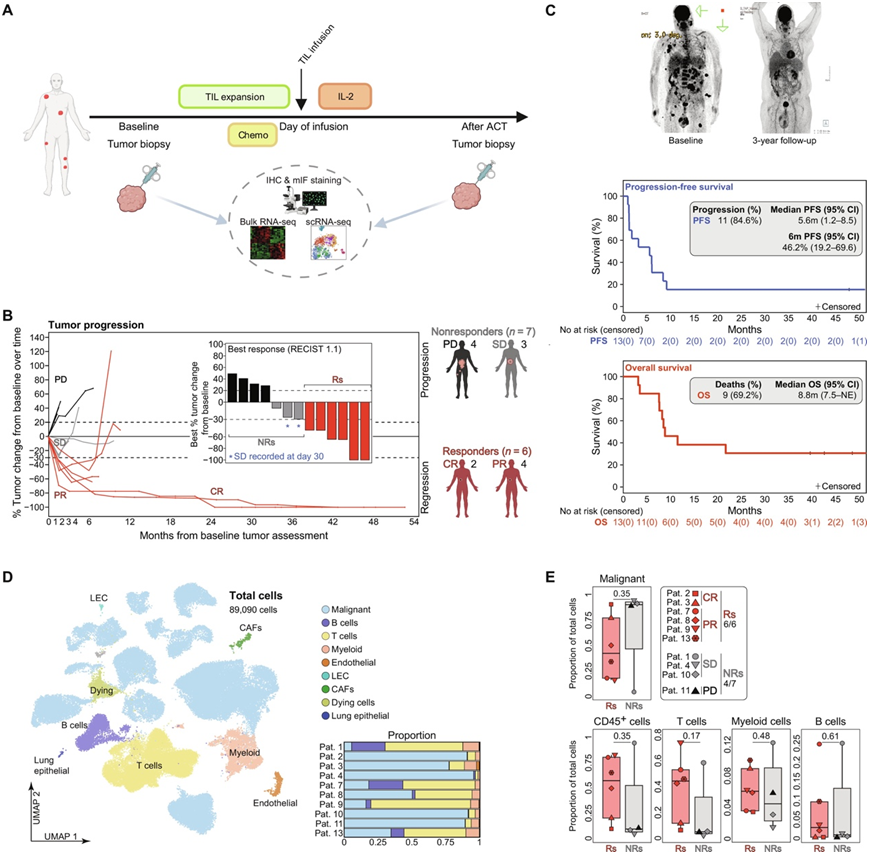
图1. 黑色素瘤 TIL-ACT 队列的临床特征和肿瘤微环境(TME)情况。
(A) 研究设计和转化分析时间点的示意图。(B)随时间推移肿瘤大小相对于基线的变化百分比。(C) 采用Kaplan-Meier方法分析患者3 (CR)在基线和3年随访时(上)的正电子发射断层扫描-计算机断层扫描(PET-CT)图像以及研究队列(NCT03475134)的PFS(中)和OS(下)。(D)UMAP可视化。(E) 箱线图显示根据临床反应的主要细胞类型比例。
02
Rs 的基线黑色素瘤表现出肿瘤固有的免疫原性
然后他们检测了基线恶性间隔(图2A)。与宿主细胞的TME相比,黑素瘤细胞表现出明显的染色体拷贝数变异(CNV)。这一发现证实了黑色素瘤的恶性性质,并提示了黑色素瘤细胞的基因组不稳定性(图2B)。
为了进一步分析恶性细胞中Rs和NRs之间的差异,他们进行了转录组学分析。单细胞调控网络推断和聚类(SCENIC)分析是根据调控子的表达推断转录因子(TF)的活性,揭示了几个信号转导子和转录激活因子(STAT)和干扰素(IFN)调节因子(IRF)在Rs的黑色素瘤细胞中处于激活调节的上游(图2C)。此外,单样本基因集富集分析显示,Rs的黑色素瘤细胞中激活了免疫原性程序,包括双链DNA感应、IFN-α和IFN-γ反应、补体激活、抗原呈递、主要组织相容性复合体(MHC) I/II类、IL-6/Janus激酶/STAT3信号、肿瘤坏死因子-α /核因子-κB (NF-κB)信号和免疫检查点(图2D-E)。肿瘤细胞中 B2M、TAP1、HLA-E、HLA-A 和 HLA-C、PSMB8 以及 PSMB9 的表达水平较高,这些基因编码 MHC 类 I/II 抗原呈递组件和免疫蛋白酶体的激活(图2F)。
通过对肿瘤进行的全外显子组测序分析,以及在可行的情况下对自体肿瘤来源的细胞系进行的全外显子组测序分析,与NRs相比,Rs显示出更多的体细胞突变(图2G)。为了验证这些结果,根据本项研究队列的恶性细胞ACT临床应答特征对TCGA转移性黑色素瘤队列进行了分类(图2F),并发现该特征水平高的TCGA黑色素瘤样本也有较高的肿瘤突变负荷(TMB)(图2H)。
为了寻找与TIL-ACT缺乏反应相关的黑色素瘤内在程序,他们研究了更广泛的反应组特征,发现间充质上皮转化(MET)驱动的磷脂酰肌醇3-激酶(PI3K) -AKT通路是NRs黑色素瘤细胞中唯一显著过表达的程序(图2I)。他们还发现了与细胞增殖相关的较高通路,如D环结构的解析、DNA复制起始以及G1和G2相关程序,这些提示DNA修复能力(图2D-I)。总之,Rs表现出更高的TMB,同时免疫原激活和抗原呈递增加。
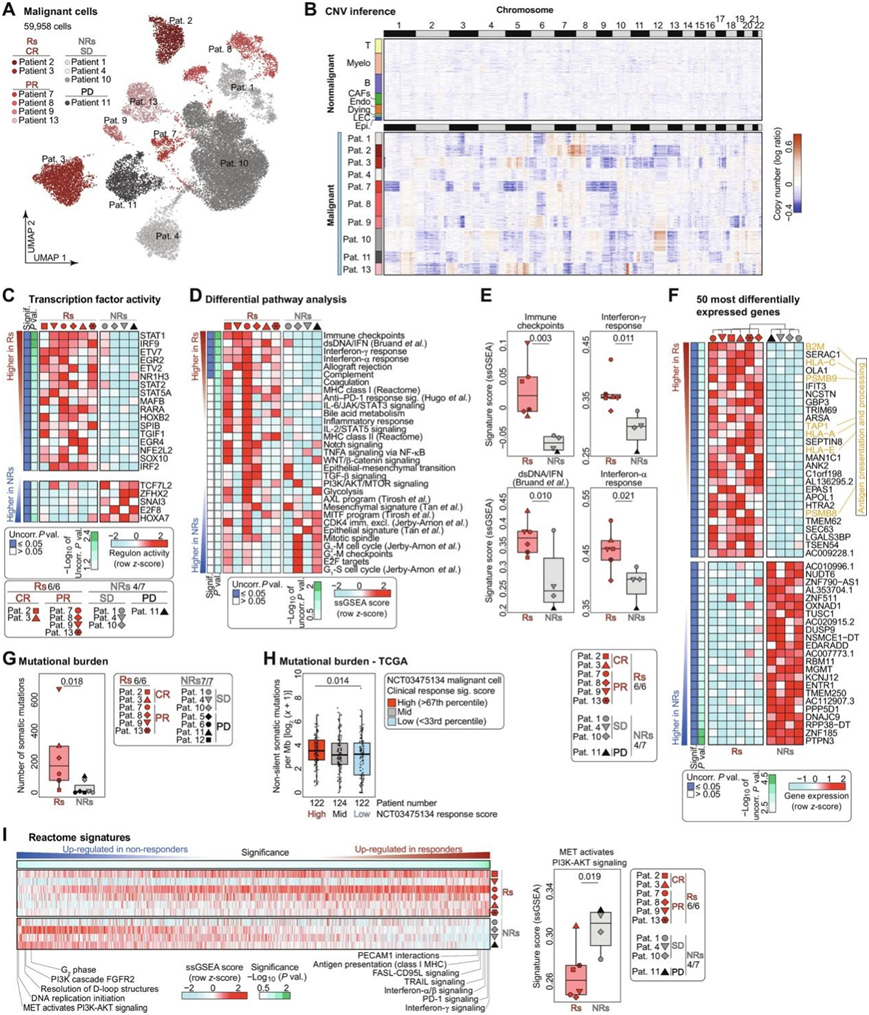
图2. Rs 的基线恶性区室的特点是高免疫原性和突变负担。
(A)UMAP可视化。(B) 从每位患者随机选择的 200 个黑色素瘤细胞的基因表达中推断出 CNV。(C) 热图显示Rs 与 NRs 的恶性细胞中最显著激活和抑制的 TF/调节子。(D) (D) Rs和NRs恶性细胞之间差异最大的标志和调控通路的热图。(E)方框图显示(D)中根据临床反应出现的恶性细胞特征评分。(F) 热图显示了Rs和NRs在恶性细胞中最显著的上调和下调基因聚类。(G) 箱线图显示根据临床反应从肿瘤或细胞系的全外显子组测序数据计算出的体细胞突变数量。(H) 显示TCGA转移性黑色素瘤病例中每百万碱基非沉默体细胞突变的数量的箱形图。(I) 左:反应组通路分析显示 Rs 和 NRs 恶性细胞之间差异最大的通路。右:箱线图显示 NRs 中最显著的恶性细胞特征评分上调。
03
对TIL-ACT有反应的黑色素瘤表现出先前存在的CD8+ T细胞免疫
通过对所有13例患者分选的CD45+细胞进行scRNA-seq,他们识别出9个不同的CD8+ TIL聚类。基于先验知识将这些聚类划分为已知状态,包括幼稚样、效应记忆(EM)样、CX3CR1+、热休克基因阳性,FOXP3+、IFN刺激基因(ISG)阳性,前体耗竭(Pex)和耗竭(Tex)聚类(图3A-B)。此外,他们还鉴定了自然杀伤(NK)样CD8+TIL、一个NK细胞聚类和三个CD4+ T细胞亚群:辅助性T细胞1 (TH1)、CXCL13+滤泡辅助性T细胞(TFH)样和调节性T细胞(Treg)。通过伪时间分化轨迹推断的状态表型分化表明,CX3CR1+、Pex和Tex(以及部分ISG和EM样)CD8+ TIL是分化程度最高的效应状态,但代表不同的程序(图3C)。这三个状态占所有 CD8+ TIL的三分之一,而效应记忆 (EM) 样细胞也占了三分之一(图3D)。
最近,研究发现人类肿瘤抗原特异性CD8+ TIL分布于三种TOX+PDCD1+CTLA4+TIGIT+转录耗竭状态,包括前体状态(TCF7、LEF1、CCR7和IL7R的高表达),终末分化状态[高表达HAVCR2/T细胞免疫球蛋白和黏蛋白结构域包含蛋白-3 (TIM3)和ENTPD1/CD39和细胞溶解效应分子],以及由近期T细胞受体(TCR)结合的TF定义的中间状态。他们发现Pex和Tex CD8+ TIL在Rs中显著富集(图3D)。基于scTCR-seq、Tex、EM样和CX3CR1+细胞表现出最多的单克隆扩增,这与基于伪时间的分化推断一致,提示抗原选择状态。然而,在所有的细胞状态中,Pex和Tex除了表现出耗竭外,还表现出TCR信号通路和细胞毒性以及增殖的最高特征(图3E),表明肿瘤抗原结合。与前体状态一致,Pex TIL过度表达了大部分的DNA扩增和修复途径以及增殖特征(图3E)。Pex转录因子7 (TCF7)、MYC、成肌分化因子1 (MYOD1)和组蛋白去乙酰化酶2 (HDAC2)的转录因子活性高于Tex,而CD8+ T细胞组织常驻的关键调节因子Runt相关转录因子3 (RUNX3)的转录因子活性高于Tex。接受了原位树突状细胞(DC)的CD28共刺激,一部分耗竭的CD8+ TIL保留了增殖能力,基线Rs黑色素瘤中的Tex和Pex也表现出CD28共刺激和增殖的特征(图3E)。
基线时 EM 样细胞和CX3CR1 + CD8 + TIL的 Rs 和 NRs 频率相似(图 3D),这可能反映出这些细胞的一部分源自不相关的旁观者细胞。基线 CD8+ TIL 在耗竭、TCR 信号、细胞毒性、CD28 共刺激、IL-2 信号、IFN-γ 激活和效应器功能的转录组程序中富集(图 3F)。通过标记肿瘤新抗原反应性,他们验证了Rs的CD8+ TIL的肿瘤反应性较高。相反,NRs的CD8+ TIL过表达病毒特异性标志物,表明其旁观者表型(图3F)。
他们在单细胞和患者假体水平更深入地分析了来自Rs和NRs的CD8+ TIL中的差异表达基因,揭示了Rs的CD8+ TIL中一致的过表达基因(CXCL13、CCL5、HLA-DRB5、HAVCR2、TNFRSF9、CTLA4和PDCD1)和调节因子[RUNX3、EOMES、TBX21、活化T细胞核因子5 (NFAT5)和ETS变异体转录因子1 (ETV1)],其中许多之前与耗竭/ CD28共刺激的CD8+ TIL特征相关(图3G-H)。此外,临床应答与基线CD8+ TIL相关,这些TIL表现出的推测的ZNF831(锌指蛋白831)和HIVEP1(锌指蛋白40)活性增加。ZNF831 和 HIVEP1 与效应子和耗竭程序中涉及的几个关键基因的增强子元件结合,包括编码 IL-2 受体(IL2RA、IL2RB和IL2RG)以及IFNB1、TBX21 /T-bet、EOMES和PRDM1 / BLIMP-1的基因涉及多个免疫检查点基因、ETV1靶向TOX和RUNX3的转录激活(图3H)。相反,TIL-ACT失败与基线时幼稚型和记忆型CD8+ TIL的优势相关,突出表现为IL7R和LTB的过表达,以及WNT/β-catenin信号通路相关的TF[包括淋巴增强因子1 (LEF1)和TCF7]和转化生长因子(TGF) - β信号通路相关的TF(包括FOXP1和SMAD3)的活性较高,这反映出缺乏抗原经历过的肿瘤反应群体。CD8+ Tex和Pex,其次是EM样,是最高度过表达T细胞临床反应特征的TIL亚群(图3G-I),证实了它们与TIL-ACT的相关性。
通过对基线肿瘤的福尔马林固定石蜡包埋(FFPE)切片进行免疫组织化学(IHC)和mIF显微镜检查,证实了对TIL的转录组学的结果。这些分析表明,肿瘤内CD3+CD8+ TIL和CD3+CD8+PD1+ TIL(位于肿瘤巢内)在Rs中频率较高(图3J)。总之,原位 T 细胞激活、细胞毒性、共刺激和耗竭以及具有较高 TMB 的免疫原性肿瘤细胞是黑色素瘤对 TIL-ACT 反应的标志。
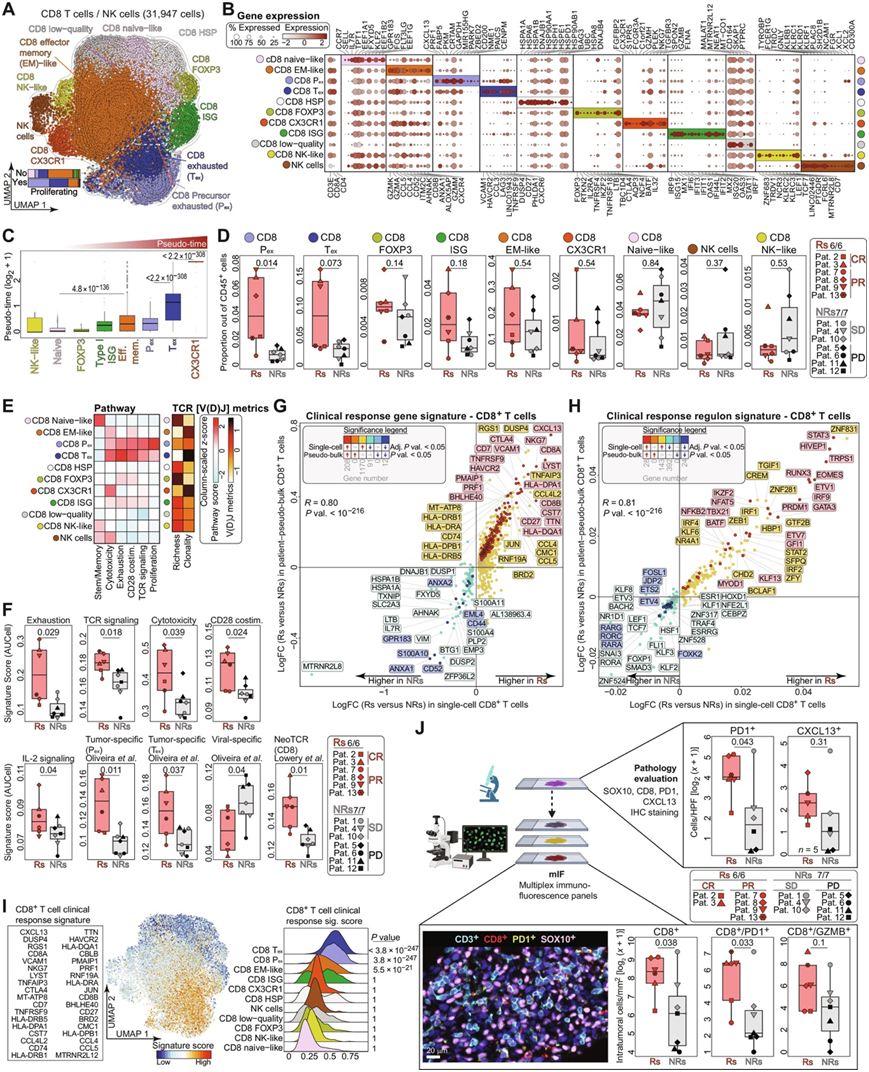
图3. 来自 ACT R 肿瘤的CD8 + T 细胞在基线时表现出抗肿瘤免疫的特征。
(A)UMAP可视化。(B) 点图显示 CD8 + T 细胞群的大多数判别基因标记的基因表达。(C) CD8+ T 细胞群的伪时间分析显示按 CD8 + T 细胞亚型分组的每个细胞的伪时间值。(D) 根据临床反应,绘制基线肿瘤中CD8+ T 细胞亚型和 NK 细胞相对于 CD45 +细胞的比例的箱线图。 (E) 左:基因特征评分。右:每个 CD8 + T 细胞群的 TCR 丰富度和克隆性指标。(F) 根据基线肿瘤的临床反应,患者平均 CD8 + T 细胞特征评分的箱线图。(G-H) 差异表达基因和TF/调节子分析。(I) CD8 + T 细胞临床反应基因特征(左)及其在 UMAP 空间(中)中投影的评分,并绘制为基线肿瘤中每个 CD8 + T 细胞亚群的岭图(右)。(J) 通过 IHC和 mIF定量对基线肿瘤中所示蛋白质进行病理学评估。
04
TIL-ACT 反应性黑色素瘤由活化的巨噬细胞和 DC 浸润
基于从所有患者获得的 scRNA-seq 数据,他们检测到了 11 个骨髓细胞聚类,将其注释为四种 DC 状态 [DC1、DC2、CCR7 + DC3 和浆细胞样细胞] (pDC)]、五种巨噬细胞状态(CXCL9 +、ISG、S100A8 +、TREM2 +和C1Q +巨噬细胞)和两种单核细胞状态 [单核细胞和单核细胞样 DC (monoDC)](图4A)。他们进一步分析了 Rs 和 NRs 之间巨噬细胞中差异表达基因。该分析揭示了参与 IFN 信号传导(IFI27、IFITM1、IFITM3、IFI6和STAT1)、补体成分合成(C1QA-C和C3)、吞噬作用以及抗原加工和呈递(HLA-B、HLA-C、B2M、HLA-DQA1、HLA-DQA2和HLA-DRB5),以及Rs 巨噬细胞中IFN 诱导趋化因子CXCL9和CXCL10的上调(图4B-C)。接下来,他们根据 Rs 中上调最多的基因计算了与临床反应相关的巨噬细胞评分(图 4D),并分析各种巨噬细胞亚群,该特征在CXCL9+和ISG巨噬细胞中高表达,其次是C1Q+和TREM2+细胞,特别是在Rs中(图4E)。IFN-γ特异性上调巨噬细胞中CXCL9的表达,提示附近存在识别肿瘤抗原的TIL,但CXCL9进一步增强肿瘤内TIL的浸润。
接下来,他们对DC进行了类似的分析。对于巨噬细胞,DC在Rs中表现出更高的活化和IFN反应特征(IRF4-7、CXCR4、ICAM1和STAT1),揭示髓系室的总体1型极化(图4F-G)。他们接下来分析了如上所述的完整DC特异性临床应答特征,这一特征主要局限于Rs中的pDC(图4H-I)。
最后,他们研究了相对于髓系亚群,肿瘤反应性CD8+ TIL的相对丰度,重点是耗竭的TIL(Tex和Pex合并)。与巨噬细胞或DC相比,Rs组中TIL的耗竭频率显著较高(图4J)。总之,特异性转录程序,如补体激活、IFN信号传导、IFN诱导的趋化因子、抗原呈递和CD28共刺激,主导了基线肿瘤中对TIL-ACT反应的巨噬细胞和DC的表型。
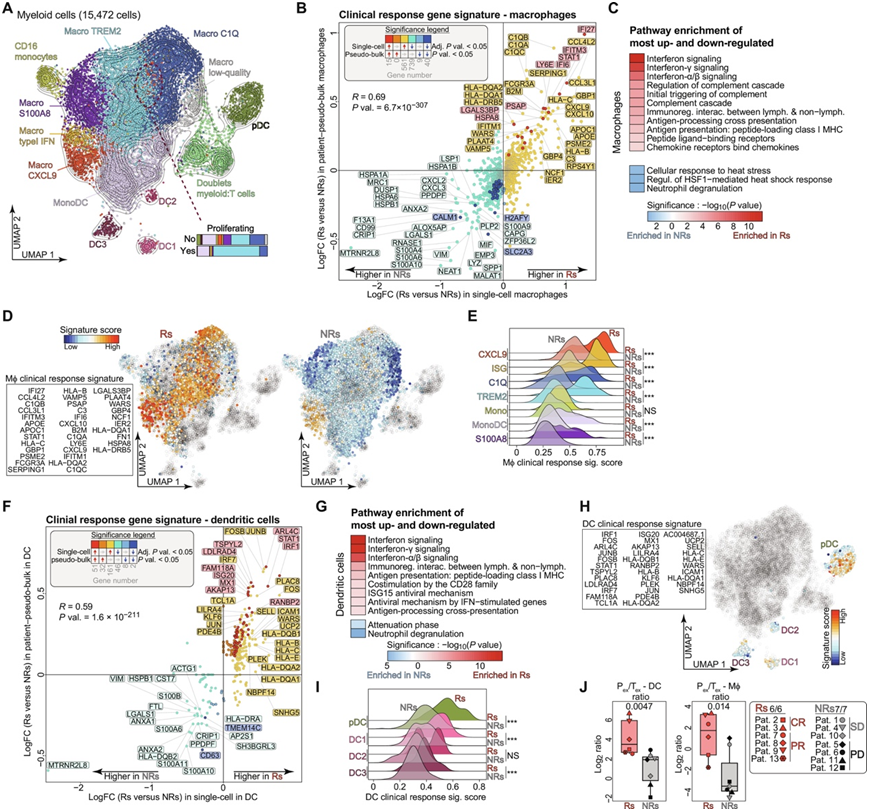
图4. 骨髓室的激活与 TIL-ACT 的反应相关。
(A) UMAP可视化。(B)差异表达基因分析。(C) 通路富集分析。(D) 巨噬细胞临床反应基因特征(左)及其在基线肿瘤 UMAP 空间中的评分(分为 Rs 和 NRs)。(E) 岭图显示根据基线肿瘤反应划分的每个巨噬细胞子集的巨噬细胞临床反应特征评分。(F)差异表达基因分析。(G) 反应组富集分析。(H) DC 临床反应基因特征及其在基线肿瘤 UMAP 空间中的评分。(I) 岭图显示根据基线肿瘤的临床反应划分的每个 DC 子集的 DC 临床反应特征评分。(J) 耗竭T细胞与DC或巨噬细胞群体之间的比例。
05
对TIL-ACT有反应的黑色素瘤具有丰富的免疫细胞交互作用的特征
他们通过计算受体-配体基因表达和 TME 中假定细胞对的相对比例,通过配体组分析推断细胞间的相互作用分析。这些分析显示,在基线时,Rs 肿瘤中的免疫细胞间相互作用比 NRs 更显著(图 5A)。
为了提高相互作用组的分辨率,他们将分析重点集中在T、B和髓系区室分析中出现的5条通路,这些通路对于免疫治疗的临床应答至关重要:补体、IFN、趋化因子、IL和共刺激/共抑制。TIL与髓系细胞、TIL与肿瘤细胞以及Rs中的CD4+和CD8+ TIL之间存在大量假定的显著相互作用(图5B),并发现预测为肿瘤特异性的TIL亚群(包括耗竭细胞、ISG细胞和EM样细胞)与几个巨噬细胞亚群和DCs之间存在交互作用(图5C)。据预测,终末耗竭T细胞和ISG T细胞主要与C1Q+和CXCL9+巨噬细胞相互作用,而Pex和EM样T细胞主要与TREM2+和S100A8+巨噬细胞相互作用。在可用分子的基础上,CXCL9+巨噬细胞可以通过CCL5、CXCL9/10/11或CXCL13吸引表达CCR5、CXCR3或CXCR5的耗竭CD8+ TIL,并可以通过巨噬细胞表达的ICAM1和ICAM2以及TIL表达的ITGB2和ITGAL与它们建立黏附相互作用(图5D)。进一步的趋化和刺激相互作用可由补体成分局部介导,因为C3在耗竭的TIL中上调,而C3AR1由补体阳性和CXCL9+巨噬细胞表达(图5D)。T细胞在TCR参与和CD28共刺激后上调并释放C3,从而驱动APC成熟和进一步的T细胞共刺激。C1Q+巨噬细胞表达IL-15, IL-15通过IL15RA-IL2RG向局部TIL提供关键的生存和干性促进信号(图5D)。
他们发现在 Rs 中,T-髓系细胞双重体的频率较高,同时 T-B 细胞和 CD4+-CD8+ T 细胞双重体的频率也有较高的趋势(图5E)。他们检测到 T 细胞耗竭和 CD28 协同刺激特征在来源于 Rs 的 T 细胞-髓系细胞双重体中过度表达,这意味着这些双重体中的耗竭 CD8+ TIL 从对应的髓系细胞中获得了 CD28 协同刺激(图5F)。通过解析细胞双重体中涉及的细胞状态,他们发现 T-髓系细胞双重体特异性地富集在 CXCL9+ 巨噬细胞和 CD8+ Pex 或 Tex 细胞中(图5G)。因此,这些关键的细胞相互作用在肿瘤反应性CD8+ TIL和正确极化的巨噬细胞之间普遍存在,并且可能对这些肿瘤特异性CD8+ T细胞的募集和功能支持至关重要,这表明了它们与对TIL-ACT的应答之间的强关联。相反,T-髓系细胞双重体在NRs中罕见,主要富集于NK样CD8+ T细胞和DC2中(图5G)。
此外,他们使用mIF识别CD8+PD-1+或CD8-PD-1+ TIL、CD11c+或CD68+髓系细胞和CD19+ B细胞,并检测它们的原位相互作用(图5H-J)。使用不同半径(20、45和100 μm)的邻域分析,发现在Rs的肿瘤微环境和间质室中,CD8+或CD8+PD-1+ TIL与CD11c+细胞之间的相互作用数量均高于NRs(图5J-L)。虽然细胞频率和它们之间的相互作用在设计上是相互依赖的,但他们发现 CD8+ 细胞和 CD11c+ 细胞之间的相互作用比它们各自的最小细胞频率在区分 Rs 和 NRs 方面更显著(图5L)。此外,Rs间质中CD8+PD-1+:CD68+、CD8+PD-1+:CD19+、CD8+PD-1+:CD8−PD-1+(即CD4+PD-1+ T细胞)比例也较高(图5J)。
他们试图在蛋白质水平上更深入地了解T细胞-髓系邻近区域内TIL和髓系细胞的状态,将GeoMx蛋白选择性地应用于T细胞-髓样微环境富集的感兴趣区域(ROI)(图5M)。对Rs和NRs基线黑色素瘤的74个靶点进行的差异蛋白表达比较表明,Rs的T细胞-髓样生态位富含蛋白质,提示较高的抗原表达(NY-ESO-1)和呈递(B2M),以及可能较高的肿瘤细胞杀伤[活化的半胱氨酸天冬氨酸蛋白酶-9 (cleaved caspase-9)、BCL2和多腺苷5 ' -二磷酸核糖聚合酶](图5N)。
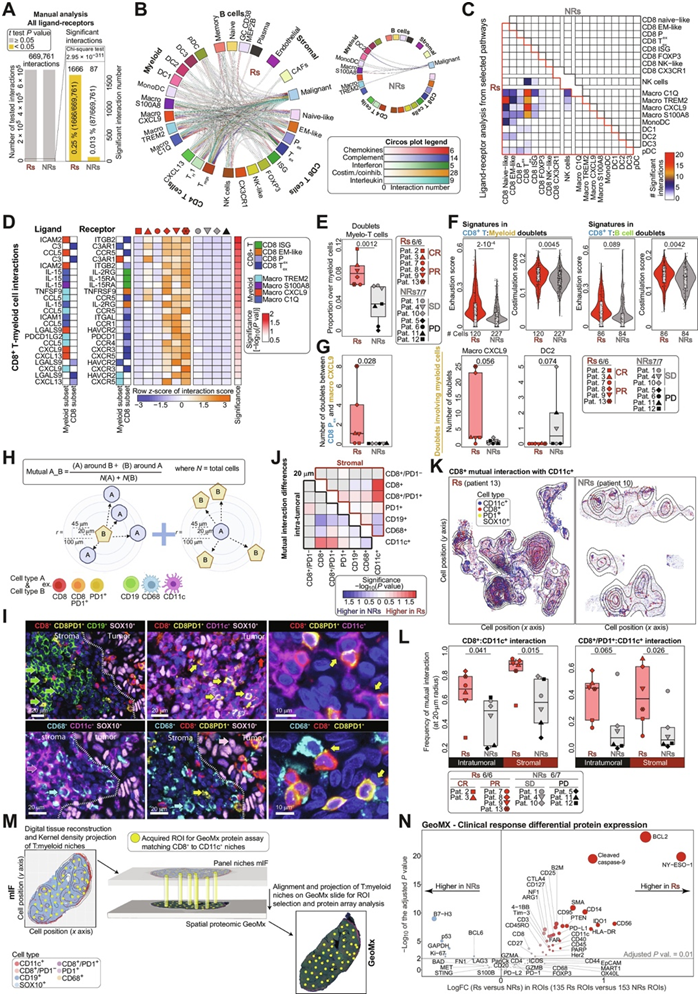
图5. TIL-ACT R 的基线肿瘤的特征是丰富的 T 细胞-TME 相互作用。
(A)条形图显示 Rs 和 NRs 之间检测到的测试和显著相互作用的总数。(B) Circos 图显示参与显著相互作用的细胞亚型(链接)以及五种不同途径的配体-受体对的显著相互作用的数量,并按基线肿瘤的临床反应进行划分。 (C) 热图显示细胞亚群之间的配体-受体数量。(D) 热图显示每位患者的相互作用分数以及基线肿瘤中骨髓细胞和 CD8+ T 细胞亚型之间选定的配体-受体相互作用的分数。 (E) 箱线图显示 T 骨髓细胞双联体的比例。(F) 在涉及 CD8 + T 细胞和骨髓细胞(左)或 CD8 + T 细胞和 B 细胞(右)的双联体中计算的选定特征分数。(G) 根据临床反应参与双峰反卷积的特定细胞亚群的示例。 (H) 计算细胞相互作用分析中两种不同细胞类型之间的距离的方案和公式。(I) 肿瘤中所示标记物的 mIF 染色示例图像。(J) 热图显示 20 μm 相邻半径内细胞类型之间相互作用频率的差异。(K) 数字组织重建的代表性图像,显示根据临床反应的CD8 +和 CD11c +细胞之间相互作用的频率密度。(L) 箱线图显示根据临床反应并按基质或肿瘤内区域划分的指定细胞类型之间相互作用的频率。(M) 方案描述了空间 GeoMx 分析的 ROI 选择策略。(N) 显示差异表达蛋白的火山图。
06
有效的TIL-ACT疗法可重编程髓系细胞群并重建抗肿瘤CD8+ TIL -髓系细胞网络
接下来,他们试图确定TIL-ACT如何影响TME动力学,方法是使用来自基线时(T0)肿瘤和ACT后至少30日(T30)获得的活检的RNA-seq数据,以捕获Rs相对于NRs的TME变化。肿瘤相关的表皮生长因子受体、ERB-B2受体酪氨酸激酶2 (ERBB2)/蛋白酪氨酸激酶6和PI3K/ERBB4信号通路在Rs中表达下调,在NRs中表达上调,可能反映了肿瘤细胞的扩增或适应(图6A)。缓解的肿瘤表现出多种炎症信号(替代补体激活、清道夫受体、toll样受体3、NF-κB、IL-18和IL-10信号)的增加,表明ACT后固有免疫的重新激活。T细胞活化[CTLA-4、程序性死亡受体1 (PD-1)、TCR、CD28、IL-2和FasL信号]和B细胞活化(BCR信号)在ACT活检后的NRs中特异性缺失(图6A)。在基线时观察到的关键TME特征在ACT后重建,包括CD8+ Pex和Tex以及CXCL13+ CD4+ TIL特征,但仅在Rs中。相反,NRs缺失了CD8+ Pex和Tex、CXCL13+ CD4+ TIL、Treg细胞和DC特征(图6B)。TIL-ACT特异性地增加了Rs中CXCL9+、ISG巨噬细胞和CD16+单核细胞的特征(图6B)。mIF分析也证实了这一观察结果,显示浸润的CD68+和CD11c+骨髓细胞密度从基线到ACT后均有所增加(图6C)。此外,通过mIF,他们证实了Rs在ACT后维持了相对较高的表达PD-1和/或颗粒酶-B的CD8+ TIL频率,而NRs在ACT后显示了相对于基线显著较低的这种肿瘤反应性CD8+ TIL频率(图6D)。他们观察到,在Rs和NRs中,肿瘤内CD8+PD-1-TIL的频率均降低,NRs在ACT后失去了CD8 Tex的浸润(图6E)。应用T30的RNA-seq中的肿瘤新抗原反应性T细胞特征,他们发现ACT后持续存在的Rs CD8+ TIL具有更高的肿瘤特异性特征(图6F)。
对来自基线和ACT后的7例患者的配对scRNA-seq数据所做的分析表明,许多最初的相互作用能重新建立,特别是在T30时,与基线相比,CD8+和髓系间的预期交互作用显著增加,特别是在Rs(图6G-H)。从基线和ACT后配对的scRNA-seq数据中,他们再次识别了与肿瘤免疫识别相关的主要CD8+ TIL状态,即在稳定状态下识别的Pex、Tex、EM-样和ISG细胞。其中大部分与关键髓系亚群紧密结合,尤其是CXCL9+巨噬细胞(图6H)。
IFNG和IFNGR1/2分别作用于CD8+ TIL和巨噬细胞,表明TIL直接诱导巨噬细胞极化,导致CXCL9和CXCL10表达上调(图6I)。这些结果表明,成功的 ACT 不仅恢复了 TIL 库,而且还将肿瘤巨噬细胞群重新编程为CXCL9+细胞,从而增强了潜在的 CD8+ T 骨髓相互作用。
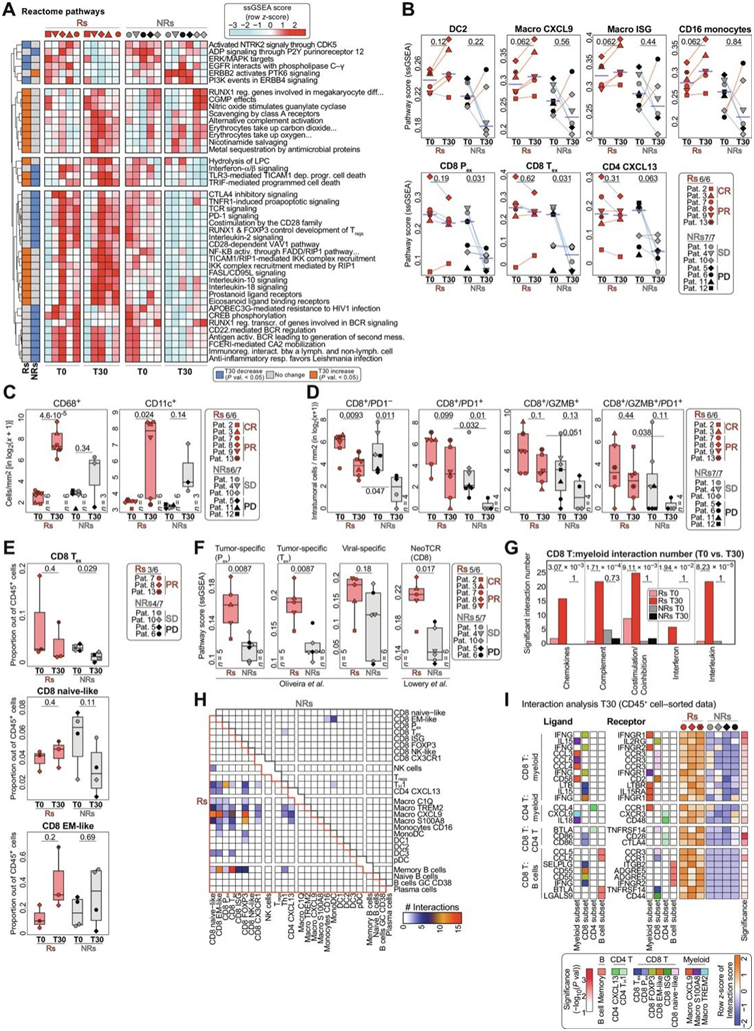
图6. TME 和 TIL-TME 相互作用的动态与 TIL-ACT 前后的临床反应相关。
(A) 热图显示 T0 和 T30 之间的反应组途径评分在 Rs 或 NRs 方面存在显著差异。(B) 线图显示RNA-seq 中的特征得分。 (C) 通过 mIF 分析的细胞密度箱线图,并按 CD68 和 CD11c 染色的临床反应和 ACT 时间划分。(D) 瘤内细胞密度的箱线图,由 mIF 按临床反应和指定染色的 ACT 时间划分。(E) 箱线图显示从 T0 到 T30 的 CD8 Tex、CD8 幼稚样和 CD8 EM样比例(单细胞数据中的CD45 +细胞)的动态。 (F) 箱形图显示按T30临床反应分割的RNA-seq数据中的特征评分。(G) CD8 + T 和骨髓细胞之间显著的配体-受体对相互作用的数量分为五种不同的途径,并按临床反应和 ACT 时间划分。(H) 热图显示T30 中响应者或无响应者中细胞亚群之间的配体-受体数量相互作用。(I) 热图显示每个患者以及 T30 肿瘤中选定的配体-受体和细胞类型相互作用评分。
+ + + + + + + + + + +
结 论
本项研究对 ACT 治疗前和治疗后的肿瘤组织进行了RNA-seq、scRNA-seq、全外显子组测序和空间蛋白质组学分析,发现 ACT 反应者表现出更高的基础肿瘤细胞内在免疫原性和突变负担。与无应答者相比,CD8 + TIL 表现出增加的细胞毒性、耗竭和共刺激,而应答者中的骨髓细胞 I 型干扰素信号传导增加。空间邻域分析证实的细胞间相互作用预测分析表明,应答者具有丰富的基线瘤内和间质肿瘤反应性 T 细胞网络,并具有激活的骨髓细胞群。成功的 TIL-ACT 疗法进一步重新编程了髓样区室并增加了 TIL-髓样网络。
+ + + + +



 English
English


