文献解读|J Nanobiotechnology(10.2):产自于马齿苋的可食用的外泌体样纳米颗粒通过促进CD4+CD8+T细胞扩增减轻DSS诱导的结肠炎
✦ +
+
论文ID
原名:Edible exosome-like nanoparticles from portulaca oleracea L mitigate DSS-induced colitis via facilitating double-positive CD4+CD8+T cells expansion
译名:产自于马齿苋的可食用的外泌体样纳米颗粒通过促进CD4+CD8+T细胞扩增减轻DSS诱导的结肠炎
期刊:Jornal of Nanobiotechnology
影响因子:10.2
发表时间:2023.8.31
DOI号:10.1186/s12951-023-02065-0
背 景
溃疡性结肠炎(UC)是一种特发性炎症性肠病(IBD),目前的证据表明,遗传、免疫和环境因素有助于UC的发展,UC的治疗主要依靠非靶向治疗,如5-氨基水杨酸盐、糖皮质激素和免疫抑制剂,以及靶向生物治疗,如抗TNF抗体和JAK信号通路抑制剂等等。然而,与这些治疗相关的不耐受、无应答、不良事件和毒性阻碍了UC患者实现缓解,因此,迫切需要开发出疗效更好、副作用更小的新药。
可食用植物衍生的外泌体样纳米颗粒(PDENs)是来自可食用植物,如生姜、葡萄、胡萝卜和西兰花的纳米大小的囊泡,并且已被鉴定。积累的研究表明,PDENs在植物细胞内的细胞间通信中起着作用,并且具有无毒性、低免疫原性和优良的生物相容性等几个优点,使得其在治疗包括UC在内的各种疾病中具有很高的临床应用前景。马齿苋L.(马齿苋,POL)是一种广泛使用的药用植物,已被证明通过抑制氧化应激反应,如一氧化氮和超氧化物歧化酶,以及降低促炎细胞因子如TNF-α、IL-1的水平,有效地减轻DSS诱导的结肠炎β和IL-6。在这里,作者的研究结果证明了PELNs(POL-derived exosome-like nanoparticles )作为一种新的、天然的和结肠靶向药物的潜力,为管理UC提供了一种有希望的治疗方法。
实验设计
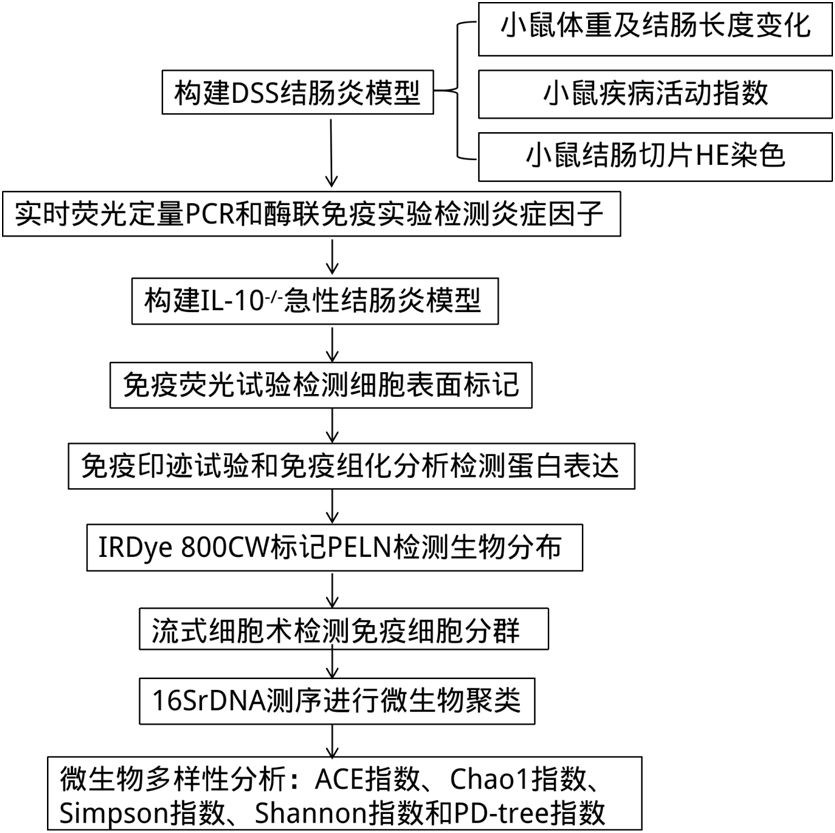
结 果
01
口服PELNs保护小鼠免受DSS诱导的结肠炎
为了研究PELNs的抗炎作用,小鼠分为四组:健康对照组,DSS(dextran sulfate sodium)对照组,PELNs-L组和PELNs-H组,在整个实验中,健康对照组小鼠的体重逐渐增加,而DSS对照组小鼠的体重明显下降(图1b)。然而,与DSS对照组相比,PELN治疗显示出预防体重减轻的潜力(图1b)。值得注意的是,与PELNs-L相比,PELNs-H似乎在防止体重减轻方面更有效(图1b)。同样,PELNs在降低疾病活动指数(DAI)方面发挥了关键作用(图1c)。与DSS对照组相比,PELNs组的DAI显着降低(图1c)。PELNs组DAI与健康对照组相当(图1c)。此外,PELNs显著阻止结肠缩短(图1d,e)。组织学分析,包括苏木精-伊红染色(H&E)和组织学评分,进一步证实PELN减少了免疫细胞的积累和对结肠上皮屏障的损伤(图1f,g)。有趣的是,PELNs-H组的组织学评分明显低于PELNs-L组(图1f,g),表明PELNs-H在治疗小鼠DSS诱导的结肠炎中具有比PELNs-L更有效的抗炎治疗作用。
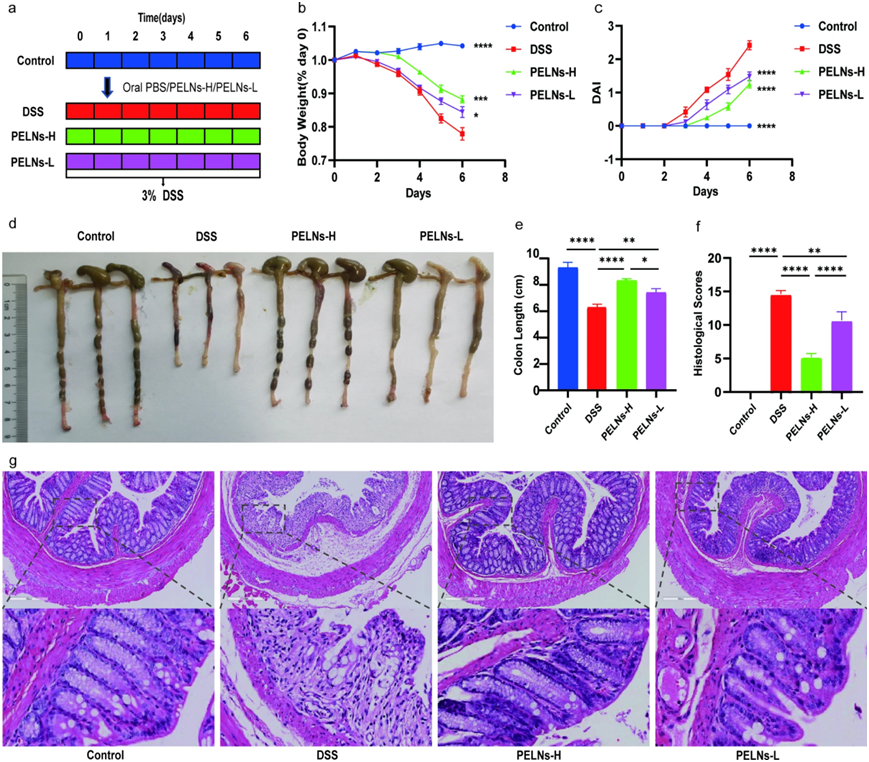
图1:口服PELN可保护小鼠免受DSS诱导的结肠炎。
a,DSS诱导的结肠炎和PELN给药方案; b,体重随时间的变化,标准化为零日体重的百分比; c疾病活动指数(DAI); d、e,结肠长度; f,组织学评分; g,H&E染色结肠切片
众所周知,促炎细胞因子在肠道炎症中起着至关重要的作用。与健康对照组相比,DSS对照组中的促炎细胞因子的水平(IL-6、IL-12、IL-1β和TNF-α)显著升高(图 2a、b、c和d)。然而,用PELNs治疗显著抑制这些促炎细胞因子的表达(图2a、b、c和d)。相反,IL-10,一种抗炎细胞因子,在DSS对照组中表现出与健康对照组相比显著下降,而其水平在PELNs组中显着增加(图2e)。ELISA实验证明,DSS对照组促炎细胞因子分泌水平显著增加(IL-6、IL-12、IL-1β和TNF-α),与中性粒细胞相关的标志物髓过氧化物酶(MPO)也增加(图 2f ,g, 2 h, 2i和 2k)。然而,用PELNs治疗显著降低了这些促炎细胞因子和MPO的分泌水平(图2f ,g, 2 h, 2i和 2k)。同样,PELNs亦促进IL-10的分泌(图2j)。值得注意的是,与PELNs-L相比,PELNs-H在小鼠结肠炎治疗中在减少促炎细胞因子和增加抗炎细胞因子方面表现出更好的效果。
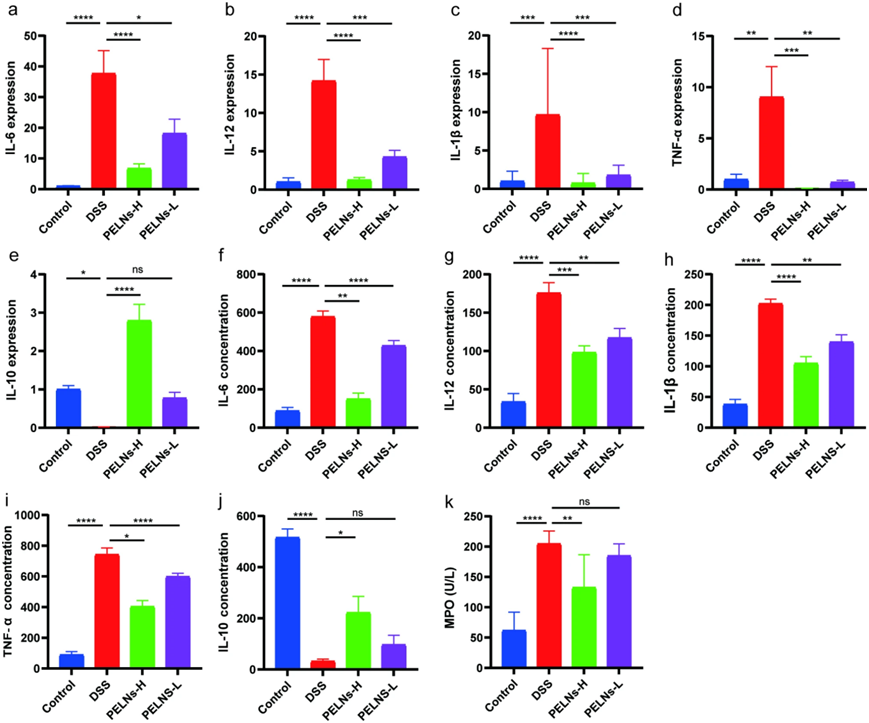
图2:促炎细胞因子和抗炎细胞因子表达谱。
a、b、c、d、e :qRT-PCR检测结肠样本中IL-6、IL-12、IL-1β、TNF-α和IL-10的水平; f、g、h、i、j、k :ELISA检测血清中IL-6、IL-12、IL-1β、TNF-α、IL-10和MPO的表达谱
02
口服PELNs保护IL-10−/− 自发性急性结肠炎
为了进一步评估PELN在急性结肠炎模型中的抗炎作用,喂食IL-10−/− 小鼠,分为健康对照组、DSS对照组和PELNs-H组。令人惊讶的是,用PELNs-H处理的IL-10−/− 小鼠没有发生急性结肠炎。与DSS对照组小鼠相比,PELNs-H治疗有效地防止了体重减轻、DAI、结肠缩短、组织学评分降低和免疫细胞浸润(图3a、b、c、d及 3e)。这些发现突出了PELNs-H在IL-10−/− 小鼠急性结肠炎模型中减轻结肠炎症状的有效抗炎特性。
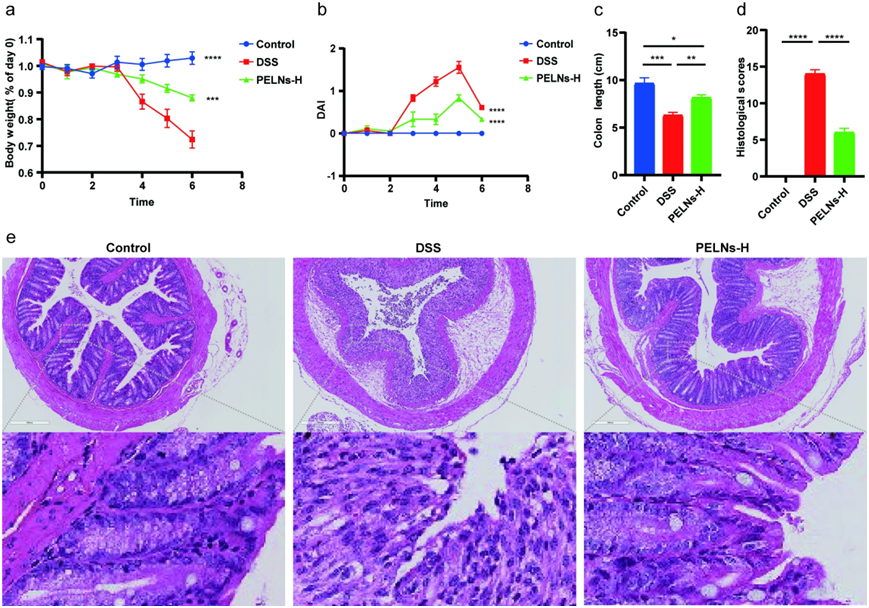
图3:口服PELNs保护IL-10−/− 小鼠自发性结肠炎。
a:体重变化; b:疾病活动指数(DAI); c:结肠长度; d:组织学评分; e:H&E染色结肠切片
03
PELNs在体内分布情况
口服纳米治疗剂在所需结肠中的积累对于发挥针对UC的治疗效果至关重要。为了确定口服给药后PELN的生物分布,用IRDye 800CW标记的PELN(100 mg/g)灌胃3、6、12和24 h。近红外成像显示,IRDye 800CW标记的PELN在结肠中3 h可见,并且在结肠炎小鼠中6 h它们的存在逐渐增加。然而,在结肠中检测到的荧光信号在24 h内稳步下降(图 4a)。值得注意的是,当PELN给与健康小鼠时,在结肠中检测到低荧光信号(图4b)。随后,检查了重要器官(如心脏、肝脏、脾脏、肺和肾脏)中荧光信号的积累,发现在3、6、12和24 h,在用PELNs治疗的结肠炎小鼠和健康对照小鼠的这些器官中检测到很少的荧光信号(图 4a和b)。这一发现表明PELNs选择性靶向治疗小鼠结肠炎的炎症结肠。
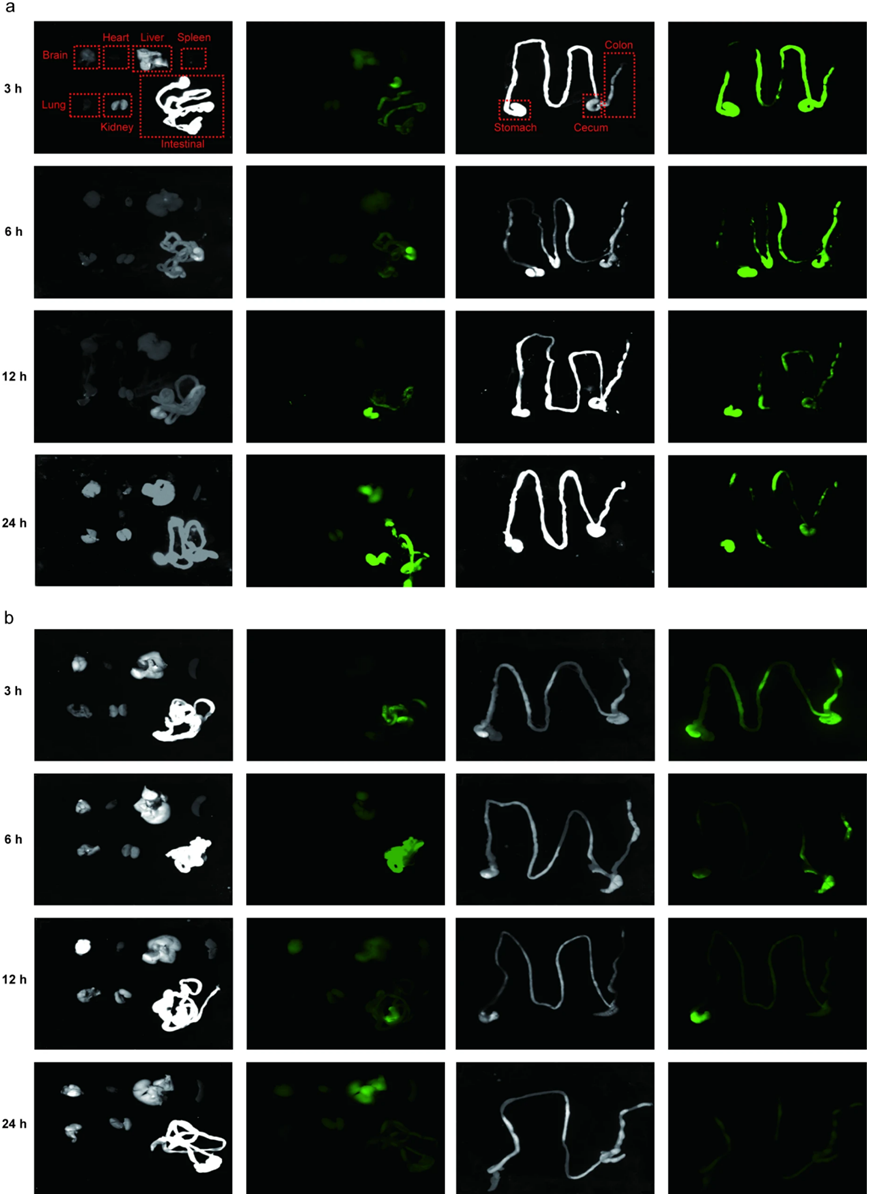
图4:PELN的体内分布。
胃肠道的荧光图像揭示了不同时间点(3,6,12和24 h)口服IRDye 800CW标记的PELN的体内生物分布:(a)急性结肠炎小鼠(b)健康小鼠
04
PELNs明显改变肠道菌群的多样性
16SrDNA测序分析肠道菌群分布。通过计算OTU的数量来评估肠道微生物群的丰度,与结肠炎小鼠相比,PELNs处理后显著增加(5a)。为了进一步评估PELNs对α-多样性的影响,作者检查了五个多样性指数:ACE(图 5b),Chao1 (图5c),PD-tree(图5d),Simpson(图5e),Shannon(图5f)。DSS诱导的结肠炎导致α-多样性的显著下降,PELNs治疗显著增加了α-多样性。通过使用PCA(图5g),PCoA(图5h)和NMDS(图 5i)评估不同组肠道菌群之间β-多样性的差异,作者在所有三种方法中观察到与α-多样性一致的结果。分析表明,PELNs显著改变了结肠炎小鼠的微生物结构,使其更接近健康对照组。总体而言,这些发现表明PELNs治疗调节了结肠炎小鼠肠道菌群的组成和结构,导致α-多样性增加,微生物结构恢复到更健康的状态。
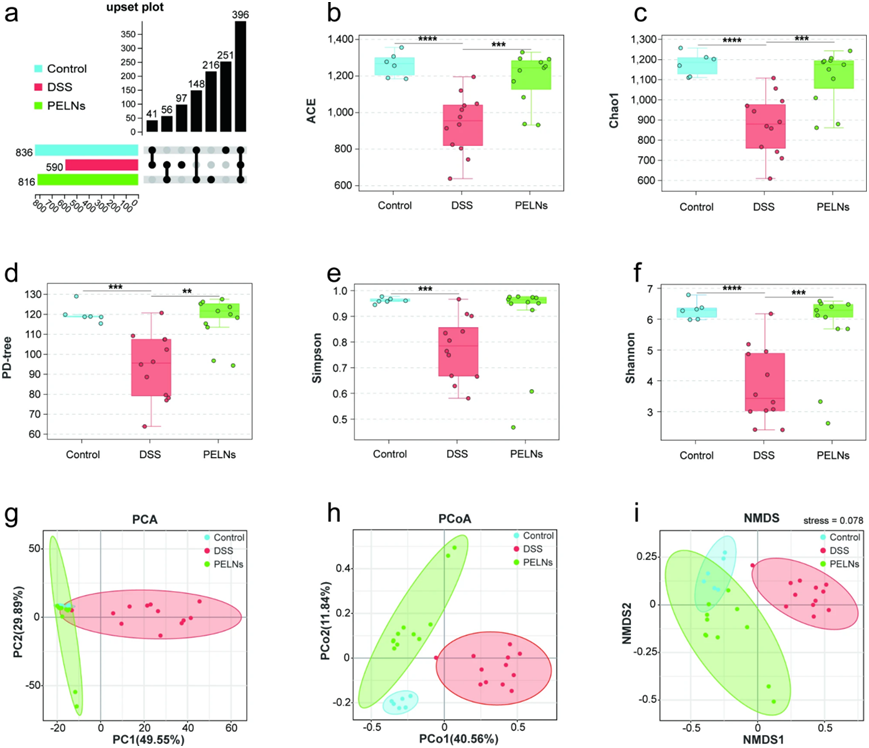
图5:PELNs改变结肠炎小鼠模型肠道菌群的多样性。
a:OTU的端损; b:ACE指数; c:Chao1指数; d:PD-tree; e:Simpson指数; f;Shannon指数; g:主成分分析(PCA); h:PCoA(主坐标分析)。PCoA1和PCoA2之和大于50%,表明差异显著; iNMDS(非度量多维缩放)
05
PELNs改善DSS诱导的优势菌群和微生物结构的显著变化
某些细菌分类群的相对丰度在PELNs处理小鼠和结肠炎组之间存在显著差异(图6a)。 放线菌拉赫诺螺旋科 、 鲁米诺球菌科毛杆菌科、 乳杆菌科 、 摩拉赛菌科、 丹毒菌科 、乳杆菌、 不动杆菌属 和钙乙酸不动杆菌等在PELNs处理的小鼠中显著升高。相反,丰富的蛋白杆菌脱铁杆菌 、 雷克耐尔科 、埃希氏志贺氏菌等减少了。采用Welch’s t检验检测PELNs诱导的微生物变化。分析显示 Firmicutes 和 帕特西杆菌丰度增加(图6b),而 蛋白杆菌 和 脱铁杆菌 丰度下降。值得注意的是,几个菌种的相对比例(图6c),包括拉赫诺螺旋科,、鲁米诺球菌科、蔗糖科、丹毒菌科等显示了显著的增长。另一方面,肠杆菌科,、铁杆菌科和 丹纳菌科等与结肠炎组相比丰度有所下降。此外,在属水平(图 6d),PELNs组表现出较高的相对丰度 。在物种水平(图 6e),菌种的相对比例被PELN大幅提升(图 6e)。
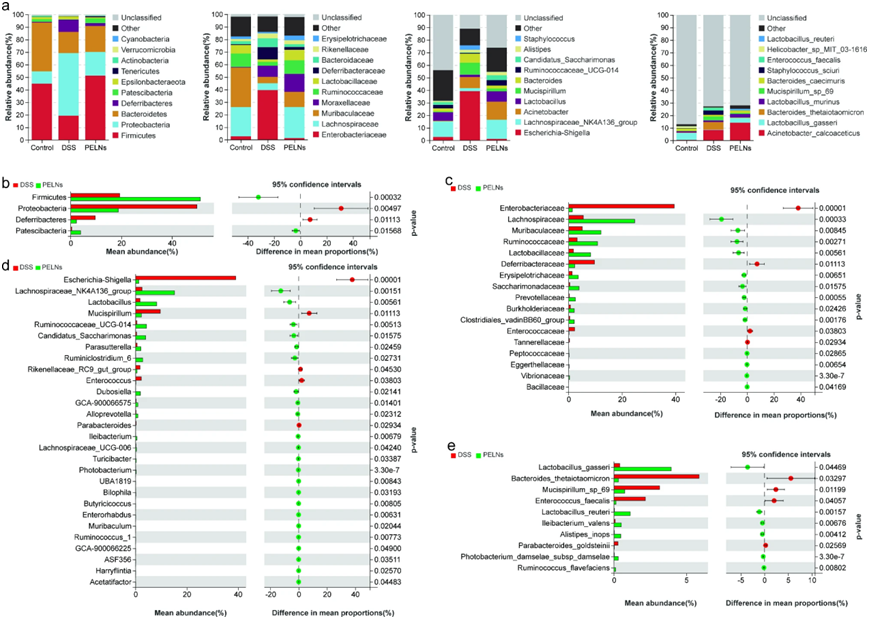
图6:PELNs改变结肠炎小鼠不同水平的肠道微生物群结构。
a:堆叠条形图描绘了每组小鼠肠道菌群的结构。从左到右分为门、科、属和种; b-e:Welch's t检验分析PELNs在门、科、属和种水平介导的微生物变化
06
PELN-Lactobacillus reuteri-吲哚衍生物轴诱导CD4+CD8+ T细胞的分化
已经发现 Lactobacillus reuteri 具有将色氨酸(L-Trp)转化为吲哚衍生物的能力。这些衍生物可以激活常规中的芳基烃受体,导致Zbtb7b蛋白表达下调和常规CD4+ T细胞分化 CD4+CD8+ T细胞(图7a和f)。通过检测OD600处的吸光度值评估 Lactobacillus reuteri的生长水平,结果表明,在静止期和延迟期PELNs组和对照组Lactobacillus reuteri的代谢水平相当,但与对照组相比,PELNs组中分离物的生长在对数期明显更快(图 7b)。此外,与DSS组相比,PELNs处理显著增加了粪便样本中的吲哚衍生物,包括3-甲基吲哚、吲哚乙醇、吲哚丙酸和色胺(图 7c)。CD4+CD8+ T细胞位于肠上皮细胞层中,具有多种功能,包括抑制Th1细胞诱导的肠道炎症,维持肠道粘膜稳态,以及在致病性感染期间抑制促炎性细胞因子的释放。之前的研究中,作者已经证明 UC患者和UC小鼠结肠样本中Zbtb7b表达的显著增加和CD4+CD8+ T细胞数量的显著减少。作者观察到PELNs组Zbtb7b蛋白表达显著降低,如WB分析和IHC分析所证明(图7d和e)。此外,通过FCM测定,PELNs组的CD4+CD8+ T细胞显著高于DSS对照组(图 7g)。同样,免疫荧光分析显示,PELNs组的CD4+CD8+ T细胞显著高于DSS对照组(图7h)。
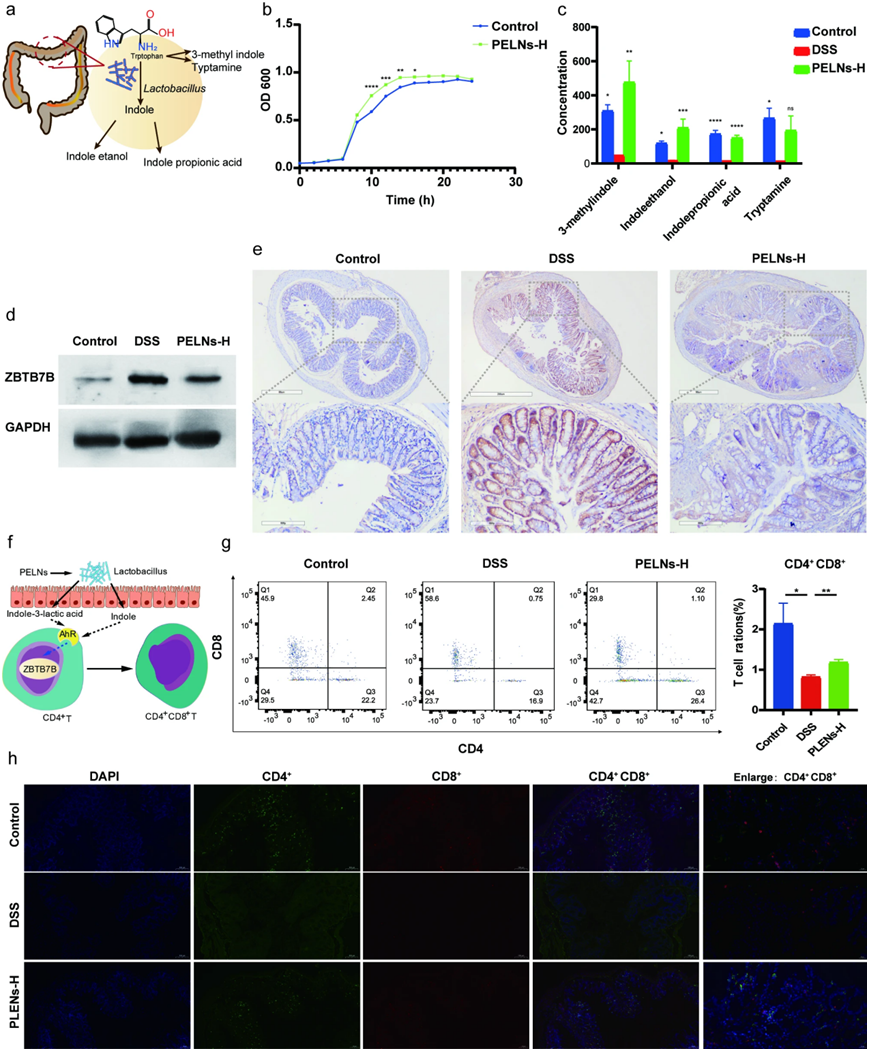
图7:PELNs诱导CD4+CD8+T细胞分化。
a:模式图 :Lactobacillus reuteri 将色氨酸(L-Trp)转化为吲哚衍生物; b:PELNs处理显著增加吲哚衍生物的水平; d、e:通过WB和IHC检测,PELNs处理可显著降低Zbtb7b蛋白水平; f:示意图表示 Lactobacillus reuteri 可以激活常规CD4+ T细胞中的芳基烃受体,导致Zbtb7b蛋白表达下调和常规CD4+ T细胞分化 CD4+CD8+ T细胞; g:流式细胞术检测结肠样本中的CD4+CD8+ T细胞; h:免疫荧光显示结肠样本中的CD4+CD8+ T细胞
07
口服PELN的生物安全性
从每天接受50mg和100mg PELN剂量并为期5天的小鼠中收集血清样本评估口服PELN对重要器官(心、肝、脾、肺、肾)的安全性。使用H&E染色对重要器官进行组织学分析,发现PELNs给药组没有明显的异常或器官损伤迹象(图8a)。此外,血细胞计数、心肌酶、谷氨酸丙酮酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、血清肌酐(CREA)和血清尿素(UREA)与正常对照组相比也无无明显变化(图 8b、c、d和e)
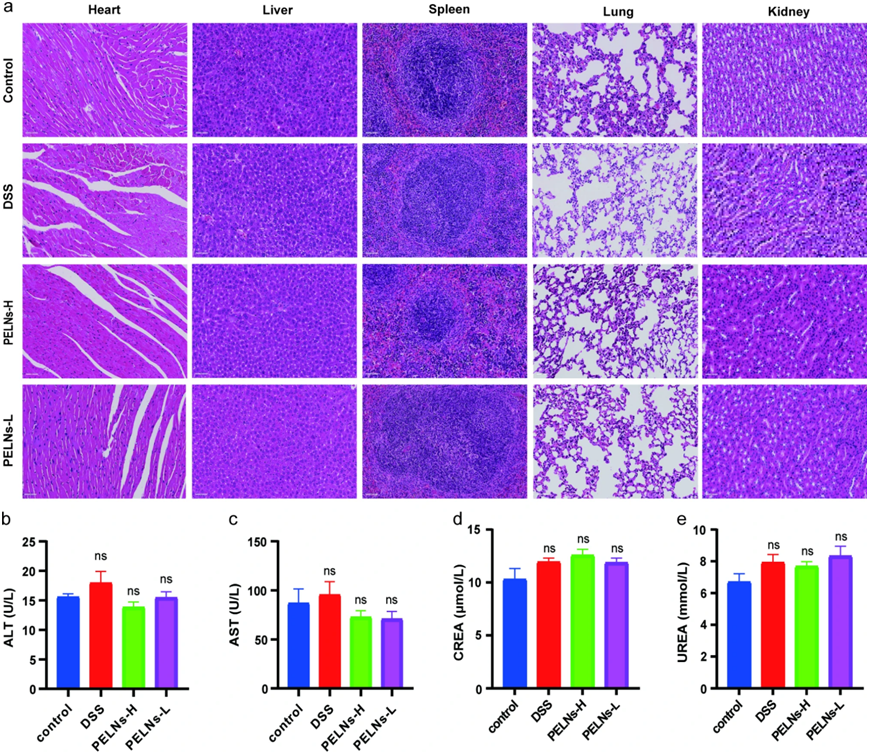
图8:口服PELN的生物安全性。
a:对照组、DSS、PELNs-L和PELNs-H组小鼠重要器官(心、肝、脾、肺、肾)的H&E染色图; b、c:小鼠肝功能检测; d、e:小鼠肾功能检测
+ + + + + + + + + + +
结 论
1. 口服PELNs可有效抑制促炎细胞因子TNF-α、IL-6、IL-12和IL-1β的表达,增加抗炎细胞因子(IL-10)水平,减轻DSS诱导的结肠炎和IL-10−/− 小鼠的急性结肠炎。
2. PELNs处理促进 Lactobacillus reuteri 生长及其代谢物吲哚衍生物水平升高,从而重新编程常规CD4+ T细胞转化为双阳性CD4+CD8+T细胞,并降低促炎细胞因子的水平。
+ + + + +



 English
English


