文献解读|Adv Sci(14.3):H3K27ac 全基因组分析确定TDO2是代谢相关脂肪性肝炎肝病的关键治疗靶点
✦ +
+
论文ID
原名:Genome-Wide Profiling of H3K27ac Identifies TDO2 as a Pivotal Therapeutic Target in Metabolic Associated Steatohepatitis Liver Disease
译名:H3K27ac 全基因组分析确定TDO2是代谢相关脂肪性肝炎肝病的关键治疗靶点
期刊:Advanced Science
影响因子:14.3
发表时间:2024.10.04
DOI号:10.1002/advs.202404224
背 景
代谢功能障碍相关脂肪变性肝病 (MASLD),也称为非酒精性脂肪性肝病 (NAFLD),是一种世界范围内日益流行的慢性肝病,其特征是脂质积聚引起的肝细胞损伤和先天免疫细胞激活的慢性炎症。H3K27ac 是活性增强子的代表性表观遗传标记,但其在MASLD发病机制中的调控机制仍不清楚。
实验设计

结 果
01
H3K27ac是MASLD关键基因调控的代表性组蛋白标记
为了研究基因表达在 MASLD 发病机制中的表观遗传调控,研究团队首先利用健康和 MASLD 患者(GSE112221)的 ChIP-seq 数据来建立组蛋白修饰标记的全基因组模式,包括 H3K4me3(活性启动子)、H3K27ac(活性增强子)和 H3K4me1(活性/平衡增强子)。值得注意的是,H3K27ac 在正常人和患者之间有显著区别(图S1A-B),表明 H3K27ac 在调节疾病状态中起着关键作用。随后,他们整合了来自人类、大鼠和小鼠样本的转录组分析(RNA-seq)数据,鉴定出 256 个跨物种重叠基因,其中 121 个基因在受 MASLD 影响的样本中持续上调,涉及脂质代谢过程(图S1C)。他们进一步分析了这些均一基因的峰值热图,并在所有组蛋白样本中进行了标准化(图S1D-E),证实样本主要根据 H3K27ac 标记的疾病状态进行分组,这证明了 H3K27ac 在调节这些基因在物种间 MASLD 发展中的关键作用。
为了阐明H3K27ac在MASLD中调控这些均一基因的分子机制,他们建立了高脂饮食(HFD)诱导的大鼠MASLD模型。随后,他们整合分析了 H3K27ac ChIP-seq 和 RNA-seq 数据,以确定 MASLD 病理过程中的差异 H3K27ac 峰及其靶基因(图 1A)。首先,他们分析了差异 H3K27ac 峰与其潜在靶基因之间的Pearson相关系数 (PCC),这些靶基因的转录起始位点 (TSS) 位于峰的 1000 kb 窗口内。值得注意的是,总共有 3607 个差异峰-基因相关性既有正相关性也有负相关性,其中包括 400 个 PP 峰基因,1918 个 NN 峰基因,756 个 PN 峰基因和 533 个 NP 峰基因(图 1B)。更有趣的是,他们发现基因和峰并不是简单的“一对一”的关系,即多个增强子可能用于调控一个基因,并且一个峰可能贡献多个基因。他们发现了正常饮食 (ND)和 MASLD组中 ChIP-seq 与 RNA-seq的相关性(图 1C-D),表明两组中的各种基因均由 H3K27ac 介导。然后,他们对 PP 和 NN 的差异 H3K27ac 峰基因进行功能富集分析,以更好地评估 HFD 诱导的 MASLD 引起的功能改变。有趣的是,使用 DAVID 数据库,正常和 MASLD 肝脏之间差异高乙酰化峰基因在脂质代谢过程(包括“甘油三酯稳态”、“胆固醇代谢过程”和“脂蛋白代谢过程”)中显著富集(图 1E)。 KEGG 通路中还发现了“类固醇激素生物合成”、“代谢通路”和“PPAR 信号通路”(图 1F)。综上所述,这些结果不仅揭示了 H3K27ac 标记的增强子和转录组变异在 HFD 诱导的 MASLD 大鼠肝脏中发生了显著变化,而且进一步强调了 H3K27ac 通过失调脂质代谢过程在 MASLD 发病机制中调控关键基因的关键作用。

图S1. H3K27ac是MASLD中调控关键基因的具有代表性的组蛋白标记物。
(A) H3K4me3、H3K27ac和H3K4me1在正常和MASLD相关患者之间的差异峰数。(B) 热图显示正常和肝硬化患者转录起始位点(TSS)附近H3K4me3、H327ac和H3K4me1标记的增强子密度±5 kb。(C) 维恩图说明了MASLD和对照之间差异表达基因的重叠。(D-E) H3K27ac、H3K4me1和H3K4me3的峰值热图。

图1. HFD 诱导脂质代谢基因中 H3K27ac 标记的增强子发生强烈畸变。
(A) 识别 MASLD 进展中核心表观遗传和遗传生物标志物的策略示意图。(B) 全基因组“四向”图显示显著变化的基因。(C) ND 组 ChIP-seq 的 H3K27ac 峰与 RNA-Seq 的基因表达呈正相关。(D) MASLD 组 ChIP-Seq 的 H3K27ac 峰与 RNA-Seq 的基因表达呈正相关。(E) 过度代表 PP 和 NN 假定峰靶基因的生物学过程。(F) KEGG 通路分析。
02
TDO2在 MASLD 中通过 H3K27ac 修饰表观遗传激活
接下来,他们试图研究正常和 MASLD 大鼠中正相关 H3K27ac 峰基因过度表达的关键基因和通路。有趣的是,他们将TDO2筛选出来,其成为最显著的疾病相关 H3K27ac 峰基因(图 2A-G),并且多个代谢通路中富集(图 1F),以及不同物种之间 H3K27ac 诱导的显著均一基因之一(图S1C)。值得注意的是,他们进一步验证了MASLD组中Chr2:180025335-180029021的峰区域具有较高的H3K27乙酰化密度,该区域定义为TDO2的假定增强子区域(Chr2:180897011-180914940)(图 2C),经Cistrome数据库(登录号:GSM2360941)在人肝组织中的验证证实(图 2D)。Pearson相关性分析也显示MASLD中Tdo2和H3K27ac 之间存在正相关性(图2E-G)。此外,他们观察到姜黄素(H3K27ac 抑制剂)以剂量依赖性方式诱导TDO2 mRNA 和蛋白质水平下降(图2H-I),进一步证实 H3K27ac 增强子是调控TDO2中枢靶基因在 MASLD 病理过程中的重要调控元件。此外,在人、大鼠和小鼠的肝脏中,TDO2的表达明显高于其他组织。在肝脏的各个细胞中,肝细胞占TDO2细胞定位的大部分。因此,TDO2具有在肝细胞中聚集的表达特异性,在 H3K27ac 的表观遗传调控下在 MASLD 中上调,可能在肝脏病理生理中发挥关键作用。

图2. Tdo2是 MASLD 中由 H3K27ac 表观遗传激活的关键因子。
(a) ChIP-seq 和 RNA-seq 数据的热图显示 ND 和 MASLD 组之间的 H3K27ac 富集和转录水平差异。(b) ChIP-seq 和 RNA-seq 中前 20 个 H3K27ac 峰基因的变化条形图。 (C) Tdo2上 H3K27 乙酰化的差异密度。(D) H3K27ac 是肝脏中TDO2基因的组蛋白修饰标记。(E) 使用 ChIP-seq 数据比较 MASLD 大鼠与 ND 大鼠中Tdo2基因的 H3K27ac 密度。(F) MASLD 大鼠相对于 ND 个体的Tdo2 mRNA 表达水平。(G) Tdo2表达水平与 H3K27ac 峰(chr2:180025335-180029021)密度之间的相关性。(H-I) 分别通过 qRT-PCR 和免疫印迹法测定用指定浓度的姜黄素 (Cur) 处理的 HepG2 和 Huh-7 细胞中TDO2的 mRNA 和蛋白质水平。
03
YY1通过增强H3K27ac修饰促进TDO2的转录激活
进一步研究了MASLD模型中TDO2 H3K27ac修饰激活的机制。他们首先基于UCSC (http://genome-asia.ucsc.edu) 和PROMO (http://alggen.lsi.upc.es/) 数据库,预测了与TDO2启动子和增强子结合的转录因子TF。筛选出了与TDO2启动子和增强子都相关的前20个重叠TF(图S7A),其中Yin Yang 1 (YY1)是最相关的TF(图S7B)。为了进一步研究YY1和TDO2在人、小鼠和大鼠之间的保守性,使用Uniprot数据库(https://www.uniprot.org/)的TDO2和YY1具有高度的序列一致性(图S7C-D)。总共鉴定出45个重叠的TF可能在三个不同物种中同时靶向TDO2的启动子和增强子(图S7E),并且YY1是最相关的TF(图S7F)。此外,Cistrome数据库也证实YY1是肝脏组织中TDO2的潜在转录调控因子(图S7G)。
随后进行一系列实验利用生物信息学方法验证预测结果。首先证实在过表达YY1的HepG2细胞中,用OA(油酸)处理后,YY1和TDO2的mRNA和蛋白质水平上调(图3A-B)。相反,在用OA处理的 YY1耗尽的Huh-7细胞中,YY1和TDO2的表达均降低,无论是RNA还是蛋白质水平(图3C-D)。此外,将含有潜在野生型或突变型YY1结合位点的TDO2启动子序列(2 kb)克隆到pGL3报告质粒中(图 3E),野生型TDO2启动子来源的报告基因活性依赖于YY1,但YY1结合位点的突变消除了YY1对TDO2启动子来源的报告基因活性(图3F-G)。此外,Cistrome数据库的ChIP-seq数据显示H3K27ac在HepG2和Huh-7细胞中 TDO2基因区高度富集(图3H),在人肝组织中 TDO2启动子区也观察到了明显的YY1结合峰(图3I),这表明TDO2受YY1和H3K27ac的转录调控。有趣的是,ChIP实验显示,在强制表达YY1的HepG2细胞中TDO2的H3K27ac水平增加(图 3J),而在YY1敲除后,Huh-7细胞中H3K27ac的富集降低(图 3K)。综上所述,这些数据强调了YY1通过增强H3K27ac修饰在促进TDO2转录激活中的关键作用(图 3L)。

图S7. YY1是TDO2的潜在转录因子。
(A) 前20位预测TF与TDO2的增强子和启动子结合。(B) 前20名TF的PPI网络。(C-D) 基于Uniprot数据库(https://www.uniprot.org/)的人、大鼠和小鼠TDO2和YY1序列保守性分析。(E) 分别为人(蓝色)、小鼠(红色)和大鼠(绿色)的TDO2推定TF的维恩图。(F) 通过构建重叠45个TF的PPI网络验证YY1的同源性。(G) 根据Cistrome数据库(登录号:ENCSR994YLZ_1)鉴定Y Y1为TDO2基因的潜在调控因子。

图3. YY1通过调节 H3K27ac诱导TDO2上调。
(a-D) YY1 和 TDO2 的 mRNA 和蛋白质水平。(E) TDO2 DNA 启动子区中野生型和突变型YY1结合位点的示意图。(F-G) 通过荧光素酶报告基因检测确定YY1对野生型或突变型TDO2启动子活性的调节。(H) ChIP-seq 数据显示 HepG2 和 Huh-7 细胞中 TDO2启动子区周围 H3K27ac 的富集。(I) ChIP-seq 数据显示YY1在人肝脏中TDO2启动子区周围的富集。(J-K) 通过 ChIP 分析确定YY1对 HepG2 和 Huh-7 细胞中TDO2启动子区周围 H3K27ac 富集的调节。(L) 通过 ChIP 分析确定YY1对 HepG2 和 Huh-7 细胞中TDO2启动子区周围 H3K27ac 富集的调节。
04
在肝脂肪变性患者和肝细胞脂肪变性模型中观察到TDO2升高
为了研究TDO2在肝细胞脂肪变性中的功能性作用,他们首先检测了其在 MASLD 中的表达模式。GEO 数据分析显示,与健康正常人相比,MASLD 患者肝脏组织中TDO2表达升高(图 4A-B),与低 TG 水平的小鼠相比,高 TG 水平小鼠肝脏组织中 TDO2表达水平升高(图4C)。此外,OA 以剂量依赖性方式诱导 HepG2 和 Huh-7 细胞中的 TDO2表达(图4D-G)。与体外细胞脂肪变性模型的结果一致,与 ND 喂养的大鼠相比,HFD 喂养的大鼠也表现出更高的肝脏TDO2表达(图4H-J)。总之,这些发现表明TDO2上调与肝脏脂肪变性有关,支持其作为 MASLD 背景下的生物标志物或治疗靶点的潜在作用。
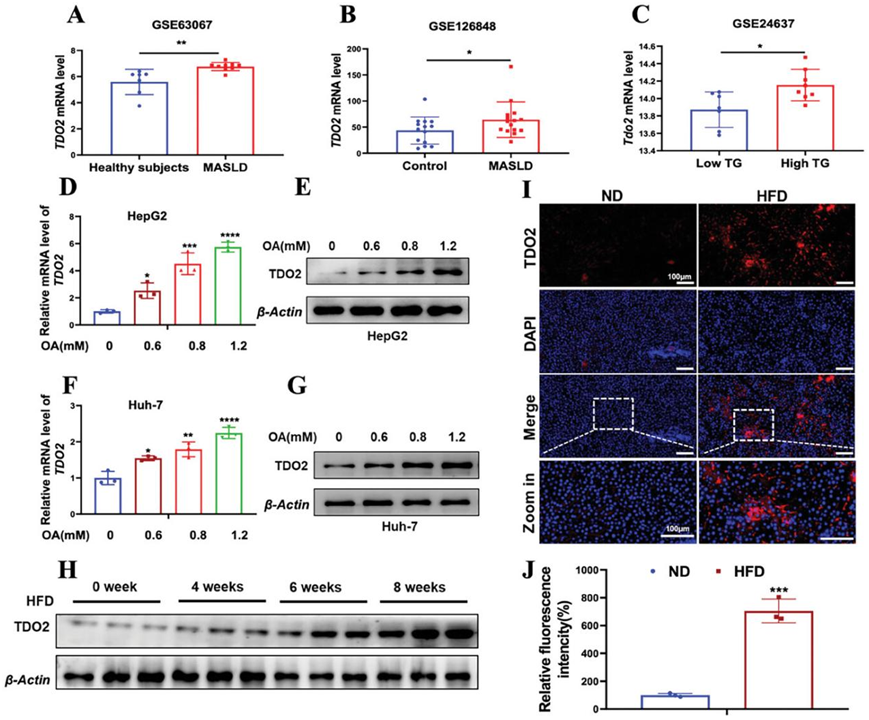
图4. 在肝脏脂肪变性患者和模型中,TDO2表达增加。
(a-b) GSE63067和 GSE126848中 MASLD 和健康患者肝脏中 TDO2 mRNA 表达。(C) GSE34637 中低血清 TG 和高血清 TG 小鼠肝脏中 Tdo2 的 mRNA 水平。(D-G) TDO2 的 mRNA 和蛋白质水平。(H) TDO2 的蛋白质水平分析。(I-J) 代表性免疫荧光染色和量化喂食 ND 或 HFD 的大鼠肝组织切片中 TDO2 表达。
05
敲低TDO2可预防 HFD 诱发的大鼠肝脂肪变性
为了进一步确定Tdo2在肝脏脂质积累中的病理作用,将携带针对TDO2的 shRNA 的慢病毒(shTdo2)通过尾静脉注射到 HFD 诱导的大鼠体内。在注射 sh Tdo2慢病毒后,HFD 诱导的大鼠肝组织中升高的 TDO2 表达显著降低。功能上,肝脏的外观在Tdo2抑制后明显改变,从 HFD 诱导的浅黄色(边缘较厚、表面油腻)变为深红色(边缘更锋利、表面更光滑)(图 5A)。此外,H&E 染色(图5B)、油红 O 染色(图 5C)和透射电子显微镜(图 5D)证明,注射 sh Tdo2可显著减少 HFD 诱导的大鼠肝脏中的严重脂肪变性和脂质积累。此外,TDO2敲低导致 HFD 喂养大鼠的体重和肝脏指数增加均显着降低(图 5E-F)。此外,HFD 诱导大鼠血清 ALT、AST、TC、TG、LDL-C 水平升高和血清 HDL-C 水平降低因TDO2耗竭而明显逆转(图 5G-L)。因此,肝脏TDO2的损失减轻了 HFD 喂养大鼠的肝脏脂肪变性。
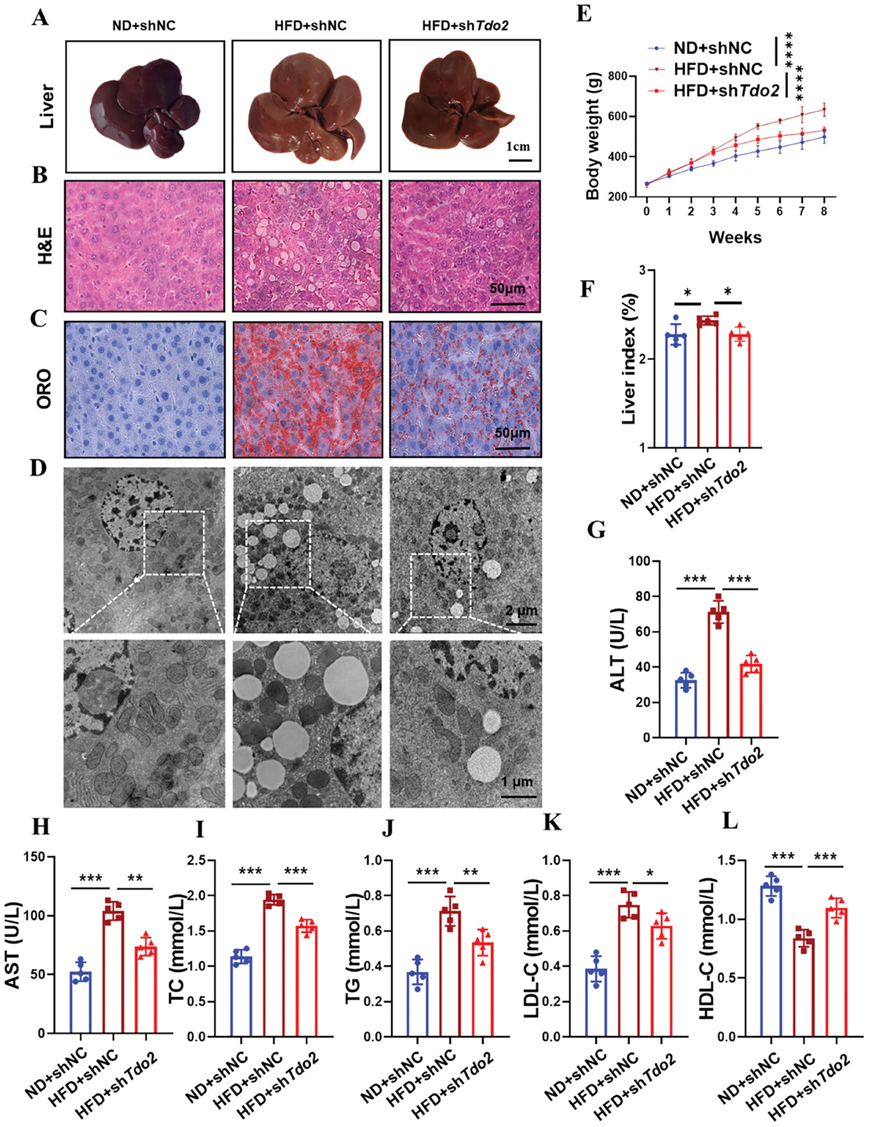
图5. 敲除Tdo2可减轻HFD诱导的大鼠脂肪肝。
(a) 代表性肝组织。(b-C) 肝组织切片的H&E和油红O染色。(D) 肝组织切片透射电子显微镜超微结构。(E) 每周测量体重。(F) 每组大鼠处死后测量肝脏指数。(G-L) 各组大鼠血清 ALT、AST、TC、TG、LDL-C 和 HDL-C 水平。
06
TDO2促进肝脂肪变性模型中巨噬细胞M1极化
据报道,诱导炎症性M1巨噬细胞极化可促进MASLD的发展。为了探索TDO2是否通过改变巨噬细胞极化来促进脂质积累,他们建立了OA诱导的HepG2/Huh-7细胞和THP-1衍生的巨噬细胞共培养体系(图 6A)。鉴于HepG2细胞中内源性TDO2水平较低,而Huh-7细胞中内源性TDO2水平较高,因此在HepG2细胞中过表达TDO2,而在Huh-7细胞中则敲除TDO2,以便随后进行功能和机制研究。正如预期的那样,qRT-PCR 分析表明,在 HepG2 细胞中过表达TDO2显著增强了与 OA 诱导共培养的巨噬细胞中 M1 标志物(HLA-DR和TNF-α)的表达(图6B),而用TDO2 siRNA 转染的 Huh-7 细胞对 M1 标志物的表达表现出相反的影响(图 6C)。免疫荧光染色表明,当与添加 OA 的过表达TDO2的 HepG2 细胞共培养时,巨噬细胞中的 iNOS 蛋白水平增强(图6D-E),但当与TDO2消耗的 Huh-7 细胞共培养时,iNOS 蛋白水平受到抑制(图 6F-G)。流式细胞分析表明,在HepG2细胞中强制表达TDO2可进一步促进OA引起的 CD86+巨噬细胞百分比的增加(图6H-I),而在Huh-7细胞中敲低TDO2可降低OA引起的CD86+巨噬细胞百分比的增加(图 6J-K)。此外,敲除TDO2可显著抑制HFD喂养大鼠肝组织切片中iNOS表达的增加(图 6L-M)。
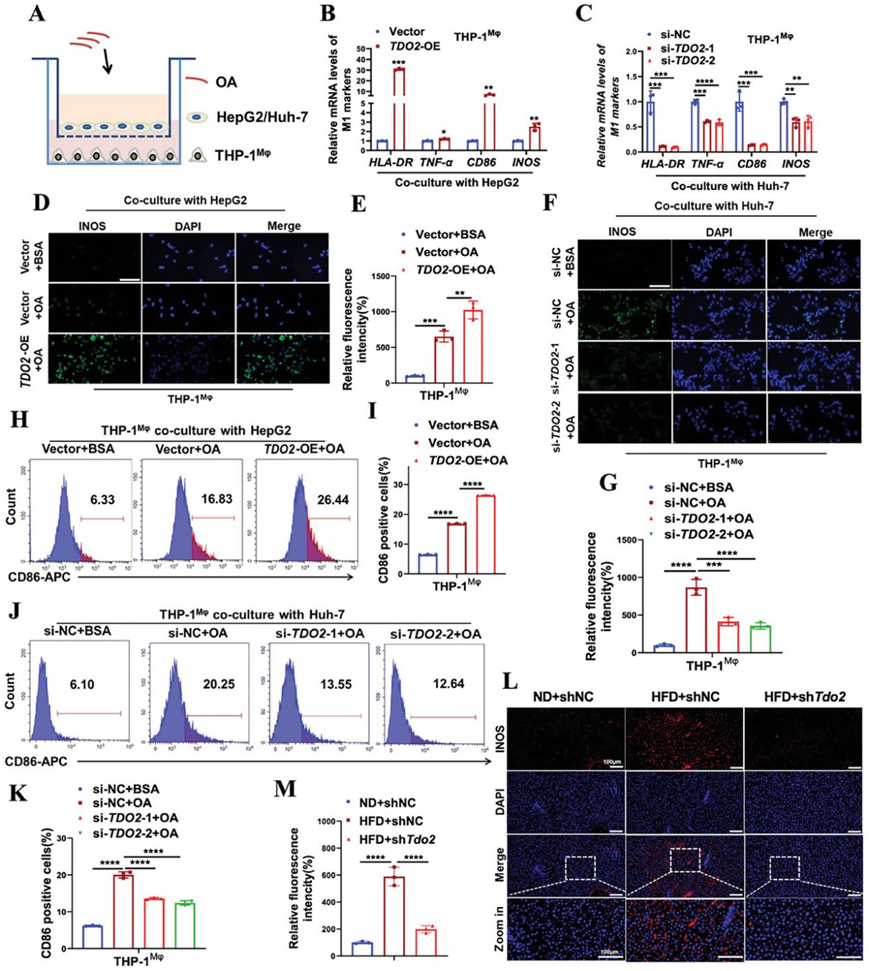
图6. TDO2促进肝脂肪变性模型中巨噬细胞的 M1 极化。
(A) 共培养系统示意图。(b-C) M1 标志物(HLA-DR和TNF-α)的 mRNA 水平。 (D-G) 代表性免疫荧光染色和定量巨噬细胞中的 iNOS 表达。(H-K) 流式细胞分析。(L-M) 代表性免疫荧光染色和 iNOS 表达量化。
07
TDO2激活NF-κB通路促进巨噬细胞M1极化
为了探究TDO2如何促进巨噬细胞 M1 极化,他们在共培养系统上室收集了TDO2耗尽的 Huh-7 细胞及其阴性对照,然后对其进行 RNA-seq 分析。通过邻接 (NJ) 树和主成分分析 (PCA) 以及 Spearman 相关系数对样本间 RNA-seq 数据的可重复性进行分析,进一步证实了数据的有效性以供进一步分析。在 19245 个基因中,共有 185 个鉴定为差异表达基因 (DEG),其中 108 个下调,77 个上调(图 7A-B)。随后,他们进行功能富集分析,发现免疫细胞的增殖、分化和活化具有过度代表性(图 7C)。为了进一步了解生物学过程和通路,进行了GSEA以进一步识别DEG富集的潜在靶点。其中,脂质代谢过程、类固醇代谢过程和中性粒细胞胞外陷阱形成显著富集(图 7D-F)。此外,KEGG数据库显示NF-κB通路为典型信号通路(图 7G-H),它是经典的促炎信号通路,并且还是巨噬细胞M1极化的驱动因素。进一步的验证实验表明,OA处理后Huh-7细胞中p-NF-κB和p-iκBa蛋白水平的升高由于TDO2的耗竭而显著降低,而TDO2过表达的HepG2细胞则表现出相反的趋势(图 7I-J)。据报道,KYN/AHR轴介导TDO2激活NF-κB信号通路,TDO2的过表达增强了用OA处理的HepG2细胞中KYN和AHR水平的升高,而OA处理后Huh-7细胞中KYN和AHR水平的升高由于TDO2的消耗而显著降低。此外,KYN促进,而AHR抑制剂(CH-223191)降低了OA处理后肝细胞中p-NF-κB和p-iκBa升高的蛋白水平。他们证明OA以剂量依赖性方式诱导HepG2和Huh-7细胞中AHR,p-NF-κB和p-iκBa的蛋白水平,以及在MASLD建模过程中以不同周数HFD喂养的大鼠肝组织中AHR,p-NF-κB和p-iκBa的蛋白水平。此外,在sh Tdo2慢病毒处理后,HFD喂养的大鼠肝组织中升高的AHR,p-NF-κB和p-iκBa蛋白水平显著降低。因此,这些结果表明TDO2通过激活 KYN/AHR/NF-κB 信号通路使巨噬细胞偏向 M1 极化,参与肝脏脂肪变性过程。

图7. TDO2激活NF-κB通路促进巨噬细胞M1极化。
(a) si Tdo2和siNC组之间显著差异表达基因的火山图。(b) si Tdo2和siNC组之间差异表达基因的转录谱。(C)炎症反应网络。(D-F) 基因集富集分析(GSEA)。(G) KEGG通路分析。(H) 桑基图显示si Tdo2组中显著下调的基因富集的前三条通路。(I-J)免疫印迹分析。
+ + + + + + + + + + +
结 论
本文对高脂饮食(HFD)诱导的 MASLD 模型中的 H3K27ac 活性和转录组分析进行了全基因组比较研究。在 MASLD 大鼠中观察到 H3K27ac 密度显著增强,调控转录组发生大量改变。基于 ChIP-seq 和 RNA-seq 的综合分析,TDO2是脂质异常积累的关键因子,由 YY1 促进的 H3K27ac 转录激活。此外,TDO2耗竭可有效预防肝脏脂肪变性。在机制方面,TDO2激活 NF-κB 通路促进巨噬细胞 M1 极化,代表 MASLD 进展中的一个关键分子事件。这项研究从表观遗传和遗传角度揭示了TDO2及其潜在机制在 MASLD 发病机制中的关键作用。靶向 H3K27ac- TDO2- NF-κB 轴可能为异常脂质积累的发病机制提供新的见解。
+ + + + +



 English
English


