文献解读|Nat Commun(14.7):MYT1L 缺乏会损害皮质发育过程中的兴奋性神经元轨迹
✦ +
+
论文ID
原名:MYT1L deficiency impairs excitatory neuron trajectory during cortical development
译名:MYT1L 缺乏会损害皮质发育过程中的兴奋性神经元轨迹
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.27
DOI号:10.1038/s41467-024-54371-2
背 景
降低神经元特异性转录因子 MYT1L(髓鞘转录因子1)功能的突变与综合征性神经发育障碍有关。MYT1L 用作成纤维细胞到神经元转分化中的促神经因子,据推测会影响神经元的特化和成熟,但尚不清楚哪些神经元类型受 MYT1L 缺失的影响最大。
实验设计
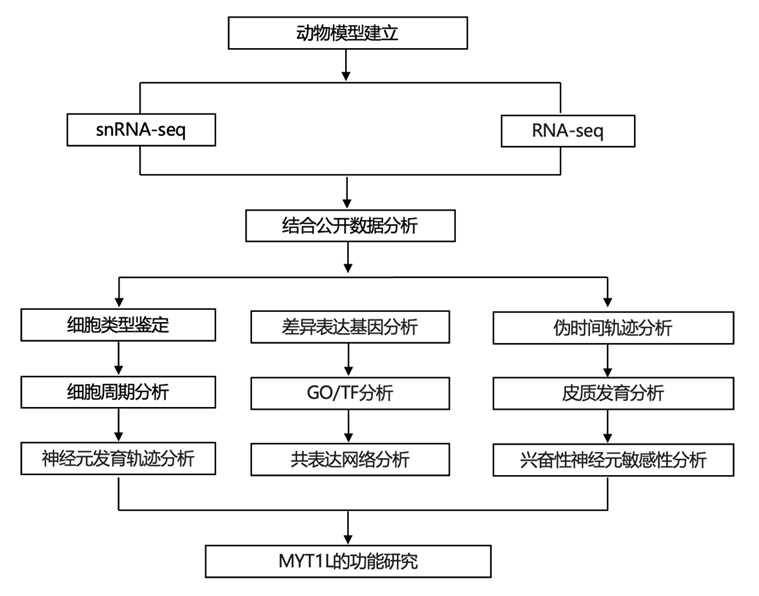
结 果
01
MYT1L 的缺失会扰乱兴奋性神经元和抑制性神经元的比例
为了表征 MYT1L 在神经发生高峰期的作用并了解 MYT1L 单倍体不足和缺失对细胞命运指定和成熟的急性后果,研究团队对来自胚胎第 14 天 (E14) MYT1L 敲除 (KO)、杂合(Het) 和野生型 (WT) 动物发育前脑的 216830 个细胞核进行了单细胞核转录组分析(snRNA-seq)(图 1A-B)。他们发现细胞类型在所有基因型中都有很好的代表性(图 1C-F),鉴定出代表7大类神经细胞类型的26个聚类,进一步分为3种放射状胶质细胞亚型(Hes1和Nestin阳性)、3种兴奋性神经元的中间祖细胞亚型(Neurog2和Eomes阳性)、3种抑制性中间祖细胞亚型(Dlx1和Nkx2.1阳性)、8种兴奋性神经元亚型(Neurod6和Tbr1阳性)、9种抑制性神经元亚型(Gad1和Gad2阳性)、Cajal-Retzius细胞、少突胶质细胞祖细胞和小胶质细胞(图 1C-G)。他们根据细胞周期阶段标志基因的表达分配细胞周期评分,并证实祖细胞大多处于G2M或S期,而有丝分裂后神经元处于G1/G0期并表达MYT1L(图 1H-I)。祖细胞分离成两个不同的群体,产生了不同的兴奋性和抑制性神经元发育轨迹。这种细胞多样性概况表明,他们捕捉到了一个涵盖分化和成熟过程的发育窗口,可以研究 MYT1L 在发育中的 E14 皮质中缺失的分子和细胞后果。
由于 MYT1L 在神经发生过程中几乎在所有神经元中都高度表达(图 1I),他们旨在评估其缺乏对整体细胞类型比例的短期影响,观察到有丝分裂后未成熟兴奋性神经元(Im ExN_3)、深层兴奋性神经元(Im L5-6 ExN_1、Im L5-6 ExN_2、L5-6 ExN_1、L5-6 ExN_2 和 Im L6 ExN)、未成熟抑制性神经元(Im InhN_3)和特定亚型抑制性神经元(体感皮层 (SI)、Darpp32 + D1-D2 和 CEA-BST)的丰度出现细微但具有统计学意义的破坏(图 1J)。放射状胶质细胞 (RG) 和抑制性中间祖细胞 (InhIP) 的比例大多不受 MYT1L 缺失的影响。然而,与 WT 相比,RG_2 和 InhIP_1 聚类中的 Het 和 KO 祖细胞在 G0/G1 期的比例更高,而在 S 期的比例有下降趋势(图 1J)。这支持了以下假设:MYT1L 的缺失会降低细胞增殖,扰乱正常的皮质发育,并可能导致小头畸形12。可能位于脑室下区 (SVZ) 的非循环未成熟兴奋性神经元 (Im ExN_3) 是兴奋轨迹中发育最不成熟的有丝分裂后神经元,与 WT 相比,KO 中的丰度有所增加,这可能是由于发育中的神经元过早分化并过早做出细胞命运决定。
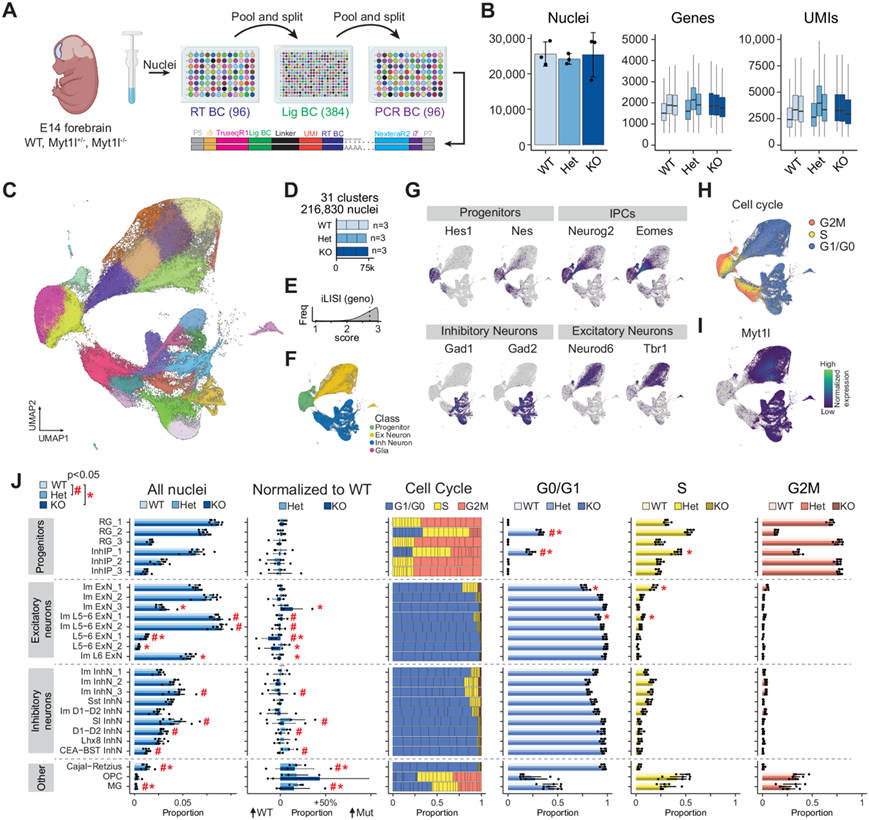
图1. MYT1L 动物 E14 前脑的snRNA-seq。
(A) 示意图显示了前脑组织的解剖、细胞核的分离、大规模并行条形码和 snRNAseq 文库的生成。(B) 总体文库统计数据。(C) UMAP) 显示来自 E14 MYT1L WT、Het和 KO动物前脑的 216830 个细胞核,按细胞类型着色。(D) 条形图显示生物重复中每种基因型的细胞核总数。(E) 直方图显示局部逆辛普森指数 (LISI) 得分,中位数为 2.7,表明基因型混合良好且整合良好。(F) 所有细胞核的UMAP按细胞类别进行颜色编码。(G) 祖细胞、中间祖细胞 (IPC)、抑制性神经元和兴奋性神经元的聚类标记。(H) 所有细胞核的UMAP按基于细胞周期基因表达的细胞周期评分进行颜色编码。(I) UMAP特征图显示 MYT1L 在有丝分裂后兴奋性和抑制性神经元中的表达。(J) 每个注释细胞聚类中细胞核的平均±SEM 相对比例。
02
MYT1L 的缺失会破坏兴奋性神经元的发育
他们进行了差异表达分析,以分析每种细胞类型的分子特征,并确定哪些亚型由于 MYT1L 缺乏而表现出最显著的转录变化,确定了 WT 和 KO 之间 900 个独特的差异表达基因 (DEG),与 WT 相比,KO 聚类中 600 个持续上调,285 个持续下调(图 2A)。值得注意的是,深层兴奋性神经元即使在降采样后也含有大多数 DEG,这表明它们对 MYT1L 缺失具有特殊的敏感性。为了确保这不是由于基因捕获率不同导致的敏感性差异,他们确认了 DEG 的数量与检测到的基因数量无关。不表达 MYT1L 的祖细胞没有显示 DEG,这表明 MYT1L 缺乏的影响是 MYT1L 表达细胞固有的。
鉴于 MYT1L 纯合子无法在出生后存活,而这种人类疾病是由单倍体不足引起的,他们还分析了 Het。WT 和 Het 之间的成对伪批量分析显示,所有细胞类型中只有 5 个 DEG。DEG 的明显缺乏可能是由于E14 是一个动态分化期,其中细胞可能处于沿着发育轨迹的不同细胞状态并且不同步,导致聚类内基因表达的高度可变性。因此,他们没有进行成对比较,而是将功能等位基因的数量建模为序数因子,并应用似然比检验来评估随 MYT1L 基因剂量变化而变化的情况。这可以深入了解这种调控模式对于激活和抑制的基因是否相同,这可能表明哪种功能对这种疾病最为关键。他们将 KO 中上调最多的 414 个基因归类为 MYT1L 抑制基因,而 WT 中上调最多的 232 个基因则作为 MYT1L 激活基因。MYT1L 抑制基因比 MYT1L 激活基因表现出更大的基因剂量敏感性(图 2B),即使丢失一个 MYT1L 等位基因也会上调。
为了评估某种特定细胞类型是否驱动了先前在 E14 MYT1L Het 小鼠皮层12中观察到的未成熟转录特征,他们对每个聚类中的 DEG 进行了GO富集分析。MYT1L 抑制的基因在发育、神经元迁移和细胞命运决定通路中富集,尤其是在未成熟和深层兴奋性神经元聚类中(图 2C)。相反,MYT1L 激活的基因参与突触组织、轴突形成以及神经递质的分泌和运输(图 2D)。总之,这表明 MYT1L 的缺失会导致不成熟的发育转录状态,从而进一步证明抑制发育基因对于确保神经元正常成熟至关重要。
接下来,他们将DEG 与年龄和区域匹配的 E14 前脑 MYT1L CUT&RUN 数据集整合在一起,该数据集对 480 个基因的启动子序列内的 560 个高置信度 MYT1L 结合位点进行了分类,以确定 MYT1L 激活和抑制的基因是否是 MYT1L 的直接或间接靶标。在 55 个差异表达的 MYT1L 靶标中,与 WT 相比,KO 中有 42 个上调,13 个下调,这强化了 MYT1L 作为转录抑制因子的主要作用。此外,差异表达的 MYT1L 靶标显著富集转录因子 (TF) (图 2E),表明 DEG 主要由 MYT1L 缺乏的间接影响驱动。
为了深入了解上游调节因子,他们使用 SCENIC构建了共表达网络并识别了调节子,即假定的 TF 调节因子及其推断的靶基因的模块。他们在 WT 细胞中鉴定了 984 个调节子,其中 171 个调节子根据调节子特异性评分 (RSS) 富集了某些细胞类型特异性活性(图 2F)。虽然 MYT1L 的缺失并没有显著破坏推断的共表达网络结构,但 171 个调节子中有 27 个(16%)出现了差异表达,主要出现在兴奋性神经元中(图 2G)。这证明 MYT1L 可以是一种转录调节因子,不仅影响其直接靶标,还影响基因网络内的下游间接靶标。
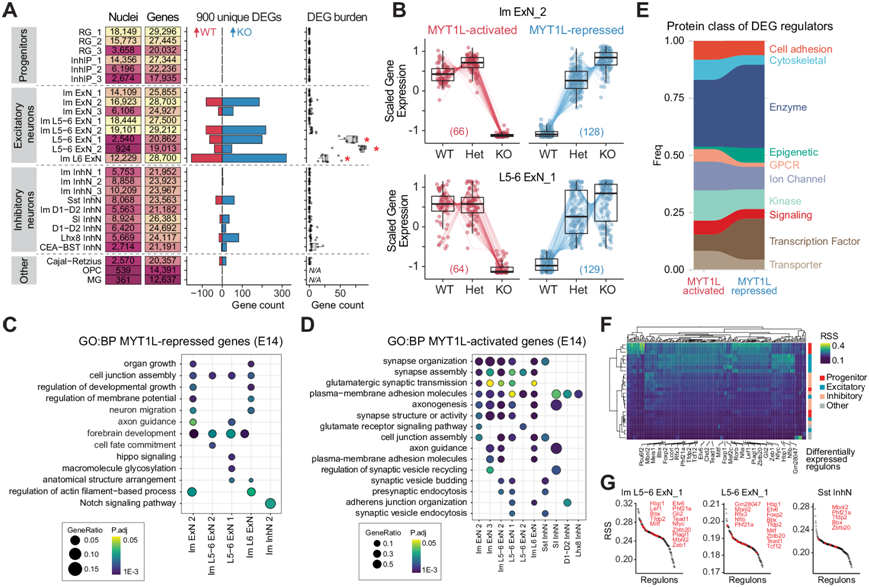
图2. E14 时细胞类型特异性基因表达变化。
(A) 汇总图显示了每个聚类中检测到的细胞核和基因的数量(左)。条形图(中间)显示在 WT或 KO条件下上调的差异表达基因 (DEG) 的数量。DEG 负担分析(右)显示每种细胞类型的 DEG 分布。(B) Im ExN_2 和 L5-6 ExN_1 聚类中 DEG 的 MYT1L 基因剂量依赖性表达模式,分为 MYT1L 激活(KO 中表达降低)和 MYT1L 抑制(KO 中表达增加)。(C-D)GO分析。(E) 显示 DEG 中注释蛋白质类别的频率分布。(F) 热图显示每个 WT 聚类(行)的已识别调节子(列),按调节子特异性得分 (RSS) 着色。
03
MYT1L 在神经元成熟时间中的关键作用
差异分析表明,MYT1L 缺乏与兴奋性神经元中不成熟的转录特征有关。他们假设 MYT1L 缺乏的祖细胞会过早分化,做出早期的神经元细胞命运决定,但随后表现出延迟或停滞的成熟,这导致转录成熟特征发生破坏。他们提出在分化过程中的一个关键时刻,MYT1L 功能对于指导神经元发育轨迹至关重要。该模型协调了在 MYT1L 缺乏的神经元中观察到的过早分化和不成熟的转录特征。为了验证这些假设,他们评估了神经发生关键发育窗口期间不同基因型之间的成熟轨迹差异。使用 Monocle3,他们重建了一条独立于先前聚类定义的伪时间轨迹(图 3A)。这种方法将细胞状态建模为动态变化的连续体,从而能够量化分化过程中基因表达的变化。与WT相比,Het和KO细胞核在拟时间状态下的分布存在细微但广泛的破坏(图 3B-D),这表明转录成熟特征发生破坏,在仅基于聚类标记检查细胞比例时可能会忽视。
为了确定兴奋性神经元发育的驱动因素,他们分析了 WT 细胞中 TF 的拟时间表达,建立了从祖细胞到分化的兴奋性神经元的基因激活和表达的假定时间线(图 3E)。然后,他们检测了 MYT1L 缺失是否会导致 TF 表达时间发生变化,从而可能影响兴奋性神经元的发育轨迹。他们确定了 27 个由于 MYT1L 缺乏而导致表达时间中断的 TF(图 3F-G)。这些 TF 在 Hets 和 KO 中通常在解除抑制,参与发育调控(Dlx5、Dlx6和Hoxd10)、控制细胞周期进程(Hbp1)、神经发生(Nhlh2、Lmx1a和Insm2)和表观遗传调控(Tet2和Prdm)(图 3G-H)。为了确定 MYT1L 可能产生最大影响的位置,他们将所有兴奋性伪时间 TF 与 E14 MYT1L CUT&RUN 峰相交。他们发现在从祖细胞到有丝分裂后神经元的转变后不久的短暂时期内直接 MYT1L 靶标富集,表明其在此关键时刻的重要作用(图 3F)。此外,他们在此伪时间区间内确定了六个基因(Efna4、Ccng2、Nbr1、Frmd4b、Sorsb2和Midn)作为 ZBTB12 的靶标,ZBTB12 是一种分子守门人,已知可以保护祖细胞单向转变为分化状态。该分析提供了 MYT1L 靶基因表达的伪时间分辨序列,并确定了一个关键的发育窗口,在此敏感时期内基因表达模式的改变可能导致神经元分化和成熟的中断。
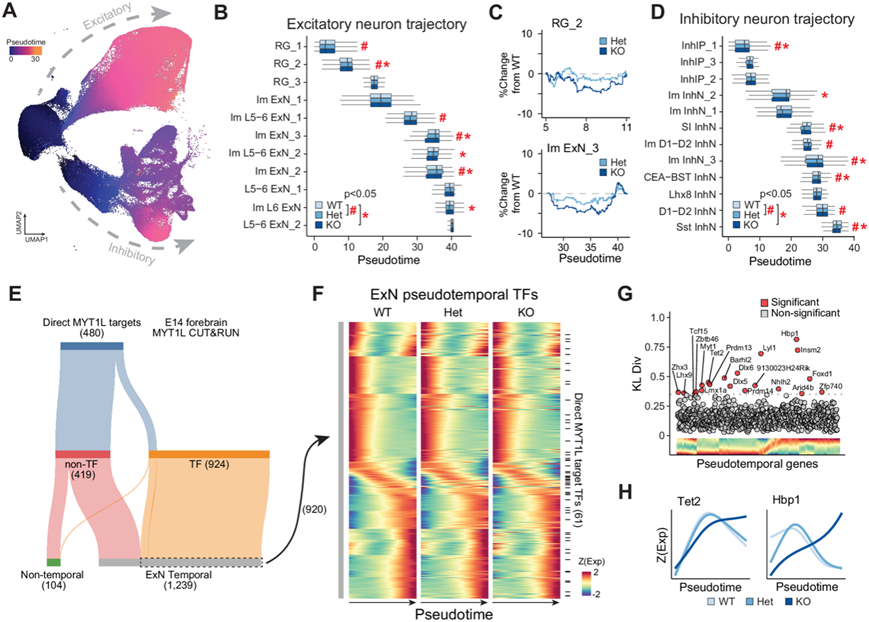
图3. MYT1L 的缺失会破坏 E14 时的兴奋性神经元成熟。
(A) 所有 E14 核的 UMAP 以伪时间着色。(B) 箱线图显示每个基因型的兴奋性神经元的核沿伪时间的分布。(C) 代表性图显示 MYT1L Het 和 KO 核的分布与 RG_2 和 Im ExN_3 聚类中的 WT 分布相比的相对差异。(D) 箱线图显示每个基因型的抑制性神经元细胞核沿伪时间的分布。(E) 显示由 CUT&RUN 确定的直接 MYT1L 靶标的细分,这些靶标是转录因子,并显示兴奋性神经元轨迹中伪时间的基因表达变化。(F) 热图显示 WT(左)、Het(中)和 KO(右)兴奋性神经元伪时间基因表达。(G) 散点图显示用于识别 KO 与 WT 相比的差异伪时间表达谱的 Kullback-Liebler 散度度量。(H) 跨基因型的Tet2和Hbp1的基因表达谱的代表性轨迹。
04
MYT1L 缺失会破坏 P1 早期出生后皮质发育
为了研究 MYT1L 缺乏对所有皮质神经元出生后神经元发育的影响,他们对神经元诞生时 (P1) MYT1L WT(n = 4)和 Het(n = 8)动物的前脑组织进行了 snRNA-seq 。在MYT1L 小鼠模型中,KO 动物在出生后无法存活,因此他们只能分析 WT 和 Het,收集了 98797 个细胞核,鉴定出 36 个不同的细胞聚类(图 4A)。聚类比例分析显示,与 WT 相比,Het 中深层兴奋性神经元(L5-6 ExN_2 和 L6 ExN)、上层兴奋性神经元(Im L2-4 ExN_2 和 L2-4 ExN_2)显著减少,而 Im L2-4 ExN_1 增加。有趣的是,差异分析确定了 89 个独特的 DEG(图 4B),与 E14 KO 与 WT 比较的 DEG 数量相比明显减少,但比 E14 Het 与 WT 比较的数量要多,表明随着时间的推移,中断越来越多。这些 DEG 中的大多数在 Het 中上调,这与 MYT1L 作为转录抑制因子的主要作用一致。
为了了解这些转录变化的功能意义,他们对 MYT1L 激活和抑制的基因进行了 GO 富集分析。MYT1L 激活的基因在 Het 动物中下调,在对神经元功能和成熟至关重要的过程中富集,包括细胞间粘附、突触传递和谷氨酸受体信号传导(图 4C)。这表明 MYT1L 的缺失会导致神经元成熟和突触功能受损。相反,MYT1L 抑制的基因在 Het 动物中上调,与发育过程有关,包括神经元投射引导(图 4D)。这表明 MYT1L 缺乏会导致发育程序的持续。
接下来,他们对连续兴奋性神经元聚类进行了伪时间分析,以检测每个伪时间区间内每种基因型的细胞分布变化(图 4E)。在 P1 时,他们检测到主要在上层神经元聚类内分布发生变化,其中 Het 细胞趋向于较低的伪时间值。与 E14 类似,这些发现表明与 WT 细胞相比,神经元状态不成熟(图 4F)。这些结果进一步表明,WT 细胞沿着发育轨迹成熟,而 Het 细胞落后(图 4G),这强化了 MYT1L 在正确神经元发育中的作用。
总体而言,MYT1L 可能在调节出生后早期发育过程中特定神经元亚型的成熟比例方面发挥着关键作用,这与之前的研究一致,观察到的细胞类型比例和基因表达模式的变化表明,MYT1L 缺乏会导致持续的未成熟转录状态和神经元组成的改变,这可能导致与 MYT1L 综合征相关的神经发育表型。
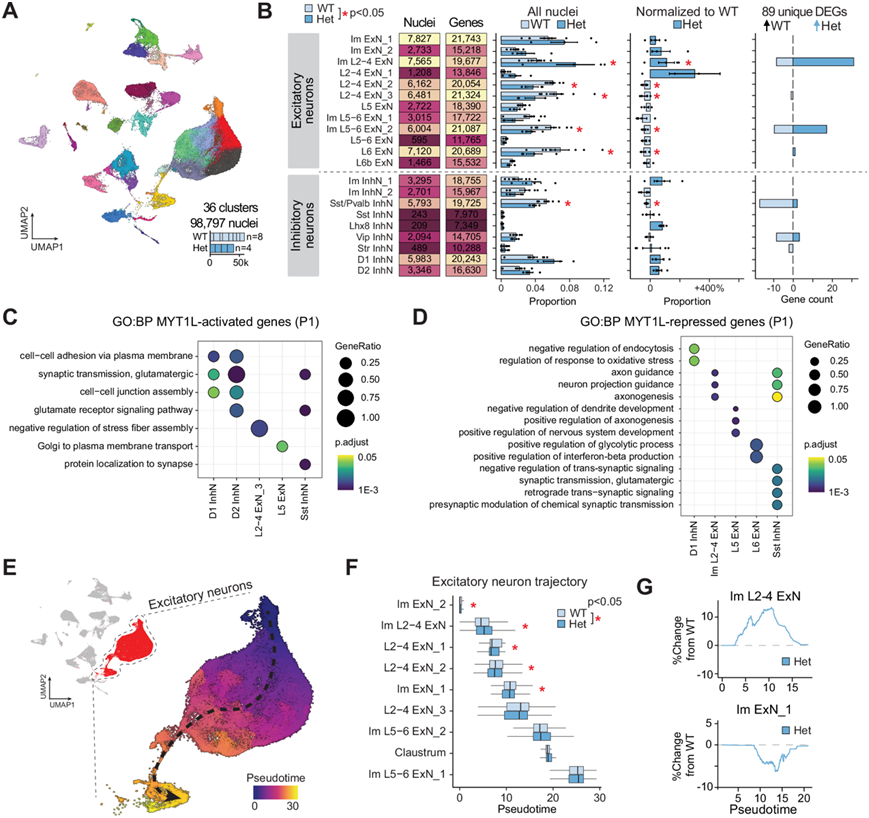
图4. MYT1L 的缺失会扰乱 P1 处兴奋性神经元的比例。
(A) UMAP显示 P1 MYT1L WT和 Het动物前脑的 36 个聚类中的 98797 个细胞核。(B) 汇总图显示每个聚类中检测到的细胞核和基因的数量;条形图显示 MYT1L WT 和 Het 基因型在每个注释细胞聚类中细胞核的平均值 ± SEM 相对比,以及每种细胞类型在 WT 中上调和在 Het 中上调的差异表达基因 (DEG) 数量。(C-D) GO分析。(E) UMAP可视化按伪时间着色的兴奋性神经元聚类。(F) WT和 Het沿伪时间轴的兴奋性神经元亚型分布。(G) Het样本中细胞比例随伪时间的百分比变化。
05
兴奋性神经元的敏感性在整个神经发育过程中持续存在
为了研究 MYT1L 缺乏对细胞比例和转录变化的长期影响,他们对神经元正在成熟时 (P21)的幼年 WT和 MYT1L Het动物的皮质组织进行了 snRNA-seq 分析,此时神经发生已基本完成,但皮质回路成熟的关键时期仍在进行中。由于出生后致死,KO 的分析再次无法进行。他们分析了 96505 个细胞核,使用分层相关图谱并参考来自 Allen Brain Cell (ABC) Atlas 的分类法和子类注释,识别出 19 种跨越皮质层的兴奋性神经元、11 种抑制性神经元亚型和 8 种非神经元类型(图 5A)。对兴奋性神经元比例的分析显示,与 WT 相比,MYT1L Het 皮质中上层 L2/3 IT ENT 和 L4/5 IT 神经元数量明显减少,而深层 L6 CT、L6 IT 和 L6b CT 神经元数量增加(图 5B)。这与 P60 Het 小鼠11皮质中深层神经元密度增加相一致。他们检测到 412 个独特的DEG,主要位于兴奋性神经元中(图 5B)。与 E14 和 P1 的发现一致,MYT1L Het 神经元显示上调的 DEG 数量增加,表明去抑制。与 WT 相比,他们观察到 Hets 中 DEG 从 E14(5 DEG)到 P1(89 DEG)再到 P21(412 DEG)的逐渐增加。 L6 神经元受影响最严重,对 L2/3 丘脑内 (IT) 和 L4/5 IT 神经元的影响适中。GO 分析显示,WT 上调的 DEG 与轴突引导(Epha3、Epha5、Epha6、Epha7、Slit2和Robo2)、突触组织(Cdh6、Cdh9、Sema3a、Cntn5和Lrrc4c)和神经传递(Gria4、Glra2、Rim1和Grm3) 相关(图 5C),而 Het 上调的基因在神经系统发育通路(Pak1、Numbl、Etv5、Smurf1、Bcl2、Nfix和Ptn)中富集(图 5D)。该分析表明,与 WT 相比,MYT1L Het 兴奋性神经元在转录上仍未成熟,表明 Het的神经发育缺陷始于胚胎发育期间,并持续并扩展到出生后早期发育。
有趣的是,他们还观察到在 E14(图 1J)、P1(图 4B)和 P21时 MYT1L Het 皮质中 DARPP32 阳性纹状体抑制神经元的比例持续增加。他们假设 MYT1L 缺乏可能导致这些细胞在发育过程中定位错误,导致它们迁移到皮质而不是典型的纹状体目的地。为了验证这一发现并获得 snRNAseq 未捕获的空间信息,他们进行了免疫荧光染色,以直接可视化和量化来自皮质三个不同区域的 DARPP32 和 NeuN 双阳性神经元的原位分布(图 5E-F)。他们证实了皮层深层 DARPP32 和 NeuN 双阳性神经元的增加(图 5G),验证了 snRNA-seq 结果并深入了解了与 MYT1L 缺乏相关的潜在迁移缺陷。需要进一步研究以阐明这一现象背后的机制。
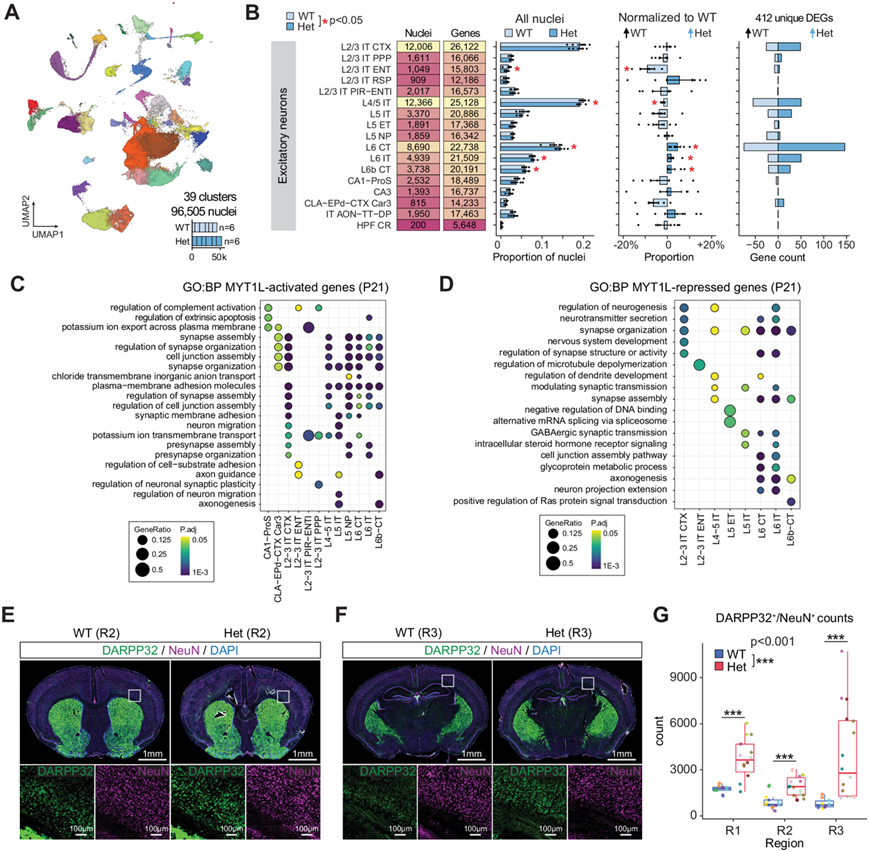
图5. 兴奋性神经元的敏感性在整个神经发育过程中持续存在至 P21。
(A) UMAP 投影显示 P21 MYT1L WT和 Het动物皮层中 39 个聚类中的 96505 个细胞核。(B) 汇总图显示每个聚类中检测到的细胞核和基因的数量;条形图显示 MYT1L WT 和 Het 基因型在每个注释聚类中细胞核的平均值 ± SEM 相对比例,以及DEG改变的数量。(C-D)GO分析。(E-F) WT和 MYT1L Het 小鼠大脑皮层内侧区域 (R2) 和后部 (R3) 区域的脑切片代表性免疫荧光图像。(G) 箱线图显示 WT 和 MYT1L Het 小鼠三个皮质区域(R1、R2 和 R3)中 DARPP32 和 NeuN 双阳性细胞计数的定量。
06
在所有时间点都可以检测到兴奋性神经元的中断
为了深化对从 E14 祖细胞到 P1 时神经发生结束再到 P21 时终末分化细胞类型的发育进程的理解,他们将三个数据集整合在一起,分析了总共 412132 个细胞核。整合的 UMAP 可视化揭示了与主要细胞类别相对应的不同聚类,包括祖细胞、兴奋性和抑制性神经元、神经胶质细胞和其他非神经元细胞类型。已识别的 54 个聚类显示出从 E14 到 P21 的明确发育进程,反映了各种细胞类型随时间的成熟(图 6A)。对不同发育阶段的细胞类别比例的分析证实了祖细胞比例的预期下降,而兴奋性和抑制性神经元群体从 E14 到 P21 增加,这与神经发生和成熟的进程一致。(图 6B)。专注于兴奋性神经元,他们观察到两种基因型在发育过程中都从未成熟到成熟的神经元转变。然而,MYT1L Het 动物在深层 (DL) 和上层 (UL) 兴奋神经元的比例上表现出细微但一致的变化(图 6C)。
为了评估 MYT1L 缺乏对发育过程中转录的影响,他们对 80866 个深层兴奋性神经元 (DL ExN) 进行了差异表达分析。他们总共鉴定了 20521 个 DEG,其中绝大多数与发育阶段(年龄)相关(图 6D)。重要的是,他们发现 63 个 DEG 显示年龄和基因型之间的相互作用。基因型相互作用 DEG 揭示了 WT 和 Het 动物在发育过程中的不同表达模式(图 6E)。其中一些基因在 P21 时表现出与 E14 水平相似的表达增加,例如 NCOR2、SKI 和 SMURF1,它们是 TGF-β 信号转导的负调节因子。这可能会导致 TGF-β 信号转导的显著抑制,从而可能导致分化、成熟和迁移的中断。需要进一步研究以确定过度表达的程度和细胞背景,以及响应这些变化而激活的潜在补偿机制。
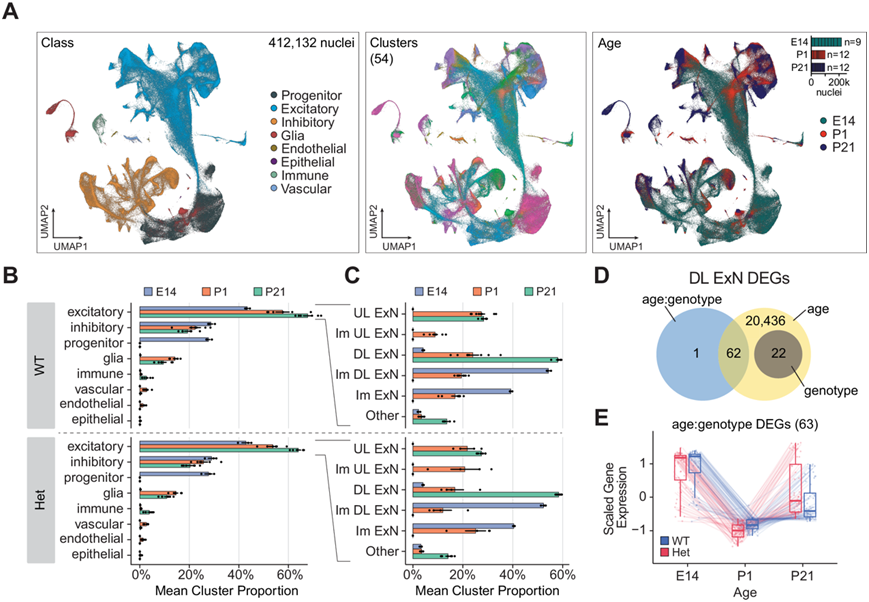
图6. MYT1L 缺乏对神经发育的影响的综合分析。
(A) UMAP投影显示来自 E14、P1 和 P21 数据集的 412132 个细胞核的综合数据。(B) WT和 Het中各发育阶段主要细胞类别的平均值 ± SEM 比例。(C) 各发育阶段兴奋性神经元亚型的平均值 ± SEM 比例。(D) 维恩图显示通过伪体分析在深层兴奋性神经元 (DL ExN) 中确定的与年龄、基因型和年龄:基因型相互作用相关的DEG数量。(E) 基因的表达模式显示出 WT(蓝色)和 Het(红色)动物在发育阶段中存在显著的年龄:基因型相互作用。
+ + + + + + + + + + +
结 论
本研究分析了野生型和 MYT1L 缺陷小鼠前脑的 412132 个细胞核,这些细胞处于三个发育阶段:神经发生高峰期的 E14、皮质神经元诞生时的 P1 和神经元成熟的 P21。MYT1L 缺陷会破坏皮质神经元的比例和基因表达,主要影响神经元成熟程序。影响主要是细胞自主的,并在整个发育过程中持续存在。虽然 MYT1L 既可以激活基因表达,也可以抑制基因表达,但抑制效应对单倍体不足最为敏感,可能介导 MYT1L 综合征。这些发现阐明了 MYT1L 在神经元发育过程中协调基因表达的作用,为 MYT1L 综合征的分子基础提供了见解。
+ + + + +



 English
English


