文献解读|Nature(50.5):小鼠健康衰老的全脑细胞类型特异性转录组特征
✦ +
+
论文ID
原名:Brain-wide cell-type-specific transcriptomic signatures of healthy ageing in mice
译名:小鼠健康衰老的全脑细胞类型特异性转录组特征
期刊:Nature
影响因子:50.5
发表时间:2025.01.01
DOI号:10.1038/s41586-024-08350-8
背 景
定义和区分随着衰老而发生的整体、区域特异性和细胞类型特异性功能变化是理解正常衰老过程以及正常衰老与疾病病理之间相互作用的重要步骤。在过去十年中,人们做出了一致努力来记录和分类在不同的模型系统中保留的各种衰老分子和细胞标志。新兴的大脑衰老和神经退行性疾病研究开始揭示大脑中存在一些衰老标志,包括由小胶质细胞和其他胶质细胞类型介导的慢性炎症、异常的神经元网络活动、细胞衰老等。虽然这些标志为理解单个细胞如何衰老提供了重要的基础,但对像大脑这样复杂和异质的多细胞组织如何衰老的理解仍然处于初级阶段。
实验设计
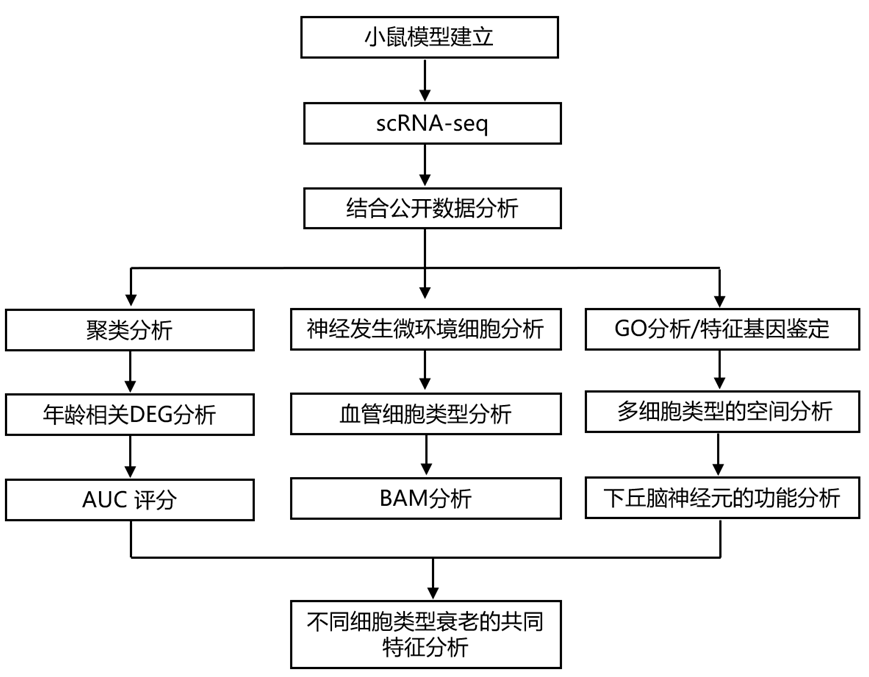
结 果
01
全脑单细胞和原位 RNA 分析
研究团队基于10x Genomics Chromium 平台,对年轻成年(P53–69,2 个月龄)和老年(P540–553,18 个月龄)雌性和雄性小鼠大脑的 16 个广泛解剖区域进行了单细胞转录组学分析(scRNA-seq)。之所以选择这 16 个大区域(图1a),是因为它们在文献中已知对年龄和年龄相关疾病的敏感性。分为六个主要大脑结构:(1)等皮质,包括前边缘区+下边缘区+眶区、无颗粒岛叶区(agranular insular area)、前扣带区(ACA)和后压部区(RSP);(2) 海马结构(HPF),包括海马、旁下托+后下托+前下托+前下托+下托和外侧和内侧内嗅区(ENT);(3)下丘脑(HY);(4)大脑核(CNU),包括背侧和腹侧纹状体、苍白球和纹状体样杏仁核;(5)中脑,包括中脑导水管周围灰质+中脑缝核以及黑质+腹侧被盖区;(6)后脑,包括脑桥前部或后部、运动相关区域和行为状态相关区域(图1a-b)。他们预计这 16 个广泛的解剖区域涵盖了大约 110 个 CCF 定义的大脑区域,覆盖了整个小鼠大脑中大约 35% 的所有灰质区域。
本研究中的所有细胞至少都有四个级别的注释:细胞类(最广泛的注释级别)、亚类、超类型和聚类。所有类、亚类和超类型标签与 ABC-WMB 图谱中的标签相匹配,而此处显示的聚类标签是本研究独有的(图1c)。在后续分析中,他们使用了两种主要策略来表征细胞类型特异性的年龄相关变化:(1)使用三种计算方法在亚类、超类型和/或聚类级别识别年龄相关差异表达基因(DEG);(2)对所有细胞进行高分辨率聚类以识别因衰老而富集或因衰老而耗竭的聚类(图1d)。
在 ABC-WMB 图谱中定义的总共 338 个亚类中,他们在合并的老年和成人数据集中鉴定了 172 个独特的亚类(缺失的亚类主要来自本研究中未分析的大脑区域)。这些亚类涵盖 25 种不同的细胞类(图1e),并显示特定的标记基因表达。本研究中略多于一半的细胞是非神经元的,它们的比例因大脑区域而异。大多数非神经元细胞类型在大脑区域之间共享,而神经元在大脑区域之间有所不同(图1e-f)。所有亚类每个年龄段的平均供体小鼠数量为 14 ± 11(平均值 ± 标准差)。大多数亚类在年龄和性别之间保持了良好的平衡,但由于数据生成和分析流程中各个阶段的质量控制程序,平衡并不完美(图1e-f)。
鉴于亚类水平的非神经元多样性与神经元相比较少,他们开始在超类型水平(总共 20 个超类型)和亚类水平(总共 132 个亚类)研究非神经元细胞。他们在所有细胞类型中观察到了大量的年龄差异基因(总共 2449 个独特基因),在许多非神经元类型中观察到了更多的年龄差异基因(图1f-g)。
为了证实用MAST评估年龄相关变化的方法是稳健的,他们还进行了进一步的分析:(1)在进行DEG分析时将scRNA-seq数据分组为伪批量样本,(2)使用Augur统计方法,旨在根据基于基因表达预测状况(即年龄)的能力对细胞类型进行优先排序。对于大多数细胞类型,从MAST计算出的基因水平系数与使用伪批量方法计算出的系数具有很好的相关性,所有细胞类型的平均相关系数为0.72。此外,受试者工作曲线下面积(AUC)评分与每个超类型或亚类中MAST的年龄DEG数量高度相关(图1g)。
在所有神经元亚类和非神经元超型中,他们发现大多数年龄相关DEG仅在一个或两个亚类或超型中显著(图1h),这表明大多数年龄相关DEG是细胞类型特异性的。只有少数 DEG在许多亚类和/或超型中发生显著变化(图1h),他们将在十个或更多亚类和/或超型中发现的年龄相关DEG定义为常见的年龄-DEG(图1h)。
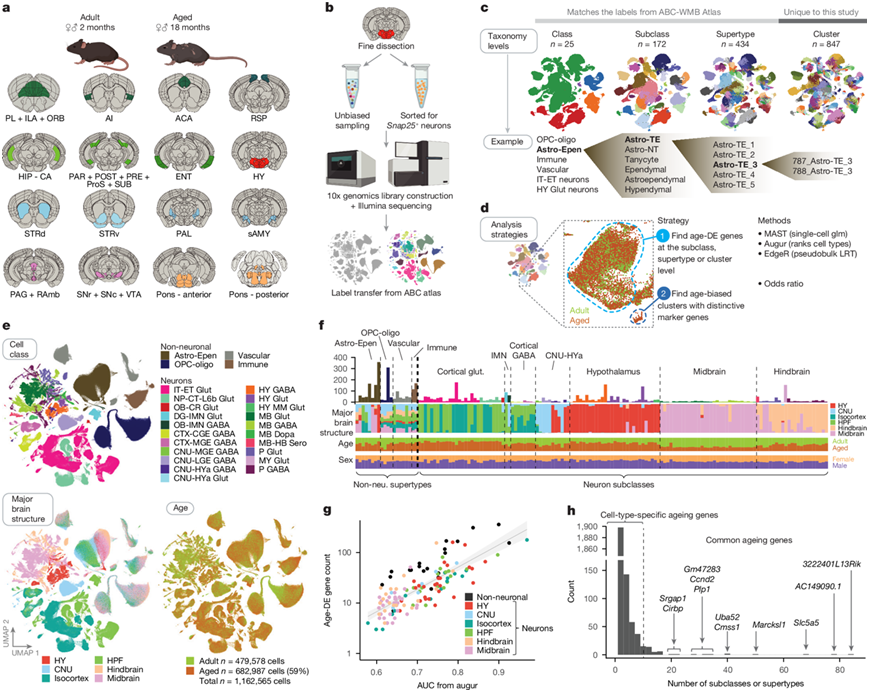
图1. 年轻成年小鼠和老年小鼠大脑中的转录组细胞类型。
(a) 本研究中解剖的大脑区域示意图。(b) 文库生成和细胞注释工作流程示意图。(c) 基于ABC-WMB 图谱的细胞注释级别图。(d) 用于识别易受衰老影响的细胞类型的一般分析策略示意图。(e) 本研究中包括的所有单细胞转录组的 UMAP 表示,按细胞类别、主要大脑结构和年龄着色。(f) 从每个亚类(针对神经元)和超类型(针对非神经元细胞)中识别出的所有年龄-DEG数量摘要。(g) 所有细胞类型的年龄相关DEG数量与 Augur AUC 评分之间的关系。(h) 细胞类型(神经元亚类)数量直方图。
02
衰老影响成人神经发生微环境的细胞
首先,他们检测了非神经元超型和不成熟的神经元(IMN)亚类中的年龄相关DEG(图2a)。非神经元细胞类型分为四类:(1)星形胶质细胞和室管膜样细胞类型(Astro-Epen),(2)少突胶质细胞及其前体(OPC-Oligo),(3)血管细胞和(4)免疫细胞。许多 Astro-Epen 细胞类型具有高度区域特异性。本研究数据集中存在的两个 IMN 亚类分析是 DG-PIR Ex IMN[它主要包含来自位于颗粒下区 (SGZ) 的齿状回的 IMN,产生谷氨酸能齿状回颗粒细胞]以及 OB-STR-CTX Inh IMN[它包含起源于脑室下区 (SVZ) 的 IMN]。
对于更丰富的非神经元细胞类型,他们还使用 RSTE1 估计了不同大脑结构中细胞比例随年龄的变化。在更精细的聚类级别,为了确定是否有任何聚类存在年龄偏差(即由比偶然预期更多或更少的老化细胞组成),他们根据聚类内衰老细胞与成年细胞的比例与类相比计算了每个聚类的优势比 (OR)。log 2 OR < −2.5 或 log 2 OR > 2.5的聚类分别定义为衰老耗竭或衰老富集的(图2b)。
他们发现了大量的年龄相关DEG,它们在不同细胞类型中存在很大差异。年龄相关差异基因数量最多且 Augur 的 AUC 得分最高的超类型包括与脑室系统密切相关的超类型(图2c-d)。这些细胞类型中的许多位于大脑中已知或潜在的成人神经发生区域:纹状体内壁的 SVZ、齿状回的 SGZ 和下丘脑的第三脑室(V3)(图2c-d)。这些细胞包括伸长细胞、室管膜细胞、OB-STR-CTX Inh IMN 和 Astro-TE_5。V3 内壁的伸长细胞(图2c)在成年期具有类似干细胞的活性。 Astro-TE_5 是一种端脑星形胶质细胞超型,它与 OB-STR-CTX Inh IMN 在 SVZ 中特异性共定位(图2c)。对这些类型中年龄-DEG进行的GO分析表明,在 OB-STR-CTX Inh IMN 中,随着年龄的增长,参与区域化、神经发生和上皮形态发生的基因表达降低(图2e),而 Astro-TE_5 显示参与细胞间粘附(例如,钙粘蛋白基因Cdh19)和离子通道活动(例如Grin2a和Grid1)的基因表达增加(图2f)。Astro-TE_5 中最大的基因表达变化是Csmd1的减少(图2f),该基因与认知能力下降和帕金森氏症等退行性疾病以及大脑补体活动和回路发育有关。
此外,他们发现 Astro-TE_2 和 DG-PIR Ex IMN 都是局限于齿状回 SGZ 的小细胞群(图2c),与其他 astro-TE 超型相比,它们共有Dscaml1和Sox4等共同标记基因,但随着年龄的增长,它们的耗竭程度比偶然预期的要大(图2b)。这些发现表明,小鼠 SGZ 中的神经发生活动在 18 个月龄时显著减少。
其余星形胶质细胞超型中的年龄相关-DEG多种多样(图2f),但许多基因在与神经元投射发育、突触膜区室和离子通道活性相关的通路富集。他们分析了大脑中两种最丰富的星形胶质细胞超型 Astro-TE_3 和 Astro-NT_2 的细胞比例随年龄的变化(图2f)。Astro-TE_3 是端脑中的主要星形胶质细胞超型,其丰度不会随年龄而发生显著变化,而 Astro-NT_2 是非端脑区域的主要星形胶质细胞超型,其在中脑和后脑的丰度随年龄增长而显著下降。
衰老会导致脑微血管完整性和功能丧失。他们描述了血管细胞超型中与年龄相关的变化:蛛网膜屏障细胞 (ABC)、两种类型的血管软脑膜细胞 (VLMC)、内皮细胞、平滑肌细胞 (SMC) 和周细胞。他们在所有血管细胞类型中观察到了不同的年龄差异基因集(图2h),这些基因显示出不同类型的生物过程和分子功能的富集。内皮细胞中与主要组织相容性复合体 (MHC) I 类 (MHC-I) 反应相关的基因上调,例如组织相容性 (H2) 基因H2-Q6和H2-Q7,以及 ABC 中与 MHC II 类 (MHC-II) 反应相关的基因上调,例如Cd74、H2-Aa和H2-Ab1(图2h)。此外,周细胞、SMC 和 VLMC 中与胶原复合物形成和细胞外基质组织相关的基因下调。
在所有血管类型中,内皮细胞表现出最多的年龄相关DEG,并且在 Augur 中排名很高(图2d-h)。在所有年龄相关DEG中,效应大小最大的基因是Rasgrf2和Hdac9,其表达增加已在原位得到证实(图2h-i)。内皮细胞中Rasgrf2表达随年龄增长而增加可能作为一种保护机制,因为在人类血管内皮细胞中,它是一种抗凋亡的保护因子。先前在缺血性脑中观察到Hdac9基因上调,它加剧了内皮损伤。他们还观察到内皮细胞中Fmo1和Fmo2表达随年龄增长而增加(图2h-i),人类 FMO 基因的表达与各种神经系统疾病有关。
由于本研究scRNA-seq 数据集中淋巴样细胞和树突状细胞的数量有限,他们将免疫细胞的分析重点放在小胶质细胞和边界相关巨噬细胞 (BAM) 上,这两者都显示出大量的年龄相关 DEG和来自 Augur 的高 AUC 值(图2a-d)。BAM分析显示,在老年小鼠中,许多Cd209基因协同上调(图2j),这些基因编码的凝集素在细胞粘附和病原体识别中发挥作用。原位证实了Cd209a和Cd209b的表达随年龄增长而增加。他们还观察到某些 H2 基因的上调,这表明 MHC-II 蛋白反应增加,包括H2-Ab1和H2-Eb1(图2j)。
在随着年龄增长的小胶质细胞中,他们观察到Ildr2、Ccl3、Ccl4和Upk1b的上调,这在至少一个区域中得到了原位证实,而Rgs7bp则下调(图2j-k),这与之前对小胶质细胞衰老的单细胞研究一致。Upk1b包含在小胶质细胞“感觉体”中,这是一组特征性的小胶质细胞基因,它们编码的蛋白质可感知内源性配体和微生物。这些基因与涉及炎症反应、细胞因子产生、NF-κB 信号传导、MHC-I 蛋白复合物等相关通路。
OPC-Oligo 细胞类包含少突胶质细胞前体细胞 (OPC) 以及过渡期和成熟少突胶质细胞 (MOL)。他们根据公开数据和 ABC-WMB 图谱,将少突胶质细胞群分解为以下超类型:定向少突胶质细胞前体细胞 (COP)、新生少突胶质细胞 (NFOL)、髓鞘形成少突胶质细胞 (MFOL) 和 MOL。MOL 是髓鞘细胞,通过生成和维持髓鞘(髓鞘包裹和保护穿过大脑的轴突)构成大脑中大部分白质。正常衰老过程中全脑白质体积减少,并且与认知能力下降相关。
在这些超型中,他们观察到 MOL 中年龄-DE 基因数量最多(图2a-d)。OPC 和 MOL 的年龄相关DEG特征明显不同,而 OPC 和 COP 显示出更多重叠的年龄相关DEG,这与它们的发育轨迹一致(图2l)。MOL 中Abca8a、Cdh8和Dpyd的表达显著增加,这已在原位得到证实(图2l-m)。随着年龄增长,Abca8a和Dpyd的表达增加,这表明 MOL 的髓鞘维持能力发生了改变。他们还观察并从空间上证实了 OPC 中Maf和Nr6a1的表达增加(图2l)。Maf编码一种与转录因子Nrf2形成异二聚体的转录因子,Nrf2和Maf的大脑表达改变与认知障碍和 OPC衰老有关。

图2. 跨非神经元超型的年龄相关DEG。
(a) 按细胞类别分组,每种非神经元超类型以及两个 IMN 亚类的年龄-DEG数量汇总。(b) 每个聚类的老年细胞与成年细胞成员数与相应类别的老年细胞与成年细胞成员总数的 log2 OR 之比。(c) 从 ABC-WMB图谱 MERFISH 数据中获取的已知和/或疑似成年神经发生区域的空间定位。(d) 每种非神经元超类型和 IMN 亚类的年龄相关DEG数量与 Augur AUC 评分之间的关系。(e)GO分析。(f,h,j,l) 所有年龄相关DEG的年龄效应大小热图。(g,I,k,m) 所有聚类的标记基因的点图和箱线图。
03
后脑富集老化少突胶质细胞
在四类非神经元细胞中,OPC-Oligo 类具有最多数量的年龄偏向聚类(图2b),包括在过渡期 COP、NFOL 和 MFOL 类型中偏向成体细胞,以及在两种 MOL 聚类中偏向衰老细胞(图3a-b)。原位证实了 COP、NFOL 和 MFOL 类型会随着年龄的增长而丢失(图3c-d),表明随着年龄的增长,新 MOL 的产生会减少。他们观察到所有 OPC 聚类中均出现了 OPC 标记基因的预期表达,例如Cspg4和Pdgfra,COP 中的Arhgap,NFOL 中的Cemip2,MFOL 中的Synpr,以及MFOL 和 MOL聚类中的Apod和Prr5l(图3e)。如预期的那样,Mbp在成熟细胞和成熟细胞中的表达高于 OPC。
两个衰老富集的 MOL 聚类 816 和 819 主要来自后脑区域,与它们最接近的、无偏的 MOL 聚类815 一样,它们都表达其他 MOL聚类中不存在的独特标记,包括Hopx、Nkx2-9和Anxa5(图3b-e)。聚类815 和 816 不表达Opalin,该基因通常是 MFOL 和 MOL 特异性标记。衰老富集的聚类 816 和 819 具有独特的特定标记基因,包括Art3、Adgrg6、Prkag3和Slc9b2。聚类816 还显示出细胞衰老标记Cdkn1a的独特表达。尽管在衰老的大脑中观察到了衰老的星形胶质细胞和小胶质细胞,但少突胶质细胞是否会随着衰老而发生细胞衰老迄今为止仍不清楚。
在所分析的四个区域(等皮质、纹状体、中脑、后脑)中,他们发现了与老年后脑样本中的衰老聚类 816 和 819 最相似的细胞富集,这与从 scRNA-seq 数据观察到的后脑富集一致(图3f-g)。空间数据中的 816 细胞多于 819 细胞,与 scRNA-seq 数据中的相似。值得注意的是,虽然 819 在 scRNA-seq 数据中似乎是一个雄性偏向的聚类,但与其最密切映射的原位细胞在雄性和雌性动物中都有检测到。空间数据中的标记基因水平与 scRNA-seq 中的水平相似,包括815 和 816 中Opalin表达较低、后脑富集聚类中Hopx表达以及816 中的Art3和Cdkna1表达(图3h-i)。
对 816 和 819 聚类特有的标记基因进行 GO 富集分析,发现两组标记基因均富集了系统发育和细胞分化的通路(图3j-k)。对于 816,涉及洞穴大分子信号复合物的基因有独特的富集,包括Cav1和Cav2(图3e),以及与质膜筏组装相关的基因的富集。对于 819,存在神经元结构(树突、轴突和突触)基因的富集,以及与神经胶质生成相关的基因的富集。
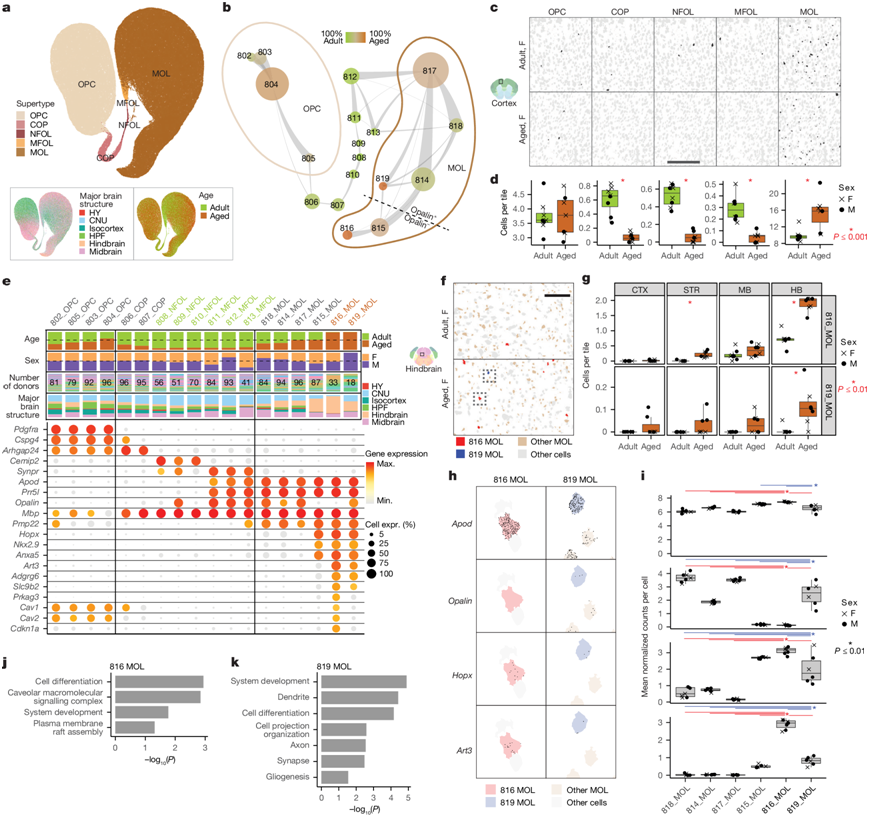
图3. 在后脑中观察到因衰老而富集的 MOL 聚类。
(a) 所有 OPC 和少突胶质细胞转录组的 UMAP可视化。(b) 表示 OPC 和少突胶质细胞聚类的星座图。(c) 来自 RSTE1 的等皮质中代表性样本的 OPC-Oligo 的空间位置。(d) 等皮质中 OPC-Oligo 细胞密度的定量。(e) 每个 OPC-Oligo 聚类按主要大脑结构、性别、供体和年龄的条形图(上)和每个聚类的标记基因的点图(下)。(f) 来自RSTE1的老年和成人后脑代表性样本中衰老富集的 MOL 816 和 819 的原位空间定位。(g) 对 RSTE1 中四个大脑区域中 MOL 816 和 819 的密度进行定量。(h) 显示Apod、Opalin、Hopx和Art3的 mRNA 分子的精确空间位置。(i) 对h中显示的基因在所有 MOL 聚类中的表达进行定量。(j-k)GO分析。
04
室管膜细胞和伸长细胞随年龄的变化
两种随年龄增长而表现出最大转录组变化的细胞类型是室管膜细胞和伸长细胞(图2d),它们是排列在大脑特定区域特定脑室中的一小群特殊神经胶质细胞。它们与星形胶质细胞有关,属于 ABC-WMB 图谱中的 Astro-Epen 类(图4a)。室管膜细胞是排列在大脑所有脑室和脊髓中央管内的纤毛神经胶质细胞,有助于脑脊液在整个脑室系统中循环。伸长细胞排列在下丘脑 V3 的腹侧和腹外侧,并具有一个伸入附近实质的长突起。已证明伸长细胞参与下丘脑的各种功能,包括在脑室周围器官(CVO)(脑部以存在具有孔内皮的高通透性血管为特征的区域)形成血脑屏障,调节营养感知和激素信号传导,以及表现出成人神经发生能力,可能作为对身体活动和饮食等外部因素作出反应的适应机制。他们在这两个亚类中发现了相似的随着年龄而富集的年龄-DEG和,但在其他 Astro-Epen 亚类中没有发现(图4b)。他们在空间上鉴定了 V3 内壁的伸长细胞和室管膜细胞(图4c)。根据伸长细胞的标记基因Gpr50和室管膜细胞的标记基因 Tm4sf1,两个细胞亚类之间存在从背侧到腹侧的转变,这使他们能够直观地确认基因表达随年龄的变化。
在室管膜细胞和伸长细胞中(程度较小),许多干扰素反应基因(如Ifi27、Ifit1、Ifit3和Oasl2)随着年龄增长表达增加(图4b)。他们证实了室管膜细胞原位中Oasl2和Ifit1的表达增加(图4d)。参与MHC-I反应的基因表达也有所增加,包括B2m、Bst2、H2-K1和H2-D1,在两个细胞亚类中均有增加,但在室管膜细胞中表达更为强烈(图4b)。这些年龄相关DEG有助于富集与免疫反应、MHC-I蛋白复合物以及室管膜细胞独有的干扰素介导的信号传导相关的通路。
在两个细胞亚类中,随着年龄增长表达下降最明显的基因是细胞周期基因Ccnd2和钙粘蛋白相关蛋白基因Ctnna2 ,这两项基因也在原位得到了证实(图4b-d)。Ccnd2已证明在成人神经发生中起着重要作用。Ctnna2参与调节神经元迁移和神经元投射发育。GO 分析显示,与神经发生、神经元分化、运动蛋白复合物和基于微管的运动相关的基因表达下降的通路在伸长细胞中富集,这表明伸长细胞的神经发生潜力随着年龄增长而下降。
聚类后,他们定义了六个伸长细胞聚类和三个室管膜聚类(图4e)。六个伸长细胞聚类显示出独特的标记基因集,大部分与不同的已知伸长细胞亚型对齐。为了估计每个伸长细胞聚类的空间位置,他们检测了成年伸长细胞细胞的聚类标签及其在 ABC- WMB空间图谱3中的注释位置。他们发现了几乎所有成人全脑伸长细胞聚类的代表:聚类792 代表来自喙 V3 的伸长细胞,聚类794 和 795 代表最背侧的 α1 亚型[与下丘脑的背内侧 (DMH) 和腹内侧 (VMH) 核对齐],793 代表 α2 亚型(与背侧和主要后部的 ARH 对齐),796 代表 β1 亚型(与 ARH 对齐),而 797 可能代表 β1 和 β2 亚型的混合(与正中隆起,ME 对齐)(图4f)。利用这些注释,他们对 RSTE3 数据进行相关性映射,发现其中一些聚类在老年和成人组织中原位一致,并得到一致的伸长细胞标记基因表达的支持。具体来说,他们在 RSTE3 中始终检测到聚类 795、796 和 797(图4g),但没有检测到聚类 792、793 和 794,因为这些类型在特定的 RSTE3 部分中可能很少见。在 RSTE3 中检测到的主要伸长细胞聚类中,他们发现背腹轴上的年龄相关DEG表达存在差异。最腹侧的 797聚类主要由 β2 伸长细胞组成,其H2-K1表达显著增加,而更背侧的 795(α1)和 796(β1)聚类则表现出Ifi27表达更强烈的增加(图4h-i)。
鉴于 V3 处室管膜细胞和伸长细胞中免疫反应基因的上调,他们接下来评估了随着年龄增长,免疫细胞向该区域的募集是否会有所增加。他们使用了空间数据集 RSTE3,并计算了 V3 内壁每个细胞 150 µm 距离内的小胶质细胞和 BAM 的总数,将它们从背侧到腹侧定位分为大类:室管膜细胞、伸长细胞聚类 795、796 和 797。虽然没有发现 V3 不同部位周围的小胶质细胞数量有显著变化,但在聚类 797 附近 BAM 的定位显著增加,最腹侧的细胞(β2 伸长细胞)位于正中隆起(图4j-k)。结合之前观察结果,与其他大脑区域相比,即使在正常成人组织中,CVO 中的小胶质细胞和 BAM 活化程度也有所增加,这表明,诸如正中隆起之类的 CVO 可能是导致大脑炎症随年龄增长而增加的区域。
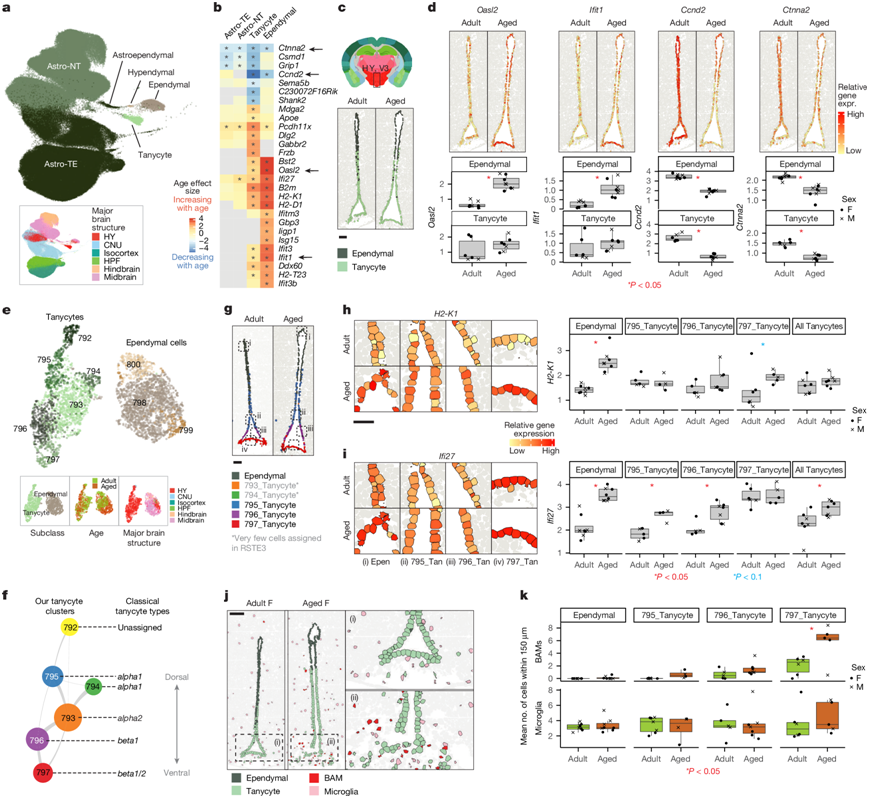
图4. V3 内壁的伸长细胞和室管膜细胞与年龄相关的变化。
(a) 所有 Astro-Epen 细胞亚类的 UMAP,按亚类和主要大脑结构着色。(b) 伸长细胞和室管膜细胞中DEG的年龄效应大小热图。(c) 来自RSTE3的选定样本中的伸长细胞和室管膜细胞体位置。(d) 来自RSTE3的代表性样本的空间定位以及 V3 中室管膜细胞和伸长细胞中Oasl2、Ifit1、Ccnd2和Ctnna2的相应基因表达定量。(e) 包含 ABC- WMB图谱中额外成体细胞的 tanycyte 和室管膜细胞转录组的 UMAP。(f) (e)中tanycyte 聚类的星座图。(g) RSTE3 示例样本中 V3 中 tanycyte 亚型的空间定位。(h-i) RSTE3 中每个亚型中方框区域的放大图像(左)和H2-K1和Ifi27基因表达的量化(右)。(j) RSTE3 示例样本中 V3 周围免疫细胞的空间定位。(k) 不同 V3 细胞类型 150 µm 范围内的 BAM 和小胶质细胞的平均细胞数。
05
下丘脑神经元在能量稳态和衰老中的作用
接下来,他们检测了神经元随年龄的变化。如上所述,在下丘脑神经元以及少数其他神经元亚类中观察到了最多的年龄相关DEG和 Augur 预测评分(图1f-g和图5a)。他们的衰老 scRNA-seq 数据集中有五类下丘脑神经元,即 CNU-HYa Glut、CNU-HYa GABA、HY GABA、HY Glut 和 HY MM Glut(MM 代表内侧乳头核),这通过Slc17a6和Slc32a1 的表达得到证实(图5b)。在这些类别下,有 29 个亚类显示出独特的标记基因表达,总共捕捉到了成年小鼠下丘脑中报告的巨大细胞类型复杂性。年龄相关DEG最多的亚类是下丘脑 V3 近端区域的亚类,包括 ARH、DMH 和 PVH(图5a-c)。这些亚类中的许多都表现出转录因子Tbx3和Otp的特异性表达。
他们进一步在聚类级别研究了这些神经元,特别是六个亚类中的神经元,每个亚类都有超过 50 个年龄相关DEG(图5c-d)。ARH 和 DMH 中的神经元以其在调节能量稳态和饱腹感反应中的关键作用而闻名,其中包括许多功能。这些亚类中的许多聚类都具有高度特异性的神经肽、神经肽受体和激素基因表达,这些基因与食物摄入、能量代谢、饱腹感和内分泌信号通路有关。例如,聚类 325_DMH-LHA Gsx1 Gaba 具有高表达Lepr(瘦素受体)和Glp1r(胰高血糖素样肽 1 受体),聚类 331_TU-ARH Otp Six6 Gaba 具有高表达Agrp(刺豚鼠相关肽)和Npy(神经肽 Y),聚类 374_ARH-PVp Tbx3 Glut 具有高表达Pomc (原阿片黑素皮质素)(图5d)。特征明确的 AgRP-POMC 信号回路定位于 ARH。Agrp/Npy和Pomc神经元分别刺激或抑制食物摄入,并且是在饮食干扰(包括禁食和高脂饮食)下表现出最多基因表达变化的神经元类型之一。
在具有最多年龄-DE 基因的聚类中,有Lepr+/ Glp1r+聚类325_DMH-LHA Gsx1 Gaba、Agrp+ / Npy +聚类331_TU-ARH Otp Six6 Gaba、聚类350_ARH-PVp Tbx3 Gaba(显示神经肽 Y 受体Npy5r的高表达)和聚类 387_PVH-SO-PVa Otp Glut(显示Crh的特异性表达,Crh 是一种编码促皮质素释放激素的基因)(图5d)。
在富含Agrp+/Npy +神经元聚类 331_TU-ARH Otp Six6 Gaba的年龄相关-DEG的 GO 分析中,他们看到参与各种神经调节途径的基因富集,包括血清素受体 ( Htr1b )、大麻素受体 1 ( Cnr1 ) 和组胺 H3 受体 (Hrh3)(图5e)。他们还观察到随着年龄增长,昼夜节律基因 (例如Bhlhe40、Bhlhe41、Nr1d2、Per3) 上调,而参与神经元结构和突触信号传导的基因 (例如Grm8、Grik1、Gabra5)下调。虽然此亚类的细胞聚类存在于 ARH 和结节核 (TU) 中,但聚类 331 专门定位到 ARH(图5f)。原位证实了随着年龄增长,昼夜节律调节基因Bhlhe41表达增加,细胞周期基因Ccnd2和代谢型谷氨酸受体Grm8表达减少(图5g)。
在Lepr + / Glp1r +聚类 325_DMH-LHA Gsx1 Gaba 中,他们发现老年大脑中 MHC-I 基因(例如B2m、H2-K1、H2-D1)表达增加,以及与类固醇和胆固醇代谢相关的基因(例如Abca1、Idi1、Ldlr、Msmo1、Srebf2)和神经肽激素活性(例如Gal、Oxt、Vgf)表达增加(图5h)。这些基因的显著差异表达仅限于聚类 325,而不是其他 DMH-LHA聚类,表明这些与年龄相关的变化对这一小聚类细胞具有高度特殊性。在三个 DMH-LHA Gsx1 Gaba 聚类中,325 位于 DMH 中,并显示原位证实的H2-K1和B2m表达增加,这些基因与 MHC-I 反应有关(图5i-j)。
出于好奇下丘脑中其他神经元聚类是否也表现出 MHC 活性增加,他们分析了所有聚类的通路,发现聚类 389_PVH-SO-PVa Otp Glut_4 中的 MHC-I 基因表达大幅增加。PVH-SO-PVa Otp Glut 4 超型中的聚类 389 和 390 高度定位于视交叉后视上核 (rSO),分别具有神经肽基因Avp(精氨酸加压素)和Oxt(催产素)的强烈表达(图5d),并且两者均显示出随着原位衰老H2-K1的表达增加。巧合的是,所有显示 MHC-I 活性增加的聚类也显示出Glp1r的独特表达(图5d),考虑到最近的研究报告了 Glp1 对包括大脑在内的各种组织的抗炎作用,这是一个有趣的结果。
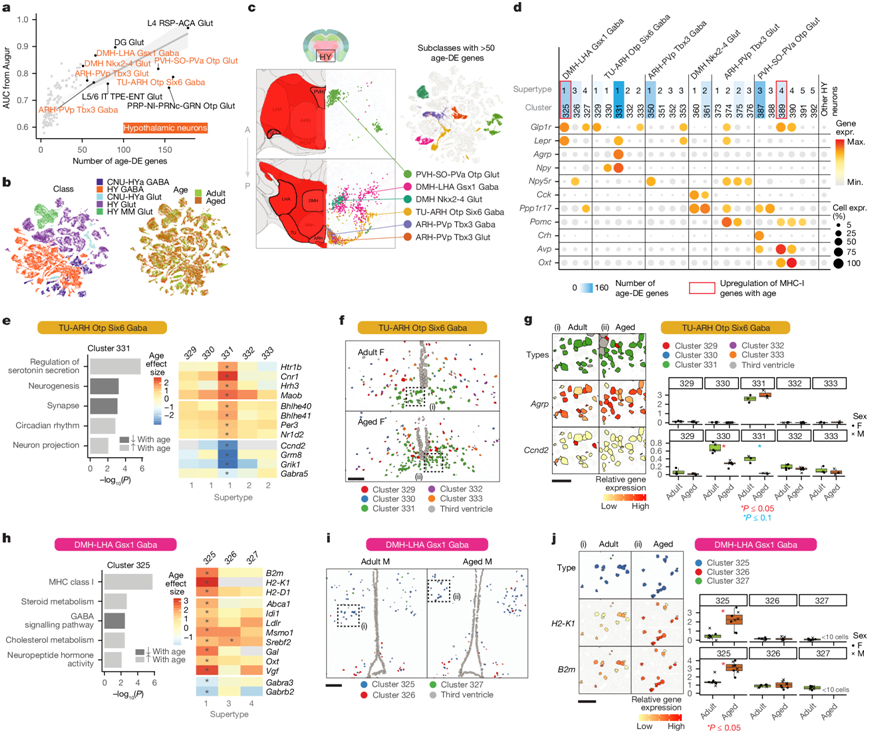
图5. 表现出最大与年龄相关变化的下丘脑神经元类型与能量稳态有关。
(a) 每个神经元亚类的年龄-DEG数量与 Augur AUC 评分之间的关系。(b-c) 按类别和年龄着色的所有下丘脑 (HY) 神经元的 UMAP。(d) 来自具有最多年龄-DEG的下丘脑神经元亚类的聚类中与摄食行为和能量稳态有关的典型基因表达的点图。(e)GO分析和选定基因的年龄效应大小热图。(f) 来自RSTE4的代表性样本中所有 TU-ARH Otp Six6 Gaba 聚类的空间定位。(g) 按Agrp和Ccnd2的聚类或表达着色的方框区域的放大视图(左),以及来自 RSTE4 的这两个基因的表达的定量(右)。(h)GO分析和选定基因的年龄效应大小热图。(i) RSTE3 代表性样本中所有 DMH-LHA Gsx1 Gaba 聚类的空间定位。(j) 按H2-K1和B2m的聚类或表达(左)着色的方框区域的放大视图,以及来自 RSTE3 的这两个基因的表达的定量。
06
不同细胞类型衰老的共同特征
最后,为了揭示所有大脑区域中多种细胞类型中发生变化的常见生物学过程(由基因表达的增加或减少驱动),他们对所有神经元亚类和非神经元超类型中富集的最常见的通路进行了聚类,并在一个按通路的重要性得分着色的矩阵中对它们进行了可视化(图6a)。
他们观察到许多常见的生物过程,这些过程在几种细胞类型中富集。例如,与胶原网络和细胞外基质相关的基因表达减少,主要是由周细胞、SMC 和 VLMC 超型 2 中的不同胶原基因(例如Col4a2、Col1a2和Col3a1)驱动,这与76岁后脑血管中观察到的结构完整性下降和胶原重塑相一致。某些生物学术语在不同细胞类型中也会朝相反的方向变化。例如,与胆固醇和脂质代谢相关的通路显示,随着 MOL 中相关基因的衰老,表达减少,但在下丘脑神经元亚类 DMH-LHA Gsx1 Gaba 中表达增加。这些通路部分由重叠的基因组驱动,包括Dhcr24、Hmgcs1和Idi1,以及在一种或另一种类型中独特变化的基因。随着年龄增长,脂质生物合成减少与 MOL中富含脂质的髓鞘完整性和生成的丧失相一致。虽然尚不清楚这在 DMH-LHA Gsx1 Gaba 神经元中意味着什么,但这一亚类表现出强烈的年龄反应(图5a),包含具有强烈Lepr和Glp1r表达的聚类(图5d),并且是少数几种随着年龄增长而显示 MHC-I 活性增加的神经元类型之一(图5d-j)。
在大多数非神经元细胞类型中,与免疫反应和细胞迁移相关的通路在随着年龄增长而表达增加的基因中高度富集,特别是在小胶质细胞和 BAM 等免疫细胞中(图6a)。在这些免疫通路中,通路确定了 MHC-I 或 MHC-II 抗原呈递反应的特定变化,这些变化在许多细胞类型中重叠:非神经元和神经元。具体而言,小胶质细胞、伸长细胞、室管膜细胞、内皮细胞和 DMH-LHA Gsx1 Gaba 神经元中的 MHC-I 反应显著上调,而 BAM 和 ABC 中的 MHC-II 强烈上调(图6b)。MHC-I 和 MHC-II 上调部分由组织相容性 (H2) 基因上调驱动(图6b)。MHC-I 反应似乎是由不同细胞类型中的不同 H2 基因驱动的。除了一种 MHC-I 反应增强的细胞类型外,其余所有细胞类型均会随着年龄增长而出现H2-D1和H2-K1表达增强的情况,而只有内皮细胞的 MHC-I 反应由H2-Q4、H2-Q6和H2-Q7驱动,室管膜细胞是唯一一种H2-T23显著增强的细胞类型。相比之下,BAM 和 ABC 中的 MHC-II 活性主要由相同的 H2 基因驱动(例如H2-Aa、H2-Ab1、H2-DMb1、H2-Eb1和H2-DMa)。
最后,在单个基因层面,他们发现某些神经元基因在少数神经元类型中下调,包括Robo1和Sema6d,它们都编码轴突导向蛋白(图6c)。然而,大多数基因在单个神经元类型中都是独一无二的下调(图6c-d),进一步表明大多数神经元具有独特的衰老特征。
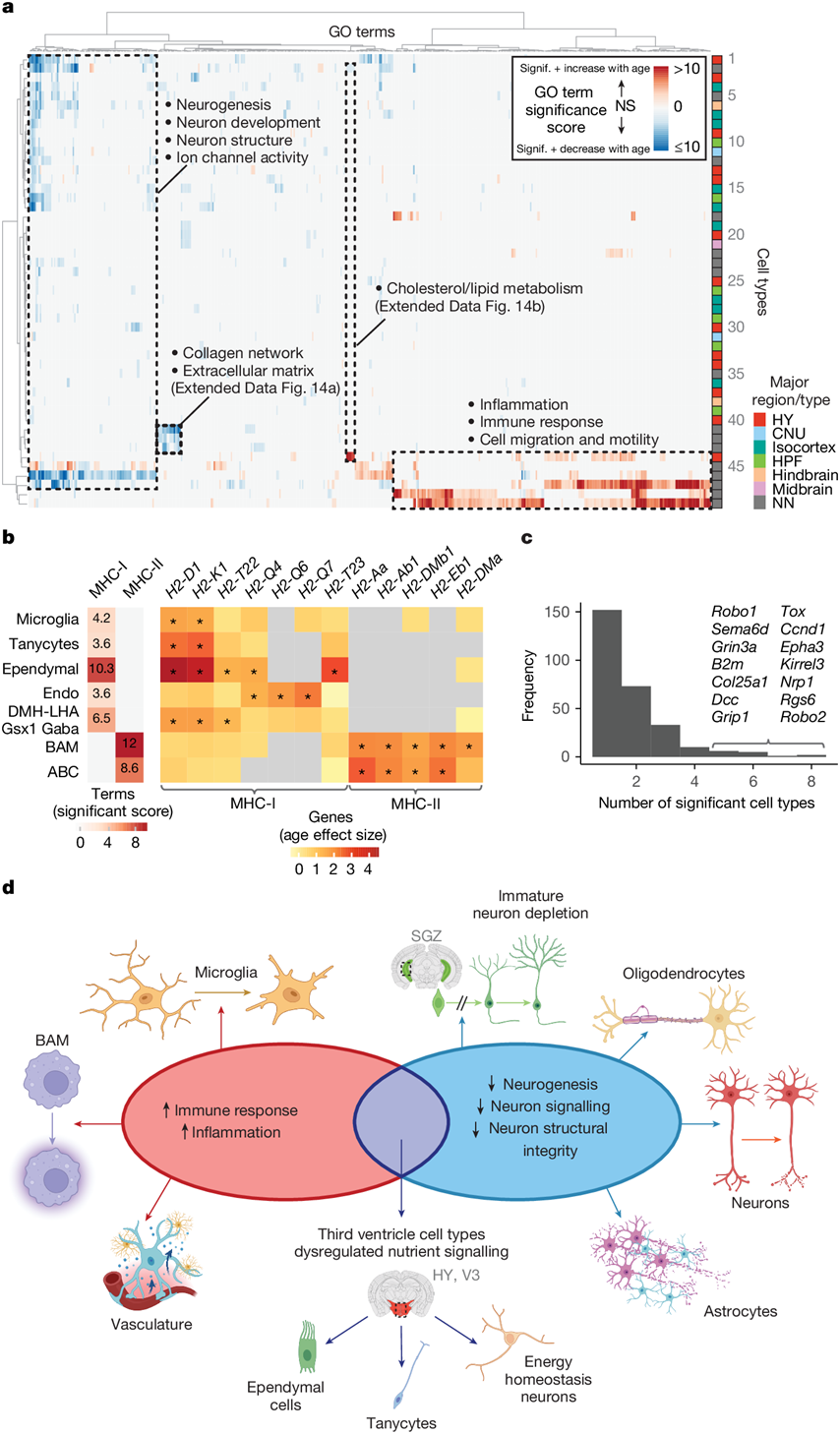
图6. 神经功能下降和免疫活动增强是各类脑细胞衰老的共同特征。
(a)GO分析。(b) 选定细胞类型的 MHC-I 和 MHC-II 活性(左)和选定 H2 基因的年龄效应大小(右)的 GO 重要性得分热图。(c) 属于神经元信号传导或结构术语的基因重要的细胞类型数量分布。(d) 总结了与衰老相关的基因表达变化的主要趋势,包括不同细胞类型的免疫反应增强和神经元功能下降。
+ + + + + + + + + + +
结 论
在更广泛的细胞亚类和超类水平上,他们发现了与年龄相关的基因表达特征,并提供了 2449 个独特的年龄相关DEG的通路,涵盖许多神经元和非神经元细胞类型。虽然大多数年龄相关差异基因是特定细胞类型所特有的,但他们观察到不同细胞类型衰老的共同特征,包括许多神经元类型、主要星形胶质细胞类型和成熟少突胶质细胞中与神经元结构和功能相关的基因表达减少,以及免疫细胞类型和某些血管细胞类型中与免疫功能、抗原呈递、炎症和细胞运动相关的基因表达增加。最后,他们观察到一些对衰老最敏感的细胞类型集中在下丘脑的第三脑室周围,包括伸长细胞、室管膜细胞以及弓状核、背内侧核和室旁核中表达与能量稳态典型相关的基因的某些神经元类型。其中许多类型都表现出神经元功能下降和免疫反应增强。这些发现表明,下丘脑的第三脑室可能是小鼠大脑衰老的枢纽。总体而言,这项研究系统地描述了与正常衰老相关的大脑中细胞类型特异性转录组变化的动态情况,这为研究衰老的功能变化以及衰老与疾病的相互作用奠定了基础。
+ + + + +



 English
English


