文献解读|Nature(50.5):人类新皮层发育的分子和细胞动力学
✦ +
+
论文ID
原名:Molecular and cellular dynamics of the developing human neocortex
译名:人类新皮层发育的分子和细胞动力学
期刊:Nature
影响因子:50.5
发表时间:2025.01.08
DOI号:10.1038/s41586-024-08351-7
背 景
人类新皮质的发育是一个复杂而协调的过程,对于建立大脑的复杂结构和功能至关重要。在发育中的新皮质中,放射状胶质细胞 (RG) 以特有的由内而外的层状模式生成谷氨酸能兴奋性神经元 (EN),首先产生的是非端脑内 (non-IT) 神经元,然后是端脑内 (IT) 神经元。随后,EN 沿着 RG 支架迁移到皮质板,在那里它们分化并形成具有协调突触连接的不同皮质层。同时,起源于神经节隆起的 GABA 能抑制神经元 (IN) 通过边缘区和生发区迁移到皮质,最终成为成人皮质的皮质中间神经元。在妊娠中期后期,RG 从神经发生转变为神经胶质生成,产生填充皮质的星形胶质细胞和少突胶质细胞谱系细胞。细胞增殖和分化所依赖的细胞类型特异性基因调控机制控制着这些动态过程。然而,目前的研究对这些机制的理解仍不完整。
实验设计
结 果
01
发育新皮质的多组学图谱
研究团队从五个关键发育阶段(从妊娠前三个月到青春期)收集了 27 个人类脑标本和 38 个生物样本,以研究人类新皮质发育中的转录组和表观基因组变化(图1a)。样本来自前额叶 (PFC) 和初级视觉 (V1) 皮质。使用 10x Genomics 的单细胞核多组学 (snMultiome) 技术,他们从 243535 个细胞核获得了配对的单细胞核染色质可及性(scATAC-seq)数据和 单细胞转录组(scRNA-seq)数据。排除间脑和纹状体的细胞核后,最终数据集中有 232328 个细胞核。每个细胞核产生中位数为 2289 个基因、4840 个转录本和 4121 个 ATAC 峰区域片段。
他们进行了加权最近邻分析以整合来自配对的信息,得到的最近邻图用于均匀流形近似和投影 (UMAP) 嵌入和聚类。在已建立的皮质细胞类型参考和标记基因的基础上,确定了5个类、11 个亚类和 33 种高保真细胞类型(图1b)。细胞按谱系、类型、年龄和区域聚类,其中 EN、少突胶质细胞和星形胶质细胞显示出明显的区域差异(图1b-c)。细胞类型比例在不同年龄组和区域之间存在显著差异(图1d)。祖细胞和未成熟神经元在妊娠前三个月和中期更为丰富,但后期逐渐减少。相比之下,上层 IT 神经元和大胶质细胞在出生后增加。妊娠晚期后,EN-L4-IT 神经元在 V1 中比在 PFC 中更普遍,这与 V1 中丘脑受体第 4 层 (L4) 的扩张特征相一致。
为了进一步评估数据质量,他们比较了不同细胞类型的谱系特异性转录因子 (TF) 的基因表达、染色质可及性和转录调控活性,发现这些属性之间存在很强的一致性(图1e)。例如,PAX6和EMX2是两种对皮质祖细胞特化至关重要的 TF,在 RG 中表现出选择性表达、高启动子可及性和丰富的基序活性(图1e),突出了新皮质发育过程中表观基因组和转录组学的协调变化。
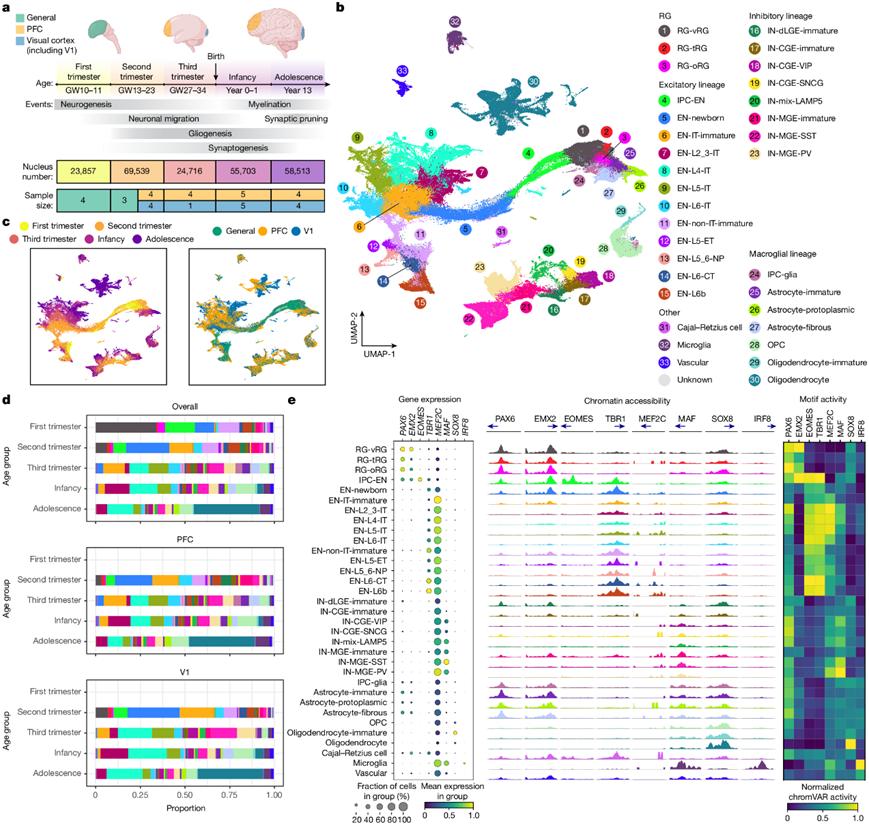
图1. 对正在发育的人类新皮质进行多组学分析。
(a)研究设计。(b) snMultiome 数据的 UMAP 图,显示 33 种细胞类型的分布。(c) UMAP图显示年龄组(左)和区域(右)的分布。(d) 各个细胞类型在发育阶段和皮质区域中的比例。(e) 左:各个细胞类型中特征 TF 的表达。中:不同细胞类型的特征 TF 启动子处的聚合染色质可及性谱。右:不同细胞类型的特征 TF 的标准化 chromVAR 基序活性。
02
发育中的新皮质的细胞结构
为了定位观察到的细胞类型,他们根据从 snMultiome 数据中鉴定出的细胞类型标记设计了一个 300 个基因的组合,并使用多重荧光原位杂交(MERFISH)技术进行空间转录组分析。他们分析了从妊娠中期到婴儿期三个年龄组的六个 PFC 和 V1 样本,保留了 404030 个高质量细胞,可分为29 种细胞类型,与匹配年龄组的 snMultiome 数据中的对应细胞类型一一对应(图2a)。MERFISH 和 snMultiome 之间的细胞类型比例一致,表明抽样偏差有限。为了定义新皮质细胞结构,他们根据细胞的 50 个最近的空间特征将细胞分为 10 个生态位。这些生态位与组织学上建立的皮质区域一致,并据此命名(图2a)。
不同类型的细胞表现出不同的生态位分布模式。神经祖细胞主要位于脑室/脑室下区 (VZ/SVZ),而成熟的 EN 在整个发育过程中局限于其特定的皮质层(图2b)。妊娠中期未成熟的中间神经元在边缘区和 VZ/SVZ 中均有富集,这两条路径是它们迁移到皮质的途径。在此阶段,边缘区与 VZ/SVZ 中迁移的中间神经元的总体比例为 1:4.1,尾神经节隆起 (CGE) 衍生的中间神经元的比例高于内侧神经节隆起 (MGE) 衍生的中间神经元,表明谱系特异性路径偏好。这种偏差可能导致了中间神经元亚型的层状分布,CGE 衍生的中间神经元在上层富集,而 MGE 衍生的表达 PVALB 的中间神经元(IN-MGE-PV)则富集在 L4-6(图2a-b)。背外侧神经节隆起(dLGE)主要产生嗅球中间神经元。值得注意的是,他们在三个年龄组的白质中都观察到了 IN-dLGE 未成熟细胞,它是表达MEIS2、SP8、TSHZ1和PBX3的IN 亚型,可能起源于 dLGE。这些神经元在成年期可能构成白质间质中间神经元的一个子集。至于神经胶质细胞,OPC 均匀分布在灰质和白质之间,而少突胶质细胞在白质中更为丰富(图2b),证明了OPC 在皮质灰质中起非祖细胞作用。
为了识别发育中的人类新皮质中的细胞间通讯,他们首先通过邻域富集分析评估了每个 MERFISH 样本中细胞类型的空间接近度。不同类型的 EN 在它们自己的邻域中富集,反映了强烈的层特异性。他们还观察到特定 EN 和 IN 之间的富集,例如 EN-IT 未成熟细胞与 IN-CGE-VIP 以及 EN-L4-IT 神经元与 IN-MGE-SST(图2c)。为了确定某种细胞类型的基因表达是否受其与邻近细胞类型的接近度的影响,他们进行了节点中心表达建模 (NCEM)。他们发现跨数据集的 EN 之间以及 EN 与 IN 之间存在强烈的相互作用(图2d)。 EN-IT-未成熟细胞(发送者)影响各种 IN 类型(接收者)中的基因表达,而 IN-MGE-SST(发送者)影响多种 EN 类型(接收者)。
由于大多数 MERFISH 样本是在突触形成高峰之前收集的,他们使用 CellChat进行配体-受体分析,以确定潜在的通讯机制。神经调节蛋白和生长抑素分别鉴定为 EN-IT 未成熟细胞和 IN-MGE-SST 与 IN 和 EN 之间的潜在介质(图2e-f)。他们通过用两种受体激动剂处理中期妊娠人类皮质切片培养物来探索生长抑素的作用,并使用scRNA-seq技术分析基因表达。两种激动剂诱导的基因表达变化在预测与 IN-MGE-SST 相互作用的 EN 亚型中呈正相关,证明了激动剂的靶向效应。两种激动剂均抑制神经元投射发育和突触形成,同时激活跨 EN 亚型的代谢过程。这些结果表明 IN-MGE-SST 产生的生长抑素调节 EN 成熟,强调了皮质发育过程中两个神经元亚类之间的相互通讯。
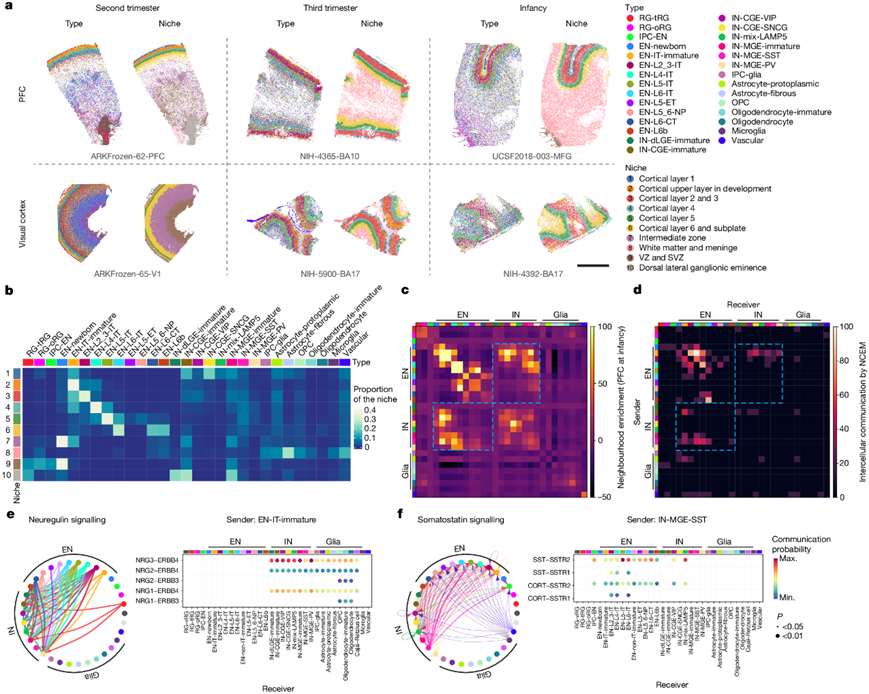
图2. 人类新皮层发育过程中的细胞间通讯。
(a) 六个新皮层样本的空间转录组分析。(b) 不同细胞类型在单个生态位中的比例。(c) 婴儿期 PFC 样本的邻域富集分数。(d) NCEM确定的所有数据集中显著细胞间通讯的百分比。(e) 左:神经调节蛋白信号传导介导的细胞相互作用的方向。右:神经调节蛋白信号通路中示例配体-受体对从 EN-IT 未成熟到其他细胞类型的通讯概率。(f) 左:生长抑素信号传导介导的细胞相互作用的方向(左)。右:生长抑素信号通路中配体-受体对从 IN-MGE-SST到其他细胞类型的通讯概率。
03
基因调控网络分析
为了建立控制人类新皮质发育的基因调控网络 (GRN),他们使用了 SCENIC技术,它将scATAC-seq数据和基因表达数据与基序发现相结合,以推断增强子驱动的调控子 (eRegulons),将单个 TF 与它们各自的目标顺式调控区域和基因联系起来。他们确定了 582 个 eRegulons,其中 385 个转录激活因子和 197 个抑制因子,靶向 8134 个区域和 8048 个基因。他们使用来自人类新皮质的ChIP-seq 数据验证了 eRegulons 靶区域预测,发现 79% 的测试 TF 具有高于预期的重叠,其中 58% 显示出显著富集。预测的区域到基因连接也在 3D 基因组分析的增强子-启动子环中富集,进一步验证了已鉴定的 eRegulons 的有效性。
他们使用 AUCell定量了 eRegulons 活性,根据靶区域可及性或靶基因表达评估曲线下面积 (AUC) 得分,激活剂与靶标呈正相关,而抑制物则呈负相关。在激活剂中,他们恢复了已知的皮质祖细胞(EMX1 和 SALL1)、EN(FOXP1 和 TBR1)和 IN(ARX 和 LHX6)的主调节因子,并确定了细胞类型和年龄特异性的 eRegulons 是潜在的谱系决定因子(图3a)。
许多细胞类型特异性的 eRegulons 共有靶区域或基因,例如心室 RG(RG-vRG)中的TCF7L1和TCF7L2 、 EN-L4-IT 神经元中的GLIS1和SMAD3、 IN-MGE-PV 神经元中的 MAF和PRDM1 、星形胶质细胞-原生质细胞中的PAX6和SOX9以及 OPC 中的OLIG2和VSX1(图3b)。这些协同 TF 表现出三种作用模式:它们共有相同的基序和结合位点,可能有助于增加皮质发育过程中 GRN 的特异性和稳健性。
建立 GRN 后,他们旨在了解细胞类型特异性 eRegulons 如何控制皮质神经元分化。选择了 EN 谱系核,从 RG-vRG 推断出九条分化轨迹,并计算了每个细胞核的伪时间值(图3c)。除了一条导致晚期 RG 的轨迹[包括外部 RG (oRG) 和截短 RG (tRG)]外,其他八条轨迹都以终末分化的 EN 结束。使用广义加性模型,他们分析了每条轨迹上的 eRegulons 活性,并根据活动的时间模式将它们分为六个模块(图3d)。总体而言,所有六个模块沿伪时间都表现出不同的活动模式,但在不同轨迹上的模式具有可比性(图3d)。分别在早期、中期和晚期阶段活跃的模块促进了细胞分裂、形态发生和突触可塑性(图3e)。这些发现强调了大多数 eRegulons 在 EN 类型中表现出保守的活性,在神经元分化过程中控制着共同的细胞过程。
接下来,他们探索了定义 EN 身份的基因调控机制,确定了八条轨迹上的五个分叉点 (BP)(图3f)。值得注意的是,EN-L4-IT 神经元根据其起源区域分为两条轨迹(图3c-f),V1 特异性 EN-L4-IT 神经元在 BP2 处分支以跟随 EN-L2-3-IT,而 PFC 和 V1 共有 EN-L4-IT 神经元与 EN-L5-IT 细胞重叠(图 3f-g)。差异表达基因分析确定了 1908 个基因,将 V1 特异性和普通 EN-L4-IT 神经元区分开来(图3h)。接下来,他们使用来自 Allen Brain Atlas 的原位杂交 (ISH) 数据检测了差异表达基因的表达模式,证实CUX1和KCNIP1在 V1 的 L4 中富集,而 KCNAB1 在次级视觉皮层 (V2) 的 L4 中普遍存在。此外,V1 特异性和常见的 EN-L4-IT 神经元均表达了最近在成人人类皮层中报告的标志标记。这些发现突出了 V1 特异性 EN-L4-IT 神经元的独特发育轨迹。
为了识别与谱系分叉相关的 eRegulons,他们将轨迹分成五个部分,并在每个 BP 进行差异 eRegulons 活性分析。排名靠前的差异活性 eRegulons 包括对身份至关重要的已确定的 TF,例如上层 IT 神经元的CUX2 、非 IT 神经元的FEZF2和 EN 层 6b (EN-L6b) 神经元的NR4A2(图3i)。此外,他们还确定了假定的调节因子,包括IT 神经元的POU3F1、上层 IT 神经元的SMAD3和 V1 特异性 EN-L4-IT 神经元的CUX1(图3i-j)。这些结果揭示了驱动 EN 特征变化的遗传程序。
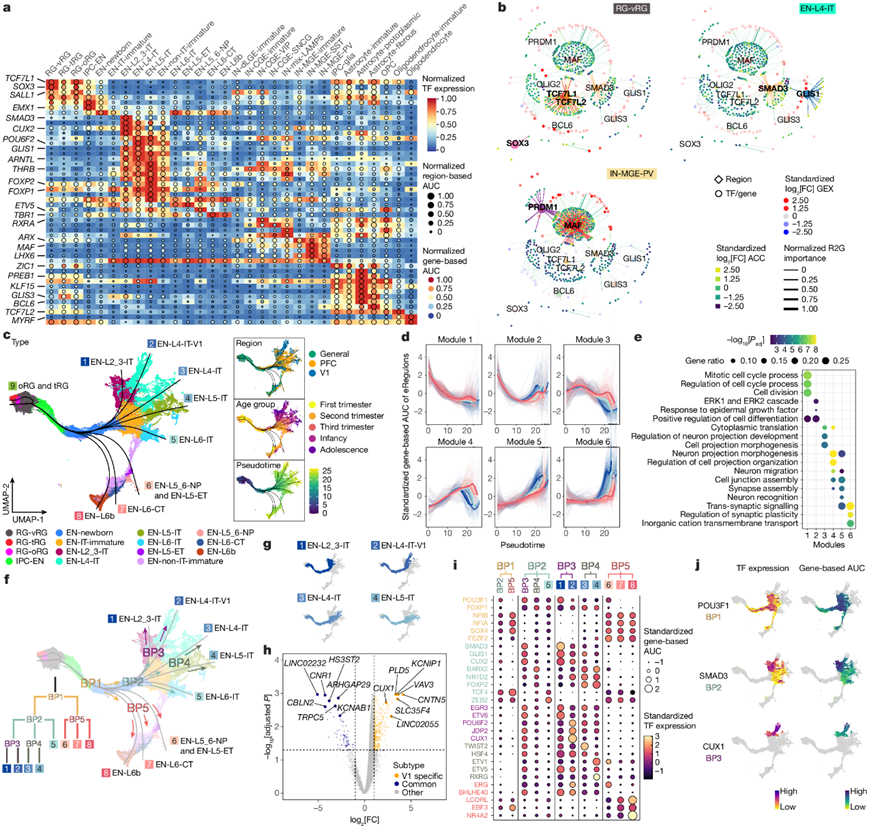
图3. 建立细胞身份的 GRN。
(a) 不同细胞类型中选择性 eRegulons 的最小-最大标准化 TF 表达水平、基于区域的 AUC 分数和基于基因的 AUC 分数。(b) 三种不同细胞类型(RG-vRG、EN-L4-IT 和 IN-MGE-PV)中选择性 eRegulons 的 GRN。(c) 属于 EN 谱系的细胞的 UMAP 图。(d) EN 谱系轨迹上六个 eRegulons 模块的标准化基于基因的 AUC 分数。(e) 单个 eRegulons 模块的靶基因的GO富集分析。(f) EN 分化过程中的 BP。(g) 四种 IT 神经元谱系的轨迹。(h) V1特异性和常见 EN-L4-IT 神经元之间差异表达的基因。(i) 参与 BP 处轨迹确定的代表性 eRegulons(激活剂)。(j) 参与BP处轨迹确定的代表性 eRegulons 的 UMAP 表示。
04
神经胶质祖细胞的谱系潜力
他们利用在 GW20 和 GW24 之间收集的 snMultiome 数据并探索了表面蛋白标志物的表达模式,鉴定了五种蛋白质,它们的组合表达可区分中期妊娠晚期的不同神经胶质细胞类型(图4a)。使用组织解剖、表面染色和荧光激活细胞分选,他们从中期妊娠晚期人类皮质中分离出四种神经胶质祖细胞:RG-tRG、RG-oRG、IPC-glia 和 OPC(图4b)。在不含生长因子的基础培养基中培养 5 天后,RG-tRG 和 RG-oRG 呈现单极特征,具有较大的胞体和类似于放射状纤维的长突起,而 IPC-glia 大多为双极或寡极,具有较短的突起(图4b)。 OPC 呈现出浓密的形态,表明已分化为髓鞘形成前的少突胶质细胞。OPC 培养物中的大多数细胞在 8 天内死亡,这与它们对生长因子的依赖性一致。因此,他们随后的分析重点是 RG-tRG、RG-oRG 和 IPC-glia。通过体外第一天的免疫染色 (DIV1) 验证了细胞身份。RG-tRG 和 RG-oRG 表达祖细胞标记物 TFAP2C,其中 CRYAB 专门在 RG-tRG 中表达。IPC-glia 对 OLIG2 和 EGFR 呈阳性。所有培养物中很少有细胞表达 EN 标记物 NeuN、星形胶质细胞标记物 SPARCL1 或 IN 标记物 DLX5。此外,很少有细胞仅为 OLIG2+,表明来自 OPC 或少突胶质细胞的污染最少。
验证分离策略后,他们让细胞在没有生长因子的情况下分化 14 天,并在 DIV0、DIV7 和 DIV14 进行 scRNA-seq 以追踪分化。细胞根据分化阶段、种子细胞类型和身份在 UMAP 中聚类,揭示出十种不同的细胞类型,与来自 snMultiome 数据的体内群体非常匹配。来自 DIV0 的数据证实了分选细胞的身份(图4c)。在 DIV7 时,IPC-glia 培养物中出现了三种类型的后代-星形胶质细胞(9.4%)、OPC(1.1%)和 IN 谱系细胞,即DLX5+ BEST3+ IPC-IN(26.2%)和DLX5 + BEST3-IN(19.9%)(图4c)。因此,他们将 IPC-glia 重命名为 Tri-IPC 以突出它们的三能性。低 OPC 比例(DIV7 上为 1.1%,DIV14 上为 1.8%)可归因于缺少其存活所需的生长因子。相比之下,RG-tRG 和 RG-oRG 在 DIV7 时分化为 IPC-EN,并在 DIV14 时分化为 EN,表明它们在妊娠中期后期继续产生 EN(图4c)。到 DIV7 时,Tri-IPC 也出现在 RG 培养物中(3.0% 和 6.3%),同时出现了少量 IPC-IN(1.0% 和 3.0%),但没有出现 IN。到 DIV14 时,星形胶质细胞(0.7% 和 1.8%)、OPC(1.5% 和 1.8%)和 IN(5.4% 和 9.1%)均已出现(图4c)。RG 培养物中 IN 的延迟出现与最近研究结果一致,表明它们通过 Tri-IPC 间接产生 IN。
到目前为止描述的谱系追踪实验都是在群体水平上进行的。为了在单细胞水平上评估神经胶质祖细胞的谱系潜力,他们分离了单个 RG-tRG、RG-oRG 和 Tri-IPC,并将它们培养 14 天以产生克隆后代。约 30% 的 RG-tRG 和 RG-oRG 克隆同时包含 IPC-EN 和 Tri-IPC,说明单个 RG 会产生两种细胞类型(图4d)。约 80% 的 Tri-IPC 克隆产生了星形胶质细胞、OPC 和 IN,证实了它们的三重潜能性质(图4d)。当移植到离体培养的人类皮质切片上时,RG 在 8 天内主要产生 IPC-EN,而 Tri-IPC 产生星形胶质细胞、OPC 和 IN,这与体外研究结果一致。为了评估体内 Tri-IPC 的潜力,他们将它们移植到出生后早期免疫缺陷小鼠体内。12 周后,Tri-IPC 在深层皮质层、白质和 SVZ 中产生了 GFAP +星形胶质细胞、SOX10 +少突胶质细胞谱系细胞和 GABA + IN(图4e),这些结果证实 Tri-IPC 是三潜能神经祖细胞。
为了鉴定 Tri-IPC 产生的 IN 亚型,他们使用了来自人类神经节隆起的 scRNA-seq 数据作为参考,并根据已知标记基因对中间神经元亚型进行了注释。基于此参考使用 SingleCellNet的随机森林分类器模型显示,Tri-IPC 衍生的 IN 与来自 dLGE 和 CGE 的MEIS2+ PAX6+ IN 非常相似(图4f),与它们在 snMultiome 数据中映射到 IN-dLGE 未成熟神经元一致。这些细胞也是SP8+ SCGN +,预计会发育成嗅球和白质中间神经元。他们的 MERFISH 数据进一步支持了这一点,显示出生前和出生后端脑的白质中存在 Tri-IPC 和 IN-dLGE 未成熟细胞,并表明一些 IN-dLGE 未成熟细胞可能起源于 Tri-IPC。他们将它们重新命名为新皮质和背神经节隆起衍生的未成熟 IN(IN-NCx_dGE-immature),以反映其更广泛的起源。使用 Seurat 进行基于最近邻的标签转移也获得了类似的结果(图4f)。此外,他们旨在对来自 Tri-IPC 的星形胶质细胞类型进行分类。他们还对来自 Tri-IPC 的星形胶质细胞进行了分类。Tri-IPC 衍生的星形胶质细胞定位到 Olig2(原生质)和 S100a11(纤维)谱系(图4f)。这些发现促使他们建立了一个更新的中期妊娠晚期人类神经祖细胞谱系潜能模型(图4g)。
Tri-IPC 产生神经元、少突胶质细胞谱系细胞和星形胶质细胞,所有这些都是胶质母细胞瘤 (GBM) 的重要组成部分。先前的研究还在恶性 GBM 细胞中发现了类似神经胶质祖细胞的细胞群。他们利用发育图谱,使用 SingleCellNet 平台训练了一个多类分类器进行细胞类型分配。然后,使用训练后的模型将恶性 GBM 细胞与发育皮质中最接近的细胞进行匹配。这些结果显示,超过一半的恶性 GBM 细胞在转录上类似于 Tri-IPC(图4h-j)。此外,Tri-IPC 是先前定义的所有四种肿瘤细胞状态中最丰富的映射细胞类型(图4j),存在于 87% 的所有 GBM 样本中。第二丰富的细胞类型是血管细胞,可能对应于神经胶质样伤口反应状态(图4j)。GBM 中的其他主要细胞类型包括 OPC、少突胶质细胞-未成熟、星形胶质细胞-纤维和 IN-NCx_dGE-immature(图4j),所有都是潜在的 Tri-IPC 后代。这些结果表明,GBM 细胞劫持 Tri-IPC 多能性和增殖,以驱动肿瘤异质性和快速生长。
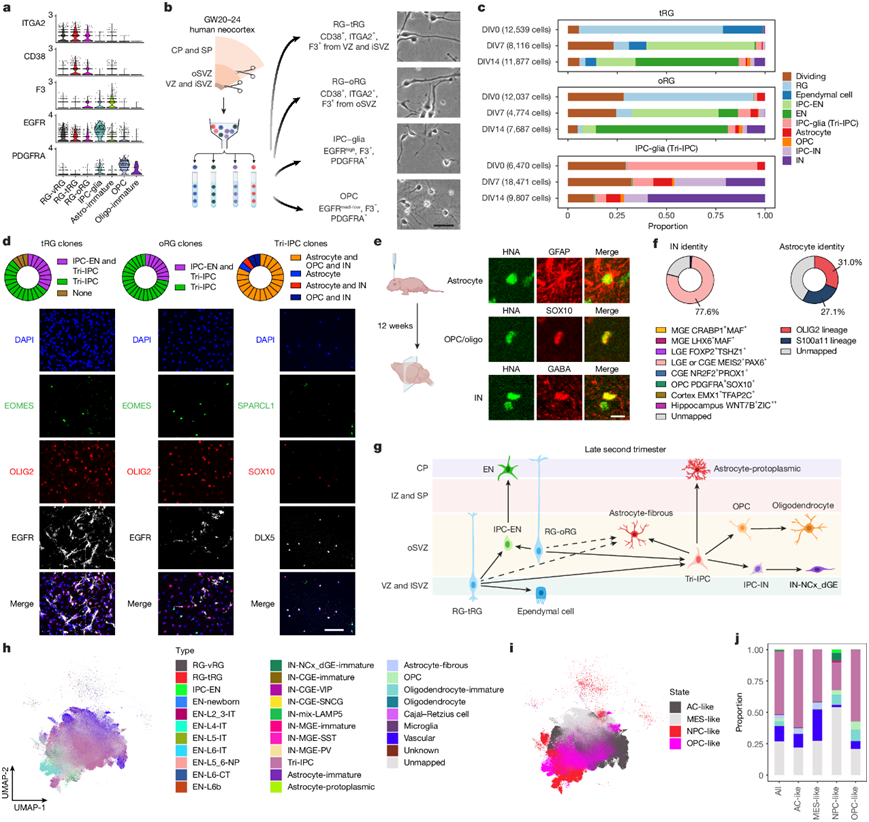
图4. 从神经发生到神经胶质发生的转变过程中的多能祖细胞。
(a) 用于祖细胞分离的表面蛋白的表达模式。(b) 左:分离祖细胞亚型的分选策略示意图。右:培养 5 天后祖细胞亚型的相位对比图像。(c) 体外祖细胞分化过程中,各个细胞类型在祖细胞亚型和分化阶段中的比例。(d) 克隆分析显示单个祖细胞的多能性。(e) 移植到小鼠皮层 12 周后 Tri-IPC 后代的免疫染色。(f) SingleCellNet 预测的源自 Tri-IPC 的 IN 和星形胶质细胞的身份。(g) 妊娠中期晚期人类新皮质中细胞谱系关系的图形摘要。(h) 按SingleCellNet 预测的细胞类型颜色编码的恶性 GBM 细胞的 UMAP 图。(i) 按主要细胞状态颜色编码的恶性 GBM 细胞的 UMAP 图。(j) 恶性 GBM 细胞中不同细胞状态下预测的细胞类型的比例。
05
细胞类型与认知和疾病的相关性
利用染色质可及性数据,他们应用 SCAVENGE将全基因组关联研究 (GWAS) 变异映射到其相关的细胞环境。具体而言,该算法定量了可及区域内 GWAS 变异的富集,并通过网络传播解决了单细胞谱的稀疏性问题。富集强度通过单细胞水平上的性状相关性评分 (TRS) 和细胞组水平上显著富集细胞的比例来量化。使用这种方法,他们分析了四种认知特征和五种神经精神疾病。对于认知特征,流体智力和处理速度与 IT 神经元相关,这与成年人脑的发现一致(图5a-c)。此外,他们惊讶地观察到 RG 与执行功能之间以及小胶质细胞与工作记忆之间的关联(图5a-c),但这些关联的确切机制仍有待阐明。至于精神疾病,所有疾病都与 EN 表现出显著关联(图5b-c)。双向情感障碍 (BPD)、精神分裂症 (SCZ) 和注意力缺陷多动障碍 (ADHD),但自闭症谱系障碍 (ASD) 或重度抑郁障碍 (MDD) 与 IN 有关(图5b-c)。值得注意的是,在 ASD 和特定 IT 类型(EN-IT-未成熟和 EN-L6-IT 神经元)之间发现了一些最强的关联。作为对照,他们分析了阿尔茨海默病,已知该病在小胶质细胞中具有很强的遗传性成分。他们观察到小胶质细胞中富集最强,血管细胞和星形胶质细胞中也显著富集,与它们与阿尔茨海默病的关联一致。
除了细胞类型之外,他们还比较了大脑区域和年龄组之间的特征关联,结果发现不同年龄组之间的差异更为明显。例如,ASD 风险在妊娠中期达到峰值,而 BPD 和 SCZ 在婴儿期达到峰值。鉴于 EN 中的风险富集最为显著(图5b-c),他们推测它们以 EN 分化的不同阶段为目标。为了验证这一点,他们选择了 EN 谱系细胞并分析了其伪时间中的 TRS 模式(图5d)。事实上,ASD 显示出最早的 TRS 峰值,其次是 MDD、BPD 和 SCZ,这种模式与 ASD 与其他疾病相比发病较早相一致。为了探究 EN 分化过程中由风险变异破坏的潜在 GRN,他们确定了活性与每种情况下的 TRS 呈正相关的 eRegulons(图5e)。在与 ASD 相关的前十大 eRegulons 的核心 TF 中,有六个在 SFARI 基因数据库中确认为 ASD 风险基因。总之,他们的分析不仅发现了与认知特征和脑部疾病最相关的细胞类型和发育阶段,还阐明了潜在的疾病机制。
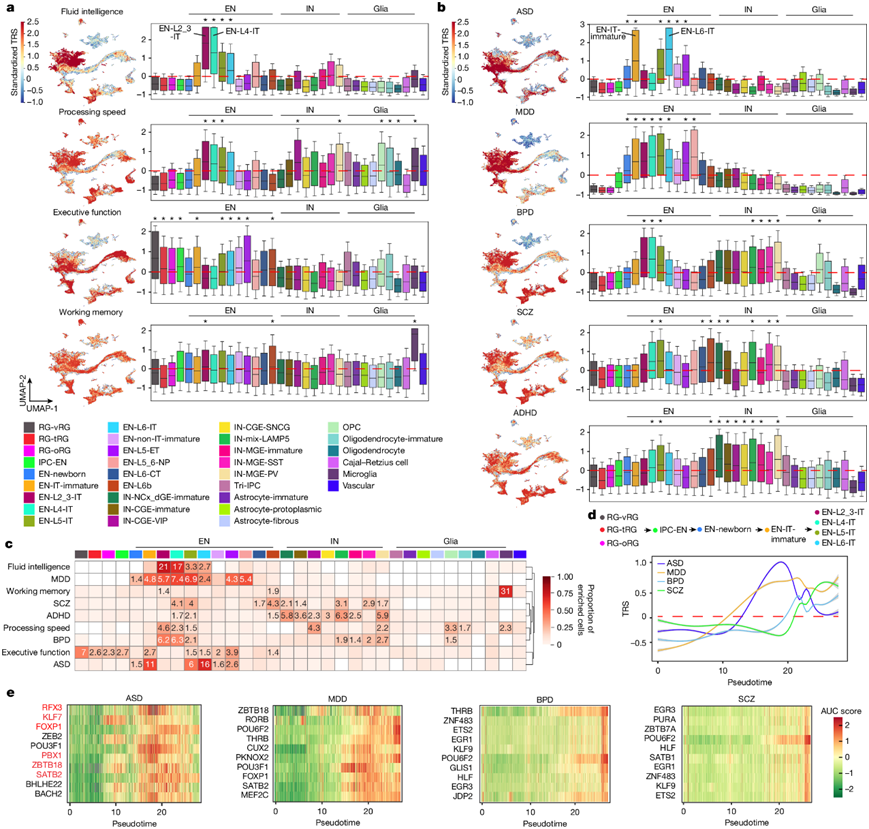
图5. 细胞类型与人类认知和脑部疾病的关系。
(a) 四种认知功能的标准化每细胞 SCAVENGE TRS。(b) 五种脑部疾病(包括 ASD、MDD、BPD、ADHD 和 SCZ)的标准化每细胞 SCAVENGE TRS。(c) 跨细胞类型具有富集性状相关性的细胞比例。(d) 沿IT神经元谱系伪时间绘制的四种脑部疾病的标准化 SCAVENGE TRS。(e) 按 Spearman ρ沿 IT 神经元谱系伪时间排序的前十大疾病相关 eRegulons(激活剂)的标准化基于基因的 AUC 得分。
+ + + + + + + + + + +
结 论
本研究从 38 个人类新皮质样本中收集了成对的单核染色质可及性和转录组数据,这些样本涵盖前额叶皮质和初级视觉皮质。这些样本涵盖五个主要发育阶段,从妊娠前三个月到青春期。同时,本研究对一部分样本进行了空间转录组分析,以阐明空间组织和细胞间通讯。该图谱能够分类神经分化背后的细胞类型特异性、年龄特异性和区域特异性基因调控网络。此外,结合单细胞分析、祖细胞纯化和谱系追踪实验,本研究发现了神经发生到神经胶质生成转变过程中祖细胞亚型之间复杂的谱系关系,确定了一种三潜能中间祖细胞亚型Tri-IPC、负责局部产生 GABA 能神经元、少突胶质细胞前体细胞和星形胶质细胞。值得注意的是,大多数胶质母细胞瘤细胞在转录组水平上与 Tri-IPC 相似,这表明癌细胞劫持了发育过程以增强生长和异质性。此外,通过将图谱数据与大规模全基因组关联研究数据相结合,本研究创建了一个疾病风险图,突出显示了中期妊娠端脑神经元中与自闭症谱系障碍相关的丰富风险。
+ + + + +



 English
English


