文献解读|Nat Commun(14.7):视网膜色素上皮的多组学分析揭示了创伤性增生性玻璃体视网膜病变中增强子驱动的 RANK-NFATc1 信号激活
✦ +
+
论文ID
原名:Multi-omics profiling of retinal pigment epithelium reveals enhancer-driven activation of RANK-NFATc1 signaling in traumatic proliferative vitreoretinopathy
译名:视网膜色素上皮的多组学分析揭示了创伤性增生性玻璃体视网膜病变中增强子驱动的 RANK-NFATc1 信号激活
期刊:Nature Communications
影响因子:14.7
发表时间:2024.08.25
DOI号:10.1038/s41467-024-51624-y
背 景
开放性眼球损伤 (OGI) 是一种严重的眼科急症,常常导致失明。外伤性增生性玻璃体视网膜病变 (PVR) 是 OGI 的主要并发症,大约 40–60% 的 OGI 后患者会出现该症状。在眼部创伤后增生性玻璃体视网膜病变 (PVR) 进展过程中,先前处于静止状态的视网膜色素上皮 (RPE) 细胞转变为快速增殖、迁移和分泌的状态。这些变化背后难以捉摸的分子机制阻碍了有效药物治疗的发展,带来了紧迫的临床挑战。
实验设计
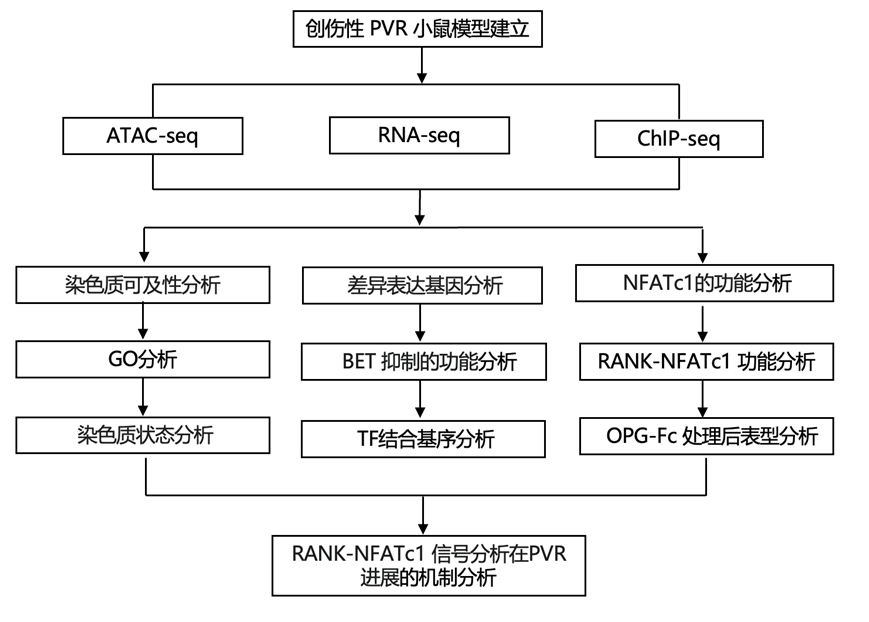
结 果
01
PVR 进展过程中 RPE 细胞动态表观遗传景观的表征
为了阐明损伤后 PVR 发病机制的表观遗传机制,研究团队首先建立了创伤性 PVR 小鼠模型。通过眼部穿刺,诱发了全层视网膜损伤,与 OGI 患者的穿透性伤口非常相似。随后的 Dispase 注射加重了眼内组织损伤,促进了 PVR 的形成。从这些小鼠中纯化了原代 RPE 细胞,并进行了转座酶可及染色质测序(ATAC-seq)、染色质免疫沉淀后测序(ChIP-seq)和转录组分析(RNA-seq) (图1A)。使用 HOMER 分析,他们在 PVR 组中确定了 9819 个可及性增加的峰和 1454 个可及性降低的峰(图1B)。这些差异可及性区域 (DAR) 主要位于顺式调控区域,包括启动子、内含子和基因间区域(图 1C)。GO分析表明,PVR 开放基因组区域主要与控制细胞迁移、分裂和上皮-间质转化的通路一致(图 1D)。这些结果表明RPE 细胞在 PVR 过程中发生 EMT,并强调 RPE 细胞迁移和增殖在 PVR 进展中的作用。PVR 封闭基因组区域富含对运输过程至关重要的基因,表明 RPE 细胞在 PVR 进展过程中可能会失去其固有的细胞功能。MDM2(小鼠双微体 2)是P53的E3连接酶,可促进RPE细胞的EMT。
使用 ChromHMM,他们整合了 ChIP-seq 数据来定义染色质状态(图1E),包括四类染色质状态:异染色质(状态 5 和 7)、增强子(状态 2 和 3)、转录基因(状态 1 和 4)和空白/无信号状态(状态 6)。值得注意的是,他们观察到 PVR 组中从状态 3(弱增强子)明显转变为状态 2(强增强子),这表明随着 PVR 的进展,增强子发生激活(图 1F)。
组蛋白修饰和染色质可及性错综复杂地交织在一起,协同调节参与细胞命运决定的关键基因的表达。为了辨别染色质状态改变是否与染色质可及性一致,他们检测了明显的 H3K27ac 信号区域(增强子标记)内的 H3K4me1 和染色质可及性信号。在与 H3K27ac 增加相关的区域中,H3K4me1 的染色质富集显著增加,染色质可及性增强(图 1G),这表明在 PVR 进展过程中,增强子活性与 RPE 细胞中染色质可及性的增加是一致的。波形蛋白(Vimentin)是先前在 PVR 膜中发现的纤维化标志物,在 RPE 细胞的 EMT 中起着至关重要的作用。与正常 RPE 细胞相比,PVR RPE 细胞中的Runx1和Vim基因表现出染色质可及性增强,H3K27ac、H3K4me1 和 H3K4me3 水平升高,而其他组蛋白修饰则保持相对不变(图 1H)。总之,这些发现揭示了损伤后驱动 PVR 发展的表观遗传基础,在 PVR 进展过程中,RPE 细胞中增强子的激活和染色质可及性增强。
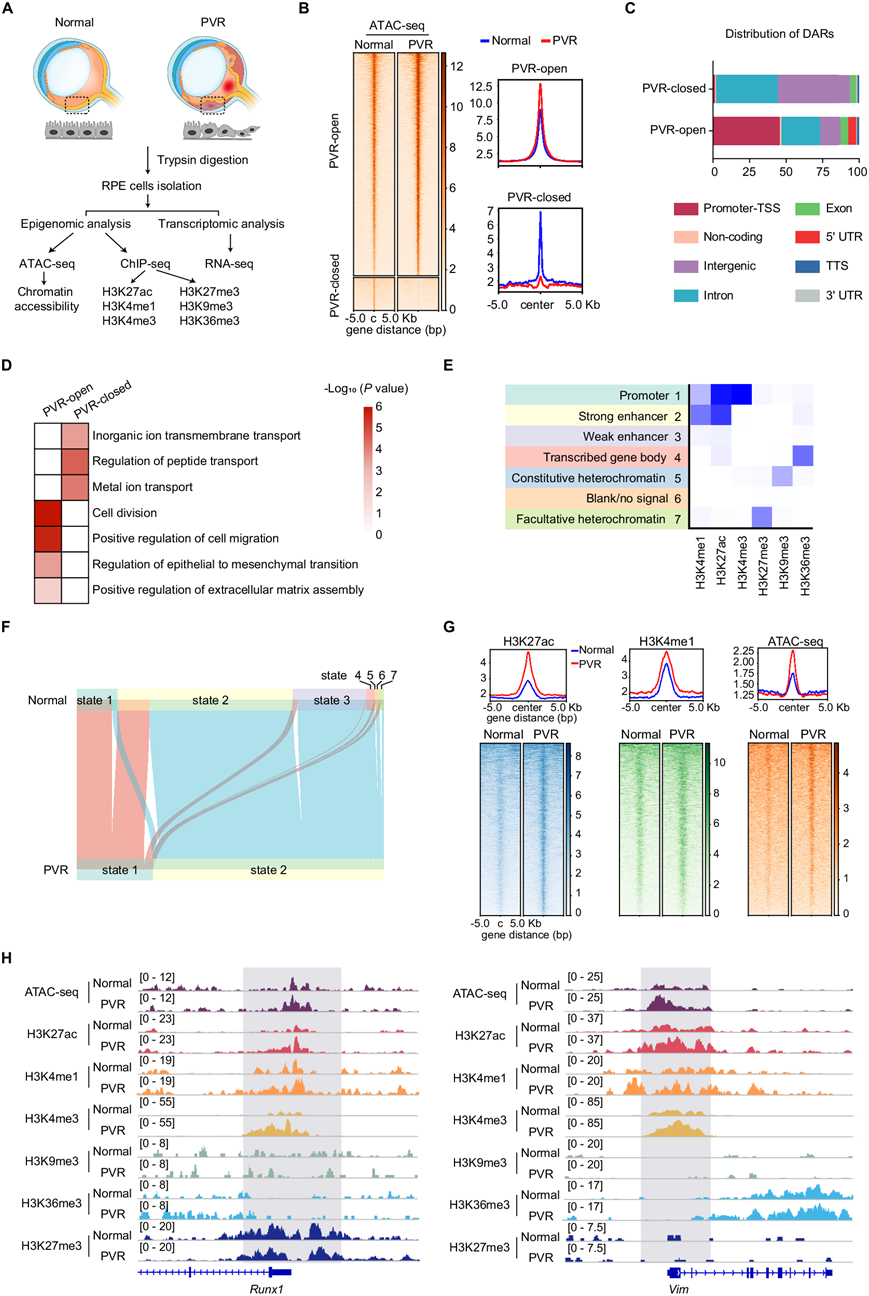
图1. PVR 后 RPE 中动态表观遗传变化的分析。
(A) 实验流程包括ATAC-seq、ChIP-seq 和 RNA-seq 实验。(B) 热图显示正常和 PVR 小鼠 RPE 细胞中染色质的可及性。(C) 条形图显示 RPE 细胞中差异可及区域 (DAR) 的全基因组分布。(D) GO分析。(E) 基于 ChromHMM 算法的七种染色质状态推断。(F) 冲积图显示染色质状态的动态。(G) H3K27ac 信号区域的平均 H3K4me1 ATAC-seq 和 ChIP-seq 信号(上),以及组蛋白标记和 ATAC-seq 信号的热图可视化(下)。(H) H3K27ac、H3K4me1、H3K4me3、H3K9me3、H3K36me3、H3K27me3 和 ATAC-seq 信号的代表性 ChIP-seq 轨迹。
02
活性染色质状态与 PVR 相关基因表达程序的上调相关
染色质可及性的增加与增强子的激活相结合,是激活基因表达的关键调控机制。鉴于关键基因的激活在细胞命运转变中起着关键作用,他们试图探索 PVR 中的这些表观遗传变化与相应的 PVR 相关基因表达程序之间的联系。为此,他们对从正常和 PVR 小鼠中纯化的 RPE 细胞进行了RNA-seq。DESEQ2 算法分析显示正常 RPE 细胞和PVR RPE 细胞之间的转录组谱存在显著差异(图 2A)。与正常对照相比,在 PVR 中发现总共 2004 个基因上调,543 个基因下调超过 2 倍(图 2B)。 GO分析显示,下调的基因主要包括视网膜功能相关基因,例如参与光刺激的感觉知觉、感觉器官发育和视网膜稳态的基因(图 2C),表明在PVR进展过程中RPE细胞的功能状态受损。相反,上调的基因富集在包括细胞外基质组织、胶原代谢过程和细胞因子产生调节在内的通路中(图 2C),表明PVR中的纤维化和炎症活动增强。基因集富集分析(GSEA)表明,在PVR RPE细胞中上调的基因中,来自PVR开放染色质区域的区域的基因特别普遍(图 2D)。RNA-seq和ChIP-seq数据的综合分析表明,具有明显H3K27ac信号的区域与基因激活相关,而H3K27ac信号减弱或稳定的区域则相反(图 2E)。总之,上述发现强调了活跃染色质状态与 PVR 相关基因增强表达之间的密切相关性。
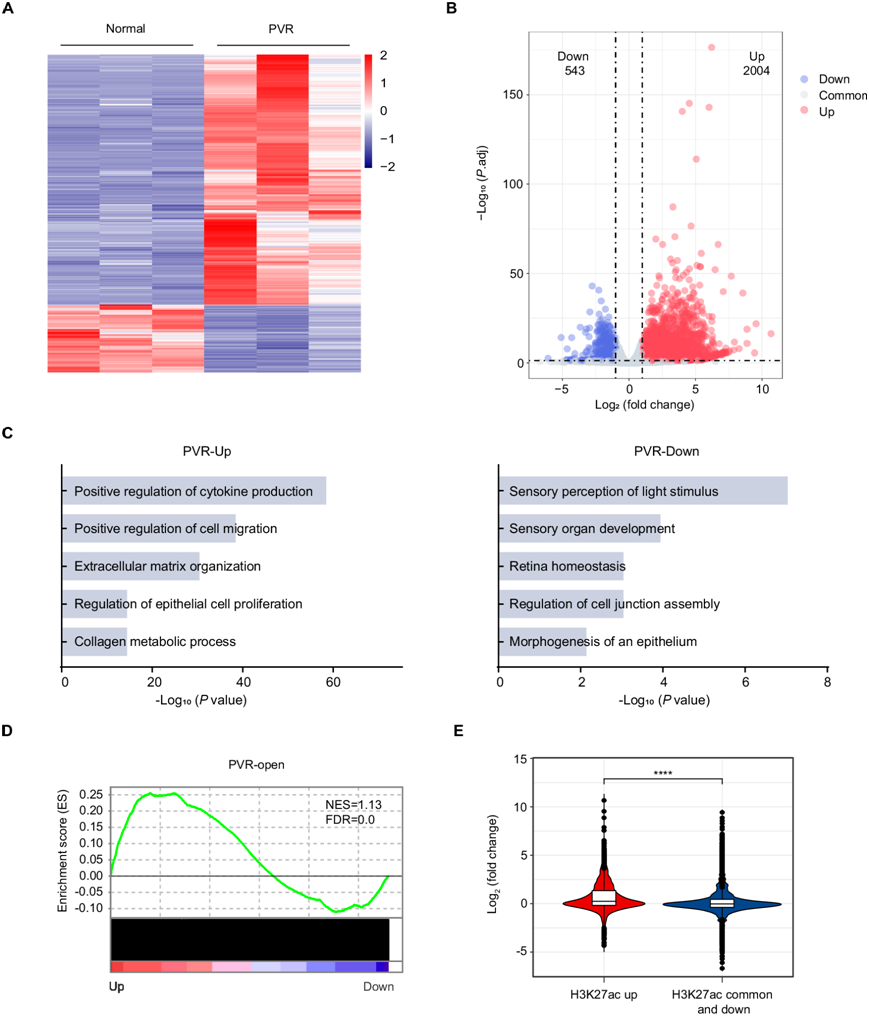
图2. 活跃的染色质状态与 PVR 相关基因的表达升高有关。
(A) RPE 细胞中差异基因表达的热图。(B) 火山图显示差异表达基因。(C) GO分析。(D) 基因集富集分析 (GSEA)。(E) 小提琴图显示标记有较高水平 H3K27ac 的基因与基因激活显著相关。
03
BET 抑制可减轻 PVR 进展
H3K27 乙酰基标记存在于活性增强子和开放染色质区域,可作为表观基因组读取蛋白募集的对接位点。溴结构域和额外末端结构域 (BET) 蛋白可识别乙酰化组蛋白并协调活性增强子处转录机制的组装。BET蛋白BRD4的小分子抑制剂(如 JQ1)可与 BRD4 溴结构域的乙酰-赖氨酸结合口袋结合,将 BRD4 从染色质中取代。这种取代导致介导复合物和 RNA 聚合酶 II 从增强子中去除,随后降低相关基因表达。鉴于增强子激活基因与 PVR 进展之间存在显著相关性,他们试图探索 JQ1 介导的增强子抑制在治疗 PVR 中的潜在治疗效果。为了避免全身副作用并提供 DMSO 替代品作为溶剂,他们配制了一种专门用于 JQ1 眼内递送的纳米乳剂(eNano-JQ1)(图 3A)。eNano-JQ1 稀释十倍后的平均尺寸为 21.89 ± 0.36 nm,平均 Zeta 电位为 −6.96 ± 1.36 mV(图3C),其观结构显示出均匀的球形和分散性。平均尺寸和多分散指数 (PDI)在 1-7 天内保持一致,并且在稀释 10-200 倍后也保持一致,表明具有可靠的储存稳定性(图 3D)。合成后七天进行的后续体外释放研究表明,eNano-JQ1 比游离 JQ1 提供了更一致和更持久的释放,累计释放率超过 80% (图 3E)。
接下来,他们评估 eNano-JQ1 在 PVR 小鼠模型中的治疗潜力。OCT 成像证实 eNano-JQ1 组的视网膜厚度有所改善,且在隆起的视网膜区域没有增生膜(图3F)。进一步的组织学分析显示,与对照组相比,eNano-JQ1 组的玻璃体血肿减少、视网膜结构更清晰、纤维化样病变更少。利用既定的分级标准,接受 eNano-JQ1 治疗的眼睛与接受载体治疗的眼睛相比显示出更轻微的 PVR 表型(图 3G)。小鼠眼罩组织中 αSMA 表达的降低(图 3H)及其在冷冻小鼠眼切片中定位的减少(图 3I),凸显了 eNano-JQ1 显著的抗纤维化功效。PVR 膜明显更薄、分布更不均匀,视网膜结构保存得更好。总体而言,这些研究结果强调了 eNano-JQ1 对小鼠 PVR 进展的强大抑制作用。
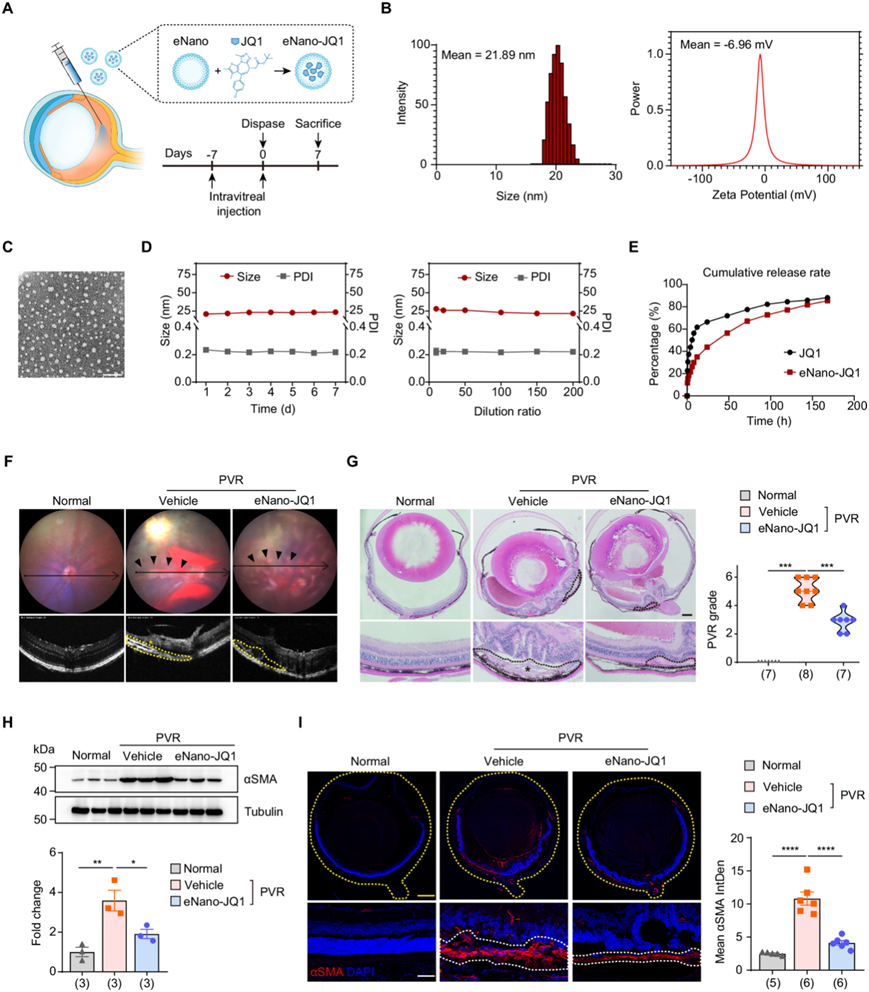
图3. 抑制 BET 溴结构域可减轻 PVR 的进展。
(A) PVR 小鼠模型中的实验策略示意图。(B) eNano-JQ1 的尺寸和电位。(C) eNano-JQ1 的透射电子显微镜图像。(D) 通过测量不同时间(左)和稀释率(右)下的尺寸和多分散性指数 (PDI) 的变化来评估稳定性。(E) eNano-JQ1 中 JQ1 的释放曲线。(F) 小鼠的代表性眼底成像和 OCT 图像。(G) 小鼠眼部切片的代表性 H&E 染色(左),PVR 严重程度(右)。(H)免疫印迹分析。(I) 代表性免疫荧光染色分析。
04
PVR中转录调控网络的识别
染色质状态主要由转录因子介导的染色质重塑决定,为了识别参与重塑 PVR 表观遗传景观的关键转录因子(TF),他们评估了 PVR 开放区域内 TF 基序的富集情况。通过整合转录组数据,精确定位了在 PVR 进展过程中上调的 TF,确定了 12 种 TF,它们的结合基序富集且在 PVR RPE 细胞中的表达升高(图 4A-B)。TF 通常相互作用以形成调控网络,从而增强转录活性。接下来,他们根据 TRN 通过结合基序和表达水平的互连性对其进行了映射(图 4C)。值得注意的是,Nfatc1、Tgif1、Rel、Creb5、Prdm1、Bach1 和 Smad3 是具有自我调节性的 TF(图 4D),它们可以作为放大器协同作用以加强 PVR 相关的基因表达程序,Nfatc1的可及区域包含这些 TRN TF 的基序(图4E)。已知 TGF-β 信号通路在 PVR 进展中起着重要作用,而 Smad3 抑制可以减缓疾病的进程。
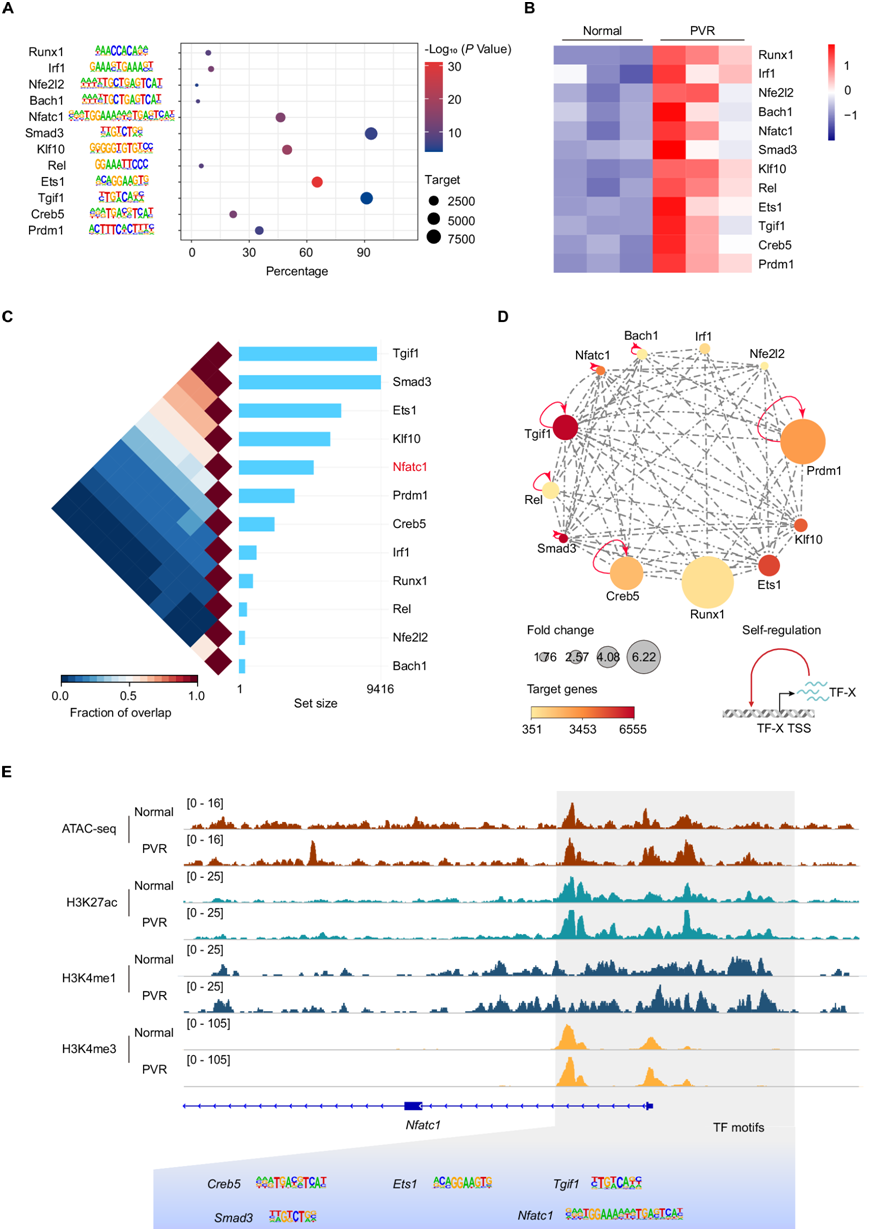
图4. 揭示 PVR 背后的转录调控网络。
(A) 气泡图显示转录因子 ( TF ) 结合基序在 PVR-开放区域的富集。(B) 热图描绘了 TF 的 FPKM 值。(C) 三角形热图显示 TF 的共定位。(D) PVR的TF调控网络。(E) H3K27ac、H3K4me1 和 H3K4me3 的 IGV 轨道概况。
05
抑制 RPE 细胞中的 NFATc1 可减轻 PVR 进展
他们首先验证了 PVR 后 NFATc1 的表达。PVR 中 NFATc1 的 mRNA 和蛋白质水平均显著升高(图 5A-B)。随后对 RPE 细胞进行免疫荧光测定(与 NFATc1 和紧密连接蛋白 ZO-1 共染色),结果显示,虽然 ZO-1 通常划定健康 RPE 细胞的规则六边形结构,但 PVR 后其完整性受到损害。值得注意的是,PVR 小鼠中 NFATc1 的荧光强度显著升高,并伴有明显的核易位(图 5C)。重要的是,还观察到与对照相比,TPVR 患者的 RPE 细胞中 NFATc1 的表达升高(图 5D)。响应外部信号,NFATc1 可以从细胞质转移到细胞核,随后激活下游靶基因。因此,他们评估了 NFATc1 靶基因的表达,包括Mmp9和Ctsk,这些基因的 mRNA 水平在 PVR 后均增加。
NFATc1 在 PVR 中的表达和转录活性升高促使他们推测抑制它是否可以减缓 PVR 进展。视网膜下注射重组腺相关病毒 2/2 型 (rAAV2/2) 已广泛用于将治疗基因特异性地递送到 RPE 细胞。因此,他们设计了两个带有针对NFATc1 的shRNA 序列的rAAV2/2 载体(rAAV2/2-sh-Nfatc1) 并评估它们对 PVR 进展的影响(图 5E)。用 rAAV2/2-sh-Nfatc1 处理的 PVR 小鼠表现出眼底混浊、小块出血和视网膜皱褶减少,但通过 OCT 扫描未检测到明显的视网膜脱离或大面积的 PVR 膜(图 5F)。眼部切片的组织学检查表明,沉默NFATc1可抑制视网膜下膜的增殖,减轻视网膜的牵引性损伤,从而降低 PVR 的严重程度(图 5G-H)。免疫印迹分析显示 NFATc1 总蛋白水平显著降低,证实了 NFATc1 的敲低效率。同时,αSMA 蛋白表达的下降表明眼部组织内纤维化减少(图 5I)。小鼠眼部切片中 αSMA 蛋白的免疫染色显示,在注射 rAAV2/2-sh-Nfatc1 后,PVR 小鼠视网膜下方 αSMA 阳性区域的厚度和范围减小,这与视网膜皱褶减少和视网膜脱离面积受限相关(图 5J-K)。总的来说,这些发现表明,特异性抑制 RPE 细胞中的 NFATc1 可减轻 PVR 进展。
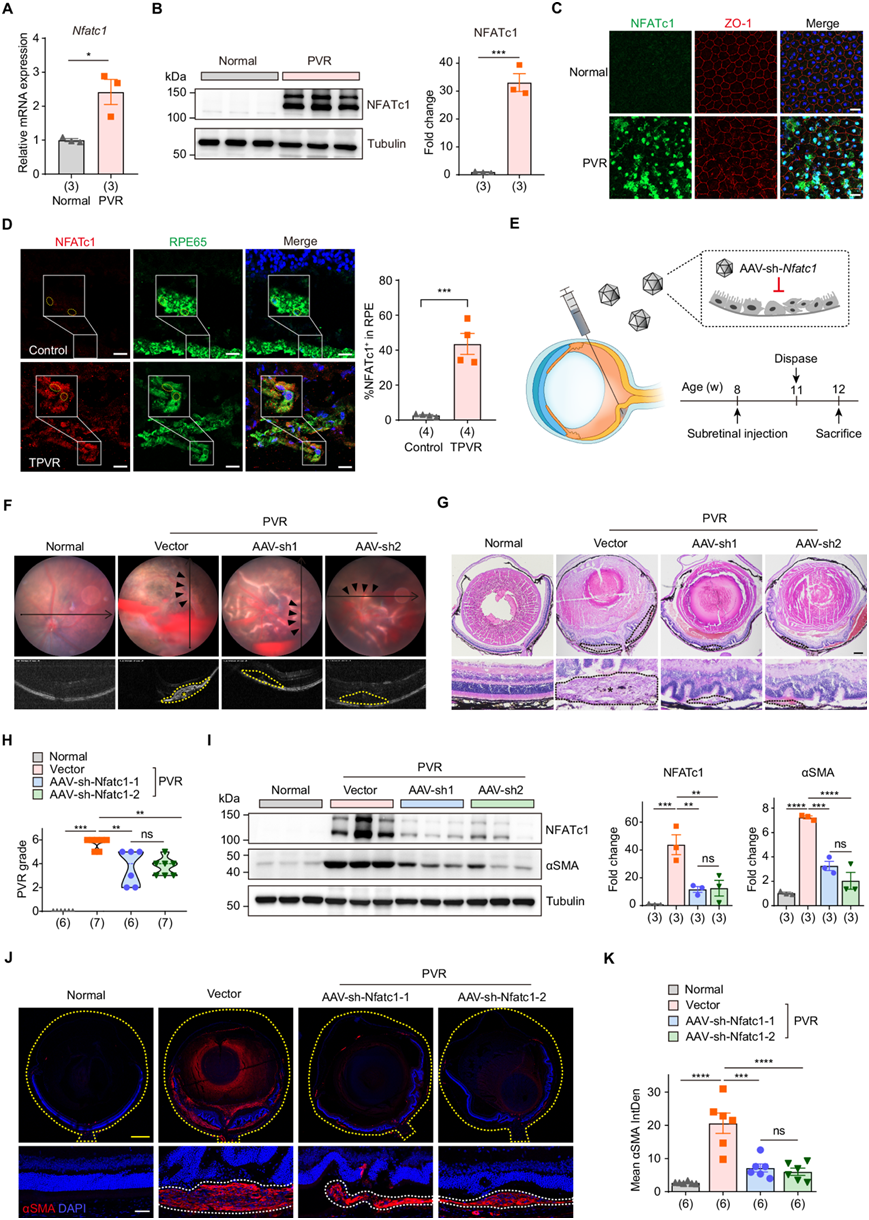
图5. 抑制 RPE 中的 NFATc1 可减缓 PVR 进展。
(A) RT-qPCR 分析原代 RPE 细胞中的NFATc1表达。 (B) 免疫印迹分析。(C) 正常和 PVR 小鼠 RPE 平板中 NFATc1 的免疫荧光染色。(D) 人PVR 膜和供体眼切片中 NFATc1 和 RPE65 的免疫荧光染色。(E) PVR 小鼠模型中的实验策略示意图。(F) 小鼠的代表性眼底成像和 OCT 图像。(G) 小鼠眼部切片的代表性 H&E 染色。(H) PVR严重程度的定量。(I) 免疫印迹分析。(J) 小鼠眼部切片中 αSMA 的代表性免疫荧光染色。(K) αSMA 平均荧光积分密度的定量。
06
阻断 RANK-NFATc1 轴可缓解 PVR 进展
RANK(核因子 κB 受体激活剂)是一种细胞表面受体,与其配体 RANKL 结合后,会引发一系列细胞内信号传导事件,最终导致 NFATc1 的激活和随后的核易位。与正常对照组相比,PVR 组的 Tnfrsf11a启动子上游区域的染色质可及性增加,同时 H3K27ac 和 H3K4me1 标记升高(图6A)。此外,PVR 后 RANK 的 mRNA 和蛋白质水平均升高(图 6B-C)。RANK 通过调节中间通路来增强 NFATc1 的活化。与此一致,PVR 小鼠中 p38 MAPK 和 p65 NF-κB 的磷酸化均升高(图 6D)。这些观察结果共同表明,RANK 通路在 PVR 进展过程中发生激活。
骨保护素 (OPG) 充当可溶性诱饵受体,与 RANKL 结合,阻止其与 RANK 相互作用,从而抑制 RANK 通路。因此,他们采用 OPG-Fc 抑制 RANK 通路并检查其对 PVR 进展的影响(图 6E)。随后的 OCT 扫描和组织学评估表明,OPG-Fc 处理可减少前视网膜出血、减少视网膜皱褶形成和减少视网膜脱离,从而降低 PVR 严重程度评分(图 6F-G)。此外,免疫印迹和免疫荧光试验均显示 αSMA 水平下降,表明 OPG 治疗后眼内纤维化减弱(图 6H-J)。总之,这些结果强调了抑制 RANK(NFATc1 上游调节因子)对 PVR 进展的保护作用。
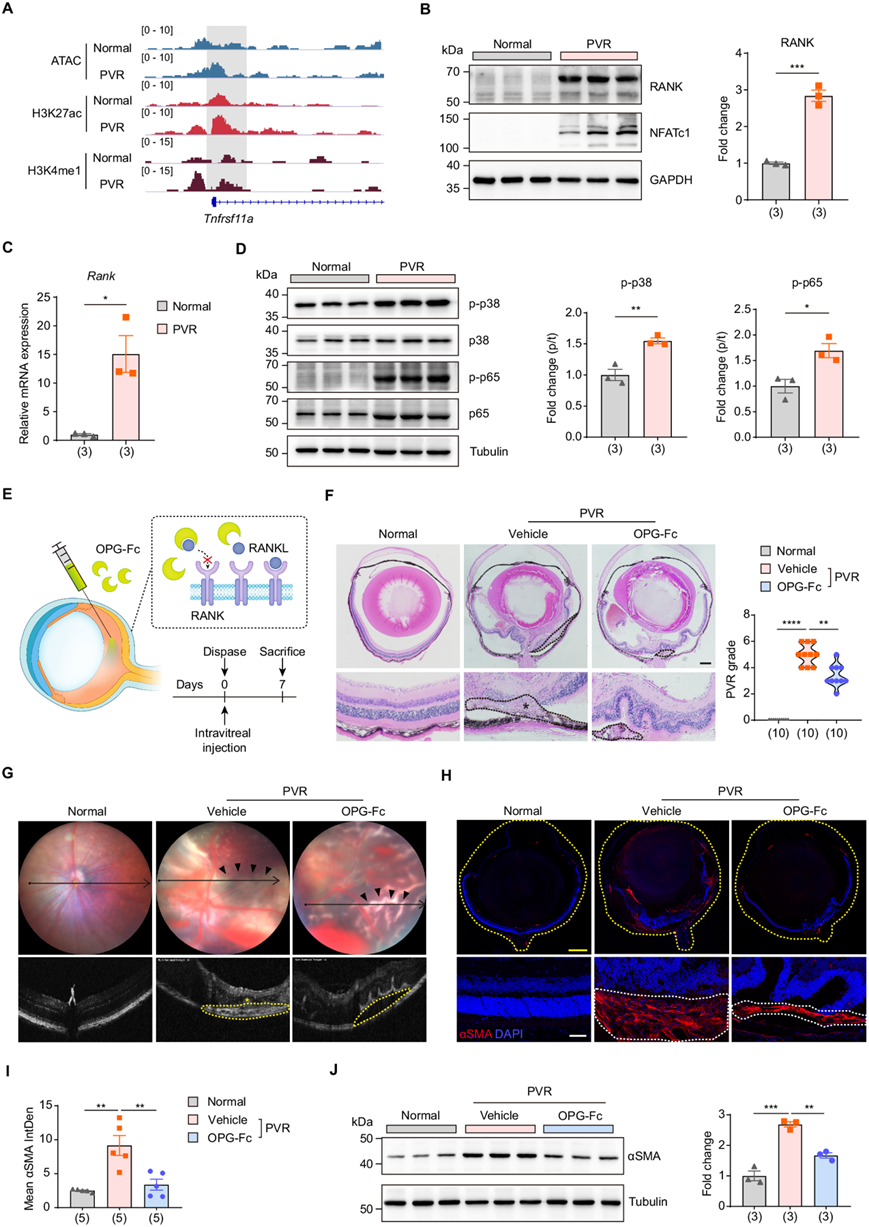
图6. 抑制 RANK-NFATc1 轴可延缓 PVR 进展。
(A) ATAC-seq、ChIP-seq 对Tnfrsf11a (RANK)基因的 H3K27ac 和 H3K4me1 的 IGV 轨迹概况。(B) 免疫印迹分析。(C) 正常和 PVR 小鼠原代 RPE 细胞中RANK表达的 RT-qPCR 分析。(D) 免疫印迹分析。(E) PVR 小鼠模型中的实验策略示意图。(F) 小鼠眼部切片的代表性 H&E 染色(左)。PVR 严重程度的定量(右)。(G) 小鼠的代表性眼底成像和 OCT 图像。(H) 小鼠眼部切片中 αSMA 的代表性免疫荧光染色。(I) αSMA平均荧光积分密度的定量。(J) 免疫印迹分析。
+ + + + + + + + + + +
结 论
本项研究通过监测染色质可及性和各种组蛋白修饰的动态变化,绘制了遭受创伤性 PVR 的雄性小鼠 RPE 细胞的综合表观遗传图谱。结合转录组分析,揭示了增强子激活与 PVR 相关基因程序上调之间的强相关性。此外,通过构建转录因子调控网络,确定了在 PVR 进展过程中增强子驱动的 RANK-NFATc1 通路的异常激活。重要的是,本研究证明了眼内干预措施(包括抑制增强子活性的纳米药物、针对 NFATc1 的基因疗法和针对 RANK 通路的抗体疗法)可有效缓解 PVR 进展。总之,本研究的结果阐明了 RPE 细胞命运转变过程中 PVR 相关基因激活的表观遗传基础,并为针对表观遗传调节和 RANK-NFATc1 轴的 PVR 管理提供了有希望的治疗途径。
+ + + + +



 English
English


