文献解读 |Cell Rep Med ( 10.6 ):肿瘤免疫微环境描绘了不同鼻咽癌表型的进展轨迹
✦ +
+
论文ID
原名:Tumor immune microenvironment delineates progression trajectories of distinct nasopharyngeal carcinoma phenotypes
译名:肿瘤免疫微环境描绘了不同鼻咽癌表型的进展轨迹
期刊:Cell Reports Medicine
影响因子:10.6
发表时间:2025.06.17
DOI号:10.1016/j.xcrm.2025.102143.
背 景
鼻咽癌 (NPC) 是一种独特的头颈部癌症,在流行地区(例如中国南方、东南亚和北非)通常与 Epstein-Barr 病毒 (EBV) 感染有关。此外,鼻咽癌是一种以男性为主的癌症,70% 以上的患者为男性。由于鼻咽部的解剖结构,扩散的临床模式可能非常隐匿,一些肿瘤表现为向咀嚼空间、颅底和颅内结构的侵袭性局部浸润,而另一些则表现为巨大的颈部淋巴结转移。这反映在大多数患者在诊断时患有局部区域晚期 (LA) 疾病,需要采用诱导同步或同步辅助序列的联合化放疗。LA-NPC 的临床表现可能存在 3 种不同的亚型——上升型(A)、下降型(D)和上升-下降型(AD)。一些患者的肿瘤表现为局部侵袭性,淋巴结转移有限,因此属于 A 亚型;相反,患者在原发性肿瘤较小的情况下可能表现为大和/或多个颈部淋巴结,因此属于 D 亚型。回顾性研究进一步表明,不同亚型治疗后的复发模式不同,A 亚型 NPC 更容易发生局部区域复发,而 D 亚型更容易发生远处转移。无论如何,目前对这些不同亚型 LA-NPC 的治疗标准仍然是放化疗,而没有考虑它们之间潜在的生物学差异。
实验设计
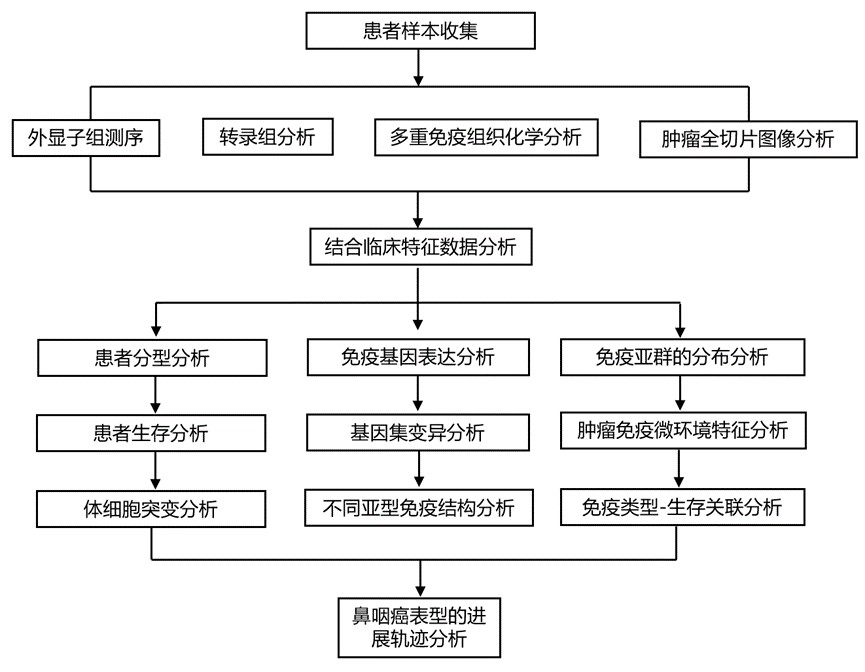
结 果
01
研究队列的特征
研究团队根据研究标准整理了登记册,并根据临床表现将 994 名患者分为 4 种亚型:303 名(30.5%)患者归类为有限(L)亚型(T0-2 和 N0-1),201 名(20.2%)患者归类为 A 亚型(T3-4 和 N0-1),246 名(24.7%)患者归类为 D 亚型(T1-2 和 N2-3),244 名(24.5%)患者归类为 AD 亚型(T3-4 和 N2-3)(图 1 A-B)。不出所料,大多数 L 亚型鼻咽癌患者仅接受放疗(240/303 [79.2%]),而 3 种 LA 亚型患者大多接受联合放化疗,接受诱导化疗 (IC) 和/或辅助化疗 (AC) 与同步放化疗 (CCRT) 的患者多于 A 亚型患者。与本研究队列中的其他 3 种亚型相比,AD 亚型鼻咽癌患者的总生存率 (OS)、无病生存率 (DFS)、局部区域无复发生存率 (LRRFS) 和远处无转移生存率 (DMFS) 明显较差; AD 亚型 NPC 患者的 3 年 OS、DFS、LRRFS 和 DMFS 率分别为 91.8%、69.4%、80.8%和 77.9%(图 1 C)。
鉴于已知的鼻咽癌遗传易感性,他们首先研究了生殖细胞系变异与不同鼻咽癌亚型之间的关联。为此,他们为所有 994 名鼻咽癌患者生成了生殖细胞系全外显子组测序 (WES) 数据,并对各亚型与 SG10K 研究中的非癌症本地受试者进行了成对病例对照分析。简而言之,SG10K 研究是一项前瞻性的人口水平生殖细胞系分析,研究对象为 4810 名新加坡非癌症受试者,其中 2706 名(56.3%)为健康个体,其余受试者则选自另外三项队列研究,研究对象分别为心力衰竭、帕金森病和接受减肥手术治疗的肥胖症。首先,在 4 种 NPC 亚型中,与对照组相比,携带 AD 亚型的患者拥有最多的独特种系变异,而他们发现分别与 L、A 和 D 亚型相关的独特种系变异为 5、7 和 2 个。当将比较范围限制在 SG10K 研究的健康亚组时,他们发现了与不同 NPC 亚型相关的 6 种独特变异(图1D)。值得注意的是,无论是与健康对照组比较还是与所有对照组比较,有 4 种变异均与 NPC 亚型显著相关(图1E)。在基因水平上,受这 4 种变异影响的基因包括COMMD5(含 MURR1 结构域的铜代谢蛋白 5),该基因在 L 亚型肿瘤患者中发现参与 NF-κB 信号传导的调控。在A亚型肿瘤患者中,FADS1(脂肪酸去饱和酶 1)受到影响,这是一种参与调节脂肪酸代谢的酶,与多种癌症有关。在 AD 亚型肿瘤患者中,受影响的基因包括TNFSF15(TNF 超家族成员 15),该基因参与激活 NF-κB 信号传导和 PI3K/Akt通路。
最后,他们探讨了这些变异与肿瘤基因表达的关联以及它们在本研究数据集内的预后关联。有趣的是,他们观察到rs72643557的 CC 基因型的 A 亚型患者相关基因FADS1的肿瘤表达显著低于TC 基因型的 A 亚型患者(图1F)。此外,他们观察到与 TC 基因型患者相比,CC 基因型的 A 亚型患者的 DFS 趋势较差(图1G)。这与之前的研究一致,该研究报告了非小细胞肺癌患者FADS1表达降低与 OS 和 DFS 较差相关。
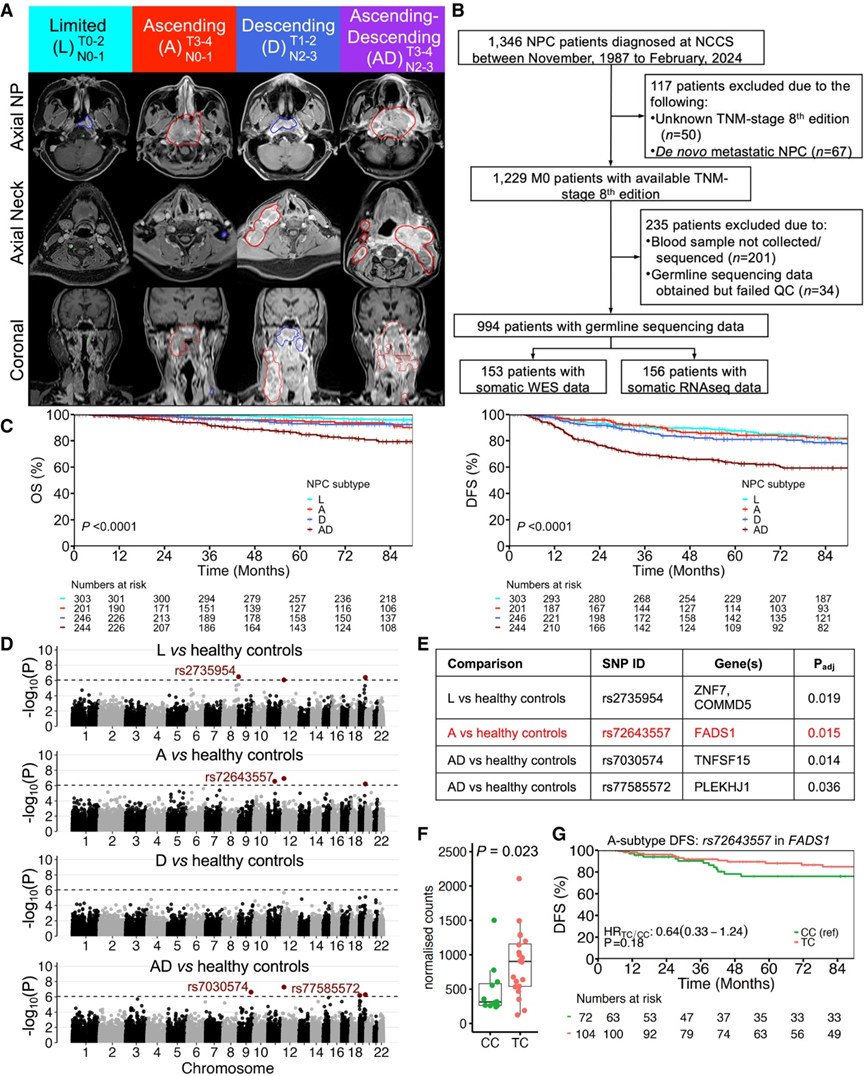
图1. 与 NPC 亚型相关的临床特征和种系变异。
(A) 与 NPC 亚型相关的临床特征和种系变异。(B) NCCS 队列患者选择的 CONSORT 图。(C) NCCS 队列患者选择的 CONSORT 图。(D) 曼哈顿图显示与 L、A、D 或 AD 亚型相关的生殖系变异相对于健康对照的p值。(E) 在与健康对照和所有对照的比较中,发现与 NPC 亚型显著相关的变体。(F-G) rs72643557基因型为 CC 和 TC 的 A 亚型患者的肿瘤FADS1和 DFS表达情况。
02
NPC 不同亚型的体细胞突变情况
153例具有体细胞WES数据的患者包括51例(33.3%)L型、29例(19.0%)A型、30例(19.6%)D型和43例(28.1%)AD型。总体而言,本研究的鼻咽癌肿瘤的体细胞突变谱与已发表的文献一致,他们观察到经典的鼻咽癌相关热点突变,例如TP53、CYLD、NFKBIA和TRAF3(图2 A)。他们没有观察到这些常见基因在任何亚型中的富集,虽然大多数肿瘤在基因本体论 (GO) 防御 (131/153 [85.6% ] ) 和炎症反应 (104/153 [68.0%]) 基因集中的基因突变。同样,对癌症体细胞突变目录 (COSMIC) 单碱基替换 (SBS) 特征的分析也没有发现任何亚型中的富集。已鉴定的前 10 个突变特征包括与化疗(SBS86 和 SBS87)、载脂蛋白 B mRNA 编辑催化多肽样 (APOBEC) 活性(SBS2 和 SBS13)和 DNA 错配修复 (SBS6 和 SBS15)相关的突变(图 2 B)。最后,NPC 亚型之间的总突变计数具有可比性(图 2 C)。
接下来,鉴于 NF-κB 通路在 NPC 中的重要性,他们选择关注在CYLD和NFKBIA (NF-κB 抑制因子α)基因中发现的突变,并研究了这些基因内突变相对于不同亚型的位置。值得注意的是,CYLD和NFKBIA均作为 NF-κB 通路的负调节因子发挥作用。对于CYLD,12个突变中有 9 个定位于肽酶 C19N 和第三个富含甘氨酸的细胞骨架相关蛋白 (CAP-Gly) 结构域,这些结构域在各个亚型中均匀分布。对于NFKBIA,9 个突变中有 5 个定位于锚蛋白 (ANK) 2 和 ANK5 结构域,9 个突变中有 4 个发生在具有 D 亚型的患者中。他们进一步探讨了这些突变对具有配对转录组数据的患者基因表达的下游影响(图 2D-E)。CYLD 突变与CYLD表达降低相关,但矛盾的是,也与NFKBIA表达增加相关,而NFKBIA突变仅影响NKBIA表达,而不影响CYLD表达;这些结果表明CYLD和NFKBIA表达与CYLD敲低之间存在相互依赖性。
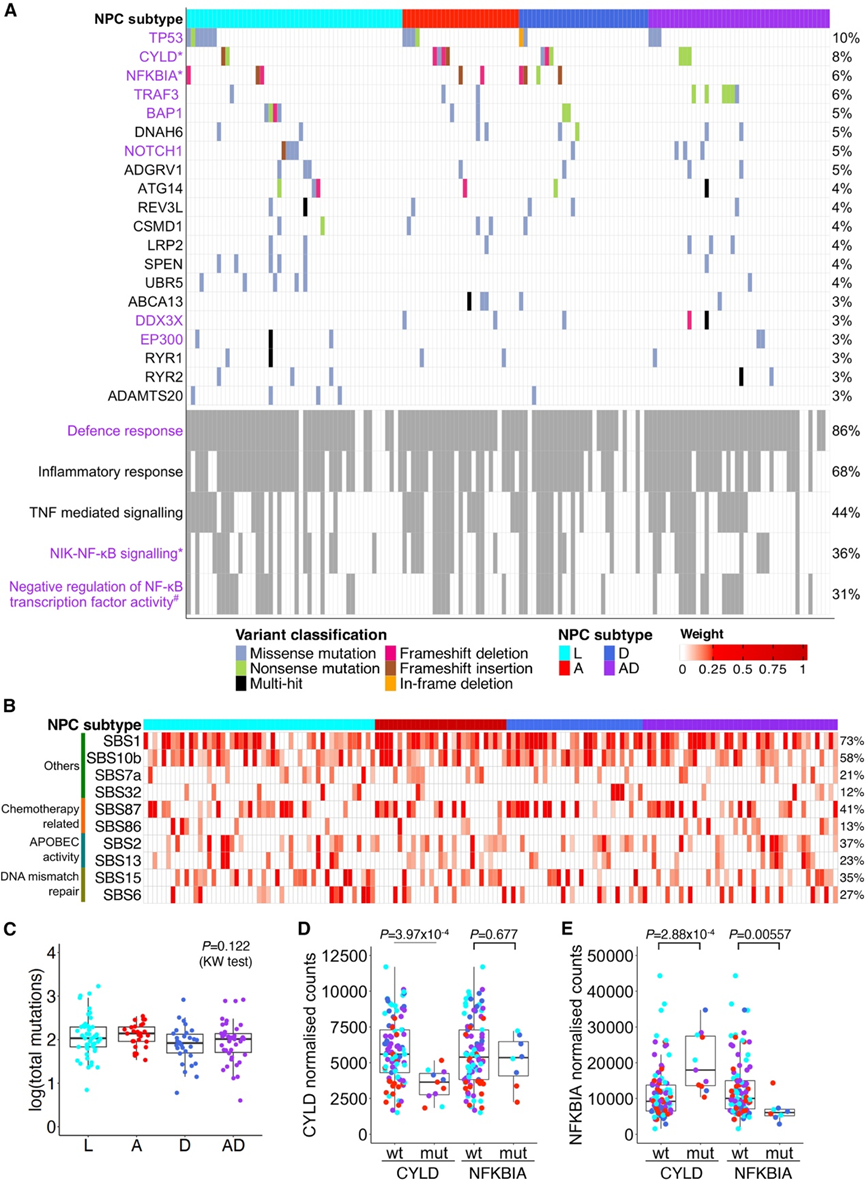
图2. 不同 NPC 亚型的体细胞突变情况。
(A) 所有 NPC 亚型中受体细胞突变影响的前 20 个基因(上)和选定的免疫和 NF-κB 通路(下)。(B) 前 10 个 COSMIC SBS 突变特征在所有 NPC 亚型中富集。(C)不同 NPC 亚型间总突变的比较。(D-E) 不同 NPC 亚型间总突变的比较。
03
NPC 亚型的转录组分析揭示了不同的肿瘤微环境
他们对156例肿瘤的进行了转录组分析(RNA-seq),其中包括40例(25.6%)L型肿瘤、35例(22.4%)A型肿瘤、33例(21.2%)D型肿瘤和48例(30.8%)AD型肿瘤。首先,鉴于A型和D型肿瘤的临床表现差异最大,他们在基因水平和通路水平上分析了它们之间的差异基因表达谱。有趣的是,在A型肿瘤中,参与细胞外基质(ECM)重塑的基因上调,而与此相反,参与免疫调节的基因在D型肿瘤中主要上调。基因集富集分析 (GSEA) 证实了这一现象,该分析揭示了一个强烈的信号,表明几个 ECM 相关基因集的富集,如 A 亚型中的 ECM 结构成分和胶原原纤维组织,而免疫相关基因集,如 B 细胞受体信号传导和抗原受体介导的信号传导,在 D 亚型中富集(图 3 A)。这与A亚型中与ECM相关的差异表达基因(DEG)数量高于D亚型相一致(图3B)。相反,D亚型中与免疫相关的DEG数量高于A亚型(图3C)。
接下来,他们使用从 GSEA 中鉴定出的前 15 个 ECM 和免疫相关基因集进行了基因集变异分析 (GSVA),然后对不同的 NPC 亚型进行无监督聚类(图 3D)。这揭示了一个独特的 ECM-高、免疫-低 GSVA 评分聚类,该聚类在 A 和 AD 亚型中富集,但不在 L 和 D 亚型中富集(图 3E),这与 GSEA 的结果一致。相反,D 和 L 亚型更常见于免疫-高、ECM-低 GSVA 评分聚类中。鉴于 L 亚型具有较高比例的免疫高肿瘤,他们进一步根据淋巴结状态分析了这一组,但未观察到它们之间的 GSVA 评分聚类有任何显著差异(图 3F)。总体而言,转录组分析揭示了与肿瘤微环境相关的不同通路,可能与 NPC 的不同临床表现有关。
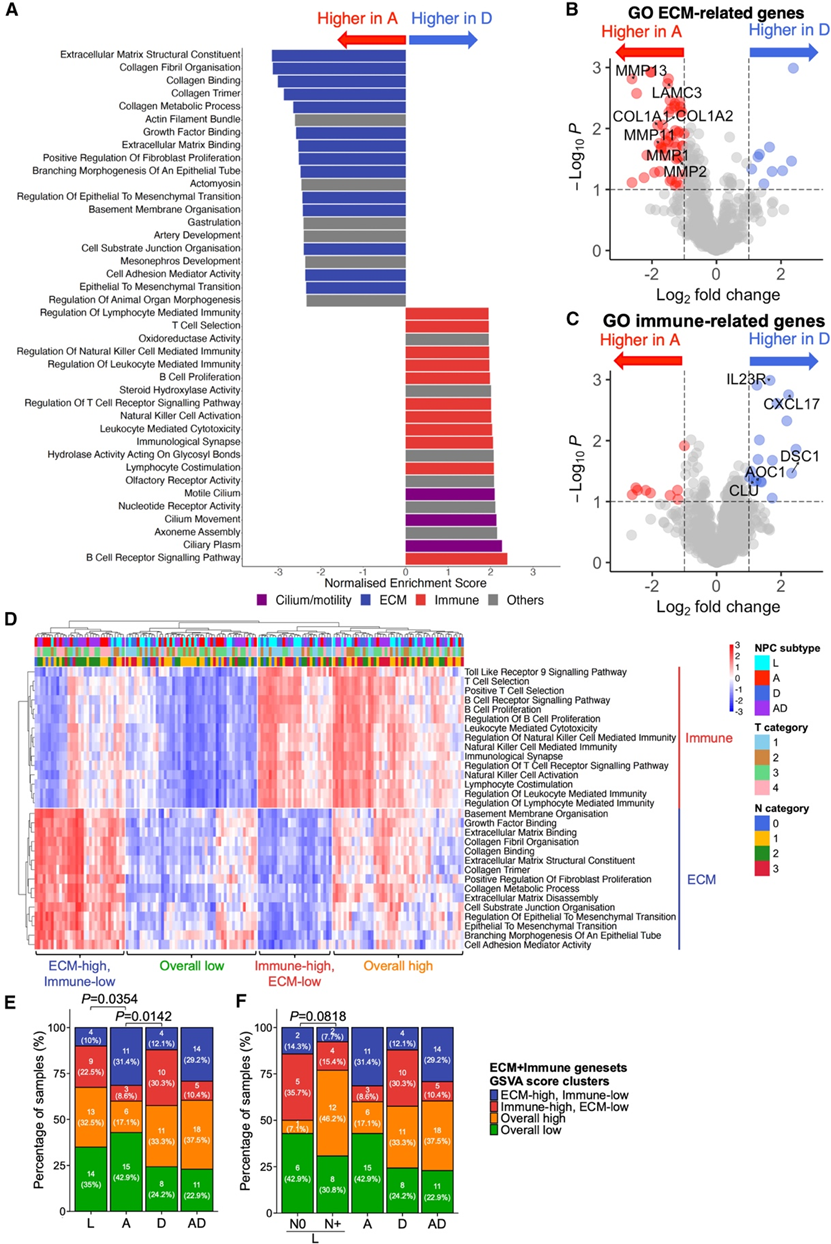
图3. NPC 亚型中 ECM 和免疫基因表达的差异。
(A) 根据整个转录组谱,在 A 亚型和 D 亚型肿瘤中富集的基因集。(B-C) 差异表达基因。(D) 分别针对从 GSEA 中识别出的前 15 个 ECM 基因集和前 15 个免疫相关基因集的所有 NPC 亚型的表达热图。(E-F) 各鼻咽癌亚型在中定义的 GSVA 评分聚类中所占比例,并使用卡方检验对各亚型进行比较。
04
不同鼻咽癌亚型的免疫结构
为了研究基因表达分析阐明的差异免疫活性,他们使用表达数据 (ESTIMATE) 估计恶性肿瘤中的基质和免疫细胞进行免疫估计,并使用通过肿瘤免疫估计资源 (TIMER 2.0) 提供的两种不同算法进行反卷积分析,即通过估计已知 RNA 转录本的相对子集进行细胞类型识别 (CIBERSORTx) 和 quanTIseq。与基因表达分析结果一致,他们观察到除N0 L 亚型外,所有亚型的总体免疫评分均显著高于 A 亚型(图 4 A)。
随后,他们使用quanTIseq和CIBERSORTx反卷积方法分析了4种亚型中不同免疫亚群的分布。结果显示,D亚型在多个淋巴样亚群中均显著高于A亚型,包括B细胞、CD8+ T细胞、调节性T细胞(Treg)和自然杀伤细胞。然而,在髓系亚群(M2型巨噬细胞和中性粒细胞)的分析中,各亚型间差异无统计学意义(图4B)。N0与N+ L亚型的免疫评分亦无显著差异。上述趋势在另一独立数据集中得到了验证:该数据集包含40例LA-NPC样本,具有匹配的临床信息及肿瘤免疫微环境(TIME)来源的RNA-seq数据,同时也在本研究测序肿瘤样本的全切片图像(WSI)及外部队列(JXCH)的组织病理定量(QuPath v0.4)中得到验证。
为了进一步表征 A 型和 D 亚型 NPC 免疫评分的显著差异,他们对一组肿瘤 (3 [N0 L]、4 [N+ L]、8 [A]、8 [D] 和 8 [AD]) 进行了多重免疫组织化学 (mIHC),使用了一组肿瘤和免疫相关标志物,包括 CK、CD4、CD8、CD20、FOXP3、CD68 和 CLDN1(参与调节免疫细胞运输并在头颈癌中过表达的紧密连接蛋白)。首先,他们再次看到 A 亚型肿瘤的免疫细胞丰度低于 D 型和 AD 亚型肿瘤(图 5 A-C)。这对应于 D 亚型肿瘤在不同亚型中表现出最低的 Treg 与 CD8+ T 细胞比率(图 5 D)。其次,比较髓系细胞类型,未发现它们之间存在显著差异(图 5E-F)。虽然大多数肿瘤(无论亚型如何)均对 CLDN1 染色呈阳性,但这种阳性在 N0 L 型和 A 型肿瘤中最为明显(图 5G)。
有趣的是,他们观察到 N0 和 N+ L 亚型肿瘤之间存在一些明显的差异。N+ 亚型中的总免疫细胞丰度和 B 细胞丰度高于 N0 L 亚型,这在之前的分析中并不明显。后者的 M2 巨噬细胞数量也呈高于前者的趋势。最后,N0 L 亚型肿瘤表现出非常高的 CLDN1 阳性率,与 A 亚型肿瘤相匹配。总之,这些数据验证了转录组结果,即 A 亚型 NPC 是一种免疫-低而 ECM-高的表现型。N0 和 N+ L 亚型 NPC 之间 TIME 的明显差异也表明前者的免疫 TIME 与 A 亚型 NPC 趋于一致。
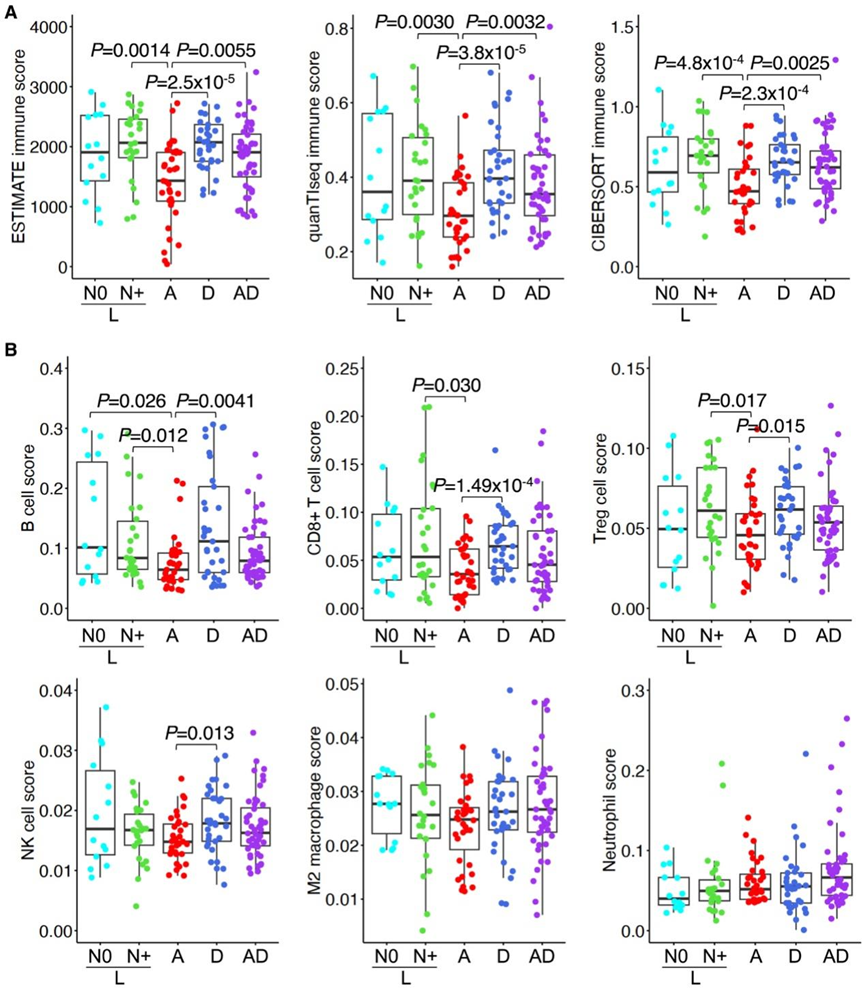
图4. 对 NPC 亚型进行免疫分析。
(A) 分别使用 ESTIMATE、quanTIseq 和 CIBERSORT 算法计算的 NPC 亚型之间的免疫评分比较。(B) 基于 quanTIseq 反卷积的特定免疫亚群的免疫评分。
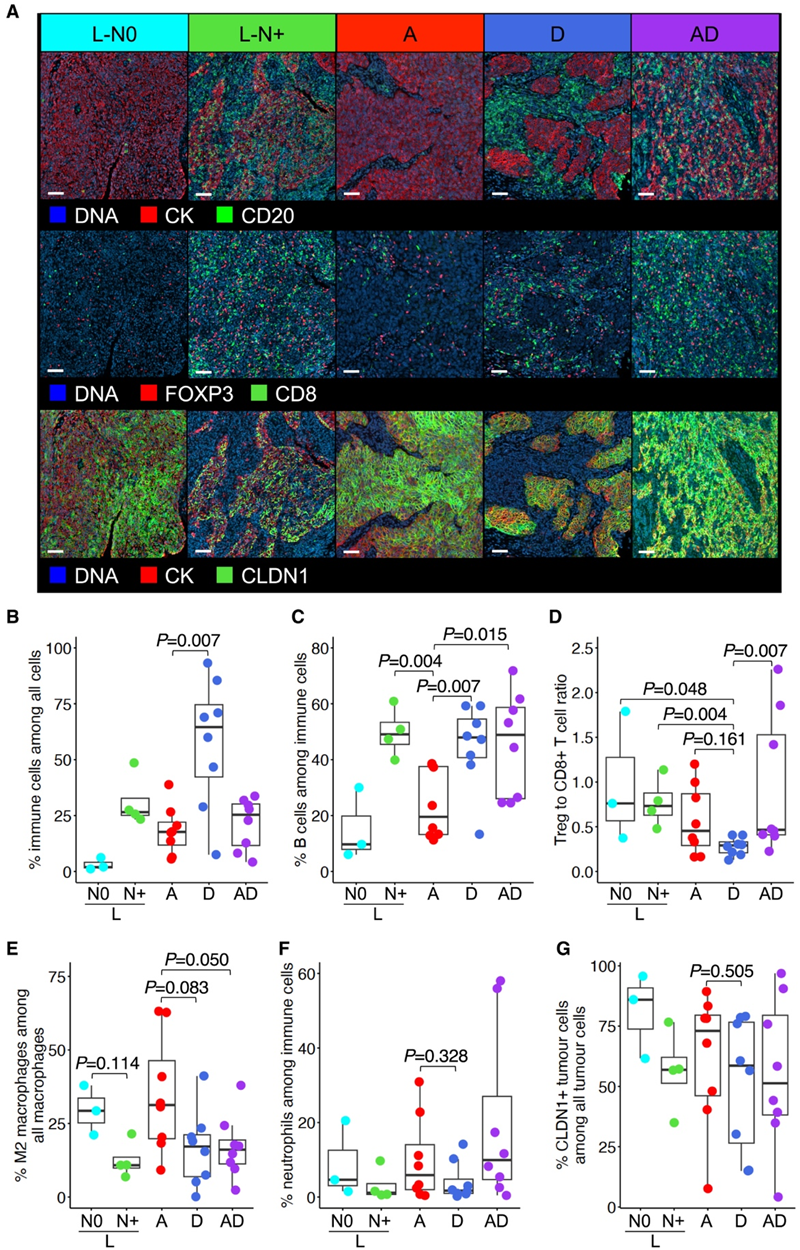
图5. mIHC 分析鼻咽癌亚型中肿瘤和免疫亚群的分布。
(A) mIHC 图像分析。(B-G) mIHC 图像中不同鼻咽癌亚型细胞亚群的分布。
05
NPC 亚型中 TIME 的差异空间分布
他们整合本研究队列和外部队列的大型 WSI 数据集,探究 NPC 亚型的肿瘤和免疫细胞群的空间模式是否不同。为了进行此分析,根据肿瘤富集区与免疫富集区的空间分布,将肿瘤独立分为 3 个 TIME 类别,即免疫沙漠、免疫稀疏或免疫密集(图 6 A)。仅 NCCS 队列的 L 亚型分为 N0 和 N+,因为 JXCH 队列中只有 1 名 N0 L 亚型 NPC 患者。
正如预期的那样,他们对 WSI 进行的空间分析表明,在 NCCS 和 JXCH 队列中,D 亚型的免疫富集比例明显高于 A 亚型(图 6 B)。这与得出的肿瘤富集区到免疫富集区的平均距离相对应,其中 D 亚型肿瘤在两个队列中均表现出肿瘤富集区和免疫富集区之间的最小距离(图 6C)。值得注意的是,对于这两个参数,N+ L 亚型与 D 亚型紧密匹配,而 N0 L 亚型与 A 亚型相当。根据空间分类,他们发现 NCCS 队列中 D 和 N+ L 亚型的免疫密集型肿瘤比例高于 N0 L、A 和 AD 亚型D 亚型肿瘤归类为免疫沙漠(图6D)。使用相同的距离阈值,他们在 JXCH 队列中得出了一致的趋势,其中 D 亚型归类为免疫密集型的比例高于 L、A 和 AD 亚型。
最后,他们观察到在两个 NCCS 中,对于 AD 亚型和 JXCH队列,免疫稀疏和沙漠肿瘤的 DFS 趋势均低于免疫密集肿瘤(图 6 E)。总之,结果强烈支持这样一种模型,其中 TIME 描述了这些不同 NPC 亚型不同临床表现背后的生物学原理,并且 N0 和 N+ L 亚型与晚期表现之间可能存在进化联系。
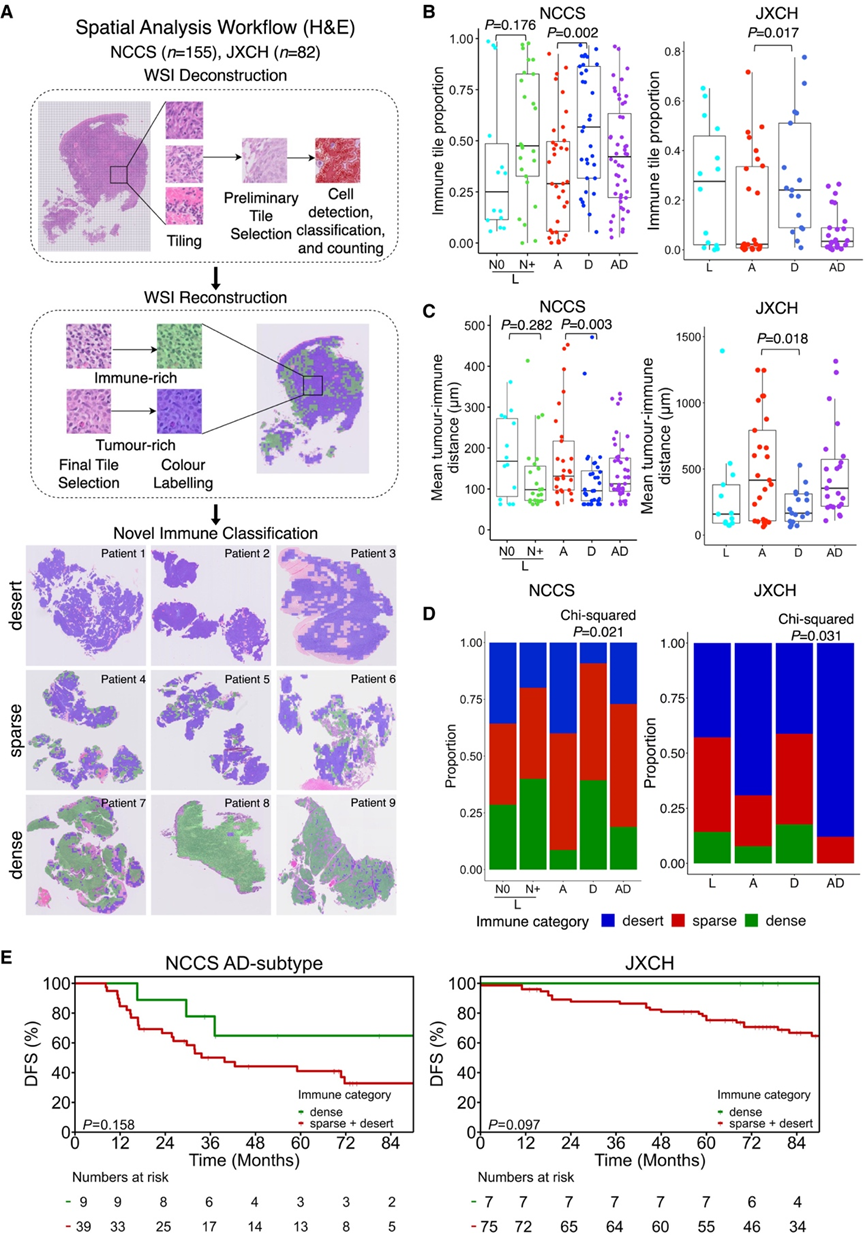
图6. 使用全切片成像分析 NPC 亚型中的 TIME。
(A) 空间分析的工作流程基于肿瘤 WSI 内免疫富集的空间分布和密度进行免疫分类。(B) 空间分析的工作流程基于肿瘤 WSI 内免疫富集的空间分布和密度进行免疫分类。(C) 四种亚型WSI的平均肿瘤免疫距离。(D) 四种亚型的 WSI 中三种免疫类别的分布。(E) NCCS 和 JXCH 队列中免疫类型与 DFS 的关联。
+ + + + + + + + + + +
结 论
本研究纳入了 994 例患者,进行了WES、转录组分析、mIHC以及WSI的空间组织病理学分析。种系 WES 揭示了 AD 亚型中最多的变异,但体细胞 WES 未显示亚型特异性突变。转录组学分析显示 A 和 AD 亚型中ECM基因表达较高,D 和 AD 亚型中免疫基因表达较高,这与反卷积和 mIHC 的结果一致。淋巴结阴性(N0)和淋巴结阳性(N+)L亚型的TIME分别与A亚型和D亚型相似,提示其具有不同的进化轨迹。空间WSI分析识别了D亚型中免疫致密性最高的肿瘤,并揭示了TIME与AD亚型中无病生存期的关联。这些发现强调了TIME在LA-NPC进展中的作用及其对治疗策略的潜在影响。
+ + + + +



 English
English


