文献解读|J Adv Res(13):基于多组学技术研究慢性砷暴露引起的鸡肝-菌-肠轴紊乱相关生物毒性
✦ +
+
论文ID
原名:Chronic arsenic exposure-provoked biotoxicity involved in liver-microbiota-gut axis disruption in chickens based on multi-omics technologies
译名:基于多组学技术研究慢性砷暴露引起的鸡肝-菌-肠轴紊乱相关生物毒性
期刊:Journal of Advanced Research
影响因子:13
发表时间:2025.01.17
DOI号:10.1016/j.jare.2024.01.019
背 景
2007年,美国有毒物质与疾病登记署将砷列为优先控制物质清单的首位,宣布环境砷暴露对人类和动物健康具有最高的毒性。砷是一种普遍存在的类金属元素,由于自然和人类活动,它不可避免地释放到土壤、地下水和大气中。到目前为止,地下水砷污染仍然对公众健康构成重大威胁。饮用受砷污染的水是环境中砷侵入人体的主要途径,直接导致砷中毒。2001年,美国环境保护署(US EPA)制定了饮用水中砷的最大推荐限量为十亿分之十。大约有 9400 万到 2.2 亿人可能受到地下水中高浓度砷的危害,涉及许多国家。多组学是一项革命性的数据分析技术,它提供了整合的生物信息视角,有助于全面系统地理解疾病的复杂机制。
实验设计
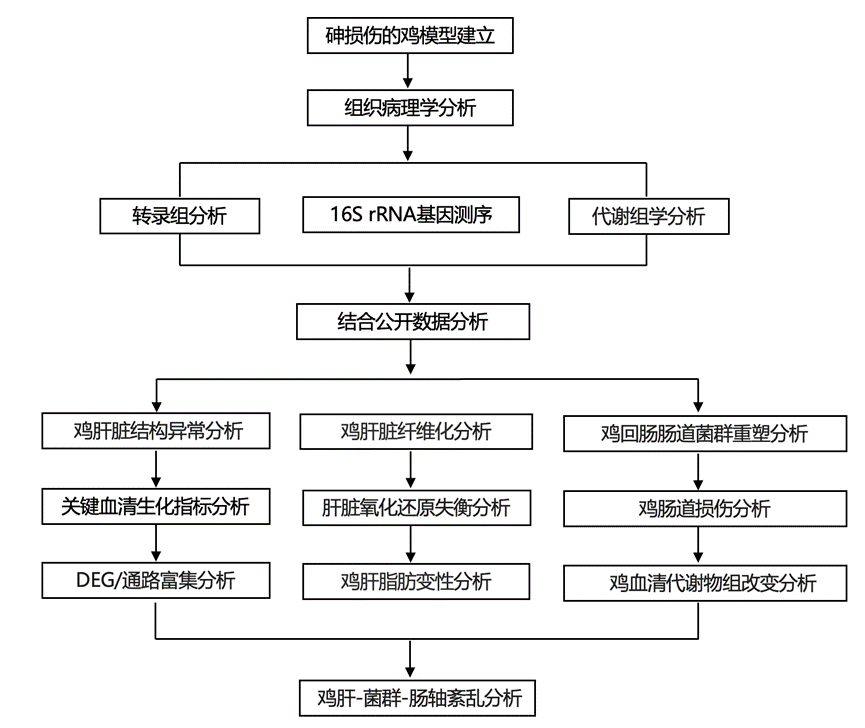
结 果
01
砷暴露引起鸡肝组织病理学异常及肝功能障碍
研究团队将不同剂量的亚砷酸钠溶于常规饮用水中,四组Hy-Line W-80产蛋母鸡分别饮用含有0、17.3、34.7或52mg/L亚砷酸钠(分别对应0、10、20或30mg/L砷)的饮用水。试验持续时间为42天。最后一次给予饮用水后,鸡禁食处死,然后从翅根静脉取血用于血清样本检测。收集部分肝脏组织、血清样本和回肠内容物,进行多组学测序。为了直观地观察Hy-Line W-80产蛋母鸡的肝脏组织损伤情况,研究团队对鸡的肝脏进行了宏观形态学观察。与对照组相比,砷暴露组的肝脏呈现苍白色、黄色、脂肪增多的现象,且呈现剂量依赖性(图1 A)。随后对各组鸡的肝脏组织结构进行了组织病理学评估。
H&E染色示对照组肝脏结构正常,肝索呈放射状排列(图1 B-C)。10 mg/L砷处理组肝组织切片可见肝索轻度紊乱,中心静脉轻度淤血(图1 C)。20 mg/L砷处理组肝组织病理改变类似,但程度更重,细胞间隙增大(图1 C)。最高砷处理组肝脏组织损伤最为严重,肝组织结构破坏,肝细胞肿胀,广泛炎症浸润(图1 C)。利用透射电子显微镜观察肝细胞超微结构,特别是线粒体的高分辨率显微照片。对照组鸡的肝细胞结构正常,线粒体形态、嵴膜和嵴连接均较规则(图 1 D)。而砷处理组则出现不同程度的损伤(图 1 D)。在 10 mg/L 砷处理组中,形态学显示多个肿胀的线粒体,单个细胞的线粒体嵴碎裂或部分消失。除了与 10 mg/L 砷组的变化相似但变化程度更大之外,20 mg/L 砷处理共同导致核膜边缘不清和线粒体结构丢失(图 1 D)。此外,最高剂量砷组表现出最严重的变化,包括线粒体嵴碎裂且严重模糊,以及线粒体空泡化(图 1 D)。
为评估肝损伤,检测了几项与肝功能相关的关键血清生化指标。天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT) 、碱性磷酸酶(ALP) 活性共同反映肝功能(图 1 E-H)。同样,作为肝脏疾病线索的 AST/ALT 比值 (AST/ALT) 呈剂量依赖性下降(图 1 G)。在所有砷处理组,AST 和 ALT 活性明显升高(图 1 E-F),30 mg/L 砷处理组的 AST/ALT 比值呈下降趋势(图 1 G)。
对鸡肝中宿主基因表达进行转录组分析,以鉴定参与砷诱导肝毒性的关键基因。各组样品的相似性和异质性以热图(图1 I)显示。测序分析结果显示共包含363个差异表达基因(DEG),筛选出195个上调基因和168个下调基因(图1 J-K)。GO 分析和 DEG 的富集通路相互作用网络分析表明(图 1 L),DEG 主要富集于多种通路,包括脂质代谢、激素反应、PPAR信号通路、小分子代谢过程调节、细胞对化学应激的反应、脂质定位、核受体元 通路、脂肪酸代谢过程、线粒体组织、小分子代谢过程的负向调节、循环系统过程、对毒性物质的反应、多细胞生物体内平衡、非酒精性脂肪性肝病、氧化应激反应、血管发育、冷诱导产热的正向调节、性腺发育、IL-18 信号通路和 PID IL27 通路相关的生物过程。
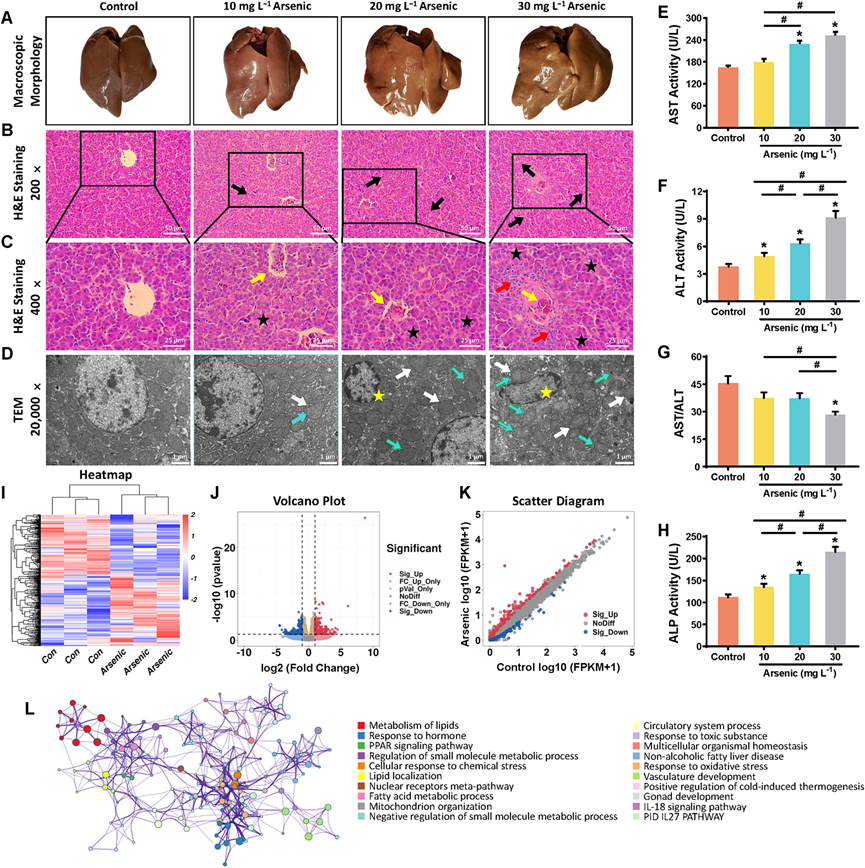
图1. 砷给药影响鸡的肝脏组织学并影响肝脏转录组分析。
(A) 用/未用砷处理的鸡的肝脏的典型宏观形态。(B-C)代表性 H&E 染色图像。(D)超微结构分析。(E-G) 对照组和砷给药组的AST、ALT、ALP 和 AST/ALT 比值。(I-K) 对照组和 30 mg/L 砷组肝脏转录组中 DEG 的热图、火山图和散点图。(L) 使用 Metascape 数据库构建的 DEG 富集的通路相互作用网络。
02
砷促进了鸡肝纤维化的发展
结缔组织染色证实了,砷处理后,在鸡肝脏均观察到不同程度的纤维化病变。具体来说,通过 Masson 三色染色和天狼星红染色对胶原纤维进行可视化定量分析。砷处理下,Masson 三色染色显示胶原纤维大量沉积(肝窦和中央静脉中蓝色胶原沉积)(图 2 A)。在普通光学显微镜下,根据脱蜡切片中红色染色胶原的范围,砷处理肝脏的纤维化程度高于对照肝脏(图 2 B)。进一步在偏光下观察,可区分出主要的 I 型胶原(红染和黄染)和少量的 III 型胶原(绿染)沉积,并呈明显的剂量依赖性(图 2 C-D)。砷暴露组鸡肝脏中羟脯氨酸(HYP)含量明显高于对照组,且砷中、高剂量组升高更为显著(图2F)。
同时,通过转录组分析(RNA-seq)筛选出肝纤维化相关基因,从而确定砷诱导肝纤维化病理生理过程的关键基因(图2E),在 30 mg/L 砷暴露过程中,转化生长因子 β1(TGFB1)、SMAD2Z、肌动蛋白α2 (ACTA2)、I 型胶原蛋白 α1 链(COL1A1)、III 型胶原蛋白 α1 链(COL3A1)、IV 型胶原蛋白 α1 链(COL4A1)、信号转导和转录激活因子(STAT)家族(STAT1、STAT2、STAT3和STAT4)等纤维化相关基因的表达呈现一定的变化趋势(图 2E)。值得注意的是,砷暴露的鸡肝中SIRT6表达急剧下降,而SMAD2表达增加(图2 G-H)。进一步采用Western blot技术检测Sirt6和Smad2的蛋白水平,发现两种蛋白的表达趋势与mRNA水平的变化趋势一致(图2 I-J)。
鉴于氧化应激是砷暴露的病理机制之一,他们收集了与氧化还原相关的RNA-seq数据。重要的氧化应激反应基因,包括核因子红细胞2相关因子2(NFE2L2,一种关键的氧化还原敏感转录因子,可抵御毒性诱导的氧化损伤,与脂质稳态密切相关)、NAD(P)H醌脱氢酶2(NQO2)、超氧化物歧化酶1(SOD1)、超氧化物歧化酶3(SOD3)和谷胱甘肽过氧化物酶4(GPX4),在30 mg/L砷处理后下均下调(图2K)。同时,他们发现谷胱甘肽S-转移酶(GST)基因家族(GSTA3、GSTZ1、GSTA4L、GSTCD、GSTO1和GSTA2)在氧化应激反应中大多显著上调(图2K)。此外,还确定了氧化还原稳态的生物标志物。本研究的数据与之前对大鼠砷诱导性肝损伤的研究一致。具体来说,氧化物生成MDA过度积累(图2L),抗氧化酶SOD活性和细胞抗氧化剂GSH水平呈剂量依赖性下调(图2M-N),标志着抗氧化防御能力的减弱。此外,砷处理鸡的上述指标均表现出显著的变化(图2L-N)。
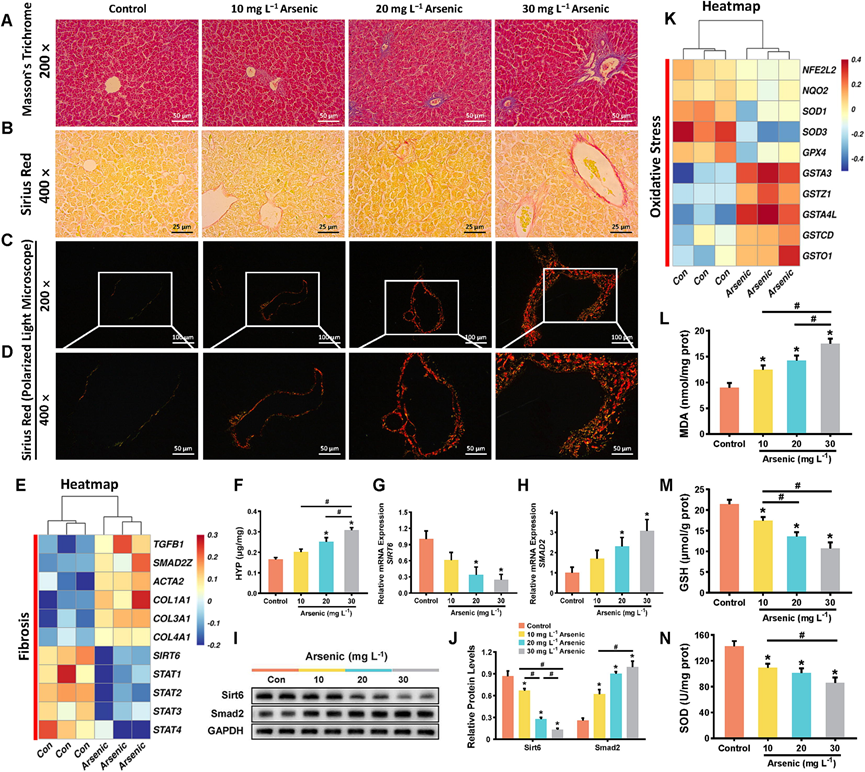
图2. 砷诱导鸡肝纤维化并影响氧化还原稳态。
(A-D) 鸡肝的 Masson 三色染色和天狼星红染色分析,以及偏光显微镜下的图像。(E) 基于 mRNA 测序数据的纤维化相关基因表达热图。(F) 各组肝组织HYP含量。(G-J) 各组鸡肝中Sirt6和Smad2的相对mRNA表达和蛋白质水平。(K-N) 基于RNA-seq数据绘制的氧化还原相关mRNA表达热图。鸡肝中氧化应激生物标志物MDA浓度、GSH水平和SOD活性。
03
砷暴露诱发鸡肝脂肪变性,扰乱鸡胆固醇和胆碱的合成
脂肪变性是中度至重度肝细胞损伤的结果,他们对生化测试中的脂质水平进行了评估。砷处理加剧了鸡血清中的甘油三酸酯和胆固醇的积累,其中20 或 30 mg/L 砷组显著增加(图 3B-C)。此外,高密度脂蛋白(HDL)和低密度脂蛋白(LDL)浓度异常与肝脏疾病密切相关。HDL 的降低和 LDL 的升高与砷的剂量依赖性有关(图 3D-E)。重要的是,砷处理的鸡血清中的总胆汁酸(TBA)水平与剂量依赖性较高,其中20 mg/L 和 30 mg/L 砷处理组显著升高(图 3A)。
脂肪变性相关基因表达热图包括过氧化物酶体增殖激活受体-γ(PPARG,脂肪细胞和肝细胞经典脂质代谢的调节剂),脂肪酸结合蛋白5(FABP5),脂肪酸结合蛋白6(FABP6),过氧化物酶体增殖激活受体-α(PPARA),酰基辅酶A氧化酶1(ACOX1),分化簇36(CD36),乙酰辅酶A酰基转移酶1(ACAA1),ELOVL脂肪酸延长酶6(ELOVL6),脂肪酸合酶(FASN)和微粒体甘油三酯转运蛋白(MTTP)在30 mg/L砷暴露期间表现出一定的变化趋势(图3F)。油红O染色是特异性识别和定量脂滴的“金标准” 。砷处理组的冰冻切片中捕获到多个脂肪和脂质区域,并且脂质积累的阳性面积呈剂量依赖性增加(图3J)。
RNA-seq数据显示肝脏胆固醇(CHO)和胆汁酸(BA)合成相关基因发生显著变化,包括乙酰辅酶 A 乙酰转移酶 2 (ACAT2)、3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGCR,一种关键的 CHO 生物合成酶)、固醇调节元件结合转录因子 2(SREBF2,一种参与 CHO 生物合成基因的转录调节因子)、水合酶/3-羟基酰基辅酶 A 脱氢酶(EHHADA)、CCAAT 增强子结合蛋白 β (CEBPB)、24-脱氢胆固醇还原酶 (DHCR24)、角鲨烯环氧酶(SQLE,一种关键的 CHO 生物合成酶)、甲基固醇单加氧酶1(MSMO1,一种参与 CHO 正常合成的蛋白质编码基因)和细胞色素与对照组相比,高剂量砷暴露鸡的P450家族7亚家族A成员1(CYP7A1)的表达增加(图3G)。此外,在砷处理的肝脏中,胆碱肝胆转运相关基因,包括ATP结合盒B亚家族成员11(ABCB11,编码肝细胞胆碱的主要小管转运蛋白)和ABCB1的表达也增加(图3G)。
他们分别鉴定了线粒体动力学和凋亡相关关键基因。线粒体形态由线粒体融合和裂变之间的平衡决定。肝线粒体动力学紊乱表现为线粒体融合相关蛋白线粒体融合蛋白1 (MFN1)和线粒体动力蛋白样GTP酶 (OPA1),以及线粒体裂变相关蛋白线粒体裂变蛋白1 (FIS1)、动力蛋白1样蛋白 (DNM1L)和动力蛋白1(DNM1) mRNA表达的改变(图3H)。
BCL-2和BCL-9是重要的抗凋亡蛋白,而半胱天冬酶6(CASP6)和CASP7作为关键执行者,通过底物切割和亚细胞结构破坏介导凋亡过程。肝脏凋亡现象通过BCL2、BCL9 mRNA表达下调及CASP6、CASP7 mRNA表达上调得到证实(图3H)。基于生物素-dUTP标记和二氨基联苯胺(DAB)染色的原位凋亡检测显示,砷处理组鸡肝脏中DAB阳性细胞(棕色)比例呈剂量依赖性增加(图3J-K)。此外,他们还观察到COX基因家族的显著上调(图3H)。PPI网络揭示了与砷引发的一系列肝脏损害相关的基因(图3 I),连接不同蛋白质的边代表已知的相互作用、预测的相互作用等。
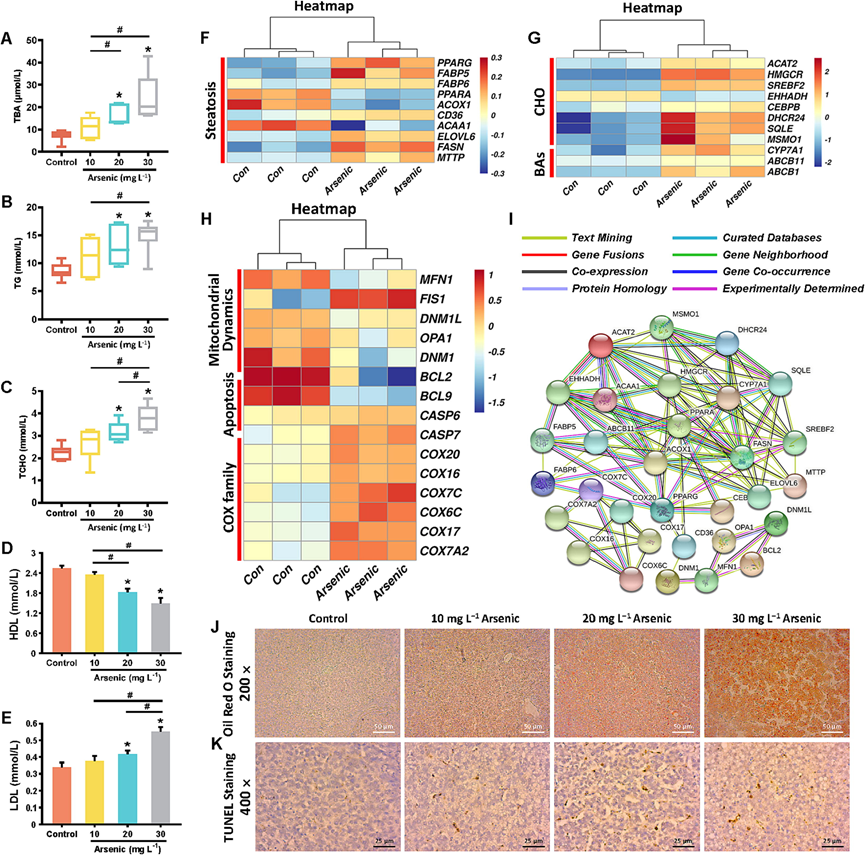
图3. 砷引起鸡脂肪变性,扰乱胆固醇(CHO)和胆汁酸(BA)合成,并诱导线粒体动力学紊乱和细胞凋亡。
(A-E) 血清TBA,TG和TCHO含量,HDL和LDL浓度。(F-G) 基于mRNA测序数据的脂肪变性相关mRNA表达,CHO和BA合成相关mRNA表达的热图。(H) 基于测序数据的肝线粒体动力学,细胞凋亡和COX家族相关mRNA表达的热图。(I) 研究相关基因的PPI网络。(J) 油红O染色显示脂质积累区域。(K) 鸡肝TUNEL染色。
04
砷处理引起鸡回肠肠道菌群显著重塑
为探究砷调控肠道稳态的潜在机制,他们对未处理组与30 mg/L砷处理组鸡回肠内容物进行细菌16S rRNA基因测序。结果显示,砷处理显著影响菌群α多样性指数:回肠微生物群的Shannon多样性指数、OTU数、Pielou均匀度指数及Faith系统发育多样性均呈现急剧下降(图4A-D)(图4 A-D)。
在砷处理条件下,不同层次 (门、纲、目、科、属和种) 的细菌丰度均出现明显变化(图4E-F)。具体而言,砷显著提高了厚壁菌门/拟杆菌门的比例,表现为菌群失调(图 4 G)。接下来采用线性判别分析效应大小 (LEfSe) 来区分肠道菌群的变化,以探究对照组和砷暴露组之间特有的优势群落(图4H-I)。同时, Christensenellaceae (一种治疗性细菌)和Muribaculaceae(拟杆菌目中的优势细菌群)的相对丰度在砷处理下受到显著抑制。此外,砷处理显著降低了粪杆菌属和瘤胃球菌科的丰度(图4 H-I)。值得注意的是,砷暴露显著增加了嗜蛋白菌属(革兰氏阴性菌)、芽孢杆菌目和乳杆菌科 的相对丰度(图4 H-I)。综合起来,粪便样本16S rRNA基因测序结果揭示了砷引起的肠道菌群的剧烈变化。
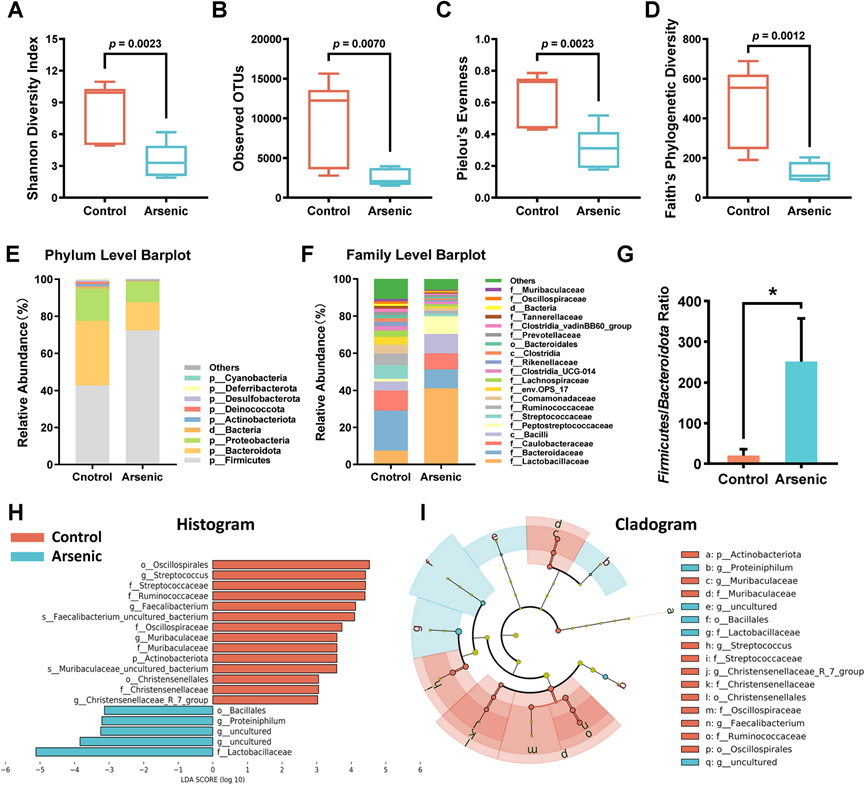
图4. 砷给药扰乱了鸡回肠肠道菌群组成。
(A-D) 样品的 Alpha 多样性指数箱线图:回肠菌群的 Shannon 多样性指数、观察到的 OTU、Pielou 均匀度指数和 Faith 系统发育多样性。(E-F) 门和科水平上不同肠道细菌的相对丰度。(G) 鸡回肠菌群中厚壁菌门/拟杆菌门的比例。(H-I) 由 LEfSe 分析生成的 LDA 得分图和分支图。
05
砷影响鸡肠道屏障并引起肠道毒性
为深入探究砷对肠道的影响,他们通过H&E染色(图5A)观察到砷的显著毒性效应。组织学分析显示(图5A),砷处理破坏回肠组织结构,导致绒毛高度(图5B)和隐窝深度(图5C)显著降低。此外,砷摄入显著增加肠道屏障通透性:回肠紧密连接蛋白CLDN1、OCLN及ZO-1的mRNA表达呈剂量依赖性下降(图5G),其蛋白水平与qPCR结果一致,在砷处理组显著降低(图5D-E)。基于屏障功能障碍的肠道通透性增加可能引发脂多糖(LPS)易位,他们观察到砷处理组鸡血清LPS水平显著升高(图5I)。与对照组相比,砷处理以剂量依赖性的方式上调炎症反应相关基因NF-κB、IL-1β、TLR4、IFN-γ和TNF-α的mRNA表达,同时降低IL-6表达(图5H)。TGF-β1、TNF-α、IL-1β及核NF-κB蛋白水平随砷剂量增加呈显著上升趋势(图5D-F)。
Pearson相关系数表明肠道菌群与肝肠损伤相关指标之间存在统计学关联(图5J)。Christensenellaceae、Lachnospiraceae、Muribaculaceae、Ruminococcaceae、Faecalibacterium和Lactobacillaceae与鸡的肠道炎症、肝功能和肝纤维化高度相关(图5J) 。与本研究相关的肝纤维化指标、肝功能指标、LPS、肠道屏障完整性和肠道炎症指标呈现出很强的相关性(图5K)。总之,这些结果表明肝脏-菌群-肠道轴共同导致了砷处理对鸡的器官组织的生物毒性。
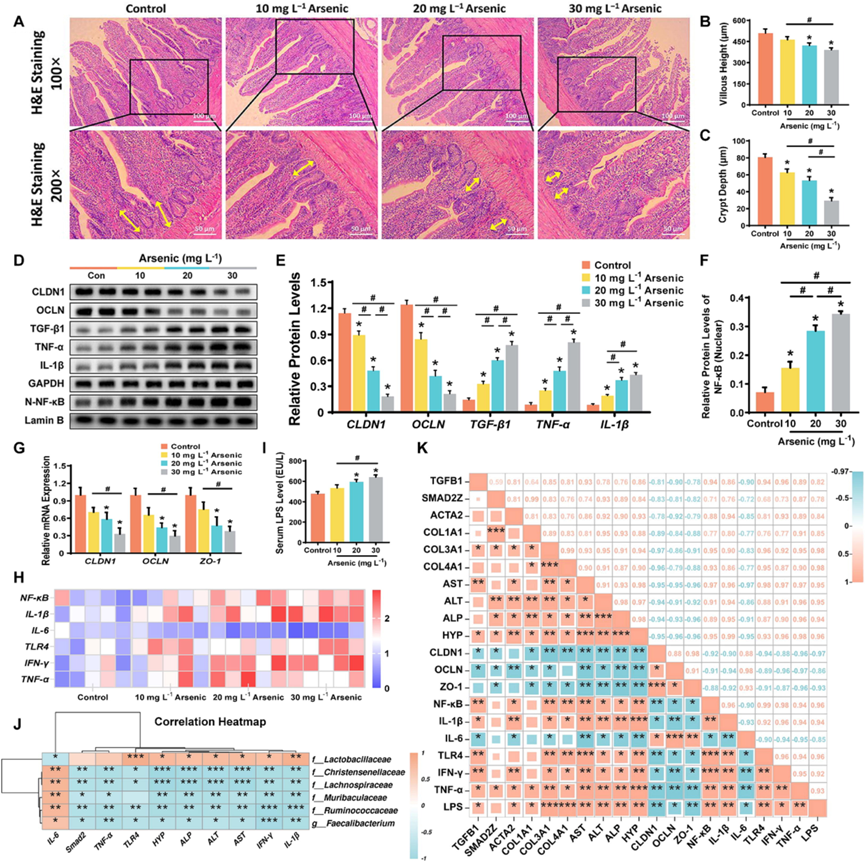
图5.砷处理诱导鸡肠损伤。
(A) 鸡回肠H&E染色代表性图像。(B-F) 用/未用砷处理鸡(n=4)的回肠绒毛高度和隐窝深度,免疫印迹分析和相对蛋白水平分析。(G-H) 鸡回肠中相对mRNA表达。(I) 各组鸡血清中LPS水平。(J) 通过Pearson校正分析确定的鸡肠道菌群与肝肠损伤相关指标之间的相关性。(K) 肝脏-菌群-肠道轴之间的相关性分析。
06
砷处理改变鸡的血清代谢组
随后,他们开展了血清代谢组学研究,以进一步探究鸡肠道和肝脏之间的相关性。采用液相色谱-质谱法(LC-MS)分析了对照组和30 mg/L砷组各5份血清样本,共鉴定出323种代谢物。血清中已鉴定的差异代谢物的z得分图和热图显示,无论是否经过砷处理,N-甲基-2-吡咯烷酮、雌酮、氨基氢醌、L-蛋氨酸S-氧化物、二乙酰、γ-氨基丁酸、鹅去氧胆酸(CDCA)、L-2,4-二氨基丁酸、1H-吲哚-3-甲醛、烟酸、13S-羟基十八碳二烯酸、膦酰基乙酸盐、 Se-甲基硒代半胱氨酸、4-喹啉羧酸、甲基茉莉酸和半乳糖二酸的表达水平均存在显著的统计差异(图6A-B)。本研究中,血清代谢物的主成分分析(PCA)评分图清晰地呈现出明显的区分度,无论是否接受砷处理,均呈现出明显的分离趋势(图6C)。同时,基于组间比较的偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)评分图也显示出组间明显的分离趋势(图6D-G)。因此,代谢组结果很好地证实了砷在干预血清代谢稳态方面的作用,并在一定程度上可能造成肝毒性。
亚砷酸钠的最终代谢物——二甲基胂酸盐在鸡血清中的含量显著升高(图6 H)。此外,还鉴定了与胆酸代谢相关的关键不同代谢物。结果显示,初级胆酸 (PBA) 水平升高,例如CDCA和甘氨胆酸(GCA),而次级胆酸 (SBA) 水平降低,例如熊去氧胆酸(UDCA) 和石胆酸(LCA)(图6 I-L)。这些结果共同证实了慢性砷处理对鸡肝脏-菌群-肠道轴的不利影响(图6M)。
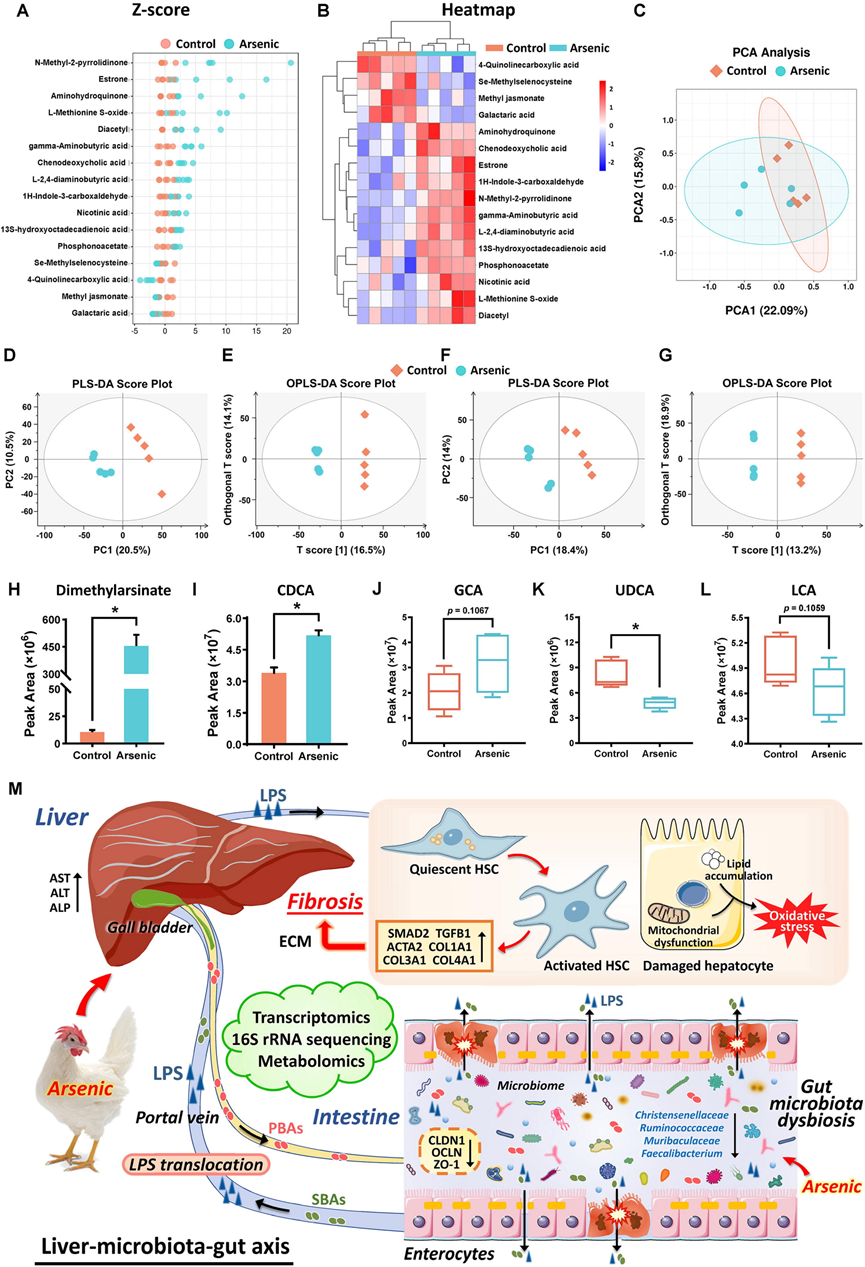
图6. 砷处理引起鸡血清代谢物组改变。
(A-B) 用/未用砷处理的鸡(n = 5)血清中鉴定出的差异代谢物的z得分图和热图。(C-G) 基于PCA、PLS-DA和OPLS-DA分析的多元统计分析。正离子和负离子模式下对照组与30 mg/L砷组的PCA和PLS-DA以及OPLS-DA得分图。(H-L) 对照组与30 mg/L砷组血清中相关的差异代谢物包括二甲基胂酸盐、CDCA、GCA、UDCA和LCA的水平。(M) 基于多组学分析的鸡砷诱导生物毒性示意图。
+ + + + + + + + + + +
结 论
本研究通过多组学分析和组织病理学数据发现砷处理导致鸡肝功能严重受损,尤其是严重的肝纤维化,同时改变回肠菌群数量,破坏鸡肠道屏障,进一步导致肠源性脂多糖经门静脉循环易位,加重肝脏损伤。此外,受损肝脏通过上调BA合成的关键限速酶CYP7A1,扰乱BA的稳态,导致血清总BA过量积累,并伴随初级BA——鹅去氧胆酸的大量合成。此外,次级BA——熊去氧胆酸和石胆酸的浓度显著降低,这可能与瘤胃球菌科和毛螺菌科的脱羟基作用受抑制有关。BA代谢异常反过来又加剧了肠道损伤,最终导致鸡的恶性循环。值得注意的是,四种有益微生物群(Christensenellaceae、Ruminococcaceae、Muribaculaceae和Faecalibacterium)的丰度明显减少与暴露于砷的鸡的肝肠循环过程密切相关。
+ + + + +



 English
English


